Mariano Aníbal Giorgi ID
Investigador principal. Unidad de Economía de la Salud y Tecnologías Sanitarias, Instituto Universitario CEMIC (IUC).
Profesor asociado de Farmacología, Instituto Universitario CEMIC (IUC). Jefe del Área de Medicamentos, Construir Salud.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2023;53(2):104-108
Recibido: 20/06/2023 / Aceptado: 28/06/2023 / Publicado online el 30/06/2023 / https://doi.org/10.52787/agl.v53i2.332
Las evaluaciones económicas en salud representan un abordaje técnico que aporta información en el proceso de toma de decisiones para incorporar o no un medicamento, un dispositivo o un método diagnóstico en un sistema de salud. Pero, antes de describirlas, repasaremos el marco conceptual que las contiene.
Salud y economía
La salud y la economía están íntimamente relacionadas. Como nos demostró la experiencia de la pandemia del COVID-19, una condición patológica puede desarticular al sistema económico de una sociedad (del mundo, en este caso). A su vez, la reorganización de dicho sistema ha permitido afrontar los múltiples desafíos de la enfermedad: inversión directa en el sistema de salud, vacunas, subsidios, entre tantos.1 Asimismo, las condiciones económicas en las que se desenvuelve una sociedad pueden influir en los habitantes, generar estilos de vida menos saludables, disminuir la accesibilidad a los servicios de salud y, en consecuencia, determinar una mayor prevalencia e incidencia de enfermedades crónicas no transmisibles (cardiovasculares, oncológicas) y cambios en la mortalidad.2
La salud está reconocida como un derecho humano por la Organización Mundial de la Salud (OMS) y ello implica la «obligación legal de los Estados a asegurar el acceso al cuidado de la salud en forma oportuna, aceptable y asequible», y forma parte de la agenda 2030 para el Desarrollo Sustentable y Cobertura Universal de Salud.3-4 El término asequible implica que desde el máximo nivel mundial de planificación sanitaria, la OMS, se tiene en consideración que los aspectos económicos son una parte esencial de la salud. Todos los recursos involucrados en la provisión de servicios de salud (denominados tecnologías sanitarias o TS) tienen un impacto económico para beneficiarios, personal de salud, efectores, industria de medicamentos y dispositivos, y autoridades de salud. Cada vez que una persona requiere de atención o es parte de una intervención preventiva, hay un costo involucrado que será diferente según qué parte del proceso consideremos. Tomemos un ejemplo muy conciso: una persona que concurre a una consulta ambulatoria en un centro de salud puede tener que cubrir el traslado, el lucro cesante o incluso algún tipo de copago. Por otra parte, el centro de salud tiene que costear el personal, los insumos, la infraestructura. Finalmente, si se ha prescripto un medicamento, el costo puede estar repartido entre el paciente, la farmacia y el financiador (un seguro de salud, el Estado).5 Cada vez que nos vemos frente a la necesidad de prescribir un medicamento, un estudio diagnóstico o un procedimiento debemos tener presente que alguien, en algún punto, deberá cargar con el precio de lo que hemos indicado hacer. Por lo tanto, es importante poder establecer cuáles son los recursos de salud que mayor beneficio aportan a los pacientes y que justifican el costo.
La salud tiene valor y precio
En los cursos de Economía de la salud es habitual mencionar una frase de Antonio Machado quien, en Proverbios y Cantares dice: «Todo necio confunde valor con precio». Técnicamente hablando, definimos valor como el beneficio clínico de una TS y precio como la consecuencia pecuniaria de ésta.
La decisión acerca del valor (entendido como beneficio clínico) que aporta una TS debe apoyarse en criterios estandarizados basados en un robusto sistema de análisis de calidad de evidencia.6 Sistemas como el GRADE (Grading of Recommendations Assessment, Development and Evaluation)7 o los niveles de evidencia del CEBM (Centre for Evidence Based Medicine de la Universidad de Oxford)8 son dos de los principales marcos conceptuales que han permitido definir la calidad de la evidencia de las diferentes TS. En el caso del GRADE, el proceso comienza por analizar en la literatura médica qué es importante para los pacientes y luego incorporar otras miradas, como la eficacia de las intervenciones y el impacto poblacional que pudieran tener utilizando estrictos criterios sobre la calidad metodológica de las fuentes de evidencia. En el caso del CEBM el foco está puesto en determinar qué tipo de diseño de investigación es el más adecuado para responder a una pregunta, desde la eficacia y la seguridad hasta los aspectos epidemiológicos y económicos. Si bien la principal fuente de evidencia sobre la eficacia y la seguridad de las TS proviene de ensayos clínicos aleatorizados y metaanálisis, sus resultados no pueden ser trasladados directamente a los pacientes, generalmente debido a que tienen estrictos criterios de inclusión y exclusión. Para complementar esas fuentes, en años recientes se han sumado los estudios de vida real (conocidos como Real-World Evidence) que aportan información sobre el desempeño de una TS en pacientes y escenarios asistenciales reales.9 La otra fuente de evidencia recientemente incorporada al análisis de valor de una TS son los patient-reported outcomes (PROs) que incluyen la perspectiva de los pacientes a través de estudios que miden los resultados clínicos directamente, por ejemplo, a través de escalas.10 La integración de otras miradas resulta en escenarios donde las decisiones sobre la evidencia no son sencillas. Por ejemplo, un nuevo medicamento puede aportar incremento en la supervivencia global pero a expensas de una alta incidencia de eventos adversos graves y, en consecuencia, implicar una mala calidad de vida para los pacientes. Por lo tanto, el beneficio clínico puede ser medido en eventos (por ejemplo, mortalidad, hospitalizaciones) o en medidas que combinan supervivencia y calidad de vida como son los Años de Vida Ajustados a Calidad (QALY, por sus siglas en inglés).11 Finalmente, a la hora de considerar el beneficio clínico de una TS, es importante resaltar que cada país o jurisdicción tiene características propias (población, infraestructura, recursos humanos, accesibilidad al sistema de salud, acceso a medicamentos) que también podrían modificar los resultados clínicos de una enfermedad12 y el impacto esperado de una TS sobre una determinada enfermedad o condición.13
En lo referente al precio (o costo, según se lo mire) es importante remarcar que se debe considerar no sólo el precio de compra o la adquisición de una TS, sino también todos los costos asociados al manejo de la enfermedad, tal como señalamos previamente.5 Es decir, una TS puede tener un alto costo de adquisición pero representar un menor costo final por resultar en un menor uso de recursos (por ejemplo, hospitalizaciones, muertes). El costo es diferente para los diversos participantes del sistema de salud y varía según el tipo de TS (si es una terapia innovadora, por ejemplo, será más cara), el tiempo que debemos usarla (por ejemplo, tratamientos de por vida) y, lo más importante, según en qué país estemos. Por lo tanto, los costos no son extrapolables o aplicables de la misma manera en una jurisdicción que en otra (lo que técnicamente se denomina no transferabilidad).14
¿Cuánto se debe pagar por una tecnología sanitaria?
Esta es, sin dudas, una de las preguntas más difíciles de responder. Dos elementos centrales deben ser considerados para enfrentar este dilema: 1) el valor y la calidad de la evidencia que aporta una TS y 2) la asequibilidad. Un abordaje utilizado a nivel global desde hace ya muchas décadas es el del precio basado en el valor (value-based price). Brevemente, se trata de establecer un precio aceptable para obtener un beneficio en salud, por ejemplo, precio por QALY ganado. En algunos países este precio está bien definido y representa el gasto que se puede realizar para incorporar una nueva TS considerando la equidad en el uso de los recursos.15 Por ejemplo, el Reino Unido suele situar este precio entre £ 20 000 y £ 30 000 por QALY obtenido. En otros casos, este umbral de pago (threshold) se define utilizando el producto interno bruto (PIB) per capita e intenta reflejar que monto sería adecuado invertir para poder mejorar la salud de una población.16 Estos umbrales definen lo que un sistema de salud está dispuesto a pagar (willingness to pay) para lograr un beneficio en salud y para afirmar que una TS es costo-efectiva.
Evaluaciones económicas en salud. El caso de la farmacoeconomía
Las evaluaciones económicas son un conjunto de métodos de análisis que permiten aportar información sobre el impacto económico de una TS. Una de las ramas de las evaluaciones económicas en salud aborda el uso de fármacos y es conocida como fármacoeconomía (FE). La metodología de análisis farmacoeconómico está estandarizada y eso permite tener robustez metodológica. Una de las principales fuentes de estandarización proviene de la International Society for Pharmacoeconomics and Outcomes Research (ISPOR) que publica consensos para la realización de estudios de FE.17 Básicamente, los estudios de FE comparan dos o más opciones terapéuticas para determinada enfermedad o condición, y miden costos y beneficios clínicos para todas las opciones utilizando los mismos criterios.
Los tipos básicos de análisis más utilizados en fármacoeconomía son: análisis de costo-beneficio, costo-efectividad, costo-minimización e impacto presupuestario (Tabla 1).
Tabla 1. Tipos principales de evaluaciones económicas en salud

Análisis de costo-beneficio (ACB): este tipo de estudio mide tanto los costos como los beneficios en salud en unidades monetarias (dólares estadounidenses, por ejemplo). Este enfoque contempla sólo el valor económico de la salud. Los ACB son de gran utilidad para evaluar el impacto financiero de programas de salud que utilizan intervenciones farmacéuticas.
Análisis de costo-efectividad (ACE): en términos estrictos, en este tipo de estudio los costos se miden en unidades monetarias, y los resultados en unidades de efectividad clínica como años de vida ganados, muertes o eventos clínicos evitados y en QALYs. Si comparamos dos drogas, A y B, tendremos, para cada una de ellas, una efectividad clínica (por ejemplo, QALYs obtenidos) y el costo total que representa el uso de cada una de ellas. De tal modo, tendremos un cociente de costo y beneficio para cada una de ellas. La diferencia entre ambas es el cociente de costo-efectividad incremental (ICER, por sus siglas en inglés) que expresa cuánto más se paga por el beneficio extra obtenido en salud. Esta medida se correlaciona con los umbrales de pago (mencionados previamente).
Análisis de costo-minimización (ACM): analiza, para dos drogas que tienen la misma efectividad clínica, las diferencias de costos. Es una forma simple de evaluación que permite una aproximación rápida al problema.
Análisis de impacto presupuestario (AIP): analiza el gasto integral en salud que implica el uso de un medicamento respecto a otro en relación al presupuesto en salud. Contempla el hecho de que los recursos en salud tienen un límite definido.
Si bien cada una de estas herramientas tiene características técnicas específicas comparten el hecho de que integran valor y precio en una sola evaluación y permiten, en definitiva, tener una medida estandarizada.
¿Qué elementos se deben considerar para leer una evaluación económica en salud?
Sin ser especialistas en la materia, los médicos asistenciales estamos expuestos cada vez con mayor frecuencia a estudios de estas características. Si bien hemos mencionado que existen métodos estandarizados, es importante resaltar algunas consideraciones que debemos tener presentes para valorar la literatura científica en este campo:
1. Calidad de la evidencia: el estudio debe reportar con claridad qué estudios consideró para la estimación de la efectividad clínica de la TS;
2. Calidad de los datos de costos: si bien no es posible saber con precisión los costos en salud de cada sistema o jurisdicción, deben estar reportadas, cuando menos, las fuentes de los mismos;
3. Datos locales: la evaluación económica debe estar realizada o adaptada al país o la jurisdicción donde se está considerando el uso de la TS. Es decir, debe tener información epidemiológica, sobre el uso de los recursos y los costos locales.
Finalmente, considerando que las condiciones económicas actuales pueden ser inestables, los estudios deben tener, asimismo, precisiones sobre este punto.18
Propiedad intelectual. El autor declara que los datos y la tabla presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. El autor declara que no hubo fuentes de financiación externas.
Conflicto de interés. El autor declara no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2023 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Giorgi M A. Evaluaciones económicas en salud: ¿qué debemos tener en cuenta al leerlas?. Acta Gastroenterol Latinoam. 2023;53(2):104-108. https://doi.org/10.52787/agl.v53i2.332
Referencias
- World Bank. The World Bank Group’s Response to the COVID-19 (coronavirus) Pandemic. Disponible en: https://www.worldbank.org/en/who-we-are/news/coronavirus-covid19
- MacDonald R, Horton R. Trade and health: time for the health sector to get involved. Lancet. 2009 Jan 24;373(9660):273-4.
- Human Rights. World Health Organization. 2022. Disponible en: https://www.who.int/news-room/fact-sheets/detail/human-rights-and-health
- Transforming our world: the 2030 Agenda for Sustainable Development. Resolution adopted by the General Assembly on 25 September 2015. United Nations. Disponible en: https://documents-dds-ny.un.org/doc/UNDOC/GEN/N15/291/89/PDF/N1529189.pdf?OpenElement
- Meltzer MI. Introduction to health economics for physicians. Lancet. 2001 Sep 22;358(9286):993-8. DOI:10.1016/S0140-6736(01)06107-4. PMID: 11583768.
- Djulbegovic B, Guyatt GH. Progress in evidence-based medicine: a quarter century on. Lancet. 2017 Jul 22;390(10092):415-423
- The GRADE Working Group. Disponible en: https://www.gradeworkinggroup.org/
- Levels of Evidence. Disponible en: https://www.cebm.ox.ac.uk/resources/levels-of-evidence/ocebm-levels-of-evidence
- Chodankar D. Introduction to real-world evidence studies. Perspect Clin Res. 2021 Jul-Sep;12(3):171-174. DOI:10.4103/picr.picr_62_21. Epub 2021 Jul 7. PMID: 34386383; PMCID: PMC8323556.
- Patient-Reported Outcomes and other Clinical Outcome Assessments. Food and Drug Administation. Disponible en: https://www.fda.gov/science-research/focus-areas-regulatory-science-report/focus-area-patient-reported-outcomes-and-other-clinical-outcome-
assessments#:~:text=Patient%2Dreported%20outcomes%20(PROs)%3A,such%20as%20a%20pain%20scale - QALY. Glossary. NICE. Disponible en: https://www.nice.org.uk/glossary?letter=q
- Ma C, Congly SE, Chyou DE, Ross-Driscoll K, Forbes N, Tsang ES, Sussman DA, Goldberg DS. Factors Associated With Geographic Disparities in Gastrointestinal Cancer Mortality in the United States. Gastroenterology. 2022 Aug;163(2):437-448.e1. DOI:10.1053/j.gastro.2022.04.019. Epub 2022 Apr 25. PMID: 35483444; PMCID: PMC9703359.
- Boissonnet CP, Giorgi MA, Carosella L, Brescacin C, Pissinis J, Guetta JN. Clinical outcomes after transcatheter aortic valve replacement in South America: A centre-level systematic review and meta-analysis of observational data. J Eval Clin Pract. 2021 Aug;27(4):785-798. DOI:10.1111/jep.13469. Epub 2020 Sep 2. PMID: 32881274.
- Drummond M, Barbieri M, Cook J, Glick HA, Lis J, Malik F, Reed SD, Rutten F, Sculpher M, Severens J. Transferability of economic evaluations across jurisdictions: ISPOR Good Research Practices Task Force report. Value Health. 2009 Jun;12(4):409-18. DOI:10.1111/j.1524-4733.2008.00489.x. Epub 2009 Jan 12. PMID: 19900249.
- National Institute for Health and Clinical Excellence. Guide to the methods of technology appraisal 2008. London: NICE; 2008. Disponible en: https://www.nice.org.uk/process/pmg9/resources/guide-to-the-methods-of-technology-appraisal-2013-pdf-2007975843781
- Pichon-Riviere A, Drummond M, Palacios A, Garcia-Marti S, Augustovski F. Determining the efficiency path to universal health coverage: cost-effectiveness thresholds for 174 countries based on growth in life expectancy and health expenditures. Lancet Glob Health. 2023 Jun;11(6):e833-e842. DOI:10.1016/S2214-109X(23)00162-6. PMID: 37202020.
- Consolidated Health Economic Evaluation Reporting Standards (CHEERS) 2022 Explanation and Elaboration: A Report of the ISPOR CHEERS II Good Practices Task Force. Value Health. 2022 Jun;25(6):1060. DOI:10.1016/j.jval.2022.03.002. Epub 2022 Apr 23. Erratum for: Value Health. 2022 Jan;25(1):10-31. PMID: 35474251.
- Giorgi MA, Boissonnet CP, Luque PS, Piastrella J, Porley C, Ditata F, Volman S. Cost-effectiveness in unstable economies: the case of sacubitril/valsartan in heart failure with reduced ejection fraction in Argentina. Health Econ Rev. 2023 Feb 18;13(1):13. DOI:10.1186/s13561-023-00427-w. PMID: 36808581; PMCID: PMC9938575.
Correspondencia: Mariano Aníbal Giorgi
Correo electrónico: marianoagiorgi@gmail.com
Acta Gastroenterol Latinoam 2023;53(2):104-108
Health Economic Evaluations: what should we take into account when reading them?
Mariano Aníbal Giorgi ID
Principal investigator. Health Economics and Health Technologies Unit, Instituto Universitario CEMIC (IUC).
Associate Professor of Pharmacology, Instituto Universitario CEMIC (IUC).
Head of Pharmacology, Construir Salud.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2023;53(2):109-112
Received: 20/06/2023 / Accepted: 28/06/2023 / Published online 30/06/2023 / https://doi.org/10.52787/agl.v53i2.332
Health economic evaluations represent a technical approach that provides information in the decision-making process to incorporate or not a drug, a device or a diagnostic method in a healthcare system. However, before describing them, we will review the conceptual framework that contains them.
Health and Economy
Health and economy are closely related. As the experience of the COVID-19 pandemic has shown us, a pathological condition can disrupt the economic system of a society -of the world, in this case-. In turn, the reorganization of this system has made it possible to meet the multiple challenges of the disease: direct investment in the healthcare system, vaccines, subsidies, among others.1 Likewise, the economic conditions in which a society develops can influence the inhabitants, generate less healthy lifestyles, reduce accessibility to healthcare services and, consequently, lead to a higher prevalence and incidence of chronic non-communicable diseases (cardiovascular, oncological) and changes in mortality patterns.2
Health is recognized as a human right by the World Health Organization (WHO), which implies the a «legal obligation of States to ensure access to healthcare in a timely, acceptable and affordable way», and is part of the 2030 agenda for Sustainable Development and Universal Health Coverage.3-4 The term “affordable” implies that from the world’s highest level of health planning, the WHO, takes into consideration that economic aspects are an essential part of health. All resources involved in the provision of healthcare services (called health technologies – HT) have an economic impact for beneficiaries, healthcare personnel, providers, payors, the pharmaceutical and device industry, and health authorities. Every time a person requires care or is part of a preventive intervention, there is a cost involved that has to vary depending on which part of the process we consider. Let’s take a very concise example: a person who attends an outpatient consultation at a health center may have to cover transportation, loss of earnings or even some type of co-payment. On the other hand, the health center will pay for the personnel, supplies, and infrastructure. Finally, if a drug has been prescribed, the cost may be shared among the patient, the pharmacy and the funder (health insurance, the State).5 Every time we face the need to prescribe a drug, a diagnostic study, or a procedure, we must keep in mind that someone, at some point, will have to bear the cost of what we have been told to do. Therefore, it is important to be able to establish which health resources provide the greatest benefit to patients and justify the cost.
Health Has a Value and a Price
In Health Economics courses it is common to mention a quote from Antonio Machado (Proverbios y Cantares): «A fool confuses value with price». Technically speaking, we define value as the clinical benefit of a HT and price as its financial consequence.
The decision on the value (understood as clinical benefit) provided by a HT should be supported by standardized criteria based on a robust system of evidence-quality analysis.6 Systems such as GRADE (Grading of Recommendations Assessment, Development and Evaluation)7 or Levels of Evidence from the CEBM (Center for Evidence Based Medicine of the University of Oxford)8 are two of the main conceptual frameworks that have made it possible to define the quality of the evidence for different HT. In the case of GRADE, the process begins by analyzing the medical literature to find what is important to patients and then incorporating other perspectives, such as the efficacy of the interventions and the population impact that they may have, using strict criteria on the methodological quality of the sources of evidence. In the case of the CEBM, the focus is on determining which type of research design is the most appropriate to answer a question, from efficacy and safety to epidemiological and economic aspects. Although the main source of evidence on the efficacy and safety of HT comes from randomized clinical trials and meta-analyses, the results cannot be directly transferred to patients usually because of strict inclusion and exclusion criteria. To complement these sources, in recent years, real-life studies (called Real-World Evidence) has been added to provide information on the performance of a HT in real patients and healthcare scenarios.9 The other source of evidence recently incorporated into the value analysis of a HT is the patient-reported outcomes (PROs), which include the patient’s perspective through studies that directly measure clinical results, for example, through scales.10 The integration of other perspectives works well in scenarios where decisions about the evidence are not easy. For example, a new drug may provide an increase in overall survival but at the cost of a high incidence of serious adverse events and, consequently, imply a poor quality of life for patients. Therefore, the clinical benefit can be measured in terms of events (for example, mortality, hospitalizations) or by using measures that combine survival and quality of life such as Quality Adjusted Life Years (QALY).11 Finally, when considering the clinical benefit of HT, it is important to highlight that each country or jurisdiction has its own characteristics (population, infrastructure, human resources, accessibility to the healthcare system, access to drugs) that could also modify the clinical results of a disease12 and the expected impact of HT on specific diseases or conditions.13
Regarding the price (or cost, depending on your point of view), it is important to note that not only the purchase or acquisition price of a HT should be considered, but also all the costs associated with disease management, as previously indicated.5 In other words, a HT may have a high acquisition cost but represents a lower final cost because it results in a lower use of resources (for example, hospitalizations, deaths). The cost is different for the various participants in the healthcare system and varies according to the type of HT (an innovative therapy will be more expensive, for instance), the duration of use (for example, lifelong treatments) and, most importantly, the country we are in. Therefore, costs cannot be extrapolated or applied from one jurisdiction to another, which is technically known as non-transferability.14
How Much Should Be Paid for a Health Technology?
This is undoubtedly one of the most difficult questions to answer. Two central elements must be considered to face this dilemma: 1) the value and quality of the evidence provided by a HT and 2) affordability. A globally used approach for many decades has been the value-based pricing. Briefly, it is about establishing an acceptable price for a health benefit, for example, price per QALY gained. In some countries this price is well defined and represents the expense that can be made to incorporate a new HT considering equity in the use of resources.15 For example, the UK typically places this price between £ 20,000 and £ 30,000 per QALY gained. In other countries, this threshold is defined using gross domestic product (GDP) per capita which intends to represent the ammount of money that would be appropriate to invest in order to improve healthcare for the population.16 These thresholds define what a healthcare system is willing to pay to achieve a health benefit and to claim that a HT is cost-effective.
Health Economic Evaluations. The Case of Pharmacoeconomics
Economic evaluations are a set of analytical methods that provide information on the economic impact of a HT. One branch of health economic evaluations deals with drugs use and is known as pharmacoeconomics (PE). The methodology of pharmacoeconomic analysis is standardized, allowing methodological robustness. One of the main sources of standardization comes from the International Society for Pharmacoeconomics and Outcomes Research (ISPOR), which publishes consensus for conducting PE studies.17 Basically, PE studies compare two or more therapeutic options for a given disease or condition. They measure clinical costs and benefits for all options using the same criteria.
The basic types of analysis most commonly used in pharmacoeconomics are: cost-benefit, cost-effectiveness, cost-minimization and budgetary impact (Table 1).
Table 1. Main types of health economic evaluations
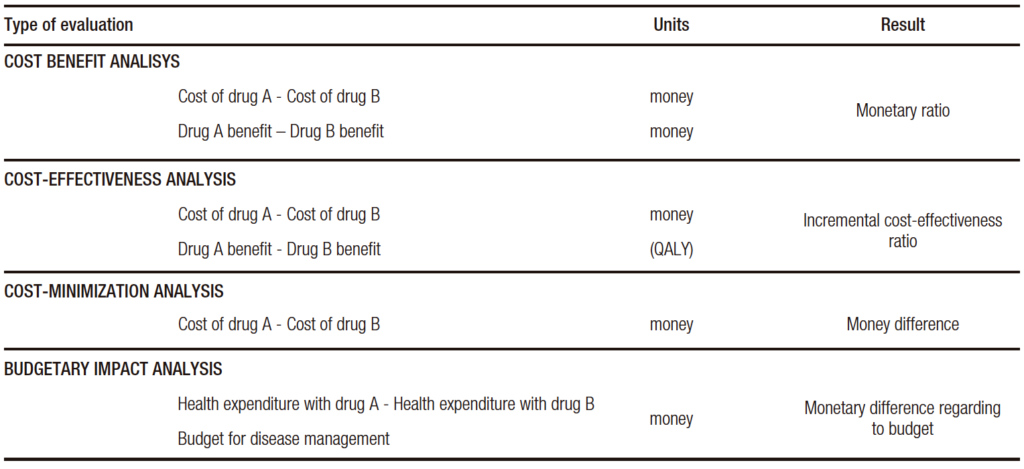
Cost-Benefit Analysis (CBA): this type of study measures both health costs and benefits in monetary units (US dollars, for example). This approach contemplates only the economic value of health. CBAs are very useful in order to assess the financial impact of health programs that involve pharmaceutical interventions.
Cost-Effectiveness Analysis (CEA): strictly speaking, in this type of study, costs are measured in monetary units and health outcomes in units of clinical effectiveness as life years gained, deaths or events avoided, and in QALY. If we compare two drugs, A and B, for each drug, there would be a clinical effectiveness measure (per QALY) and the total cost of using each. Thus, there would be a cost-benefit ratio for each of them. The difference between the two is the incremental cost-effectiveness ratio (ICER), which expresses how much more is paid for the extra health benefit obtained. This measure is correlated with payment thresholds mentioned previously.
Cost-Minimization Analysis (CMA): this analysis compares the costs of two drugs that have the same clinical effectiveness. It is a simple form of evaluation that allows a quick approach to the problem.
Budgetary Impact Analysis (BIA): this analysis examines the overall healthcare expenditure involved in the use of one drug compared to another in relation to the health budget. It contemplates the fact that healthcare resources have a defined limit.
Although each of these tools has specific technical characteristics, they share the fact that they integrate value and price into a single evaluation and ultimately provide a standardized measurement.
What Elements Should Be Considered to Read Health Economic Evaluations?
Without being specialists in the field, healthcare physicians are increasingly exposed to studies of these characteristics. Although we have mentioned that there are standardized methods, it is important to highlight some considerations that we must keep in mind to assess the scientific literature in this field:
1. Quality of evidence: the study should clearly report which studies were considered to estimate the clinical effectiveness of HT.
2. Quality of cost data: although it is not possible to precisely know the health costs of each system or jurisdiction, at least the sources of these costs should be reported.
3. Local data: the economic evaluation should be carried out or adapted to the country or jurisdiction where the use of HT is being considered. That is, it should have epidemiological information, resource use data, and local cost information.
Finally, considering that the current economic conditions may be unstable, the studies should also provide information on this point.18
Intellectual Property. The author declares that the data and table presented in the manuscript are original and were carried out at his belonging institution.
Funding. The author declares that there were no external sources of funding.
Conflict of interest. The author declares that he has no conflicts of interest in relation to this article.
Copyright
 © 2023 Acta Gastroenterológica latinoamericana. This is an open-access article released under the terms of the Creative Commons Attribution (CC BY-NC-SA 4.0) license, which allows non-commercial use, distribution, and reproduction, provided the original author and source are acknowledged.
© 2023 Acta Gastroenterológica latinoamericana. This is an open-access article released under the terms of the Creative Commons Attribution (CC BY-NC-SA 4.0) license, which allows non-commercial use, distribution, and reproduction, provided the original author and source are acknowledged.
Cite this article as: Giorgi M A. Health Economic Evaluations: what should we take into account when reading them?. Acta Gastroenterol Latinoam. 2023;53(2):109-112. https://doi.org/10.52787/agl.v53i2.332
References
- World Bank. The World Bank Group’s Response to the COVID-19 (coronavirus) Pandemic. Disponible en: https://www.worldbank.org/en/who-we-are/news/coronavirus-covid19
- MacDonald R, Horton R. Trade and health: time for the health sector to get involved. Lancet. 2009 Jan 24;373(9660):273-4.
- Human Rights. World Health Organization. 2022. Disponible en: https://www.who.int/news-room/fact-sheets/detail/human-rights-and-health
- Transforming our world: the 2030 Agenda for Sustainable Development. Resolution adopted by the General Assembly on 25 September 2015. United Nations. Disponible en: https://documents-dds-ny.un.org/doc/UNDOC/GEN/N15/291/89/PDF/N1529189.pdf?OpenElement
- Meltzer MI. Introduction to health economics for physicians. Lancet. 2001 Sep 22;358(9286):993-8. DOI:10.1016/S0140-6736(01)06107-4. PMID: 11583768.
- Djulbegovic B, Guyatt GH. Progress in evidence-based medicine: a quarter century on. Lancet. 2017 Jul 22;390(10092):415-423.
- The GRADE Working Group. Disponible en: https://www.gradeworkinggroup.org/
- Levels of Evidence. Disponible en: https://www.cebm.ox.ac.uk/resources/levels-of-evidence/ocebm-levels-of-evidence
- Chodankar D. Introduction to real-world evidence studies. Perspect Clin Res. 2021 Jul-Sep;12(3):171-174. DOI:10.4103/picr.picr_62_21. Epub 2021 Jul 7. PMID: 34386383; PMCID: PMC8323556.
- Patient-Reported Outcomes and other Clinical Outcome Assessments. Food and Drug Administation. Disponible en: https://www.fda.gov/science-research/focus-areas-regulatory-science-report/focus-area-patient-reported-outcomes-and-other-clinical-outcome-assessments#:~:text=Patient%2Dreported%20outcomes%20(PROs)%3A,such%20as%20a%20pain%20scale
- QALY. Glossary. NICE. Disponible en: https://www.nice.org.uk/glossary?letter=q
- Ma C, Congly SE, Chyou DE, Ross-Driscoll K, Forbes N, Tsang ES, Sussman DA, Goldberg DS. Factors Associated With Geographic Disparities in Gastrointestinal Cancer Mortality in the United States. Gastroenterology. 2022 Aug;163(2):437-448.e1. DOI:10.1053/j.gastro.2022.04.019. Epub 2022 Apr 25. PMID: 35483444; PMCID: PMC9703359.
- Boissonnet CP, Giorgi MA, Carosella L, Brescacin C, Pissinis J, Guetta JN. Clinical outcomes after transcatheter aortic valve replacement in South America: A centre-level systematic review and meta-analysis of observational data. J Eval Clin Pract. 2021 Aug;27(4):785-798. DOI:10.1111/jep.13469. Epub 2020 Sep 2. PMID: 32881274.
- Drummond M, Barbieri M, Cook J, Glick HA, Lis J, Malik F, Reed SD, Rutten F, Sculpher M, Severens J. Transferability of economic evaluations across jurisdictions: ISPOR Good Research Practices Task Force report. Value Health. 2009 Jun;12(4):409-18. DOI:10.1111/j.1524-4733.2008.00489.x. Epub 2009 Jan 12. PMID: 19900249.
- National Institute for Health and Clinical Excellence. Guide to the methods of technology appraisal 2008. London: NICE; 2008. Disponible en: https://www.nice.org.uk/process/pmg9/resources/guide-to-the-methods-of-technology-appraisal-2013-pdf-2007975843781
- Pichon-Riviere A, Drummond M, Palacios A, Garcia-Marti S, Augustovski F. Determining the efficiency path to universal health coverage: cost-effectiveness thresholds for 174 countries based on growth in life expectancy and health expenditures. Lancet Glob Health. 2023 Jun;11(6):e833-e842. DOI:10.1016/S2214-109X(23)00162-6. PMID: 37202020.
- Consolidated Health Economic Evaluation Reporting Standards (CHEERS) 2022 Explanation and Elaboration: A Report of the ISPOR CHEERS II Good Practices Task Force. Value Health. 2022 Jun;25(6):1060. DOI:10.1016/j.jval.2022.03.002. Epub 2022 Apr 23. Erratum for: Value Health. 2022 Jan;25(1):10-31. PMID: 35474251.
- Giorgi MA, Boissonnet CP, Luque PS, Piastrella J, Porley C, Ditata F, Volman S. Cost-effectiveness in unstable economies: the case of sacubitril/valsartan in heart failure with reduced ejection fraction in Argentina. Health Econ Rev. 2023 Feb 18;13(1):13. DOI:10.1186/s13561-023-00427-w. PMID: 36808581; PMCID: PMC9938575.
Correspondence: Mariano Aníbal Giorgi
Email: marianoagiorgi@gmail.com
Acta Gastroenterol Latinoam 2023;53(2):109-112
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE




