Rodolfo Pizarro ID
Jefe de Cardiología Hospital Italiano de Buenos Aires. Master en Efectividad Clínica.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2022;52(3):297-299
Recibido: 15/08/2022 / Aceptado: 16/09/2022 / Publicado online el 29/09/2022 / https://doi.org/10.52787/agl.v52i3.236
Los ensayos clínicos de no inferioridad se llevan a cabo cuando se considera que el tratamiento experimental no es mejor que el estándar, sino que ofrece ventajas adicionales, tales como menos efectos secundarios, mejor perfil metabólico, más fácil administración, menos controles y costos menores.
La naturaleza de la investigación y las respuestas son diferentes, ya que en este tipo de ensayos nos preguntamos si el tratamiento experimental es al menos tan eficaz como el estándar.
O bien puede ser al menos tan eficaz como el estándar (hipótesis alternativa) o es menos eficaz que el estándar (hipótesis nula).
Considerar el valor de la p en estudios de no inferioridad es importante dado que debemos especificar a priori qué consideramos como al menos tan eficaz o no inferior. Para esto debe definirse un margen mínimo de no inferioridad.
Por lo tanto, consideremos los estudios de no inferioridad bajo la siguiente hipótesis:
– Diferencia tratamiento experimental – tratamiento estándar > margen de no inferioridad (hipótesis nula).
– Diferencia tratamiento experimental – tratamiento estándar < = margen de no inferioridad (hipótesis alternativa), es decir, la diferencia entre el tratamiento experimental y el control activo no supera el margen de no inferioridad.
La siguiente pregunta responde cómo establecer el margen mínimo de no inferioridad:
1. Mediante estudios previos que establezcan los límites inferiores de la intervención estándar vs. placebo.
2. Estableciendo un límite porcentual previo para el nuevo tratamiento del 50% u 80% del efecto de la intervención clásica.
Si bien esto que comentamos anteriormente es crucial para este tipo de estudios, hay que establecer el límite de inferioridad a priori para que no se preste a manipulaciones posteriores.
Un ejemplo es el estudio de la warfarina en la reducción de la incidencia de eventos embólicos respecto del placebo con un riesgo relativo de 0,38 (IC 95%: 0,28-0,52).
Primero cambiamos la categoría de riesgo para el placebo (1/0,38) lo que significaría un RR: 2,63 (IC 95%: 1,92-3,57), pudiendo considerar el margen mínimo de no inferioridad en 1,92. Sin embargo, en este caso se buscó una mayor exigencia, con un 50% del efecto de la warfarina, y se estableció en 1,46. Este valor se fijó como límite de no inferioridad.
Es decir que el límite superior del IC 95% del efecto del nuevo tratamiento con respecto a la warfarina no podía superar el 1,46.
Otro ejemplo es el estudio ONTARGET que fue diseñado para demostrar la no inferioridad del telmisartán (80 mg al día) vs. ramipril (10 mg al día) con un punto final combinado de muerte CV, accidente cerebrovascular, infarto de miocardio u hospitalización por falla de bomba.
Para determinar el margen de no inferioridad se recurrió al estudio HOPE que evaluó el ramipril versus placebo con un punto final combinado similar al ONTARGET.
En este estudio la relación de riesgo fue a favor del ramipril, con un RR 0,78 (IC 95% 0,70-0,86); esto fue transformado para un exceso de riesgo para el placebo (1/0,78) de 1,26 y se estableció un límite de no inferioridad de 1,13 (50% del efecto del ramipril para el telmisartán en el estudio ONTARGET).
Los resultados de este estudio determinaron que el telmisartán en relación con el ramipril demostró un RR 1,01 (IC 95%: 0,94-1,09) p < 0,0033, lo que es menor al límite de no inferioridad de 1,13.
Se consideró al telmisartán como no inferior al ramipril, sumando algunas ventajas a considerar: la discontinuación del estudio fue mayor para el ramipril (7,2%) que para el telmisartán (5,1%).
Gráficamente podemos determinar los estudios de no inferioridad en el siguiente esquema de la Figura 1 (∆: límite de no inferioridad preestablecido):
Figura 1. Posibles resultados de no-inferioridad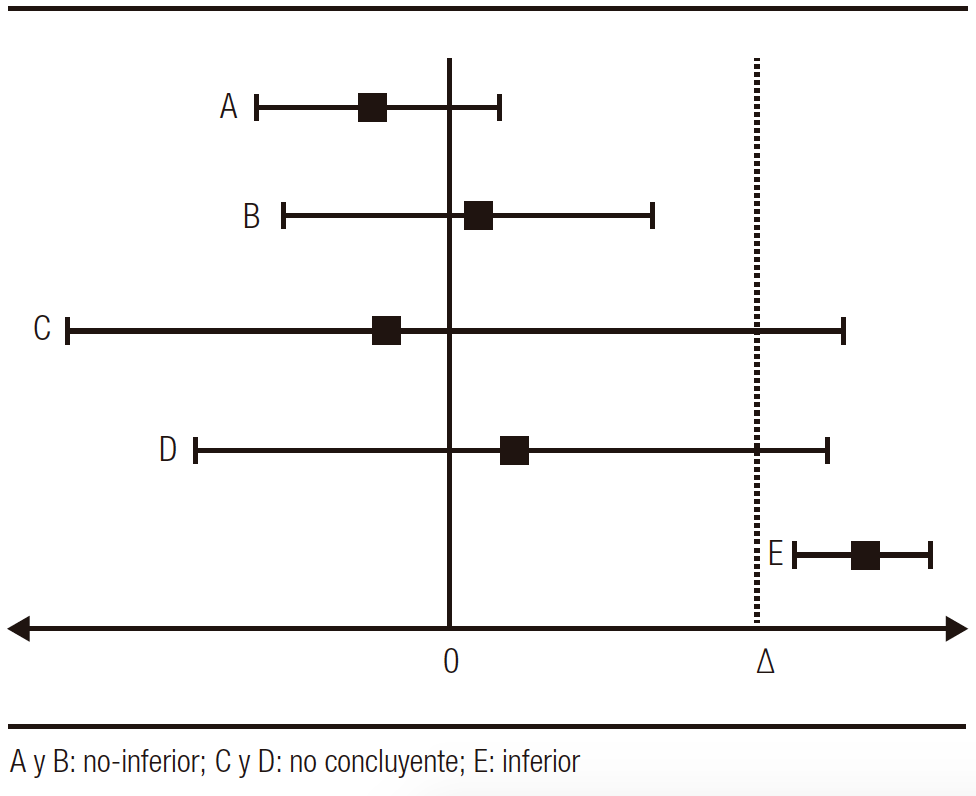
A continuación, citaremos otro ejemplo, esta vez de temas relacionados con gastroenterología, titulado:
“A Randomized, Double-Blind, Active-Control, Nonin feriority, Multicenter, Phase 4 Study to Evaluate the Efficacy and Safety of Esomeprazole/Sodium Bicarbonate 20/800 mg in Patients with Nonerosive Gastroesophageal”.
Contexto del estudio
La enfermedad por reflujo no erosiva (NERD) es el fenotipo más frecuente (60-70%). El objetivo terapéutico es mejorar los síntomas con una estrategia a demanda. Es decir, darle al paciente la mínima dosis con la que se encuentre asintomático. En este sentido, hay que enfatizar que los inhibidores de bomba de protones (IBP) de primera generación deben administrarse con el estómago vacío y asociarse con una comida posterior para no retrasar la adecuada absorción y, en consecuencia, su biodisponibilidad. Para mejorar esta situación actualmente se dispone de drogas combinadas (IBP + bicabornato de sodio). Dicha formulación permitiría sortear la degradación de la droga por el pH gástrico, tener una absorción más rápida y, con ello, una mejoría sintomática. Además, la presencia de bicarbonato es un estimulante de la secreción de gastrina ya que disminuye el pH gástrico; por ende, no sería una condición la ingesta posterior a la toma para la liberación de dicha hormona.
El estudio que mencionábamos anteriormente evaluó la eficacia y la seguridad del esomeprazol/bicarbonato 20/800 mg de sodio versus el esomeprazol 20 mg.
Describiremos las características metodológicas relevantes para su comprensión:
Diseño: Ensayo aleatorizado, doble ciego, con control activo en fase 4. Ensayo de no inferioridad.
Objetivo: Evaluar la asociación esomeprazol/bicarbonato de sodio vs. la práctica habitual con solo esomeprazol en pacientes con enfermedad por reflujo gastroesofágico no erosivo.
Población: Pacientes con reflujo gastroesofágico no erosivo con episodios de pirosis de inicio por lo menos 3 meses previos y con una frecuencia de 2 o más días en la semana previa a la aleatorización.
Punto final primario: Resolución completa de la pirosis a las 4 semanas de tratamiento.
Metodología: En la búsqueda del límite de no inferioridad los autores estimaron que en trabajos previos la relación esomeprazol vs. placebo para la resolución completa a las 4 semanas fue de 41% vs. 11%, respectivamente, es decir una diferencia de un 30% entre los grupos. Para establecer el límite de no inferioridad tomaron el 50% de esta diferencia, es decir, el 15% (0,15) como límite (sería el límite superior del IC 95%).
Resultados: La proporción de pacientes sin pirosis a las 4 semanas fue similar en los grupos, esomeprazol vs. combinado (33,3 vs. 35%, p = 0,737), y el intervalo de confianza de la diferencia fue de -0,08 a 0,11. Este límite superior es menor al 0,15 (15%) que estimaron los autores; por lo tanto, se considera a la medicación combinada como no inferior.
A su vez, se evaluaron los puntos de seguridad en los que los eventos adversos no fueron diferentes entre los grupos.
Conclusión: La combinación de esomeprazol/bicarbonato de sodio no fue inferior al esomeprazol no combinado para suprimir la acidez en la semana 4 de tratamiento en pacientes con reflujo gastroesofágico no erosivo.
Análisis de los resultados
El punto limitante del trabajo es la determinación del límite de no inferioridad, que se estimó en relación con trabajos previos en los que la diferencia entre el placebo y el esomeprazol fue del 30%. Esta es una de las fortalezas del estudio, ya que se tomaron referencias de estudios validados previamente.
Una segunda consideración es que la resolución de la pirosis del esomeprazol vs. placebo fue del 41% y, en este trabajo, un 35%, menor que lo estimado previamente.
Si hiciéramos la diferencia vs. placebo del 35% vs. 11% (24%) y estimáramos el límite de no inferioridad con el 50% de esta diferencia, este sería del 12%, dentro del límite de inferioridad del 11,39% del trabajo.
Otro punto que considerar es la seguridad de la combinación vs. la droga aislada, ya que es relevante en los estudios de no inferioridad tener en cuenta que una nueva droga eficaz tiene que ser también segura para su uso clínico, tal como lo expresan los resultados de este estudio.
Los autores comentan también que la combinación con bicarbonato de sodio tendría ventajas farmacodinámicas y farmacocinéticas que favorecen el perfil de la droga.
Consideraciones finales
1. En los ensayos de no inferioridad se testea si el nuevo tratamiento es no inferior al control activo.
2. Los ensayos de no inferioridad fueron diseñados con el objetivo de evaluar ventajas adicionales del nuevo tratamiento respecto del estándar en aspectos de importancia tales como: costo, disponibilidad, efectos adversos, ser menos invasivo y tener ventajas farmacológicas tales como farmacocinética y farmacodinamia.
3. La definición de un margen de no inferioridad a priori es de esencial importancia (identificando la fuente que determinó este margen y sus intervalos de confianza) así como analizar los resultados por intención de tratar o por protocolo en este tipo de ensayos. La no inferioridad se sostiene solo si con estos dos análisis se mantiene el efecto en forma coordinada.
4. La demostración de la no inferioridad no implica la superioridad del nuevo tratamiento. Los ensayos de superioridad tienen como hipótesis alternativa que el nuevo tratamiento es mejor al tratamiento activo o al placebo y se analiza a dos colas (p < 0,05), a diferencia del ensayo de no inferioridad que se analiza a 1 cola (p < 0,025).
5. Los ensayos de no inferioridad son necesarios en situaciones en las que no es ético evaluar el nuevo tratamiento vs. placebo.
Propiedad intelectual. El autor declara que los datos y la figura presente en el manuscrito son originales y se realizaron en su institución perteneciente.
Financiamiento. El autor declara que no hubo fuentes de financiación externas.
Conflicto de interés. El autor declara no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Pizarro Rodolfo. Ensayos clínicos de no inferioridad. Acta Gastroenterol Latinoam. 2022;52 (3): 297-299. https://doi.org/10.52787/agl.v52i3.236
Referencias
Pluchino S. Estudios clínicos de no-inferioridad y de equivalencia: metodología, análisis e interpretación de los resultados Avances Cardiol. 2009;29:76-81.
Ferreira – González I. Bases para la interpretación de los estudios de no inferioridad: a propósito de los estudios ROCKET-AF, RE-LY y ARISTOTLE. Rev Esp Cardiol 2014;67:432-435.
Ciapponi A. Ensayos aleatorizados de no inferioridad y de equivalencia. Evid Act Pract Ambul 2013;16:92-94.
Leung JT, Barnes SL, Lo ST and Leung DJ. Non-inferiority trials in cardiology: what clinicians need to know. Heart 2020;106:99-104.
Park SH, Lee KN, Lee OY, et al. A Randomized, Double-Blind, Active-Control, Noninferiority, Multicenter, Phase 4 Study to Evaluate the Efficacy and Safety of Esomeprazole/Sodium Bicarbonate 20/800 mg in Patients with Nonerosive Gastroesophageal Reflux Disease. Gut and Liver; 22 de junio de 2022.
Correspondencia: Rodolfo Pizarro
Correo electrónico: rodolfo.pizarro@hospitalitaliano.org.ar
Acta Gastroenterol Latinoam 2022;52(3):297-299
Non-Inferiority Clinical Trials
Rodolfo Pizarro ID
Head of Cardiology, Hospital Italiano de Buenos Aires. Master in Clinical Effectiveness.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2022;52(3):300-302
Received: 15/08/2022 / Accepted: 16/09/2022 / Published online 29/09/2022 / https://doi.org/10.52787/agl.v52i3.236
Non-inferiority clinical trials are conducted because the experimental treatment is not considered to be better than the standard treatment, but it offers additional advantages, such as: fewer side effects, better metabolic profile, easier administration, less controls and minor costs.
The nature of the research and the answers are different, as in this type of trials we ask whether the experimental treatment is at least as effective as the standard.
It can either be at least as effective as the standard (alternative hypothesis) or less effective than the standard (null hypothesis).
Considering the p-value in non-inferiority studies is important, since we must specify a priori what we consider to be at least as effective or non-inferior. For this, a minimum margin of non-inferiority must be defined.
Therefore, let us consider non-inferiority studies under the following hypothesis:
– Difference in experimental treatment – standard treatment > margin of non-inferiority (null hypothesis).
– Difference in experimental treatment – standard treatment < = margin of non-inferiority (alternative hypothesis), that is, the difference between the experimental treatment and the active control does not exceed the margin of non-inferiority.
The following question answers how to set the minimum non-inferiority margin:
1. Through previous studies that establish the lower limits of the standard intervention vs. placebo.
2. Establishing a previous percentage limit for the new treatment of 50 or 80% of the effect in the classic intervention.
Although what we discussed above is crucial for this type of study, the inferiority limit must be established a priori so that it does not lend itself to subsequent manipulations.
An example is the study of warfarin in reducing the incidence of embolic events compared to placebo with a relative risk of 0.38 (95% CI: 0.28-0.52).
First, we changed the risk category for the placebo (1/0.38) which would mean a RR: 2.63 (95% CI: 1.92-3.57), being able to consider the minimum margin of non-inferiority to be 1.92. However, in this case, a higher requirement was sought, with 50% of the effect of warfarin, and it was established at 1.46. This value was set as the non-inferiority limit.
That is to say the upper limit of the 95% CI of the effect of the new treatment, with respect to warfarin, could not exceed 1.46.
Another example is the ONTARGET study that was designed to demonstrate the non-inferiority of telmisartan (80 mg per day) vs ramipril (10 mg per day) with a combined endpoint of CV death, stroke, myocardial infarction, or hospitalization for pump failure.
To determine the margin of non-inferiority, the HOPE study was used, which evaluated ramipril versus placebo with a combined endpoint similar to ONTARGET.
In this study, the hazard ratio was in favor of ramipril, with a RR of 0.78 (95% CI 0.70-0.86); this was transformed to an excess risk for placebo (1/0.78) of 1.26, and a non-inferiority limit of 1.13 (50% effect of ramipril for telmisartan in the ONTARGET study) was established.
The results of this study determined that telmisartan compared to ramipril showed a RR of 1.01 (95% CI: 0.94-1.09) p < 0.0033, which is lower than the non-inferiority limit of 1.13 .
Telmisartan was considered non-inferior to ramipril, adding some advantages to consider: study discontinuation was higher for ramipril (7.2%) than for telmisartan (5.1%).
Graphically we can determine the non-inferiority studies in the following scheme of Figure 1 (∆: pre-established non-inferiority limit):
Figure 1. Possible non-inferiority results 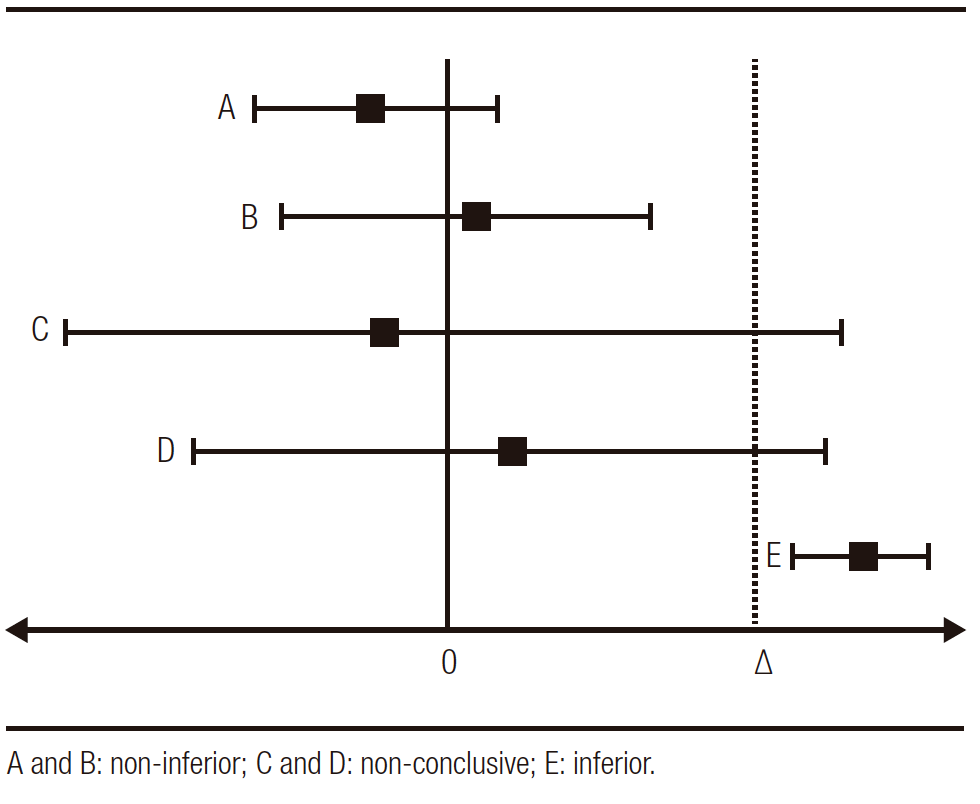
Next, we will cite another example, this time on topics related to gastroenterology, entitled: «A Randomized, Double-Blind, Active-Control, Noninferiority, Multicenter, Phase 4 Study to Evaluate the Efficacy and Safety of Esomeprazole/Sodium Bicarbonate 20/800 mg in Patients with Nonerosive Gastroesophageal Reflux Disease”.
Study Context
Non-erosive reflux disease (NERD) is the most frequent phenotype (60-70%). The therapeutic goal is to improve symptoms with an on-demand strategy. That is, to give the patient the minimum dose with which he/she is asymptomatic. In this sense, it must be emphasized that first-generation proton pump inhibitors (PPIs) must be administered on an empty stomach and associated with a subsequent meal so as not to delay adequate absorption and, consequently, their bioavailability. To improve this situation, combined drugs (PPI+sodium bicarbonate) are currently available. Said formulation would make it possible to avoid the degradation of the drug due to the gastric pH, to have a faster absorption and, with it, a symptomatic improvement. In addition, the presence of bicarbonate is a stimulant of gastrin secretion since it lowers gastric pH; therefore, post-meal intake would not be a condition for the release of the hormone.
The aforementioned study evaluated the efficacy and safety of esomeprazole/sodium bicarbonate 20/800mg vs. esomeprazole 20mg.
We will describe the relevant methodological characteristics for its understanding:
Design: Randomized, double-blind, active-controlled phase 4 trial. Non-inferiority trial.
Objective: To evaluate the association esomeprazole/sodium bicarbonate vs. standard practice with esomeprazole alone in patients with non-erosive gastroesophageal reflux disease.
Population: Patients with non-erosive gastroesophageal reflux with episodes of heartburn starting at least 3 months before and with a frequency of 2 or more days in the week prior to randomization.
Primary endpoint: Complete resolution of heartburn at 4 weeks of treatment.
Methodology: In the search for the non-inferiority limit, the authors estimated that in previous studies the esomeprazole vs. placebo ratio for complete resolution at 4 weeks was 41 vs. 11%, respectively, that is, a difference of 30% between the groups. To establish the non-inferiority limit, they took 50% of this difference, that is, 15% (0.15) as the limit (this would be the upper limit of the 95% CI).
Results: The proportion of patients without heartburn at 4 weeks was similar in the groups, esomeprazole vs. combined (33.3 vs. 35%, p = 0.737) and the confidence interval for the difference was -0.08 to 0.11, this upper limit is lower than the 0.15 (15%) estimated by the authors, therefore combined medication is considered non-inferior.
In turn, the safety points were evaluated, and adverse events were not different between groups.
Conclusion: The combination of esomeprazole/sodium bicarbonate was not inferior to the non-combined esomeprazole in suppressing heartburn at week 4 of treatment in patients with non-erosive gastroesophageal reflux.
Analysis of the Results
The limiting point of the work is the determination of the non-inferiority limit, which was estimated in relation to previous studies where the difference with placebo of esomeprazole was 30%. This is one of the strengths of the study since references were taken from previously validated studies.
A second consideration is that resolution of heartburn with esomeprazole vs. placebo was 41% and in this study 35%, lower than previously estimated.
If we made the difference between the 35% placebo vs. 11% (24%) and if we estimate the non-inferiority limit with 50% of this difference, this would be 12%, within the 11.39% inferiority limit of the study.
Another point to consider is the safety of the combination vs. the isolated drug, since it is relevant in non-inferiority studies to consider that a new effective drug must also be safe for clinical use, as expressed by the results of this study.
The authors also comment that the combination with sodium bicarbonate would have pharmacodynamic and pharmacokinetic advantages that favor the profile of the drug.
Final Considerations
1. In non-inferiority trials it is tested whether the new treatment is non-inferior to the active control.
2. The non-inferiority trials were designed with the objective of evaluating additional advantages of the new treatment with respect to the standard, in important aspects such as: cost, availability, adverse effects, being less invasive and having pharmacological advantages such as pharmacokinetics and pharmacodynamics.
3. The definition of an a priori non-inferiority margin is of essential importance (identifying the source that determined this margin and its confidence intervals) as well as analyzing the results by intention-to-treat or by protocol in this type of trials. Non-inferiority holds only if these two analyses maintain the effect in a coordinated way.
4. The demonstration of non-inferiority does not imply superiority of the new treatment. The superiority trials have as an alternative hypothesis that the new treatment is better than the active treatment or placebo and are analyzed at two tails (p < 0.05), unlike the non-inferiority trial that is analyzed in one tail (p < 0.025).
5. Non-inferiority trials are necessary in situations where it is not ethical to evaluate the new treatment vs. placebo.
Intellectual Property. The author declares that the data and tables that appear in this manuscript are original and were made in his belonging institution.
Funding. The author states that there were no external funding sources.
Conflict of interest. The author declares that he has no conflicts of interest in relation to this article.
Copyright © 2022 Acta Gastroenterológica latinoamericana. This is an open-access article released under the terms of the Creative Commons Attribution (CC BY-NC-SA 4.0) license, which allows non-commercial use, distribution, and reproduction, provided the original author and source are acknowledged.
© 2022 Acta Gastroenterológica latinoamericana. This is an open-access article released under the terms of the Creative Commons Attribution (CC BY-NC-SA 4.0) license, which allows non-commercial use, distribution, and reproduction, provided the original author and source are acknowledged.
Cite this article as: Pizarro Rodolfo. Non-inferiority Clinical Trials. Acta Gastroenterol Latinoam. 2022;52(3):300– 302. https://doi.org/10.52787/agl.v52i3.236
References
Pluchino S. Estudios clínicos de no-inferioridad y de equivalencia: metodología, análisis e interpretación de los resultados Avances Cardiol 2009; 29: 76-81.
Ferreira – González I. Bases para la interpretación de los estudios de no inferioridad: a propósito de los estudios ROCKET-AF, RE-LY y ARISTOTLE. Rev Esp Cardiol 2014;67:432-435.
Ciapponi A. Ensayos aleatorizados de no inferioridad y de equivalencia. Evid Act Pract Ambul 2013;16:92-94.
Leung JT, Barnes SL, Lo ST and Leung DJ. Non-inferiority trials in cardiology: what clinicians need to know. Heart 2020;106:99-104.
Park SH, Lee KN, Lee OY, et al. A Randomized, Double-Blind, Active- Control, Noninferiority, Multicenter, Phase 4 Study to Evaluate the Efficacy and Safety of Esomeprazole/Sodium Bicarbonate 20/800 mg in Patients with Nonerosive Gastroesophageal Reflux Disease. Gut and Liver; June 22, 2022.
Correspondence: Rodolfo Pizarro
Email: rodolfo.pizarro@hospitalitaliano.org.ar
Acta Gastroenterol Latinoam 2022;52(3):300-302
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE