Juan Santiago Rubio,1 Pablo Barros Schelotto,1 Nicolás Aguirre,1 Néstor Pedraza Alonso,1 Diego Ramisch,1 Pablo Farinelli,1 Juan Cundom,2 Guillermo Méndez,2 Enrique Roca,3 Gabriel Eduardo Gondolesi1
1 Servicio de Cirugía General, HPB y Trasplante Hepático, Intestinal y Pancreático, Hospital Universitario Fundación Favaloro.
2 Servicio de Oncología, Hospital Universitario Fundación Favaloro.
3 Sección Oncología, Hospital de Gastroenterología Dr. Carlos Bonorino Udaondo.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2018;48(2):98-105
Recibido: 31/03/2017 / Aprobado: 17/05/2017 / Publicado en www.actagastro.org el 18/06/2018
Resumen
La duodenopancreatectomía cefálica (DPC) es el tratamiento estándar para las neoplasias malignas de la cabeza de páncreas y periampulares. A pesar de los avances en los estudios por imágenes, la mayoría de los casos continúan no siendo resecables al momento de realizar el diagnóstico. Incluir las estructuras vasculares aumenta las posibilidades de resección. Objetivo. Presentar los resultados de duodenopancreatectomía cefálica (DPC) asociadas a resección vascular. Material y métodos. Se trata de un estudio retrospectivo que incluye pacientes operados en un único centro desde enero de 2008 a septiembre de 2016. En el análisis se incluyeron variables como características demográficas, tumorales, presencia de invasión vascular, las complicaciones posoperatorias inmediatas, la supervivencia global y la supervivencia libre de enfermedad. Para el análisis estadístico se utilizó SPSS®v.21. (p < 0,05 fue considerado significativo)- Resultados. Se realizaron 74 DPC por neoplasias malignas primarias. Veinte requirieron resección vascular (RV). Estas se compararon con 54 que no requirieron RV. No se encontraron diferencias significativas entre los grupos en términos de edad, sexo, patología y requerimiento de transfusión. La mediana de seguimiento fue de 33 meses (rango: 0,2-112), el número de resecciones R0 fue comparable entre los grupos, y las supervivencias global y libre de enfermedad no presentaron diferencias significativas (p = 0,10). Conclusiones. Hoy en día la necesidad de realizar DPC + RV no debe ser considerada una contraindicación quirúrgica, ya que amplía las posibilidades de obtener una resección R0 sin impactar en la morbimortalidad perioperatoria, asegurando así resultados adecuados en pacientes que previamente no eran candidatos a resección.
Palabras claves. Duodenopancreatectomía cefálica, resección vascular, enfermedad maligna pancreática y periampular.
Pancreatoduodenectomy for “borderline” malignancies: short and long-term results of performing vascular resections
Summary
Pancreatoduodenectomy is the standard treatment for malignant periampular neoplasms and malignant neoplasms of the pancreatic head, but most cases are not resectable at the time of diagnosis. Resectability may be increase by including vascular structures; but higher rates of complications and associated mortality risk have been reported. Objective. To report our results of Pancreatoduodenectomy associated with vascular resection. Material and methods. Retrospective review from January 2008 to September 2016. We analyzed demographic, tumor, vascular invasion, immediate postoperative complications, overall survival, and disease-free survival. For statistical analysis, SPSS®v.21 was used. (p < 0.05 was considered significant). Results. 74 pancreatoduodenectomies were performed due to primary malignant neoplasms. Twenty required vascular resection (RV). They were compared with 54 that did not require RV. There were no significant differences between groups in terms of age, sex, pathology and transfusion requirement. Median follow-up was 33 months (range: 0.2-112), the number of R0 resections was comparable between groups, global and disease-free survivals did not present significant differences (p = 0.10). Conclusions. VR increases the chances of obtaining an R0 resection without impacting peri-operative morbidity and mortality. In doing so, it expands the indication and applicability of surgery in patients with pancreatic cancer oncology, with or without previous neoadjuvancy.
Key words. Pancreatoduodenectomy, vascular resection, pancreatic and periampular malignancies.
Abreviaturas
HPB: hepato-pancreato-biliar.
DPC: duodenopancreatectomía cefálica.
DPC+RV: duodenopancreatectomía cefálica con resección vascular.
DPC-RV: duodenopancreatectomía cefálica sin resección vascular.
SLE: supervivencia libre de enfermedad.
TNE: tumor neuroendócrino.
TB: tumor borderline.
VP: vena porta.
VMS: vena mesentérica superior.
El adenocarcinoma de páncreas es hoy la segunda causa de cáncer más frecuente del aparato digestivo y la cuarta causa de muerte por cáncer en Estados Unidos, con una supervivencia global a los 5 años de tan solo un 8%.1 La mayoría de los tumores son irresecables al momento del diagnóstico por lo que solamente el 15-20% de los pacientes son candidatos a la cirugía resectiva, único tratamiento capaz de cambiar la historia natural de la enfermedad.2–5
Se considera que un paciente tiene enfermedad resecable cuando el tumor está limitado al páncreas, sin enfermedad metastásica a distancia o compromiso de la vena porta y/o vena mesentérica superior, los ganglios del hilio hepático o el tronco celíaco (TC).6 Cuando el tumor es localmente avanzado, con invasión de las estructuras venosas (distorsión, estrechamiento u oclusión), contacto del tumor con la arteria mesentérica superior (AMS) no mayor a 180° de la circunferencia del vaso, y sin diseminación a distancia, se los denomina “tumores borderline” (TB).7, 8 Los TB son considerados un estadio intermedio entre enfermedad resecable y la que no tiene posibilidad de resección.9, 10 Por lo que, tanto la invasión del tronco espleno-mesentérico-portal como la del TC o AMS no están definidas como criterios de “irresecabilidad”, pero suelen solo ser indicados en centros con experiencia y volumen en cirugía HPB (11 a 30 resecciones pancreáticas por año).2, 5
Uno de los métodos más recomendados para la estadificación preoperatoria es la tomografía computada multicorte con protocolo para páncreas, la cual tiene una sensibilidad del 63-82% y una especificidad del 92-100%. En los tumores resecables en los que no hay evidencia de contacto con estructuras arteriales, puede haber estrechamiento de la VP o VMS menor al 50%. En los TB, se puede observar compromiso de la AMS y/o TC menor a 180°, estrechamiento venoso mayor al 50% u oclusión de un segmento corto de VP, VMS o confluente; por último, los tumores irresecables son aquellos que tienen compromiso arterial de más de 180° y compromiso venoso no reconstruible.11, 12
La invasión vascular del confluente espleno-mesentérico-portal fue considerada una contraindicación de la resección pancreática durante muchos años, ya que no brindaba beneficios oncológicos y aumentaba la morbilidad.13-15
Sin embargo, en varios estudios publicados recientemente, se demostró que la resección vascular mejoraba los resultados oncológicos, ya que se lograban mayores tasas de resección R0.16-18 Kulemann y col. publicaron en 2014 una serie de 359 DPC por adenocarcinoma pancreático y demostraron que al agregar resección multivisceral y resección vascular aumentaba la tasa de resección R0 (90% vs 76%; p = 0,02).16 Actualmente, existe el debate de cuál es la mejor estrategia para los TB. Por un lado, están los que apoyan la idea de hacer quimioterapia + radioterapia (QT+RT) neoadyuvante con posterior resección en caso de respuesta, y por otro lado los que apoyan hacer la resección vascular con la DPC y posteriormente tratamiento QT adyuvante.9, 19-22
La resección vascular venosa, con o sin neoadyuvancia previa, debe ser realizada en centros con experiencia y alto volumen, para disminuir la morbimortalidad de la DPC.9, 19-22 Las RV durante la DPC incluyen la resección de la VP, VMS o el tronco espleno-mesentérico-portal, o según se ha reportado recientemente, la resección del TC o arteria hepática (AH). Se pueden realizar resecciones completas del vaso cuando involucra más de 180 grados de la circunferencia, o resecciones parciales cuando el compromiso es menor.
La invasión arterial continúa siendo materia de discusión aun en centros especializados.23 Perinel publicó algunos puntos para tener en cuenta.24 El compromiso arterial debería ser estudiado por angiotomografía para planear la táctica quirúrgica más adecuada. Además, re-comienda un enfoque multidisciplinario de la resección arterial planificada (la combinación de los cirujanos HPB de alto volumen y cirujanos vasculares) para optimizar el procedimiento y así lograr resultados con una morbilidad aceptable. Como ocurrió con las resecciones venosas hace unos años, las resecciones arteriales han empezado a tener alguna indicación precisa.25
El objetivo de este trabajo es presentar los resultados de pacientes sometidos a DPC+RV por patología maligna pancreática primaria o por tumores de la región periampular.
Material y métodos
Estudio retrospectivo, comparativo, observacional, realizado en un único centro. Se utilizó la base de datos de pacientes sometidos a DPC por enfermedad maligna primaria, en el período comprendido entre enero de 2008 y septiembre de 2016.
Se incluyeron todos los pacientes mayores de 18 años, a los cuales se les realizó una DPC, por enfermedad maligna primaria, con o sin resección vascular (venosa, arterial o ambas). Se excluyeron aquellos pacientes sometidos a una DPC en los que el diagnóstico histopatológico informó: enfermedad benigna, premaligna y/o enfermedad metastásica (por ej.: IPMN, cistoadenoma mucinoso, cistoadenoma seroso, neoplasia pseudopapilar, etc.). Se analizaron variables demográficas, histología tumoral, tiempo de internación, necesidad de transfusiones, tiempo operatorio, aparición de complicaciones de acuerdo con la clasificación de Dindo-Clavien,26 el desarrollo de fístulas pancreáticas según la clasificación del International Study Group of Pancreatic Fístula,27 la necesidad de reoperaciones y extensión de la resección.
Las variables continuas son presentadas como media (± DS), las variables categóricas se presentan como número total y porcentajes. La comparación de las variables continuas se realizó mediante test de Student. Las variables categóricas con Chi cuadrado y prueba de Fisher, según correspondiera. Tanto la supervivencia global como libre de enfermedad fueron analizadas aplicando curvas de Kaplan-Meier, considerándose estadísticamente significativo cuando p < 0,05 (Log Rank test). Para el análisis estadístico de utilizó el paquete SPSS®v.21 (IBM SPSS Statistics, Versión 21.0).
Diagnóstico y manejo preoperatorio
Para el diagnóstico, se utilizó una tomografía computada multicorte con protocolo para páncreas. Todos los pacientes fueron presentados en el Comité de Tumores, conformado por un equipo multidisciplinario (cirujanos, oncólogos, radiólogos y patólogos) donde se decidió la conducta quirúrgica. Para aquellos pacientes con compromiso vascular por imágenes, se le solicitó una angiotomografía para determinar el vaso comprometido y el grado de compromiso. En el intraoperatorio, a los pacientes que tuvieron RV se les realizó una ecografía doppler, para evaluar la permeabilidad.
Seguimiento posoperatorio
Todos los pacientes pasaron a la unidad de cuidados intensivos. Durante el posoperatorio, recibieron, como tratamiento profiláctico de trombosis, heparina de bajo peso molecular durante las primeras 24 horas. En el posoperatorio inmediato, se les realizó a todos los pacientes que recibieron una RV una ecografía doppler para evaluar la permeabilidad de las anastomosis o injertos vasculares, y se repitió al segundo y tercer día.
Resultados
Durante el período analizado, fueron realizadas 74 DPC por patología maligna primaria. En 20 se realizó alguna resección vascular (27%). La edad mediana fue 64 años (rango 29-85), 45 fueron hombres (61%).
Para el grupo DPC+RV la edad media fue 64 años (rango: 46-76). Once (55%) fueron hombres. El riesgo operatorio fue determinado según los criterios de la American Society of Anesthesiologist (ASA):28 ASA I en 2 (10%), ASA II en 16 (80%) y ASA III en 2 (10%) (Tabla 1).
De las 20 DPC+RV, 18 (90%) fueron resecciones venosas y 2 (10%) resecciones combinadas (vena y arteria). Las resecciones venosas incluyeron: 5 resecciones portales (2 completas y 3 parciales); 11 resección de VMS (8 completas y 3 parciales); 3 resección completa del confluente; 1 resección parcial del confluente.
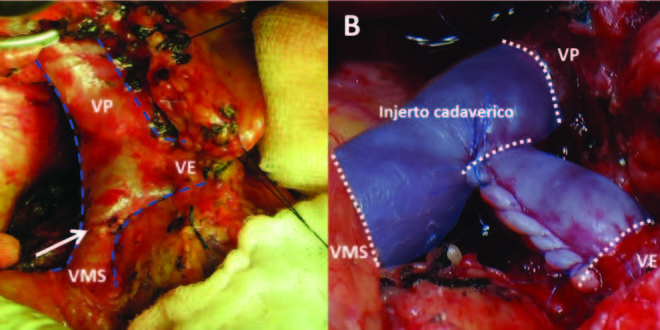
En 11 pacientes la restitución del flujo portal se realizó por medio de una anastomosis termino-terminal entre los cabos seccionados, en 7 pacientes se utilizaron injertos cadavéricos isogrupo, y en otros dos pacientes injertos autólogos de vena yugular interna (Figura 1).
En cuanto a las resecciones arteriales, se realizó la resección de un segmento de la arteria hepática derecha (AHD) y reconstrucción con anastomosis termino-terminal en un paciente. El paciente restante presentaba una variante anatómica (AHD que nacía en la arteria mesentérica superior). Se realizó resección parcial de la AHD y reimplantación de esta en el TC.
Figura 1. A) Anastomosis primaria de vena mesentérica superior. B) Reconstrucción del tronco espleno-mesentérico portal con injerto cadavérico.
Tabla 1. Características demográficas, información preoperatoria, complicaciones, margen oncológico y estadía hospitalaria según el grupo.
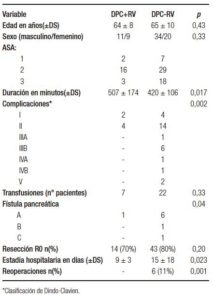
La mediana del tiempo de cirugía fue de 507 minutos (rango: 300-900) para DPC+RV vs. 420 minutos (rango: 240-720) para DPC sin RV (p = 0,017). En la Tabla 1 se detallan las complicaciones posoperatorias por grupo.
Se reoperaron 6 pacientes, 2 por evisceración, 3 por colecciones abdominales y 1 por sangrado posoperatorio. Todos los pacientes pertenecían al grupo de DPC-RV (p = 0,001).
No hubo diferencias estadísticamente significativas en cuanto a necesidad de transfusiones y tiempo de internación. El desarrollo de fístula pancreática fue mayor en el grupo DPC-RV, como se puede ver en la Tabla 1.
El diagnóstico histopatológico se detalla en la Tabla 2. Se confirmó la invasión vascular en 5 pacientes, y en un paciente se confirmó que no había compromiso vascular. En los 14 pacientes restantes no hay descripción en el informe de anatomía patológica.
Tabla 2. Distribución según el diagnóstico histológico.

La estadía hospitalaria promedio fue de 15 días para DPC-RV y de 9 días para DPC+RV (p = 0,023), esto se debió a que el grupo de pacientes que no tuvieron RV presentaron mayor tasa de complicaciones que aquellos a los que sí se les realizó RV. Los pacientes que recibieron transfusiones tuvieron una supervivencia a largo plazo significativamente menor que aquellos que no las recibieron (15% vs. 50% [IC95%: 23-52]; p = 0,014).
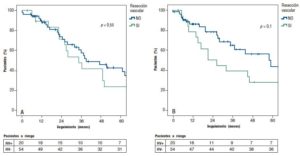
La mediana de seguimiento fue de 33 meses (rango: 0,2-112). La supervivencia global a los 1, 3 y 5 años fue de 87%, 57% y 42% para DPC-RV y de 89%, 41% y 23% para DPC+RV (p = 0,55). La supervivencia libre de enfermedad (SLE) a los 1, 3 y 5 años fue de 86%, 65% y 43% para DPC-RV y 78%, 39% y 28% para DPC+RV respectivamente (p = 0,10) (Figura 2A y 2B).
Teniendo en cuenta los diferentes tipos histológicos, se hizo un análisis de la supervivencia para cada grupo histológico. Para el adenocarcinoma de páncreas, la supervivencia global a los 1, 3 y 5 años para DPC-RV (n = 16) fue de 80%, 22% y 15% y para el grupo DPC+RV (n = 16) fue de 93%, 47%, 16% (p = 0,18). La SLE a los 1, 3 y 5 años fue de 73%, 34% y 17% para el grupo DPC-RV vs. 86%, 36% y 14% para el grupo DPC+RV (p = 0,5).
Figura 2. A) Supervivencia global. B) Superviviencia libre de enfermedad
Discusión
Desde los inicios de la cirugía pancreática oncológica, el compromiso vascular regional por enfermedad pancreática maligna primaria se ha considerado una contraindicación absoluta para la resección. En 1973, Fortner describió la técnica de resección pancreática regional en bloque para el cáncer de páncreas, la cual incluía la resección y la reconstrucción arterial y venosa.39 Sin embargo, las altas tasas de morbimortalidad resultaron prohibitivas.13, 14, 28, 29
Los avances en los métodos de diagnóstico, el desarrollo de nuevos medicamentos citostáticos y las mejoras en las técnicas quirúrgicas en la DPC han incrementado los casos en los que se realiza la resección venosa en los tumores considerados borderline. A pesar de ser un procedimiento de mayor complejidad, las cifras de morbilidad y mortalidad son comparables con aquellos pacientes en los que no se realizó RV, según lo publicaron Beltrame y col. DPC+RV 3% vs. DPC sin RV 4% (p = NS) y Gong y col. DPC+RV 6% vs. DCP sin RV 3% (p = 0,23).13, 14, 23, 29, 31, 32 Escasos reportes del tema han sido realizados en Latinoamérica, lo que motivó la realización de este estudio en nuestro centro.40, 41
Desde lo técnico, cuando nos encontramos ante la necesidad de realizar una resección vascular, hay que tener conocimiento de las opciones de reconstrucción y planificarlo acorde con esto en el preoperatorio.38 Existen diferentes tipos de reconstrucción: venorrafia lateral y/o cierre primario; resección tangencial con parche autólogo o cadavérico; resección segmentaria con ligadura de vena esplénica y anastomosis primaria o interposición de injerto autólogo o cadavérico.11 La necesidad de injertos estará dada por la tensión que pueda presentarse al momento de la anastomosis, si se considera que la tensión será excesiva, se prefiere realizar la interposición de un injerto. Generalmente se puede realizar anastomosis T-T cuando la resección es menor a 4 cm. En la actualidad, la DPC con RV se realiza en hasta un 20% de los casos en los centros de cirugía pancreática de alto volumen.2, 5, 30 En nuestro centro, se realizaron RV en 27% de los casos, gracias a la existencia de un programa interdisciplinario, y a la realización por el mismo equipo quirúrgico de trasplantes de órganos abdominales, lo que permite contar con todas las opciones descriptas al momento de planificar la estrategia.
Al compararse la radicalidad de la resección no se encontró diferencia estadística entre ambos grupos (p = 0,20). Lo mismo ocurrió al compararse la supervivencia global y libre de enfermedad, coincidiendo con las publicaciones internacionales mencionadas. Beltrame publicó sus resultados en 2014, comparando 119 pacientes operados con DPC+RV, que tuvieron una supervivencia media de 20 meses vs. 447 pacientes operados con DPC- RV que tuvieron supervivencia media de 26 meses, sin resultados estadísticamente significativos (p = 0,31).13
Los avances descriptos, los resultados obtenidos en Estados Unidos, Europa, y Asia, como en centros de cirugía HPB en nuestro medio, avalan que hoy la invasión venosa no deba ser considerada una contraindicación para la resección de patología pancreática maligna primaria ubicada en la cabeza del páncreas. Por el contrario, debe ser estimulada, y lo que ocurre en nuestro centro donde más de un cuarto de las DPC son con resección vascular, ya que al hacerla se incrementa la aplicabilidad de la cirugía en pacientes borderline y se aumenta la posibilidad de resección R0.
Diferentes son los resultados cuando se incluyen estructuras arteriales. En los pacientes con compromiso corto del TC o la AMS sin invasión en su origen, podría intentarse resección y anastomosis termino-terminal. En los casos en los que el compromiso axial es más extenso se pueden utilizar injertos arteriales cadavéricos. La resecabilidad debe redefinirse sobre la base de un compromiso axial (más que circunferencial).21 Entre los diversos enfoques para la reconstrucción arterial, la transposición de arteria esplénica es una opción interesante cuando es factible. La evidencia actual sugiere que la resección arterial puede ser apropiada para ciertos pacientes, presentándose mayor beneficio en aquellos casos que presentan tumores del cuerpo o cola del páncreas. Sin embargo, es importante señalar que la recomendación para la resección vascular es que debe ser realizada en centros de alto volumen.23, 33
La falta de confirmación del compromiso vascular en 14 pacientes de nuestro estudio es quizás la debilidad de este trabajo. Se puede pensar que la falta de este análisis representa una sobreestimación del compromiso vascular real. La realización de la RV no impactó en la morbimortalidad del procedimiento. Este es un hecho a resaltar. A su vez, este déficit del informe histopatológico estimuló la estandarización del estudio de la pieza quirúrgica por par-te de los patólogos; para tal fin utilizamos el Protocol for the Examination of Specimens From Patients with Carcinoma of the Pancreas, publicado por el College of American Pathologist en agosto de 2016.34
Como ya se ha propuesto en otras publicaciones, el hecho de que los pacientes reciban transfusiones de hemoderivados, ya sea en el intraoperatorio o en el posoperatorio inmediato tiene impacto negativo en la sobrevida a largo plazo.35-38 No está claro aún el mecanismo, pero la transfusión de glóbulos rojos inhibiría la inmuno-vigilancia innata responsable de la detección y eliminación de células mutadas.35 Nuestros resultados confirman este dato.
Conclusión
No existe diferencia en cuanto a supervivencia global y libre de enfermedad entre los grupos analizados. La DPC+RV no aumenta la morbimortalidad. La RV aumenta el número de resecciones R0. Por esto, podemos afirmar que las resecciones venosas pueden ser realizadas en forma segura, con una baja tasa de complicaciones, si se realiza en centros especializados de alto volumen, y que el abordaje interdisciplinario es fundamental para lograr resultados favorables, así los pacientes portadores de patología maligna primaria pancreática borderline serían beneficiados.
Sostén financiero. Ninguno.
Referencias
- Siegel RL, Miller KD, Jemal A. Cancer statistics. CA Cancer J Clin 2016; 66: 7-30.
- Joseph B, Morton JM, Hernandez-Boussard T, Rubinfeld I, Faraj C, Velanovich V. Relationship Between Hospital Volume, System Clinical Resources and Mortality in Pancreatic Resection. J Am Coll Surg 2009; 208: 520-527.
- Meguid RA, Ahuja N, Chang DC. What constitutes a “High- Volume” Hospital for Pancreatic Resection? J Am Coll Surg 2008; 206: 622-628.
- Ziegler KM, Nakeeb A, Pitt HA, Schmidt CM, Bishop SN, Moreno J, Matos JM, Zyromski NJ, House MG, Madura JA, Howard TJ, Lillemoe KD. Pancreatic surgery: Evolution at a high-volume center. Surgery 2010; 148: 702-710.
- Eppsteiner RW, Csikesz NG, Mcphee JT. Surgeon Volume Impacts Hospital Mortality for Pancreatic Resection. Ann Surg 2009; 249: 635-640.
- Jones WE 3rd, Suh WW, Abdel-Wahab M, Abrams RA, Azad N, Das P, Dragovic J, Goodman KA, Jabbour SK, Konski AA, Koong AC, Kumar R, Lee P, Pawlik TM, Small W Jr, Herman JM. Expert Panel on Radiation Oncology Gastrointestinal. ACR Appropriateness Criteria® Resectable Pancreatic Cancer. Am J Clin Oncol 2017; 40: 109-117.
- Small W Jr, Hayes JP, Warren Suh W, Abdel-Wahab M, Abrams RS, Azad N, Das P, Dragovic J, Goodman KA, Jabbour SK, Jones WE 3rd, Konski AA, Koong AC, Kumar R, Lee P, Pawlik TM, Herman JM . Am Coll of Radiol. Appropriateness Criteria® Resectable Pancreatic Cancer. Summary of Literature Review. J Am Coll Radiol 2017; 1-13.
- de Santibañes M, Ocampo C, Mazza O, Álvarez Rodríguez J, Martín Palavecino M, Facundo Alonso, Sung Ho Hyon, Pablo Sánchez HZ. Primer Consenso Argentino de Cáncer de Páncrea: Recomendaciones para el diagnóstico, estadificación, tratamiento y paliación. Rev Argent Cir 2016; 108: 213-220
- Bockhorn M. Borderline resectable pancreatic cancer: A consensus statement by the International Study Group of Pancreatic Surgery (ISGPS). Surg 2014; 155: 977-988.
- Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol 2010; 17: 1471- 1474.
- Younan G, Tsai S, Christians KK. Techniques of Vascular Resection and Reconstruction in Pancreatic Cancer Pancreaticoduodenectomy Vascular Resection Vascular reconstruction Whipple. Surg Clin North Am 2016; 96: 1351-1370.
- Nakao A, Kanzaki A, Fujii T, Kodera Y, Yamada S, Sugimoto H, Nomoto S, Nakamura S, Morita S, Takeda S. Correlation between radiographic classification and pathological grade of portal vein wall invasion in pancreatic head cancer. Ann Surg 2012; 255: 103-108.
- Beltrame V, Gruppo M, Pedrazzoli S, Merigliano S, Pastorelli D, Sperti C. Mesenteric-portal vein resection during pancreatectomy for pancreatic cancer. Gastroenterol Res Pract 2015; 2015: 1-5.
- Chua TC, Saxena A. Extended Pancreaticoduodenectomy with Vascular Resection for Pancreatic Cancer: A Systematic Review. J Gastrointest Surg 2010; 14: 1442-1452.
- Delpero JR, Boher JM, Sauvanet A, Le Treut YP, Sa-Cunha A, Mabrut JY. Pancreatic Adenocarcinoma with Venous Involvement: Is Up-Front Synchronous Portal-Superior Mesenteric Vein Resection Still Justified? A Survey of the Association Française de Chirurgie. Ann Surg Oncol 2015; 22: 1874-1883.
- Kulemann B, Hoeppner J, Wittel U, Glatz T, Keck T, Wellner UF, Bronsert P, Sick O, Hopt UT, Makowiec F, Riediger H. Perioperative and Long-Term Outcome after Standard Pancreaticoduodenectomy, Additional Portal Vein and Multivisceral Resection for Pancreatic Head Cancer. J Gastrointest Surg 2015; 19: 438-444.
- Riall TS, Cameron JL, Lillemoe KD, Campbell KA, Sauter PK, Coleman J. Pancreaticoduodenectomy with or without distal gastrectomy and extended retroperitoneal lymphadenectomy for periampullary adenocarcinoma – Part 3: Update on 5-year survival. J Gastrointest Surg 2005; 9: 1191-1206.
- Chen Y, Tan C, Mai G, Ke N, Liu X. Resection of pancreatic tumors involving the anterior surface of the superior mesenteric/portal veins axis: An alternative procedure to pancreaticoduodenectomy with vein resection. J Am Coll Surg 2013; 217: 21-28.
- di Sebastiano P, Grottola T, di Mola FF. Borderline resectable pancreatic cancer and the role of neoadjuvant chemoradiotherapy. Updates Surg 2016; 68: 235-239.
- Addeo P, Rosso E, Fuchshuber P, Oussoultzoglou E, De Blasi V, Simone G, Belletier C, Dufour P, Bachellier P. Resection of Borderline Resectable and Locally Advanced Pancreatic Adenocarcinomas after Neoadjuvant Chemotherapy. Oncology 2015; 89: 37-46.
- Tempero MA, Malafa MP, Behrman SW. Pancreatic Adenocarcinoma. Featured Updates to the NCCN Guidelines. JNCCN J Natl Compr Cancer Netw 2014; 12: 1671-1680.
- Hackert T, Ulrich A, Büchler MW. Borderline resectable pancreatic cancer. Cancer Lett 2016; 375: 231-237.
- Kasumova GG, Conway WC, Tseng JF. The Role of Venous and Arterial Resection in Pancreatic Cancer Surgery. Ann Surg Oncol 2018; 25: 51-58.
- Perinel J, Nappo G, Bechwaty M El, Walter T, Hervieu V. Locally advanced pancreatic duct adenocarcinoma : pancreatectomy with planned arterial resection based on axial arterial encasement. Langenbeck’s Arch Surg 2016; 401: 1131-1142.
- Amano H, Miura F, Toyota N, Wada K, Katoh KI, Hayano K. Is pancreatectomy with arterial reconstruction a safe and useful procedure for locally advanced pancreatic cancer? J Hepatobiliary Pancreat Surg 2009; 16: 850-857.
- Dindo D, Demartines N, Clavien P. Classification of Surgical Complications. 2004; 240: 205-213.
- Bassi C, Dervenis C, Butturini G, Fingerhut A, Yeo C, Izbicki J, John Neoptolemos J, Sarr M, Traverso W, Buchler M. Postoperative pancreatic fistula: An international study group (ISGPF) definition. Surgery 2005; 138: 8-13.
- Cohen MM, Duncan PG. Physical status score and trends in anesthetic complications. J Clin Epidemiol 1988; 41: 83-90.
- Harrison LE, Klimstra DS, Brennan MF. Isolated portal vein involvement in pancreatic adenocarcinoma. A contraindication for resection? Ann Surg 1996; 224: 342-347.
- Smoot RL, Christein JD, Farnell MB. Durability of portal venous reconstruction following resection during pancreaticoduodenectomy. J Gastrointest Surg 2006; 10: 1371-1375.
- Flis V, Potrc S, Kobilica N, Ivanecz A. Pancreaticoduodenectomy for ductal adenocarcinoma of the pancreatic head with venous resection. Radiol Oncol 2016; 50: 321-328.
- Gong Y, Zhang L, He T, Ding J, Zhang H, Chen G. Pancreaticoduodenectomy combined with vascular resection and reconstruction for patients with locally advanced pancreatic cancer: A Multicenter, Retrospective Analysis. PLoS One 2013; 8: e70340.
- Fukami Y, Kaneoka Y, Maeda A, Takayama Y, Onoe S. Prognostic impact of splenic artery invasion for pancreatic cancer of the body and tail. Int J Surg 2016; 35: 64-68.
- Washington K, Berlin J, Branton P, Burgart LJ, Carter DK, Compton CC, Fitzgibbons P, Frankel WL, Jessup J, Kakar S, Minsky B, Nakhleh R, Tang L. Protocol for the examination of specimens from patients with carcinoma of the pancreas. College of American Pathologists 2016; 1-19.
- Sutton JM, Kooby DA, Wilson GC, Squires MH, Hanseman DJ, Maithel SK, Bentrem DJ, Weber SM, Cho CS, Winslow ER, Scoggins CR, Martin RC 2nd, Kim HJ, Baker JJ, Merchant NB, Parikh AA, Abbott DE, Edwards MJ, Ahmad SA. Perioperative blood transfusion is associated with decreased survival in patients undergoing pancreaticoduodenectomy for pancreatic adenocarcinoma: a Multi-institutional Study. J Gastrointest Surg 2014; 18: 1575-1587.
- Yao HS, Wang Q, Wang WJ, Hu ZQ. Intraoperative allogeneic red blood cell transfusion in ampullary cancer outcome after curative pancreatoduodenectomy: A clinical study and meta-analysis. World J Surg 2008; 32: 2038-2046.
- Shiba H, Misawa T, Fujiwara Y, Futagawa Y, Furukawa K, Haruki K, Iida T, Iwase R, Yanaga K. Negative impact of fresh-frozen plasma transfusion on prognosis of pancreatic ductal adenocarcinoma after pancreatic resection. Anticancer Res 2013; 33: 4041-4047.
- Park SJ, Kim SW, Jang JY, Lee KU, Park YH. Intraoperative transfusion: Is it a real prognostic factor of periampullary cancer following pancreatoduodenectomy? World J Surg 2002; 26: 487-492.
- Fortner JG. Regional resection and pancreatic carcinoma. Surgery 1973; 106: 496-498.
- de Santibañes M, Álvarez FA, Mazza O, Sanchez Claria R, Rodriguez Santos F, Brandi C, de Santibañes E, Pekolj J. Surgical strategies for restoring liver arterial perfusion in pancreatic resections. Lang Arch Surg 2016; 401: 113-120.
- Norero E, Báez S, Viñuela E, Martínez C, Reyes J, Kusanovic R, Sanhueza M, Aguayo G, Calvo A, Mege RM, Caracci M, Días A. Resultados perioperatorios y sobrevida alejada de la pancreatoduodenectomía con resección vascular. Rev Chil Cir 2009; 61: 519-525.
Correspondencia: Gabriel Eduardo Gondolesi
Av. Belgrano 1782 (C1093AAS).Ciudad Autónoma de Buenos Aires, Argentina
Tel: (54) 11 43781200 – Int: 3700/05
Correo electrónico: ggondolesi@ffavaloro.org
Acta Gastroenterol Latinoam 2018;48(2): 98-105
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE