Florencia Giraudo ID· María Laura Garbi ID
Hospital Interzonal General de Agudos “General San Martín» de la Plata.
La Plata, Provincia de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2024;54(1):31-39
Recibido: 20/02/2024 / Aceptado: 20/03/2024 / Publicado online el 25/03/2024 / https://doi.org/10.52787/agl.v54i1.396
Resumen
La hemorragia digestiva de intestino medio es considerada una patología poco frecuente y representa aproximadamente el 5 a 10% de todas las hemorragias del tracto gastrointestinal. En las últimas décadas, los avances en el estudio del intestino delgado han mejorado considerablemente su diagnóstico, logrando una tasa de detección de la etiología cercana al 75%. A pesar de estos avances, su presentación clínica, diagnóstico y abordaje terapéutico continúan siendo un desafío en la práctica médica. El éxito en el tratamiento de esta condición depende en gran medida de una evaluación exhaustiva de la historia clínica del paciente, de una sospecha adecuada de las lesiones subyacentes y de la correcta implementación de las herramientas diagnósticas y terapéuticas disponibles en la actualidad. Esta revisión tiene como objetivo abordar las definiciones actuales de hemorragia digestiva del intestino medio, su etiología, así como su enfoque diagnóstico y terapéutico, con el fin de orientar el manejo de esta patología.
Palabras claves. Cápsula endoscópica, colonoscopía, hemorragia gastrointestinal, intestino delgado, tomografía computada, enteroscopía asistida por dispositivo, angioectasias.
Current Concepts and Approach to Mid-Gastrointestinal Bleeding
Summary
Mid-gastrointestinal bleeding is considered an uncommon pathology, representing approximately 5 to 10% of all gastrointestinal tract bleedings. Over the last few decades, significant advancements in the study of the small intestine have considerably improved diagnosis, resulting in a detection rate of the etiology close to 75%. Despite these developments, clinical presentation, diagnosis, and therapeutic approach continue to be a challenge in medical practice. Effectively managing this condition largely depends on thoroughly assessing the patient’s medical history, properly considering underlying lesions, and correctly implementing available diagnostic and therapeutic tools. Therefore, this review aims to address the current definitions of mid-gastrointestinal bleeding, its etiology, along with its diagnostic and therapeutic approach, to guide the management of this patholog.
Keywords. Capsule endoscopy, colonoscopy, gastrointestinal hemorrhage, instestine small, tomography, device-assisted enteroscopy, angioectasias.
Introducción
La hemorragia digestiva de intestino medio (HDIM) se define como el sangrado que ocurre entre la ampolla de Vater y la válvula ileocecal en el tracto gastrointestinal. Es considerada una patología poco frecuente y representa del 5 al 10% de las hemorragias digestivas.1-2
En las últimas décadas, se ha observado un importante progreso en el estudio y tratamiento de las lesiones del intestino delgado (ID), lo que ha llevado a una revisión de las definiciones previamente establecidas. Sin embargo, a pesar del desarrollo de nuevas tecnologías como la videocápsula endoscópica (VCE) de ID y de la enteroscopía asistida por dispositivo (EAD), el diagnóstico y el tratamiento de estos pacientes sigue presentando desafíos significativos en la práctica clínica. El objetivo de esta revisión es analizar la definición actual de la HDIM, así como su enfoque diagnóstico y terapéutico, con el fin de proporcionar pautas para el lograr orientar el abordaje de esta patología.3
Definiciones
Históricamente, la HDIM se denominó como hemorragia digestiva oscura hasta el año 2015, cuando el American College of Gastroenterology propuso una nueva nomenclatura.1 Este cambio se originó gracias a los avances significativos en los estudios del ID mediante técnicas como la VCE, EAD y estudios por imágenes, los cuales han permitido mejorar la capacidad de diagnosticar la causa del sangrado en el ID.4 Como resultado, el término “hemorragia de origen oscuro” se reserva para los casos en los que no se pueda identificar el sitio de sangrado en el tracto gastrointestinal, incluso después de un estudio exhaustivo que incluya endoscopías digestivas alta y baja, VCE y/o estudios por imágenes.1
En consecuencia, actualmente se proponen las siguientes definiciones:
●HDIM: sangrado digestivo que se identifica distal a la ampolla de Vater y proximal a la válvula ileocecal.1,3
●Sospecha de hemorragia digestiva de intestino medio: pacientes con anemia o sangrado evidente, sin lograr identificar el sitio de sangrado después de una videoendoscopía digestiva alta (VEDA) e ileocolonoscopía, debiendo cumplir ambos estudios con los estándares de calidad.1,3
● HDIM oculta: pacientes que presentan anemia ferropénica, con o sin sangre oculta en materia fecal positiva, con diagnóstico etiológico del sitio de sangrado en el ID.1,3
●HDIM evidente: pacientes que presentan melena o hematoquecia con diagnóstico etiológico del sitio de sangrado en el ID.1,3
●Hemorragia digestiva oscura: pacientes en los que, a pesar de haber realizado VEDA, ileocolonoscopía, VCE y/o EAD y estudios por imágenes, no se ha diagnosticado el sitio de sangrado.1,3
Epidemiología e historia natural del sangrado del intestino delgado
Comprender la epidemiología y las causas subyacentes del sangrado del ID es esencial para abordar eficazmente esta patología. Diferentes guías estiman que la prevalencia de la hemorragia digestiva del ID es del 5 al 10% de todos los pacientes que se presentan con hemorragia digestiva.1 La etiología del sangrado está estrechamente relacionada con la edad del paciente, la forma de presentación y las enfermedades subyacentes.3 Por lo tanto, la anamnesis desempeña un papel fundamental para lograr orientar la etiología. Al evaluar los pacientes con sospecha de HDIM, es importante considerar varios factores de riesgo y antecedentes clínicos, que pueden incluir:
● Uso previo de fármacos: antiinflamatorios no esteroideos (AINEs), ácido acetil salicílico, anticoagulantes y/o agentes antiplaquetarios.3
● Antecedentes patológicos: insuficiencia renal crónica, enfermedad de Von Willebrand, valvulopatías cardíacas, enfermedades genéticas (por ejemplo: Síndrome de Rendu Osler) y/o trastornos asociados a la hipertensión portal.3
● Antecedentes quirúrgicos: resección intestinal previa, cirugía de reparación de aneurisma aórtico, trasplante hepático.3
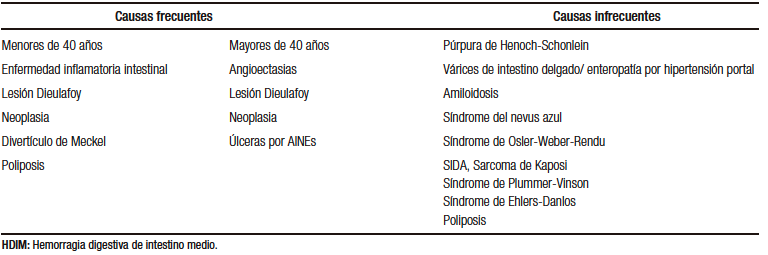
La etiología del sangrado del ID puede dividirse en dos grupos principales según la edad del paciente. En pacientes menores de 40 años, las causas más frecuentes son la enfermedad inflamatoria intestinal y el divertículo de Meckel, mientras que en aquellos mayores de 40 años, las angioectasias y las lesiones asociadas al uso de AINEs son más prevalentes.5,6,7 Sin embargo, es importante tener en cuenta que las neoplasias (adenocarcinoma, tumores del estroma gastrointestinal, tumores neuroendocrinos) y la lesión de Dieulafoy pueden presentarse en ambos grupos etarios (Tabla 1).5,6
Tabla 1. Etiología de la HDIM según grupo etario
Gracias a los avances en los métodos diagnósticos, se estima que aproximadamente el 75% de los pacientes con sospecha de HDIM pueden obtener un diagnóstico preciso de la etiología.8
Diagnóstico
En la actualidad, se dispone de diferentes modalidades diagnósticas para investigar la etiología de la HDIM. La elección del método diagnóstico adecuado depende del estado clínico del paciente, las características de la hemorragia y la sospecha diagnóstica. La mayoría de los pacientes con HDIM se presenta hemodinámicamente estable, excepto en casos raros de fístula aórtica, lesión de Dieulafoy o divertículo de Meckel. Por lo tanto, es fundamental una anamnesis completa y una correcta interpretación de las manifestaciones clínicas para determinar los estudios complementarios a realizar.1,3,4
●Segunda evaluación endoscópica (second look): Se ha observado que un porcentaje de pacientes presenta lesiones perdidas durante la realización de la VEDA y/o ileocolonoscopía. La repetición de la VEDA ha demostrado un rédito diagnóstico del 2 al 25%, mientras que una nueva ileocolonoscopía aporta un rédito del 6 al 23%.9,10,11 Estudios recientes que emplean EAD y VCE confirman estos hallazgos.12 Actualmente no se recomienda repetir la VEDA y la ileocolonoscopía de forma rutinaria, excepto cuando los estudios endoscópicos iniciales no cumplen con los estándares de calidad.3,9,13 Algunos autores proponen realizar un second look endoscópico con enteroscopía por push para examinar el duodeno y el yeyuno proximal, sitios de localización más frecuentes de las lesiones en el ID.1,3,13
●Enteroscopía por push o por empuje: Es una endoscopía alta extendida que se realiza con un endoscopio largo, o con un colonoscopio pediátrico. La enteroscopía por push permite la evaluación de aproximadamente 50 a 70 cm distales al ligamento de Treitz.1,3 Su rendimiento diagnóstico oscila entre el 3 y el 70%, siendo las lesiones vasculares el hallazgo más frecuente.1.2.3 Aunque se ha considerado su implementación en casos de second look endoscópico, no se la considera un método de primera línea en el estudio de la HDIM.2
●Videocápsula endoscópica: Es el procedimiento de primera línea para el estudio del ID en los pacientes con sospecha de HDIM.3 Esta técnica permite una evaluación no invasiva y completa del ID en el 70 al 90% de los pacientes. Su rendimiento diagnóstico oscila entre el 38 y 83% en casos de sospecha de HDIM, presentando una alta sensibilidad y especificidad, con valores predictivos positivos y negativos en rangos del 94 al 97% y del 83 al 100% respectivamente.13,14 Diferentes estudios mostraron que los hallazgos obtenidos mediante VCE tienen un impacto clínico significativo. Guían la decisión de intervenciones endoscópicas o quirúrgicas y conducen a un cambio en el tratamiento entre el 37 y el 87% de los pacientes. Además, se ha demostrado que entre el 50 al 66% de los pacientes logran mantenerse libres de transfusiones y sin recurrencia del sangrado luego de recibir un tratamiento dirigido por los hallazgos de la VCE.15 La tasa de resangrado oscila entre el 6 y el 27% en pacientes con VCE negativa.16 Se recomienda realizar el estudio tan pronto como sea posible luego del episodio de sangrado, preferentemente dentro de los 14 días, para lograr maximizar el rédito diagnóstico del método.17 El rédito diagnóstico de la VCE en la HDIM evidente es del 85 al 92%, mientras que en la HDIM oculta es cercano al 45%. Es posible mejorar la tasa de rédito diagnóstico si la VCE se realiza con el menor intervalo posible desde el episodio de hemorragia digestiva. Si bien durante mucho tiempo el intervalo sugerido fue de 14 días, actualmente se sabe que este tiempo es algo arbitrario y bastante amplio.17 Estudios recientes recomiendan realizar la VCE lo antes posible luego del episodio, idealmente dentro de las 48 horas. Chao y col. demostraron una tasa de detección del origen del sangrado del 70 al 77%, si la VCE se realizaba dentro de las 72 horas del episodio de sangrado, en pacientes con HDIM evidente. Por el contrario, la tasa de detección disminuyó al 36,4% cuando se realizaba luego del cuarto día.18 Kim y col. realizaron un estudio retrospectivo con 94 pacientes con HDIM evidente, con rendimiento diagnóstico en el grupo en el que se realizó la VCE antes de las 48 horas del 66,7% vs. 40,6% en el grupo en el cual se la realizó luego de las 48 horas. También observaron un rendimiento terapéutico superior (24,7% vs. 9,45%) y menor estancia hospitalaria (5 días vs. 7 días), con una diferencia estadísticamente significativa.19
Otras características asociadas a un mayor rédito diagnóstico incluyen: antecedentes de hemorragia manifiesta, uso de agentes antitrombóticos, sexo masculino, edad avanzada, comorbilidades hepáticas y renales.20,21 Desde el punto de vista técnico, una revisión cuidadosa de las imágenes obtenidas realizada por profesionales capacitados, utilizando los avances tecnológicos disponibles (por ejemplo: inteligencia artificial), podría contribuir en aumentar aún más el rendimiento diagnóstico y acortar los tiempos de lectura.22,23,24 Se asociaron a mayor probabilidad de resultados positivos de VCE: valores de hemoglobina menores a 10 g/dl, duración del sangrado mayor a 6 meses, más de un episodio de sangrado, presentación del sangrado en forma manifiesta, y la realización del estudio dentro de los 14 días posteriores al episodio de sangrado.25,26 El predictor más fuerte para un estudio de VCE positivo fue el sangrado manifiesto. El sexo masculino, la edad mayor a 60 años y la necesidad de internación también fueron predictores independientes.2 En los pacientes con sospecha de HDIM, la VCE mostró un excelente perfil de seguridad, con tasas de retención entre 1,2 y 2,1%, por lo que no es necesaria la implementación de estudios de permeabilidad (entero-imágenes o cápsula de permeabilidad) de forma rutinaria.27
●Enteroscopía asistida por dispositivo: Implica el uso de enteroscopios doble balón (FujiFilm®), simple balón (Olympus®) o en espiral (actualmente fuera del mercado por el alerta de seguridad de su fabricante debido a reportes de efectos adversos severos).28 La EAD permite realizar diagnóstico y tratamiento en el mismo procedimiento, con tasas de estudio completo del ID más bajas que con la VCE.3 La tasa de rédito diagnóstico de la EAD aumenta de 56% a 75% si está precedida por una VCE positiva.29 Sin embargo, se la puede considerar de primera línea para la sospecha de HDIM en pacientes y situaciones seleccionados, como la presencia de sangrado evidente profuso y ante la disponibilidad local de enteroscopio.30,31 La EAD ofrece dos modalidades de abordaje, anterógrada u oral y retrógrada o anal. La vía anterógrada requiere preparación con ayuno de sólidos de 8 a 12 horas y se propone cuando las lesiones se encuentran en los primeros dos tercios del ID, debido a su mayor tasa de inserción en profundidad. La vía retrógrada requiere una preparación para colonoscopía y se propone para las lesiones evidenciadas en el tercio distal del ID. No obstante, es importante resaltar que no se recomienda la evaluación conjunta de ambas vías en una sola sesión. A pesar de su eficacia, la EAD conlleva un riesgo mínimo de complicaciones, de alrededor del 1%, siendo la perforación, el sangrado y la pancreatitis las más frecuentes.3 La pancreatitis se produce en el 0,2 a 0,3% de los pacientes, casi exclusivamente durante la exploración anterógrada. Parece estar relacionada con un daño isquémico o traumático durante las maniobras de push and pull. Respecto a la perforación y el sangrado, son las complicaciones más graves y en general están asociadas a procedimientos terapéuticos, sobre todo a la polipectomía de lesiones grandes.3
●Enteroscopía intraoperatoria: Implica la evaluación del ID durante una laparotomía o laparoscopía. Puede realizarse por vía oral, rectal o mediante una enterotomía, en la que el endoscopio se inserta a través de una incisión quirúrgica del ID.1 Es un método confiable para lograr una evaluación completa del ID con la desventaja de que es altamente invasivo. Sus principales complicaciones incluyen desgarros serosos, avulsión de vasos mesentéricos e íleo prolongado. El rendimiento diagnóstico oscila entre 58 y 88%, con una tasa de resangrado de hasta 60%.32 Esta técnica está reservada para los pacientes con sangrados recurrentes, que requieran múltiples transfusiones y hospitalizaciones, luego de una evaluación integral negativa con VCE y EAD, o para aquellos pacientes en los que no se pueda realizar una EAD sin lisis previa de adherencias.1,3,4
●Estudios por imágenes del intestino delgado: Se utilizan dos modalidades principales: tomografía computada o resonancia magnética.1 Su principal ventaja es que permiten la visualización de las asas intestinales sin superposición y la visualización de estructuras extraluminales. Se utiliza un contraste oral neutro (con densidad similar al agua) para mejorar la detección de sangrado y de anomalías que realzan con el contraste endovenoso.33 La mayoría de las anomalías patológicas del ID que causan sangrado de intestino medio, luego de la administración del contraste endovenoso, serán más brillantes o llamativas con el contraste entérico neutro hipodenso/hipointenso.33
La tomografía computada es de elección debido a su mayor disponibilidad, especialmente en el contexto de la HDIM. En pacientes con sangrado activo es de utilidad la angiotomografía computada.1,3,17 Es frecuente que este grupo de pacientes no se encuentre en condiciones de ingerir contraste vía oral o se presente con inestabilidad hemodinámica. A su vez, en ese contexto, el contraste vía oral puede hacer que el sangrado activo sea más difícil de detectar. En los pacientes estables, por el contrario, son de elección la enterotomografía o la enteroresonancia magnética con contraste entérico que mejoran la detección de masas intraluminales.1,3,17,33
Con respecto a los datos de rendimiento diagnóstico, es importante aclarar que la mayoría de los trabajos publicados se realizan con enterotomografía en pacientes con hemorragia evidente. Por lo tanto, la precisión diagnóstica de las enteroimágenes para la HDIM oculta es escasa.33 Algunos estudios han demostrado que el rendimiento diagnóstico de estas técnicas es superior en pacientes con hemorragia evidente.1,2,3 La sensibilidad y especificidad general del estudio (es decir, sin distinguir entre evidente y oculta) para detectar la etiología de la HDIM son heterogéneas. Un metanálisis demostró una sensibilidad combinada del 73,4% (I2= 80,8%; rango 40 – 100%) y una especificidad del 75,2% (I2= 77,7%; rango, 45,5 – 100%).34 En general, los rendimientos diagnósticos fueron menores en pacientes con hemorragia oculta
(0 – 33%) vs. hemorragia evidente (22,4 – 66,7%).35,36,37 Cuando se compara el rédito diagnóstico de la VCE y la enterotomografía, los resultados son similares. Algunos estudios demostraron que la VCE tiene mayor rédito para lesiones vasculares e inflamatorias mientras que la enterotomografía es mejor para la detección de masas en el ID. En un estudio con 30 enterotomografías negativas, la VCE posterior fue positiva en el 57% de los pacientes.1,39 En otro estudio con 52 VCE no concluyentes, la enterotomografía tuvo un rendimiento positivo en el 50% de los pacientes con HDIM evidente.1,40 Por lo tanto, es importante resaltar que ambos estudios se consideran complementarios entre sí.1,33
●Angiotomografía computada: Permite detectar tasas de sangrado lentas de 0,3 ml/min en comparación con 0,5 a 1 ml/min para la angiografía convencional y 0,2 ml/min para el centellograma con eritrocitos marcados con tecnecio 99.1 Presenta una sensibilidad del 89% y una especificidad del 85% en el diagnóstico de hemorragia digestiva aguda en todo el tracto gastrointestinal.41 Otros estudios han demostrado tasas de sensibilidad del 79% al 94% y una especificidad del 95% al 100%.1, 33,42 Las principales ventajas de esta técnica son su amplia disponibilidad, la rapidez de su realización y su rol en la detección de lesiones en el tubo digestivo. Otra ventaja que presenta este método es que permite orientar el tratamiento posterior. Algunos estudios mostraron que logró una orientación correcta en la EAD en el 100% de los casos.38,43 Sin embargo, esta técnica presenta la limitación de que el paciente debe estar sangrando activamente en el momento del estudio para detectar el sangrado.1,4 En pacientes con angiotomografía negativa, no se recomienda realizar angiografía, por la baja probabilidad de lograr un estudio positivo.1,3,9
●Centellograma con eritrocitos marcados con tecnecio 99: La ventaja de esta técnica es que permite detectar tasas de sangrado más bajas en comparación con la angiografía.44 La detección de sangrado en la angiografía puede mejorar si el paciente presenta un estudio de centellograma previo positivo. La principal limitación de la técnica es la variabilidad en la localización del sangrado y la incapacidad para definir el origen.1,44 Los estudios muestran resultados muy variables, con sensibilidad del 33 al 93%, especificidad del 30 al 95%, rendimiento diagnóstico del 26 al 87% y precisión en la localización del sangrado del 19 al 100% para todo el tracto gastrointestinal.1,33,44 Es importante destacar su rol en los pacientes jóvenes con hemorragia digestiva evidente continua y evaluación negativa con VCE y enteroimágenes, con sospecha de divertículo de Meckel.1,3,4
●Angiografía: La principal ventaja de este método es su capacidad para realizar una intervención terapéutica con embolización transarterial en el momento del estudio.1,33 Sus limitaciones son: el requerimiento de tasas altas de sangrado (0,5 – 1ml/min) y el riesgo de complicaciones (insuficiencia renal, eventos tromboembólicos, infecciones, sangrados del catéter), que ocurren hasta en el 10% de los pacientes.1,33 La inestabilidad hemodinámica es un predictor de angiografía positiva, con aumento del rédito diagnóstico al 87% en pacientes con hemorragias gastrointestinales masivas.1,4
Tratamiento
El tratamiento de la HDIM dependerá de su etiología. Siendo las lesiones vasculares la etiología más frecuente, en esta revisión se abordarán las opciones de tratamiento disponibles para esta patología. Quedarán fuera del alcance de este artículo el tratamiento de las lesiones secundarias a enfermedad de Crohn, síndrome de poliposis y neoplasias del intestino delgado.
Tratamiento de las lesiones vasculares en intestino delgado
Las angioectasias son capilares dilatados, venosos o arteriales, ubicados a nivel de la mucosa gastrointestinal, responsables de hasta el 60% de las HDIM.45
Las opciones de tratamiento disponibles se dividen en endoscópicas, farmacológicas y quirúrgicas. La primera línea de tratamiento consiste en la terapia endoscópica con argón plasma, con una respuesta clínica que puede alcanzar el 90%. Sin embargo, se ha observado que las tasas de resangrado son elevadas, superando el 50% en el seguimiento a largo plazo entre 12 y 24 meses.45 Los principales factores de riesgo asociados a la recurrencia incluyen el número de lesiones vasculares, la edad mayor a 65 años, la presencia de lesiones yeyunales, la presencia de enfermedad valvular cardíaca, la enfermedad renal crónica, el uso de medicamentos anticoagulantes y la necesidad de transfusiones.1
Dentro de las opciones de tratamiento farmacológico podemos encontrar:
●Análogos de la somatostatina: Han demostrado ser eficaces en el tratamiento de la HDIM secundaria a angioectasias. Los principales mecanismos de acción por los que se cree que actúan en la reducción del sangrado incluyen la agregación plaquetaria, la disminución de la circulación esplácnica, la disminución de la expresión del factor de crecimiento endotelial vascular y la inhibición de la angiogénesis. En un estudio realizado por Zammit y col. se comparó el tratamiento endoscópico con el tratamiento combinado (endoscópico y lanreótido), demostrando mejores resultados en el segundo grupo, con un perfil de seguridad satisfactorio.46 Goltstein y col. observaron que el 83% de 212 pacientes presentaron buena respuesta a los análogos de la somatostatina, definida como la reducción de al menos el 50% de las transfusiones.45 El 18% de los casos desarrollaron efectos adversos, siendo la mayoría de ellos gastrointestinales (diarrea, flatulencias, dolor abdominal, náuseas, coledocolitiasis, litiasis vesicular).45 Sólo se requirió suspender el tratamiento en el 5% de los pacientes, por lo que sugieren que son fármacos seguros y efectivos en la mayoría de los pacientes con hemorragia digestiva secundaria a angioectasias.45 Estos fármacos fueron más efectivos en los pacientes con angioectasias localizadas en ID y colon, en comparación con aquellas de localización gástrica. Además, el octreótido demostró ser más efectivo que el lanreótido.45 En nuestro país, la presentación de octreótido de liberación prolongada de 20 mg está disponible para su uso clínico.
●Talidomida: Es un inhibidor de la angiogénesis que representa una alternativa para el tratamiento de pacientes con lesiones vasculares en ID refractarias al tratamiento endoscópico con argón plasma. Aunque ha demostrado reducir hasta un 82% el número de transfusiones al año de tratamiento, hasta el 70% de los pacientes presentaron efectos adversos.47 Entre los efectos adversos más frecuentes se encuentran: constipación, somnolencia, fatiga y neuropatía periférica. Esta última puede afectar hasta el 80% de los pacientes después de los 6 meses de tratamiento.48
●Anticuerpos anti-factor de crecimiento endotelial vascular (Bevacizumab): Su uso está recomendado en los pacientes con sangrado secundario al síndrome de telangiectasia hemorrágica hereditaria (Rendu-Osler).49 Aunque existen reportes de casos en la literatura de su uso en sangrados secundarios a otras patologías, su utilización no está estandarizada.50
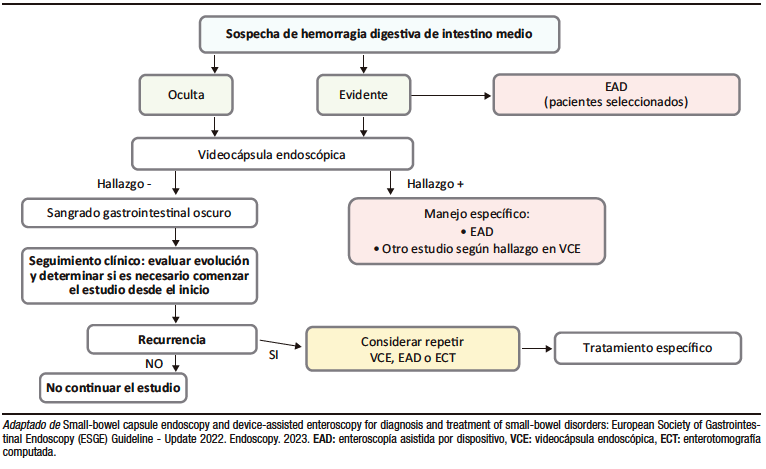
Figura 1. Algoritmo de abordaje de la sospecha de hemorragia de intestino medio
Conclusión
El abordaje de la HDIM requiere de un enfoque multidisciplinario y personalizado, teniendo en cuenta la complejidad de la enfermedad y las características individuales de cada paciente. A pesar de los avances significativos logrados en las últimas décadas, aún se requieren más investigaciones para profundizar la comprensión y el tratamiento de esta patología, con el objetivo último de mejorar los resultados clínicos y la calidad de vida de los pacientes afectados.
Propiedad intelectual. Los autores declaran que los datos, las tablas y las figuras presentes en el manuscrito son veraces. Asimismo, solicitaron autorización y dieron reconocimiento al autor original de la Figura 1.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2024 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Giraudo F y Garbi M L. Conceptos actuales y abordaje de la hemorragia digestiva de intestino medio. Acta Gastroenterol Latinoam. 2024;54(1):31-39. https://doi.org/10.52787/agl.v54i1.396
Referencias
- Gerson LB, Fidler JL, Cave DR, Leighton JA. ACG Clinical Guideline: Diagnosis and Management of Small Bowel Bleeding. Am J Gastroenterol. 2015;110(9):1265-1288.
- Vlachogiannakos J, Papaxoinis K, Viazis N, Kegioglou A, Binas I, Karamanolis D, Ladas SD. Bleeding lesions within reach of conventional endoscopy in capsule endoscopy examinations for obscure gastrointestinal bleeding: is repeating endoscopy economically feasible? Dig Dis Sci. 2011;56(6):1763-8.
- Pennazio M, Cortegoso Valdivia P, Triantafyllou K, Gralnek IM. Diagnosis and management of small-bowel bleeding. Best Pract Res Clin Gastroenterol. 2023;64-65:101844.
- Pennazio M, Rondonotti E, Despott EJ, Dray X, Keuchel M, Moreels T, Sanders DS, Spada C, Carretero C, Cortegoso Valdivia P, Elli L, Fuccio L, Gonzalez Suarez B, Koulaouzidis A, Kunovsky L, McNamara D, Neumann H, Perez-Cuadrado-Martinez E, Perez-Cuadrado-Robles E, Piccirelli S, Rosa B, Saurin JC, Sidhu R, Tacheci I, Vlachou E, Triantafyllou K. Small-bowel capsule endoscopy and device-assisted enteroscopy for diagnosis and treatment of small-bowel disorders: European Society of Gastrointestinal Endoscopy (ESGE) Guideline – Update 2022. Endoscopy. 2023;55(1):58-95.
- Pennazio M, Santucci R, Rondonotti E, Abbiati C, Beccari G, Rossini FP, De Franchis R. Outcome of patients with obscure gastrointestinal bleeding after capsule endoscopy: report of 100 consecutive cases. Gastroenterology. 2004;126(3):643-53.
- Mitsui K, Tanaka S, Yamamoto H, Kobayashi T, Ehara A, Yano T, Goto H, Nakase H, Tanaka S, Matsui T, Iida M, Sugano K, Sakamoto C. Role of double-balloon endoscopy in the diagnosis of small-bowel tumors: the first Japanese multicenter study. Gastrointest Endosc. 2009;70(3):498-504.
- Norton ID, Petersen BT, Sorbi D, Balm RK, Alexander GL, Gostout CJ. Management and long-term prognosis of Dieulafoy lesion. Gastrointest Endosc. 1999;50(6):762-767.
- Mylonaki M, Fritscher-Ravens A, Swain P. Wireless capsule endoscopy: a comparison with push enteroscopy in patients with gastroscopy and colonoscopy negative gastrointestinal bleeding. Gut. 2003;52(8):1122-1126.
- Zaman A, Katon RM. Push enteroscopy for obscure gastrointestinal bleeding yields a high incidence of proximal lesions within reach of a standard endoscope. Gastrointest Endosc. 1998;47(5):372-376.
- Descamps C, Schmit A, Van Gossum A. «Missed» upper gastrointestinal tract lesions may explain «occult» bleeding. Endoscopy. 1999;31(6):452-455.
- Tang SJ, Christodoulou D, Zanati S, Dubcenco E, Petroniene R, Cirocco M, Kandel G, Haber GB, Kortan P, Marcon NE. Wireless capsule endoscopy for obscure gastrointestinal bleeding: a single-centre, one-year experience. Can J Gastroenterol. 2004;18(9):559-65.
- Gilbert D, O’Malley S, Selby W. Are repeat upper gastrointestinal endoscopy and colonoscopy necessary within six months of capsule endoscopy in patients with obscure gastrointestinal bleeding? J Gastroenterol Hepatol. 2008;23(12):1806-1809.
- Kuo JR, Pasha SF, Leighton JA. The Clinician’s Guide to Suspected Small Bowel Bleeding. Am J Gastroenterol. 2019;114 (4):591-598.
- Ben Soussan E, Antonietti M, Hervé S, Savoye G, Ramirez S, Lecleire S, Ducrotté P, Lerebours E. Diagnostic yield and therapeutic implications of capsule endoscopy in obscure gastrointestinal bleeding. Gastroenterol Clin Biol. 2004;28(11):1068-73.
- Estévez E, González-Conde B, Vázquez-Iglesias JL, de Los Ángeles Vázquez-Millán M, Pértega S, Alonso PA, Clofent J, Santos E, Ulla JL, Sánchez E. Diagnostic yield and clinical outcomes after capsule endoscopy in 100 consecutive patients with obscure gastrointestinal bleeding. Eur J Gastroenterol Hepatol. 2006;18(8):881-8.
- Lai LH, Wong GL, Chow DK, Lau JY, Sung JJ, Leung WK. Long-term follow-up of patients with obscure gastrointestinal bleeding after negative capsule endoscopy. Am J Gastroenterol. 2006;101(6):1224-1228.
- Pennazio M, Spada C, Eliakim R, Keuchel M, May A, Mulder CJ, Rondonotti E, Adler SN, Albert J, Baltes P, Barbaro F, Cellier C, Charton JP, Delvaux M, Despott EJ, Domagk D, Klein A, McAlindon M, Rosa B, Rowse G, Sanders DS, Saurin JC, Sidhu R, Dumonceau JM, Hassan C, Gralnek IM. Small-bowel capsule endoscopy and device-assisted enteroscopy for diagnosis and treatment of small-bowel disorders: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy. 2015;47(4):352-76.
- Chao CC, Mo LR, Hu SC. The Optimal Timing for Using Capsule Endoscopy for Patients with Gastrointestinal Bleeding. Biomed Res Int. 2021;27;2021:7605324.
- Kim SH, Keum B, Chun HJ, Yoo IK, Lee JM, Lee JS, Nam SJ, Choi HS, Kim ES, Seo YS, Jeen YT, Lee HS, Um SH, Kim CD. Efficacy and implications of a 48-h cutoff for video capsule endoscopy application in overt obscure gastrointestinal bleeding. Endosc Int Open. 2015;3(4):E334-8.
- Yamada A, Watabe H, Kobayashi Y, Yamaji Y, Yoshida H, Koike K. Timing of capsule endoscopy influences the diagnosis and outcome in obscure-overt gastrointestinal bleeding. Hepatogastroenterology. 2012;59(115):676-679.
- Lepileur L, Dray X, Antonietti M, Iwanicki-Caron I, Grigioni S, Chaput U, Di-Fiore A, Alhameedi R, Marteau P, Ducrotté P, Lecleire S. Factors associated with diagnosis of obscure gastrointestinal bleeding by video capsule enteroscopy. Clin Gastroenterol Hepatol. 2012;10(12):1376-80.
- Xie X, Xiao YF, Zhao XY, Li JJ, Yang QQ, Peng X, Nie XB, Zhou JY, Zhao YB, Yang H, Liu X, Liu E, Chen YY, Zhou YY, Fan CQ, Bai JY, Lin H, Koulaouzidis A, Yang SM. Development and Validation of an Artificial Intelligence Model for Small Bowel Capsule Endoscopy Video Review. JAMA Netw Open. 2022;1;5(7):e2221992.
- Elli L, Scaramella L, Tontini GE, Topa M, Conte D, Sidhu R, Rondonotti E, Penagini R, Vecchi M. Clinical impact of videocapsule and double balloon enteroscopy on small bowel bleeding: Results from a large monocentric cohort in the last 19 years. Dig Liver Dis. 2022;54(2):251-257.
- Tziortziotis I, Laskaratos FM, Coda S. Role of Artificial Intelligence in Video Capsule Endoscopy. Diagnostics (Basel). 2021;11(7):1192.
- Bresci G, Parisi G, Bertoni M, Tumino E, Capria A. The role of video capsule endoscopy for evaluating obscure gastrointestinal bleeding: usefulness of early use. J Gastroenterol. 2005;40(3):256-259.
- Carey EJ, Leighton JA, Heigh RI, Shiff AD, Sharma VK, Post JK, Fleischer DE. A single-center experience of 260 consecutive patients undergoing capsule endoscopy for obscure gastrointestinal bleeding. Am J Gastroenterol. 2007;102(1):89-95.
- Pennazio M. Capsule endoscopy: where are we after 6 years of clinical use? Dig Liver Dis 2006;38:867-78.
- Yamamoto H, Despott EJ, González-Suárez B, Pennazio M, Mönkemüller K. The evolving role of device-assisted enteroscopy: The state of the art as of August 2023. Best Pract Res Clin Gastroenterol. 2023;64-65:101858.
- Teshima CW, Kuipers EJ, van Zanten SV, Mensink PB. Double balloon enteroscopy and capsule endoscopy for obscure gastrointestinal bleeding: an updated meta-analysis. J Gastroenterol Hepatol. 2011;26(5):796-801.
- Elli L, Scaramella L, Tontini GE, Topa M, Conte D, Sidhu R, Rondonotti E, Penagini R, Vecchi M. Clinical impact of videocapsule and double balloon enteroscopy on small bowel bleeding: Results from a large monocentric cohort in the last 19 years. Dig Liver Dis. 2022;54(2):251-257.
- Estevinho MM, Pinho R, Fernandes C, Rodrigues A, Ponte A, Gomes AC, Afecto E, Correia J, Carvalho J. Diagnostic and therapeutic yields of early capsule endoscopy and device-assisted enteroscopy in the setting of overt GI bleeding: a systematic review with meta-analysis. Gastrointest Endosc. 2022;95(4):610-625.e9.
- Bonnet S, Douard R, Malamut G, Cellier C, Wind P. Intraoperative enteroscopy in the management of obscure gastrointestinal bleeding. Dig Liver Dis. 2013;45(4):277-84.
- Sengupta N, Kastenberg DM, Bruining DH, Latorre M, Leighton JA, Brook OR, Wells ML, Guglielmo FF, Naringrekar HV, Gee MS, Soto JA, Park SH, Yoo DC, Ramalingam V, Huete A, Khandelwal A, Gupta A, Allen BC, Anderson MA, Dane BR, Sokhandon F, Grand DJ, Tse JR, Fidler JL. The Role of Imaging for GI Bleeding: ACG and SAR Consensus Recommendations. Radiology. 2024;
310(3):e232298. - He B, Yang J, Xiao J, Gu J, Chen F, Wang L, Qian J, Gong S. Accuracy of Computed Tomographic Enterography for Obscure Gastrointestinal Bleeding: A Diagnostic Meta-analysis. Acad Radiol. 2018;25(2):196-201.
- Law R, Varayil JE, WongKeeSong LM, Fidler J, Fletcher JG, Barlow J, Alexander J, Rajan E, Hansel S, Becker B, Larson JJ, Enders FT, Bruining DH, Coelho-Prabhu N. Assessment of multi-modality evaluations of obscure gastrointestinal bleeding. World J Gastroenterol. 2017;28;23(4):614-621.
- Agrawal JR, Travis AC, Mortele KJ, Silverman SG, Maurer R, Reddy SI, Saltzman JR. Diagnostic yield of dual-phase computed tomography enterography in patients with obscure gastrointestinal bleeding and a non-diagnostic capsule endoscopy. J Gastroenterol Hepatol. 2012;27(4):751-9.
- Sodhi JS, Zargar SA, Rashid W, Shaheen F, Singh M, Javid G, Ali S, Khan BA, Yattoo GN, Shah A, Gulzar GM, Khan MA, Ahmad Z. 64-section multiphase CT enterography as a diagnostic tool in the evaluation of obscure gastrointestinal bleeding. Indian J Gastroenterol. 2012;31(2):61-8.
- Chen YY, Yang CW, Liu CK, Soon MS. Clinical impact of multidetector computed tomography before double-balloon enteroscopy for obscure gastrointestinal bleeding. World J Gastroenterol. 2012 Feb 21;18(7):692-7.
- Heo HM, Park CH, Lim JS, Lee JH, Kim BK, Cheon JH, Kim TI, Kim WH, Hong SP. The role of capsule endoscopy after negative CT enterography in patients with obscure gastrointestinal bleeding. Eur Radiol. 2012;22(6):1159-66.
- Agrawal JR, Travis AC, Mortele KJ, Silverman SG, Maurer R, Reddy SI, Saltzman JR. Diagnostic yield of dual-phase computed tomography enterography in patients with obscure gastrointestinal bleeding and a non-diagnostic capsule endoscopy. J Gastroenterol Hepatol. 2012 Ghobrial IM, Rajkumar SV. Management of thalidomide toxicity. J Support Oncol. 2003;1(3):194-205.
- Wu LM, Xu JR, Yin Y, Qu XH. Usefulness of CT angiography in diagnosing acute gastrointestinal bleeding: a meta-analysis. World J Gastroenterol. 2010;16(31):3957-63.
- Yoon W, Jeong YY, Shin SS, Lim HS, Song SG, Jang NG, Kim JK, Kang HK. Acute massive gastrointestinal bleeding: detection and localization with arterial phase multi-detector row helical CT. Radiology. 2006;239(1):160-7.
- Al-Samkari H, Kasthuri RS, Parambil JG, Albitar HA, Almodallal YA, Vázquez C, Serra MM, Dupuis-Girod S, Wilsen CB, McWilliams JP, Fountain EH, Gossage JR, Weiss CR, Latif MA, Issachar A, Mei-Zahav M, Meek ME, Conrad M, Rodriguez-Lopez J, Kuter DJ, Iyer VN. An international, multicenter study of intravenous bevacizumab for bleeding in hereditary hemorrhagic telangiectasia: the InHIBIT-Bleed study. Haematologica. 2021;106(8):2161-2169.
- Howarth DM, Tang K, Lees W. The clinical utility of nuclear medicine imaging for the detection of occult gastrointestinal haemorrhage. Nucl Med Commun. 2002;23(6):591-4
- Goltstein LCMJ, Grooteman KV, Rocco A, Holleran G, Frago S, Salgueiro PS, Aparicio T, Scaglione G, Chetcuti Zammit S, Prados-Manzano R, Benamouzig R, Nardone G, McNamara D, Benallaoua M, Michopoulos S, Sidhu R, Kievit W, Drenth JPH, van Geenen EJM. Effectiveness and predictors of response to somatostatin analogues in patients with gastrointestinal angiodysplasias: a systematic review and individual patient data meta-analysis. Lancet Gastroenterol Hepatol. 2021;6(11):922-932.
- Chetcuti Zammit S, Sidhu R, Sanders D. Refractory Anaemia Secondary to Small Bowel Angioectasias – Comparison between Endotherapy Alone versus Combination with Somatostatin Analogues. J Gastrointestin Liver Dis. 2017;26(4):369-374.
- Ge ZZ, Chen HM, Gao YJ, Liu WZ, Xu CH, Tan HH, Chen HY, Wei W, Fang JY, Xiao SD. Efficacy of thalidomide for refractory gastrointestinal bleeding from vascular malformation. Gastroenterology. 2011;141(5):1629-37.
- Ghobrial IM, Rajkumar SV. Management of thalidomide toxicity. J Support Oncol. 2003;1(3):194-205.
- Al-Samkari H, Kasthuri RS, Parambil JG, Albitar HA, Almodallal YA, Vázquez C, Serra MM, Dupuis-Girod S, Wilsen CB, McWilliams JP, Fountain EH, Gossage JR, Weiss CR, Latif MA, Issachar A, Mei-Zahav M, Meek ME, Conrad M, Rodriguez-Lopez J, Kuter DJ, Iyer VN. An international, multicenter study of intravenous bevacizumab for bleeding in hereditary hemorrhagic telangiectasia: the InHIBIT-Bleed study. Haematologica. 2021;106(8):2161-2169.
- Virk ZM, Song AB, Badran YR, Al-Samkari H. Systemic bevacizumab as salvage therapy for persistent severe bleeding and anemia in heyde syndrome following aortic valve replacement. J Thromb Thrombolysis. 2022;54(2):255-259.
Correspondencia: María Laura Garbi
Correo electrónico: lauragarbi83@hotmail.com
Acta Gastroenterol Latinoam 2024;54(1):31-39
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE