Marcelo Corti,1, 2 Jorge Correa,1, 2 María F. Villafañe,1, 2 Ana Campitelli,3 Elisa Gancedo,4 Claudio Petraroia,4 Mariana Rizzolo5
1División de VIH/SIDA, Hospital de Infecciosas «Francisco Javier Muñiz».
2Departamento de Medicina, Orientación Enfermedades Infecciosas, Facultad de Medicina, Universidad de Buenos Aires.
3Laboratorio de Histopatología, Hospital de Infecciosas «Francisco Javier Muñiz».
4Servicio de Imágenes, Hospital de Infecciosas «Francisco Javier Muñiz».
5Laboratorio de Anatomía Patológica, Hospital de Gastroenterología «Dr. Carlos Bonorino Udaondo».
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2019;49(4):356-361
Recibido: 01/02/2018 / Aprobado: 28/01/2019 / Publicado en www.actagastro.org el 17/12/2019
Resumen
La reactivación de la infección por citomegalovirus puede resultar en una enfermedad gastrointestinal de evolución aguda y grave. El citomegalovirus es la infección oportunista más frecuente del tracto gastrointestinal en pacientes con sida, y se manifiesta con lesiones erosivas y ulcerativas, a menudo acompañadas de complicaciones como perforación o hemorragia. En contraste con el esófago y el colon, el compromiso del estómago asociado a enfermedades marcadoras del sida es menos frecuente. La histoplasmosis es la micosis endémica más común en individuos infectados con VIH, y la infección diseminada ocurre con mayor frecuencia que en individuos inmunocompetentes. Existe un amplio rango de manifestaciones clínicas. El tracto gastrointestinal está involucrado en hasta el 90% de los casos de histoplasmosis diseminada; sin embargo, el compromiso gástrico es poco usual. Los procedimientos diagnósticos deberían incluir estudios microbiológicos e histológicos de biopsias realizadas por endoscopias digestivas altas. Se presenta un caso inusual de pseudotumor gástrico causado por citomegalovirus e Histoplasma capsulatum en un paciente con diagnóstico reciente de VIH/sida.
Palabras claves. Pseudotumor gástrico, citomegalovirus, Histoplasma capsulatum, VIH/sida.
Gastric involvement by cytomegalovirus and Histoplasma capsulatum with pseudo neoplastic appearance. Case report and literature review
Summary
The reactivation of human Cytomegalovirus in aids patients can result in an acute and severe gastrointestinal disease. Cytomegalovirus being the most important opportunistic infection in the gastrointestinal tract in symptomatic aids patients is correlated with erosive and ulcerative lesions, often accompanied by complications like perforation or bleeding. In contrast to the esophagus and colon, the stomach is a less common site for the occurrence of primary opportunistic infections in aids. Histoplasmosis is an endemic mycosis with a high prevalence in HIV/aids patients. Clinical presentation included a wide spectrum of clinical manifestations. Disseminated infection occurs more frequently than in immunecompetent individuals. The gastrointestinal tract is involved in up to 90% cases of disseminated histoplasmosis; however, specific gastric features are uncommon. Diagnostic procedures should include microbiological and histological investigations of biopsies looking for opportunistic infections or tumors. We present an unusual case of gastric pseudotumor caused by cytomegalovirus and Histoplasma capsulatum in an HIV/aids recent diagnosis patient.
Key words. Gastric pseudotumor, cytomegalovirus, Histoplasma capsulatum, HIV/aids.
Abreviaturas
TARGA: Terapia antirretroviral de gran actividad.
CMV: Citomegalovirus.
VIH: Virus de la inmunodeficiencia humana.
SNC: Sistema nervioso central.
VEDA: Videoendoscopía digestiva alta.
Las infecciones oportunistas son una causa importante y frecuente de morbimortalidad en pacientes con sida, especialmente en aquellos individuos que no reciben terapia antirretroviral de gran actividad (TARGA), los que desconocen su condición de infectados por el retrovirus o aquellos que no tienen buena adherencia a la TARGA.1 En algunos casos representan la primera manifestación de la inmunodeficiencia que permite sospechar el diagnóstico de infección por el retrovirus.
La histoplasmosis es una micosis de distribución universal, pero con neto predominio en los continentes americano y africano. En América, las zonas de mayor endemia se sitúan a lo largo de los valles de los ríos Mississippi, Missouri y Ohio en los EE.UU., en la Serra do Mar en Brasil y, en el cono sur, en la cuenca del Río de la Plata. En la República Argentina, su área de distribución es amplia y abarca tanto zonas rurales como urbanas.2 Se adquiere por la inhalación de esporas presentes en el suelo, especialmente en aquellas tierras ricas en sustancias orgánicas que contienen deyecciones de murciélagos y aves. Tiene una patogenia similar a la de la tuberculosis; o sea, primoinfección asintomática en la gran mayoría de casos (excepto exposiciones a grandes inóculos) y enfermedad con manifestaciones principalmente respiratorias.3
El citomegalovirus (CMV) pertenece a la familia herpesviridae, y como todos los integrantes de esta familia produce primoinfecciones agudas, sintomáticas o no, seguidas de infecciones latentes que pueden reactivarse en sujetos inmunocomprometidos. En los pacientes infectados por el virus de la inmunodeficiencia humana (VIH), la reactivación de los herpesvirus es una causa importante de morbimortalidad, debido a la frecuencia de formas diseminadas graves con compromiso visceral. Estas formas diseminadas graves se asocian con compromiso cutáneo, visceral y del sistema nervioso central (SNC) y periférico.4
Caso clínico
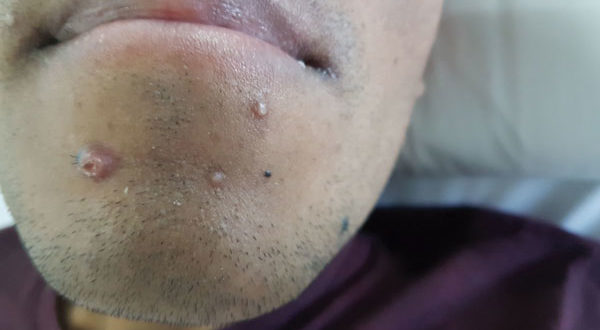
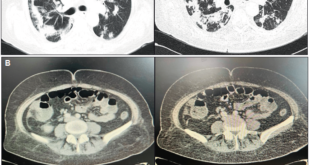
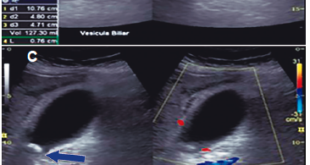
Paciente de 30 años que consulta por intolerancia a alimentos sólidos y líquidos, pirosis, sialorrea, sudoración nocturna y diarrea de 3 meses de evolución. Al examen físico presentaba lesiones papulosas con umbilicación central a nivel del mentón (Figura 1) y úlceras perirrectales. La palpación abdominal mostró dolor epigástrico con moderada defensa parietal. En el Hospital de Gastroenterología se le realiza una videoendoscopía digestiva alta (VEDA) que informa esofagitis candidiásica grado III y engrosamiento de los pliegues de la región subcardial, techo y cuerpo gástricos hasta el sector distal con ulceraciones de forma irregular y pliegues distorsionados con múltiples sufusiones hemorrágicas suprayacentes. Se toman múltiples muestras de biopsias y es derivado al hospital de referencia en Enfermedades Infecciosas del GCABA “F. J. Muñiz”, donde se interna en la Unidad 10 de la División de VIH/sida. Los estudios de laboratorio de ingreso confirmaron el diagnóstico de retrovirus positivo con carga viral de 356.000 copias/mL (5,6 log10) y recuento de linfocitos T CD4+ de 16 cel/uL (2%). La escarificación de las pápulas del rostro mostró levaduras compatibles con Histoplasma capsulatum. La biopsia de las lesiones perirrectales también mostró la presencia de levaduras compatibles con Histoplasma capsulatum. El examen de fondo oscuro de las mismas fue negativo. Los hemocultivos resultaron positivos para Histoplasma capsulatum y fueron negativos para bacterias comunes y micobacterias. La antigenemia pp65 fue negativa. Las serologías para chagas, toxoplasmosis y hepatitis C fueron negativas, en tanto, el HBsAg y el HBcAc resultaron positivos. La ecografía abdominal mostró: hígado normal, esplenomegalia (122 mm), y adenopatías hipoecoicas en retroperitoneo. El estómago presentaba paredes engrosadas con pérdida de la estratificación normal y peristaltismo conservado (Figura 2). El epiplón periantral se hallaba engrosado e hiperecogénico (Figura 3). La tomografía computada de abdomen mostró hallazgos similares con engrosamiento de la pared gástrica a nivel del antro y disminución de la luz a ese nivel (Figura 4). El examen histopatológico de la biopsia de estómago reveló mucosa gástrica erosionada y ulcerada, con tejido de granulación y trombos vasculares fibrinoides y con la presencia de cuerpos de inclusión intracitoplasmáticos característicos de infección por CMV (Figura 5).
Figura 1. Lesiones papulosas localizadas en el mentón correspondientes a histoplasmosis diseminada.
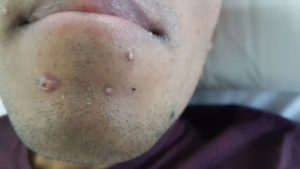
Figura 2. Ecografía abdominal que muestra el engrosamiento de la pared gástrica.
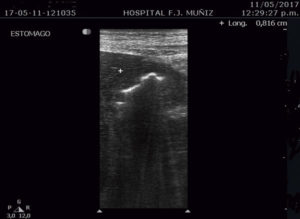
Figura 3. Ecografía abdominal con engrosamiento del epiplón periantral.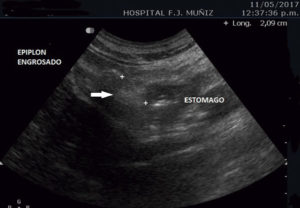
Figura 4. TC en la que se observa el engrosamiento de la pared gástrica a nivel del antro con disminución de la luz a ese nivel.
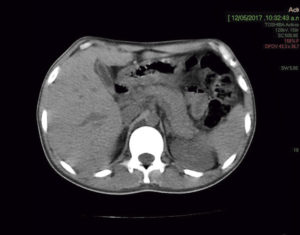
Figura 5. Biopsia gástrica (H/E) con la presencia de cuerpos de inclusión intracitoplasmáticos característicos de la infección por CMV. A nivel de la lámina propia y en sectores epiteliales se evidencia la presencia de elementos puntiformes intracelulares que se identificaron como estructuras compatibles con Histoplasma.
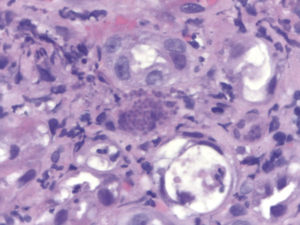
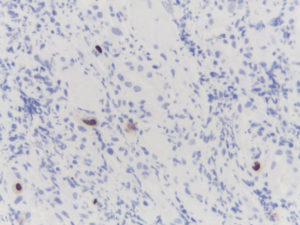
A nivel de la lámina propia y en sectores epiteliales se evidencia la presencia de elementos puntiformes intracelulares, que con la tinción de Grocott se identificaron como estructuras compatibles con Histoplasma capsulatum. Con técnica de inmunohistoquímica se observan inclusiones virales de CMV (Figura 6). Se indica tratamiento con fluconazol para la candidiasis esofágica (dosis de 400 mg/día por vía IV), con mejoría luego de 14 días de tratamiento, y con foscarnet y ganciclovir para el CMV durante 21 días (tratamiento de inducción). Luego se indicó anfotericina B hasta una dosis total acumulada de 525 mg, con mejoría sintomática y resolución de lesiones del rostro y perianales. Se realizaron nuevas imágenes de control que demostraron una muy buena respuesta de las lesiones que comprometían la pared gástrica. Se inició además TARGA en base a emtricitabina 200 mg/día, tenofovir disoproxil fumarato 300 mg/día y raltegravir 400 mg cada 12 horas. El paciente se externa en buena condición clínica y continúa los controles y la profilaxis secundaria en forma ambulatoria.
Figura 6. IHQ positiva para CMV.
Discusión
A nivel del tubo digestivo, la reactivación de CMV en pacientes con enfermedad VIH/sida consiste en úlceras cutáneo-mucosas que se localizan por lo general en la región genital, perianal y en la mucosa oral y esofágica. El CMV también puede asociarse con el desarrollo de úlceras intestinales que se acompañan de dolor abdominal y proctorragia.
Hay pocos casos descriptos en la literatura médica de CMV como causa de un pseudotumor o tumor inflamatorio gástrico o de oclusión intestinal.5, 6 El sarcoma de Kaposi y los linfomas no Hodgkin son las dos causas más comunes de tumores gástricos en pacientes con sida.
El CMV es la causa más frecuente de úlceras gastroduodenales en esta población de pacientes.7 En cambio, el H. pylori se asocia con mucha menor frecuencia con estas lesiones, en comparación con la población general.8 Probablemente, el sobredesarrollo de microorganismos oportunistas inhibe el crecimiento del H. pylori en la mucosa gástrica.9 Si bien el CMV se presenta como el agente etiológico más común de lesiones ulcerosas gastroduodenales, el compromiso del estómago bajo la forma clínico/patológica de un pseudotumor es rara y puede simular una neoplasia gástrica.10 Mohan y col.5 describen cinco casos de infección por CMV como causa de pseudotumores gástricos en pacientes con sida, en tres de ellos bajo la presentación clínica de síndrome pilórico por estenosis. Posteriormente, Kelesidis y col.11 describen un caso de reactivación de la infección crónica por CMV como causa de pseudotumor duodenal, y agregan 14 casos más de tumores inflamatorios por este agente en diferentes niveles del tubo digestivo.
Las úlceras causadas por CMV se asocian, en su patogenia, a vasculitis con la consiguiente isquemia de la mucosa, que es causada por la colonización de las células endoteliales de los pequeños vasos por este virus. Sin embargo, la patogenia del engrosamiento de la mucosa y la formación de pseudotumores no es bien conocida. Se postula que, cuando se produce la infección por CMV en las células epiteliales o del estroma, se gatillan diversas vías que estimulan la proliferación celular, llevando a la hiperplasia foveolar con el consiguiente engrosamiento de la mucosa. Cuando la infección por CMV es de larga data, estas modificaciones se transforman en masas grandes e irregulares que simulan tumores, y que han sido descriptas por diferentes autores como lesiones de apariencia pseudotumoral.12
La identificación de CMV como causa de compromiso aislado del estómago es muy infrecuente.13 La forma clínica habitual de presentación es la enfermedad ulcerosa con fiebre, disfagia, dolor epigástrico, vómitos y hemorragia digestiva alta.9 La VEDA puede evidenciar diversos tipos de lesiones desde eritema, edema, erosiones, exfoliación de la mucosa hasta múltiples úlceras o erosiones e hipertrofia de los pliegues gástricos. Eventualmente pueden observarse pacientes que desarrollan una gran respuesta inflamatoria lo que da origen a formas pseudotumorales, como en el paciente que se presenta.14 La confirmación diagnóstica requiere la toma de múltiples muestras de biopsias para reconocer los efectos citopáticos característicos de CMV en lesiones gastrointestinales de pacientes inmunocomprometidos, especialmente aquellos con enfermedad VIH/sida avanzada y efectuar la PCR para poner de manifiesto la presencia del genoma viral.15
Una forma rara de presentación de la enfermedad gástrica por CMV en pacientes VIH positivos es la perforación gástrica con abdomen agudo y neumoperitoneo.16, 17 Recientemente se ha descrito la hemorragia digestiva baja como forma de presentación clínica de la enfermedad por CMV con lesiones ulcerosas en intestino delgado.18 Diversos autores han llamado la atención sobre el hecho de que la infección del tracto digestivo por CMV puede provocar la aparición de lesiones macroscópicas de apariencia neoplásica que, en la mayoría de casos, obligan al tratamiento combinado, médico y quirúrgico.14 Adicionalmente a la inusual asociación de CMV e Histoplasma como causa de un pseudotumor gástrico, el paciente que se describe respondió de manera favorable al tratamiento médico específico para ambas enfermedades oportunistas que comprometieron la pared gástrica.
Desde el punto de vista de los hallazgos endoscópicos puede observarse eritema, compromiso inflamatorio parcelar, erosiones o úlceras múltiples de distinto tamaño, incluso que simulan un proceso maligno.19
En relación con el hallazgo de Histoplasma en el estudio histopatológico, es importante recordar que Histoplasma capsulatum se identifica en el tracto gastrointestinal en el 70-90% de las autopsias de pacientes con diagnóstico de histoplasmosis diseminada.20 A pesar de que el compromiso gastrointestinal es común, las manifestaciones gastrointestinales se detectan solo en el 3% al 12% de los pacientes.20 La afectación gástrica en la histoplasmosis diseminada es rara, y ocurre como entidad aislada en solo un 4% de casos en series de auptosias.21Los síntomas más frecuentes son la diarrea, la fiebre, el dolor abdominal y la pérdida de peso, síntomas inespecíficos que hacen que el diagnóstico de histoplasmosis gastrointestinal no sea sospechado, particularmente en áreas no endémicas.20, 21 En muchos pacientes no resulta claro si estos síntomas pueden responder únicamente a la histoplasmosis o a otras enfermedades concomitantes, como en el caso que se describe.20, 22
En una amplia búsqueda bibliográfica que incluyó las principales bases de datos biomédicas (Pub Med, Scopus, Index Copernicus y Scielo), solo encontramos un caso de enfermedad por CMV e histoplasmosis como causa de coinfección, pero con afectación del intestino delgado.18
En conclusión, la infección del tracto digestivo por CMV puede provocar la aparición de lesiones macroscópicas de apariencia neoplásica. Estas pueden consistir en úlceras de localización atípica, de gran tamaño o con bordes sobreelevados, engrosamiento de pliegues gástricos, masas pseudotumorales o imágenes de tipo linitis plástica.23, 24 Es importante resaltar la necesidad de efectuar varias tomas de biopsia para aumentar el rédito de este método de diagnóstico, ya que las lesiones pueden presentarse en parches.
Referencias
- CDC: Revision of case definition at acquired immunodeficiency syndrome for national reporting in the United States. MMWR 1985; 34: 373-375.
- Corti M, Negroni R, Esquivel P, Villafañe MF. Histoplasmosis diseminada en pacientes con sida: análisis epidemiológico, clínico, microbiológico e inmunológico de 26 pacientes. Enf Emerg 2004; 6: 8-15.
- Negroni R. Histoplasmosis. En: Palmieri OJ, Corti M, Laube G, Negroni R. Enfermedades Infecciosas. Buenos Aires, 2009: 575-579.
- Villafañe MF, Corti M. Citomegalovirus. En: Corti M. Clínica y tratamiento de la enfermedad HIV/sida. 3° Ed. Buenos Aires 2017; capítulo 19: 129-134.
- Mohan H, Bal A, Garg S, Dalal U. Cytomegalovirus-associated psudotumor simulating gastric malignancy in acquired immunodeficiency syndrome: a case report with review of the literature. Jpn J Infect Dis 2007; 60: 134-136.
- Boteon YL, Alves IP, da Silva AP, Tercioti Junior V, Coelho Neto Jde S, Lopes LR, et al. Obstructive gastric pseudotumor caused by cytomegalovirus in an AIDS patient: A case report and review of surgical treatment. Am J Case Rep 2015; 16: 536-541.
- Vachon GC, Brown BS, Kim C, Chessin LN. CMV gastric ulcer as the presenting manifestation of AIDS. Am J Gastroenterol 1995; 90: 319-321.
- Chiu HM, Wu MS, Hung CC, Shun CT, Lin JT. Low prevalence of Helicobacter pylori but high prevalence of cytomegalovirus-associated peptic ulcer disease in AIDS patients: Comparative study of symptomatic subjects evaluated by endoscopy and CD4 counts. J Gastroenterol Hepatol 2004; 4: 423-428.
- Varsky CG, Correa MC, Sarmiento N, Bonfanti M, Peluffo G, Dutack A, Maciel O, Capece P, Valentinuzzi G, Weinstock D. Prevalence and etiology of gastroduodenal ulcer in HIV-positive-patients: A comparative study of 497 symptomatic subjects evaluated by endoscopy. Am J Gastroenterol 1998; 93: 395-340.
- Cullen MH, Stansfeld AG. Cytomegalovirus-associated gastric ulcer simulating malignancy. Postgrad Med J 1979; 55: 210-211.
- Kelesidis T, Tozzi S, Mitty R, Worthington M, Fleisher J. Cytomegalovirus pseudotumor of the duodenum in a patient with AIDS: anunrecognized and potentially treatable clinical entity. Int J Infect Dis 2010; 14: e274-e282.
- Reggiani Bonetti L, Losi L, Di Gregorio C, Bertani A, Merighi A, Bettelli S, Scuri M, Maiorana A. Cytomegalovirus infection of the upper gastrointestinal tract: a clinical and pathological study of 30 cases. Scand J Gastroenterol 2011; 46: 1228-1235.
- Murray RN, Parker A, Kadakia SC, Ayala E, Martínez EM. Cytomegalovirus in upper gastrointestinal ulcers. J Clin Gastroenterol 1994; 19: 198-201.
- Iwamuro M, Kondo E, Tanaka T, Hagiya H, Kawano S, Kawahara S, Otsuk F, Okada H. Endoscopic Manifestations and Clinical Characteristics of Cytomegalovirus Infection in the Upper Gastrointestinal tract. Acta Med Okayama 2017; 71: 97-104.
- Gupta T, Agarwal D, Mandot A, Desai D, Joshi A, Abraham Ph. Cytomegalovirus involving gastric antrum in immunocompromised hosts: a report of 5 cases. Indian Journal of Gastroenterology 2005; 24: 258-260.
- Kaplan CS, Petersen EA, Icenogle TB, Copeland JG, Villar HV, Sampliner R, et al. Gastrointestinal cytomegalovirus infection in heart and heart-lung transplant recipients. Arch Intern Med 1989; 149: 2095-2100.
- M´garbane B, Résiere D, Ferrand J, Raskine L, Vahedi K, Baud F. Difficulties in assessing cytomegalovirus-associated gastric perforation in an HIV-infected patient. BMC Infect Dis 2005; 5: 28-31.
- Bruno MA, Parodi M, Olmedo I, Picón Molina H, Palencia R, Doniquian A. Massive gastrointestinal bleeding in AIDS patients secondary to histoplasma and cytomegalovirus infection. Int J Surg Case Reports 2016; 25: 128-131.
- Coma MJ, Fachal C, Ojeda C, Carretero L. Solitary gastric ulcer due to cytomegalovirus: a cause of acute digestive hemorrhage. Rev Esp Enferm Dig 1991; 79: 43-45.
- Suh KN, Anekthananon T, Mariuz PR. Gastrointestinal histoplasmosis in patients with AIDS: case report and review. Clin Infect Dis 2001; 32: 483-491.
- Kahi CJ, Wheat LJ, Allen SD, Sarosi GA. Gastrointestinal histoplasmosis. Am J Gastroenterol 2005; 100: 220-231.
- Hernández-Rosa MR, Navarro-López V, Ruiz-Maciá JA, Corti M. Varón de 34 años con diarrea y epigastralgia. Enferm Infecc Microbiol Clin 2008; 26: 117-118.
- Rich JD, Crawford JM, Kazanjian SN, Kazanjian PH. Discrete gastrointestinal mass lesions caused by cytomegalovirus in patients with AIDS: report of three cases and review. Clin Infetc Dis 1992; 15: 609-614.
- Alta G, Turnage R, Eckhauser FF. A submucosal antral mass caused by cytomegalovirus infection in a patient with the acquired immunodeficiency syndrome. Am J Gastroenterol 1986; 81: 714-717.
Correspondencia: Marcelo Corti
Puan 381, 2º Piso (C.P.: 1406). Ciudad Autónoma de Buenos Aires, Argentina.
Correo electrónico: marcelocorti@fibertel.com.ar
Acta Gastroenterol Latinoam 2019;49(4):356-361
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE