Julieta Argüero1 ID· Daniel Sifrim2 ID
1 Sección Neurogastroenterología. Servicio de Gastroenterología. Hospital Italiano de Buenos Aires. Buenos Aires, Argentina.
2 Unidad de Fisiología Gastrointestinal. Barts and The London School of Medicine and Dentistry, Queen Mary University of London. Londres, Reino Unido.
Acta Gastroenterol Latinoam 2022;52(2):135-152
Recibido: 11/05/2022 / Aceptado: 13/06/2022 / Publicado online el 27/06/2022 / https://doi.org/10.52787/agl.v52i2.212
Resumen
La fisiopatología de la enfermedad por reflujo gastroesofágico es multifactorial. Los eventos involucrados se inician en el estómago y, en forma ascendente, afectan la unión gastroesofágica y el esófago. Las características del material refluido impactarán en la magnitud del daño mucoso y en la percepción sintomática. Existen mecanismos defensivos y factores agresores, que son determinantes de la enfermedad. La intensidad con la que se perciben los síntomas es variable en cada individuo y está determinada por una combinación de mecanismos modulados por el sistema nervioso central y periférico, y factores psicológicos como la hipervigilancia. Las alteraciones en el aclaramiento esofágico junto con el tipo de material refluido probablemente sean los mayores determinantes para el desarrollo de una enfermedad de tipo erosiva, mientras que la sensibilidad de la mucosa lo sea para la percepción sintomática. El desarrollo de la enfermedad por reflujo gastroesofágico es el producto de un desbalance entre los factores mencionados anteriormente. Entender cuál es el mecanismo fisiopatológico predominante permite ofrecer al paciente el mejor tratamiento disponible.
Palabras claves. Enfermedad por reflujo gastroesofágico, unión gastroesofágica, esfínter esofágico inferior, mucosa esofágica, percepción sintomática.
Update on the Physiopathology of Gastroesophageal Reflux Disease
Summary
The pathophysiology of gastroesophageal reflux disease is multifactorial. The events involved begin in the stomach and, ascending, affect the gastroesophageal junction and the esophagus. The characteristics of the refluxed material will impact the magnitude of the mucosal damage and the symptomatic perception. There are defensive mechanisms and aggressor factors, which are determinants of the disease. The intensity with which symptoms are perceived is variable in each individual and is determined by a combination of mechanisms modulated by the central and peripheral nervous system, and psychological factors such as hypervigilance. Alterations in esophageal clearance together with the type of refluxed material are probably the major determinants of an erosive reflux disease, while mucosal sensitivity is for symptomatic perception. The development of gastroesophageal reflux disease is the product of an imbalance between the factors mentioned above. Understanding the predominant pathophysiological mechanism allows us to offer the patient the best available treatment.
Keywords. Gastroesophageal reflux disease, gastroesophageal junction, lower esophageal sphincter, esophageal mucosa, symptomatic perception.
Abreviaturas
ERGE: Enfermedad por reflujo gastroesofágico.
ERNE: Enfermedad por reflujo gastroesofágico no erosiva.
CD: Crura diafragmática.
UGE: Unión gastroesofágica.
EEI: Esfínter esofágico inferior.
RT-EII: Relajaciones transitorias del esfínter esofágico inferior.
RDGE: Reflujo biliar o duodeno-gastro-esofágico.
Introducción
La fisiopatología de la enfermedad por reflujo gastroesofágico (ERGE) es multifactorial. Los eventos involucrados se inician en el estómago y, en forma ascendente, afectan la unión gastroesofágica y el esófago. Las características del material refluido, en términos físico-químicos y de volumen, impactarán en la magnitud del daño mucoso y en la percepción sintomática. Mecanismos defensivos como la peristalsis esofágica primaria y secundaria, así como la capacidad neutralizante de la saliva, son determinantes del tiempo durante el cual el contenido refluido permanecerá en contacto con la mucosa esofágica.1 Por otra parte, la integridad estructural de esta, ya sea macro o microscópica, juega un rol crítico para determinar la perpetuación del daño y la intensidad de la percepción sintomática. La intensidad con la que se perciben los síntomas es variable en cada individuo y está determinada por una combinación de mecanismos modulados por el sistema nervioso central y periférico, y factores psicológicos como la hipervigilancia. Las alteraciones en el depuramiento esofágico junto con el tipo de material refluido probablemente sean los mayores determinantes para el desarrollo de una enfermedad de tipo erosiva, mientras que la sensibilidad de la mucosa lo sea para la percepción sintomática.2
El desarrollo de la ERGE es el producto de un desbalance entre los factores mencionados anteriormente. Entender cuál es el mecanismo fisiopatológico predominante permite ofrecer al paciente el mejor tratamiento disponible.
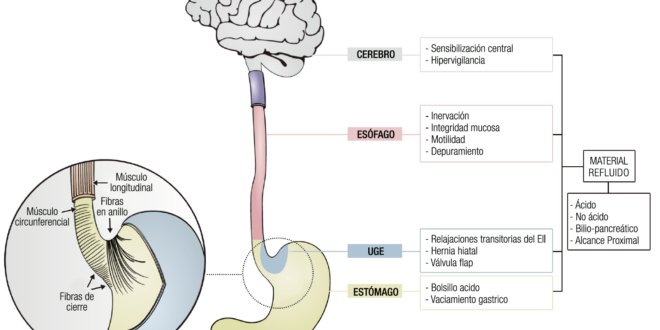
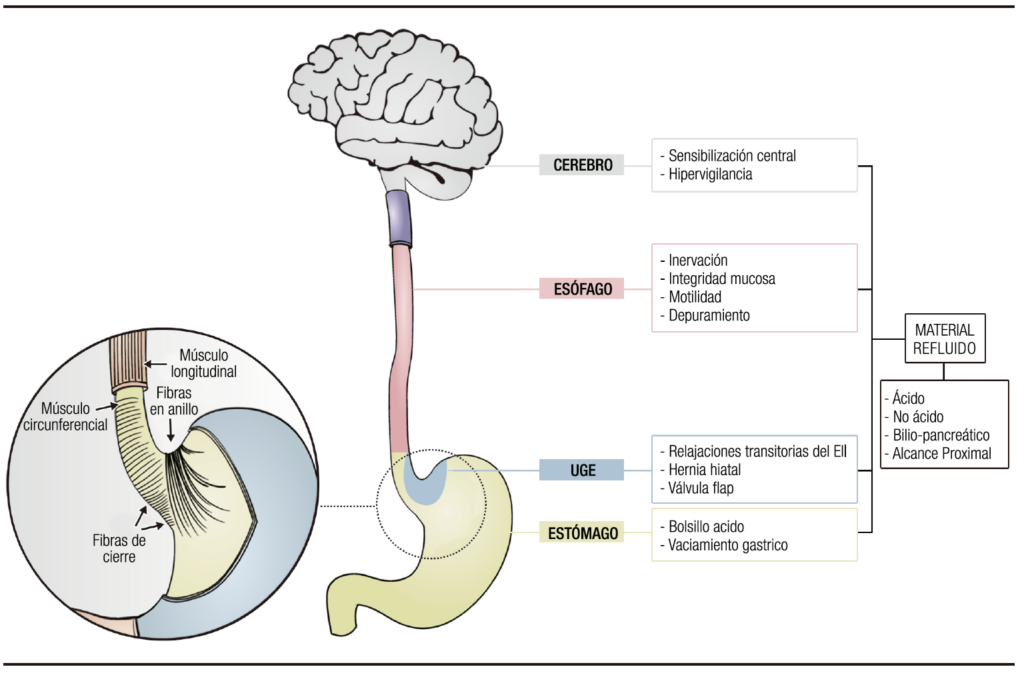
El objetivo de esta revisión, es describir en forma detallada los mecanismos fisiopatológicos involucrados en la ERGE (Figura 1). Para ello, haremos hincapié en los factores que mencionamos en el siguiente esquema, por considerarlos determinantes de esta entidad.
Figura 1. Principales mecanismos fisiopatológicos de la enfermedad por reflujo gastroesfágica.
Factores gástricos
La mayor parte de los pacientes con enfermedad por reflujo gastroesofágico no tienen un aumento significativo en el volumen de secreción ácida.3 Algunos de ellos pueden tener un aumento de la secreción basal de ácido4 o de aquella inducida por alimentos. Quizás, más importante que la secreción total de ácido secretada por el estómago, lo sea su localización en relación con la unión esófago-gástrica.5
Luego de la ingesta, la acidez gástrica es alcalinizada por los alimentos, lo cual genera una variabilidad del pH en las distintas áreas del estómago.6 Sin embargo, en un monitoreo de pH esófago-gástrico de 24 horas, el pH del contenido refluido mostró ser menor que el pH medido en la luz del cuerpo gástrico.7 En estudios realizados por Fletcher y col., se midió el pH intragástrico desde las áreas distales hasta las proximales y se demostró la presencia de un área de mayor acidez a nivel de la unión gastroesofágica (UGE) en la mayoría de los sujetos estudiados.8 Esta área escaparía de la amortiguación realizada por los alimentos y se denomina bolsillo ácido.8,9 Este “bolsillo” tiene una extensión de 2-3 cm e involucra al cardias y la unión escamo-columnar. Otros estudios con monitoreo prolongado a través de la cápsula inalámbrica, en combinación con centellografía o resonancia magnética, han confirmado estos hallazgos en pacientes con ERGE y han caracterizado el “bolsillo ácido” así como su relación con el reflujo ácido.10 En personas con ERGE, la magnitud de este bolsillo es mayor en comparación con controles sanos y llega a extenderse 6 cm por encima de la unión escamo-columnar en pacientes con hernias hiatales grandes.11,12 En un estudio en el que se compararon las características de este segmento en controles sanos vs. personas con ERGE, se mostró que, en los primeros, dicho segmento se encuentra contenido en sentido distal a la unión escamo-columnar. En cambio, en personas con reflujo, este segmento se extendió a través del cambio mucoso, inclusive por encima de este. Como esto ocurre aún con presiones normales del esfínter esofágico inferior (EEI), se ha propuesto que es más apropiado el término film más que “bolsillo”. Este concepto ayuda a explicar la propensión que posee la mucosa del esófago distal a las lesiones por reflujo.11 Beaumont y col. demostraron que, en los pacientes con hernias hiatales, el “bolsillo ácido” está más frecuentemente localizado dentro del saco herniario o sobre el diafragma. Esta posición supradiafragmática predispone la ocurrencia de reflujos ácidos durante las relajaciones transitorias del esfínter esofágico inferior.13 Además, ha sido descrita la presencia de un “bolsillo biliar” alrededor de la unión gastroesofágica que, junto con el “bolsillo ácido”, contribuiría a la ocurrencia de reflujos, particularmente en los períodos posprandiales.14
Solo un 30% de los pacientes con ERGE tiene un vaciamiento gástrico alterado. Aún no ha sido claramente demostrado si existe una correlación lineal entre el retraso en el vaciamiento y la severidad del reflujo.13,15 Sin embargo, un vaciamiento gástrico retardado podría ser relevante en los episodios de reflujo que ocurren en el periodo posprandial. Cuando el vaciamiento gástrico está retardado, los episodios de reflujo tienen una mayor extensión proximal. Ha sido descrita la alteración en la acomodación gástrica ante la llegada de alimento y una relajación prolongada del fundus en pacientes con ERGE.16,17 Ambos fenómenos podrían influir en el volumen del contenido y en la presión fúndica posprandial, e incidir en la tasa de relajaciones transitorias del EEI (RT-EEI) inducidas por este mecanismo.18
Unión gastroesofágica
La unión gastroesofágica es una estructura anatómica compleja que constituye una unidad funcional al actuar como barrera antirreflujo. Está formado por una zona de alta presión localizada entre el estómago y el esófago, compuesta fundamentalmente por el EEI, la crura diafragmática (CD) y la válvula “flap”, un entrecruzamiento de estructuras formado por el ligamento freno esofágico y fibras anulares del cardias gástrico. Su rol es crucial en la fisiopatología de la ERGE.19
Existen tres mecanismos principales, que involucran la unión gastroesofágica, en la fisiopatología del reflujo: las RT-EEI, la presión disminuida en forma basal del EEI o la presencia de alguna alteración anatómica a nivel del UGE como, por ejemplo, una hernia hiatal por deslizamiento. En pacientes con otros factores predisponentes, como enfermedades del tejido conectivo o luego de una miotomía por acalasia, el reflujo puede ocurrir sin cambios en las presiones gástricas o del EII.20
Relajaciones transitorias del esfínter esofágico inferior
Las RT-EEI son relajaciones no inducidas por degluciones; por lo tanto, no están asociadas con una onda peristáltica. Están asociadas a la inhibición de la contracción del diafragma y a un acortamiento significativo del cuerpo esofágico, debido a la contracción de la capa muscular longitudinal de este órgano. Esta contracción puede contribuir con la apertura del EEI y predisponer a un episodio de reflujo. Se caracterizan por persistir durante más tiempo (> 10 segundos) en comparación con aquellas inducidas por degluciones.21 Este fenómeno ocurre, en proporciones similares, tanto en personas con ERGE como en sujetos sanos. La mayoría de ellas se concentran en las primeras dos horas después de la ingesta. Sin embargo, en los sujetos sanos, solo el 30% se asocian a episodios de reflujo ácido, en comparación con los pacientes con ERGE, en quienes esta asociación ocurre en el 65% de los casos.21,22 Estudios con manometría esofágica ambulatoria prolongada han mostrado que la mayoría de los episodios de reflujo en personas sanas y con esofagitis leves ocurren en el contexto de RT-EEI.23 En los casos de esofagitis severas y hernias hiatales, si bien se observan reflujos durante las RT-EEI, una mayor proporción de los episodios se presentan asociados a presiones basales bajas del EII y a relajaciones inducidas por degluciones.20
Durante una RT-EEI no se observa reflujo en forma continua, lo que indica que debe haber otro mecanismo involucrado. En un 15-20% de los casos se observó un aumento de la presión intraabdominal. Las maniobras de esfuerzo incrementan la probabilidad de ocurrencia de un reflujo durante una RT-EEI, pero su prevalencia no es mayor en los pacientes con ERGE.24,25
El principal gatillo para que ocurra una RT-EEI es la distensión gástrica, inducida generalmente por los alimentos. Esto genera un estímulo aferente al sistema nervioso central que induce a una descarga vagal eferente, con la consecuente liberación de óxido nítrico, el principal neurotransmisor encargado de la relación del EEI. Mittal y cols. sugirieron que las neuronas motoras a nivel de la unión gastroesofágica serían sensibles a estímulos mecánicos locales, dando como resultado también la liberación de óxido nítrico al ser estimuladas. Según este grupo, una secuencia posible de eventos durante una RT-EEI podría involucrar una contracción fuerte del músculo longitudinal del esófago, con el consecuente acortamiento, que provocaría un movimiento axial y estiramiento neuronal del plexo mientérico del EEI.26
Presión basal del esfínter esofágico inferior
El EEI, constituido por músculo liso, posee una presión basal que varía a lo largo del día. Es mayor en posición supina y se produce una relajación significativa en los períodos posprandiales. También varía según la etapa del complejo motor migratorio, dado que aumenta durante la fase 3 de dicho complejo. La presión basal puede verse afectada por la presión intraabdominal, la distensión gástrica y la concentración de péptidos, hormonas, alimentos y ciertos medicamentos. Los pacientes con ERGE tienen una presión basal media del EEI más baja que los controles sanos, aún cuando esta se encuentra dentro del rango de normalidad (10-20 mmHg). Un subgrupo de pacientes, en general con lesiones erosivas en la mucosa esofágica, suelen tener presiones aún más bajas, por debajo de 10 mmHg.27
Estructura de la unión gastroesofágica y sus alteraciones
En condiciones normales, el EEI y la CD se encuentran superpuestos. Registros de electromiografía permiten distinguir la contribución que cada una de estas estructuras ejerce de manera individual a la barrera antirreflujo. Durante un ciclo respiratorio normal, el gradiente de presión entre el estómago y el esófago cambia durante la inspiración y la espiración. Durante la espiración, la presión aumenta levemente en el esófago y prácticamente no varía en el estómago. Por lo tanto, aunque el gradiente sea bajo, la presión del EEI es suficiente para evitar un episodio de reflujo. Durante la inspiración, sin embargo, la presión intragástrica aumenta y la presión intraesofágica disminuye. En consecuencia, el gradiente es mayor y la presión del EEI debe aumentar para evitar un episodio de reflujo. Durante una inspiración profunda, durante una maniobra de esfuerzo o durante un episodio de tos, el gradiente entre el estómago y el esófago puede aumentar hasta 100 mmHg. Normalmente, en esta situación no suele haber reflujo, gracias a una contracción potente de la CD, que induce un aumento de presión de la CD de hasta 150 mmHg.28 Bajo situaciones de presiones bajas del EEI, por ejemplo, durante el consumo de fármacos anticolinérgicos o durante una RT-EEI, el reflujo gastroesofágico ocurre solo si la actividad de la CD se encuentra inhibida.29
La parte más distal de la barrera antirreflujo depende de un pliegue a nivel gástrico, llamado válvula flap, formado por la oposición de fibras anulares y de cierre de nivel del cardias. El ligamento freno-esofágico y las fibras anulares gástricas contribuyen a mantener la posición del EEI al mismo nivel que el CD.29,30 Es importante la evaluación, a través de la clasificación de Hill, del fondo gástrico y de la unión gastroesofágica durante una videoendoscopía digestiva alta, en retroversoflexión. Esta clasificación permite realizar una descripción objetiva, que facilita la compresión y otorga calidad a un informe endoscópico. Establece cuatro categorías: tipo I (normal), pliegue cerrado alrededor del endoscopio con 3-4 cm de extensión hacia la curvatura menor; tipo II, pliegue menos marcado que durante la inspiración que permite la formación de un espacio entre este y el endoscopio; tipo III, no existe prácticamente pliegue y se observa la presencia constante de un espacio entre este y el endoscopio, cuyo calibre es mayor que el del instrumento; tipo IV (hernia hiatal), espacio entre el endoscopio y la impresión hiatal que no permite la identificación de la válvula.31
Una hernia hiatal es una separación entre el EEI y la CD, que predispone a la ocurrencia de reflujo por debilitar la barrera gastroesofágica. La CD sufre un desplazamiento axial y una disrupción radial por la atrofia, secundaria a la dilatación del hiato. Las hernias de mayor tamaño (> 2 cm) causan un ensanchamiento del hiato esofágico que altera la función de esfínter de la CD.32 La contracción de la CD durante la inspiración, en los pacientes con hernias, genera una compartimentalización del estómago, entre el EEI y el diafragma, que aumenta la probabilidad de que se produzca un episodio de reflujo. Este mecanismo es más claro en los pacientes que tienen un bolsillo ácido dentro de la hernia. Una disminución de la presión en el EEI facilita el ascenso del contenido herniario al esófago. Además, la motilidad del cuerpo del esófago, así como la capacidad de depuramiento, se encuentran alteradas en pacientes con hernias hiatales no reductibles.33
El vaciamiento y depuramiento esofágico pueden verse afectados por una hernia de hiato. Estudios con gammagrafía, radiología y pH-impedanciometría describieron un fenómeno denominado re-reflujo, que está dado por el reflujo de líquido dentro del saco herniario que se produce durante una deglución. Esto es particularmente importante en los pacientes con hernias irreductibles.34,35
Los factores que incrementan la presión intraabdominal son predisponentes para alterar la estructura de la UGE. La obesidad, por ejemplo, es uno de los factores de riesgo más importantes para padecer ERGE y sus complicaciones.36 El índice cintura-cadera es más importante que el índice de masa corporal para estimar el riesgo.19
Tono del cuerpo esofágico
Si bien el cuerpo esofágico no forma parte de la unión gastroesofágica, su correcta motilidad contribuye a la barrera antirreflujo. Cualquiera sea el mecanismo por el cual el material gástrico atraviesa esta estructura, tiene que vencer la fuerza de gravedad, así como la resistencia que oponga el cuerpo del esófago. En estudios realizados con baróstatos, se ha demostrado la presencia de un tono basal colinérgico33,37 que se encuentra francamente alterado en los pacientes con esofagitis severas y aperistalsis. Durante una RT-EEI, no solo se relaja el EEI, sino también el cuerpo esofágico.33,37,38
En sujetos sanos, no hay inhibición o, incluso, hay contracción del cuerpo esofágico luego de un episodio de reflujo ácido, que probablemente prevenga que el bolo ácido ascienda. En pacientes con ERGE, la entrada de ácido al esófago suele inhibir la motilidad del cuerpo esofágico.39
Estos hallazgos sugieren que el tono del cuerpo esofágico puede jugar un rol importante como mecanismo antirreflujo e influenciar en el alcance proximal de este.40
Material refluido
El material refluido contiene agentes que pueden ser nocivos para la mucosa esofágica. Es producido fundamentalmente en el estómago; en consecuencia, está compuesto principalmente por ácido clorhídrico y pepsina. Sin embargo, puede contener además ácidos biliares y enzimas pancreáticas, que se entremezclan con el jugo gástrico principalmente por la noche y en los períodos posprandiales, como producto del reflujo transpilórico. El contenido que alcanza el esófago puede ser ácido (pH < 4), débilmente ácido (pH 4-6) o no ácido (pH > 6). Además, su consistencia puede ser líquida o una mezcla de gas y líquido.40,41
Reflujo ácido
En comparación con sujetos sanos, los pacientes con ERGE tienen una tasa mayor de reflujo ácido líquido puro. La importancia del reflujo ácido en el desarrollo de la pirosis y la esofagitis no es un punto de discusión. Una mayor exposición del esófago al ácido se correlaciona con la severidad del daño de la mucosa esofágica.42,43 Estudios realizados con pH-metría inalámbrica de 48 horas confirman lo mencionado anteriormente.44 Otros estudios han demostrado correlación entre la severidad de los síntomas y la acidez del contenido refluido. La relación entre el pH y la generación de pirosis fue analizada por Smith y col., que mostraron que un pH por encima de 4 es capaz de producir síntomas en forma más tardía.45
En un estudio con pH-impedanciometría, Bredenoord y col. demostraron que es más probable que se produzca pirosis y regurgitación cuando la caída de pH es prolongada, el contenido refluido llega al esófago proximal y el depuramiento esofágico se encuentra retardado. Una observación importante de este estudio fue que la suma de períodos de exposición al ácido en forma previa produce la sensibilización de la mucosa a una nueva exposición, lo que genera un estado de hipersensibilidad.46
Reflujo no ácido
El advenimiento de la pH-impedanciometría posibilitó diagnosticar y estudiar la fisiopatología del reflujo débilmente ácido y no ácido, el cual está presente en pacientes con ERGE y en sujetos sanos. Este tipo de reflujo no parece estar involucrado en el daño mucoso. La pH-impedanciometría ambulatoria sugiere que los pacientes con esofagitis moderada y severa tienen una tasa de reflujo débilmente ácido similar o levemente superior que los controles sanos. Además, la exposición del esófago distal al reflujo débilmente ácido es similar en pacientes con esofagitis que en pacientes con reflujo gastroesofágico no erosivo.43
El reflujo no ácido puede provocar síntomas, particularmente regurgitación en pacientes con síntomas típicos de reflujo que se encuentran bajo tratamiento con inhibidores de la bomba de protones y, con menos frecuencia, pirosis y dolor de pecho.47 Este tipo de reflujo puede estar asociado también a episodios de microaspiración en pacientes con desórdenes respiratorios, tanto adultos como niños.48-49 Además, el reflujo no ácido es prácticamente el único tipo de reflujo en bebés pequeños con alimentación frecuente.50,51
Reflujo duodeno-gastro-esofágico
El reflujo débilmente ácido no es sinónimo de reflujo biliar o duodeno-gastro-esofágico (RDGE). Estudios con registros simultáneos de pH y espectrofotometría biliar con Bilitec® han mostrado que la mayoría de los eventos de RDGE ocurren en un entorno ácido (pH < 4).52 Es probable que el reflujo biliar represente solo entre el 10-15% del reflujo débilmente ácido y no ácido. Un estudio que usó en forma simultánea Bilitec® e impedanciometría mostró una falta de correlación entre el porcentaje de tiempo de absorción de bilirrubina y los parámetros que indican la presencia de reflujo débilmente ácido y no ácido.53
Estudios con Bilitec® han mostrado un gradiente creciente de reflujo biliar ácido y no ácido en controles sanos, en pacientes con esofagitis, con máximos valores en pacientes con esófago de Barrett.54 La perfusión con soluciones no ácidas, que contienen ácidos biliares, pueden provocar pirosis.55 La exposición de la mucosa del esófago de conejo a soluciones débilmente ácidas que contienen ácidos biliares, situación similar a lo que sucede en los pacientes que consumen IBP, incrementan la permeabilidad de la mucosa y la dilatación de los espacios intercelulares, uno de los mecanismos fisiopatológicos propuestos para explicar la sensación de pirosis.56 Un estudio de Tack y col. sugirió un posible rol del reflujo biliar en pacientes con síntomas refractarios a inhibidores de bomba; sin embargo, otro estudio mostró la presencia de reflujo biliar en un 82% de los respondedores a IBP vs. 67% en los no respondedores, lo que sugiere un BP.28
Reflujo gaseoso
La monitorización del reflujo con pH-impedanciometría permite la detección y el seguimiento del movimiento del gas intraesofágico, tanto en dirección anterógrada como en dirección retrógrada, es decir, durante la aerofagia y los eructos. El reflujo gastroesofágico puede estar asociado a la presencia de gas. El gas en el contenido refluido incrementa la percepción de los episodios de reflujo, particularmente en pacientes con reflujo no erosivo.59 El monitoreo con impedancia ha identificado dos tipos de eructos, supragástricos (ESG) y gástricos (EG).60 En los ESG, el aire entra y sale del esófago rápidamente sin alcanzar el estómago y son detectados frecuentemente en pacientes con síntomas de reflujo,61 y en algunos de estos pacientes están asociados a la aparición de reflujos ácidos.62 Los EG ocurren durante las relajaciones transitorias del esfínter esofágico inferior y están frecuentemente asociados a reflujo de líquidos, de tipo ácido y no ácido. Este tipo de reflujo está aumentado en pacientes con excesiva aerofagia durante las comidas.63
Volumen, extensión proximal y distensión esofágica
El volumen de reflujo puede afectar su distribución dentro de la luz del esófago, así como el grado de distensión de dicho órgano. Hasta el momento, no es posible estimar el volumen de un episodio de reflujo. Sin embargo, la extensión proximal de un episodio de reflujo, que puede evaluarse en un registro de impedanciometría, puede considerarse como un indicador indirecto de este. Estudios de pH-impedanciometría con múltiples sensores han mostrado que los episodios sintomáticos de reflujo están producidos por episodios más prolongados que alcanzan más frecuentemente el esófago proximal, en comparación con los reflujos no asociados a síntomas.68-70 Además, la magnitud de la caída del pH es mayor, el nadir del pH es menor y la depuración del volumen y del ácido son más prolongados en los episodios de reflujo sintomático. Un hecho interesante es que los episodios de reflujo asociados con regurgitación tienen una extensión más proximal que los asociados a pirosis.49
La hipersensibilidad del esófago proximal es más pronunciada en los pacientes con reflujo no erosivo que en los pacientes con esofagitis. La distensión esofágica es un determinante crítico en la percepción sintomática, particularmente en los pacientes con ERGE refractario.71 En un estudio que utilizó pH-impedancia y ultrasonido de alta frecuencia, se comparó la distensión esofágica inducida por reflujo antes y durante el tratamiento con IBP. La supresión ácida no influenció la magnitud de la distensión esofágica inducida por reflujo. Los eventos de reflujo no ácidos, producto del tratamiento con IBP, indujeron un grado de distensión esofágica similar a los eventos de reflujo ácidos previos al tratamiento.72 Estos datos sugieren que los síntomas pueden estar afectados por la distensión esofágica junto con el grado de acidez.
Aclaramiento de volumen
El vaciamiento esofágico luego de un episodio de reflujo se da como consecuencia de la presión de gravedad y de las peristalsis, primaria y secundaria. El efecto de la falta de gravedad cobra mayor importancia en el decúbito supino, en los bebés pequeños y en las personas que requieren estar recostadas por alguna condición particular. Casi el 50% de los pacientes con ERGE tienen el mecanismo de depuramiento de ácido esofágico enlentecido. La efectividad de la onda peristáltica ha demostrado ser crítica en este proceso. La fuerza de contracción mínima efectiva para el aclaramiento esofágico es de aproximadamente 30 mmHg. Por encima de ese umbral, el transporte de líquidos no se ve afectado por la amplitud o la duración de las contracciones.73 Otro factor relevante es la integridad de la secuencia peristáltica. Una onda fragmentada está asociada con un depuramiento del bolo deficitario.74-75 La prevalencia de dismotilidad esofágica va desde un 20% en pacientes con enfermedad por reflujo no erosivo, hasta un 48% en pacientes con esofagitis severa.76-78 Una peristalsis anómala afecta en forma directa el depuramiento esofágico, sobre todo en los períodos en decúbito supino.79
La peristalsis secundaria es aquella que se produce en ausencia de una deglución. Cobra importancia durante el sueño, cuando la tasa de ondas primarias es reducida, y se ve alterada en los pacientes con ERGE, en particular, en respuesta a la distensión esofágica con aire o agua.80
Aún se encuentra bajo debate si la anormalidad en la peristalsis primaria es causa o consecuencia de la injuria producida por el material refluido. Estudios que comparan la peristalsis esofágica y la función del EEI, antes y después de la curación mucosa por una esofagitis, no han podido demostrar una mejoría significativa en la contractilidad luego del tratamiento.81-82
Los eventos de reflujo gastroesofágico son seguidos inmediatamente por un reflejo que desencadena el peristaltismo inducido por deglución y/o una onda peristáltica secundaria. El efecto de aclaramiento de la actividad peristáltica mencionada anteriormente puede medirse como cambios en la impedancia posterior al reflujo. El índice de ondas peristálticas posteriores a unas degluciones después del reflujo, PSPW (del inglés: post-reflux swallow-induced peristaltic wave), ha sido diseñado para evaluar las capacidades de depuramiento esofágico en los distintos fenotipos de ERGE. En pacientes con esofagitis y reflujo no erosivo, el índice PSPW es significativamente más bajo que en sujetos sanos o con pirosis funcional.83-84
Aclaramiento químico
Luego del aclaramiento de volumen dado por una onda peristáltica, la mucosa del esófago distal aún permanece ácida. Se necesitan varios tragos para lograr que el pH supere los 4 puntos. Este proceso, denominado depuramiento químico, está dado por la llegada de la saliva y se debe a la presencia de bicarbonato.85 La llegada de saliva al esófago distal no requiere una peristalsis intacta. Las contracciones faríngeas y del esófago proximal son suficientes para que la saliva alcance el esófago distal, tanto en posición de pie como en decúbito supino.86 La xerostomía crónica y el síndrome de Sjögren, por ejemplo, son condiciones en las que se encuentra alterado el depuramiento químico, y este mecanismo es una de las razones por las que estos pacientes presentan una predisposición a tener esofagitis.87-88 El consumo de ciertos fármacos y la edad avanzada son otras causas frecuentes de xerostomía.89
Aclaramiento esofágico post-reflujo
La duración de la exposición de la mucosa esofágica al reflujo depende de la efectividad de los mecanismos de depuramiento esofágico. Entre ellos, se encuentran la peristalsis, la salivación y la competencia del hiato diafragmático. Un aclaramiento retardado se correlaciona con la severidad de la esofagitis y la presencia de un esófago de Barrett. Este proceso involucra una primera etapa, que sucede en forma inmediata y está dada por la contracción peristáltica del cuerpo esofágico que produce el aclaramiento de la mayor parte del volumen del material refluido; y una segunda etapa, conocida como aclaramiento químico, que está dada por la llegada del bicarbonato de la saliva con los sucesivos tragos.85 Tanto el depuramiento del bolo esofágico como el aclaramiento químico del ácido pueden ser medidos a través de una pH-impedanciometría.90
Factores esofágicos
Una vez que el reflujo alcanza el esófago, si el mecanismo de depuramiento se encuentra alterado, la mucosa esofágica queda expuesta al contenido luminal, compuesto por ácido gástrico, enzimas (gástricas, pancreáticas e intestinales) y ácidos biliares. La duración de la exposición y la indemnidad de los mecanismos defensivos de la mucosa esofágica son determinantes de la severidad del daño. El epitelio escamoso estratificado de la mucosa esofágica forma usualmente uniones estrechas que generan una barrera de protección contra las noxas que se encuentran en el contenido refluido. Cualquier disrupción de esta barrera contribuirá a la aparición de síntomas inducidos por reflujo.
Enfermedad por reflujo erosiva
La esofagitis por reflujo se define como la presencia de erosiones en la mucosa del esófago distal, visibles durante una endoscopía digestiva alta. Históricamente, se ha asumido que las erosiones se producen por una quemadura ácida en la que las células epiteliales escamosas del esófago se dañan por los efectos cáusticos del ácido gástrico refluido. La muerte celular producida por el ácido inicia una respuesta inflamatoria aguda de tipo granulocítica que comienza en el epitelio y progresa hacia la lámina propia, con la consecuente ulceración hacia la submucosa. La pérdida de células de la superficie esofágica estimula la hiperplasia de las células basales, constituyendo un rasgo histológico característico de la ERGE.91
Más recientemente, se ha cuestionado la teoría de la quemadura ácida como causa de la esofagitis. En un estudio sobre progresión histológica de la ERGE en un modelo de rata, se mostró que la esofagitis comienza con la infiltración de linfocitos T en la submucosa, antes de que se produzca la muerte de las células epiteliales. Esta infiltración se extiende luego a la lámina propia y al epitelio del esófago. En estudios in vitro se mostró que el ácido y las sales biliares estimulan la secreción epitelial de citoquinas proinflamatorias como la IL-8. Estos hallazgos sugirieron que el jugo gástrico refluido no genera la muerte de las células en forma directa, sino que las estimula para generar una reacción inflamatoria, quimiotáctica de linfocitos T y de otras células de la inflamación, que finalmente termina dañando la mucosa.92 Un estudio reciente del mismo grupo evaluó esta hipótesis de que la esofagitis por reflujo se desarrolle como una lesión mediada por citoquinas inflamatorias más que por daño directo del ácido. En 12 pacientes con esofagitis por reflujo curados con tratamiento con IBP, se interrumpió el tratamiento, lo que indujo la reaparición de la esofagitis. Se analizó la histología esofágica a las semanas 1 y 2 posteriores a la suspensión del tratamiento y se vio que todos los pacientes habían vuelto a desarrollar esofagitis con una respuesta inflamatoria con linfocitos T predominantemente a nivel de las células basales del epitelio, acompañada de una hiperplasia a dicho nivel en respuesta a la pérdida de las células de las capas más superficiales.91,93 Si bien está demostrado el efecto antiinflamatorio de los IBP, lo mencionado anteriormente podría cambiar el paradigma de tratamiento de la ERGE hacia tratamientos antiinflamatorios más que antiácidos.
Enfermedad por reflujo no erosiva
Los síntomas típicos de reflujo, pirosis y regurgitación pueden ocurrir en presencia o ausencia de daño mucoso. Un 50-70% de los pacientes con ERGE tienen una endoscopía normal, por lo que se los clasifica como una enfermedad por reflujo no erosivo (ERNE).94-95
El consenso de Roma subdivide a los pacientes en esofagitis erosiva, ERNE (mucosa esofágica endoscópicamente normal, con tiempo total de exposición al ácido alterado en la pH-metría), hipersensibilidad al reflujo (mucosa esofágica endoscópicamente normal, con tiempo total de exposición al ácido normal en la pH-metría, pero con asociación sintomática positiva) o pirosis funcional (síntomas asociados a mucosa esofágica endoscópicamente normal, con tiempo total de exposición al ácido normal en la pH-metría, sin asociación sintomática positiva). Todos, salvo la pirosis funcional, se encuentran bajo el espectro de la ERGE, dado que se considera que los síntomas son causados por el material gástrico que refluye hacia el esófago. La ERNE es el fenotipo más frecuente en la práctica clínica y su manejo puede ser más dificultoso que la enfermedad erosiva.95-96
Contrariamente a la apariencia endoscópica normal de la mucosa esofágica en los pacientes con ERNE, se observan alteraciones microscópicas que alteran la integridad de la barrera mucosa. Esto ha sido demostrado en estudios morfológicos y funcionales, que indican una dilatación de los espacios intercelulares evaluados en la anatomía patológica.97 Esta anormalidad histológica no es específica de los pacientes con ERNE, pero está en relación con la exposición de la mucosa esofágica frente al ácido, dado que se resuelve con el tratamiento con IBP.98
Existen estudios funcionales que confirman el deterioro de la integridad de la mucosa esofágica en pacientes con ERNE. Estos estudios se han realizado tanto in vitro -en biopsias esofágicas- como in vivo -a través de la impedancia basal nocturna medida por una pH-impedanciometría-. La impedancia basal es una medida indirecta de la indemnidad mucosa. Se ha demostrado una media de impedancia basal nocturna más baja en los pacientes con ERNE que en los pacientes con pirosis funcional. Además, se observa una mayor sensibilidad al ácido en los pacientes con una impedancia basal más baja. Las mediciones de la resistencia eléctrica transepitelial, una medida de la permeabilidad paracelular a iones, ya sea en secciones de tejidos o en biopsias, es usada para estudiar la función de la barrera esofágica. Cuando la mucosa se encuentra expuesta a soluciones con ácidos gástricos o biliares, la resistencia cae y la magnitud de dicha caída se correlaciona con la presencia de dilataciones intercelulares y con la permeabilidad a moléculas pequeñas, como la fluoresceína.99-100
A nivel molecular, la integridad mucosa depende de complejos de unión apical intacta. Una función correcta de estos complejos previene la difusión del contenido luminal a las células y a través de los espacios intercelulares. Las uniones estrechas y las uniones adherentes son componentes que integran los complejos de unión apicales que están integrados por varias proteínas, tales como: claudinas y ocludinas en las uniones estrechas, y cadherinas en las uniones adherentes. Su correcta función puede reducir en gran medida la difusión de iones para celulares. La alteración en la conformación de alguna de estas proteínas podría estar involucrada en el aumento de permeabilidad de la barrera. Se ha demostrado que existe una mayor permeabilidad en asociación con la escisión de la E-cadherina en pacientes con ERNE.101
Sensibilidad e hipersensibilidad esofágica
Durante el monitoreo del reflujo, la mayoría de los episodios no son percibidos por los pacientes. Existe una variabilidad interpersonal importante en cuanto a la percepción sintomática, lo que sugiere la presencia de diferentes umbrales de sensibilidad esofágica. Algunos pacientes sin ERGE perciben de manera intensa los episodios de reflujo considerados fisiológicos. Esta situación ha sido denominada sensibilidad esofágica al ácido.102
En contraparte, otros pacientes, particularmente aquellos con estenosis péptica o esófago de Barrett, tienen un umbral mayor de sensibilidad esofágica y desarrollan lesiones graves, con síntomas leves o incluso sin síntomas. Los mecanismos que se encuentran detrás de esta variabilidad aún se están estudiando.103
La manifestación de los síntomas es consecuencia de la interacción entre el estímulo esofágico dado por el contenido endoluminal, la activación de nociceptores de fibras aferentes nociceptivas y el procesamiento a nivel central. La instilación de una sustancia ácida en el esófago es capaz de reproducir el síntoma pirosis, al igual que el reflujo. En muchos pacientes hay una relación temporal entre el ácido refluido y la sensación de pirosis. En otros pacientes, sin embargo, la relación temporal no es clara.48
La nocicepción en el aparato digestivo está dada por dos circuitos de inervación extrínsecos y por uno intrínseco. La inervación extrínseca está formada por fibras nerviosas aferentes viscerales vagales y espinales, y ambos tipos tienen terminaciones nerviosas en todas las capas de la pared intestinal. Las neuronas de primer orden hacen sinapsis con las de segundo orden en el asta dorsal de la médula espinal, que ascienden a través de los tractos espino-reticular y espino-talámico hasta los núcleos reticulares y el tálamo. El último tracto transmite la sensación consciente, mientras que el primero activa principalmente respuestas inconscientes a la información sensorial visceral. Se postula que las fibras espinales constituyen el sistema de inervación aferente más importante en la nocicepción visceral.104 Sin embargo, las fibras aferentes vagales proyectadas desde el esófago también tienen su rol, dado que pueden ser excitadas por la presencia de ácido, muy probablemente debido a una acción directa sobre la inervación mucosa.105
Los nervios aferentes vagales y espinales expresan canales de cationes que actúan como sensores de ácido a nivel molecular. Varios receptores pueden modular la sensibilidad al ácido. Los canales iónicos sensibles al ácido ASIC1, ASOC2 y ASIC3 están activados por ácido y, como tales, pueden estar involucrados en la nocicepción durante un evento de reflujo ácido.106
Los receptores vaniloides de potencial receptor transitorio (TRPV, del inglés: transient receptor potential vanilloid receptors) también son receptores para la nocicepción esofágica inducida por ácido. TRVP1 y TRVP4, en particular, son capaces de activarse por una sustancia ácida.107 Además del ácido, el calor y los vaniloides como la capsaicina, también puede excitar receptores TRPV1.106
La activación de PAR2 sensibiliza el cultivo de células humanas de epitelio esofágico en medio ácido, en parte a través de la fosforilación de TRPV1. Esta podría ser una vía a través de la cual la activación de los mastocitos -por la liberación de triptasa activadora de PAR2- o el reflujo duodeno-gastro-esofágico -que contiene tripsina activadora de PAR2–, sensibilizan el esófago al ácido débil.108
La hipersensibilidad esofágica al reflujo puede deberse a una transmisión sensorial excesiva de las vísceras al cerebro (sensibilización periférica), a un procesamiento central aberrante (sensibilización central) o a una combinación de ambos mecanismos. En la sensibilización periférica, existe un umbral reducido y una magnitud exagerada de la respuesta sensorial a un estímulo determinado. Esto generalmente se ve afectado por una lesión e inflamación local. Un ejemplo fácilmente identificable es el aumento de la sensibilidad de la piel en el área que rodea una quemadura. Los mediadores sensibilizantes pueden ser aminas, prostanoides, purinas, proteasas y citoquinas. Estos pueden actuar por activación directa de receptores acoplados a la apertura de canales iónicos en terminales nerviosas aferentes provocando despolarización y activación. La sensibilización periférica puede ser rápida y de corta duración, pero en el caso de una lesión o inflamación prolongada o repetitiva, son los cambios en la expresión genética los que conducen a una sensibilización periférica prolongada. El disparo repetitivo de señales nociceptivas desde la periferia es capaz de alterar la cantidad y el patrón de los neurotransmisores liberados desde las terminales nerviosas sensoriales en la médula espinal y el cerebro y, por lo tanto, alterar el procesamiento central de la información sensorial visceral.109 Tal sensibilización central puede contribuir a la hipersensibilidad visceral en el esófago. También es el mecanismo que se cree que subyace a la hiperalgesia secundaria, un fenómeno por el cual aumenta la capacidad de respuesta a los estímulos distantes del sitio de la lesión o inflamación. De hecho, se ha demostrado que los pacientes con ERNE no solo tienen una mayor sensibilidad del esófago,110 sino también aumento de la sensibilidad somática de la pared torácica. Esto sugiere que es probable que la sensibilización central desempeñe al menos un papel en la mecanosensibilidad al ácido en este subgrupo de pacientes.111
Un componente final del dolor esofágico es a través de la modulación psico-neuro-inmune. Muchos pacientes con pirosis informan que el estrés psicológico empeora sus síntomas. Se sabe que el estrés experimental agudo reduce los umbrales de dolor a la perfusión de ácido esofágico.112 Las comorbilidades psicosociales también determinan la gravedad de los síntomas de la ERGE, así como la respuesta al tratamiento. Los pacientes con ERGE tienen una mayor sensibilidad a la perfusión de ácido después de una noche de privación de sueño.113
Sensibilidad diferencial en esófago distal y proximal
Si bien el esófago proximal no parece verse afectado con frecuencia en la ERGE, cada vez se reconoce más su importancia en la percepción de los síntomas esofágicos en los seres humanos. Hay datos que sugieren que el esófago proximal puede ser incluso más importante para la percepción sintomática que el esófago distal. Podría tratarse de un mecanismo protector para el sistema respiratorio, frente a la presencia de reflujo en el esófago superior. La llegada del material refluido a niveles proximales dispara un reflejo que contrae el esfínter esofágico superior para evitar una eventual bronco aspiración. El esófago proximal es la región más sensible a la distensión mecánica y la sensibilidad disminuye cuanto más distal se encuentre el estímulo.114-115 De manera similar, el esófago proximal es más sensible a la perfusión ácida experimental que el esófago distal.116-117 La relevancia clínica potencial de una sensibilidad diferencial del esófago distal y proximal ha sido destacada en la ERGE por una serie de estudios de fisiología del reflujo. Sabemos que los pacientes con ERGE tienen más eventos de reflujo que llegan al esófago proximal que los sujetos sanos.49
Más interesante aún es el hecho de que es más probable que los pacientes perciban un evento de reflujo no ácido si llega al esófago proximal cuando están en terapia con IBP.70,118
Inervación de la mucosa esofágica
Un estudio reciente describió la distribución de los nervios aferentes de la mucosa esofágica en sujetos sanos. Se evaluó la presencia y ubicación de las fibras nerviosas que reaccionaron con un anticuerpo marcado contra el péptido relacionado con el gen de la calcitonina (CGRP), un marcador de los nervios sensoriales nociceptivos. En el esófago distal, las fibras nerviosas se localizan predominantemente en lo profundo del epitelio. Por el contrario, la inervación de la mucosa esofágica proximal parece estar concentrada superficialmente, es decir, cerca de la superficie luminal. Se postula que esta es la razón subyacente a la mayor sensibilidad del esófago proximal al ácido, lo que tal vez contribuya a los mecanismos reflejos protectores contra la aspiración traqueal del reflujo proximal.119
En otro estudio, se comparó la distribución de las fibras nerviosas de la mucosa en pacientes con ERNE, reflujo erosivo y esófago de Barrett, respecto de la de sujetos sanos. La mucosa esofágica proximal y distal de los pacientes con ERNE tiene nervios aferentes más superficiales en comparación con los controles o los pacientes con enfermedad erosiva o Barrett. La hipersensibilidad ácida en pacientes con ERNE podría explicarse parcialmente por la mayor proximidad de sus nervios aferentes a la luz esofágica y, por lo tanto, una mayor exposición a sustancias nocivas en el reflujo.119-121
Relevancia de la hipersensibilidad esofágica en la enfermedad por reflujo refractaria
La hipersensibilidad esofágica se considera un factor fisiopatológico importante en pacientes con síntomas persistentes a pesar de un tratamiento adecuado con IBP.122
Se ha demostrado la combinación de hipersensibilidad del esófago proximal a estímulos mecánicos y un mayor número de eventos de reflujo proximal en pacientes con síntomas persistentes a pesar de la terapia con IBP. La distensión esofágica proximal puede ocurrir en caso de reflujo débilmente ácido que contiene gas. Los pacientes refractarios a los IBP pueden ser hipersensibles a diferentes estímulos, es decir, térmicos, mecánicos y eléctricos.71
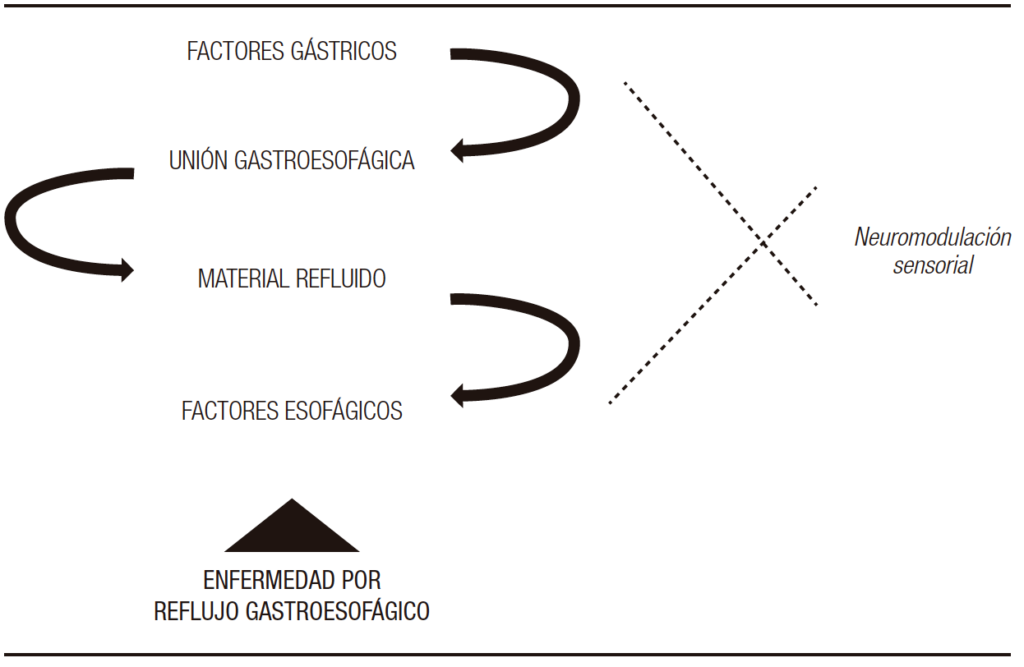
Neuromodulación sensorial
Un aspecto importante y no del todo dilucidado de la ERGE es la variabilidad en la percepción de los síntomas, tanto en intensidad como en el tipo. Esto ha llevado a clasificarla en distintos fenotipos, que derivan en distintos abordajes terapéuticos.123 Además, no siempre hay una correlación entre la percepción del síntoma y la presencia de un episodio de reflujo. Investigaciones en reflujo refractario muestran que la mayoría de los síntomas reportados no coinciden con un evento de exposición ácida a nivel del esófago.124 Alrededor de un tercio de los pacientes con un perfil de reflujo normal reportan síntomas compatibles con ERGE.125 Estos hallazgos sugieren la presencia de mecanismos por fuera de la presencia de reflujo en el esófago.
La hipervigilancia esofágica es un mecanismo psicológico que lleva a una mayor conciencia y amplificación de los síntomas y sensaciones esofágicas.126 Esta percepción sintomática incrementada genera una respuesta de miedo aprendida, que da como resultado círculo vicioso de excitación del sistema nervioso autónomo que lleva a conductas inconscientes para evitar el síntoma.127 Ha sido mayormente estudiado en poblaciones con pirosis funcional. Sin embargo, alrededor de un 45% de pacientes con ERGE en tratamiento con IBP experimentan síntomas, por lo que son considerados en el grupo de ERGE refractario.128 Esto podría indicar que la hipervigilancia esofágica estaría implicada en la fisiopatología del ERGE refractario.
Un estudio evaluó el estado de hipervigilancia y ansiedad a través del EHAS (del inglés Esophageal Hypervigilance and Anxiety Scale)129 en función del grado de reflujo, categorizados a través de una cápsula inalámbrica de 96 horas. Se concluyó que la hipervigilancia se encuentra presente en todos los grados de ERGE, independientemente de la carga ácida y el índice sintomático, y que es un predictor de la severidad de los síntomas. Por el contrario, los niveles de ansiedad no fueron significativamente diferentes entre los distintos fenotipos.130
Bonus track: Microbiota y enfermedad por reflujo gastroesofágico
El estudio de la microbiota ha crecido exponencialmente en los últimos años. A pesar de que su alteración se ha asociado con múltiples trastornos gastrointestinales, su rol en la enfermedad por reflujo no se encuentra estudiado en profundidad, dado que las investigaciones sobre el entorno microbiológico del esófago son escasas.
En condiciones fisiológicas, el esófago actúa como un conducto de transporte de contenido desde la boca hasta el estómago. Esto significa que es un órgano en el que no suele haber retención de contenido, como sucede, por ejemplo, con el estómago. Estudios de cultivos provenientes de lavados esofágicos sugirieron que los microorganismos que habitan este órgano provienen de la boca, por la deglución, o del estómago, por el reflujo.131 El género predominante en esófagos sanos es el Streptococo, acompañado de Prevotella y Veillonella,131-132 mientras que en personas con esofagistis erosivas o esófago de Barrett predominan los microorganismos gram negativos.131-133
En pacientes con ERGE grave, se han evidenciado cambios histológicos caracterizados por una inflamación predominantemente de linfocitos T con hiperplasia papilar y de células basales sin pérdida de células superficiales.91 Algunos grupos sugieren que esta inflamación puede estar mediada por citoquinas, en lugar de ser el resultado de una lesión química producto del reflujo predominantemente ácido. Otros grupos sugieren que la patogenia podría estar relacionada con alteraciones del microbioma esofágico, con un aumento de los gram negativos. El lipopolisacárido de estos microorganismos podría regular en más la proliferación celular y desencadenar la producción de citoquinas proinflamatorias a través de TLR-4 (del inglés: toll like receptor type 4) y de la vía del NF-kB (del inglés: nuclear factor kappa light chain enhancer of activated B cells).91,133
Todos los estudios reportados en relación con el microbioma esofágico presentan como limitación un bajo número de casos estudiados, pero son el puntapié para empezar a conocer este aspecto.
Conclusión
La ERGE es el resultado de mecanismos fisiopatológicos cuya complejidad hace que aún no sean del todo comprendidos. Es el resultado de un fino disbalance entre los factores protectores y agresores, que hemos mencionado a lo largo de esta revisión.
La presencia en el esófago del material refluido es una condición necesaria, pero no suficiente, para que se desencadene una enfermedad por reflujo, dado que intervienen otros factores, tales como los trastornos motores esófago-gástricos, las alteraciones anatómicas de la unión gastroesofágica y las alteraciones estructurales macro y microscópicas de la mucosa esofágica, así como mecanismos neurosensoriales.
Sobre la base de supuestos fisiopatológicos conocidos, el tratamiento con supresión del ácido es el más difundido actualmente. Sin embargo, el reconocimiento de mecanismos más modernos, que involucran a estados proinflamatorios, podría cambiar el rumbo del tratamiento de esta enfermedad.
Propiedad intelectual. Los autores declaran que los datos y las figuras presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Daniel Sifrim ha recibido becas de investigación de Reckitt Benckiser de Reino Unido, Jinshan Technology de China y Alfa Sigma de Italia.
Conflictos de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2022 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Argüero J, Sifrim D. Actualización en la fisiopatología de la enfermedad por reflujo gastroesofágico. Acta Gastroenterol Latinoam. 2022;52(2):135-152.
https://doi.org/10.52787/agl.v52i2.212
Referencias
- Fass R, Boeckxstaens GE, El-Serag H, et al. Gastro-oesophageal reflux disease. Nat Rev Dis Primers 2021;7:55.
- Katzka DA, Kahrilas PJ. Advances in the diagnosis and management of gastroesophageal reflux disease. BMJ 2020;371:m3786.
- Hirschowitz BI. A critical analysis, with appropriate controls, of gastric acid and pepsin secretion in clinical esophagitis. Gastroenterology 1991;101:1149-1158.
- Collen MJ, Johnson DA, Sheridan MJ. Basal acid output and gastric acid hypersecretion in gastroesophageal reflux disease. Digestive Diseases and Sciences 1994;39:410-417.
- Gardner JD, Sloan S, Miner PB, et al. Meal-stimulated gastric acid secretion and integrated gastric acidity in gastro-oesophageal reflux disease. Alimentary Pharmacology & Therapeutics 2003;17: 945-953.
- Fisher RS, Sher DJ, Donahue D, Knight LC, Maurer A, Urbain JL, et al. Regional differences in gastric acidity and antacid distribution: is a single pH electrode sufficient? Am J Gastroenterol. 1997;92(2):263-70..
- Caparello C, Bravi I, Cantù P, et al. Traditional vs wireless intragastric pH monitoring: are the two techniques comparable? Neurogastroenterol Motil 2012;24:951-e464.
- Fletcher J, Wirz A, Young J, et al. Unbuffered highly acidic gastric juice exists at the gastroesophageal junction after a meal. Gastroenterology 2001;121:775-783.
- McColl KEL, Clarke A, Seenan J. Acid pocket, hiatus hernia and acid reflux. Gut 2010;59:430-431.
- Pandolfino JE, Schreiner MA, Lee TJ, et al. Bravo capsule placement in the gastric cardia: a novel method for analysis of proximal stomach acid environment. Am J Gastroenterol 2005;100: 1721-1727.
- Pandolfino JE, Zhang Q, Ghosh SK, et al. Acidity Surrounding the Squamocolumnar Junction in GERD Patients: ‘Acid Pocket’ Versus ‘Acid Film’. The American Journal of Gastroenterology 2007;102:2633–2641.
- Clarke AT, Wirz AA, Manning JJ, et al. Severe reflux disease is associated with an enlarged unbuffered proximal gastric acid pocket. Gut 2008;57:292–297.
- Beaumont H, Bennink RJ, de Jong J, et al. The position of the acid pocket as a major risk factor for acidic reflux in healthy subjects and patients with GORD. Gut 2010;59:441–451.
- Boecxstaens V, Bisschops R, Blondeau K, et al. Modulation of the postprandial acid and bile pockets at the gastro-oesophageal junction by drugs that affect gastric motility. Aliment Pharmacol Ther 2011;33:1370-1377.
- Stacher G, Lenglinger J, Bergmann H, et al. Gastric emptying: a contributory factor in gastro-oesophageal reflux activity? Gut 2000;47:661-666.
- Penagini R, Hebbard G, Horowitz M, et al. Motor function of the proximal stomach and visceral perception in gastro-oesophageal reflux disease. Gut 1998;42:251-257.
- Zerbib F, des Varannes SB, Ropert A, et al. Proximal gastric tone in gastro-oesophageal reflux disease. Eur J Gastroenterol Hepatol 1999;11:511–515.
- Emerenziani S, Zhang X, Blondeau K, et al. Gastric fullness, physical activity, and proximal extent of gastroesophageal reflux. Am J Gastroenterol 2005;100:1251-1256.
- Mittal R, Vaezi MF. Esophageal Motility Disorders and Gastroesophageal Reflux Disease. New England Journal of Medicine 2020;383:1961-1972.
- van Herwaarden MA, Samsom M, Smout AJ. Excess gastroesophageal reflux in patients with hiatus hernia is caused by mechanisms other than transient LES relaxations. Gastroenterology 2000; 119:1439-1446.
- Babaei A, Bhargava V, Korsapati H, et al. A unique longitudinal muscle contraction pattern associated with transient lower esophageal sphincter relaxation. Gastroenterology 2008;134:1322-1331.
- Sifrim D, Holloway R. Transient lower esophageal sphincter relaxations: how many or how harmful? The American Journal of Gastroenterology 2001;96:2529-2532.
- Dent J, Holloway RH, Toouli J, et al. Mechanisms of lower oesophageal sphincter incompetence in patients with symptomatic gastrooesophageal reflux. Gut 1988;29:1020-1028.
- Schoeman MN, Tippett MD, Akkermans LM, et al. Mechanisms of gastroesophageal reflux in ambulant healthy human subjects. Gastroenterology 1995;108:83-91.
- Penagini R, Schoeman MN, Dent J, et al. Motor events underlying gastro-oesophageal reflux in ambulant patients with reflux oesophagitis. Neurogastroenterol Motil 1996;8:131-141.
- Jiang Y, Bhargava V, Mittal RK. Mechanism of stretch-activated excitatory and inhibitory responses in the lower esophageal sphincter. Am J Physiol Gastrointest Liver Physiol 2009;297: G397-405.
- Dodds WJ, Dent J, Hogan WJ, et al. Mechanisms of gastroesophageal reflux in patients with reflux esophagitis. N Engl J Med 1982;307:1547-1552.
- Mittal RK. Current concepts of the antireflux barrier. Gastroenterol Clin North Am 1990;19:501-516.
- Mittal RK, Holloway RH, Penagini R, et al. Transient lower esophageal sphincter relaxation. Gastroenterology 1995;109:601-610.
- Kahrilas PJ, Lin S, Chen J, et al. The effect of hiatus hernia on gastro-oesophageal junction pressure. Gut 1999;44:476-482.
- Hill LD, Kozarek RA. The gastroesophageal flap valve. Journal of clinical gastroenterology 1999;28:194-197.
- Mittal RK, Balaban DH. The esophagogastric junction. N Engl J Med 1997;336:924-932.
- Sloan S, Kahrilas PJ. Impairment of esophageal emptying with hiatal hernia. Gastroenterology 1991;100:596-605.
- Mittal RK, Lange RC, McCallum RW. Identification and mechanism of delayed esophageal acid clearance in subjects with hiatus hernia. Gastroenterology 1987;92:130-135.
- Vardar R, Keskin M. Indications of 24-h esophageal pH monitoring, capsule pH monitoring, combined pH monitoring with multichannel impedance, esophageal manometry, radiology and scintigraphy in gastroesophageal reflux disease? The Turkish Journal of Gastroenterology 2017;28:16-21.
- Singh S, Sharma AN, Murad MH, et al. Central Adiposity Is Associated With Increased Risk of Esophageal Inflammation, Metaplasia, and Adenocarcinoma: A Systematic Review and Meta-analysis. Clinical Gastroenterology and Hepatology 2013;11: 1399-1412.e7.
- Mayrand S, Diamant NE. Measurement of human esophageal tone in vivo. Gastroenterology 1993;105:1411-1420.
- Mearin F, Vasconez C, Zárate N, et al. Esophageal tone in patients with total aperistalsis: gastroesophageal reflux disease versus achalasia. Am J Physiol Gastrointest Liver Physiol 2000;279: G374-9.
- Sifrim D, Janssens J, Vantrappen G. Transient lower esophageal sphincter relaxations and esophageal body muscular contractile response in normal humans. Gastroenterology 1996; 110:659-668.
- Sifrim D, Tack J, Lerut T, et al. Transient lower esophageal sphincter relaxations and esophageal body muscular contractile response in reflux esophagitis. Dig Dis Sci 2000;45: 1293-1300.
- Sifrim D, Holloway R, Silny J, et al. Acid, nonacid, and gas reflux in patients with gastroesophageal reflux disease during ambulatory 24-hour pH-impedance recordings. Gastroenterology 2001; 120:1588-1598.
- DeMeester TR, Wang CI, Wernly JA, et al. Technique, indications, and clinical use of 24 hour esophageal pH monitoring. J Thorac Cardiovasc Surg 1980;79:656-670.
- Bredenoord AJ, Hemmink GJM, Smout AJPM. Relationship between gastro-oesophageal reflux pattern and severity of mucosal damage. Neurogastroenterol Motil 2009;21:807-812.
- Pandolfino JE, Richter JE, Ours T, et al. Ambulatory esophageal pH monitoring using a wireless system. The American Journal of Gastroenterology 2003;98:740-749.
- Smith JL, Lacey Smith J, Opekun AR, et al. Sensitivity of the esophageal mucosa to pH in gastroesophageal reflux disease. Gastroenterology 1989;96:683-689.
- Bredenoord AJ, Weusten BLAM, Curvers WL, et al. Determinants of perception of heartburn and regurgitation. Gut 2006; 55:313-318.
- Savarino E, Carbone R, Marabotto E, et al. Gastro-oesophageal reflux and gastric aspiration in idiopathic pulmonary fibrosis patients. Eur Respir J 2013;42:1322-1331.
- Smith JA, Decalmer S, Kelsall A, et al. Acoustic cough-reflux associations in chronic cough: potential triggers and mechanisms. Gastroenterology 2010;139:754-762.
- Wenzl TG, Schenke S, Peschgens T, et al. Association of apnea and nonacid gastroesophageal reflux in infants: Investigations with the intraluminal impedance technique. Pediatr Pulmonol 2001;31:144-149.
- Skopnik H, Silny J, Heiber O, et al. Gastroesophageal reflux in infants: evaluation of a new intraluminal impedance technique. J Pediatr Gastroenterol Nutr 1996;23:591-598.
- López-Alonso M, Moya MJ, Cabo JA, et al. Twenty-four-hour esophageal impedance-pH monitoring in healthy preterm neonates: rate and characteristics of acid, weakly acidic, and weakly alkaline gastroesophageal reflux. Pediatrics 2006;118: e299-308.
- Vaezi M, Richter J. Synergism of acid and duodenogastroesophageal reflux in complicated Barrett’s esophagus. Surgery 1995;117: 699-704.
- Pace F, Sangaletti O, Pallotta S, et al. Biliary reflux and non-acid reflux are two distinct phenomena: a comparison between 24-hour multichannel intraesophageal impedance and bilirubin monitoring. Scand J Gastroenterol 2007;42:1031-1039.
- Vaezi MF, Richter JE. Role of acid and duodenogastroesophageal reflux in gastroesophageal reflux disease. Gastroenterology 1996; 111:1192-1199.
- Siddiqui A, Rodriguez-Stanley S, Zubaidi S, et al. Esophageal visceral sensitivity to bile salts in patients with functional heartburn and in healthy control subjects. Dig Dis Sci 2005;50:81-85.
- Farré R, van Malenstein H, De Vos R, et al. Short exposure of oesophageal mucosa to bile acids, both in acidic and weakly acidic conditions, can impair mucosal integrity and provoke dilated intercellular spaces. Gut 2008;57:1366-1374.
- Tack J, Koek G, Demedts I, et al. Gastroesophageal Reflux Disease Poorly Responsive to Single-Dose Proton Pump Inhibitors in Patients without Barrett’s Esophagus: Acid Reflux, Bile Reflux, or Both? The American Journal of Gastroenterology 2004;99:981-988.
- Gasiorowska A, Navarro-Rodriguez T, Wendel C, et al. Comparison of the degree of duodenogastroesophageal reflux and acid reflux between patients who failed to respond and those who were successfully treated with a proton pump inhibitor once daily. Am J Gastroenterol 2009;104:2005-2013.
- Emerenziani S, Sifrim D, Habib FI, et al. Presence of gas in the refluxate enhances reflux perception in non-erosive patients with physiological acid exposure of the oesophagus. Gut 2008;57:443-447.
- Bredenoord AJ, Weusten BLAM, Sifrim D, et al. Aerophagia, gastric, and supragastric belching: a study using intraluminal electrical impedance monitoring. Gut 2004;53:1561-1565.
- Hemmink GJ, Bredenoord AJ, Weusten BL, et al. T1959 Supragastric Belching in Patients with Reflux Symptoms. Gastroenterology 2008;134:A-588.
- Koukias N, Woodland P, Yazaki E, et al. Supragastric Belching: Prevalence and Association With Gastroesophageal Reflux Disease and Esophageal Hypomotility. J Neurogastroenterol Motil 2015;21:398-403.
- Sifrim D, Silny J, Holloway RH, et al. Patterns of gas and liquid reflux during transient lower oesophageal sphincter relaxation: a study using intraluminal electrical impedance. Gut 1999;44:47-54.
- Gyawali CP, Kahrilas PJ, Savarino E, et al. Modern diagnosis of GERD: the Lyon Consensus. Gut 2018;67:1351-1362.
- Collen MJ, Johnson DA, Sheridan MJ. Basal acid output and gastric acid hypersecretion in gastroesophageal reflux disease [Internet]. Digestive Diseases and Sciences. 1994;39:410-7. Disponible en: http://dx.doi.org/10.1007/bf02090216
- Gardner JD, Sloan S, Miner PB, Robinson M. Meal-stimulated gastric acid secretion and integrated gastric acidity in gastro-oesophageal reflux disease [Internet]. Alimentary Pharmacology & Therapeutics. 2003;17:945-53. Disponible en: http://dx.doi.org/10.1046/j.1365-2036.2003.01533.x
- McColl KEL, Clarke A, Seenan J. Acid pocket, hiatus hernia and acid reflux [Internet]. Gut. 2010;59:430-1. Disponible en: http://dx.doi.org/10.1136/gut.2009.192922
- Pandolfino JE, Schreiner MA, Lee TJ, Zhang Q, Kahrilas PJ. Bravo capsule placement in the gastric cardia: a novel method for analysis of proximal stomach acid environment. Am J Gastroenterol. 2005;100(8):1721-7.
- Simonian HP, Vo L, Doma S, Fisher RS, Parkman HP. Regional Postprandial Differences in pH Within the Stomach and Gastroesophageal Junction [Internet]. Digestive Diseases and Sciences;50:2276-85. Disponible en: http://dx.doi.org/10.1007/s10620-005-3048-0
- Pandolfino JE, Zhang Q, Ghosh SK, Post J, Kwiatek M, Kahrilas PJ. Acidity Surrounding the Squamocolumnar Junction in GERD Patients: “Acid Pocket” Versus “Acid Film” [Internet]. The American Journal of Gastroenterology. 2007;102:2633-41. Disponible en: http://dx.doi.org/10.1111/j.1572-0241.2007.01488.x
- Clarke AT, Wirz AA, Manning JJ, Ballantyne SA, Alcorn DJ, McColl KEL. Severe reflux disease is associated with an enlarged unbuffered proximal gastric acid pocket [Internet]. Gut. 2008;57:292-7. Disponible en: http://dx.doi.org/10.1136/gut.2006.109421
- Grigolon A, Cantú P, Bravi I, Caparello C, Penagini R. Subcardial 24-h wireless pH monitoring in gastroesophageal reflux disease patients with and without hiatal hernia compared with healthy subjects. Am J Gastroenterol. 2009;104(11):2714-20.
- Beaumont H, Bennink RJ, de Jong J, Boeckxstaens GE. The position of the acid pocket as a major risk factor for acidic reflux in healthy subjects and patients with GORD [Internet]. Gut. 2010;59:441-51. Disponible en: http://dx.doi.org/10.1136/gut.2009.178061
- Boecxstaens V, Bisschops R, Blondeau K, Vos R, Scarpellini E, De Wulf D, et al. Modulation of the postprandial acid and bile pockets at the gastro-oesophageal junction by drugs that affect gastric motility. Aliment Pharmacol Ther. 2011;33(12):1370-7.
- Stacher G, Lenglinger J, Bergmann H, Schneider C, Hoffmann M, Wölfl G, et al. Gastric emptying: a contributory factor in gastro-oesophageal reflux activity? Gut. 2000;47(5):661-6.
- Penagini R, Hebbard G, Horowitz M, Dent J, Bermingham H, Jones K, et al. Motor function of the proximal stomach and visceral perception in gastro-oesophageal reflux disease. Gut. 1998;42(2):251-7.
- Zerbib F, des Varannes SB, Ropert A, Lamouliatte H, Quinton A, Galmiche JP. Proximal gastric tone in gastro-oesophageal reflux disease. Eur J Gastroenterol Hepatol. 1999;11(5):511-5.
- Emerenziani S, Zhang X, Blondeau K, Silny J, Tack J, Janssens J, et al. Gastric fullness, physical activity, and proximal extent of gastroesophageal reflux. Am J Gastroenterol. 2005;100(6):1251-6.
- Mittal R, Vaezi MF. Esophageal Motility Disorders and Gastroesophageal Reflux Disease [Internet]. New England Journal of Medicine. 2020;383:1961-72. Disponible en: http://dx.doi.org/10.1056/nejmra2000328
- van Herwaarden MA, Samsom M, Smout AJ. Excess gastroesophageal reflux in patients with hiatus hernia is caused by mechanisms other than transient LES relaxations. Gastroenterology. 2000;119(6):1439-46.
- Babaei A, Bhargava V, Korsapati H, Zheng WH, Mittal RK. A unique longitudinal muscle contraction pattern associated with transient lower esophageal sphincter relaxation. Gastroenterology. 2008;134(5):1322-31.
- Sifrim D, Holloway R. Transient lower esophageal sphincter relaxations: how many or how harmful? [Internet]. The American Journal of Gastroenterology. 2001;96:2529-32. Disponible en: http://dx.doi.org/10.1111/j.1572-0241.2001.04095.x
- Dent J, Holloway RH, Toouli J, Dodds WJ. Mechanisms of lower oesophageal sphincter incompetence in patients with symptomatic gastrooesophageal reflux. Gut. 1988;29(8):1020-8.
- Schoeman MN, Tippett MD, Akkermans LM, Dent J, Holloway RH. Mechanisms of gastroesophageal reflux in ambulant healthy human subjects. Gastroenterology. 1995;108(1):83-91.
- Penagini R, Schoeman MN, Dent J, Tippett MD, Holloway RH. Motor events underlying gastro-oesophageal reflux in ambulant patients with reflux oesophagitis. Neurogastroenterol Motil. 1996;8(2):131-41.
- Jiang Y, Bhargava V, Mittal RK. Mechanism of stretch-activated excitatory and inhibitory responses in the lower esophageal sphincter. Am J Physiol Gastrointest Liver Physiol. 2009;297(2):G397-405.
- Dodds WJ, Dent J, Hogan WJ, Helm JF, Hauser R, Patel GK, et al. Mechanisms of gastroesophageal reflux in patients with reflux esophagitis. N Engl J Med. 1982;307(25):1547-52.
- Mittal RK. Current concepts of the antireflux barrier. Gastroenterol Clin North Am. 1990;19(3):501-16.
- Mittal RK, Holloway RH, Penagini R, Blackshaw LA, Dent J. Transient lower esophageal sphincter relaxation. Gastroenterology. 1995;109(2):601-10.
- Kahrilas PJ, Lin S, Chen J, Manka M. The effect of hiatus hernia on gastro-oesophageal junction pressure [Internet]. Gut. 1999;44:476-82. Disponible en: http://dx.doi.org/10.1136/gut.44.4.476
- Hill LD, Kozarek RA. The gastroesophageal flap valve. J Clin Gastroenterol. 1999;28(3):194-7.
- Mittal RK, Balaban DH. The esophagogastric junction. N Engl J Med. 1997;336(13):924-32.
- Sloan S, Kahrilas PJ. Impairment of esophageal emptying with hiatal hernia. Gastroenterology. 1991;100(3):596-605.
- Mittal RK, Lange RC, McCallum RW. Identification and mechanism of delayed esophageal acid clearance in subjects with hiatus hernia. Gastroenterology. 1987;92(1):130-5.
- Vardar R, Keskin M. Indications of 24-h esophageal pH monitoring, capsule pH monitoring, combined pH monitoring with multichannel impedance, esophageal manometry, radiology and scintigraphy in gastroesophageal reflux disease? [Internet]. The Turkish Journal of Gastroenterology. 2017;28:16-21. Disponible en: http://dx.doi.org/10.5152/tjg.2017.06
- Singh S, Sharma AN, Murad MH, Buttar NS, El-Serag HB, Katzka DA, et al. Central Adiposity Is Associated With Increased Risk of Esophageal Inflammation, Metaplasia, and Adenocarcinoma: A Systematic Review and Meta-analysis [Internet]. Clinical Gastroenterology and Hepatology. 2013;11:399-412.e7. Disponible en: http://dx.doi.org/10.1016/j.cgh.2013.05.009
- Mayrand S, Diamant NE. Measurement of human esophageal tone in vivo. Gastroenterology. 1993;105(5):1411-20.
- Mearin F, Vasconez C, Zárate N, Malagelada JR. Esophageal tone in patients with total aperistalsis: gastroesophageal reflux disease versus achalasia. Am J Physiol Gastrointest Liver Physiol. 2000;279(2):G374-9.
- Sifrim D, Janssens J, Vantrappen G. Transient lower esophageal sphincter relaxations and esophageal body muscular contractile response in normal humans [Internet]. Vol. 110, Gastroenterology. 1996;110:659-68. Disponible en: http://dx.doi.org/10.1053/gast.1996.v110.pm8608873
- Sifrim D, Tack J, Lerut T, Janssens J. Transient lower esophageal sphincter relaxations and esophageal body muscular contractile response in reflux esophagitis. Dig Dis Sci. 2000;45(7):1293-300.
- Sifrim D, Holloway R, Silny J, Xin Z, Tack J, Lerut A, et al. Acid, nonacid, and gas reflux in patients with gastroesophageal reflux disease during ambulatory 24-hour pH-impedance recordings. Gastroenterology. 2001;120(7):1588-98.
- DeMeester TR, Wang CI, Wernly JA, Pellegrini CA, Little AG, Klementschitsch P, et al. Technique, indications, and clinical use of 24 hour esophageal pH monitoring. J Thorac Cardiovasc Surg. 1980;79(5):656-70.
- Frazzoni M, De Micheli E, Savarino V. Different patterns of oesophageal acid exposure distinguish complicated reflux disease from either erosive reflux oesophagitis or non-erosive reflux disease [Internet]. Vol. 18, Alimentary Pharmacology & Therapeutics. 2003;18:1091-8. Disponible en: http://dx.doi.org/10.1046/j.1365-2036.2003.01768.x
- Bredenoord AJ, Hemmink GJM, Smout AJPM. Relationship between gastro-oesophageal reflux pattern and severity of mucosal damage. Neurogastroenterol Motil. 2009;21(8):807-12.
- Pandolfino JE, Richter JE, Ours T, Guardino JM, Chapman J, Kahrilas PJ. Ambulatory esophageal pH monitoring using a wireless system [Internet]. The American Journal of Gastroenterology. 2003.;98:740-9. Disponible en: http://dx.doi.org/10.1111/j.1572-0241.2003.07398.x
- Smith JL, Lacey Smith J, Opekun AR, Larkai E, Graham DY. Sensitivity of the esophageal mucosa to pH in gastroesophageal reflux disease [Internet]. Gastroenterology. 1989;96:683-9.
Disponible en: http://dx.doi.org/10.1016/0016-5085(89)90890-1 - Bredenoord AJ, Weusten BLAM, Curvers WL, Timmer R, Smout AJPM. Determinants of perception of heartburn and regurgitation. Gut. 2006;55(3):313-8.
- Savarino E, Carbone R, Marabotto E, Furnari M, Sconfienza L, Ghio M, et al. Gastro-oesophageal reflux and gastric aspiration in idiopathic pulmonary fibrosis patients. Eur Respir J. 2013;42(5):1322-31.
- Smith JA, Decalmer S, Kelsall A, McGuinness K, Jones H, Galloway S, et al. Acoustic cough-reflux associations in chronic cough: potential triggers and mechanisms. Gastroenterology. 2010;139(3):754-62.
- Rosen R, Johnston N, Hart K, Khatwa U, Katz E, Nurko S. Higher rate of bronchoalveolar lavage culture positivity in children with nonacid reflux and respiratory disorders. J Pediatr. 2011;159(3):504-6.
- Wenzl TG, Schenke S, Peschgens T, Silny J, Heimann G, Skopnik H. Association of apnea and nonacid gastroesophageal reflux in infants: Investigations with the intraluminal impedance technique. Pediatr Pulmonol. 2001;31(2):144-9.
- Skopnik H, Silny J, Heiber O, Schulz J, Rau G, Heimann G. Gastroesophageal reflux in infants: evaluation of a new intraluminal impedance technique. J Pediatr Gastroenterol Nutr. 1996;23(5):591-8.
- López-Alonso M, Moya MJ, Cabo JA, Ribas J, del Carmen Macías M, Silny J, et al. Twenty-four-hour esophageal impedance-pH monitoring in healthy preterm neonates: rate and characteristics of acid, weakly acidic, and weakly alkaline gastroesophageal reflux. Pediatrics. 2006;118(2):e299-308.
- Pace F, Sangaletti O, Pallotta S, Molteni P, Porro GB. Biliary reflux and non-acid reflux are two distinct phenomena: a comparison between 24-hour multichannel intraesophageal impedance and bilirubin monitoring. Scand J Gastroenterol. 2007;42(9):1031-9.
- Vaezi MF, Richter JE. Role of acid and duodenogastroesophageal reflux in gastroesophageal reflux disease. Gastroenterology. 1996;111(5):1192-9.
- Siddiqui A, Rodriguez-Stanley S, Zubaidi S, Miner PB Jr. Esophageal visceral sensitivity to bile salts in patients with functional heartburn and in healthy control subjects. Dig Dis Sci. 2005;50(1):81-5.
- Farré R, van Malenstein H, De Vos R, Geboes K, Depoortere I, Vanden Berghe P, et al. Short exposure of oesophageal mucosa to bile acids, both in acidic and weakly acidic conditions, can impair mucosal integrity and provoke dilated intercellular spaces. Gut. 2008;57(10):1366-74.
- Tack J, Koek G, Demedts I, Sifrim D, Janssens J. Gastroesophageal Reflux Disease Poorly Responsive to Single-Dose Proton Pump Inhibitors in Patients without Barrett’s Esophagus: Acid Reflux, Bile Reflux, or Both? [Internet]. The American Journal of Gastroenterology. 2004;99:981-8. Disponible en: http://dx.doi.org/10.1111/j.1572-0241.2004.04171.x
- Gasiorowska A, Navarro-Rodríguez T, Wendel C, Krupinski E, Perry ZH, Koenig K, et al. Comparison of the degree of duodenogastroesophageal reflux and acid reflux between patients who failed to respond and those who were successfully treated with a proton pump inhibitor once daily. Am J Gastroenterol. 2009;104(8):2005-13.
- Emerenziani S, Sifrim D, Habib FI, Ribolsi M, Guarino MPL, Rizzi M, et al. Presence of gas in the refluxate enhances reflux perception in non-erosive patients with physiological acid exposure of the oesophagus. Gut. 2008;57(4):443-7.
- Bredenoord AJ, Weusten BLAM, Sifrim D, Timmer R, Smout AJPM. Aerophagia, gastric, and supragastric belching: a study using intraluminal electrical impedance monitoring. Gut. 2004;53(11):1561-5.
- Hemmink GJ, Bredenoord AJ, Weusten BL, Timmer R, Smout AJ. T1959 Supragastric Belching in Patients with Reflux Symptoms [Internet]. Gastroenterology. 2008;134:588. Disponible en: http://dx.doi.org/10.1016/s0016-5085(08)62748-1
- Koukias N, Woodland P, Yazaki E, Sifrim D. Supragastric Belching: Prevalence and Association With Gastroesophageal Reflux Disease and Esophageal Hypomotility. J Neurogastroenterol Motil. 201530;21(3):398-403.
- Sifrim D, Silny J, Holloway RH, Janssens JJ. Patterns of gas and liquid reflux during transient lower oesophageal sphincter relaxation: a study using intraluminal electrical impedance. Gut. 1999;44(1):47-54.
- Cicala M, Emerenziani S, Caviglia R, Guarino MPL, Vavassori P, Ribolsi M, et al. Intra-oesophageal distribution and perception of acid reflux in patients with non-erosive gastro-oesophageal reflux disease. Aliment Pharmacol Ther. 2003;18(6):605-13.
- Weusten BL, Akkermans LM, vanBerge-Henegouwen GP, Smout AJ. Symptom perception in gastroesophageal reflux disease is dependent on spatiotemporal reflux characteristics. Gastroenterology. 1995;108(6):1739-44.
- Zerbib F, Duriez A, Roman S, Capdepont M, Mion F. Determinants of gastro-oesophageal reflux perception in patients with persistent symptoms despite proton pump inhibitors. Gut. 2008;57(2):156-60.
- Rohof WO, Bennink RJ, de Jonge H, Boeckxstaens GE. Increased Proximal Reflux in a Hypersensitive Esophagus Might Explain Symptoms Resistant to Proton Pump Inhibitors in Patients With Gastroesophageal Reflux Disease [Internet]. Clinical Gastroenterology and Hepatology. 2014;12:1647-55. Disponible en: http://dx.doi.org/10.1016/j.cgh.2013.10.026
- Tipnis NA, Rhee P-L, Mittal RK. Distension during gastroesophageal reflux: effects of acid inhibition and correlation with symptoms. Am J Physiol Gastrointest Liver Physiol. 2007;293(2):G469-74.
- Richter JE, Blackwell JN, Wu WC, Johns DN, Cowan RJ, Castell DO. Relationship of radionuclide liquid bolus transport and esophageal manometry. J Lab Clin Med. 1987;109(2):217-24.
- Ribolsi M, Balestrieri P, Emerenziani S, Guarino MPL, Cicala M. Weak peristalsis with large breaks is associated with higher acid exposure and delayed reflux clearance in the supine position in GERD patients. Am J Gastroenterol. 2014;109(1):46-51.
- Kim YJ. Weak peristalsis in esophageal pressure topography: classification and association with Dysphagia (Am J Gastroenterol 2011;106:349-56). J Neurogastroenterol Motil. 2011;17(2):197-9.
- Kahrilas PJ, Dodds WJ, Hogan WJ, Kern M, Arndorfer RC, Reece A. Esophageal peristaltic dysfunction in peptic esophagitis [Internet]. Gastroenterology. 1986;91:897-904. Disponible en: http://dx.doi.org/10.1016/0016-5085(86)90692-x
- Katzka DA. Motility Abnormalities in Gastroesophageal Reflux Disease [Internet]. Gastroenterology Clinics of North America. 1999;28:905-15. Disponible en: http://dx.doi.org/10.1016/s0889-8553(05)70097-2
- Ang D, Blondeau K, Sifrim D, Tack J. The Spectrum of Motor Function Abnormalities in Gastroesophageal Reflux Disease and Barrett’s Esophagus [Internet]. Digestion. 2009;79:158-68. Disponible en: http://dx.doi.org/10.1159/000210265
- Fornari F, Blondeau K, Durand L, Rey E, Diaz-Rubio M, De Meyer A, et al. Relevance of mild ineffective oesophageal motility (IOM) and potential pharmacological reversibility of severe IOM in patients with gastro-oesophageal reflux disease. Aliment Pharmacol Ther. 2007;26(10):1345-54.
- Schoeman MN, Holloway RH. Integrity and characteristics of secondary oesophageal peristalsis in patients with gastro-oesophageal reflux disease. Gut. 1995;36(4):499-504.
- Williams D, Thompson DG, Heggie L, O’Hanrahan T, Bancewicz J. Esophageal clearance function following treatment of esophagitis. Gastroenterology. 1994;106(1):108-16.
- Timmer R, Breumelhof R, Nadorp JH, Smout AJ. Oesophageal motility and gastro-oesophageal reflux before and after healing of reflux oesophagitis. A study using 24 hour ambulatory pH and pressure monitoring. Gut. 1994;35(11):1519-22.
- Frazzoni M, Conigliaro R, Mirante VG, Melotti G. The added value of quantitative analysis of on-therapy impedance-pH parameters in distinguishing refractory non-erosive reflux disease from functional heartburn. Neurogastroenterol Motil. 2012;24(2):141-6, e87.
- Frazzoni M, de Bortoli N, Frazzoni L, Furnari M, Martinucci I, Tolone S, et al. Impairment of chemical clearance and mucosal integrity distinguishes hypersensitive esophagus from functional heartburn. J Gastroenterol. 2017;52(4):444-51.
- Helm JF, Dodds WJ, Pelc LR, Palmer DW, Hogan WJ, Teeter BC. Effect of esophageal emptying and saliva on clearance of acid from the esophagus. N Engl J Med. 1984;310(5):284-8.
- Murray JA, Kost LJ, Hardtke C, Shahin W. Bolus transport in the proximal and distal esophagus as measured by intraluminal impedance [Internet]. Vol. 118, Gastroenterology. 2000. P. A133. Disponible en: http://dx.doi.org/10.1016/s0016-5085(00)82612-8
- Korsten MA, Rosman AS, Fishbein S, Shlein RD, Goldberg HE, Biener A. Chronic xerostomia increases esophageal acid exposure and is associated with esophageal injury. Am J Med. 1991;90(6):701-6.
- Orr WC, Chen CL, Sloan S. The role of age and salivation in acid clearance in symptomatic patients with gastro-oesophageal reflux disease. Aliment Pharmacol Ther. 2001;15(9):1385-8.
- Chang C-S, Liao C-H, Muo C-H, Kao C-H. Increased risk of concurrent gastroesophageal reflux disease among patients with Sjögren’s syndrome: A nationwide population-based study [Internet]. European Journal of Internal Medicine. 2016;31:73-8. Disponible en: http://dx.doi.org/10.1016/j.ejim.2016.01.014
- Frazzoni M, Manta R, Mirante VG, Conigliaro R, Frazzoni L, Melotti G. Esophageal chemical clearance is impaired in gastro-esophageal reflux disease-a 24-h impedance-pH monitoring assessment. Neurogastroenterol Motil. 2013;25(5):399-406, e295.
- Dunbar KB, Agoston AT, Odze RD, Huo X, Pham TH, Cipher DJ, et al. Association of Acute Gastroesophageal Reflux Disease With Esophageal Histologic Changes. JAMA. 2016;315(19):2104-12.
- Rothenberg M. Faculty Opinions recommendation of Gastroesophageal reflux might cause esophagitis through a cytokine-mediated mechanism rather than caustic acid injury [Internet]. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature. 2010. Disponible en: http://dx.doi.org/10.3410/f.1164194.885055
- Souza RF, Bayeh L, Spechler SJ, Tambar UK, Bruick RK. A new paradigm for GERD pathogenesis. Not acid injury, but cytokine-mediated inflammation driven by HIF-2α: a potential role for targeting HIF-2α to prevent and treat reflux esophagitis [Internet]. Current Opinion in Pharmacology. 2017;37:93-9. Disponible en: http://dx.doi.org/10.1016/j.coph.2017.10.004
- Lundell LR, Dent J, Bennett JR, Blum AL, Armstrong D, Galmiche JP, et al. Endoscopic assessment of oesophagitis: clinical and functional correlates and further validation of the Los Angeles classification. Gut. 1999;45(2):172-80.
- El-Serag HB. Epidemiology of Non-Erosive Reflux Disease [Internet]. Vol. 78, Digestion. 2008;78:6-10. Disponible: http://dx.doi.org/10.1159/000151249
- Bytzer P, van Zanten SV, Mattsson H, Wernersson B. Partial symptom-response to proton pump inhibitors in patients with non-erosive reflux disease or reflux oesophagitis – a post hoc analysis of 5796 patients. Aliment Pharmacol Ther. 2012;36(7):635-43.
- Tobey NA, Carson JL, Alkiek RA, Orlando RC. Dilated intercellular spaces: a morphological feature of acid reflux-damaged human esophageal epithelium. Gastroenterology. 1996;111(5):1200-5.
- Calabrese C, Bortolotti M, Fabbri A, Areni A, Cenacchi G, Scialpi C, et al. Reversibility of GERD ultrastructural alterations and relief of symptoms after omeprazole treatment. Am J Gastroenterol. 2005;100(3):537-42.
- Woodland P, Al-Zinaty M, Yazaki E, Sifrim D. In vivo evaluation of acid-induced changes in oesophageal mucosa integrity and sensitivity in non-erosive reflux disease. Gut. 2013;62(9):1256-61.
- Woodland P, Lee C, Duraisamy Y, Farré R, Dettmar P, Sifrim D. Assessment and protection of esophageal mucosal integrity in patients with heartburn without esophagitis. Am J Gastroenterol. 2013;108(4):535-43.
- Jovov B, Que J, Tobey NA, Djukic Z, Hogan BLM, Orlando RC. Role of E-cadherin in the pathogenesis of gastroesophageal reflux disease. Am J Gastroenterol. 2011;106(6):1039-47.
- Shi G, des Varannes SB, Scarpignato C, Le Rhun M, Galmiche JP. Reflux related symptoms in patients with normal oesophageal exposure to acid [Internet]. Gut. 1995;37:457-64. Disponible en: http://dx.doi.org/10.1136/gut.37.4.457
- Byrne PJ, Mulligan ED, O’Riordan J, Keeling PWN, Reynolds JV. Impaired visceral sensitivity to acid reflux in patients with Barrett’s esophagus. the role of esophageal motility* [Internet]. Diseases of the Esophagus. 2003;16:199-203. Disponible en: http://dx.doi.org/10.1046/j.1442-2050.2003.00328.x
- Chen C-L. Visceral hypersensitivity in non-erosive reflux disease: neurogenic overwhelming in esophagus? Dig Dis Sci. 2013;58(8):2131-2.
- Kollarik M, Ru F, Brozmanova M. Vagal afferent nerves with the properties of nociceptors. Auton Neurosci. 2010;153(1-2):12-20.
- Holzer P. Acid-sensitive ion channels in gastrointestinal function [Internet]. Current Opinion in Pharmacology. 2003.;3:618-25. Disponible en: http://dx.doi.org/10.1016/j.coph.2003.06.008
- Caterina MJ, Julius D. The Vanilloid Receptor: A Molecular Gateway to the Pain Pathway [Internet]. Annual Review of Neuroscience. 2001;24:87-517. Disponible en: http://dx.doi.org/10.1146/annurev.neuro.24.1.487
- Kandulski A, Wex T, Mönkemüller K, Kuester D, Fry LC, Roessner A, et al. Proteinase-activated receptor-2 in the pathogenesis of gastroesophageal reflux disease. Am J Gastroenterol. 2010;105(9):1934-43.
- Travagli RA, Rogers RC. Receptors and transmission in the brain-gut axis: potential for novel therapies. V. Fast and slow extrinsic modulation of dorsal vagal complex circuits. Am J Physiol Gastrointest Liver Physiol. 2001;281(3):G595-601.
- Sarkar S, Thompson DG, Woolf CJ, Hobson AR, Millane T, Aziz Q. Patients with chest pain and occult gastroesophageal reflux demonstrate visceral pain hypersensitivity which may be partially responsive to acid suppression. Am J Gastroenterol. 2004;99(10):1998-2006.
- Sarkar S, Aziz Q, Woolf CJ, Hobson AR, Thompson DG. Contribution of central sensitisation to the development of noncardiac chest pain [Internet]. The Lancet. 2000;356:54-9. Disponible en: http://dx.doi.org/10.1016/s0140-6736(00)02758-6
- Fass R, Naliboff BD, Fass SS, Peleg N, Wendel C, Malagon IB, et al. The effect of auditory stress on perception of intraesophageal acid in patients with gastroesophageal reflux disease. Gastroenterology. 2008;134(3):696-705.
- Schey R, Dickman R, Parthasarathy S, Quan SF, Wendel C, Merchant J, et al. Sleep deprivation is hyperalgesic in patients with gastroesophageal reflux disease. Gastroenterology. 2007;133(6):1787-95.
- Patel RS, Rao SS. Biomechanical and sensory parameters of the human esophagus at four levels. Am J Physiol. 1998;275(2):G187-91.
- Krarup AL. Proximal and distal esophageal sensitivity is decreased in patients with Barrett’s esophagus [Internet]. Vol. 17, World Journal of Gastroenterology. 2011. P. 514. Disponible en: http://dx.doi.org/10.3748/wjg.v17.i4.514
- Thoua NM, Khoo D, Kalantzis C, Emmanuel AV. Acid-related oesophageal sensitivity, not dysmotility, differentiates subgroups of patients with non-erosive reflux disease [Internet]. Alimentary Pharmacology & Therapeutics. 2007;27:396-403. Disponible en: http://dx.doi.org/10.1111/j.1365-2036.2007.03584.x
- van Hoeij FB, Weijenborg PW, van den Bergh Weerman MA, van den Wijngaard RMJGJ, Verheij J, Smout AJPM, et al. Mucosal integrity and sensitivity to acid in the proximal esophagus in patients with gastroesophageal reflux disease. Am J Physiol Gastrointest Liver Physiol. 2016;311(1):G117-22.
- Tutuian R, Vela MF, Hill EG, Mainie I, Agrawal A, Castell DO. Characteristics of symptomatic reflux episodes on Acid suppressive therapy. Am J Gastroenterol. 2008;103(5):1090-6.
- Woodland P, Aktar R, Mthunzi E, Lee C, Peiris M, Preston SL, et al. Distinct afferent innervation patterns within the human proximal and distal esophageal mucosa. Am J Physiol Gastrointest Liver Physiol. 2015;308(6):G525-31.
- Exam 2: Superficial Esophageal Mucosal Afferent Nerves May Contribute to Reflux Hypersensitivity in Nonerosive Reflux Disease [Internet]. Vol. 153, Gastroenterology. 2017. P. e16. Disponible en: http://dx.doi.org/10.1053/j.gastro.2017.09.032
- Ustaoglu A, Nguyen A, Spechler S, Sifrim D, Souza R, Woodland P. Mucosal pathogenesis in gastro-esophageal reflux disease [Internet]. Vol. 32, Neurogastroenterology & Motility. 2020. Disponible en: http://dx.doi.org/10.1111/nmo.14022
- Sifrim D, Zerbib F. Diagnosis and management of patients with reflux symptoms refractory to proton pump inhibitors [Internet]. Gut. 2012;61:1340-54. Disponible en: http://dx.doi.org/10.1136/gutjnl-2011-301897
- Katzka DA, Pandolfino JE, Kahrilas PJ. Phenotypes of Gastroesophageal Reflux Disease: Where Rome, Lyon, and Montreal Meet [Internet]. Clinical Gastroenterology and Hepatology. 2020;18:767-76. Disponible en: http://dx.doi.org/10.1016/j.cgh.2019.07.015
- Roman S, Keefer L, Imam H, Korrapati P, Mogni B, Eident K, et al. Majority of symptoms in esophageal reflux PPI non-responders are not related to reflux [Internet]. Neurogastroenterology & Motility. 2015;27:1667-74. Disponible en: http://dx.doi.org/10.1111/nmo.12666
- Yadlapati R, Tye M, Keefer L, Kahrilas PJ, Pandolfino JE. Psychosocial Distress and Quality of Life Impairment Are Associated With Symptom Severity in PPI Non-Responders With Normal Impedance-pH Profiles. Am J Gastroenterol. 2018;113(1):31-8.
- Kahrilas PJ, Keefer L, Pandolfino JE. Patients with refractory reflux symptoms: What do they have and how should they be managed? Neurogastroenterol Motil. 2015;27(9):1195-201.
- Riehl ME, Keefer L. Hypnotherapy for Esophageal Disorders. Am J Clin Hypn. 2015;58(1):22-33.
- El-Serag H, Becher A, Jones R. Systematic review: persistent reflux symptoms on proton pump inhibitor therapy in primary care and community studies. Aliment Pharmacol Ther. 2010;32(6):720-37.
- Taft TH, Guadagnoli L, Carlson DA, Kou W, Keefer L, Pandolfino J. Validation of the Short-Form Esophageal Hypervigilance and Anxiety Scale. Clin Gastroenterol Hepatol. 2022;20(2):e64-73.
- Guadagnoli L, Yadlapati R, Taft T, Pandolfino JE, Tye M, Keefer L. Esophageal hypervigilance is prevalent across gastroesophageal reflux disease presentations. Neurogastroenterol Motil. 2021;33(8):e14081.
- Gagliardi D, Makihara S, Corsi PR, Viana A de T, Wiczer MV, Nakakubo S, et al. Microbial flora of the normal esophagus. Dis Esophagus. 1998;11(4):248-50.
- Pei Z. Bacterial biota in reflux esophagitis and Barrett’s esophagus [Internet]. Vol. 11, World Journal of Gastroenterology. 2005. P. 7277. Disponible en: http://dx.doi.org/10.3748/wjg.v11.i46.7277
- Yang L, Francois F, Pei Z. Molecular Pathways: Pathogenesis and Clinical Implications of Microbiome Alteration in Esophagitis and Barrett Esophagus: Figure 1 [Internet]. Clinical Cancer Research. 2012;18:2138-44. Disponible en: http://dx.doi.org/10.1158/1078-0432.ccr-11-0934
Correspondencia: Julieta Argüero
Correo electrónico: julieta.arguero@gmail.com
Acta Gastroenterol Latinoam 2022;52(2):135-152
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE