Romina Medeot1 ID· Javier Mena1 ID· Pablo Rodríguez2 ID· Pablo Herrera Najum2 ID· Luis López1 ID· María Soledad Muñoz1 ID
1 Staff bioquímico del área de microbiología. Servicio de Bioquímica. Instituto Modelo de Cardiología S.R.L.
2 Staff médico. Servicio de Gastroenterología. Instituto Modelo de Cardiología S.R.L.
Av. Sagrada Familia 359, Córdoba, Argentina.
Acta Gastroenterol Latinoam 2024;54(3):254-261
Recibido: 15/07/2024 / Aceptado: 25/09/2024 / Publicado online el 30/09/2024 /
https://doi.org/10.52787/agl.v54i3.423
Resumen
Introducción. El endoscopio es un tubo flexible con cámara y luz, usado para diagnosticar y tratar patologías digestivas. El reprocesamiento adecuado del endoscopio es esencial para prevenir infecciones, por lo que deben seguirse guías que incluyan lineamientos de limpieza, desinfección y almacenamiento. Objetivo. Comparar la eficacia del reprocesamiento manual y automatizado en videogastroscopios y videocolonoscopios mediante la vigilancia microbiológica de los siguientes microrganismos: Escherichia coli BLEE, Shigella spp., Salmonella spp., Pseudomonas aeruginosa, Klebsiella pneumoniae productora de carbapenemasa de tipo KPC y Enterococcus spp. vancomicina resistente. Materiales y métodos. Se realizó un estudio prospectivo, observacional y descriptivo en el que se seleccionaron 207 procedimientos de reprocesamiento de videogastroscopios y videocolonoscopios (103 manuales y 104 automatizados) y se evaluaron durante las etapas de pre y post reprocesamiento. Se cultivaron con propósito de aislar Escherichia coli beta lactamasa de espectro extendido, Shigella spp., Salmonella spp., Pseudomonas aeruginosa, Klebsiella pneumoniae productora de carbapenemasa y Enterococcus spp. vancomicina resistente. Resultados. En muestras pre reprocesamiento manual y automatizado se aislaron Escherichia coli BLEE (45% vs. 55%); Pseudomonas aeruginosa (36% vs. 18%); Salmonella spp. (18% en ambas) y 9% Enterococcus spp. vancomicina resistentes en el automatizado. Los resultados post reprocesamiento manuales arrojaron en el 1% recuentos de 1000 – 99.999 UFC/ml y en el 6% más de 100.000 UFC/ml. El automatizado refirió 7% más de 100.000 UFC/ml. Al comparar ambas modalidades, en 7/103 de las muestras manuales no se hallaron los patógenos investigados, al igual que en 6/104 de las muestras automatizadas. Solo se observó desarrollo de Staphylococcus coagulasa negativa, posible contaminante. No obstante, en una muestra automatizada se aisló Salmonella spp. Conclusión. Los resultados fueron similares con ambas metodologías. Se obtuvo desarrollo de un enteropatógeno en el reprocesamiento automatizado. Estos hallazgos permitirán replantear mejoras en los pasos del reprocesamiento, con la finalidad de mejorar los procedimientos.
Palabras claves. Endoscopios, reprocesamiento, contaminación.
Pre- and Post-Processing Evaluations of Manual and Automated Endoscopes: A Microbiological Isolation
Summary
Introduction. An endoscope is a flexible tube equipped with a camera and a light used for the diagnosis and treatment of digestive pathologies. Although healthcare-associated infections are uncommon, they represent a significant concern. Proper endoscope reprocessing is essential to prevent infections, requiring adherence to established guidelines for cleaning, disinfection, and storage. Objetive. To compare the effectiveness of manual and automated reprocessing of video gastroscopes and colonoscopes through microbiological monitoring of the following microorganisms: ESBL Escherichia coli, Shigella spp., Salmonella spp., Pseudomonas aeruginosa, Klebsiella pneumoniae carbapenemase (KPC)-producing, and vancomycin-resistant Enterococcus spp. Materials and Methods. A prospective, observational, descriptive study was conducted, in which 207 reprocessing procedures of video gastroscopes and colonoscopes were selected for evaluation. Of these, 103 were manual and 104 were automated. The procedures were evaluated in both the pre- and post-processing stages. Cultures were performed to isolate ESBL Escherichia coli, Shigella spp., Salmonella spp., Pseudomonas aeruginosa, Klebsiella pneumoniae carbapenemase (KPC)-producing, and vancomycin-resistant Enterococcus spp. Results. In the pre-reprocessing samples, ESBL Escherichia coli was isolated in 45% of cases, compared to 55% for manual and automated reprocessing, respectively. Similarly, Pseudomonas aeruginosa was isolated in 36% of cases for manual reprocessing and 18% for automated reprocessing. Salmonella spp. was isolated in 18% of cases for both manual and automated reprocessing. Finally, vancomycin-resistant Enterococcus spp. was isolated in 9% of automated reprocessing samples. The results of the manual post-processing demonstrated that 1% of the samples exhibited counts of 1,000–99,999 colony-forming units (CFU)/ml, while 6% exhibited counts exceeding 100,000 CFU/ml. The automated method demonstrated a 7% prevalence of samples with over 100,000 colony-forming units (CFU) per milliliter. A comparison of the two modalities revealed that pathogens were not identified in seven of the 103 manual samples and six of the 104 automated samples. The only growth observed in the automated samples was that of coagulase-negative Staphylococcus, which is a potential contaminant. However, one automated sample did yield Salmonella spp. Conclusion. The results obtained were comparable between the two methodologies. The automated reprocessing revealed the presence of an enteropathogen, which will allow for a reassessment of the reprocessing steps in order to enhance the efficacy of the procedures.
Keywords. Endoscopes, reprocessing, contamination.
Abreviaturas
IACS: Infecciones asociadas al cuidado de la salud.
DAN: Desinfección de alto nivel.
ENDIBA: Endoscopistas Digestivos de Buenos Aires.
BLEE: Betalactamasa de espectro extendido.
SS: Salmonella Shigella.
OPA: Ortoftaldehído.
ANMAT: Administración Nacional de Medicamentos, Alimentos y Tecnología Médica.
FDA: Food and Drug Administration.
Introducción
El endoscopio es un delgado tubo flexible, compuesto de lúmenes estrechos y múltiples canales internos, con una cámara y un haz de luz en su extremo, el cual se utiliza con fines diagnósticos y terapéuticos para muchas patologías. Puede comportarse como un vehículo de transmisión de agentes patógenos a un huésped susceptible, originando la aparición de una infección nosocomial o asociada al cuidado de la salud (IACS).1,2
Las IACS constituyen un grave problema sanitario debido al impacto asistencial, económico y social que generan, representando uno de los principales eventos adversos vinculados con la seguridad del paciente en la atención médica. Pueden ser endógenas, como consecuencia del arrastre o transferencia de la microbiota propia del paciente, o exógenas, provenientes del ambiente, del personal de salud o de otros pacientes, por contaminación del dispositivo.3,4,5
La incidencia de infecciones reportadas es muy baja, alrededor de 1 en 1,8 millones de procedimientos, pero cada vez más se encuentran reportes referidos a brotes o seudobrotes producidos por microorganismos multirresistentes.1,3,4,5,6 En muchas ocasiones la transmisión cruzada de microorganismos de un paciente a otro produce una colonización asintomática del huésped y, en otras, infecciones sintomáticas, como bacteriemias, colangitis, colecistitis o hepatitis.1
La carga microbiana encontrada en los endoscopios gastrointestinales después de su manipulación varía entre 105 a 1010 UFC/ml. El lavado adecuado reduce el número de microorganismos y restos orgánicos en 4 a 6 logaritmos, o 99,99%.3,6,7,8 La clasificación de Spaulding agrupa los endoscopios flexibles en semicríticos, debido a que toman contacto con las membranas mucosas en cavidades no estériles, y deben ser sometidos a una desinfección de alto nivel (DAN) entre pacientes para asegurar la eliminación de bacterias vegetativas, micobacterias, hongos y virus, exceptuando un pequeño número de bacterias esporuladas. Contrariamente, accesorios reutilizables empleados en el procedimiento, como pinzas de biopsias, son considerados críticos, por lo que deben esterilizarse.1,3,6,8 9
En la Argentina se encuentra vigente la guía de reprocesamiento de endoscopios y materiales accesorios creada por Endoscopistas Digestivos de Buenos Aires (ENDIBA).10 La mayoría de las normas recomiendan múltiples pasos: prelimpieza, limpieza, desinfección, enjuague, secado y almacenamiento. Se deben tener en cuenta detalles críticos para lograr su efectividad en cada paso, por lo cual es preciso contar con personal capacitado.10,11
El reprocesamiento puede realizarse de forma manual o automatizada. La literatura reporta ventajas respecto del segundo, debido a la protocolización de los pasos, la reducción de riesgos y de errores humanos, el contacto uniforme con el desinfectante y la disminución en la contaminación ambiental.12,13
En la literatura se hallan diversos reportes bibliográficos asociados al aislamiento de patógenos productores de infecciones exógenas en los dispositivos, como Salmonella spp., Pseudomonas aureginosa, Klebsiella pneumoniae, Enterobacter spp., Serratia marcescens, Helicobacter pylori, Clostridioides difficile, Mycobacterium spp., HBV, HCV, Strongyloides spp., Trichosporon spp. A su vez, entre las bacterias aisladas se encontraron diferentes mecanismos de resistencia, como betalactamasa de espectro extendido (BLEE) y carbapenemasas.1,3,9,10,13
El examen microbiológico permite un control minucioso del reprocesamiento, de sus pasos y de los posibles daños del dispositivo reutilizable, el cual puede favorecer la persistencia de los microorganismos.1,3,6,7,14
En la actualidad diferentes sociedades científicas del mundo poseen guías que recomiendan los procedimientos y la periodicidad de la realización de cultivos, pero aún no existe un consenso unánime sobre la necesidad de control y su metodología estandarizada.1,3,4,6,14
El objetivo del estudio fue realizar un análisis comparativo entre reprocesamiento manual y automatizado de videogastroscopios y videocolonoscopios, mediante la vigilancia microbiológica de los siguientes microrganismos: Escherichia coli BLEE, Shigella spp., Salmonella spp., Pseudomonas aeruginosa, Klebsiella pneumoniae productora de carbapenemasa tipo KPC y Enterococcus spp. vancomicina resistente, en el servicio de gastroenterología de nuestra institución.
Materiales y métodos
Se realizó un estudio prospectivo, observacional, descriptivo, en el que se analizaron 207 procedimientos. La evaluación se realizó en dos períodos: de septiembre a noviembre de 2017 se llevaron a cabo 103 reprocesamientos manuales, y de marzo a mayo de 2018, 104 automatizados. Este estudio de investigación se realizó en el servicio de Gastroenterología y Microbiología del Instituto Modelo de Cardiología S.R.L. en Córdoba Capital.
El personal técnico del servicio de Gastroenterología realizó los diferentes pasos del reprocesamiento según las indicaciones establecidas por el fabricante y las guías propuestas por la Organización Mundial de Gastroenterología y ENDIBA.9,10,15
En ambas técnicas, el detergente utilizado fue trienzimático (proteasa, lipasa, amilasa) marca Anios combinado con agentes tensioactivos, con propiedades desinfectantes y el DAN Ortoftaldehído. El reprocesamiento automatizado se realizó en el lavador Endo clean 2000, con tiempos estandarizados en cada paso, programa utilizado de 15 minutos totales.
Se tomaron muestras pre-reprocesamiento, una vez finalizado cada estudio endoscópico, y post-reprocesamiento en ambas técnicas. Los videogastroscopios y videocolonoscopios marca Olympus serie 160 y 180 utilizados se hisoparon en tres áreas: extremos proximales del cabezal tanto del canal de aire/agua como del canal de biopsia y extremo distal del tubo de inserción, se colocaron en 1 ml de medio líquido tioglicolato y en 1 ml de caldo selenito. Se incubaron 24 horas en estufa a 37º C. Luego se esparció 0,1 ml en placas de agar cromogénico para enterobacterias, orientativo colorimétrico y placas de agar Salmonella Shigella (SS), dejándose 48 hs en estufa a 37º C.
Como método de screening para la detección de los mecanismos de resistencia buscados, en las placas cromogénicas para enterobacterias se colocaron discos antibióticos de cefotaxima 30 µg, imipenem 10 µg, vancomicina 5 µg y ertapenem 10 µg.
Ante la presencia de colonias sospechosas, se realizaron las tipificaciones convencionales utilizando TSI, urea, citrato, SIM, aminoácidos y oxidasa. Las pruebas antibióticas empleadas para poner de manifiesto los posibles mecanismos de resistencia investigados se realizaron por el método de difusión Kirby Bauer en placas de Müller Hinton. Se emplearon discos de ceftazidima 30 µg, ceftazidima 30 µg + ácido clavulánico 10 µg, y cefotaxima 30 µg, cefotaxima 30 µg + ácido clavulánico 10 µg, para la búsqueda de diferencias mayores o iguales a 5 mm entre los respectivos halos de inhibición, poniendo en evidencia la presencia de BLEE. La pesquisa de carbapenemasa se realizó utilizando discos de imipenem 10 µg, ácido borónico 300 µg y meropenem 10 µg, dispuestos de forma tal que se evidenciara la distorsión del halo de inhibición.
Resultados
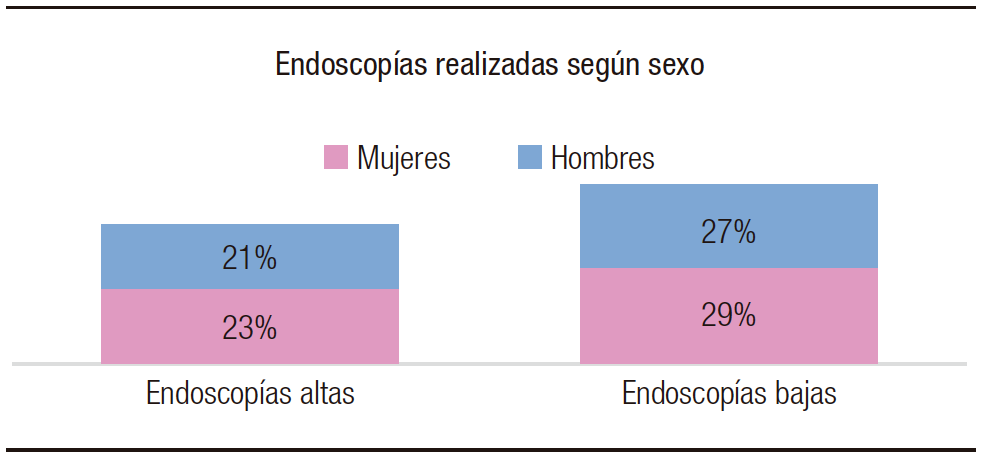
De los 207 procedimientos endoscópicos realizados, 91 (44%) correspondieron a endoscopias altas y 116 (56%) a endoscopias bajas. La población estudiada se dividió en 107 (52%) mujeres: 47 (23%) endoscopias altas; 60 (29%) endoscopias bajas y 100 (48%) y hombres: 44 (21%) endoscopias altas; 56 (27%) endoscopias bajas (Figura 1). Del total de los procedimientos, 103 reprocesamientos post-estudio fueron manuales y 104 automatizados.
Figura 1. Población estudiada según sexo, agrupados según el procedimiento endoscópico realizado, endoscopia alta y baja
Se realizaron 828 cultivos, de los cuales 414 fueron correspondieron a muestras pre-reprocesamiento como evaluación de las portaciones en endoscopios antes de su prelimpieza, y 414 cultivos post-reprocesamiento (206 pertenecientes a reprocesamiento manual y 208 automatizado), como vigilancia de los procedimientos realizados y la eficacia de la desinfección de alto nivel, sembrándose en partes iguales en agar cromogénico y agar SS.
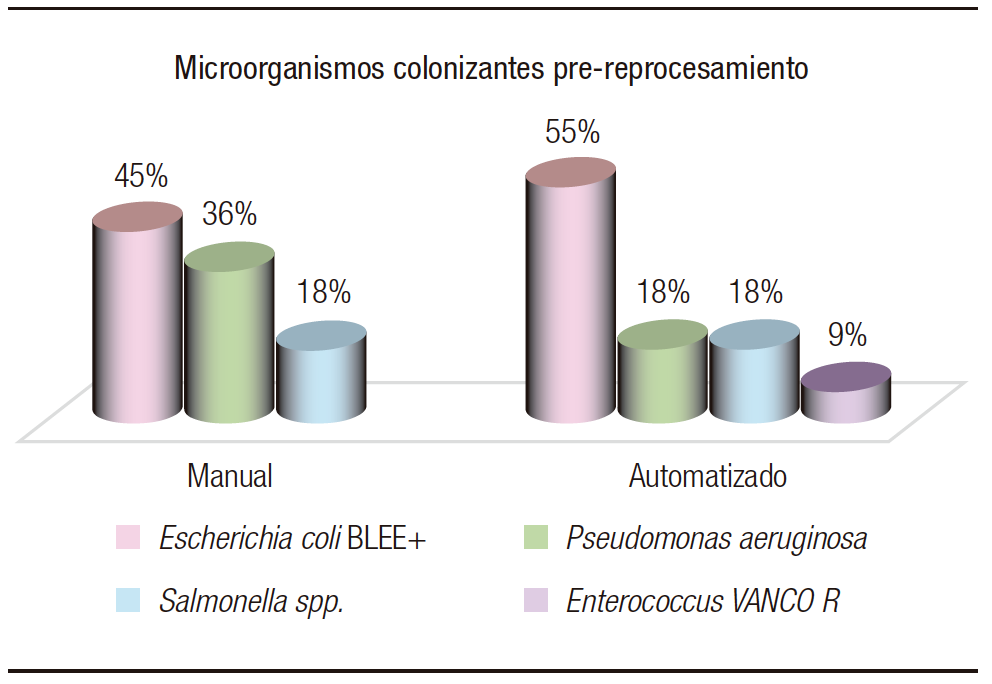
De las muestras obtenidas pre-reprocesamiento, se discriminó según el tipo de reprocesamiento realizado posteriormente (103 manuales y 104 automatizados). En relación con los microorganismos estudiados, se hallaron en pre-reprocesamiento manual: 45% (5) Escherichia coli BLEE, 36% (4) Pseudomonas aeruginosa, 18% (2) Salmonella spp. En cuanto a los automatizados, 55% (6) Escherichia coli BLEE, 18% (2) Pseudomonas aeruginosa, 18% (2) Salmonella spp. y 9% (1) Enterococcus spp. vancomicina resistente (Figura 2).
Figura 2. Microorganismos aislados de los cultivos realizados previos al reprocesamiento manual y automatizado
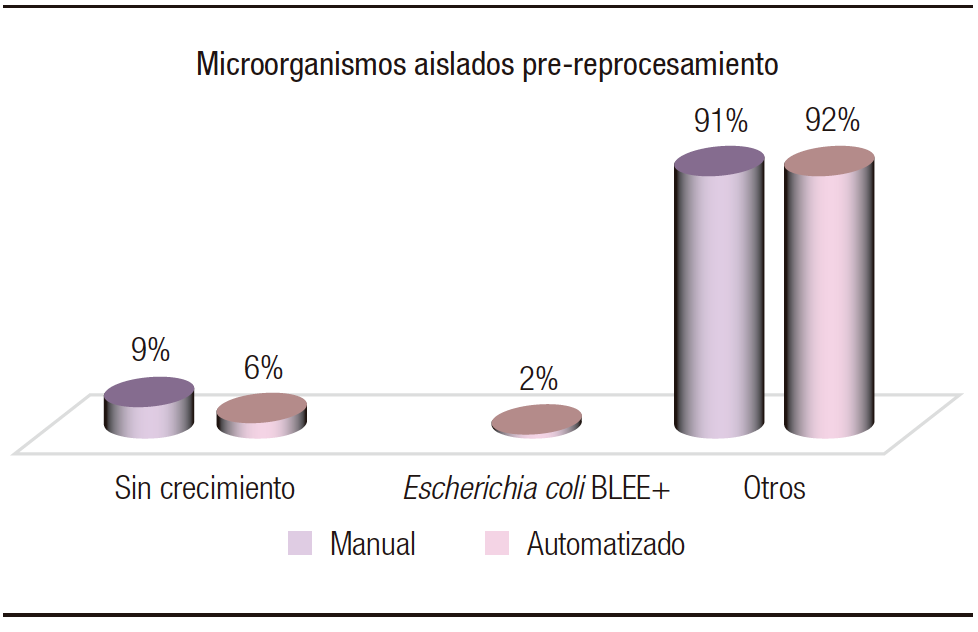
En relación con los tipos de endoscopías realizadas, en cuanto a los microorganimos colonizantes y el reprocesamiento al que luego se sometieron, se observó una escasa colonización de los microrganismos estudiados. Este hallazgo era esperable, ya que no son microbiota habitual orofaríngea (Figura 3). Con respecto al reprocesamiento manual, hubo un desarrollo de 91% (34) de otros microorganismos y 9% (4) sin crecimiento, en un total de 43 muestras tomadas. En cuanto al automatizado, se observó un crecimiento del 2% (1) de Escherichia coli BLEE, 92% (44) de otros microorganismos y 6% (3) sin desarrollo en 48 muestras tomadas. Si bien E. coli no es un colonizante orofaríngeo, su desarrollo puede deberse a un arrastre de la microbiota desde otra cavidad. El desarrollo en recuentos de 105 UFC/mL de otros microorganismos fue en su mayoría de Staphylococcus coagulasa negativos y Candida spp., microbiota habitual o posible contaminación en la manipulación de los operadores, sin relevancia para el estudio realizado.
Figura 3. Microorganismos patógenos colonizantes en endoscopías altas previo al reprocesamiento manual y el automatizado
En relación a de las endoscopías bajas (Figura 4), en los sometidos a reprocesamiento manual en muestras pre-reprocesamiento, el 8% (5) desarrollaron Escherichia coli BLEE, el 7% (4) Pseudomonas aeruginosa, el 3% (2) Salmonella spp., el 78% (47) otros microorganismos y el 3% (2) sin desarrollo, en un total de 60 muestras. En el reprocesamiento automatizado, se observó un 8% (5) de desarrollo de Escherichia coli BLEE, 4% (2) Pseudomonas aeruginosa, 4% (2) Salmonella spp., 2% (1) Enterococcus spp. vancomicina resistente, 80% (45) otros microorganismos y 2% (1) sin desarrollo. Se hallaron similares cantidades de microorganismos, con predominio de E. coli BLEE, colonizante habitual del intestino con un mecanismo de resistencia a penicilinas, cefalosporinas de 1º, 2º, 3º y 4º generaciones y aztreonam, ya instalado en pacientes ambulatorios desde hace varios años debido a diversas causas, como la interrupción de tratamientos antibióticos, la automedicación, el consumo de alimentos vacunos u ovinos que utilizan antimicrobianos para su crecimiento, entre otras situaciones.
Figura 4. Microorganismos patógenos colonizantes en endoscopias bajas previo al reprocesamiento manual y automatizado
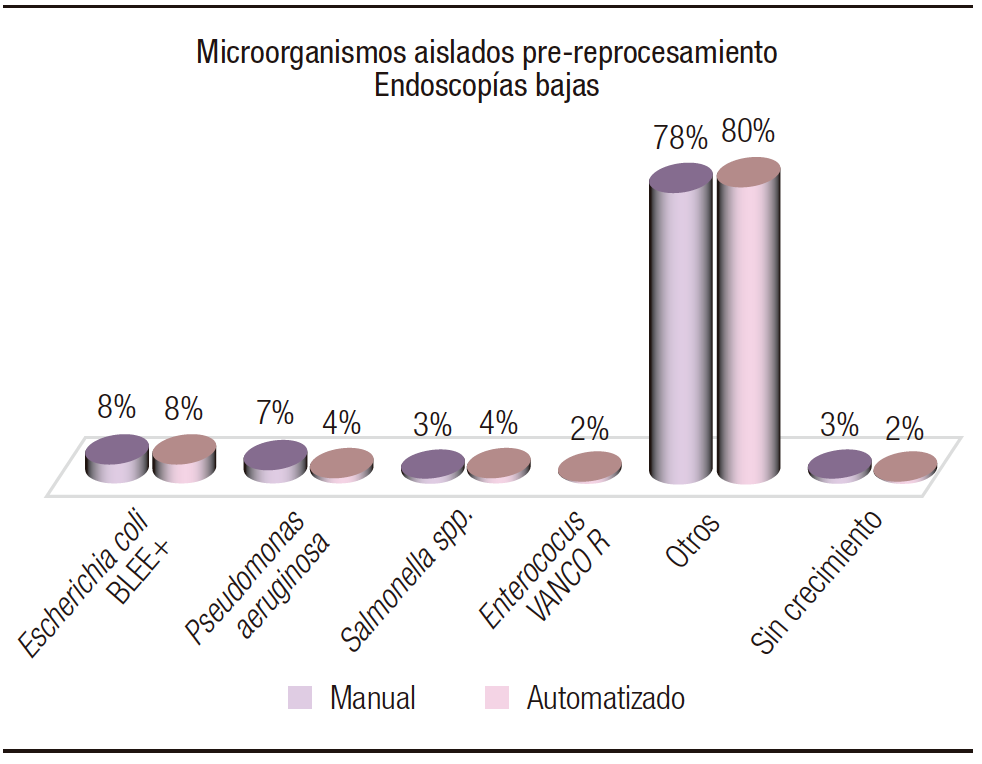
En cuanto al desarrollo de Pseudomonas spp., se atribuye a contaminaciones en drenajes de agua no filtrada o destilada, como el bidón para aspiración utilizado en el estudio. Salmonella spp. es un posible colonizante intestinal, al igual que Enterococcus spp., pero con menor frecuencia. Además, forma parte de los patógenos productores de gastroenteritis bacterianas.
En las endoscopías bajas, los microorganismos correspondientes a otros gérmenes desarrollados en recuentos relevantes fueron en gran mayoría Enterococcus spp., Escherichia coli, Proteus spp., Citrobacter freundii, Enterobacter cloacae, Staphylococcus spp y levaduras, formando parte de la microbiota del tracto intestinal.
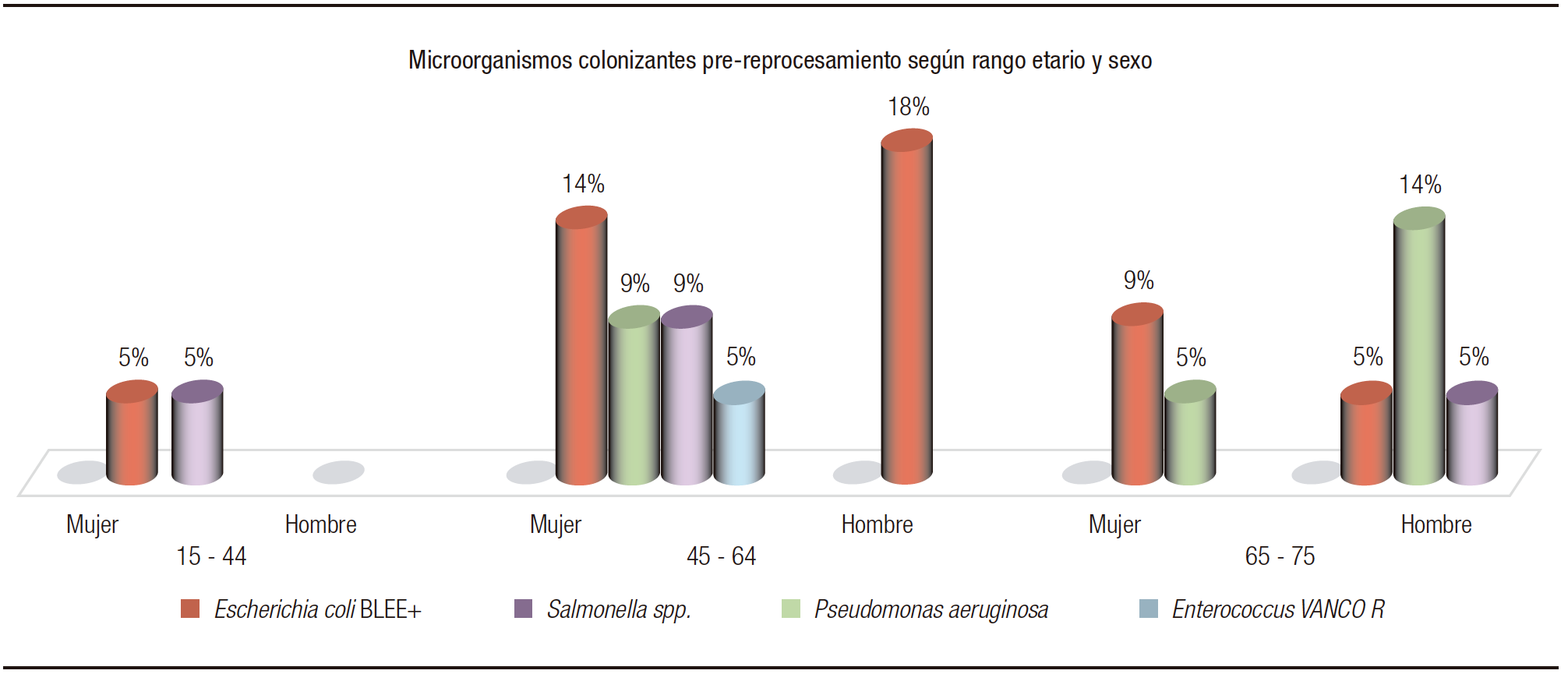
En cuanto al análisis del total de muestras pre reprocesamiento, según sexo y rangos etarios (Figura 5), se puede observar un aislamiento de 5% (1) de E. coli BLEE y 5% (1) Pseudomonas spp. en mujeres de 15 a 44 años; entre 44 a 60 años se obtuvo 14% (3) E. coli BLEE, 9% (2) Pseudomonas spp., 9% (2) Salmonella spp. y 5% (1) Enterococcus spp. vancomicina resistente; mientras que en hombres de esta edad un 18% (4) E. coli BLEE. En pacientes de 65 a 75 años, en mujeres 9% (2) E. coli BLEE, 5% (1) Pseudomonas spp.; y en hombres, 5% (1) E. coli BLEE, 14% (3) Pseudomonas spp., 5%(1) Salmonella spp.
Figura 5. Microorganismos colonizantes pre-reprocesamiento según rango etario y sexo
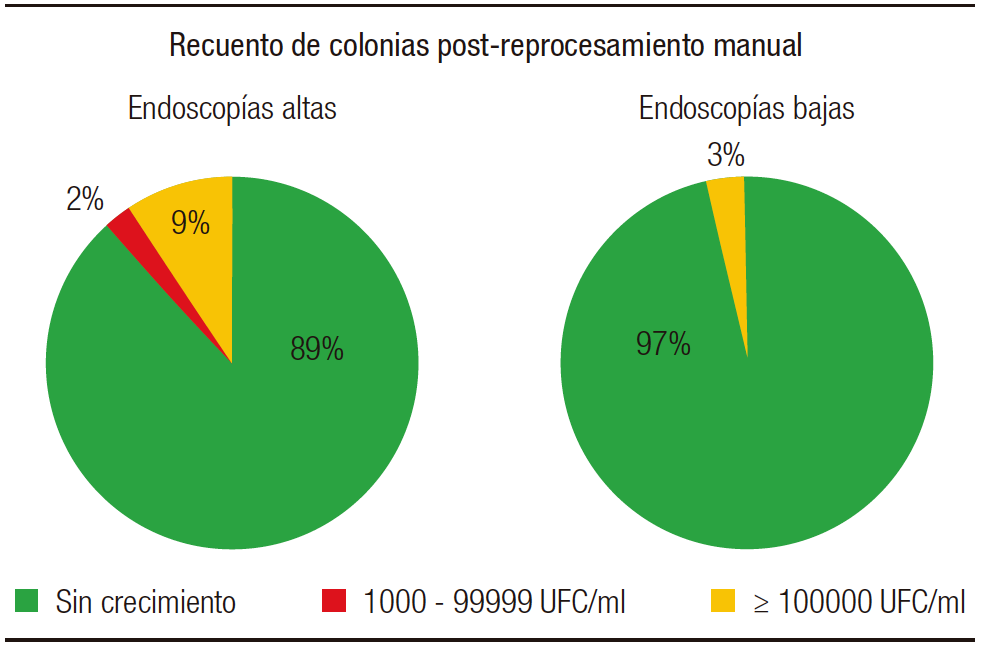
Con respecto a los resultados post-reprocesamiento manual (Figura 6), de un total de 103 muestras analizadas, 43 fueron provenientes de endoscopías altas, de las cuales 38 (89%) no desarrollaron, 1 (2%) desarrolló cultivo con recuento de 1000–99.999 UFC/ml y 4 (9%) en recuentos de más de 100.000 UFC/ml. En cuanto a las endoscopias bajas, de las 60 muestras procesadas, 58 (97%) no tuvieron crecimiento en los cultivos y 2 (3%) desarrollaron un recuento mayor a 100.000 UFC/ml. De estos 7/103 crecimientos obtenidos, no se hallaron ninguno de los patógenos buscados. Se obtuvo crecimiento de Staphylococcus coagulasa negativa, los cuales podrían ser provenientes de una contaminación por la manipulación de los mismos instrumentos.
Figura 6. Recuento de colonias obtenidas en muestras post-reprocesamiento manual
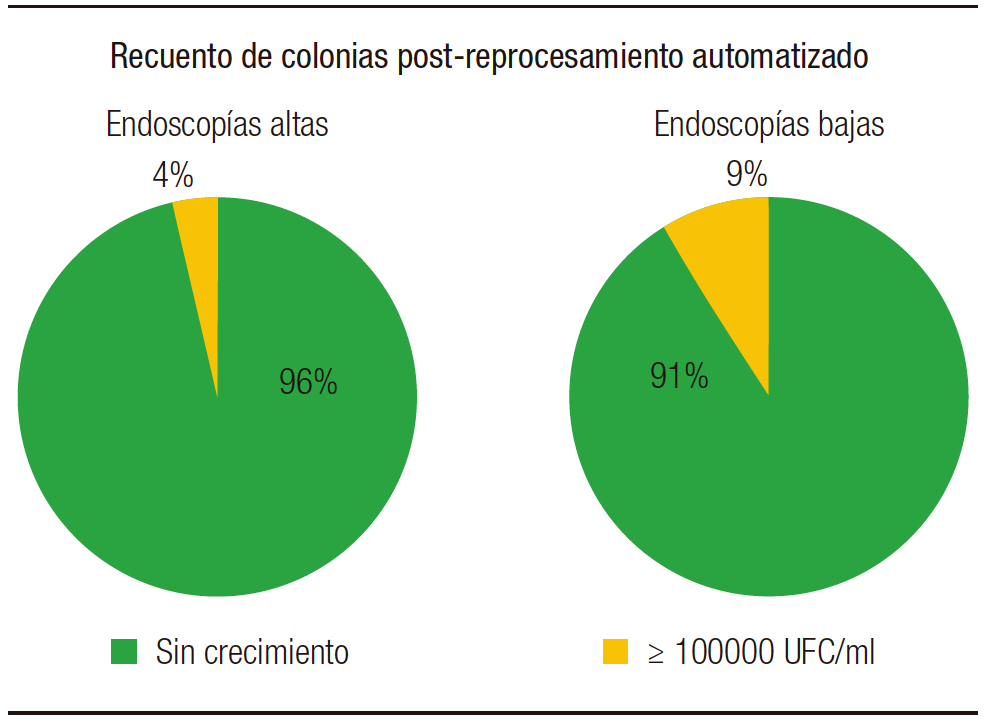
De un total de 104 muestras post-reprocesamiento automatizado (Figura 7), 48 fueron endoscopías altas, de las cuales 46 (96%) no desarrollaron y 2 (4%) desarrolló más de 100.000 UFC/ml. De 56 muestras de endoscopías bajas, 51 (91%) no tuvieron crecimiento en los cultivos y 5 (9%) desarrollaron un recuento mayor a 100.000 UFC/ml, siendo 1 (2%) tipificado como Salmonella spp. Las 6/104 cepas restantes fueron Staphylococcus coagulasa negativa.
Figura 7. Recuento de colonias obtenidas en muestras post-reprocesamiento automatizado
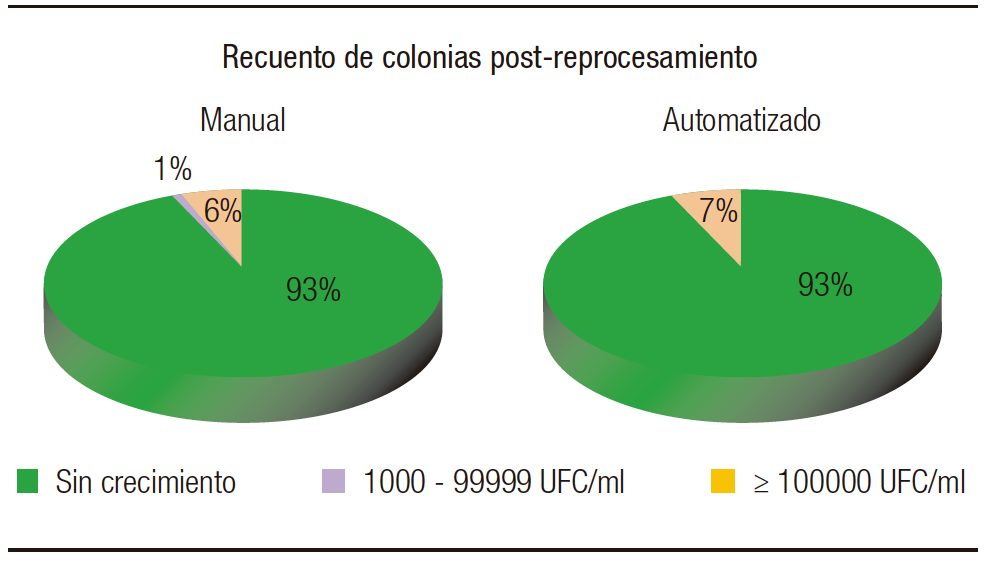
Al comparar los dos tipos de reprocesamientos (Figura 8), del manual se obtuvieron 7/103 desarrollos en recuento alto, sin un nuevo desarrollo de los patógenos aislados previamente. En cuanto al automatizado, 7/104 desarrollaron en recuentos de más de 105 UFC/mL, uno de los cuales corresponde al aislamiento de Salmonella spp., lo cual indica que el reprocesamiento y DAN no fueron adecuados. Cabe destacar que en cierto período del estudio la lavadora presentó fallas, por lo que fue reparada posteriormente; esta puede ser la causa más probable del desarrollo de este enteropatógeno. En el resto de los cultivos, 6/104 desarrollaron Staphylococccus coagulasa negativa, refiriendo a una contaminación en la toma o procesamiento de la muestra. En general, ambas formas de reprocesamientos fueron adecuadas.
Figura 8. Recuento de colonias post-reprocesamiento en metodología manual y automatizada
Discusión
Las infecciones exógenas pueden prevenirse cumpliendo correctamente los pasos de desinfección de endoscopios y materiales accesorios, dispuestos y normatizados por diferentes asociaciones a lo largo del mundo, con la finalidad de brindar un servicio seguro al paciente. Respecto del seguimiento de estas, el cultivo microbiológico es un punto importante dentro del control de calidad para la evaluación de la eficacia en el proceso y de la actividad de DAN.11,16,17,18 Permite establecer pautas de trabajo en la desinfección de endoscopios y determinar puntos críticos a reforzar y modificar en cuanto a las actividades diarias en el reprocesamiento y su mejora.
El DAN utilizado es ortoftaldehído (OPA) aprobado por Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) y la Food and Drug Administration (FDA).
La literatura presenta algunas guías en cuanto a estos controles, así como recomendaciones, pero aún no están establecidos como requisitos obligatorios. En la Argentina, no se cuenta con una normatización vigente en control microbiológico de endoscopios.
En el lavado manual, se utiliza agua potable en el servicio, lo cual puede ser una fuente de posible contaminación posterior a la desinfección por patógenos como Pseudomonas spp o Mycobacterium spp.1,8,17 Respecto del enjuague final, las guías sugieren aclarar el endoscopio, las válvulas e irrigar los canales con agua filtrada o, idealmente, agua estéril.
El lavado automático tiene entre sus beneficios filtros en los canales de entrada de agua de grifo, lo cual mejora la calidad del agua administrada en el proceso. Previo a comenzar el reprocesamiento, debe realizarse una prelimpieza manual para disminuir la materia orgánica residual presente en el dispositivo. Entre otras ventajas, esto optimiza y estandariza los tiempos del proceso, minimizando errores del personal, con programas prediseñados, y disminuye la exposición a desinfectantes nocivos e irritables para sus mucosas.19,20 Además, asegura una completa irrigación de todos los canales y depende en menor medida del personal encargado, quien puede realizar inadecuadamente alguna de las fases del proceso de desinfección.21 En un estudio multicéntrico se demostró que frecuentemente se producen determinados errores en el reprocesamiento manual, como tiempos de inmersión inferiores a los recomendados, insuficiente lavado de los canales o inmersión incompleta del endoscopio en el desinfectante, que conllevan una incorrecta desinfección.22 Los datos aportados en nuestro estudio reflejan una alta eficacia de ambos métodos de desinfección, sin diferencias significativas al comparar la desinfección manual con la automatizada.
El secado se realiza con aire forzado, lo que aumenta la efectividad del proceso de desinfección, permitiendo así inhibir la colonización por Pseudomonas aeruginosa y otros bacilos no fermentadores antes del almacenamiento del instrumento. Este paso se realiza correctamente en ambas técnicas.
Otro punto a modificar es la descontaminación de los recipientes de agua, considerados en diferentes publicaciones como portadores de altos recuentos bacterianos, en su mayoría con Pseudomonas aeruginosa, por lo cual se sugiere su esterilización.6,20,23
Conclusión
Los resultados arrojados en el trabajo demuestran una semejanza en las recuperaciones tanto de reprocesamientos manuales como automatizados. Discrepa el desarrollo de un enteropatógeno dentro de los microorganismos considerados en la investigación: Salmonella spp., recuperado en 1 de 104 reprocesamientos automatizados analizados. El resto de los patógenos obtenidos fueron Staphylococcus coagulasa negativos, en 7 de 103 procedimientos manuales y en 6 de 104 automatizados. Si bien hay modificaciones por realizar, al ser el primer control microbiológico, arrojó valores muy alentadores, en vista de buscar detalles donde realizar ajustes y cambios para mejorar el servicio brindado y la seguridad del personal.
Sería recomendable incorporar un programa de control de calidad microbiológico del reprocesamiento, que incluya una supervisión de los diferentes pasos, en cumplimiento de las normas dispuestas por las diferentes organizaciones, ajustado a las necesidades y recursos del servicio, como así también es necesaria la capacitación continua del personal involucrado.
Propiedad intelectual. Los autores declaran que los datos y las figuras presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2024 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Medeot, R, Mena, J, Rodríguez, P y col. Evaluaciónes pre y post reprocesamiento manual y automatizado de endoscopios: aislamiento microbiológico. Acta Gastroenterol Latinoam. 2024;54(3):254-261. https://doi.org/10.52787/agl.v54i3.423
Referencias
- Blázquez-Garrido RM, Cuchí-Burgos E, Martín-Salas C, Ruiz-Garbajosa P. Métodos microbiológicos para la monitorización de la limpieza, desinfección y esterilización de dispositivos médicos. Enferm Infecc Microbiol Clin [Internet]. 2018;36(10):657-61. Disponible en: http://dx.doi.org/10.1016/j.eimc.2017.09.012
- Juan H. Programa Nacional de Vigilancia de Infecciones Hospitalarias de Argentina (VIHDA). Áreas Críticas y Cirugía Programa Nacional. 2019;2020.
- Kovaleva J, Peters FT, Van Der Mei HC, Degener JE. Transmission of infection by flexible gastrointestinal endoscopy and bronchoscopy. Clinical Microbiology Reviews. 2013;26(2):231-54.
- Nelson DB. Infectious disease complications of Gl endoscopy: Part I, endogenous infections. Gastrointestinal Endoscopy. 2003;57(4):546-56.
- Lascano VM. Control de calidad microbiológico en la desinfección de colonoscopios, gastroscopios y broncoscopios. Trabajo Integrador Final (Especialista en Esterilización). Facultad de Ciencias Químicas. 2015.
- Robles C, Turín C, Villar A, Huerta-Mercado J, Samalvides F. Evaluación microbiológica de la desinfección de alto nivel de los endoscopios flexibles en un hospital general. Revista de Gastroenterología del Perú. 2014;34(2): 115-9:
- Rutala WA, Weber DJ. Guideline for Disinfection and Sterilization in Healthcare Facilities. North Carolina: CDC. 2008;158.
- Speer T. Actualización de la desinfección de endoscopios: guía para un reprocesamiento sensible a los recursos. WGO/WEO Global Guideline Endoscope Disinfection. World Gastroenterology Organisation. 2019.
- Diana Weinstock, Nadia Poczter, Lucía Daciuk y Analía Martínez. Consenso entre las siguientes Sociedades Científicas: Endoscopistas Digestivos de Buenos Aires-Sociedad Argentina de Infectología – Club Argentino de Esterilización. Guía de reprocesamiento de endoscopios y material accesorios [Internet]. 2014. Disponible en: http://www.endiba.org.ar/site/index.php/recursos/guias.
- Beilenhoff U, Neumann CS, Rey JF, Biering H, Blum R, Schmidt V, & null and the ESGE Guidelines Committee. ESGE-ESGENA guideline for quality assurance in reprocessing: microbiological surveillance testing in endoscopy. Endoscopy. 2007;39(02):175-81.
- Graziano KU, Pereira MEA, Koda E. Propuesta metodológica para la validación de la eficacia de la desinfección de un reprocesador automatizado de endoscopios flexibles. Revista Latino-Americana de Enfermagem. 2016.
- Sosa-Hernández Ó, Campos-Jiménez R. Relevancia del reprocesamiento de los endoscopios en el control de infecciones. Endoscopia [Internet]. 2019;31(4). Disponible en: http://dx.doi.org/10.24875/end.19000023.
- Shin SP, Kim WH. Recent update on microbiological monitoring of gastrointestinal endoscopes after High-Level disinfection. Clin Endosc [Internet]. 2015;48(5):369-73. Disponible en: http://dx.doi.org/10.5946/ce.2015.48.5.369.
- Manual sobre el método de endoscopía. Instrucciones de utilización asociadas con el sistema [Internet]. Disponible en: https:www.olympusoste.eu/media/contact_and_support/download/system_guides/W7052_803.pdf.
- Petersen BT, Chennat J, Cohen J, Cotton PB, Greenwald DA, Kowalski TE, et al. Multisociety guideline on reprocessing flexible GI endoscopes: 2011. Infect Control Hosp Epidemiol [Internet]. 2011;32(6):527-37. Disponible en: http://dx.doi.org/10.1086/660676.
- Spaulding EH, Groschel DH. Hospital disinfectants and antiseptics. Manual of clinical microbiology. Washington DC: American Society for Microbiology. 1974. Pp. 852-7.
- Argaraña Gerico A, Enriqueta H-S. Recomendaciones AEEED Limpieza y desinfección en endoscopía gastrointestinal. www.aeeed.com; 2013.
- Bradley CR, Babb JR. Endoscope decontamination: automated vs. manual. J Hosp Infect [Internet]. 1995;30Suppl:537-42. Disponible en: http://dx.doi.org/10.1016/0195-6701(95)90060-8 .
- Pérez DN, González IB, Pastor VP, Mateu PN, Bellver VO, Felis TS. y Viudez L A, editor. Comparación de la eficacia en la limpieza y desinfección de videoendoscopios: mecanizada frente a manual. 2000 23(9): 412-5.
- Alfa MJ, Olson N, DeGagne P. Automated washing with the Reliance Endoscope Processing System and its equivalence to optimal manual cleaning. Am J Infect Control [Internet]. 2006;34(9):561-70. Disponible en: http://dx.doi.org/10.1016/j.ajic.2006.01.010.
- Kaczmarek RG, Moore RM Jr, McCrohan J, Goldmann DA, Reynolds C, Caquelin C, et al. Multi-state investigation of the actual disinfection/sterilization of endoscopes in health care facilities. Am J Med [Internet]. 1992;92(3):257-61. Disponible en: http://dx.doi.org/10.1016/0002-9343(92)90074-l.
- Acosta-Gnass SI. Manual de esterilización para centros de salud. Pan American Health Org. 2008.
- Bader L, Blumenstock G, Birkner B, Leiss O, Heesemann J, Riemann JF, et al. HYGEA (Hygiene in gastroenterology-endoscope reprocessing): Study on quality of reprocessing flexible endoscopes in hospitals and in the practice setting. Zeitschrift fur Gastroenterologie. 2002;40(3):157-70.
Correspondencia: Romina Medeot
Correo electrónico: rominapmedeot@gmail.com
Acta Gastroenterol Latinoam 2024;54(3):254-261
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE