Agustina Vigilante,1 Patricia Saleg,1 Maira Orozco,2 Álvaro Alcaraz,1 Lucio R Obeide1
1Servicio de Cirugía General.
2Servicio de Diagnóstico por Imágenes. Hospital Privado de Córdoba. Córdoba, Argentina.
Acta Gastroenterol Latinoam 2017;47(2):131-136
Recibido: 18/07/2016 / Aprobado: 09/01/2017 / Publicado en www.actagastro.org el 03/07/2017
Resumen
La pancreatitis del surco o groove pancreatitis es una forma segmentaria de pancreatitis crónica caracterizada por la presencia de fibras cicatrizales en el área del surco pancreatoduodenal. Dada la infrecuencia de dicha patología y las dificultades que plantea su diagnóstico, se expone el caso de un varón de 64 años con antecedentes de tabaquismo severo y alcoholismo con dolor epigástrico inespecífico de 6 meses de evolución. Se realizaron análisis sanguíneos incluyendo marcadores tumorales donde sólo se detectó discreta elevación de las enzimas pancreáticas. En la colangiorresonancia se evidenció una lesión de aspecto sólido hipointensa en T1 y T2, ubicada entre la pared de la segunda porción duodenal y la cabeza del páncreas, compatible con pancreatitis del surco. Las biopsias de la mucosa duodenal fueron negativas para malignidad. Se inició tratamiento conservador con remisión de los síntomas y mejoría de las imágenes hasta el momento actual. Si bien es una entidad poco frecuente, debe tenerse presente en el diagnóstico diferencial de una masa pancreática, particularmente de cáncer de cabeza de páncreas, ya que tanto el tratamiento como el pronóstico difieren en gran medida.
Palabras claves. Surco pancreatoduodenal, pancreatitis del surco, cáncer de páncreas.
Groove pancreatitis: presentation of a clinical case and review of the literature
Summary
Groove pancreatitis is a segmental chronic pancreatitis characterized by the presence of fibrous scars in the anatomic space between the dorsocranial part of the head of the pancreas, the duodenum and the common bile duct. Being this disease unusual and difficult to diagnose, we report a case of a 64-year-old man with history of severe smoking and alcoholism who presented recurrent epigastric pain for 6 months. Blood tests, including tumour markers, only revealed slight elevation of serum pancreatic enzyme levels. Nuclear magnetic resonance detected a solid mass in the groove area, which was hypointense relative to the pancreatic parenchyma on T 1 and T 2 -weighted images, which supports the diagnosis of groove pancreatitis. Duodenal biopsies were negative for malignancy.
The patient was treated conservatively. Until now, the patient is free of symptoms and images have improved. Even though it is a rare disease, it should be reminded when we make the differential diagnosis of pancreatic mass, particularly pancreatic head carcinoma, as both treatment and prognosis differ greatly.
Key words. Pancreatoduodenal groove, groove pancreatitis, pancreatic cancer.
Abreviaturas
SPD: surco pancreatoduodenal.
IBP: inhibidores de la bomba de protones.
CEA: antígeno carcinoembrionario.
CA 19-9: antígeno carbohidrato.
TC: tomografía computada.
RMN: resonancia magnética nuclear.
ASGE: The American Society for Gastrointestinal Endoscopy.
La pancreatitis del surco o groove pancreatitis es una forma de pancreatitis crónica segmentaria caracterizada por la presencia de fibras cicatrizales en el área del surco pancreatoduodenal (SPD).1 Este surco está delimitado por la cabeza del páncreas, la tercera porción duodenal y el colédoco.1, 2
Es una entidad muy poco frecuente y su fisiopatología no está bien determinada. La importancia en la sospecha clínica radica en la dificultad que plantea para diferenciarla de otras patologías como el cáncer de páncreas, que se puede presentar en el mismo lugar anatómico y difiere en gran medida tanto en el tratamiento como en el pronóstico.
Presentamos el caso clínico de un paciente con pancreatitis del surco, sus características clínicas y radiológicas y los diagnósticos diferenciales que se plantearon.
Caso clínico
Varón de 64 años de edad con antecedentes de tabaquismo severo y alcoholismo. Ingresa a nuestra institución por dolor epigástrico inespecífico de 6 meses de evolución, sin mejoría luego de tratamiento prolongado con inhibidores de la bomba de protones (IBP). Tres años antes del episodio actual presentó cuadro de pancreatitis aguda alcohólica Ranson II, que resolvió con tratamiento médico. No registró pérdida de peso ni posee antecedentes familiares de cáncer.
La analítica demostró: amilasa 236 U/L, lipasa: 130 U/L y hepatograma normal. Los marcadores tumorales tampoco registraron elevación [antígeno carcinoembrionario (CEA) 4,2 ng/ml y antígeno carbohidrato 19-9 (CA 19-9) 29 U/ml].
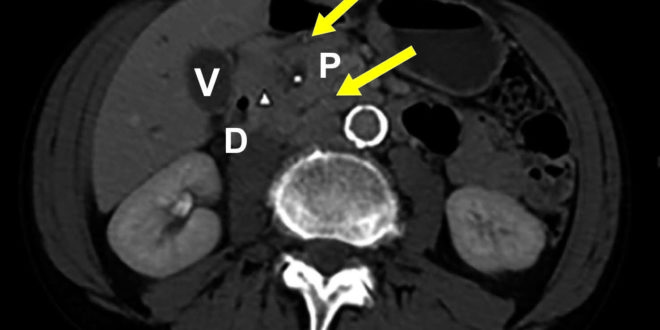
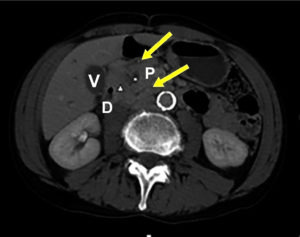
Se realizó una endoscopia digestiva alta que informó esofagitis ulcerada sin sangrado activo, por lo cual se inició tratamiento con IBP sin mejoría del dolor epigástrico. Las biopsias de la mucosa duodenal fueron negativas para malignidad. Se decide realizar una tomografía computada (TC) donde se detectó engrosamiento y tumefacción del plano graso del SPD de 11 mm, con realce tardío. El páncreas era de tamaño y morfología normales, con dilatación del conducto de Wirsung (4 mm) y del conducto de Santorini. Se evidenció una lesión quística de 14 x 9 mm a nivel cefálico, sin realce, con múltiples tabiques finos, de bordes irregulares y presencia de algunos ganglios infracentimétricos regionales. El colédoco de 6 mm de diámetro, con calibre irregular en su porción distal (Figura 1).
Figura 1. TC abdominal C/CTE EV (cortes axiales), en fase arterial (a) y tardía (b): engrosamiento y tumefacción del plano graso del surco pancreatoduodenal de 11 mm, con realce tardío (punta de flecha). Lesión quística de 14 mm a nivel cefálico, sin realce, con múltiples tabiques finos, de bordes irregulares (asterisco). Dilatación del conducto de Wirsung y del conducto de Santorini (flechas). D: duodeno; P: páncreas; V: vesícula.
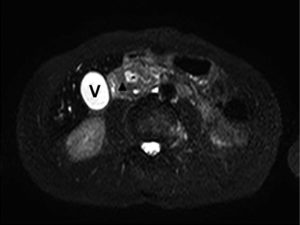
Se discutió el caso y se sospechó un tumor de páncreas vs pancreatitis del surco. Posteriormente se realizó una resonancia magnética nuclear (RMN) que informó moderada dilatación de la vía biliar extrahepática, midiendo el colédoco 8 mm. Se detectó una lesión de aspecto sólido ubicada entre la pared de la segunda porción duodenal y la cabeza del páncreas, sin presentar un claro plano de clivaje con este último, hipointensa en T1 y T2, de aproximadamente 11 mm de diámetro. En la cabeza pancreática se observó un quiste de 13 mm de diámetro (ya visualizado en un estudio tomográfico previo). El conducto de Wirsung se encontró dilatado con un diámetro de 5 mm y el duodeno con leve engrosamiento edematoso en su segunda porción (Figura 2). Los hallazgos en la RMN hicieron sospechar la pancreatitis del surco.
Ante el cuadro clínico sin síntomas de alarma, el laboratorio sin alteraciones de magnitud, con imágenes (TC y RM) altamente sugestivas del diagnóstico, se decidió tratamiento médico sólo con analgésicos.
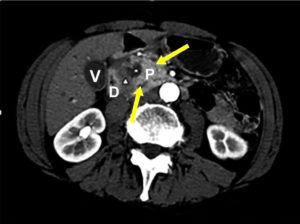
En los controles realizados a los 6 meses siguientes, el paciente permaneció asintomático, sin alteraciones analíticas. Se realizó una nueva TC donde se observa una franca mejoría de las imágenes radiológicas comparadas con el examen tomográfico previo. Se redujo el espesor del SPD de 11 a 7 mm de espesor y el calibre del conducto de Wirsung de 5 mm a 3,5 mm a nivel de istmo. Se comprueba también resolución de la lesión de aspecto lacunar-quístico, cefálico pancreático (de 13 mm a desaparición completa) (Figura 3).
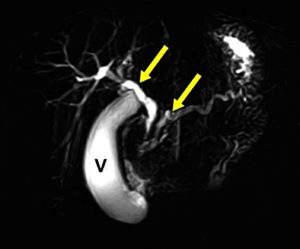
Figura 2. RMN. (A) Corte axial T2 con supresión grasa. (B) Colangiografía. Lesión de aspecto sólido, hipointensa, ubicada entre la pared de la segunda porción duodenal y la cabeza del páncreas, de aproximadamente 11 mm de diámetro (punta de flecha). En la cabeza pancreática, quiste de 13 mm de diámetro (asterisco). Dilatación del conducto de Wirsung y el colédoco (flechas). Leve engrosamiento edematoso del duodeno en su segunda porción. V: vesícula.
Figura 3. TC abdominal C/CTE EV (corte axial), en fase arterial. Disminución del espesor del «surco pancreatoduodenal” (punta de flecha), reducción del calibre del conducto de Wirsung, no se observan lesiones focalizadas en el páncreas. D: duodeno; P: páncreas; V: vesícula.

Discusión
La pancreatitis del surco o groove pancreatitis es una forma de pancreatitis crónica segmentaria caracterizada por la presencia de fibras cicatrizales en el área del SPD.1 Se encuentra delimitada por la cabeza pancreática medialmente, el duodeno descendente lateralmente, la tercera porción duodenal o vena cava inferior posteriormente, y la primera porción duodenal y el antro gástrico anteriormente. Pueden hallarse en esta zona pequeños ganglios linfáticos que generalmente no se detectan por técnicas de imagen.3
Esta región puede ser asiento de diversas patologías difíciles de diferenciar a pesar de los aportes de los estudios por imágenes. En la mayoría de los casos el diagnóstico se realiza con la anatomía patológica posterior a una duodenopancreatectomía.
La pancreatitis del surco, también conocida como distrofia quística de la pared duodenal, fue descrita inicialmente por Becker y Bauchspeichel en 1973 y clasificada posteriormente en una forma pura y una forma segmentaria, según afecte al área del surco exclusivamente o, además, a la porción dorsocraneal de la cabeza pancreática, respectivamente.4, 5 Se presenta generalmente en varones entre 40-50 años de edad con historia de abuso de alcohol.6 En nuestro caso se trata de un paciente masculino enolista de 64 años.
En la mayoría de los casos la clínica se caracteriza por dolor abdominal postprandial en epigastrio o mesograstrio, acompañado de vómitos y pérdida ponderal, probablemente debido a la alteración en la motilidad intestinal y a una estenosis del duodeno. Si bien puede aparecer ictericia secundaria a la compresión del colédoco, es poco frecuente y característica de los procesos neoplásicos. Los síntomas duran desde algunas semanas hasta más de un año, pueden ser intermitentes o ir incrementándose y, en algunas ocasiones, cursa de forma asintomática, como un hallazgo en estudios por imágenes. Nuestro paciente presentó sólo dolor epigástrico inespecífico de 6 meses de evolución, sin pérdida de peso, vómitos o ictericia.
En la analítica se suele detectar una leve elevación de las enzimas pancreáticas y, algunas veces, elevación de las enzimas hepáticas.4, 5 Los marcadores tumorales CEA y CA 19-9 no suelen estar elevados.7 Coincidiendo con lo publicado en la literatura, en nuestro paciente se objetivó un registro de amilasa y lipasa levemente alterado en el hepatograma y marcadores tumorales dentro de valores normales.
La patogenia no está claramente definida. Se propone que esta entidad estaría relacionada a una interrupción en la salida del jugo pancreático. Cuando esto ocurre por alguna razón, el jugo pancreático se dirige retrógradamente hacia el cuerpo pancreático, estancándose en esta localización y provocando pancreatitis en el área del SPD. Shudo y col indican que un conducto de Santorini anómalo podría ser uno de los factores más importantes involucrados, principalmente en la forma segmentaria de la enfermedad.4, 5 En pacientes que consumen alcohol de forma crónica, la presencia de un jugo pancreático más espeso y rico en proteínas asociado a la hiperplasia de las glándulas de Brunner obstruirían la salida del jugo pancreático.8 Se han descrito otros factores probablemente relacionados como úlceras pépticas, resección gástrica, quistes verdaderos en la pared duodenal y heterotopía pancreática en el duodeno.3
En los estudios anatomopatológicos es característico encontrar una pared duodenal engrosada con cambios seudoquísticos y reacción estromal adyacente, hiperplasia de las glándulas de Brunner, proliferación mioide densa estromal y excedente de fibrosis en el área del surco.6 Este engrosamiento y la fibrosis de la pared duodenal cerca de la papila menor suelen condicionar una estenosis de la segunda porción del duodeno. El parénquima de la cabeza pancreática inicialmente no está comprometido, pero con el progreso de la enfermedad, la fibrosis avanza y afecta esta región, causando dilatación del conducto pancreático principal. Estos cambios anátomo-patológicos descritos son comunes a otras enfermedades como la distrofia quística de la pared duodenal, la distrofia quística del páncreas heterotópico, el hamartoma pancreático del duodeno y la mioadenomatosis. De ahí que algunos consideren que la pancreatitis del surco pertenece a estas entidades.2-6
Los estudios por imágenes utilizados, como la ecografía, TC, RMN o la colangiopancreatografía retrógrada endoscópica (CPRE), pueden dar, en su conjunto, el diagnóstico de pancreatitis del surco. Sin embargo, éste depende fundamentalmente de la opinión de los médicos imagenólogos, su experiencia en esta patología y la comunicación de la sospecha diagnóstica al médico que evalúa y está realizando el seguimiento clínico de estos pacientes.
Las características imagenológicas tanto en la ecografía como en la CPRE son similares y varían en función del curso de la enfermedad, según predomine la inflamación (etapa aguda) o la fibrosis (etapa crónica).
Los hallazgos por ecografía abdominal son frecuentemente un engrosamiento de la pared duodenal con estenosis de su luz, hipoecogenicidad en el área del surco (signo de inflamación) con alguna lesión quística y una moderada dilatación del colédoco. En las etapas crónicas del proceso, el engrosamiento en forma de banda hipoecoica se sustituye por una banda hiperecoica en el sitio del surco con engrosamiento hiperecoico del duodeno y una cabeza de páncreas cada vez más hiperecogénica.7 Actualmente, algunos autores proponen la ecografía endoscópica como técnica diagnóstica de elección debido a una mayor sensibilidad (hasta un 86%) y especificidad.9 Este método nos permitiría fundamentalmente la obtención de material para su histología, además de proporcionarnos imágenes tales como un engrosamiento parietal del borde interno de la segunda porción duodenal, presencia de formaciones quísticas generalmente en la cuarta capa de la pared duodenal y/o un ducto que conecta aquéllas con la luz intestinal.
En la CPRE puede visualizarse una estenosis sutil del conducto pancreático principal y la vía biliar inferior estrecha, que a veces puede ser difícil de diferenciar del estrechamiento irregular del conducto común que se observa en las neoplasias.7 Sin embargo, la realización de este estudio muchas veces puede verse complicada por la disminución de la luz duodenal.
Los hallazgos en la TC de un paciente con pancreatitis del surco difieren según se trate de la forma segmentaria o la forma pura. En la forma pura, el aspecto puede variar desde grasa mal definida y cambios inflamatorios en el SPD, hasta tejido graso francamente hipodenso. Este tejido de densidad de partes blandas tiene, frecuentemente, una forma de lámina semilunar curvilínea.10 Tiende a ser poco captante en función del componente fibroso, debido a que su presencia determina un enlentecimiento de la circulación y de la difusión del contraste yodado al espacio intersticial. Puede apreciarse también engrosamiento de la pared duodenal media y cambios quísticos, tanto en la pared duodenal engrosada como en la zona del SPD. No se visualizan alteraciones morfológicas en la cabeza pancreática.11 En la forma segmentaria, la lesión de densidad de partes suele ser más extensa, rodeando la cabeza pancreática. En el interior de la cabeza del páncreas pueden observarse áreas hipodensas correspondientes a focos de pancreatitis crónica y lesiones quísticas.1-11 Esta imagen hace sospechar que se trate de un adenocarcinoma pancreático, por lo cual es necesario una alta sospecha previa para diferenciar ambas entidades. En ambas formas, el conducto biliar común puede aparecer atenuado y estrecho, generalmente de forma suave y regular, sin stop abruptos. Independientemente de la forma específica de pancreatitis del surco, el cambio inflamatorio difuso retroperitoneal visto en las pancreatitis agudas edematosas suele estar ausente. Es raro visualizar líquido libre en los espacios pararrenales o peripancreáticos, y el cambio inflamatorio difuso suele ser mínimo.10, 12
Los hallazgos en la RMN reflejan en gran medida los encontrados en la TC. El tejido blando que se encuentra en el SPD suele ser hipointenso en relación al parénquima pancreático en las imágenes ponderadas en T1, e isointenso o ligeramente hiperintenso en las imágenes ponderadas en T2, con realce tardío tras la administración de gadolinio. La intensidad del tejido en T2 puede variar ampliamente dependiendo de la agudeza del proceso. En la fase aguda el tejido tiene a ser más hiperintenso en T2 debido al edema y el líquido, disminuyendo la intensidad con el tiempo debido a la acumulación de tejido fibrótico. Esto es bien notable en los estudios de control luego de la sospecha diagnóstica de esta patología.13, 14
En nuestro caso, si bien estos hallazgos fueron compatibles con el diagnóstico de pancreatitis del surco, plantearon la necesidad de descartar cáncer de cabeza de páncreas, dado que ambas entidades poseen gran similitud en cuanto a sus características clínicas y radiológicas, pero difieren ampliamente en su manejo y en su pronóstico. En cuanto a la clínica, nuestro paciente no presentó ictericia ni pérdida de peso, a diferencia de los pacientes con carcinoma, que generalmente sufren importante pérdida ponderal e ictericia progresiva. Con respecto a las imágenes resultó muy difícil diferenciar ambas patologías. La lesión hipointensa con realce tardío en el SPD es similar a la hallada en estas neoplasias, sobre todo si el componente fibroso es importante (como, por ejemplo, en el adenocarcinoma escirro).3 Los quistes y la estenosis duodenal con cicatrización de la pared pueden estar presentes en ambas entidades, pero suelen ser más frecuentes en la pancreatitis del surco.8 La irregularidad del calibre del colédoco en su porción distal generó grandes dudas dado que, como se mencionó anteriormente, en la pancreatitis del surco el afilamiento es progresivo y liso, mientras que en el carcinoma es abrupto, irregular y circunscrito.2, 3-5
Si bien no se realizó una ecoendoscopía y una punción por falta de disponibilidad en nuestro medio, hubiera sido de gran utilidad contar con dichos recursos para alcanzar el diagnóstico. Por lo expresado anteriormente, dado el estado clínico favorable del paciente y la experiencia del equipo actuante en manejo de patología pancreática, se decide en forma multidisciplinaria adoptar una conducta conservadora. El paciente recibe sólo tratamiento sintomático y es controlado durante 6 meses, comprobando mejoría clínica y radiológica.
Concluimos en subrayar la importancia de tener presente esta entidad en el diagnóstico diferencial en pacientes con sospecha de masa pancreática. Al ser una patología benigna, permite ante un cuadro clínico altamente sugestivo realizar tratamiento conservador, reservando la conducta quirúrgica a aquellos casos donde no se puede excluir en forma categórica la posibilidad de una neoplasia. Es importante destacar el aporte de los estudios por imágenes, que, junto a la sospecha clínica, nos permiten llegar al diagnóstico de esta patología.
Referencias
- Becker V. Proceedings: Fundamental morphological aspects of acute and chronic pancreatitis. Langenbecks Arch Surg 1973; 334: 317-322.
- Gabata T, Kadoya M, Terayama N, Sanada J, Kobayashi S, Matsui O. Groove pancreatic carcinomas: radiological and pathological findings. Eur Radiol 2003; 13: 1679-1684.
- Yu J, Fulcher AS, Turner MA, Halvorsen RA. Normal anatomy and disease processes of the pancreatoduodenal groove: imaging features. AJR 2004; 183: 839-846.
- Shudo R, Yazaki Y, Sakurai S, Uenishi H, Yamada H, Sugawara K, Okamura M, Yamaguchi K, Terayama H, Yamamoto Y. Groove pancreatitis: report of a case and review of the clinical and radiologic features of groove pancreatitis reported in Japan. Intern Med 2002; 41: 537-542.
- Shudo R, Obara T, Tanno S, Fujii T, Nishino N, Sagawa M, Ura H, Kohgo Y. Segmental groove pancreatitis accompanied by protein plugs in Santorini’s duct. J Gastroenterol 1998; 33: 289-294.
- Adsay NV, Zamboni G. Paraduodenal pancreatitis: a clinicopathologically distinct entity unifying cystic dystrophy of heterotopic pancreas, para-duodenal wall cyst, and groove pancreatitis. Semin Diagn Pathol 2004; 21: 247-254.
- Yamaguchi K, Tanaka M. Groove pancreatitis masquerading as pancreatic carcinoma. Am J Surg 1992; 163: 312-316.
- Stolte M, Weiss W, Volkholz H, Rosch W. A special form of segmental pancreatitis: groove pancreatitis. Hepatogastroenterology 1982; 29: 198-208.
- Dominguez-Muñoz JE. Acute pancreatitis. Gastroenterol Hepatol 2006; 29: 77-84.
- Kwak SW, Kim S, Lee JW, Lee NK, Kim CW, Yi MS, Kim GH, Kang DH. Evaluation of unusual causes of pancreatitis: role of cross sectional imaging. Eur J Radiol 2009; 71: 296-312.
- Itoh S, Yamakawa K, Shimamoto K, Tokiko E, Takeo I. CT findings in groove pancreatitis: correlation with histopathological findings. J Comput Assist Tomogr 1994; 18: 911-915.
- Shanbhogue AKP, Fasih N, Surabhi VR, Doherty GP, Shanbhogue DKP, Sethi, SK. A clinical and radiologic review of uncommon types and causes of pancreatitis. Radio Graphics 2009; 29: 1003-1026.
- Castell-Monsalve FJ, Sousa-Martin JM, Carranza-Carranza A. Groove pancreatitis: MRI and pathologic findings. Abdom Imaging 2008; 33: 342-348.
- Pérez M, Quiroga S, Torné M, Tous F, Quiroga S, Sebastià MC. Groove pancreatitis: hallazgos con TC helicoidal. Radiología 2003; 45:193-197.
- Raman S, Salaria S, Hruban R, Fishman E. Groove Pancreatitis: Spectrum of Imaging findings and radiology-pathology correlation. AJR Am J Roentgenol 2013; 201: W29-W39.
- Bartolomea C, Díaz FF, Rodriguez FR, Marchena GJ. Pancreatitis del surco y su diagnóstico diferencial con el adenocarcinoma de pancreas. Gastroenterol Hepatol 2009; 32: 22-28.
- Malde D, Oliveira-Cunha M, Smith MA. Pancreatic Carcinoma Masquerading as Groove Pancreatitis: Case Report and Review of Literature. JOP. J Pancreas 2011; 12: 598-602.
- Araújo-Fernández S, Fernández-Villaverde A, González-Vázquez M, de la Fuente-Aguado J. Pancreatitis del surco. Galicia Clin 2014; 75: 22-23.
Tezuka K, Makino T, Hirai I, Kimura W. Groove Pancreatitis. Dig Surg 2010; 27: 149-152.
Correspondencia: Agustina Vigilante
San Luis 145 16C (CP 5000), Córdoba Capital. Argentina.
Correo electrónico: agustinavigilante@gmail.com
Acta Gastroenterol Latinoam 2017;47(2):131-136
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE