Gustavo Calle,1 David Andrade,2 Juan Quevedo,2 Diego Jiménez,2 Fernando Benítez,2 Rubén Duque 2
1 Hospital del IESS José Carrasco Arteaga y Universidad del Azuay, Cuenca, Ecuador.
2 Hospital del IESS José Carrasco Arteaga. Cuenca, Ecuador.
Acta Gastroenterol Latinoam 2017;47(2):92-98
Recibido: 18/07/2016 / Aprobado: 12/10/2016 / Publicado en www.actagastro.org el 03/07/2017
Resumen
Últimamente se ha dado un cambio del paradigma en el manejo de las colecciones que complican un episodio de pancreatitis aguda, pasando de la cirugía a los procedimientos mínimamente invasivos como la endoscopía. Se ilustra el caso de una necrosectomía pancreática endoscópica guiada por ultrasonido en la cual se colocó una prótesis de metal totalmente cubierta de bordes amplios específicamente dedicada para esta tarea; tras el éxito técnico y clínico inicial del procedimiento se la deja en espera que se colapse la colección y ésta se resuelva. Sin embargo, durante el seguimiento clínico, esta prótesis migra intracavitariamente quedando embebida en su interior. Se presenta el video completo del caso*, su resolución clínica y su discusión.
Palabras claves. Pancreatitis aguda necrotizante, prótesis metálica cubierta autoexpansible, ultrasonido endoscópico, necrosectomía pancreática endoscópica.
*Link del video: https://youtu.be/uwV6840pAJY
Spontaneous elimination of a fully-covered biflanged metal stent migrated and embedded into pancreatic cavity after endoscopic pancreatic necrosectomy
Summary
Lately there has been a paradigm shift in the management of collections that complicate an episode of acute pancreatitis, from surgery to minimally invasive procedures such as endoscopy. We show an endoscopic pancreatic necrosectomy guided by ultrasound, in which a fully covered biflanged metal stent (BFMS) specifically dedicated to this task was used, after initial technical and clinical success of the procedure, this stent is left in placed waiting the completely collapse of the collection and this resolution. However, during the clinical follow-up, this stent migrates into the cavity and got embedded. A full video of the case* is presented, its clinical resolution and discussion.
Key words. Acute necrotizing pancreatitis, self expandable metallic stents, endosonography, endoscopic necrosectomy, dislodged cystgastrostomy stent.
Abreviaturas
BFMS: stent de metal biflocado completamente cubierto.
El tratamiento endoscópico de las colecciones post pancreatitis aguda está bien establecido.1 Inicialmente dedicado a drenar los pseudoquistes con excelentes resultados2, 3 pero que útilmente han sido los pacientes con necrosis encapsulada sintomática los que se han beneficiado;4–6 combinado a la necrosectomía endoscópica, llega a superar a la cirugía por su simplicidad, menor mortalidad, morbilidad e igual tasa de éxito,7–9 todo esto gracias a la evolución de la técnica, la aparición de nuevos materiales como las prótesis (stents) metálicas cubiertas dedicadas y a la implementación del ultrasonido endoscópico lineal.10
Este proceder es estándar en nuestro hospital desde hace corto tiempo; tenemos apenas 7 necrosectomías guiadas por ultrasonido y con la colocación de este tipo de stents, de los cuales hemos tenido 2 migraciones, un caso de mal posicionamiento por un problema técnico que requirió cirugía y otro paciente que tras drenar la colección retrogástrica necesitó cirugía para drenar una colección de la corredera parietocólica izquierda.
Caso clínico
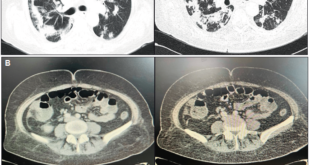
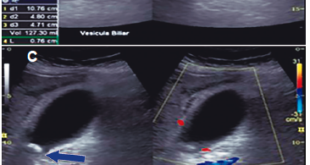
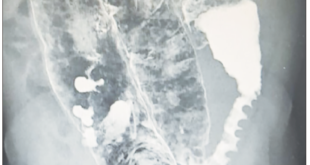
Paciente femenina de 75 años de edad remitida el 20 de noviembre de 2015 de otro hospital para el manejo de un cuadro de pancreatitis biliar de 4 días de evolución. Al ingreso se le realiza una tomografía computada (TC) trifásica que muestra una necrosis del 80%, permanece con tratamiento conservador y alimentación por sonda nasoduodenal. La TC de control al día 9 muestra una colección de 120 mm en vías de conformación con gas en su interior, tiene leucocitos en 9.000/mm3, PCR > 100 mg/l (VN: 0-3 mg/l) y dolor (necesita tramadol en infusión continua), por lo que se decide iniciarle imipenem. Al día 18 persiste el dolor, los leucocitos ascienden a 13.000/ mm3 y la nueva TC muestra una colección de mayor tamaño de (146 x 63 mm) con persistencia de gas en su interior; se decide la intervención por vía endoscópica. Inicialmente se realiza una endoscopía alta que demuestra una gastropatía congestiva sin abombamiento evidente, seguida de una ecoendoscopía lineal (Olympus modelo GF-UCT 180) que encuentra a nivel de cuerpo del estómago, sobre la pared posterior, dicha colección con contenido líquido predominante pero con imágenes que sugiere necrosis; se realiza una punción con aguja de 19 mm (Expect 19 ga, Boston Scientific), se aspira un líquido espeso francamente purulento y se envía a laboratorio para su estudio, se introduce un hilo guía cebra con puntas hidrófilas de 0,035 (Hydra Jagwire, Boston Scientific) y se intercambia aguja con balón de dilatación de 10 mm (Hurricane RX, Boston Scientific), se procede a dilatar tras la cual se observa salir abundante líquido purulento; finalmente se intercambia balón dilatador por un stent metálico, cubierto de 16 mm de diámetro por 6 cm de largo con bordes de 30 mm de diámetro (Niti-S NAGI stent, Taewoong). Se intercambia el tubo por un gastroscopio de visión axial (Olympus GIF-1TQ160), se realiza nueva dilatación a 14 mm (CRE, Boston Scientific) y se ingresa a cavidad a través del stent metálico; se procedió a lavar, succionar y debridar contenido necrótico hasta obtener una cavidad casi limpia; se usó CO2 en lugar de aire. Finalmente se colocó un drenaje nasoquístico (ENBD- 7-LIGUORY Nasal Biliary Drainage Set, Cook Medical) que se utilizó para lavar/aspirar diariamente cada 4 horas con 100 de solución salina en la cavidad; al día siguiente de la intervención se le inició dieta oral. Cuatro días después la aspiración daba un líquido claro, el dolor cedió sin analgésicos, los exámenes de laboratorio se normalizaron, pero sin embargo, la TC mostraba dicha colección “hueca” de 150 x 23 mm; se completaron 14 días de antibióticos y se le dio de alta tras 25 días de hospitalización con la indicación de tomar enzimas pancreáticas y omeprazol. Normalmente seguimos a estos pacientes semanalmente en consulta externa donde los examinamos y les pedimos pruebas de laboratorio. A los 24 días de su alta, la paciente estando asintomática, mostró una leucocitosis (15.000/ mm3) en una biometría de control, se le pidió una nueva TC que mostraba persistencia de la colección con el stent en su interior. Se le realizó una nueva endoscopía, la que encuentra en lugar del stent la presencia de una úlcera cubierta de fibrina; la ecoendoscopía lineal efectivamente mostró el stent en el interior de la colección. La paciente estaba asintomática, había ganado peso, nunca hizo fiebre y los nuevos controles de laboratorio no mostraron anormalidad alguna (leucocitos normales), aunque la PCR estaba algo elevada. Después de discutir el caso con cirugía y el equipo de gastroenterología, decidimos no intervenir y acordamos un seguimiento clínico. Finalmente es vista 50 días después de su alta siempre asintomática y en excelente estado general; se le pidió una TC, la cual descartó la presencia de colección alguna en su páncreas, así como de su stent. Decidimos enviar a la paciente a cirugía para la extracción de su vesícula.
Discusión
El caso presente llama la atención por la migración intracavitaria y sellamiento por la mucosa gástrica quedando el stent totalmente embebido, haciendo su extracción imposible sin ningún tipo de intervención invasiva.
Pensamos inicialmente en realizar un nuevo abordaje por ecoendoscopía o derivar a cirugía, pero ante las características de la colección, la edad de la paciente y la ausencia de síntomas, decidimos observar; le intervendríamos en caso que la colección crezca y/desarrolle síntomas. Esto último nunca pasó y más bien la colección se resolvió y el stent “desapareció”. Nuestra explicación más lógica es que una vez que la cavidad se colapsó, el stent fue expulsado hacia el estómago tal vez por el mismo trayecto y finalmente eliminado con las heces.
La prótesis metálica totalmente cubierta que usamos tiene los extremos amplios de 30 mm de diámetro con un cuerpo de 16 mm, lo que serviría para impedir su desplazamiento; la literatura inglesa se refiere a este stent como “ fully-covered biflanged metal stent” (BFMS). Sin embargo los estudios iniciales demostraron tasas de migración de hasta un 20%,11,12 además, no es infrecuente que durante la necrosectomía, al introducir el endoscopio, éste arrastre el stent hacia la cavidad, pudiendo ser reposicionado con una pinza de cuerpo extraño si uno se percata precozmente. También se ha reportado un caso de migración hacia la bolsa omental resuelto por laparoscopía.13 Hay reportes de menor tasa de migración de stents metálicos pero en algunos de estos estudios son usados temporalmente y/o en combinación con stents de plástico.14 Mukai y col los reemplazaban por stents de plástico en cola de cochino (“pigtails”) cuando la colección no se resolvía satisfactoriamente en un tiempo dado y estos pigtails eran dejados hasta por 2 años.14 Otros autores han sugerido el dejar una prótesis de plástico pigtail dentro del metálico para evitar la migración.15, 16 En otros estudios se han usado stents de “aposición” (Axios stent) que han mostrado menor tasa de migración pero con otros tipos de complicaciones que alcanzan el 9,8% como mal posicionamiento, sangrado autolimitado y perforación;10 además, estos stents no están disponibles en nuestro medio. La misma empresa ha lanzado ya un nuevo stent de aposición (Niti-S Spaxus stent) que asegura tener menor tasa de migración. Veremos salir nuevos estudios al respecto, mientras tanto se debe tener en cuenta este inconveniente si se piensa dejar éste stent por largo tiempo hasta que la cavidad se colapse completamente, aunque es de recalcar que, a pesar de la migración, el éxito clínico fue el esperado. Finalmente, como corolario en nuestro caso, a veces simplemente observar y “no meter mano” resulta la mejor opción.
Sostén financiero. Ninguno.
Conflicto de interés. Ninguno.
Referencias
- Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis–2012: revision of the Atlanta classification and definitions by international consensus. Gut 2013; 62: 102-111.
- Libera E Della, Siqueira ES, Morais M, Rohr MR, Brant CQ, Ardengh JC, Ferrari AP. Pancreatic Pseudocysts Transpapillary and Transmural Drainage. HPB Surg 2000; 11: 333-338.
- Smits ME, Rauws EA, Tytgat GN, Huibregtse K. The efficacy of endoscopic treatment of pancreatic pseudocysts. Gastrointest Endosc 1995; 42: 202-207.
- Papachristou GI, Takahashi N, Chahal P, Sarr MG, Baron TH. Peroral endoscopic drainage/debridement of walled-off pancreatic necrosis. Ann Surg 2007; 245: 943-951.
- Baron TH, Thaggard WG, Morgan DE, Stanley RJ. Endoscopic therapy for organized pancreatic necrosis. Gastroenterology 1996; 111: 755-764.
- Ramia JM, de la Plaza R, Quiñones-Sampedro JE, Ramiro C, Veguillas P, García-Parreño J. Walled-off pancreatic necrosis. Neth J Med 2012; 70: 168-171.
- van Brunschot S, van Grinsven J, Voermans RP, Bakker OJ, Besselink MG, Boermeester MA, Bollen TL, Bosscha K, Bouwense SA, Bruno MJ, Cappendijk VC, Consten EC, Dejong CH, Dijkgraaf MG, van Eijck CH, Erkelens GW, van Goor H, Hadithi M, Haveman JW, Hofker SH, Jansen JJ, Laméris JS, van Lienden KP, Manusama ER, Meijssen MA, Mulder CJ, Nieuwenhuis VB, Poley JW, de Ridder RJ, Rosman C, Schaapherder AF, Scheepers JJ, Schoon EJ, Seerden T, Spanier BW, Straathof JW, Timmer R, Venneman NG, Vleggaar FP, Witteman BJ, Gooszen HG, van Santvoort HC, Fockens P; Dutch Pancreatitis Study Group. Transluminal endoscopic step-up approach versus minimally invasive surgical step-up approach in patients with infected necrotising pancreatitis (TENSION trial): Design and rationale of a randomised controlled multicenter trial [ISRCTN09186711]. BMC Gastroenterol 2013; 13: 1-13.
- Bakker OJ, van Santvoort HC, van Brunschot S, Geskus RB, Besselink MG, Bollen TL, van Eijck CH, Fockens P, Hazebroek EJ, Nijmeijer RM, Poley JW, van Ramshorst B, Vleggaar FP, Boermeester MA, Gooszen HG, Weusten BL, Timmer R; Dutch Pancreatitis Study Group. Endoscopic transgastric vs surgical necrosectomy for infected necrotizing pancreatitis: a randomized trial. JAMA 2012; 307: 1053-1061.
- Rana SS, Bhasin DK, Rao C, Sharma R, Gupta R. Comparative evaluation of structural and functional changes in pancreas after endoscopic and surgical management of pancreatic necrosis. Ann Gastroenterol Q Publ Hell Soc Gastroenterol 2014; 27:162-166.
- Siddiqui AA, Adler DG, Nieto J, Shah JN, Binmoeller KF, Kane S, Yan L, Laique SN, Kowalski T, Loren DE, Taylor LJ, Munigala S, Bhat YM. EUS-guided drainage of peripancreatic fluid collections and necrosis by using a novel lumen-apposing stent: A large retrospective, multicenter U.S. experience (with videos). Gastrointest Endosc 2015; 83: 699-707.
- Chandran S, Efthymiou M, Kaffes A, Williams D, Nguyen NQ, Tam W. Management of pancreatic collections with a novel endoscopically placed fully covered self-expandable metal stent: a national experience with videos. Gastrointest Endosc 2015; 81: 127-135.
- Huggett MT, Oppong KW, Pereira SP, Keane MG, Mitra V, Charnley RM, Nayar MK. Endoscopic drainage of walled-off pancreatic necrosis using a novel self-expanding metal stent. Endoscopy 2015; 47: 929-932.
- Patrzyk M, Dierzek P, Glitsch A, Paul H, Heidecke C-D. Retrieval of a self-expanding metal stent after migration and incorporation in the omental bursa, using a gastroscopic-transgastric laparoscopic rendezvous technique. J Minim Access Surg 2015; 11: 207-209.
- Mukai S, Itoi T, Baron TH, Sofuni A, Itokawa F, Kurihara T, Tsuchiya T, Ishii K, Tsuji S, Ikeuchi N, Tanaka R, Umeda J, Tonozuka R, Honjo M, Gotoda T, Moriyasu F, Yasuda I. Endoscopic ultrasound-guided placement of plastic vs biflanged metal stents for therapy of walled-off necrosis: a retrospective single-center series. Endoscopy 2015; 47: 47-55.
- Tarantino I, Barresi L, Fazio V, Di Pisa M, Traina M. EUS-guided self-expandable stent placement in 1 step: a new method to treat pancreatic abscess. Gastrointest Endosc 2009; 69: 1401- 1403.
- Talreja JP, Shami VM, Ku J, Morris TD, Ellen K, Kahaleh M. Transenteric drainage of pancreatic-fluid collections with fully covered self-expanding metallic stents (with video). Gastrointest Endosc 2008; 68: 1199-1203.
Correspondencia: Gustavo Calle-Hinojosa
Hospital Universitario del Río, Av. 24 de Mayo
Tel: 593 7249555 – 593 991605002
Correo electrónico: gcalle.md@gmail.com
Acta Gastroenterol Latinoam 2017;47(2):137-140
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE