María Soledad Muñoz,1 María Laura Valle Rossi,1 Luciana Ferrer,2 Romina Medeot,1 Pablo Herrera Najum,2 Luis López,1 Pablo Rodríguez2
1Área de Microbiología, Servicio de Bioquímica.
2 Servicio de Gastroenterología.
Instituto Modelo de Cardiología S.R.L. Córdoba, Argentina.
Acta Gastroenterol Latinoam 2019;49(1):22-31
Recibido: 01/09/2017 / Aprobado: 28/09/2018 / Publicado en www.actagastro.org el 18/03/2019
Resumen
La infección por Helicobacter pylori (H. pylori) es causa de úlcera péptica y desarrollo del cáncer gástrico. Se detecta mediante métodos invasivos y no invasivos. Este estudio prospectivo se realizó para evaluar la utilidad de la detección de antígeno en heces como prueba no invasiva para el diagnóstico de enfermedad producida por H. pylori. Se comparó con la biopsia y su detección histológica, método de referencia invasivo, analizando la asociación entre ambos. Se realizaron endoscopía-biopsia y análisis de heces en 104 pacientes con síntomas del tracto digestivo superior. Se incluyó a pacientes que tomaban inhibidores de la bomba de protones (IBPs) y consumidores de antiinflamatorios no esteroideos (AINEs). Sensibilidad (S), especificidad (E), valor predictivo positivo (VPP) y valor predictivo negativo (VPN) de esta prueba no invasiva comparadas con el método de referencia fueron mayores en pacientes que no toman IBPs: 85,7%, 76,5%, 88,2, 73,9 respectivamente. Igual situación se observa con AINEs (S: 74,5%, E: 84,0%, VPP: 90,4, VPN: 61,9). El mejor rendimiento se obtuvo sin consumo de IBPs ni AINEs (S: 91,7%, E: 85,7%, VPP: 93,0, VPN: 84,1). Conclusiones. La detección de antígeno en heces es una prueba no invasiva, fácil y rápida para el diagnóstico y confirmación de enfermedad. En pacientes vírgenes de IBPs y AINEs no se encontraron diferencias significativas. Sin embargo, no hay asociación estadísticamente significativa entre ésta y el método de referencia en pacientes que toman IBPs (S: 52,8%, E: 75,0%, VPP: 81,1, VPN: 44,0) o AINEs (S: 55,0%, E: 50,0%, VPP: 69,1, VPN: 35,4). Se sugiere evitar estos fármacos o emplear otros métodos para su detección.
Palabras claves. Helicobacter pylori, test de antígeno en materia fecal, endoscopía.
Utility of antigen detection of Helicobacter pylori in stool as a diagnostic noninvasive method
Summary
Helicobacter pylori (H. pylori) infection is cause of peptic ulcer disease and gastric cancer development. Its detection is divided into invasive and noninvasive test. This prospective study was conducted to find out the utility of antigen detection in stool as a noninvasive test for the diagnosis of disease produced by H. pylori. It was compared to the invasive gold standard endoscopy-biopsy to analyze association between both methods. Endoscopy-biopsy and stool specimens were performed in 104 patients with symptoms attributable to upper digestive tract. Patients taking proton pump inhibitors (IPPs) as well as those consuming non-steroidal anti-inflammatory drugs (NSAIDs) were included. The sensitivity (S), specificity (Sp), positive (PPV) and negative (NPV) predictive value of this noninvasive test compared to the gold standard are higher in patients who are not taking IPPs: 85.7%, 76.5%, 88.2%, 73.9%, respectively. Same situation is observed with NSAIDs: S: 74.5%, Sp: 84.0%, PPV: 90.4%, NPV: 61.9%. The best performance is seen in patients without IPPs and NSAIDs: S: 91.7%, Sp: 85.7%, PPV: 93.0%, NPV: 84.1%. Concluding, the antigen detection in stool is a noninvasive, easy, rapid test for the diagnosis and confirmation of disease, mostly in patients not taking IPPs and NSAIDs where no significant difference was found. Nevertheless, there is no statistically significant association between this test and the gold standard in patients taking IPPs (S: 52.8%, Sp: 75.0%, PPV: 81.1%, NPV: 44.0%) or NSAIDs (S: 55.0%, Sp: 50.0%, PPV: 69.1%, NPV: 35.4%). It is suggested avoiding the use of these drugs or employing other methods for its detection.
Key words. Helicobacter pylori, stool antigen test, endoscopy.
Abreviaturas
H. pylori: Helicobacter pylori.
AgHp: antígeno de Helicobacter pylori.
IBP: inhibidores de la bomba de protones.
AINEs: antiinflamatorios no esteroideos.
MALT: linfoma del tejido linfoide asociado a las mucosas.
IARC: Agencia Internacional para la Investigación del Cáncer.
OMS: Organización Mundial de la Salud.
ELISA: inmunoensayo enzimático cuantitativo.
VPP: Valor Predictivo Positivo.
VPN: valor predictivo negativo.
AUC: área bajo la curva ROC.
Helicobacter pylori (H. pylori) es una bacteria gram negativa, con forma de espiral o “S”, microaerófila, fastidiosa por sus condiciones de cultivo y requerimientos nutricionales.1, 2 Coloniza en forma casi exclusiva la superficie apical del epitelio gástrico, desencadenando una respuesta inflamatoria local de intensidad y extensión variables y una respuesta inmune sistémica fácilmente evidenciable. Sin embargo, esta respuesta inmune específica no es capaz de eliminar la bacteria que, en la mayoría de los casos, persiste durante toda la vida del individuo.2
El descubrimiento de este microorganismo ha supuesto una evolución en la gastroenterología. En 1983 se aislaron del estómago de seres humanos microorganismos con forma espiralada, y en 1989 se estableció el género Helicobacter.2, 3 En el período transcurrido entre su primer aislamiento hasta la actualidad el avance en el conocimiento de la fisiopatología de la bacteria ha sido enorme, habiéndose demostrado que constituye la principal causa de gastritis crónica, úlceras pépticas y es un factor necesario para el desarrollo de otras enfermedades digestivas como el carcinoma gástrico o el linfoma gástrico (MALT).1, 3-5
Como un colonizador ávido de la mucosa gástrica, este microorganismo debe poseer una serie de características que incluyen una citoxina vacuolizante VacA, proteína CagA, proteína DupA, lipopolisacárido, flagelos, adhesinas, producción de ureasa, capacidad de formación de biofilm, entre otros. La importancia de la biopelícula es fundamental para su patogenicidad,3-5 ayudando en la permanencia en ambientes hostiles, como en el estómago humano y el medio ambiente natural.2 En virtud de la capacidad para colonizar la mucosa gástrica, persistir a pesar de las defensas inmunes del huésped y causar daño tisular, H. pylori es un patógeno bacteriano agresivo e importante. La movilidad le permite escapar de la acidez del estómago, refugiarse y colonizar la mucosa gástrica en íntima asociación con el epitelio. Es probable que la enzima ureasa desempeñe un papel fundamental en la supervivencia y crecimiento de este patógeno en el estómago, creando un microambiente alcalino.2, 3, 6
El cáncer de estómago o cáncer gástrico se desarrolla lentamente en un período de muchos años y se puede propagar de varias maneras: a través de la pared del estómago e invadir los órganos cercanos, y también puede diseminarse a los vasos linfáticos y a los ganglios linfáticos adyacentes.7, 8 A menudo ocurren cambios precancerosos en el revestimiento interno (mucosa) del estómago y estos cambios tempranos casi nunca causan síntomas y, por lo tanto, no se detectan.
El cáncer gástrico supone la tercera causa mundial de muerte por cáncer, con alrededor de 1 millón de nuevos casos y 720.000 muertes estimadas en el año 2012.8, 9
La prevalencia de H. pylori en el cáncer gástrico es difícil de conocer, ya que la bacteria puede desaparecer durante la malignización del tejido. La gastritis crónica es un importante factor de riesgo para su desarrollo;6, 8 por este motivo la Agencia Internacional para la Investigación del Cáncer (IARC) de la Organización Mundial de la Salud (OMS) lo considera desde 1994 como un agente carcinógeno tipo 1 asociado con cáncer gástrico.8, 10, 11 La progresión es desde la gastritis inicial al carcinoma, pasando por la atrofia, metaplasia y displasia. El punto crucial es la atrofia gástrica, ya que la erradicación de H. pylori en estómagos cuya mucosa se encuentra ya en fase de atrofia no parece reducir de forma importante el número de casos que finalmente desarrollan carcinoma.12 Por el contrario, la erradicación del microorganismo en una fase previa sí parece prevenir esta patología. Este hecho hace pensar que H. pylori no produce cáncer gástrico per se, sino un estado de atrofia que podría desembocar en él, debiendo centrarse los esfuerzos terapéuticos en prevenir el paso de la gastritis a la atrofia gástrica.9
Es un patógeno de amplia distribución mundial, afecta en promedio a más de la mitad de la población,13 pero varía según el área geográfica estudiada. La prevalencia a fines de los noventa y principio del año 2000 fue la más alta en países de América Central y América del Sur.14 En los países en vías de desarrollo en donde el contacto con el microorganismo se produce en las primeras etapas de la vida, con respecto a aquellos desarrollados, su incidencia decae progresivamente tanto por las medidas de salud pública sanitarias como por los efectos de cohorte.5, 15
La mayoría de las personas permanecen colonizadas, salvo que la erradicación por medio de la utilización de fármacos terapéuticos adecuados sea exitosa.16 La permanencia parece ser debido a la capacidad tanto para adaptarse a las respuestas inmunológicas del huésped como para soportar el ambiente gástrico en constante cambio.6, 7
No se conoce con exactitud el mecanismo de la trasmisión pero se cree que probablemente se deba al contacto interpersonal (oral-oral, oral-fecal) o una fuente común, ya que la que la transmisión de H. pylori se produce sobre todo entre miembros de la misma familia.3, 4, 6, 17, 18 La edad, el nivel de desarrollo de la zona y factores socioeconómicos individuales parecen también influir claramente en la adquisición del microorganismo.4, 5, 17, 18
Debido a la infección por este microorganismo, que puede causar complicaciones, toma especial relevancia clínica el diagnóstico, tratamiento y monitoreo de la evolución de los pacientes.
Los test utilizados para diagnóstico usualmente se dividen en métodos invasivos y no invasivos. Los invasivos incluyen la endoscopía, detección histológica, test del aire espirado, cultivo y métodos moleculares. Los no invasivos comprenden la detección de antígeno en heces, la prueba del aliento y serología.4, 11, 13, 19-22
El objetivo de este trabajo es comparar el desempeño de un método no invasivo como es la detección de antígeno H. pylori en heces, tomando como método de referencia la detección histológica con muestra obtenida por biopsia gástrica.
Material y métodos
Se estudió prospectivamente a 104 pacientes de ambos sexos, con una edad superior a 17 años, con sospecha de infección de H. pylori, ya que estos pacientes acudieron al servicio de gastroenterología de nuestra institución por síntomas atribuibles al tracto digestivo superior en el período comprendido entre noviembre de 2014 y mayo de 2016. Fueron sometidos a una endoscopía, con previo consentimiento informado, firmado voluntariamente para participar en la investigación, obteniéndose 2 biopsias de antro, 2 de ángulo y 2 de cuerpo de estómago para el estudio histológico; dividiéndose en grupos: población total; consumidores y no de antiinflamatorios no esteroideos (AINES); consumidores y no de inhibidores de la bomba de protones (IBP) y aquellos sin ninguna medicación previa. Además se analizaron según la edad en 3 grupos: menor a 40 años, entre 40 y 60 años, y mayor a 60 años. Se consideraron criterios de exclusión el tratamiento durante el último mes con antibióticos y derivados del bismuto, la administración previa de tratamiento erradicador de H. pylori, la cirugía gástrica y la presencia de enfermedades graves asociadas como cáncer de estómago y enfermedad inflamatoria intestinal. Se incluyó a todos los pacientes que presentaron síntomas digestivos superiores con indicación de endoscopía digestiva gástrica.
El estudio recibió aprobación bioética para su ejecución en el Instituto Modelo de Cardiología de Córdoba, Argentina.
Se solicitó a cada paciente una muestra de heces que se congeló a -20° C hasta su análisis.
Se determinó la presencia de antígeno de H. pylori (AgHp) en heces, mediante un inmunoensayo enzimático cuantitativo (ELISA) de fase sólida basado en el principio del sándwich. El método empleado se conoce como Juego de Examen del Antígeno H. pylori EIA y utiliza anticuerpos de H. pylori para detectar selectivamente su antígeno en excremento humano. La aparición de color corresponde a su presencia. Como limitaciones del método, el paciente que es sometido al examen no debe haber ingerido antibiótico o estar con tratamiento antibacteriano ya que esta terapia farmacéutica puede originar falsas interpretaciones. Se debe cumplir con los requerimientos de validación de los cuatro calibradores provistos para dar por legítimos los resultados obtenidos. El Juego de Examen del Antígeno H. pylori EIA ha sido comparado con un examen del Antígeno H. pylori EIA que es líder comercial, usando muestras clínicas. Los resultados evidencian que la sensibilidad del Juego de Examen del Antígeno H. pylori EIA es 98,6% (92,4-100,0%) y la especificidad de 95,4% (90,3-98,3%), con un intervalo de confianza del 95%.
Se realizaron análisis descriptivos, inferenciales con el test chi cuadrado, con tablas de contingencia y curvas ROC de las variables consideradas, adaptándose como método de referencia la detección de H. pylori por biopsia tomada en la endoscopía.
Resultados
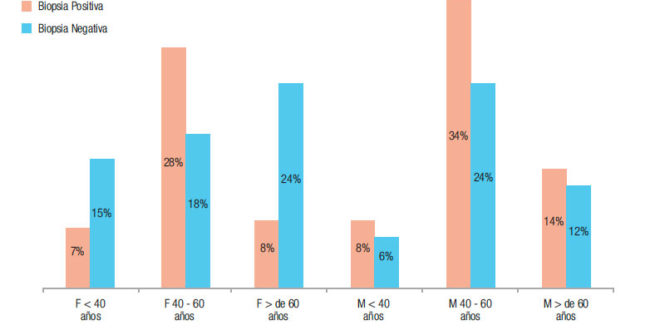
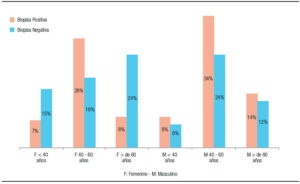
De los 104 pacientes que cumplían los criterios para participar en el estudio, la distribución según el sexo fue de 48% para mujeres y 52% para hombres, con una mediana de edad de 51 años (rango: 17-73). La mayor prevalencia de H. pylori se produce en el rango de edad de 40 a 60 años en ambos sexos, pero es mayor en hombres que en mujeres (Figura 1).
Figura 1. Incidencia de H. pylori según sexo y edad.
En nuestro estudio, la prevalencia global de la infección por H. pylori fue de 68% en los pacientes a quienes se les efectuó una endoscopía gástrica. La pesquisa llevada a cabo en esta población consideró la presencia de síntomas atribuibles al tracto digestivo superior, luego de la selección realizada criteriosamente por el gastroenterólogo de acuerdo con los criterios de exclusión descriptos y el consumo de IBP y/o AINES. No es posible afirmar que la presencia de síntomas clínicos diversos o de otros probables interferentes no modifiquen esta prevalencia.
Con respecto al test de enzimoinmunoensayo, existe una asociación estadísticamente significativa entre la detección de AgHp en materia fecal y la detección de H. pylori por biopsia, para la población total (p < 0,0001), para aquellos pacientes vírgenes de IBP y AINES (p < 0,0001), para los que no consumen IBP (p < 0,0001) como así también para los que no ingieren AINES (p < 0,0001) (Tabla 1). Sin embargo, existe una muy baja exactitud diagnóstica en los pacientes consumidores de IBP (p = 0,12) como así también en aquellos que ingieren AINES (p = 0,81), demostrándose en estos últimos la peor situación (Tabla 1).
El coeficiente de chance Odds indica que hay una probabilidad 7 veces mayor de tener un diagnóstico positivo de antígeno en materia fecal cuando la biopsia es positiva, que tener un diagnóstico negativo de antígeno en materia fecal cuando la biopsia es positiva.
Tabla 1. Evaluación de los niveles de significancia y los coeficientes de contingencia en las distintas subpoblaciones.

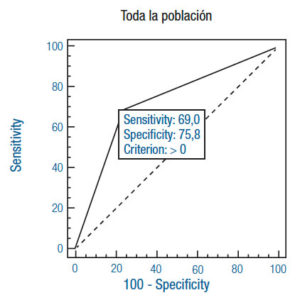
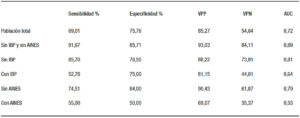
La sensibilidad y la especificidad del test de detección de AgHp en toda la población estudiada son aceptables, 69% y 76% respectivamente (Figura 2a). El alto valor predictivo positivo (VPP) indica que el 85% de las veces el test será positivo para pacientes que se encuentren colonizados por H. pylori, avalando la manifestación de síntomas del tracto digestivo superior, a pesar del consumo de IBP y/o AINES, y correlacionando con la mayor especificidad (Tabla 2). Se puede afirmar entonces que se trata de un test específico. Con respecto al valor predictivo negativo (VPN), solo el 54% de las veces en que el paciente no esté colonizado, el test será negativo; lo que se corresponde con una menor sensibilidad (Tabla 2).
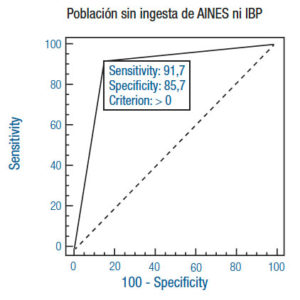
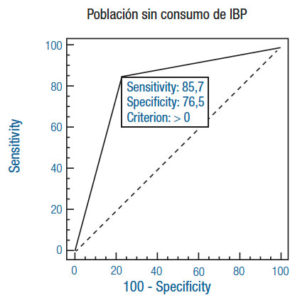
El test de detección de AgHp en materia fecal refleja su mayor rendimiento en cuanto a sensibilidad, especificidad, VPP y VPN en la población virgen de tratamiento con IBP y AINES (Tabla 2) (Figura 2b). De todas maneras, de los 38 pacientes del total de la población, 2 presentaron biopsias negativas con detección de AgHp positivo. Se puede analizar si se trata de un falso positivo para el AgHp o quizás un falso negativo de la biopsia que es operador dependiente, así como también está supeditado a la porción de muestra extraída. De igual manera, otros 2 pacientes presentaron detección de antígeno negativa con biopsias positivas. En este caso, la biopsia es considerada un verdadero positivo por tratarse de nuestro método de referencia y es posible atribuir el falso negativo del antígeno a la liberación intermitente del mismo por parte del H. pylori.
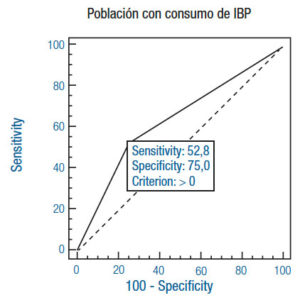
Comparando las poblaciones de pacientes no consumidores de IBP con respecto a aquellos que sí lo hacen, es notable la variación en la sensibilidad del test; no así en la especificidad, que no se modifica prácticamente, indicando de este modo que se detecta el microorganismo cada vez que está presente. Esto se acompaña coherentemente con un alto VPP (Tabla 2) (Figuras 2c y 2d). La relevante modificación en la sensibilidad demuestra la importancia de la interferencia del consumo de IBP para esta técnica y se acompaña, por ende, de un bajo VPN (Tabla 2).
Tabla 2. Comparación de los parámetros estadísticos en las distintas subpoblaciones.
De la población que no ingiere IBP, 4 pacientes presentaron un test de antígeno AgHP positivo con biopsia negativa. A nuestro criterio, existe una alta probabilidad de que se trate de verdaderos positivos y falsos negativos para la biopsia por los motivos anteriormente mencionados, pudiendo inferirse por el alto VPP y una significativa especificidad (Tabla 2). Asimismo, de los 52 pacientes que no consumen IBP, 5 tuvieron biopsias positivas con test de antígeno AgHP negativos. De estos últimos, 3 no ingerían IBP pero sí AINES, y los otros 2 eran vírgenes de ambos fármacos. Los falsos negativos de los test de materia fecal para detección de AgHP se acompañan de una disminución en la sensibilidad, pero no se puede descartar alguna otra interferencia (Figura 2d).
Asimismo, el coeficiente de chance Odds indica que hay una probabilidad 2,38 veces mayor de tener un diagnóstico positivo de antígeno en materia fecal cuando no se toman inhibidores de la bomba de protones que cuando se los toma (Tabla 3).
Tabla 3. Asociación entre la toma de antiinflamatorios no esteroideos y la ingesta de inhibidores de la bomba de protones y la presencia de antígeno de Helicobacter pylori en heces.

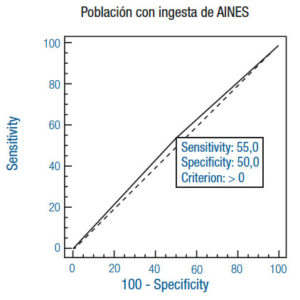
En cuanto a la ingesta de AINES, si cotejamos los resultados obtenidos para la población consumidora con respecto a la que no lo es, la situación que se refleja es la peor de todas las analizadas. La sensibilidad y la especificidad son las más bajas que se obtuvieron, demostrando una relevante interferencia de estos fármacos en el test de detección de AgHP (Tabla 2) (Figuras 2e y 2f). El nivel de significancia es el más alto obtenido de todos los examinados, lo cual indica que no existe una relación estadísticamente significativa entre ambos métodos (p = 0,81) (Tabla 1).
Asimismo, el coeficiente de Odds indica que existe menos probabilidad de tener un diagnóstico positivo de antígeno en materia fecal cuando se ingieren AINES (Tabla 3).
Del total de la población, 27% consumían AINES. De estos, el 14% obtuvo un test de detección de AgHp positivo, con biopsia negativa. Esta situación podría explicarse de la misma forma que para el caso de IBP. Pero la situación inversa, es decir, test de detección de AgHp negativo con biopsia positiva, se dio en el 32% de los casos de esta subpoblación. Podrían adjudicarse estos falsos negativos a la liberación intermitente de antígeno por parte de H. pylori, pero es conveniente tener una especial consideración por la probable alteración que provocan estos fármacos en la técnica para la detección de AgHp. Esto lleva a poner en consideración la utilización de un método alternativo, por su baja actitud diagnóstica, o la suspensión de la medicación.
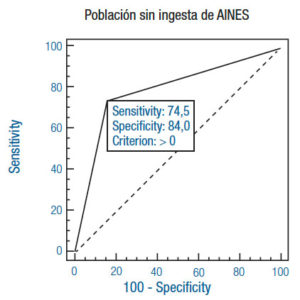
Reafirma este razonamiento el notable aumento de la sensibilidad y la especificidad, como así también el bajo nivel de significancia de la subpoblación que no consume AINES (Tabla 1 y 2) (Figuras 2e y 2f). Esto supone, entonces, que existe una relación estadísticamente significativa. El alto VPP permite inferir que el test es útil para la detección de antígeno en heces en esta subpoblación. Esto se acompaña de una alta especificidad, casi semejante a la de la población virgen de ambos fármacos. La sensibilidad también se modifica considerablemente, viéndose reflejada en la disminución de falsos negativos del test y un aumento del VPN. Solo un 17% de esta subpoblación presentó detección de AgHp negativo con biopsia positiva. Y la situación inversa se dio en el 5% de los casos.
Figura 2. Comparación de curvas ROC con las respectivas sensibilidad y especificidad en cada población.
Discusión
Existen varios métodos de detección y diagnóstico para H. pylori, invasivos como la biopsia de mucosa gástrica para histología y cultivo; y no invasivos como la determinación de anticuerpos en suero, la prueba de la ureasa, la detección de antígenos y anticuerpos contra H. pylori en saliva, orina, heces y el cultivo en materia fecal.3, 13, 19, 21, 24 Las principales ventajas de estos últimos es la forma de obtención de la muestra, ya que no requiere ningún tipo de procedimiento riesgoso para el paciente, la rapidez en el resultado, lo que permite instaurar un tratamiento antibiótico adecuado, la sencillez de la técnica y el menor costo comparado con la detección histológica del microorganismo. La detección de antígeno en heces no es suficiente para el diagnóstico de úlcera péptica y/o gastritis.
La eficacia de estos ensayos varía de acuerdo con el método de referencia utilizado para confirmar infección por H. pylori, la fuente de antígeno para el ensayo y la población estudiada.24, 25 Además de esta variabilidad, puede no diferenciarse en todos los casos entre infecciones activas vs pasadas por H. pylori. Por este motivo, la aplicación de métodos invasivos debe ser también llevada a cabo para la confirmación del diagnóstico en caso de ser necesario.
Estos puntos toman relevancia si se cuenta con un kit comercial de detección de AgHp en materia fecal que logre una buena eficacia analítica. De acuerdo con nuestra población estudiada, se puede afirmar la utilidad de este test como método diagnóstico no invasivo.
Existe una asociación estadísticamente significativa entre el método estudiado y el método de referencia.
La sensibilidad es del 92%, la especificidad del 86% y los VPP y VPN del 93% y 84% respectivamente cuando se estudia a pacientes vírgenes de AINES e IBP. Estos valores se modifican notablemente según la subpoblación estudiada.
Por lo anteriormente descripto, se considera que la realización de un solo test no es recomendable para la detección de H. pylori, ya que cada resultado va a depender de la prevalencia y de las cepas del microorganismo en las diferentes circunstancias clínicas de cada paciente. En cambio, dos o más pruebas son una buena estrategia de diagnóstico en la rutina clínica para llegar a un resultado más preciso20, 22, 24 La distribución irregular de la bacteria en la mucosa gástrica y la liberación intermitente de antígeno son algunos de los motivos por los cuales un solo test realizado puede arrojar un resultado erróneo.25
La infección por H. pylori es un problema de salud pública que requiere el apoyo de autoridades sanitarias para la realización de estudios de prevalencia y factores asociados en cada grupo poblacional; como así también procedimientos auxiliares de diagnóstico accesibles y rápidos. Así se establecerían medidas de control y acciones sanitarias adecuadas.1, 13, 14
Se sugiere, luego de realizado y analizado este estudio, y habiendo considerado la bibliografía internacional, la realización en primera instancia de un método de detección no invasivo en pacientes que presenten signos y síntomas compatibles del tracto digestivo superior para la búsqueda de H. pylori. De resultar negativa cualquiera de las metodologías no invasivas disponibles, recurrir a la realización de métodos invasivos, que conllevan otros riesgos.
De todas maneras, consideramos conveniente ampliar el número de casos para mayor representatividad, como así también evaluar la utilidad del método en pacientes que recibieron tratamiento para el control de la erradicación de H. pylori.
Sostén financiero. Se agradece el aporte económico para la provisión de reactivos a la Facultad de Ciencias Químicas de la Universidad Nacional de Córdoba.
Agradecimientos. Se agradece especialmente la colaboración personal y desinteresada del Prof. Dr. Rafael H. Gallerano y la provisión de reactivos suministrados por el Instituto Modelo de Cardiología y la Facultad de Ciencias Químicas de la Universidad Nacional de Córdoba. Se agradece también a la Dra. anatomopatóloga Gabriela Sambuelli por su importante aporte.
Referencias
- Calik Z, Karamese M, Acar O, Aksak Karamese S, Dicle Y, Albayrak F, Serpil C, Bulent G, Alpgiray T, Mustafa C, Halil Y. Investigation of Helicobacter pylori antigen in stool samples of patients with upper gastrointestinal complaints. Brazilian Journal of Microbiology 2016; 47: 167-171.
- Bailey & Scott. Campylobacter, Arcobacter y En: Bailey & Scott, ed. Diagnóstico Microbiológico, 11th ed. Buenos Aires: Médica Panamericana 2004: 499-501.
- Lawson A. Helicobacter en: Jorgensen J, Pfaller M, Carroll K, Funke G, Landry M, Richter S, Warnock D, eds. Manual of Clinical Microbiology. 11th ed. Washington DC: ASM Press, 2015: 1013-1027.
- Rollan Rodríguez, A. Diagnóstico y tratamiento de las enfermedades digestivas. Revista Médica de Chile 2013: 123-136.
- Suerbaum S, Michetti P. Helicobacter pylori New England Journal Medical 2002; 347: 1175-1186.
- Somodevilla Solís Á. Factores de virulencia, aspectos inmunológicos y patrones de sensibilidad en aislamientos clínicos de Helicobacter pylori. Universidad Complutense de Madrid 2012.
- Abadi AT, Kusters JG. Management of Helicobacter pylori infections. BMC Gastroenterology 2016; 16: 94.
- Song Z, Zhou L. Helicobacter Pylori and gastric cancer: clinical aspects. Chinese Medical Journal 2015; 128: 3101-3105.
- Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper RJ. Helicobacter pylori infection and the development of gastric cancer. New England Journal of Medicine 2002; 345: 784-789.
- Moller H, Heseltine E, Vainio H. Working group report on schistosomes, liver flukes and Helicobacter pylori. Meeting held at IARC, LYON, 1994. International Journal of Cancer 1995; 60: 587-589.
- Sreekumar J, France N, Taylor S, Matthews T, Turner P, Bliss P, Brook A, Watson A. Diagnosis of Helicobacter pylori by carbon-13 urea breath test using a portable mass spectrometer. SAGE Open Medicine 3; 2015.
- Zhang S, Moss S. Cell recruitment in gastric carcinogenesis. AGING (Albany NY) 2017; 9: 1-2.
- Castillo-Montoya V, Ruiz Bustos E, Valencia Juillerat M, Álvarez Hernández G, Sotelo Cruz N. Detección de Helicobacter pylori en niños y adolescentes mediante coproantígeno monoclonal y su asociación con gastropatías. Cirugía y Cirujanos 2016.
- Axon A. Helicobacter pylori and Public Health. Helicobacter 2014; 19: 68-73.
- Watson CL, Owen RJ, Said B, Lai S, Lee JV, Surban-Lee S, Nichols G. Detection of Helicobacter pylori by PCR but not culture in water and biofilm samples from drinking water distribution systems in England. Journal of Applied Microbiology 2004; 97: 690-698.
- Guías Clínica AUGE. Tratamiento de erradicación de Helicobacter pylori en el paciente con ulcera péptica. Ministerio de Salud. Gobierno de Chile 2013.
- Rivas-Traverso F, Hernández F. Helicobacter pylori: Factores de virulencia, patología y diagnóstico. Revista Biomédica 2000; 11: 190-191.
- Ramírez Ramos A, Sánchez R. Helicobacter pylori 25 años después (1983-2008): epidemiología, microbiología, patogenia, diagnóstico y tratamiento. Revista de Gastroenterología del Perú 2009; 29: 158-170.
- Saha R, Roy P, Das S, Kaur N, Kumari A, Kaur IR. Application of a stool antigen test to evaluate the burden of Helicobacter pylori infection in dispepsia patients. Indian Journal of Pathology & Microbiology 2016; 59: 66-68.
- Bermúdez Díaz L, Torres E, Domínguez L, Rodríguez González BL. Métodos para la detección de la infección por Helicobacter pylori. Revista Cubana de Medicina 2009; 48: 1-14.
- Honar N, Minazadeh A, Shakibazad N, Haghighat M, Saki F, Javaherizadeh H. Diagnostic accuracy of urea breath test for Helicobacter pylori infection in children with dyspepsia in comparison to histopathology. Arquivos de Gastroenterología 2016; 53: 108-112.
- On SL. Identification methods for campylobacters, helicobacters and related organisms. Clinical Microbiology 1996; 9: 405.
- Marchildon PA, Ciota LM, Zamaniyan FZ, Peacock JS, Graham DY. Evaluation of three commercial enzyme immunoassays compared with the 13C urea breath test for detection of Helicobacter pylori Journal Clinical Microbiology 1996; 34: 1147.
- Tongtawee T, Kaewpitoon S, Kaewpitoon N, Dechsukhum C, Leeanansaksiri W, Loyd R, Matrakool L, Panpimanmas S. Diagnosis of Helicobacter pylori Asian Pacific Journal of Cancer Prevention 2016: vol. 17.
- Gisbert J, del Mar Cabrera M, María Pajares J. Detección del an¬tígeno de Helicobacter pylori en heces para el diagnóstico inicial de la infección y para la confirmación de su erradicación tras el tratamiento. Medicina Clínica 2002; 118: 401-404.
Correspondencia: María Soledad Muñoz
Av. Sagrada Familia 359. Córdoba, Argentina
Tel.: 00 54 351 4858585 (Int. 485) / Fax: 00 54 351 4858595 (Int. 490)
Correo electrónico: munsol@hotmail.com
Acta Gastroenterol Latinoam 2019;49(1): 22-31
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE