Ana García García de Paredes, Javier Martínez González, Laura Crespo Pérez
Servicio de Gastroenterología y Hepatología, Hospital Ramón y Cajal. Madrid, España.
Acta Gastroenterol Latinoam 2016;46:118-121
Recibido: 09/12/2015 / Aprobado: 29/02/2016 / Publicado en www.actagastro.org el 04/07/2016
Resumen
La enfermedad de Ménétrier es una causa atípica de gastropatía que se caracteriza por la presencia de pliegues mucosos gástricos engrosados y por la pérdida secundaria de proteínas. Para su diagnóstico, una vez excluidas otras causas de engrosamiento de los pliegues gástricos, son necesarios datos clínicos, endoscópicos e histológicos. El abordaje quirúrgico constituye el tratamiento clásico. Sin embargo, la aparición de nuevos tratamientos médicos comienza a relegar la opción quirúrgica a casos graves o refractarios.
Palabras claves. Anemia ferropénica, Ménétrier, lanreótido.
An infrequent cause of iron-deficiency anemia: Ménétrier disease
Summary
Ménétrier disease is a rare condition of an unknown origin, with a wide spectrum of clinical signs and symptoms at presentation. Diagnosis is made through the combination of clinical, analytical, endoscopic and histological data. Surgery is the classical treatment. However, new medical approaches have emerged.
Key words. Iron-deficiency anemia, Ménétrier´s disease, lanreotide.
La enfermedad de Ménétrier es una entidad infrecuente de etiología desconocida que puede presentarse con una gran variedad de manifestaciones clínicas entre las que se encuentra la anemia por pérdidas digestivas. Ante la ausencia de criterios estandarizados, para alcanzar el diagnóstico es preciso combinar hallazgos clínicos, endoscópicos e histológicos. La resección gástrica constituye el tratamiento clásico, sin embargo, la aparición de nuevos tratamientos médicos comienza a relegar la opción quirúrgica a casos graves o refractarios. Presentamos un caso de esta inusual enfermedad y la revisión de la literatura.
Caso Clínico
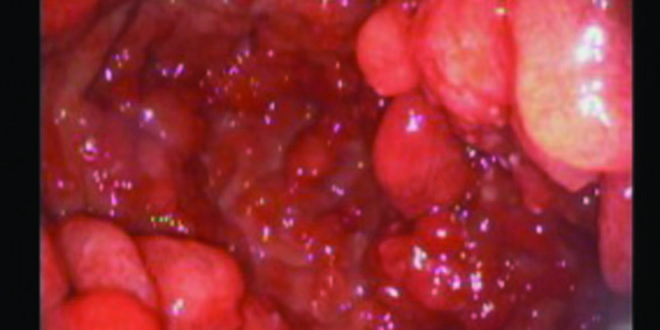
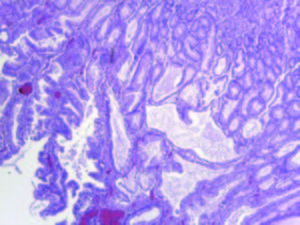
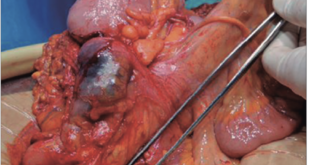
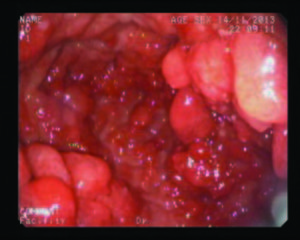
Varón de 52 años de origen iraní, ex-fumador, con antecedentes de hipertensión arterial, adenocarcinoma de colon tratado con hemicolectomía derecha en el año 2008, valvuloplastia por insuficiencia mitral grave secundaria a prolapso mitral e infarto agudo de miocardio con implante de stent farmacoactivo en el año 2009. En julio de 2013 comenzó a estudiarse por anemia ferropénica (hemoglobina 11,7 g/dl; ferritina 5,30 ng/ml; ferremia: 109 ug/dl) sin pérdida de peso ni otra sintomatología asociada. Se realizó una colonoscopía que no mostró hallazgos relevantes y una videoendoscopía digestiva alta (VEDA) en la que se observaron pliegues gástricos engrosados con formaciones pseudopolipoideas de predominio antral y corporal con una mucosa eritematosa, edematosa, nodular y friable. La histología reveló hiperplasia y dilatación de las foveolas glandulares sin observar signos de malignidad ni identificar Helicobacter pylori. En el 2008 el paciente presentaba un estudio endoscópico alto normal. Se inició tratamiento con hierro por vía oral y posteriormente parenteral por falta de respuesta. En abril de 2014, ante la aparición de hipoproteinemia progresiva (proteínas totales 4,8 g/dl), se realizó una nueva VEDA en la que se visualizó mayor afectación macroscópica (Figura 1). Se tomaron múltiples biopsias y se realizó una macrobiopsia con un asa de polipectomía que mostró una mucosa constituida por un componente glandular con hiperplasia foveolar y dilataciones quísticas, erosión del epitelio de superficie y un estroma edematoso y congestivo con fibras musculares lisas e infiltrando inflamatorio mixto con frecuentes eosinófilos (Figura 2). Los hallazgos endoscópicos e histológicos, junto con la aparición de la hipoproteinemia e hipoalbuminemia llevaron a plantear el diagnóstico de enfermedad de Ménétrier una vez descartadas otras causas de engrosamiento de los pliegues gástricos como el síndrome de Zollinger Ellison, las gastropatías infiltrativas o los síndromes polipósicos (el estudio de los genes APC y MUTYH responsables de la poliposis adenomatosa familiar no detectó ganancias ni pérdidas de material genético). Inicialmente se intentó un manejo conservador: se suspendió el tratamiento antiagregante y se indicó tratamiento con inhibidores de la bomba de protones y lanreótido 60 mg cada 28 días. A pesar de estas medidas, las cifras de hemoglobina y de las proteínas totales continuaron en descenso, junto con un deterioro marcado del estado general y la aparición de deposiciones melénicas. Ante este escenario, se propuso tratamiento quirúrgico que el paciente rechazó por lo que se planteó la posibilidad de tratamiento con cetuximab. Sin embargo, el empeoramiento analítico (proteínas totales 2,6 g/dl; albúmina 1,3 g/dl; hemoglobina 7,7 g/ dl) a pesar de nutrición parenteral domiciliaria asociado a la aparición de edema en miembros inferiores, ascitis y derrame pleural llevaron al paciente a reconsiderar su postura. Finalmente, se llevó a cabo la gastrectomía total sin complicaciones. Las alteraciones analíticas se normalizaron a las dos semanas con rápida mejoría clínica. En la última visita, seis meses tras la cirugía, el paciente se encontraba asintomático.
Discusión
La enfermedad de Ménétrier, también llamada gastropatía hipersecretora hiperplásica o gastropatía hipertrófica pierde proteínas, es una infrecuente entidad adquirida de prevalencia desconocida descrita en autopsias en 1888 por Pierre Eugène Ménétrier.1 Más frecuente en varones de edad media, puede presentarse en ambos sexos y a cualquier edad, existiendo una variante infantil de mejor pronóstico.
La patogénesis de esta enfermedad continúa sin ser bien comprendida. La hipótesis más aceptada apunta a una sobreproducción del factor de crecimiento transformante alfa (TGF-alfa) que produce un aumento de la activación del receptor del factor de crecimiento epidérmico (EGFR) resultando en una proliferación excesiva de las células mucosas del fundus y el cuerpo gástrico.2, 3 Asimismo, el TGF-alfa estimula la producción de mucina a nivel gástrico e inhibe la secreción ácida, hecho que explica la situación de la hipoclorhidria con niveles normales o ligeramente aumentados de gastrina observados en esta enfermedad.4 Por otro lado, el citomegalovirus (CMV) parece jugar un papel importante en la forma infantil al interaccionar con el EGFR y estimular la proliferación epitelial. En esta variante, la resolución de la infección suele acompañarse de la normalización mucosa.5, 6 En adultos se ha identificado la presencia de CMV de forma anecdótica.7 Se ha sugerido la posible participación del Helicobacter pylori en la patogenia de esta enfermedad y la regresión de la misma tras el tratamiento erradicador.8 Existen casos publicados que asocian esta enfermedad con el virus del herpes simple,9 el mycoplasma pneumoniae 10 y la colitis ulcerosa.11 No se dispone de criterios diagnósticos definidos por lo que es necesario la combinación de hallazgos clínicos, endoscópicos e histológicos para realizar el diagnóstico.
Clínicamente puede presentar una gran variedad de manifestaciones como epigastralgia, astenia, anorexia, pérdida de peso, náuseas, vómitos, hemorragia digestiva o diarrea. Es característica la presencia de hipoproteinemia e hipoalbuminemia sin proteinuria, que en ocasiones condiciona la aparición de edema periférico, ascitis, derrame pleural o pericárdico.12 El paciente de nuestro caso presentó inicialmente anemia secundaria a las pérdidas digestivas como única manifestación de la enfermedad. Sin embargo, con el tiempo desarrolló clínica secundaria a la pérdida de proteínas a través de la mucosa gástrica.
La forma infantil suele presentarse a edades tempranas y se resuelve de forma espontánea en pocas semanas.6 Sin embargo, en adultos la enfermedad suele cronificarse y se considera una entidad premaligna por predisponer a la aparición de cáncer gástrico. La magnitud de este riesgo no está bien establecida por la escasa prevalencia de la enfermedad.12
Endoscópicamente es característica la presencia de pliegues mucosos gástricos gigantes, tortuosos y de aspecto cerebriforme que no se aplanan con la insuflación. La mucosa muestra un aspecto polipoideo, mamelonado o nodular con áreas erosionadas e incluso ulceradas. Afecta predominantemente a la curvatura mayor del cuerpo y al fundus con el antro generalmente preservado. La afectación antral como en el caso presentado no excluye la posibilidad de enfermedad de Ménétrier.12 Es frecuente encontrar un aumento de la secreción de moco y un pH alcalino en el aspirado gástrico.12
La histología es característica pero no patognomónica. Muestra una hiperplasia foveolar difusa intensa, las criptas son grandes y dilatadas, y hay pérdida de células parietales y principales que son sustituidas por células mucosas, pudiendo existir un leve infiltrado inflamatorio con eosinófilos en la lámina propia.12 La biopsia convencional en muchas ocasiones no logra una profundidad suficiente para demostrar la pérdida de las glándulas oxínticas, por lo que se recomienda la realización de una macrobiopsia con asa de polipectomía que incluya la muscular de la mucosa. En todos los casos debe descartarse la infección por Helicobacter pylori y al menos, en la forma infantil, el CMV.
La enfermedad puede conducir a una desnutrición calórico-proteica, es de gran importancia el tratamiento de soporte con dieta hiperproteica y suplementos nutricionales y en ocasiones incluso nutrición parenteral como en el caso presentado. En las formas infantiles suele ser suficiente el tratamiento conservador; el uso de ganciclovir se reserva para casos graves y/o prolongados, pacientes inmunocomprometidos o neonatos.6 La gastrectomía total o subtotal con preservación antral constituye el tratamiento clásico al lograr la curación y eliminar el potencial riesgo de cáncer gástrico. Hasta la fecha, no se han realizado ensayos clínicos para evaluar el tratamiento médico. En casos con infección documentada por Helicobacter pylori se recomienda su erradicación ya que de forma anecdótica se ha observado regresión de la hiperplasia mucosa. Se han documentado casos y series de casos en los que se emplean antagonistas de los receptores H2, inhibidores de la bomba de protones, anticolinérgicos y octreótide con resultados variables. Existen en la literatura pacientes tratados con octreótide con rápida y mantenida resolución de la clínica y pérdida de proteínas a pesar de la persistencia de los pliegues gástricos engrosados.14-16 En el año 2000, Burdick y col17 emplearon un anticuerpo monoclonal dirigido contra el EFGR, el cetuximab, en un paciente con enfermedad avanzada y refractaria a varios tratamientos con mejoría precoz de la sintomatología y de la hipoalbuminemia. Posteriormente, otros pacientes han sido tratados con cetuximab con buenos resultados.18 En un estudio no controlado con nueve pacientes con enfermedad grave se objetivó la mejoría histológica con mínimos efectos adversos en los siete pacientes que completaron el tratamiento.19 A pesar de todo, cinco pacientes precisaron cirugía. Por otro lado, se ha documentado recurrencia de la enfermedad tras respuesta inicial favorable,20 lo que lleva a cuestionar el entusiasmo inicial.
La aparición de diversas alternativas terapéuticas ha supuesto un avance importante para los pacientes con alto riesgo quirúrgico o que rechazan la cirugía. A pesar de que la evidencia es todavía escasa, dada la agresividad de la cirugía y la posibilidad de mantenerla como rescate terapéutico, parece razonable al menos intentar el tratamiento conservador y relegar la opción quirúrgica a casos graves o refractarios como el presentado. Si se opta por el tratamiento conservador, es importante el seguimiento endoscópico por la posibilidad de malignización.
Conclusión
La enfermedad de Ménétrier es una causa infrecuente de anemia ferropénica. La aparición de diversos tratamientos médicos comienza a permitir relegar la cirugía a casos graves o refractarios, aunque todavía se precisa de ensayos clínicos que avalen su eficacia.
Conflictos de interés. Todos los autores cumplen los requisitos de autoría y todos han declarado no tener ningún conflicto de interesses. No se han recibido aportes económicos para la realización del trabajo.
Referencias
- Ménétrier P. Des polyadénomes gastriques et leur rapport avec le cancer de l’estomac. Arch Physiol Norm Pathol 1888; 1: 236-262.
- Dempsey PJ, Goldenring JR, Soroka CJ, Modlin IM, McClure RW, Lind CD, Ahlquist DA, Pittelkow MR, Lee DC, Sandgren EP. Possible role of transforming growth factor alpha in the pathogenesis of Ménétrier’s disease: supportive evidence form humans and transgenic mice. Gastroenterology 1992; 103: 1950.
- Coffey RJ, Washington MK, Corless CL, Heinrich MC. Ménétrier disease and gastrointestinal stromal tumors: hyperproliferative disorders of the stomach. J Clin Invest 2007; 117: 70-80.
- Coffey RJ, Romano M, Goldenring J. Roles for transforming growth factor-alpha in the stomach. J Clin Gastroenterol 1995; 21: S36-S39.
- Cardona Barberán A, Sorní Hubrecht A, Hostalot Abás A, Rosal Roig J, Mercé Gratacós J, Izuel Navarro JA. Ménétrier’s disease of childhood and acute cytomegalus virus infection. An Pediatr (Barc) 2006; 64: 478-480.
- Megged O, Schlesinger Y. Cytomegalovirus-associated protein-losing gastropathy in childhood. Eur J Pediatr 2008; 167: 1217-1220.
- Xiao SY, Hart J. Marked gastric foveolar hyperplasia associated with active cytomegalovirus infection. Am J Gastroenterol 2001; 96: 223-226.
- Bayerdörffer E, Ritter MM, Hatz R, Brooks W, Ruckdeschel G, Stolte M. Healing of protein losing hypertrophic gastropathy by eradication of Helicobacter pylori: is Helicobacter pylori a pathogenic factor in Menetrier’s disease? Gut 1994; 35: 701-714.
- Jun DW, Kim DH, Kim SH, Song MH, Lee HH, Kim SH, Jo YJ, Park YS. Menetrier’s disease associated with herpes infection: response to treatment with acyclovir. Gastrointest Endosc 2007; 65: 1092-1095.
- Ben Amitai D, Zahavi I, Dinari G, Garty BZ. Transient protein-losing hypertrophic gastropathy associated with Mycoplasma pneumoniae infection in childhood. J Pediatr Gastroenterol Nutr 1992; 14: 237-239.
- Hatemi I, Caglar E, Atasoy D, Goksel S, Dobrucali A. Menetrier’s disease coexisting with ulcerative colitis and sclerosing cholangitis. Dig Liver Dis 2008; 40: 78-79.
- Rich A, Toro TZ, Tanksley J, Fiske WH, Lind CD, Ayers GD, Piessevaux H, Washington MK, Coffey RJ. Distinguishing Ménétrier´s disease from its mimics. Gut 2010; 59: 1617-1624.
- Maffei M, Piessevaux H, Jouret-Mourin A. Polypoid lesions in the stomach and proximal esophagus. Ménétrier’s disease of the stomach. Gastroenterology 2011; 140: 332-369.
- Yeaton P, Frierson HF. Octreotide reduces enteral protein losses in Ménétrier´s disease. Am J Gastroenterol 1993; 88: 95.
- Green BT, Branch MS. Menetrier’s disease treated with octreotide long-acting release. Gastrointest Endosc 2004; 60: 1028-1029.
- Rothenberg M, Pai R, Stuart K. Successful use of octreotide to treat Ménétrier’s disease: a rare cause of abdominal pain, weight loss, edema, and hypoalbuminemia. Dig Dis Sci 2009; 54: 1403.
- Burdick J, Chung E, Tanner G, Sun M, Paciga JE, Cheng JQ, Washington K, Goldenring JR, Coffey RJ. Treatment of Ménétrier’s disease with a monoclonal antibody against the epidermal growth factor receptor. N Engl J Med 2000; 343: 1697-1701.
- Settle SH, Washington K, Lind C, Itzkowitz S, Fiske WH, Burdick JS, Jerome WG, Ray M, Weinstein W, Coffey RJ. Chronic treatment of Ménétrier’s disease with Erbitux: clinical efficacy and insight into pathophysiology. Clin Gastroenterol Hepatol 2005; 3: 654.
- Fiske WH, Tanksley J, Nam KT, Goldenring JR, Slebos RJ, Liebler DC, Abtahi AM, La Fleur B, Ayers GD, Lind CD, Washington MK, Coffey RJ. Efficacy of cetuximab in the treatment of Menetrier’s disease. Sci Transl Med 2009; 1: 1-18.
- Patel M, Mottershead M. Disease recurrence following cetuximab completion and declining a gastrectomy: what next to manage Ménétriers disease? BMJ Case Rep 2014; 1: 2014.
- Penfield JD, Almazar AE, Saito YA, Locke GR, Tilkes KE, Choung RS, Schleck CD, Zinsmeister AR, Talley NJ. Menetrier’s disease is associated with an increased risk of gastric cancer: A case-control study. Gastroenterology 2013; 144: S-680.
Correspondencia: Ana García García de Paredes
Hospital Ramón y Cajal. Carretera de Colmenar km 9.100; 28034. Madrid, España
Tel.: +34 606578982
Fax: +34 913368402
Correo electrónico: anaggparedes@gmail.com
Acta Gastroenterol Latinoam 2016;46(2):118-121
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE