María Laura Moreno6 ID· Ezequiel Balaban1 ID· Sofía Laudanno1 ID· Ignacio Brichta1 ID· Ana Florencia Costa2 ID· Carla Wassner2 ID· Nadia Kujta3 ID· Mauricio Paternó4 ID· Mariana Rizzolo5 ID Mirta Kujaruk6 ID
1 Servicio de Clínica médica.
2 Servicio de Nutrición.
3 Sección de Hematología.
4 Servicio de Diagnóstico por imágenes.
5 Servicio de Patología.
6 Sección de Intestino delgado.
Hospital de Gastroenterología Dr. C. Bonorino Udaondo.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2024;54(3):278-286
Recibido: 27/12/2023 / Aceptado: 19/08/2024 / Publicado online el 30/09/2024 /
https://doi.org/10.52787/agl.v54i3.383
Resumen
La enfermedad celíaca es la causa más frecuente de atrofia de las vellosidades intestinales. Puede presentarse con un cuadro clínico caracterizado por diarrea crónica, malabsorción y pérdida de peso. El diagnóstico se basa en la presencia de anticuerpos específicos positivos en el suero, la enteropatía característica y la respuesta clínica e histológica a la dieta libre de gluten. Sin embargo, en ocasiones los pacientes con atrofia vellositaria que no responden a la exclusión de gluten de la dieta plantean un desafío diagnóstico y terapéutico. Existen diferentes patologías que pueden mimetizarse con la enfermedad celíaca; por eso es importante realizar un diagnóstico diferencial. Es conocida la asociación de la enfermedad celíaca con otras enfermedades inmunomediadas, entre ellas la enfermedad inflamatoria intestinal. También se considera frecuente su asociación con la colitis microscópica, siendo esta última una causa posible de persistencia o recurrencia de los síntomas. El curso clínico de la enfermedad celíaca puede complicarse con el desarrollo de distintas condiciones tales como la colitis microscópica, la enfermedad celíaca refractaria o el sprue colágeno. El sprue colágeno es una enteropatía infrecuente que afecta al intestino delgado y se caracteriza por la presencia de atrofia vellositaria y una banda ancha de colágeno subepitelial. Puede asociarse a gastritis y colitis linfocítica y/o colágena. La literatura describe su asociación con otras enfermedades autoinmunes. Puede complicarse con ulceración, perforación y desarrollo de linfoma intestinal, por lo que presenta alta morbimortalidad y mal pronóstico. El conocimiento acerca de la historia natural, la patogénesis y la evolución clínica del sprue colágeno es limitado. Algunas publicaciones más recientes describen un curso benigno con buena respuesta al tratamiento con inmunosupresores. Sin embargo, es muy infrecuente la concomitancia de la enfermedad celíaca, la enfermedad inflamatoria intestinal y el sprue colágeno. Caso clínico. Presentamos el caso de un paciente de 52 años al que se le diagnosticó gastroenteritis colágena asociada a enfermedad inflamatoria intestinal, con evolución desfavorable a pesar del tratamiento. Conclusión. El reporte de otros casos de asociación entre el sprue colágeno y la enfermedad inflamatoria intestinal podría ayudar a mejorar el manejo clínico de estos pacientes.
Palabras claves. Enteropatía, sprue colágeno, gastritis colágena, enteritis colágena, enfermedad celíaca, malabsorción, enfermedad inflamatoria intestinal, diarrea crónica.
Collagenous Sprue, Collagenous Gastritis, and an Uncommon Association with Inflammatory Bowel Disease: A Case Report
Summary
Celiac disease is the most common cause of intestinal villous atrophy. It may present with a clinical course characterized by chronic diarrhea, malabsorption, and weight loss. Diagnosis is based on the presence of positive specific antibodies in serum, characteristic enteropathy, and the clinical and histological response to a gluten-free diet. However, in some cases, patients with villous atrophy who do not respond to the exclusion of gluten from the diet present a diagnostic and therapeutic challenge. It is essential to perform a differential diagnosis, as there are different pathologies that can mimic celiac disease. The association of celiac disease with other immune-mediated diseases is well known, including inflammatory bowel disease. It is also frequently associated with microscopic colitis, which may be a potential cause of persistent or recurrent symptoms. The clinical course of celiac disease may be complicated by the development of additional conditions such as microscopic colitis, refractory celiac disease or collagenous sprue. Collagenous sprue is a rare enteropathy affecting the small intestine, characterized by the presence of villous atrophy and a thick band of subepithelial collagen. It may be associated with gastritis and lymphocytic and/or collagenous colitis. The literature describes its association with other autoimmune diseases. Complications may include ulceration, perforation, and the development of intestinal lymphoma. Consequently, it has high morbidity and mortality, and a poor prognosis. Knowledge about the natural history, pathogenesis and clinical evolution of collagenous sprue is limited. Some recent publications describe a benign course with a good response to treatment with immunosuppressants. However, the coexistence of celiac disease, inflammatory bowel disease and collagenous sprue is rare, and is presented as isolated case reports. Case report. We present the case of a 52-year-old male patient diagnosed with collagenous gastroenteritis associated with inflammatory bowel disease, with unfavorable evolution despite treatment. Conclusion. The report of additional cases of association between collagenous sprue and inflammatory bowel disease could help improve the clinical management of these patients.
Keywords. Enteropathy, collagenous sprue, collagenous gastritis, collagenous enteritis, celiac disease, malabsorption, inflammatory bowel disease, chronic diarrhea.
Abreviaturas
AV: Atrofia vellositaria.
EC: Enfermedad celíaca.
DLG: Dieta libre de gluten.
SC: Sprue colágeno.
ID: Intestino delgado.
LIE: Linfocitosis intraepitelial.
BCS: Banda de colágeno subepitelial.
AINE: Antiinflamatorios no esteroideos.
MMP: Metaloproteinasas.
ITMP:: Inhibidor tisular de metaloproteinasas.
IBP: Inhibidores de la bomba de protones.
6-TG: Tioguaninas.
EII: Enfermedad inflamatoria intestinal.
ECR: Enfermedad celíaca refractaria.
TC: Tomografía computada.
NPT: Nutrición parenteral total.
EmA: Antiendomisio.
DGP: Anti péptidos deaminados de gliadina.
a-tTG IgA: Anti transglutaminasa.
IHQ: Inmunohistoquímica.
PET/TC: Tomografía por emisión de positrones.
CU: Colitis ulcerosa.
Introducción
En el estudio de pacientes con diarrea crónica, ante el hallazgo de atrofia vellositaria (AV) en biopsias del intestino delgado (ID), es necesario confirmar el diagnóstico etiológico preciso para poder brindar un tratamiento específico. En caso de AV y anticuerpos específicos para la enfermedad celíaca (EC) negativos, se plantea la posibilidad de EC seronegativa y el diagnóstico diferencial con otras patologías que cursan con AV pero que no responden al tratamiento con la dieta libre de gluten (DLG). Estas entidades se engloban bajo la denominación «AV no celíaca».
El sprue colágeno (SC) es una condición clínico-patológica infrecuente que afecta al ID y forma parte del diagnóstico diferencial de AV no celíaca.1 Sus características clínicas a menudo simulan una EC ya que cursa con diarrea crónica, malabsorción, pérdida de peso, hipoalbuminemia y anemia. También comparten hallazgos histológicos como la presencia de AV y linfocitosis intraepitelial (LIE), de modo que el diagnóstico diferencial entre ambas patologías puede ser desafiante.1 En la literatura han sido reportados un número limitado de casos de SC, y los criterios diagnósticos no están bien definidos. Histológicamente se caracteriza por la presencia de un engrosamiento irregular y parcheado de una banda subepitelial de colágeno de 10 a 20 μm de espesor e incluso mayor. Además, presenta AV, LIE, desprendimiento del epitelio de superficie, atrapamiento característico de capilares y células inflamatorias de la lámina propia (fibroblastos y linfocitos), aumento del número de células plasmáticas, neutrófilos y eosinófilos, así como también áreas de mucosa ulcerada. En ocasiones se puede asociar con depósito de colágeno subepitelial también en el estómago y/o en el colon, constituyendo así cuadros de gastritis y colitis colágena, respectivamente.2,3 La edad media de los pacientes diagnosticados es de 56 años, con predominio en mujeres (2 a 1 en relación a los hombres).
Muchos autores sugieren la asociación entre la EC y el SC en base a reportes de casos. El SC puede aparecer en el curso clínico de la EC como una complicación caracterizada por deterioro clínico progresivo con malabsorción, déficit nutricional, enteropatía perdedora de proteínas y falta de respuesta a la DLG. Ocasionalmente, el SC puede complicarse con el desarrollo de un linfoma.3 Un tercio de pacientes con EC no tratada puede presentar un depósito de colágeno subepitelial inespecífico que generalmente desaparece con la DLG. Mientras que la EC se trata con la restricción del gluten de la dieta (en la mayoría de los casos los pacientes presentan mejoría clínica e histológica), el SC no mejora con dicha dieta y puede ser necesario el tratamiento con inmunosupresores. Por otro lado, cuando un paciente con EC presenta persistencia o recurrencia de los síntomas (considerada EC no respondedora) es necesario realizar una nueva biopsia intestinal para evaluar la persistencia de AV y la presencia de una banda de colágeno subepitelial (BCS). El SC en este caso complica el curso de la EC y es importante iniciar un tratamiento temprano para prevenir la progresión a la fibrosis.4 La mayoría de los pacientes afectados por la EC presentan HLA DQ2/DQ8, no así todos los pacientes con SC. Esto sugiere que este último puede ocurrir en ausencia de la EC. Freeman describió al SC como una enfermedad inflamatoria de la mucosa que puede aparecer asociado a: trastornos autoinmunes (Síndrome de Sjögren, artritis o lupus eritematoso sistémico), medicamentos (antiinflamatorios no esteroideos -AINE-) y síndrome paraneoplásico en algunos tumores malignos. También ha sido reportado en individuos con sprue tropical, intolerancia a la leche de vaca, miotonía distrófica e inmunodeficiencia común variable.5 El 63-70% de los pacientes con SC presenta alguna enfermedad autoinmune asociada, como artritis, que requiere el uso de AINE para aliviar los síntomas. Dado que se ha postulado la asociación entre el uso de estos medicamentos y el desarrollo de colágeno subepitelial, es de vital importancia indagar acerca de su uso ante la presencia de colágeno subepitelial en las biopsias intestinales. El mecanismo por el cual los AINE se encuentran involucrados en la patogénesis del SC no se conoce con exactitud.6 Recientemente se han descrito casos de depósito de colágeno en pacientes tratados con olmesartán, un antagonista del receptor de angiotensina II utilizado en el tratamiento de la hipertensión arterial.7 La etiopatogenia definitiva del SC se desconoce. En una serie de casos de SC analizados en la Mayo Clinic se observó asociación con enfermedades inmunomediadas en el 70% de los casos y la EC fue la más frecuente. Otras enfermedades asociadas fueron colitis microscópica, hipotiroidismo y enteropatía autoinmune. En 8 de 30 pacientes, el depósito de colágeno se presentó también en el colon o el estómago. Los autores reportan una respuesta clínica del 80% al tratamiento combinado con DLG y agentes inmunosupresores, mejoría histológica en 9 pacientes y remisión completa en 5 de ellos. Dos pacientes murieron, uno por complicación del SC.8
Daum y col., describen como mecanismo fisiopatológico del aumento del colágeno subepitelial en el SC un desequilibrio entre la síntesis y la degradación del colágeno. El colágeno tipo I es el componente principal de la matriz extracelular en el tracto gastrointestinal. Su síntesis es estimulada por distintos factores de crecimiento (transformador beta, símil insulina I, derivado de plaquetas, fibroblástico beta e interleuquinas 4 y 13) y es inhibida por la interleuquina 1 y el factor de crecimiento derivado de plaquetas-BB. La producción de estas citoquinas puede verse afectada por factores como dieta, medicamentos, infecciones, inflamación y trauma. Las metaloproteinasas (MMP) de la matriz son las enzimas clave involucradas en su degradación. La MMP-1 (llamada colagenasa intersticial) es la principal enzima fibrilar que degrada el colágeno en el intestino. Es secretada por células del tejido conectivo y macrófagos. La expresión y la actividad de las MMP están reguladas en varios niveles: transcripcional, por inhibidores fisiológicos (alfa-macroglobulina) e inhibidores tisulares de MMP (TIMP). El TIMP-1 es el inhibidor central que inactiva irreversiblemente a la mayoría de las MMP. El mismo ha sido implicado como un actor clave en la promoción de la fibrosis tisular. Esto puede causar una sobreproducción de colágeno y su consecuente depósito.9 Se conoce el efecto pro fibrogénico de los eosinófilos. Su presencia en el infiltrado inflamatorio puede predecir un pronóstico peor. Esclarecer los polimorfismos en los genes que conducen a una mayor producción de factores pro fibrogénicos o una mayor sensibilidad a ellos, podría aclarar aspectos fisiopatológicos y orientar futuros objetivos terapéuticos.9 La banda de colágeno en el ID normal es de 5 a 7 μm de espesor. Para el diagnóstico del SC se sugiere que el valor de corte del espesor de la banda de colágeno sea mayor de 10 μm, además de la presencia de capilares y células estromales.10 El SC puede producir ulceración y perforación del ID en forma independiente o asociadas al desarrollo de un linfoma de células T intra críptico que precede a la aparición de un linfoma clínicamente bien definido.4,11 Se ha postulado que la capa de colágeno en el ID podría predisponer a la perforación.12,13 Los reportes de casos han descrito una variedad de estrategias terapéuticas para el SC, incluyendo DLG, corticoides (entre ellos budesonida), sulfasalazina, ciclosporina, altas dosis de inhibidores de la bomba de protones (IBP) y anticuerpos monoclonales anti TNF-α. Sin embargo, aún no existen protocolos de tratamiento aceptados globalmente. Maguire y col. describieron que la mitad de los pacientes responden al tratamiento con DLG y esteroides.14 Sin embargo, algunos pacientes presentan un curso clínico desfavorable y mueren por malnutrición.8 Las tioguaninas (6-TG) son análogas de purinas que provienen de la familia de tiopurinas e incluyen a la mercaptopurina y la azatioprina. Estas drogas son utilizadas en el tratamiento de la enfermedad inflamatoria intestinal (EII) y la enfermedad celíaca refractaria (ECR) tipo I en dosis de 2-2,5 mg/kg. Algunos autores sugieren que estas drogas podrían ser una opción terapéutica atractiva para pacientes con SC. Se han reportado casos en los cuales utilizaron 6-TG asociadas a budesonida. Las 6-TG podrían tener efecto hepatotóxico ya que fueron relacionadas con el desarrollo de hiperplasia nodular regenerativa, enfermedad venooclusiva e hipertensión portal no cirrótica, aunque en las dosis utilizadas demostraron ser drogas seguras. Requieren monitoreo de enzimas hepáticas y recuento de plaquetas.15 Otros pacientes han sido tratados con budesonida (9 mg/día por 8 semanas, 6 mg/día por 4 semanas y 3 mg/día por 4 semanas adicionales) junto con la suplementación oral de calcio y vitaminas.
Caso clínico
Presentamos el caso de un paciente con gastroenteritis colágena asociada a EII. Se obtuvo el consentimiento informado por escrito del paciente para la publicación de su caso.
En mayo de 2023 un paciente de sexo masculino de 52 años de edad ingresó a la sala de internación del Hospital de Gastroenterología Dr. C. Bonorino Udaondo por presentar un cuadro clínico de 11 meses de evolución caracterizado por diarrea crónica, pérdida de peso, desnutrición, astenia, dolor abdominal y vómitos. Refirió aumento del número de deposiciones habituales (6-7/día, Bristol 7) asociado a dolor abdominal localizado en epigastrio, y vómitos postprandiales ocasionales que aliviaban parcialmente el dolor. Presentaba pérdida del 50% de su peso habitual (de 75 kg a 35 kg). Era oriundo de la provincia de Entre Ríos y su trabajo consistía en el almacenamiento de cereales; refirió que tenía contacto con algunos agroquímicos. Su único antecedente quirúrgico era una hernioplastia inguinal izquierda. Negó consumir alcohol o drogas, y no fumaba.
Trajo estudios previos realizados en otro centro, los cuales se detallan a continuación: serología para VIH, Chagas, hepatitis B y C, y prueba de PPD (reacción de Mantoux) negativas. La videoendoscopía digestiva alta mostró esofagitis grado B (clasificación de los Ángeles), hernia de hiato por deslizamiento, mucosa de techo y cuerpo gástrico con patrón granular, antro congestivo con erosiones y duodeno sin lesiones. Las biopsias informaban gastritis antral crónica asociada a Helicobacter pylori, por lo que recibió tratamiento antibiótico. La colonoscopía describía mucosa con edema y múltiples erosiones pequeñas cubiertas con fibrina, con mucosa de aspecto granular en colon ascendente. La histología informaba colitis crónica inespecífica. Una tomografía computada (TC) de abdomen y pelvis previa no evidenciaba engrosamientos parietales ni adenopatías, con el único hallazgo de hidrocele bilateral.
En el examen físico, el paciente se encontraba delgado, con sarcopenia, abdomen blando, depresible y con leve dolor en epigastrio; no se palparon masas, visceromegalias ni adenomegalias. No presentaba edemas en miembros inferiores.
El examen de laboratorio de ingreso evidenció: albúmina 1,75 mg/dl; proteínas totales 3,5 mg/dl; eritrosedimentación 19 mm/h; PCR 13,6 mg/dl y gamma globulina 1,2 g/dl. En la evaluación conjunta con el servicio de nutrición se decidió iniciar soporte con nutrición parenteral total (NPT). Se solicitó toxina A y B más antígeno para Clostridium difficile que resultaron negativos. La recolección de materia fecal de 24 horas mostró volumen aumentado de 700 g/día; clearence de alfa 1 antitripsina 126 ml/24 horas (valor normal hasta 16); esteatocrito 0,5% (valor normal hasta 6%), calprotectina fecal mayor de 1000 ng/kg y elastasa fecal 250 ng/g. El cuadro clínico se interpretó como enteropatía perdedora de proteínas y desnutrición crónica. Se solicitó serología para EC: IgA total 159 (valor normal 70-400 mg/dl), anticuerpo antiendomisio (EmA) IgA negativo, anti péptido deaminado de gliadina (DGP) IgG 50 U/ml (valor normal menor de 10 U/ml) y anti transglutaminasa tisular (a-tTG) IgA 6 U/ml (valor normal menor de 10). La tipificación de los alelos HLA por PCR
fue: DQ2 DQ7 positivo: DQB1*02/ DQA1*05 y DQB1*03/DQA1*05 (DQ2.5/7.5), lo que representa una predisposición elevada para la EC. Se investigó: VIH (ELISA) negativo; vitamina D14 ng/mL; vitamina B12 170 pg/ml; ferremia 46 mcg/dl; ferritina 470 ng/mL; ácido fólico 14,6 ng/ml; TSH 2,09 μUI/ml; T4 4,82 ng/dl; ASCA IgA 1 U; ASCA IgG 1 (normal hasta 20 U); ANCA-C negativo. Una entero TC con contraste evidenció hipoesplenia, yeyunalización del íleon distal y escaso líquido libre. Se solicitó video endoscopía digestiva alta en la que se observó mucosa gástrica con patrón macronodular difuso y disminución de la distensibilidad, duodeno hasta segunda porción con patrón nodular y pliegues festoneados (Figura 1). Las biopsias gástricas antrales y corporales evidenciaron marcado infiltrado inflamatorio linfoplasmocitario con presencia de metaplasia intestinal completa focal y áreas de desprendimiento epitelial con la presencia de una BCS mayor a 10 μm de espesor. No se identificaron microorganismos. Tinciones de Giemsa y Rojo Congo negativas. Las biopsias duodenales mostraron AV, recuento normal de LIE, infiltrado de linfocitos, plasmocitos, neutrófilos y eosinófilos en la lámina propia, desprendimiento del epitelio de superficie y una BCS mayor a 10 μm de espesor con atrapamiento de pequeños vasos y células inflamatorias. La tinción con tricrómico de Masson fue positiva. Se concluyó como gastroenteritis colágena (Figura 2). Se solicitó video colonoscopía para evaluar la presencia de depósito de colágeno en colon, la cual informó la presencia de válvula ileocecal y mucosa de íleon terminal de aspecto conservado. Desde sigma hasta región proximal al ciego se observó mucosa con áreas nodulares y presencia de úlceras profundas con bordes elevados, mayores de
15 mm, con mucosa interpuesta conservada y puentes mucosos. La mucosa del recto se encontraba respetada. Se interpretó como colitis extensa. La histología del colon evidenció distorsión críptica leve y lámina propia ensanchada por la presencia de infiltrado inflamatorio linfoplasmocitario moderado y aislados microabscesos crípticos con mucosa parcialmente erosionada. La mucosa de recto también presentaba distorsión críptica, intenso infiltrado linfoplasmocitario y agregados histiocitarios. No se observó BCS con la técnica de tricrómico de Masson. La inmunohistoquímica para determinar la expresión de anticuerpo para CMV fue negativa y se concluyó como recto colitis crónica de afectación parcheada y actividad focal leve. Se realizó prueba cutánea de derivado proteico purificado (PPD) y TC de tórax que fueron normales. A favor del diagnóstico de EC presentaba atrofia vellositaria con anticuerpo DGP IgG positivo y la predisposición del HLA y en contra del diagnóstico anticuerpos a-tTG IgA y EmA IgA negativos con ausencia de LIE en la biopsia intestinal.
Figura 1. Video endoscopía digestiva alta. Visión de la segunda porción duodenal con imagen de «empedrado», nodularidad y festoneado de los pliegues («signo del peine»)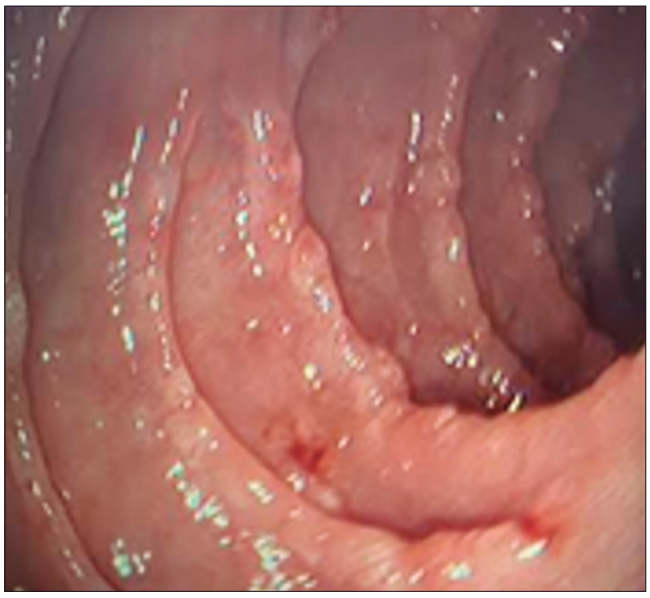
Figura 2. Anatomía patológica intestinal. Engrosamiento de la capa de colágeno subepitelial, atrofia vellositaria y desprendimiento del epitelio de superficie (tinción con tricrómico de Masson, magnificación x 200)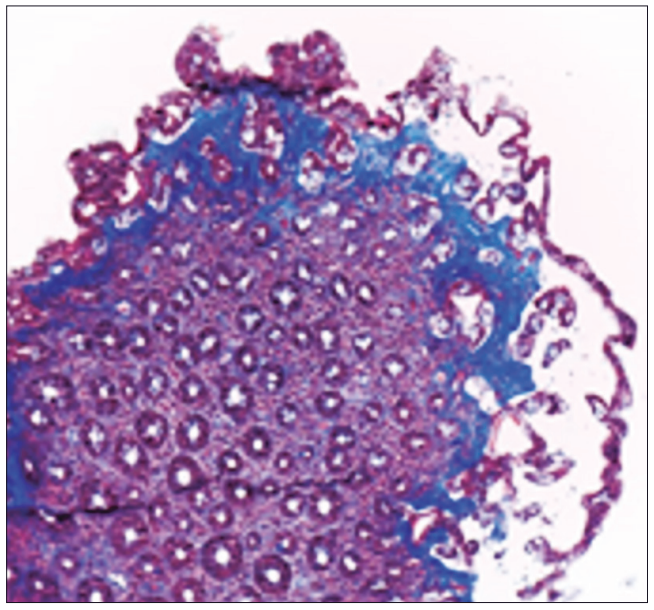
Frente al diagnóstico confirmado de gastroenteritis colágena, se inició tratamiento con IBP en altas dosis, glucocorticoides endovenosos (hidrocortisona 200 mg/día) y se decidió iniciar DLG. Por la presencia de SC y sospecha de asociación con EII (probable Enfermedad de Crohn) se solicitó videocápsula endoscópica y enteroresonancia para evaluación del compromiso del intestino delgado. La cápsula informó mucosa de duodeno y yeyuno con aspecto de «empedrado» y marcado «signo del peine». En el fondo de los surcos mucosos se observaron múltiples úlceras pequeñas cubiertas por fibrina, de distribución difusa. En algunos sectores los pliegues estaban distorsionados por áreas de pérdida de sustancia «en sacabocados». El compromiso del intestino delgado era extenso e incluía al yeyuno y al íleon proximal en forma difusa. En íleon distal se visualizaron vellosidades tróficas con un área aislada de congestión y erosiones (Figuras 3 A y B).
Figura 3. Videocápsula endoscópica: mucosa de yeyuno. A. «Signo del peine», surcos profundos y úlceras puntiformes con fibrina. B. Aspecto de «empedrado». Área de pliegues con superficie irregular y pérdida de sustancia de aspecto «en sacabocados» (flecha verde)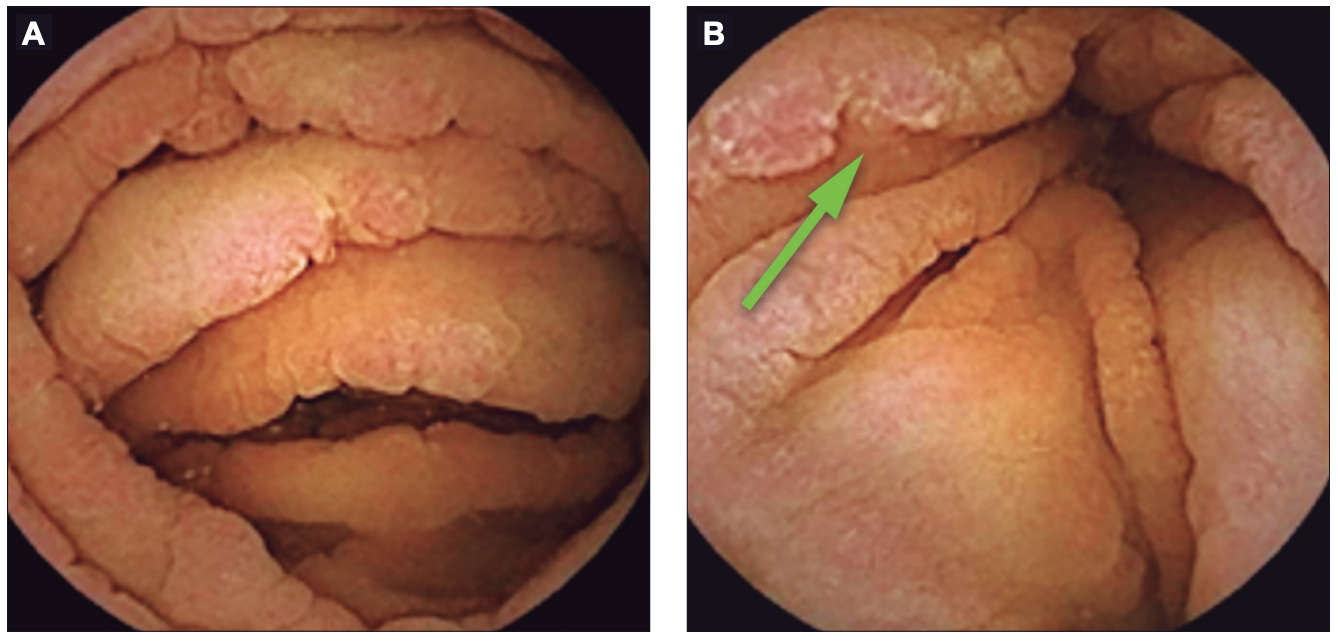
Posteriormente se solicitó una enteroscopía anterógrada que se realizó en otro centro. La misma avanzó por intestino delgado hasta 200 cm distales al ángulo de Treitz. En todo el trayecto evaluado se observó mucosa con patrón de «empedrado», «signo del peine» y múltiples úlceras pequeñas menores de 1 cm con fibrina que amputaban los pliegues. Las biopsias de yeyuno informaron alteración de la relación vellosidad-cripta, AV completa y áreas de atrofia parcial. El epitelio cúbico de revestimiento presentaba aspecto hipotrófico con tendencia a la esfacelación, con conteo normal de LIE. En sectores se observó un incremento del colágeno subepitelial mayor de 10 μm que incluía células inflamatorias. El infiltrado inflamatorio en la lámina propia presentaba predominio de plasmocitos. Los hallazgos fueron compatibles con yeyunitis colágena. Las biopsias gástricas mostraron intenso infiltrado linfoplasmocitario y cambios glandulares reactivos. Uno de los fragmentos presentaba una placa de fibrosis subepitelial similar a las muestras yeyunales, sugestiva de gastritis colágena. No se evidenció actividad inflamatoria aguda y la tinción para Helicobacter pylori fue negativa. Con la intención de descartar un linfoma intestinal, se solicitó una PET/TC ya que se planteó la posibilidad de iniciar tratamiento con agentes inmunosupresores o biológicos. La PET/TC describió un aumento difuso de la captación en colon sigmoides y recto en probable relación con la sospecha de EII, sin evidencia de enfermedad linfoproliferativa.
El paciente presentó complicación por infección asociada a catéter con rescate de Staphylococcus aureus meticilino sensible en los cultivos, por lo que recibió tratamiento con cefalotina por 10 días. Se realizó ecografía de vasos del cuello con diagnóstico de trombosis de vena yugular y subclavia derecha, por lo que se inició tratamiento anticoagulante con heparina de bajo peso molecular. Debió suspenderse la NPT en forma temporaria debido a ambas complicaciones asociadas al catéter central (infección y trombosis). El paciente evolucionó con la aparición de edemas progresivos en miembros inferiores y ascitis, que se interpretó secundaria a hipoalbuminemia y se inició tratamiento con diuréticos. Ante la persistencia de diarrea se agregó tratamiento con enzimas pancreáticas de reemplazo (pancreatina 300 mg) 10 cápsulas/día y se cambió la vía de administración de los corticoides a oral (Deltisona® B 40 mg/día) en dosis decrecientes. Posteriormente se indicó budesonida 9 mg/día (Entocort®), 3 cápsulas por día, 2 de ellas abiertas para aumentar la posibilidad de liberación del fármaco en el intestino delgado proximal, más budesonida (Cortiment MMX®) 9 mg/día vía oral para su acción en el colon. Ante la falta de respuesta clínica al tratamiento con corticoides y la asociación con EII (probable enfermedad de Crohn), en ateneo multidisciplinario se decidió iniciar tratamiento con ustekinumab (Stelara®) (anti IL-12/23). Para la elección del agente biológico se tuvo en cuenta el riesgo aumentado del paciente de desarrollar un linfoma en el contexto de una ECR o EC complicada con SC. Si bien los agentes antifactor de necrosis tumoral poseen bajo riesgo de desarrollo de linfoma, éste es mayor cuando se asocian a tiopurinas.16,17,18 La dosis inicial de ustekinumab fue de 130 mg/26 ml (5 mg/ml) endovenosa administrada en una hora sin presentar complicaciones inmediatas. Luego se continuó con 90 mg vía subcutánea a las 8 semanas, y cada 8 semanas. Se reinició la NPT, se decidió alta hospitalaria y control ambulatorio.
El paciente regresó a su lugar de origen y continuó con el tratamiento y la NPT domiciliaria. Al cabo de 20 días evolucionó con astenia, hiporexia, y disnea progresiva que requirió hospitalización en un centro de su localidad en donde falleció.
Discusión
Presentamos las características clínicas, los hallazgos histológicos, el tratamiento y la evolución de un paciente con enteropatía grave. Datos discordantes en la serología específica para EC pusieron en duda el diagnóstico y plantearon la necesidad de hacer un diagnóstico diferencial con otras causas de AV. El paciente no tenía antecedente de consumo de medicamentos asociados con el desarrollo de la enteropatía. El hallazgo de la BCS en el intestino delgado y el estómago planteó distintos escenarios: la posibilidad del debut de una ECR con mal pronóstico o un SC puro. En ambos casos se debe descartar la presencia de un linfoma intestinal. Los hallazgos histológicos en el colon demostraron la concurrencia de una EII. Múltiples estudios han investigado la asociación entre la EC y la EII. Ambas son enfermedades inmunomediadas y comparten la predisposición genética, principalmente la colitis ulcerosa (CU). Un metaanálisis de más de 60 estudios publicado en el año 2020 encontró un índice de riesgo de 4.0 para EC en pacientes con EII.19 La amplia evidencia de esta asociación, parece justificar que los pacientes con EII sean evaluados para descartar EC, especialmente aquellos que no responden al tratamiento. Por otro lado, también fue reportada la asociación entre la EC y la colitis microscópica.20 En una cohorte prospectiva evaluada entre 2005 y 2009 en la región de Uppsala, Suecia, se halló una prevalencia de EC de 2,2% en pacientes con EII. El diagnóstico de EC había sido previo al diagnóstico de la EII en la mayoría de los casos y en aquellos que padecían CU con mayor frecuencia demostraron una colitis extensa.21 Si bien existen publicaciones de la asociación de EC con colitis microscópica y EII, la asociación con SC es infrecuente. La cohorte sueca solo describe el caso de un paciente adolescente que luego de 6 meses de presentar una colectomía por CU refractaria, desarrolla SC confirmado por biopsia duodenal, con buena respuesta clínica al tratamiento con azatioprina.21 Nuestro paciente presentó un cuadro de diarrea crónica y malabsorción que requirió NPT por la presencia de insuficiencia intestinal secundaria a un compromiso extenso de la mucosa intestinal. Los estudios realizados permitieron arribar al diagnóstico de una enteropatía caracterizada por AV y depósito de colágeno subepitelial difuso en el intestino delgado y el estómago. La serología específica para la EC presentó resultados discordantes con anticuerpo a-tTG IgA negativo y DGP IgG positivo, en ausencia de déficit de IgA. El SC es una entidad clínica heterogénea que en ocasiones representa una complicación de la EC. La serología específica para la EC puede ser negativa en estos casos y ello no descarta el diagnóstico. Muchos pacientes descriptos en la literatura fueron seronegativos al momento del diagnóstico del SC, como también se observa en casos de ECR. El conteo de LIE fue normal. El estudio del HLA confirmó la presencia de los alelos predisponentes para la EC. Dada la asociación entre EC y SC iniciamos tratamiento con DLG. Frente a un paciente con debut de EC en edad tardía (mayor a 50 años) y, por lo tanto, con mayor riesgo de desarrollar complicaciones, se solicitaron PET/TC y enteroscopía con biopsias con el objetivo de descartar enfermedad linfoproliferativa asociada. La sospecha de EII asociada con compromiso del intestino delgado y el colon (probable enfermedad de Crohn) y la falta de respuesta clínica al tratamiento con corticoides, nos llevó a considerar como alternativa terapéutica a ustekinumab. El grado severo de desnutrición y el compromiso extenso de la enfermedad determinaron una mala evolución y, posteriormente, la muerte del paciente.
Conclusión
El SC es una entidad clínica poco frecuente, heterogénea y de pronóstico variable. En ocasiones se asocia a un proceso inflamatorio en la mucosa colónica y/o gástrica. Curiosamente, la colitis o la gastritis colágena y/o linfocítica se han asociado con la EC. En nuestro caso clínico, el SC se presenta en forma concomitante con gastritis colágena sin evidencia de compromiso colónico por depósito de colágeno. Sin embargo, en la video colonoscopía encontramos características endoscópicas e histológicas de una EII. La EC, la EII y el SC pueden concurrir en un mismo paciente dado que comparten factores genéticos y que las tres enfermedades son inmunomediadas. Reportamos un caso de gastroenteritis colágena en un paciente con AV y EII, que presentó una evolución desfavorable. El reporte de otros casos de asociación entre el SC y la EII podría ayudar a mejorar el manejo clínico de estos pacientes.
Consentimiento para la publicación. Se obtuvo el consentimiento informado por escrito del paciente o su padre, tutor o familiar, para la publicación de los datos y/o imágenes clínicas en beneficio de la ciencia. La copia del formulario de consentimiento se encuentra disponible para los editores de esta revista.
Propiedad intelectual. Los autores declaran que los datos y las figuras presentes en el manuscrito son originales y se realizaron en las instituciones a las que pertenecen.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflictos de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2024 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Moreno M L, Balaban E, Laudanoo S, Britcha I, Costa A F, Wassner C, Kutja N, Paternó M, Rizzolo M, Kujaruk M. Sprue colágeno, gastritis colágena y una asociación infrecuente con enfermedad inflamatoria intestinal. Reporte de un caso clínico. Acta Gastroenterol Latinoam. 2024;54(3):278-286. https://doi.org/10.52787/agl.v54i3.383
Referencias
- Kamboj AK., and Oxentenko AS. Clinical Review. Clinical and Histologic Mimickers of Celiac Disease. Clinical and Translational Gastroenterology (2017) 8, e114; DOI: 10.1038/ctg.2017.41. Official journal of the American College of Gastroenterology.
- HJ Freeman. Collagenous sprue. Can J Gastroenterol 2011;25(4):189-192.
- Gill I, Shaheen A A, Edhi A I, Amin M, Ketan Rana K, Cappell M S; Digestive Diseases and Sciences (2021) 66:4557-4564 Case Report. Novel Case Report: A Previously Reported, but Pathophysiologically Unexplained, Association Between Collagenous Colitis and Protein-Losing Enteropathy May Be Explained by an Undetected Link with Collagenous Duodenitis
- Freeman HJ. Refractory celiac disease and sprue-like intestinal disease. World J Gastroenterol. 2008 feb 14;14(6):828-30. DOI: 10.3748/wjg.14.828.
- Freeman, HJ. Review. Collagenous Sprue: A Distinctive and Heterogeneous Clinicopathologic Disorder. Gastroenterology & Hepatology Volume 5, Issue 6 June 2009.
- Vasant DH., Hayes S., Bucknall R., Lal S. Case Reports. Clinical and histological resolution of collagenous sprue following gluten-free diet and discontinuation of non-steroidal anti-inflammatory drugs (NSAIDs). BMJ Case Rep. 2013 Aug 28:2013: bcr2013200097. DOI: 10.1136/bcr-2013-200097.
- Soendergaard C, Riis LB, Nielsen OH. BMJ Case Rep 2014. Case Report. Collagenous sprue: a coeliac disease look-alike with different treatment strategy. DOI: 10.1136/bcr-2014-203721.
- Rubio-Tapia A., Nicholas J. Talley N. J., Gurudu S. R., Wu T. and Murray J. A. Gluten-Free Diet and Steroid Treatment Are Effective Therapy for Most Patients with Collagenous Sprue. Clin Gastroenterol Hepatol. 2010 April; 8(4): 344-349.e3.
- Xiangrong Zhao, Rebecca L. Johnson. Collagenous Sprue. A Rare, Severe Small-Bowel Malabsorptive Disorder. Arch Pathol Lab Med. 2011; 135:803-809
- Xiao Z, Vijaya M. Dasari VM, Kirby DF., Bronner M., Plesec TP., and Lashner BA. Collagenous Sprue: A Case Report and Literature Review. Gastroenterology & Hepatology Volume 5, Issue 6 June 2009.
- Evans MG., Guccione JP., Crymes A., Li X. Johnson CA., Chandan VS., and Lu Y. Case Report. Atypical Presentations of Collagenous Gastritis Mimicking Celiac Sprue. Case Reports in Gastrointestinal Medicine Volume 2023, Article ID 4073588, DOI: org/10.1155/2023/4073588.
- Freeman H J, Webber D L. Free perforation of the small intestine in collagenous sprue. World J Gastroenterol 2009 September 21; 15(35): 4446-4448.
- Freeman HJ. Lymphoproliferative disorders in collagenous colitis. Inflamm Bowel Dis 2005; 11: 781-782.
- Vakiani E., Arguelles-Grande C. Green P. H. et al. Collagenous sprue is not always associated with dismal outcomes: a clinicopathological study of 19 patients. Modern Pathology (2010) 23, 12-26; DOI:10.1038/modpathol.2009.151.
- van Gils T, van de Donk T, Bouma G, et al. B The first cases of collagenous sprue successfully treated with thioguanine. BMJ Open Gastro 2016; 3: e000099. DOI: 10.1136/bmjgast-2016-000099.
- Bhat S et al. Safety and Monitoring of inflammatory bowel disease Advanced therapies. Inflammatory Bowel Diseases, 2023, XX, 1-5
- Gordon H et al. ECCO Guidelines on Inflammatory Bowel Disease and Malignancies. Journal of Crohn’s and Colitis, Volume 17, Issue 6, June 2023, Pages 827-854
- Sambuelli A y col. Manejo de la enfermedad inflamatoria intestinal. revisión y algoritmos de tratamiento. Acta Gastroenterol Latinoam 2019;49(S2).
- Pinto-Sanchez MI, Seiler CL, Santesso N, et al. Association between inflammatory bowel diseases and celiac disease: a systematic review and meta-analysis. Gastroenterology 2020; 159:884-903.e31.
- Penny H.A, Baggus E.M.R, Rej A., Snowden J.A., Sanders D. S. Non-Responsive Coeliac Disease: A Comprehensive Review from the NHS England National Centre for Refractory Coeliac Disease. Nutrients 2020 Jan 14;12(1):216. DOI: 10.3390/nu12010216.
- Celiac disease, collagenous sprue and microscopic colitis in IBD. Observations from a population-based cohort of IBD (ICURE) Scand J Gastroenterol. 2015;50(10):1234-40. DOI:10.3109/00365521.2015.1041152.
Correspondencia: María Laura Moreno
Correo electrónico: marialaura_moreno@yahoo.com.ar
Acta Gastroenterol Latinoam 2024;54(3):278-286
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE


