Fernando Sarmiento Quintero,1 Adolfo J Ariza,2 Fabiola Barboza García,3 Nelly Canal de Molano,4 Mayra Castro Benavides,5 Sylvia Cruchet Muñoz,6 Laura Delgado Carbajal,7 María Rita Dewaele Olivera,8 Adriana Fernández,9 Solange Heller,10 Liliana Ladino Meléndez,11 Sonia Miriam Martínez,12 Rosa Mayor Oxilia,13 Milton Mejía Castro,14 Carlos Montero Brens,15 Marta Cristina Sanabria,16 María Consuelo Tarazona Cote,17 José Fernando Vera Chamorro18
1 Universidad Nacional de Colombia – Fundación HOMI. Bogotá, Colombia.
2 Feinberg School of Medicine, Ann & Robert H. Lurie Children’s Hospital of Chicago. Chicago, Estados Unidos.
3 Centro Médico Docente Paraíso. Maracaibo, Venezuela.
4 Hospital Chiquinquirá. Maracaibo, Venezuela.
5 Universidad Central del Ecuador. Quito, Ecuador.
6 Universidad de Chile. Santiago, Chile.
7 Centro Hospitalario Pereira Rossell – Endoscopía Digestiva. Montevideo, Uruguay.
8 Hospital Pereira Rossell. Montevideo, Uruguay.
9 Universidad de la Plata – Hospital de Niños de la Plata. La Plata, Argentina.
10 Instituto Nacional de Perinatología Isidro Espinosa de los Reyes. México D.F., México.
11 Instituto de Investigación en Nutrición, Genética y Metabolismo IINGM. Universidad El Bosque. Bogotá, Colombia.
12 Hospital Pediátrico Doctor Lorenzo A Castelán. Resistencia, Argentina.
13 Hospital Central de IPS – Universidad Católica de Asunción. Asunción, Paraguay.
14 Hospital infantil de Nicaragua. Managua, Nicaragua.
15 Universidad UNPHU. Santo Domingo, República Dominicana.
16 Hospital de Clínicas de la Universidad Nacional de Asunción. Asunsicón, Paraguay.
17 Universidad de La Sabana. Bogotá, Colombia.
18 Universidad de Los Andes – Fundación Santafé. Bogotá, Colombia.
Acta Gastroenterol Latinoam 2016;46: 131-159
Recibido: 21/10/2015 / Aprobado: 04/05/2016 / Publicado en www.actagastro.org el 04/07/2016
Resumen
Amplia y universalmente documentada, por sus complicaciones la obesidad es una epidemia con fuertes repercusiones en salud y en costos. En 2006-2007 la OMS propuso nuevas herramientas de valoración que no se utilizan globalmente ya que no existe para el hemisferio un manejo unificado del problema. Objetivos. Actualizar la epidemiología de la obesidad, estimular el uso de los estándares de la OMS, revisar los nuevos conceptos fisiopatológicos: tejido adiposo como órgano endocrino y microbiota intestinal, y dar pautas de manejo integradas en la consulta y en el seguimiento. Métodos. La SLAGHNP/LAPSGHAN, con la responsabilidad de un editor/coordinador, quien escogió el contenido y junto con los autores la bibliografía con la mejor evidencia, convocó a los asociados a preparar por separado cada tema, para luego proceder a editar y unificar los contenidos propuestos. Resultados. El documento establece: 1) aunque la obesidad extrema se ha incrementado en los países del hemisferio norte, la obesidad y el sobrepeso se han estabilizado, mientras que en los países de medianos y bajos ingresos se describe un incremento preocupante; 2) las novedades del tejido graso como órgano endocrino y autorregulador de la adiposidad; 3) el papel de la microbiota; y 4) pautas de manejo durante la consulta y el seguimiento del niño obeso. Conclusiones. No hay una implementación masiva de los estándares y referencias de la OMS. Aún no hay acuerdo para utilizar los puntajes z, como tampoco hay estandarización para el caso de los menores de 2 años por su cambiante composición corporal. La herramienta de medición más aceptada es el IMC. Este documento deja recomendaciones prácticas para enfocar la consulta y el seguimiento del niño con sobrepeso y obesidad.
Palabras claves. Obesidad, sobrepeso, niños, adolescentes, América.
Overweight and obesity: review and update
Summary
Obesity is an epidemic with important health repercussions in addition to high treatment-related costs. Between 2006 and 2007 the WHO developed new assessment tools, which aren’t being globally used. In fact, there is no unified problem management across the hemisphere. Objectives. To update obesity epidemiology, to promote application of WHO’s standards, to review new findings on physiopathology (i.e., fatty tissue as endocrine organ, intestinal microbiota), to update epidemiological information, and to provide management guidelines that can be integrated in clinical care. Methods. LAPSGHAN called up its members to collaborate in preparing this review article under the direction of an editor/coordinator, who selected the contents and literature with the best evidencetogether with the members. Each member prepared a separate document for each content. The chosen contents were later collated, unified, and edited. Results. This documents highlights the following: 1) Although extreme obesity is increasing in the US, overweight and obesity prevalence has stabilized, while in other countries it is alarmingly increasing; 2) New information regarding role of fatty tissue as endocrine organ and self-regulator of obesity; 3) The promising role of microbiota; and 4) Guidelines for children handling during consultation and follow-up. Conclusions. There is no widespread implementation of standards and guidelines from the World Health Organization (WHO). There is no agreement as to whether z-scores or percentiles should be used, especially regarding children under 2 due to their changing body complexion. The most accepted tool to assess overweight, obesity and severe obesity is the Body Mass Index (BMI). This document provides recommendations on how to approach clinical care with affected children.
Key words. Overweight, obesity, children, adolescents, Ámerica.
Este trabajo describe una revisión y actualización del sobrepeso y la obesidad en edad pediátrica. Incluye los cambios de su comportamiento epidemiológico, la fisiopatología con los novedosos conceptos del tejido adiposo y la importancia de la microbiota intestinal. Igualmente destaca la definición de la obesidad de acuerdo a los criterios de la Organización Mundial de la Salud (OMS) que contribuye al esfuerzo que dicha organización ha realizado para tener parámetros semejantes de valoración del estado nutricional a nivel mundial en especial en nuestros países de Latinoamérica, para finalizar con la presentación de las estrategias para un manejo práctico y eficiente del niño con sobrepeso y la obesidad durante la consulta y el seguimiento.
Para consolidar este proyecto la Junta Directiva de la Sociedad Latinoamericana de Gastroenterología, Hepatología y Nutrición Pediátrica SLAGHNP/LAPSGHAN, convocó a sus socios a conformar el grupo de trabajo en sobrepeso y obesidad, el cual se estableció con 17 socios, quienes voluntariamente aceptaron el llamado. Se propuso y discutió el contenido y se repartieron los temas escogidos entre los 17 participantes de 11 nacionalidades incluyendo a EE.UU.
Objetivos
Son cuatro los objetivos que esta revisión se propone: a) referir los cambios epidemiológicos que ha tenido la obesidad en los últimos años y su contraste entre los países de bajos ingresos y los países desarrollados; b) estimular la implementación de los estándares de valoración nutricional diseñados por la OMS para la unificación de la definición y su diagnóstico; c) describir el papel novedoso del tejido adiposo como órgano endocrino y el de la microbiota intestinal, que aclaran y hacen más comprensible el entendimiento de la aparición y el desarrollo de la obesidad; y por último, d) establecer conceptos unificados para su manejo integral en Latinoamérica.
Metodología
Para consultar la bibliografía con la mejor evidencia posible se realizó una búsqueda exhaustiva en Medline, Pubmed, Cochrane, Lilacs, Scielo y Bireme. Las palabras mesh utilizadas para la estrategia de búsqueda fueron: overweight, obesity, children, adolescents, metabolic syndrome, y obesidad, niños, síndrome metabólico, sobrepeso, estado nutricional, América. Un coordinador/editor examinó la bibliografía por tema, determinando su calidad y vigencia, y se escogió entre guías de práctica clínica, estudios experimentales, meta-análisis, cohortes y casos y controles, que fueron enviadas a los 17 participantes, quienes por su parte también realizaron búsquedas bajo los mismos criterios e iniciaron la redacción de los temas asignados. En adelante cada tema fue revisado por el coordinador/editor para luego proceder a unificar los contenidos propuestos; la selección inicial de 356 referencias bibliográficas fue examinada nuevamente, quedando un total final de 242. Al final, el texto completo en borrador se envió a dos revisores en México y EE.UU., quienes examinaron el manuscrito cuidadosamente y con sus sugerencias y correcciones, se obtuvo el texto definitivo.
Se analizaron las referencia de crecimiento publicadas por la OMS (OMS/MGRS, Estudio Multicentro de las Referencias de Crecimiento), que establece el puntaje z con desviación estándar (DE) para menores de cinco años y los estándares para niños de 5 a 19 años, y que se basaron en los parámetros de la OMS/National Center for Health Statistics (NCHS), Centro Nacional de Estadísticas Sanitarias de 1978 y los percentiles del Centers for Disease Control and Prevention (CDC)/National Health and Nutrition Examination Survey (NHANES) del 2000. Para la construcción de estas curvas los autores hicieron un ajuste de los datos de la muestra transversal de los patrones de crecimiento para menores de 5 años con los estándares de crecimiento para preescolares de la OMS y con los puntos de corte del IMC para adultos tomados de las referencias de crecimiento de 1 a 24 años de los datos de la NCHS/WHO de 1997. Esta fusión hizo posible una transición más cercana entre los dos estándares.1
Magnitud del sobrepeso y la obesidad
En el mundo
La obesidad se ha convertido en un problema generalizado de la salud pública. En el año 2014 era el doble comparado con el promedio de los años ochenta; 1,9 billones de adultos tenían sobrepeso y 600.000 estaban obesos. En el año 2013, la OMS estimó en 42 millones los menores de 5 años con obesidad y sobrepeso pasando de ser un problema de países de altos ingresos a hacerse generalizado, al punto que su incremento en países de bajos ingresos es un 30% mayor y ocasiona mayor mortalidad que la desnutrición.2
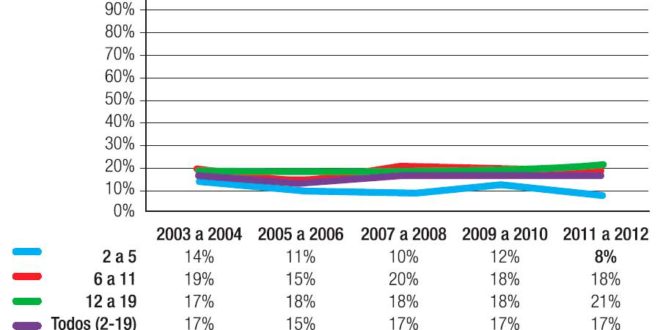
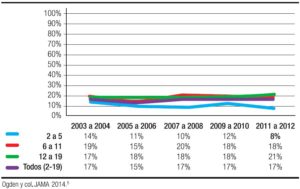
En EE.UU., la prevalencia de sobrepeso y obesidad en menores de 19 años es del 32%, en el Reino Unido es del 22,2% entre 4 a 5 años y del 33,3% de 10 a 11 años.3, 4 La prevalencia en los EE.UU. por grupos de edad se ha mantenido constante desde el año 2003 como se demuestra con los resultados del trabajo de Odgen y col (Figura 1),5 se incrementa con la edad (Figura 2) y en forma paralela su incidencia disminuye como se demuestra en el estudio de Cunningham en el cual se tomaron 6807 niños de una cohorte de 21.260 (Figura 3), que no eran obesos al comienzo del estudio.6
Paradójicamente en EE.UU., a pesar de haberse detenido el incremento del sobrepeso/obesidad, la obesidad grave o extrema, mayor a + 3 DE, o IMC ≥ 35 kg/m2 o percentil 99 del CDC 1999-2004, sufre un aumento dramático del 0,8% en 1976 al 3,8% en el período 1999- 2004, y llega al 6,9% en el período 2006-2010, con mayores porcentajes en niños hispanos y afroamericanos.7, 8
En Latinoamérica
Aunque los datos son escasos y limitados, las estadísticas reflejan un aumento progresivo y preocupante del sobrepeso/obesidad. En Argentina en el 2010 (10 a 11 años de edad) se tiene un 27,9% (incluida la obesidad); Brasil pasó del 4,1% en 1974 (6 a 18 años de edad) al 22,1% en el 2005 (7 a 10 años de edad) también sumados sobrepeso y obesidad; Costa Rica en el 2003 (7 a 12 años de edad) tenían sobrepeso el 34,5% y obesidad el 26,2%; México pasó del 17,9% de sobrepeso y 9% de obesidad en el 2006 (5 a 11 años de edad) al 20,2% y 14,6% en 2012 respectivamente, y del 21,3% de sobrepeso y del 11,9% de obesidad (12 a 19 años de edad) al 21,6% y 13,3% respectivamente en el mismo período.9, 10
En Colombia en el ENSIN 2010, con IMC como parámetro, en menores de 5 años el 1% se encuentra en obesidad severa, el 5,2% en obesidad y el 20,2% en sobrepeso. En el grupo de 5 a 17 años, el 4,1% son obesos, el 13,4% están en sobrepeso y el 17,5% en riesgo.11 En la República Domincana para 1988 y 1990 la prevalencia de sobrepeso fue entre 5 y 13%,12 y en 2013 fue 7% de niños menores de 5 años.13
Estándares con los lineamientos de la OMS
Interpretación de los estándares
Basándose en la referencia de crecimiento OMS/ NCHS de 1978, la OMS ha señalado que la desviación estándar (DE) de la z de esos indicadores es relativamente constante entre las poblaciones, con independencia de su estado nutricional, con el criterio de que los niños de cualquier origen étnico tienen el mismo potencial de crecimiento. Las DE de los valores z pueden utilizarse, por lo tanto, como indicadores de la calidad de los datos antropométricos.
Definiciones
En 2006 la OMS publicó sus nuevos patrones de crecimiento, que siempre deben complementarse con indicadores clínicos y bioquímicos. Para elaborar las nuevas tablas para menores de 5 años, la OMS promovió un proyecto multinacional (Estudio Multicéntrico de las Referencias del Crecimiento o MGRS, por sus siglas en inglés).14-17 Al definir obesidad como la condición en la cual el exceso de tejido adiposo afecta de manera adversa la salud y el bienestar,18 determinó que se debe estimar el porcentaje de grasa corporal.19 Como medir el exceso de grasa no es fácil, se propuso la antropometría con los indicadores peso y talla como alternativa no invasiva, de aplicación universal y de bajo costo, con los cuales se calcula peso para la edad z-score (WAZ), longitud/talla para la edad z-score (HAZ), peso para la longitud/talla z-score (WHZ) y la masa corporal (índice de masa corporal) para la edad z-scores (BMIZ), por sus siglas en inglés.20
El índice de masa corporal (IMC) se debe utilizar en mayores de 2 años de edad para establecer el diagnóstico de sobrepeso y obesidad. Este parámetro es de poca utilidad para menores de 2 años y en niños cuya estatura se encuentre más de 2 DE de la media poblacional.
Aplicación e implementación de los estándares de la OMS
La utilización de las referencias locales es una de la razones de por qué no se han universalizado los parámetros de la OMS 2006-2007; en América Latina solo cuatro países no las han acogido y utilizan sus propias referencias: Cuba, Argentina, Brasil y Venezuela, a pesar de que muchos expertos afirman que el crecimiento de todas las poblaciones sanas, al menos hasta los 7 años, es similar y por lo tanto, se puede utilizar una referencia universal.
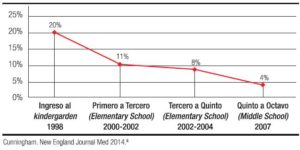
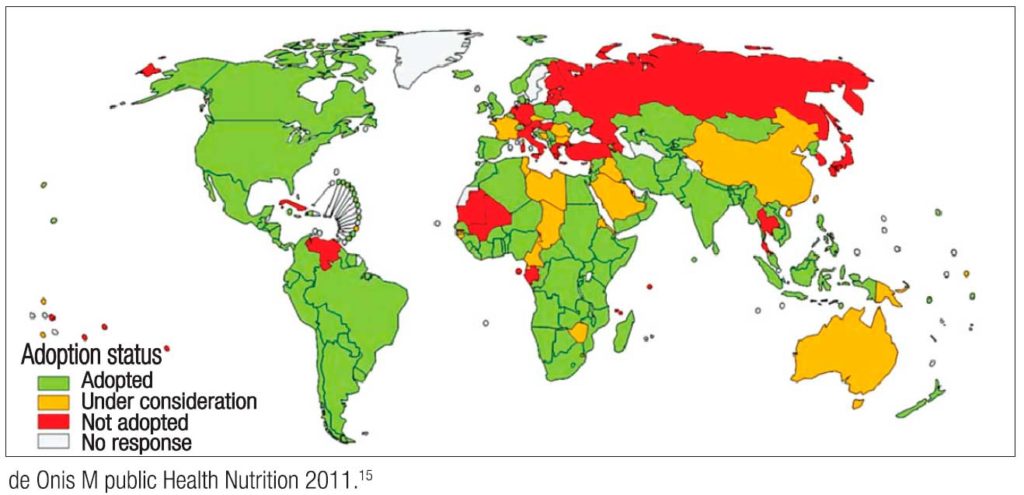
Para el 2011, de los 219 contactados por la OMS, solo 125 países las habían implementado y aplicado; 25 lo estaban considerando y 30 no lo habían hecho. La Figura 4 muestra el estado de adopción por región geográfica.15
Figura 4. Aplicación mundial de los patrones de crecimiento infantil de la OMS. Abril de 2011. Tomado de de Onis M, Public Health Nutrition 2011: 15: 1603–1610.15
Regulación endocrina del tejido adiposo
Secreción endocrina y estado inflamatorio crónico del tejido adiposo y sus efectos
El tejido adiposo blanco es comparable desde el punto de vista funcional con un órgano endocrino activo, con secreción de adipoquinas como leptina y adiponectina y factores pro-inflamatorios como el factor de necrosis tumoral (TNF) e interleuquinas IL-1 e IL-6, implicados en la enfermedad cardiovascular y en la resistencia a la insulina;21, 22 es por lo cual que el contenido de masa grasa y de masa libre de grasa, si están armónicamente distribuidas, propiciarán un trabajo metabólico equilibrado;23, 24 su control depende del balance entre la lipolisis y lipogénesis: la lipolisis libera triglicéridos por acción de catecolaminas; éstos son fuente de energía, pero en exceso o ausencia de oxidación se presenta la obesidad y como consecuencia el riesgo cardiovascular. Su balance depende de la acetil coenzima A-carboxilasa (AcoA-C) que almacena, y por la hormona sensible a la lipasa (HSL) y la lipasa adiposa de triglicéridos (LATG) que movilizan. De éstas, la HSL es la que más estimula la lipolisis, por lo que su disminución es un defecto primario manifiesto en la obesidad.25-28 Por otro lado, la lipogénesis está regulada por la hipertrofia adipocitaria y por el incremento del número de células o hiperplasia, mediante la adipogénesis y la apoptosis.29, 30 Las células precursoras adipocitarias son susceptibles de diferenciarse, y a mayor capacidad de crear más adipocitos, se incrementa también la capacidad de almacenar más grasa. El tejido adiposo se configura entonces, como un órgano clave en la regulación y control del metabolismo, y de su funcionalidad depende la morbilidad.
Implicaciones de la ubicación corporal de la grasa
Los depósitos subcutáneo y visceral han mostrado comportamientos metabólicos diferentes desde el punto de vista funcional, como miniórganos con funciones endocrinas paralelas. El depósito visceral en hombres es mayor que en mujeres, la diferenciación celular y la lipolisis parece ocurrir con mayor respuesta en el adipocito subcutáneo, es decir, hay mayor funcionalidad en la grasa subcutánea; significa esto que el comportamiento metabólico en las dos localizaciones tiene variaciones que dependen del género y de la composición corporal,31 y la insulina tiene un comportamiento diferente sobre la grasa subcutánea, cuando las mujeres tienen obesidad visceral.32 La obesidad visceral o la acumulación de grasa con distribución androide se relaciona directamente con el riesgo cardiovascular y metabólico.33
De acuerdo con lo anterior se han descrito en la literatura dos subtipos de obesidad: los obesos con alta masa grasa subcutánea y baja visceral, denominados metabólicamente “sanos” (MHO por sus siglas en inglés), con alta sensibilidad a la insulina, alto nivel de HDL y bajos triglicéridos, pero que no se refleja en la mortalidad y el riesgo de morir.34 El segundo grupo se refiere a los denominados metabólicamente obesos pero con peso normal (MONW, siglas en inglés), los cuales se caracterizan por tener alta grasa visceral, IMC normal, alta masa grasa total y baja masa muscular, con baja sensibilidad a la insulina, alta infiltración grasa en el hígado y triglicéridos altos, que tienen mayor riesgo para diabetes, síndrome metabólico y enfermedad cardiovascular, por su alta masa grasa visceral e intrahepática,23 en los que se ha encontrado aumento de citoquinas proinflamatorias, igual que en el obeso alterado metabólicamente; adicionalmente cursa con disminución de la masa muscular (sarcopenia) mostrando además las consecuencias sobre el metabolismo derivadas de la deficiencia de fibras musculares.35
Sarcopenia y Obesidad
La sarcopenia se define como la reducción de masa muscular apendicular (miembros inferiores) y disminución de la velocidad de desplazamiento, con incremento de la mortalidad y como un indicador del proceso de senectud.36, 37
La sarcopenia como resultado de la baja actividad muscular tiene también efectos en el proceso de la obesidad en los niños. El metabolismo que se realiza en el músculo y que interactúa de forma sincrónica con el metabolismo del adipocito, requiere una gran cantidad de energía que garantice la síntesis protéica para una adecuada masa muscular; por lo tanto, al mejorar la masa muscular, se puede prevenir la obesidad.38, 39 El músculo también mantiene el 80% de la captación de la glucosa, lo cual lo convierte en el órgano que sostiene la insulinosensibilidad,40 y además en el músculo se secretan miokinas que mejoran la sensibilidad a la insulina estimulando el consumo de energía dentro del adipocito.41, 42 En resumen, lo anterior explica los beneficios de la actividad física que a su vez mejora la masa magra, como factor protector.43 Con estos fundamentos se ha definido otra clasificación de la obesidad denominada obesidad sarcopénica en la que se combina la pérdida anormal de masa muscular en sujetos jóvenes sedentarios acompañada de la expansión de tejido adiposo.44, 45 La pérdida de masa muscular es más notable en los grupos de músculos de los miembros inferiores, que se reduce hasta en un 40% y es normalmente compensada por la ganancia de masa grasa. En cuanto al tipo de fibra muscular, la sarcopenia en obesos se caracteriza por atrofia y necrosis de fibras del tipo II.46
Masa muscular y masa grasa en la vida intrauterina y en el período de lactante
El mayor determinante de la adecuada y saludable masa muscular esquelética es el ambiente intrauterino; al momento de nacer se han completado en número las fibras musculares, por lo que cualquier alteración intrauterina por restricción primaria o secundaria de nutrientes por insuficiencia placentaria o la prematurez, restringen el desarrollo y cantidad de fibras musculares, que persiste aún después del reatrapaje compensatorio del crecimiento en la vida postnatal, y la hipertrofia muscular dada por el ejercicio solo la compensa en forma parcial. Estos conceptos explican la asociación del bajo peso al nacer y la prematurez, y la consecuente disminución de masa muscular, con la insulinorresistencia, síndrome metabólico, diabetes mellitis y riesgo cardiovascular en la vida posterior.47
La microbiota intestinal como factor protector
La obesidad y algunos trastornos metabólicos inducidos por la dieta, están asociados con un estado de inflamación crónica y aumento de la susceptibilidad a procesos infecciosos secundarios a la disfunción del sistema inmune.48 La microbiota intestinal (MI) regula la inmunidad innata y adaptativa, e influye en las respuestas locales y sistémicas, por lo tanto, también podría influir en la inflamación crónica asociada a la obesidad, al metabolismo de los hidratos de carbono, al gasto metabólico y a la resistencia insulínica subsecuente.49, 50 Además, hipotéticamente podría intervenir el número de macrófagos en el tejido adiposo, los cuales llevan a la producción de moléculas proinflamatorias adipoquinas y citoquinas.51, 52
Los cambios de la MI y con ella del genoma (microbioma) han sido considerados como un posible factor desencadenante de cambios metabólicos y se ha considerado como agente terapéutico en los últimos años.53 También la actividad física sobre la pérdida de peso corporal parece influir sobre la composición de la microbiota del individuo, sin que se haya establecido con claridad si es causa o efecto.54, 55 La composición de la MI también tiene variaciones respecto al peso: los niños con sobrepeso a temprana edad presentan aumento de staphylococcus aureus, en contraste con los que mantienen un peso adecuado y cuyo aumento está en función de Bifidobacterium.56 Con estos argumentos, la obesidad podría intervenirse cambiando la composición de la MI mediante su transplante de sujetos delgados a sujetos obesos, que parece efectivo solo en animales, al contrario de lo que ocurre en humanos en quienes lo único que se ha demostrado es una asociación de la disminución de peso con una alimentación adecuada, y como consecuencia el cambio en las características de la microbiota.57, 58
También se ha visto que se produce una mayor pérdida de energía en heces de individuos delgados, quienes a su vez tienen una mayor proporción de firmicutes, comparados con aquellos que tienen bacteroides.59, 60 Igualmente la MI puede interactuar con los nutrientes para controlar la obesidad: cuando en ratones delgados, que tienen una menor proporción de bacteroidetes y firmicutes, (familias de bacterias intestinales relacionadas con la homeostasis del metabolismos energético), se les suministra una alimentación alta en grasas, no aumenta su peso y la excreción de energía proveniente de los carbohidratos es mayor Como se ve el mecanismo que regula estas interacciones aún no se comprende con claridad.61
El sistema de receptores de endocannabinoide (RECB) que interelaciona el cerebro, la microbiota intestinal y el tejido adiposo, produce hiperfagia y la MI modula su tono, disminuyendo la enfermedad metabólica.62, 63
Factores de riesgo
Factores ambientales y genéticos
El creciente número de mujeres con sobrepeso y obesidad al iniciar la gestación parece tener una fuerte expresión en la actual epidemia de obesidad infantil,64 que lleva a tener hijos con mayor peso y masa grasa superior a la del promedio, pero también con riesgo de tener prematuros o recién nacidos pequeños para la edad gestacional.65 Ambas situaciones se asocian con sobrepeso y obesidad en niños y adolescentes, en las que tiene influencia también la genética.66 Además de la composición corporal materna,67 los factores ambientales ejercen influencia: alimentación con fórmulas lácteas,68 relación entre la ingesta de hidratos de carbono de la gestante con los cambios epigenéticos y la adiposidad infantil.69 Además, factores ambientales maternos y no maternos modulan la expresión fenotípica del genotipo del niño.70 Al momento se han identificado más de 32 polimorfismos comunes de nucleótido único (SNPs) asociados con el IMC en adultos y niños,71 y nuevos loci asociados con el IMC, y hasta 42 genes probablemente asociados con la obesidad.64
Factores epigenéticos: programación fetal y alimentación temprana
En obesidad, la genética es determinante, pero los factores ambientales son los responsables de su incremento en las últimas décadas. Así como la nutrición materna antes y durante la gestación, modulan la expresión genética de la placenta y el ambiente uterino, las prácticas de alimentación en los primeros meses de vida del niño determinan el riesgo de obesidad, diabetes y enfermedad cardiovascular en etapas posteriores.72, 73 Incrementos anormales de ganancia de peso de la madre y consumo inadecuado de hidratos de carbono durante la gestación, la composición corporal materna y la ganancia de peso durante los primeros dos años de vida del niño, son entre otros, los factores asociados a la programación temprana de la obesidad infantil.
Se ha demostrado que la placenta está activamente involucrada en el transporte de nutrientes al feto como uno de los factores predisponentes, ejerciendo efectos directos e indirectos en la función cardiovascular y endocrina, que a largo plazo puede predisponer a enfermedad metabólica y cardiovascular en el adulto.74-76 Igualmente en la programación de la composición corporal una rápida ganancia de peso en los primeros 2 años es predictor de obesidad en edades posteriores.77
Incremento anormal de peso en el lactante
El aumento rápido de peso durante la lactancia es uno de los mayores factores de riesgo para la obesidad en la niñez.78-80 Los niños que estaban obesos entre los 9 y los 24 meses, tuvieron tres veces más probabilidades de mantener este sobrepeso a los 4 años.81 Los niños con sobrepeso a los 5 años, tienen cuatro veces más probabilidades de desarrollar obesidad antes de los 14 años.6 En otra evaluación longitudinal los niños que tenían obesidad y obesidad severa a los 5 años, tuvieron una tasa de aumento de peso e IMC significativamente mayor entre los 2-6 meses de edad.82 En un estudio retrospectivo se demostró que el período crítico para prevenir la obesidad infantil es durante los primeros 2 años de vida, y en la mayoría de los casos, durante los primeros 3 meses de edad.83
Diagnóstico
La antropometría en la evaluación del sobrepeso y la obesidad
La obesidad es una enfermedad caracterizada por el aumento de la grasa corporal.18 Ésta aumenta progresivamente después del nacimiento en alrededor de 13 a 25% a los 6 meses de edad. Luego decrece progresivamente para llegar al rededor de 18 a 20% a los 2 años de edad.84
En pediatría, se dispone de medidas indirectas para evaluar la obesidad:
- Peso/Longitud-Talla: valora el peso de un niño con respecto al que debería tener para su talla o longitud, de manera independiente de la edad. Se correlaciona con el porcentaje de la grasa corporal y se utiliza en niños menores de cinco años de edad. Algunos autores recomiendan el uso de este indicador antropométrico para niños menores de dos años de edad y en pacientes con talla baja grave.85
- IMC: es el índice más aceptado actualmente para evaluar la obesidad infantil a partir de los 2 años de edad y del adolescente. El IMC o índice de Quetelet es una expresión del peso referido a la talla y se calcula dividiendo el peso corporal expresado en kilogramos por la talla elevada al cuadrado expresada en metros. En niños y adolescentes guarda muy buena relación con la grasa corporal medida por pliegues cutáneos. También se asocia a los marcadores de complicaciones secundarias de obesidad, incluidas la hipertensión arterial, dislipidemia, hiperinsulimemia y mortalidad a largo plazo.
La detección de una variación superior a dos puntos en el IMC en un año debe considerarse un signo de alarma para sobrepeso.
El rebote adipositario corresponde al segundo incremento en la curva del IMC que ocurre normalmente entre los 5 y los 7 años de edad. Un rebote adipositario temprano (3,2 años) se asocia con un incremento en el riesgo de obesidad reflejando un crecimiento acelerado. La edad del rebote adipositario es un predictor de masa grasa en la adultez.86 - Pliegues cutáneos: es una herramienta de medición de la masa grasa de un individuo. El estudio multicéntrico de la OMS publicó valores normales de pliegues tricipitales y sub-escapulares para niños y niñas entre 3 meses y 5 años de edad. Para niños entre 0 y 19 años de edad, se disponen también de las tablas de percentiles de pliegues tricipital y sub-escapular de Tanner (1975).
- Circunferencia de la cadera (CC): es un método sencillo, económico y reproducible que se utiliza para valorar la distribución del tejido adiposo abdominal subcutáneo (TAAS) y del tejido adiposo abdominal visceral (TAAV).87 El de mayor valor para evaluar el riesgo de síndrome metabólico y cardiovascular es el visceral, que correlaciona relativamente bien con la resonancia magnética (patrón de oro).88, 89
Se han descrito varios sitios para tomar la medida; unos autores describen ocho, pero los sitios más utilizados son cuatro: el borde inferior de la última costilla, el sitio más delgado de la cintura, el punto medio entre el borde inferior de la costilla y la cresta ilíaca, y el borde superior de la cresta ilíaca.90, 91 A pesar de esta variabilidad y la demostración en niños de que el sitio no afecta la correlación para los factores de riesgo, incluyendo a nivel del ombligo, se ha recomendado, de acuerdo con la NHANES, la cresta ilíaca como el sitio de mayor confiabilidad, y con este punto de medición se establecieron unos puntos de corte para niños que pueden tomarse como confiables y estandarizados.92-94 El consolidado de los puntos de corte en percentiles en niños de 2 a 18 años de los tres grupos étnicos se detalla en la Tabla 1.
En la Tabla 2 se observan los criterios diagnósticos de obesidad en niños y en adolescentes según parámetros antropométricos. - Bioimpedanciometría y absorciometría dual de rayos X (Dexa): son dos métodos para la evaluación de la obesidad infantil disponibles solo para investigación.
La historia clínica y el examen físico en la evaluación del sobrepeso y obesidad
A pesar de ser la herramienta más común para el diagnóstico de sobrepeso y obesidad, el IMC no es totalmente útil en niños por el notable cambio de la composición corporal.95 Es por ello que el diagnóstico debe ser complementado con otros métodos:96-99
- Anamnesis alimentaria: Los puntos claves son: comer en restaurantes, consumir bebidas azucaradas, ingesta frecuente de pasabocas, tamaño de las porciones y consumo de comidas procesadas con alta densidad energética, comúnmente denominados “comida chatarra”, que además contienen aditivos en su mayoría nocivos.100-102 Son productos de alta densidad energética con un contenido bajo o nulo de proteínas,103 ricas en grasas saturadas y trans y un alto respaldo mediático.104 De otro lado, incorporar buenos hábitos como tomar desayuno previene sobrepeso, la obesidad y asimismo mejora el IMC sin que se pueda afirmar la causalidad de estos hallazgos por ser trabajos observacionales.105, 106
- Otras medidas antropométricas: si bien el IMC es un buen indicador del exceso de grasa corporal, se han propuesto otros métodos. Los más comúnmente usados son la CC, aislada o relacionada con la altura [radio circunferencia-altura (rC/A)] y la medida de los pliegues cutáneos. Estas medidas no son del todo confiables porque no tiene puntos de corte unificados para pediatría.93, 94
Tabla 1. Circunferencia de la cadera expresada en cm de 9.713 niños de 2 a 18 años de tres grupos étnicos en EE.UU. (NHANES III).
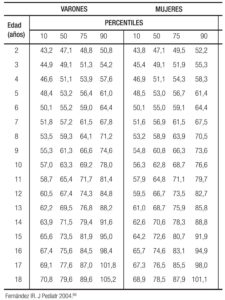
Tabla 2. Criterios diagnósticos de la obesidad en niños y adolescentes. En desviaciones estándar (DE).
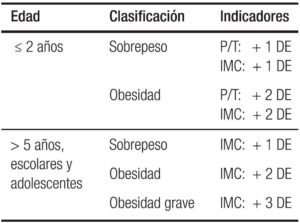
Complicaciones
Con el aumento de la obesidad infanto-juvenil, aparecen las complicaciones: diabetes, apnea hipoapnea obstructiva del sueño (SAHOS), problemas óseos y articulares, dislipidemias, síndrome metabólico (SM) y la enfermedad de hígado graso no alcohólico (EHGNA).
- Diabetes mellitus tipo 2 (DM2): el riesgo de desarrollarla aumenta considerablemente con el aumento del IMC. Su incremento a + 2DE en el niño, se acompaña de aumento del riesgo de presentar hiperinsulinemia en el 12,6%. Cuando se realiza la prueba de tolerancia oral a la glucosa (PTOG) en niños y adolescentes obesos, se encuentra que entre un 17 al 25% presentaban alteración en la prueba y un 4 al 6% tenían DM2 no diagnosticada.107
- Hipertensión arterial (HTA) y enfermedad cardiovascular (ECV): la obesidad, la intolerancia a la glucosa y la HTA se asocian con mayor riesgo de mortalidad antes de los 55 años, pasando a ser la obesidad un predictor de muerte, debido al riesgo de ECV. La presión sanguínea elevada durante la infancia es un signo de alarma que contribuye al aumento del riesgo cardiovascular en la vida adulta. Aunque el impacto de la ECV y la muerte se ven en la edad adulta, el proceso fisiopatológico y los factores de riesgo asociados comienzan durante la infancia.108
- Apnea-hipoapnea obstructiva del sueño (SAHOS): se caracteriza por episodios de obstrucción respiratoria con interrupción y fragmentación del sueño, hipoxia intermitente e hipercapnia. La obesidad produce un aumento en la presión crítica de cierre de la vía área superior, ya sea por un efecto directo debido a los depósitos de tejido adiposo o por efecto indirecto, al disminuir la capacidad contráctil de los músculos dilatadores faríngeos, lo que explica la hipercapnia repetitiva.109
- Dislipidemias: dependen de factores hereditarios, como del tipo de alimentación, la obesidad, el sedentarismo y la resistencia a la insulina, los cuales han sido identificados como factores epigenéticos de riesgo cardiovascular desde la niñez. Las estrías grasas, como depósitos, principalmente de colesterol, en la íntima arterial, se inician antes de los 10 años y en las arterias coronarias hacia fines de la segunda década. Se ha establecido con evidencia que estos cambios se inician en la infancia con determinantes como la obesidad y la resistencia a la insulina.110
- Síndrome metabólico: no hay definición unificada en niños pero las existentes han sido adaptadas teniendo en cuenta sus características biológicas y los cambios puberales.111-114 La prevalencia es variable: a modo de ejemplo está un estudio en Brasil en el que se analizaron adolescentes obesos y encontraron que el SM fue diagnosticado en el 39,7, 51,2 y 74,4% de acuerdo a tres definiciones distintas: la del IDF, la de Cook y la de de Ferranti, respectivamente.115-117
- Enfermedad de hígado graso no alcohólico (EHGNA): es la enfermedad hepática crónica más prevalente en la población pediátrica. La incidencia general es de 9,6% pero asciende hasta el 38% en los niños obesos.118 La presencia de hígado graso en niños y adolescentes obesos con SM es variable pero alcanza, de acuerdo con algunos reportes, el 95%.119 La predisposición genética y el medio ambiente contribuyen a una mayor susceptibilidad para su desarrollo pero los mecanismos no han sido adecuadamente descritos hasta el momento.
Prevención
Estado nutricional preconcepcional: el bajo peso materno preconcepcional aumenta el riesgo de bajo peso al nacer y retardo de crecimiento intrauterino y aumenta 1,8 veces el riesgo de sobrepeso a los tres años. Igualmente el sobrepeso/obesidad maternos previos, aumenta el riesgo de macrosomía y aumenta el riesgo de sobrepeso hasta 2,1 veces en la descendencia a los 3 años de edad.120
- Sobrepeso materno: una ganancia anormal de peso durante la gestación aumenta la probabilidad de sobrepeso/obesidad en un 46% en la descendencia. La ganancia anormal de peso durante la gestación tuvo un mayor impacto en el sobrepeso/obesidad del niño, entre las mujeres de peso normal pregestacional, lo que sugiere que el efecto puede ser independiente de predictores genéticos de la obesidad.121
- Consumo de cigarrillo: está relacionado con el efecto nocivo de la nicotina que se transporta a través de la placenta y el monóxido de carbono que puede influir en la función vascular placentaria y causar hipoxia fetal. Fuera de demostrar claramente que el tabaquismo materno durante el embarazo se asoció con sobrepeso a la edad de 3 años, otro estudio comprobó que entre las madres que dejaron de fumar al principio de la gestación no se encontró asociación con obesidad en la descendencia.122
- Tipo de nacimiento: cuando los niños nacen por cesárea tienen mayor probabilidad de obesidad a los 3 años (OR 2,10; IC 95%: 1,36-3,23); aunque faltan más estudios, las futuras madres que eligen el parto por cesárea, en ausencia de una indicación obstétrica o médica, deben ser conscientes de que sus hijos pueden tener un mayor riesgo de obesidad.123
- Peso al nacimiento: varios estudios han demostrado que el alto peso al nacimiento es un factor de riesgo para sobrepeso/obesidad.124, 125 Neonatos con peso ≥ 3,86 kg fueron 2,17 veces más propensos a tener sobrepeso entre los 4 y 5 años de edad.125
- Leche materna versus fórmula: el efecto protector de la leche materna está plenamente demostrado en un porcentaje moderado pero no despreciable del 6 a 22%.124-126 El efecto protector para obesidad de la leche materna parece basarse en que los lactantes autorregulan su ingesta, mientras que el uso de biberón puede alterar las señales de hambre y saciedad, y alterar la percepción de los cuidadores. Este factor protector va más alla; cuando los lactantes se alimentan exclusivamente con leche materna en el primer semestre, en el segundo semestre solo el 27% desocuparon la taza o el biberón en comparación con el 54% de los lactantes que fueron alimentados con leche materna más fórmula, y el 68% de los que fueron alimentados sólo con fórmula en el primer semestre. El análisis indicó que los lactantes alimentados con fórmula en el primer semestre de vida tenían el 71% o 2 veces más probabilidades de vaciar la botella o taza en el segundo semestre de vida.127-129
- Alimentación complementaria: a los 3 años de edad, los niños a los que se les introdujo la complementaria antes de los 4 meses, tuvieron entre 1,2 y 6,3 veces más riesgo de sobrepeso, cifras que aumentaron cuando además recibieron fórmula.130, 131 Este riesgo no es significativo cuando la introducción de la complementaria se hace en niños alimentados con leche materna.
Grupos de riesgo por tamizaje con el IMC en escolares y adolescentes
A pesar de que la tendencia para la evaluación de la obesidad con el IMC debe ser con los parámetros de la OMS,132 hay quienes recomiendan hacerlo con los de la International Obesity Task Force (IOTF), lo que lleva a una falta de acuerdo. Sin embargo, tómese con uno u otro, en la práctica, el IMC es reconocido como la mejor herramienta.
Recomendaciones:
- El IMC no es una evaluación directa de la obesidad, pero la sensibilidad de un IMC superior 25 kg/m2 se utiliza para identificar a los niños con mayor adiposidad.
- La obesidad extrema o severa lleva al incremento de los riesgos comparada con la obesidad.
- Algunos niños en la categoría de sobrepeso pueden tener incremento de la grasa visceral y pueden no ser demasiado gordos; el juicio clínico debe ser utilizado para determinar los riesgos de salud y la intervención adecuada para estos niños.
- El tener un mayor índice de TAAV aumenta los riesgos y es mejor predictor que el TAAS.
- El IMC debe ser calculado y documentado en la historia clínica de todos los niños de 2 a 18 años por lo menos anualmente, de ser posible en una visita del niño sano.
- Los menores de 2 años con un peso/longitud > +1DE, deben evaluarse con IMC.
- El cálculo del IMC debe incluirse en la evaluación del paciente junto con la toma de los signos vitales, antes de ingresar a la consulta.
- Se debe colocar una tabla con el IMC en cada consultorio y los registros electrónicos deben tener una calculadora que lo haga.
- Utilizar herramientas como carteles y folletos en toda la instalación para ayudar en la identificación y notificación a los pacientes sobre los riesgos de salud relacionados con la obesidad.
- Promover un estilo de vida sano alrededor de la nutrición y la actividad fomentando al mismo tiempo al paciente y al conocimiento de los padres de su IMC.
Educación, teniendo en cuenta grupos etarios
- Requerimientos calóricos por actividad física: la Food and Agriculture Organization of the United Nations (FAO/UN) en el año 2001 emitió un reporte en el que se calcularon los requerimientos energéticos para todas las edades y se dictaron las recomendaciones de energía durante la gestación y la lactancia.133-135
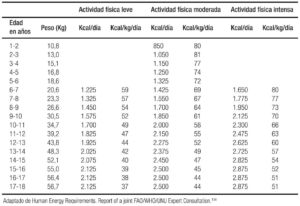
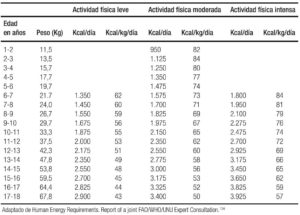
En el Tabla 3a se enlistan los requerimientos de energía en el primer año de vida, y en las Tablas 3b y 3c los requerimientos energéticos en niñas y niños de 1 a 18 años de acuerdo al grado de actividad física que son útiles para el cálculo de una alimentación adecuada.134
- Recomendaciones de actividad física: una actividad física regular para mejorar la salud cardiorrespiratoria, muscular y ósea, la composición corporal y los biomarcadores de salud cardiovascular y metabólica, son fundamentales para mantener un balance energético adecuado.135
A continuación se presentan las definiciones pertinentes para tomar acciones al respecto:136
- Actividad física: es cualquier movimiento del cuerpo realizado con los músculos esqueléticos que requiere un gasto de energía. Puede ser de diversos tipos: aeróbica o para mejorar la fuerza, la flexibilidad o el equilibrio.
- Actividad física moderada: en una escala absoluta, es la actividad física realizada de 3 a 5,9 veces más intensamente que en estado de reposo.
- Actividad física vigorosa: en la misma escala, es la actividad física que se realiza con una intensidad 6 o más veces superior a la del estado de reposo, en adultos, y por lo general 7 o más veces superior en niños y jóvenes.
- Actividad aeróbica: la actividad aeróbica o actividad de resistencia, mejora la función cardiorrespiratoria (caminar a paso rápido, correr, montar en bicicleta, saltar con una cuerda o nadar).
Las principales recomendaciones de actividad física para niños pequeños son:
- Estimular la actividad física en la cuna, con movimiento y juego supervisado durante el baño, estimular el gateo y el juego y actividades en un piso blando; y en niños mayores de un año, actividad física de por lo menos 3 horas al día en varios momentos.136-138
- En niños de menos de 2 años, se recomienda que no vean televisión y no usen juegos electrónicos (DVD, computadora o teléfonos) y en niños de 2 a 5 años, limitarlos a menos de 1 hora al día.136-138
- Motivar a la familia a participar con sus hijos en actividades físicas dentro y fuera de la casa y desestimular actividades sedentarias.
En niños y adolescentes la actividad física consiste en juegos, deportes, caminatas, actividades recreativas, educación física o ejercicios con la familia, en la escuela o en actividades comunitarias.136, 137, 139 Las recomendaciones 2010 de la OMS para niños y adolescentes de 5 a 17 años de edad son las siguientes:136
– Los niños y jóvenes deberían acumular un mínimo de 60 minutos diarios de actividad física moderada o vigorosa.
– La actividad física durante más de 60 minutos reporta beneficios adicionales para la salud.
– La actividad física diaria debe ser, en su mayor parte, aeróbica. Conviene incorporar, como mínimo tres veces por semana, actividades vigorosas que refuercen, en particular, los músculos y huesos.
El uso de tarjetas de reporte de actividad física, que tienen como objetivo su registro en niños y adolescentes, ha sido exitoso en Canadá,140 y ha sido replicado en 14 países. Esta tarjeta tiene como fin principal el empoderamiento del movimiento para que los niños aumenten el ejercicio y para valorar su impacto se han usado indicadores a varios niveles: 1) estrategias gubernamentales y no gubernamentales; 2) ámbito de influencia, especialmente la escuela, la familia y amistades; y 3) estrategias que contribuyan a incrementar la actividad física, como son deportes organizados, uso de bicicleta como medio de transporte activo, juego activo y reducción de actividades sedentarias.
- Recomendaciones de sueño: en los últimos 20 años se ha observado una reducción en el tiempo de sueño en lactantes, niños y adolescentes, entre 30 a 60 minutos diarios, por retraso en la hora de acostarse en la noche.141 Una menor duración del sueño puede ser un factor de riesgo para obesidad, diabetes tipo II, enfermedad coronaria, hipertensión arterial y otras enfermedades crónicas; probablemente la falta de sueño condiciona mayor ingesta calórica, fatiga y menor actividad física.142 Al respecto la National Sleep Foundation (NSF) ha dado las siguientes recomendaciones de sueño para niños menores de 5 años en un período de 24 horas:143
– Recién nacidos a 3 meses: 14-17 horas (rango: 11- 19). Inapropiado, menos de 11 y más de 19 horas.
– Lactantes de a 4 a 11 meses: 12-15 horas (rango: 10-18) durante la noche con siestas de 30 minutos a 2 horas de una a cuatro veces por día. Inapropiado, menos de 10 y más de 18 horas.
– Niños de 1 a 2 años: 11-14 horas (rango 9-16). Inapropiado, menos de 9 y más de 16 horas.
– Preescolares de 3 a 5 años: 10-13 horas (rango: 8-14). Inapropiado, menos de 8 y más de 14 horas.
- Alimentación complementaria de acuerdo a la OMS: la OMS recomienda lactancia materna exclusiva por 6 meses y continuarla hasta los 2 años o más, e iniciar la alimentación complementaria a los 6 meses. El período de alimentación complementaria es aquel en el que se proveen otros alimentos o líquidos junto con leche materna.144-147
De acuerdo a varios documentos publicados por la OMS, la alimentación complementaria es un componente muy importante de la llamada “ventana crítica” de oportunidades de los primeros 1.000 días, que incluye la gestación y los dos primeros años de vida.148, 149 Las principales recomendaciones de alimentación complementaria son las siguientes:144-147
– Preparar y servir alimentos complementarios con densidad energética mayor a la de la leche materna, lo que garantiza que los lactantes reciban un aporte calórico adecuado, tomando en cuenta que su capacidad gástrica funcional es de 30 g/k de peso.
– Introducir un alimento nuevo cada 3 a 5 días y evitar la ingesta de otros líquidos que no sean leche materna, fórmula láctea o, en su defecto, agua.
– Iniciar carne o alimentos fortificados con hierro como primeros alimentos, ya que son alimentos ricos además en zinc.150
– Iniciar con 2-3 comidas/día, e incrementarlas a 3-4/ día, con alimentos en papilla, que deben pasar rápidamente a alimentos macerados no más tarde de los 8 meses de edad.
– Los alimentos complementarios deben proporcionar 200 cal/día de los 6 a los 8 meses, 300 cal/día de los 9 a los 11 meses, y 550 cal/día de los 12 a los 23 meses de edad.El impacto de la alimentación complementaria como riesgo de obesidad ha sido ampliamente estudiado en los últimos años.151 Los principales puntos que han sido analizados son los siguientes:
- Edad de introducción de alimentos sólidos: se ha sugerido que el iniciar alimentos complementarios antes de los 4 meses de edad aumenta el riesgo de obesidad, especialmente si el lactante ha sido alimentado con fórmulas lácteas, o por menos de 5 meses con leche materna. Se ha especulado que una dieta rica en nutrientes puede programar en forma adversa el sistema cardio-metabólico y promover un crecimiento acelerado. El prolongar la lactancia materna exclusiva hasta los 6 meses promueve un crecimiento más lento y reduce la posibilidad de sobrepeso.152
- Tipo de alimentos: es importante que los lactantes sean expuestos a una gran variedad de frutas y verduras para garantizar la incorporación de esos alimentos en su alimentación posterior. Añadir pequeñas cantidades de purés de verduras a la leche materna y al cereal del lactante alrededor del quinto mes de vida, permite una mayor y más rápida aceptación de las mismas a corto y largo plazo.153
- Azúcares: la ingestión de jugos de frutas debe ser de 4 a 6 onzas como máximo al día, no deben iniciarse antes de los 6 a 12 meses de edad, como tampoco ser adicionados con sacarosa. Los alimentos complementarios comerciales tienen cantidades importantes de azúcares y de sodio y pueden contribuir a una ganancia excesiva de peso.154
- Energía: la densidad energética de los alimentos complementarios y de las fórmulas lácteas debe monitorizarse para evitar un consumo excesivo y aumento de peso.
- Grasa: la grasa debe proporcionar del 30 al 40% de la energía total ingerida en niños menores de 2 años; la reducción de grasas saturadas y colesterol en la alimentación e incremento de ácidos grasos poliinsaturados, aceites vegetales y leche descremada después del año de edad, puede prevenir obesidad y riesgos cardiovasculares.151
- Proteínas: las fórmulas infantiles bajas en proteínas se parecen más en su composición a la leche materna y pueden reducir un incremento de peso a los dos años de edad. La ingestión de cantidades importantes de proteína de leche de vaca promueve mayor incremento de peso, lo que no sucede con la proteína de la carne, por lo que se recomienda limitar la ingestión de leche de vaca en el segundo año de edad.151, 152, 155, 156
- Alimentación perceptiva: refleja reprocidad entre niño y cuidadores en un proceso que se ha conceptualizado en 4 pasos:157, 158 1) los cuidadores crean una rutina, estructuran expectativas, y un contexto emocional que promueve interacción; 2) el niño responde y da señales al cuidador; 3) los cuidadores responden rápidamente de manera que proporciona un soporte emocional adecuado de acuerdo al desarrollo del niño; 4) el niño experimenta respuestas predecibles. En la práctica de esta alimentación perceptiva, la OMS recomienda:145, 147
– Alimentar a los lactantes y niños pequeños directamente y ayudar a los niños mayores cuando comen por sí solos, respondiendo a sus signos de hambre y satisfacción.
– Alimentar despacio y pacientemente, y animar a los niños a comer, pero sin forzarlos.
– Si los niños rechazan varios alimentos, experimentar con diversas combinaciones, sabores, texturas y métodos para estimularlos a comer.
– Minimizar las distracciones durante las horas de comida.
– Recordar que los momentos de comer son períodos de aprendizaje y amor, por lo que se debe hablar con los niños y mantener el contacto visual.Una alimentación no perceptiva hace que los cuidadores controlen y dominen el momento de alimentación y se asocia a pobre autorregulación de la alimentación y riesgo de obesidad.
- Diseño de alimentación sana con raciones o grupos de alimentos: las guías alimentarias permiten traducir las metas nutricionales de la población en mensajes prácticos, tomando en cuenta factores sociales económicos y culturales.159 Es así como en México se diseñó e implementó el “Plato del bien comer”, en Costa Rica el “Círculo de alimentación saludable”, en Guatemala la “Olla familiar”160, 161 y en EE.UU. el “Choose my plate”.162 A pesar de que en América Latina y el Caribe existen guías alimentarias en más de 25 países, al evaluar el estado actual de estas guías, se ha comentado que los países ponen un gran esfuerzo en su elaboración y poco en las estrategias de implementación y evaluación.
La Academy of Nutrition and Dietetics (AND), diferentes guías de alimentación163 y algunos consensos de obesidad,164, 165 emiten algunas recomendaciones generales importantes que se describen a continuación:
– Promover el consumo de una gran variedad de alimentos saludables.
– Limitar el consumo de bebidas azucaradas.
– Desayunar todos los días.
– Ajustar las porciones de alimentos a la edad.
– Reducir el consumo de grasas sólidas y consumir productos lácteos bajos en grasa.
– No comer frente a un televisor.
Transición epidemiológica: impacto sobre la obesidad
Desde la década de los 80 para todos los países latinoamericanos se ha dado un aumento en la prevalencia de obesidad. Este incremento para Chile en particular ha ido paralelo a la disminucion y la posterior desaparición de la desnutrición, distinto a la situación de los demás países del área en los que la desnutrición sigue prevalente con pocas o ninguna modificaciones.166
Este aumento en la prevalencia ha coincidido con el aumento del ingreso económico. En adultos, las prevalencias medidas en la Encuesta Nacional de Salud 2009/2010 en la población mayor a 18 años fue de 20% en hombres y 29% en mujeres, siendo el de las mujeres de nivel socioeconómico bajo el grupo poblacional con la mayor prevalencia de obesidad en Chile.167, 168
Las causas del cambio son muy variadas pero principalmente se pueden atribuir a dos factores, la falta de ejercicio y la ingesta de alimentos altos en calorías que llegan masivamente al país desde finales de los años 70, sin embargo, se ha publicado relativamente poco en estas áreas.169-171
La falta de información representativa sobre estado nutricional, ingesta de alimentos y actividad física en niños hace muy difícil definir las estrategias y la toma de decisiones gubernamentales sobre la prevención de malnutrición por exceso en Chile.
Estrategias de manejo
Identificación y manejo temprano del incremento de peso en el lactante
Una forma de interpretar el crecimiento y/o aumento de peso en la práctica clínica es usando las curvas de la OMS de los 0 a 59 meses.172 Las definiciones básicas de crecimiento de la OMS son:
– Peso para la edad: refleja masa corporal alcanzada en relación con la edad cronológica.
– Longitud- talla para la edad: refleja el crecimiento lineal alcanzado en relación con la edad cronológica y sus déficits. Se relaciona con alteraciones del estado nutricional a largo plazo.
– Peso para la longitud-talla: refleja el peso corporal en proporción al crecimiento alcanzado en longitud o talla independiente de la edad. Ayuda a identificar niños con bajo peso para la talla o para identificar niños con peso para la longitud/talla elevado que pueden estar en sobrepeso u obesidad.
– IMC: es un indicador más preciso para comparar peso para la longitud-talla.
La identificación del aumento anormal de peso del lactante se puede realizar:
– Clínicamente utilizando los patrones de referencia de crecimiento de la OMS:
– Peso para la longitud-talla ≥ 2 DE.
– IMC para la edad ≥ 2 DE.
– Cambiar de carril hacia arriba en las tablas entre el nacimiento y los 2 años.
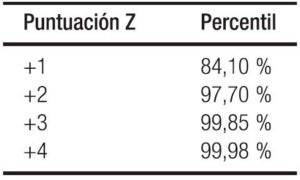
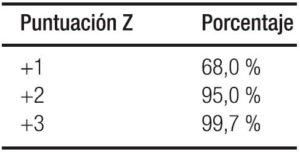
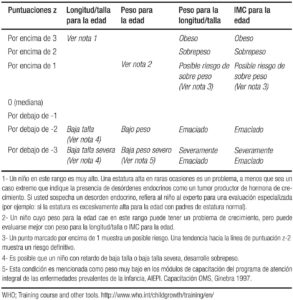
– Obteniendo la diferencia de puntuación z de peso: La puntuación z se define como el cálculo estadístico que compara los datos del valor observado con la población de referencia de manera estandarizada, Ver Tablas 4 a y b. (Se hace la equivalencia con los percentiles en desuso progresivo). En la Tabla 5 se detallan los diagnósticos y su interpretación.
Una de las formas de identificar aumento anormal de peso es cuando hay un incremento ≥ a 0,67 entre la DE de la puntuación z de peso para la edad al nacimiento y la DE de la puntuación z de peso para la edad a una edad posterior (para lactantes).173, 174
– Calculando la velocidad de aumento de peso: peso en kg a los 6 meses menos peso al nacer en kg sobre la edad exacta en meses (promedio para lactantes de 700 g/mes).175
Los lactantes con tendencia al incremento ponderal o con IMC elevado en los primeros 24 meses de edad tienen un aumento significativo en el riesgo de sobrepeso en la edad preescolar, por lo que la identificación temprana de este tipo de pacientes es clave para implementar estrategias que busquen disminuir el riesgo de sobrepeso u obesidad durante la edad preescolar y durante la adolescencia.
Tabla 5. Interpretación de la puntuación Z en DE y los diagnósticos clínicos correspondientes.
Estudios documentando riesgo
Los factores de riesgo que relacionan problemas en las etapas iniciales de vida y obesidad en la niñez y que están frecuentemente documentados incluyen:
- IMC y/o peso materno elevado previos a la gestación: el IMC materno, diabetes gestacional (DG), peso al nacer y la obesidad en la adolescencia se han documentado en un estudio nacional de actividad, y crecimiento, que incluyó 14.881 niños de 9 a 14 años, quienes fueron encuestados acerca de su dieta, la actividad, crecimiento, estatura y peso; y a las madres sobre DG, estatura, peso y el peso al nacer de sus niños. El estudio concluyó que las madres obesas y/o con DG tienen hijos con alto peso al nacer y son más propensos a ser adolescentes obesos.176
- Aumento anormal de peso materno durante gestación: el estilo de vida materno y el rápido aumento de peso inciden sobre el peso del lactante. Se encuestaron 1.524 madres japonesas de niños de 2 años sobre los métodos de alimentación, momento de iniciación de los alimentos sólidos y la edad gestacional al nacer. Se obtuvo, entre otros, número de comidas diarias, la dieta, hábitos de fumar y el consumo de alcohol durante el embarazo. Los hallazgos se resumen en que el bajo peso al nacer predijo el aumento rápido de peso del lactante, el rápido aumento de peso en lactantes se encontró más frecuentemente en madres que tuvieron IMC alto o que reportaron comer una sola comida/día, así como el fumar diariamente antes o durante el embarazo y consumir alcohol antes de la gestación.177
- Peso anormal al nacer (muy alto o bajo): para determinar si el peso/longitud al nacer y el peso/longitud desde el nacimiento hasta los 6 meses se asocia con obesidad a los 3 años, Taveras y colaboradores obtuvieron los datos de peso de nacimiento de 559 historias clínicas, puntuación z de peso/longitud al nacer y de nuevo a los 6 meses y 3 años, y el aumento de peso/longitud en los primeros 6 meses de vida se asoció con riesgo de obesidad a los 3 años.178
- Tasa elevada de aumento de peso durante los dos primeros años de vida: se realizó un estudio de cohortes retrospectivo en el que se analizaron los datos de 854 individuos con el propósito de determinar la probabilidad de obesidad en la adultez temprana en relación a la presencia o ausencia de obesidad en la niñez y a la presencia y ausencia de obesidad en los padres.179 El 94% de los participantes eran blancos no hispanos. La obesidad en los niños entre 1 a 2 años de edad se asoció con un riesgo incrementado de obesidad en la vida adulta, el riesgo de obesidad era significativamente mayor si la madre y/o el padre eran obesos y se corroboró claramente que uno de los mejores momentos para intervenir es antes de los 3 años, enfocándose en los padres y la familia.
Lo que puede y debe hacer el pediatra
Una estrategia prometedora es controlar, como ya se mencionó, tempranamente (antes de los dos años), el incremento de peso en los lactantes interviniendo sobre los factores modificables:
- Modificación de los hábitos de salud de la familia: en los primeros dos años de vida se presenta el momento oportuno para promover el gusto por comidas saludables como frutas y vegetales.180
- Alimentación: los patrones dietarios asociados a sobrepeso surgen muy temprano y se mantienen por siempre. En el estudio FITS (Feeding Infants and Toddlers Study por sus siglas en inglés),181 los lactantes menores de 6 meses mostraron una ingesta energética mayor del 14% que lo requerido; el 45% de los lactantes entre 9 y 12 meses de edad y el 66% de lactantes a los 18 meses consumen bebidas azucaradas y el 37% de los niños entre 6 y 9 meses y el 28% entre 9 y 15 meses no consumieron ni una sola porción de verduras.
- Fomentar alimentación al seno: los lactantes alimentados con leche materna tienen menor riesgo de sobrepeso y la duración y exclusividad de la lactancia materna se asocian inversamente con las tasas de crecimiento en longitud, peso e IMC entre los 3 y 6 meses.182 Además, la lactancia materna se asocia a otras prácticas deseables como: la introducción más tardía de alimentación complementaria y el consumo menos frecuente de alimentos y bebidas azucaradas, y de alimentos altos en grasas antes del primer año de vida.183
- Trabajo del área de adecuada respuesta a señales del lactante: la presentación de los alimentos debe ser adecuada por parte de los padres (no es apropiada cuando hay control y restricción excesivos o falta de control).180 La alimentación debe tener las siguientes características:
– Un entorno emocionalmente propicio de calidez, aceptación y empatía en las respuestas de los padres.
– Evitar prácticas que restrinjan o presionen la alimentación alterando el desarrollo de la autorregulación y contribuyendo al desarrollo de la obesidad.
– Desestimular la alimentación del lactante usando botella/biberón/mamila porque pueden comprometer el desarrollo de la autorregulación al comer; el comer debe ser la respuesta al sentir hambre y el terminar de comer debe ser la respuesta al sentirse satisfecho.
– Apoyar la reducción en el tamaño de las porciones: hay evidencia que demuestra que los niños pequeños comen más cuando se les dan porciones más grandes.
- Fomentar hábitos apropiados de sueño debido a que las alteraciones del mismo sueño tienen evidencia contundente:
– La evidencia de un meta-análisis que revisó estudios de la relación entre sueño y la obesidad concluyó que el riesgo de obesidad de niños y adultos aumenta al reducir la duración del tiempo que duermen.184
– Los niños que tienen problemas para dormir frecuentemente durante los primeros 2 años de vida tienen casi el doble de probabilidad (1,9 veces), de tener obesidad a los 21 años.185
– En los menores de 24 meses, el dormir menos de 12 horas durante la infancia está asociado con una puntuación z del IMC más alta y aumenta al doble el riesgo de desarrollar sobrepeso a los 3 años.186
- Cómo hablar con los padres: los valores culturales de los padres respecto al aumento de peso del niño, la preferencia de las madres a tener un lactante “gordito” y que el niño tenga un mayor peso en el nacimiento, así como la creencia tanto de los padres como de los pediatras, de que los niños “crecen su peso” cuando son mayores, afectan negativamente la identificación y el tratamiento del sobrepeso y la obesidad en los niños. Frecuentemente tanto los padres como los pediatras, e incluso las instituciones, se niegan a reconocer el problema de sobrepeso y obesidad en lactantes.187 Los niños que tienen padres con obesidad tienen el más alto riesgo de obesidad; si uno de los padres tiene obesidad, el niño tienen 40% de riesgo de desarrollar obesidad. Si ambos padres tienen obesidad, el riesgo de obesidad del niño se duplica a 80%.188 El sobrepeso u obesidad de la madre ha sido documentado como uno de los principales factores de riesgo de obesidad, por lo que se debe prestar especial atención a los recién nacidos de madres obesas.
Finalmente los resultados de la mayor parte los estudios indican que el período crítico para prevenir la obesidad en la niñez es durante los 2 primeros años de vida e inclusive para algunos desde los 3 meses de edad.189
Aspectos a considerar en la consulta del niño obeso
Entrevista motivacional: aspectos psicosociales, del medio ambiente, percepción del niño y la familia
Consideraciones: los asuntos que se deben considerar en la consulta de los niños con sobrepeso y obesidad, teniendo en cuenta que son un problema para los proveedores de salud, remiten tanto a la importancia que tiene el problema para los padres y los propios pacientes como a entender no solo los puntos de vista de los padres, si no especialmente, obtener información de la percepción de lo que es un peso normal/saludable y la relación entre peso anormal/elevado y el impacto en la salud.
En la consulta, se debe propiciar una relación de confianza con el paciente y sus padres para facilitar los objetivos: explorar las creencias sobre alimentación, salud y peso, y tener en cuenta los tipos de persona y las reacciones que se pueden encontrar: abierta o defensiva, cooperativa u oposicional, que escucha o que argumenta, comprometida o no, activa o pasiva, con poder para el cambio o ineficaz, con esperanza o que no puede cambiar, y finalmente si hay empatía médico/paciente.
Diálogo (entrevista) motivacional: el diálogo motivacional es un método de comunicación colaborativo, orientado en objetivos, con atención especial al lenguaje del cambio y está diseñado para fortalecer la motivación de un individuo para lograr un objetivo y mantenerse trabajando hacia la meta específica. La idea del diálogo motivacional es que el mismo individuo descubra y explore sus propias razones para cambiar. El diálogo motivacional es guiar, no dirigir o indicar, bailar no luchar, revelar no convencer, y debe ser respetuoso de cada elección: “un estilo de guiar al paciente para mejorar la motivación intrínseca para cambiar».190 Además, “las personas generalmente se persuaden mejor por las razones que ellas mismas han descubierto que por aquellas razones que vienen de la mente de los demás”.
En la consulta se deben tener en cuenta cuatro aspectos fundamentales:
– Informar a los padres sobre la gravedad de la obesidad del niño.
– La necesidad de bajar de peso inmediatamente si el niño se encuentra por encima de 3 DE.
– Las circunstancias en casa: situaciones especiales y quién se encarga del niño.
– Alertar a padres y al niño sobre problemas asociados a la obesidad: esteatosis hepática no alcohólica y sus implicaciones y presentar esta información en forma neutral con el objeto de mejorar la motivación al cambio, hipertensión, dislipidemia o síndrome metabólico.
Se debe también obtener información para entender lo que está sucediendo en el hogar:
– El hogar es monoparental o hay múltiples cuidadores que puedan desvirtuar las costumbres alimentarias.
– En cuanto a los alimentos, qué alimentos son deseables o apropiados para los padres y cómo deciden las familias qué comen, en qué momento y qué cantidad.
– Explorar lo que piensan los padres y los niños cuando corresponda sobre la importancia de la actividad física y el reconocimiento de sus beneficios.
El estilo de crianza y actitudes de los padres: cómo el papel de los padres es fundamental; esto debe explorarse durante la consulta. El estilo de crianza y el nivel de participación de los padres en las costumbres alimentarias, la relación entre la comida y el amor, porque hasta un cierto punto la comida es amor.191
Una vez que se tenga una idea del estilo de crianza se debe trazar un plan estratégico para implantar cambios en sus hábitos, utilizando el enfoque familiar, dándole a los padres y adultos de la familia el papel de modelos de comportamientos saludables con reforzamiento positivo de las buenas conductas observadas en sus hijos, recordando que los niños siempre ¡te están observando!190
Los aspectos emocionales: no debe dejarse de investigar la información concerniente a la salud mental del niño. La depresión y la intimidación pueden ser parte del diario vivir de los niños obesos, originadas en los fracasos de las recomendaciones hechas reiteradamente en cada visita al médico tratante. Los aspectos psicosociales, del medio ambiente, la percepción del niño y la familia de la condición de obeso del paciente, así como la relación con amigos y compañeros de colegio, deben ser parte del diálogo motivacional con los aspectos que determinan el rendimiento escolar. Una vez establecidos todos los aspectos detallados arriba, se puede avanzar con el manejo para determinar la motivación de la familia y del niño para realizar cualquier tipo de cambio, establecer en orden de prioridades los cambios a implementar concertados con padres y pacientes, sin abarcar más de dos objetivos de cambio. Debe ser parte también un cuestionamiento a los padres y a los pacientes sobre cómo harían estos cambios y su participación en el desarrollo de una estrategia específica para obtenerlos y mantenerlos.
Impacto del uso del diálogo motivacional: el uso del diálogo motivacional ha resultado muy positivo cuando se ha usado en el tratamiento de adolescentes con historia de abuso de substancias como tabaco, marihuana, alcohol, y aunque aún no ha sido evaluado por completo, su uso promete ser útil en el manejo de los pacientes con sobrepeso y obesidad y así se ha establecido en algunos estudios de pacientes en el ámbito de la atención terciaria.192
Para corroborar el impacto de la educación respecto a los aspectos emocionales, medioambientales, de atención primaria y familiares, estos dos estudios lo ejemplifican: se siguieron 211 niños y el 77% tuvieron una rebaja estable de IMC y mejoraron 6 comportamientos de salud [tomar bebidas endulzadas y jugos de caja, tiempo de TV, tipo de leche, consumo de frutas y verduras, y frecuencia de la actividad física, con una media de 2,6 visitas durante 4,6 meses en promedio (SD= 1,8)].193 En el segundo, con 432 pacientes seguidos en «Clínica de la obesidad» con una mediana de 2 visitas, el IMC se estabilizó o disminuyó después de 1 año de seguimiento.194
Conclusión: debemos bajar nuestras expectativas para evitar nuestra propia frustración, teniendo en cuenta que ningún individuo, institución o sociedad tiene la experiencia, los recursos y las relaciones para abordar la serie de factores individuales, sociales, culturales, políticos y económicos que dan como resultado los problemas crónicos de salud.195
Cómo proceder en la consulta del niño obeso o con sobrepeso
En la consulta del niño con sobrepeso u obesidad, además del interrogatorio, los hallazgos del examen físico y las recomendaciones, es necesario solicitar, buscar y saber interpretar los resultados paraclínicos en el síndrome metabólico, hígado graso, disregulación de la glucosa y dislipidemia, e interpretar y saber cómo proceder en las complicaciones, entre otras: síndrome metabólico, adiposidad central, hipertensión arterial, apnea obstructiva del sueño y transtornos ortopédicos.
Síndrome metabólico
Para diagnosticarlo es necesaria una definición, que aunque tiene limitaciones (es extrapolada de adultos y no es de consenso), ha servido de base para intentarla, así que en el 2007 la IDF,196 utilizando los criterios de diagnóstico específico para la edad, la definió para niños entre 10 y 15 años así: adiposidad central con una CC ≥ percentil 90, con al menos dos de los siguientes criterios: (TG ≥ 130 mg/dl, HDL ≤ 35 mg/dl, presión arterial sitólica ≥ 114 mmHg < p90 o diastólica ≥ 75 mmHg < p90 y glucemia en ayunas ≥ 100 mg/dl),113 a la cual se le debería sumar la resistencia a la insulina, elemento siempre presente y que solo tiene en cuenta la de la OMS. Los factores de riesgo de SM a tener en cuenta durante la consulta del niño con sobrepeso u obesidad son: circunferencia de la cadera (CC), suma de pliegues cutáneos, historia familiar de DM2, rebote de adiposidad temprana, intolerancia a la glucosa en los adolescentes, resistencia a la insulina y bajo peso al nacer,197-199 en consonancia con la Academia Americana de Pediatría (AAP), de realizar en sangre niveles de glucosa y lípidos en ayunas, y medir la presión arterial en niños y adolescentes obesos o en sobrepeso, independientemente de otras condiciones.200 Hay otros marcadores circulantes que podrían ser de utilidad.201-204
Alteraciones de la glucosa
La intolerancia a la glucosa, una condición pre-diabética tradicional aunque imprecisa, ha demostrado que puede ser un fuerte predictor para el desarrollo de DM2. La determinación de glucosa en ayunas y las pruebas de tolerancia a la glucosa son por el momento las únicas herramientas validadas para tratar de buscar el riesgo para desarrollarla.205 En un futuro la determinación de la hemoglobina glicosilada en niños en riesgo también podría ser un excelente predictor de DM2,206 por lo que solicitar glucosa en ayunas y a las dos horas postcarga debe ser de norma en la consulta.207 Los criteros de anormalidad son: glucosa plasmática en ayunas entre 100 y 125 mg/dl o glucosa plasmática a las 2 horas post-carga de glucosa (1,75 mg/kg, máximo 75 g), entre 140 y 199 mg/dl. Los criterios para el diagnóstico de DM2 son: glucosa plasmática en ayunas mayor o igual a 126 mg/dl; glucosa plasmática post-carga (1,75 mg/k, máximo 75 g), mayor o igual a 200 mg/dl o glucosa plasmática al azar mayor o igual a 200 mg/dL acompañado de síntomas de hiperglucemia.207
Enfermedad de hígado graso no alcohólico
La EHGNA tiene dos estadíos: la acumulación simple de triglicéridos se denomina esteatosis y si hay inflamación, se denomina esteatohepatitis, que puede llevar finalmente a cirrosis con incidencia y prevalencia progresivas.208, 209 Por esta razón todas las veces en la consulta se debe proceder a buscarla y a solicitar una ecografía abdominal y pruebas de función hepática.210 La histología es el estándar de oro para el diagnóstico, pero en niños el momento y la indicación de la realización de la biopsia no tiene aún consenso.211
Su manejo tiene tres niveles: en el primero con solo esteatosis, se interviene solo en el estilo de vida: alimentación y actividad física. En el segundo nivel, se suma la administración de vitamina E. Es un factor protector y puede evitar la progresión de la esteatosis simple a la esteatohepatitis o incluso una vez establecida esta última disminuirla.212 Por último, la microbiota intestinal controla la obesidad y podría tener papel en el manejo de estos pacientes.213, 214 El tercer nivel es definir el estado de fibrosis hepática y determinar primero la conveniencia de biopsia y segundo la posibilidad de transplante hepático.215
Dislipidemia
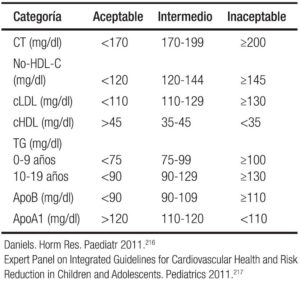
Las condiciones observadas son por lo general una combinación de colesterol total, VLD y LDL altos y colesterol HDL bajo. Los puntos de corte para los niveles aceptables, dudosos y normales de los lípidos y las lipoproteínas (mg/dl) en niños y adolescentes han sido adoptados por la AAP y adaptados por Daniels (Tabla 6).216, 217
Tabla 6. Puntos de corte para el perfil lipídico en 3 niveles: normal, máximo y anormal o inaceptable.
A continuación se dan los aspectos relevantes en el manejo de las dislipidemas, marco en el cual la terapia farmacológica tiene una considerable controversia en niños:
– Cambios del estilo de vida principalmente con el incremento de la actividad física, la intervención de la alimentación con reducción de la ingesta de grasas saturadas a 10% de las calorías totales y del colesterol a 300 mg/día, mientras se mantiene un 25 a 30% del valor calórico total (VCT) para grasas.
– Con elevaciones más graves del colesterol LDL, la ingesta de grasas saturadas debe restringirse al 7% de las calorías totales y el colesterol reducido a 200 mg/día.
– La cantidad de las grasas trans no deben subir del 1% del total de calorías.
– Limitar los alimentos altos en grasas saturadas como carnes y productos lácteos.
– Aumento del consumo de frutas, verduras, granos enteros y productos lácteos bajos en grasas.
– Cuando los niveles de colesterol LDL sobrepasan los 190 mg/dl, se recomienda la intervención farmacológica en niños mayores de 8 años en la ausencia de otros factores de riesgo, o de 160 mg/dl si existe obesidad o hipertensión arterial. La Asociación Americana de la Diabetes recomienda un enfoque más agresivo para la reducción de lípidos en niños con diabetes.
Síndrome de apnea hipoapnea obstructiva del sueño
Los niños con SAHOS tienen alterada la arquitectura de su sueño normal, con hipoxia repetitiva, hipercapnia y reoxigenación que llevan a una sostenida y potente estimulación de la actividad del sistema nervioso simpático, con alteraciones neurocognitivas y del comportamiento,218 cardiovasculares,219 probablemente hipertensivas,220 incremento del estado de inflamación crónica y resistencia a la insulina.221-223 La intervención de otorrinolaringología y neumología, y la solicitud de polisomnografía son mandatorias.
Hipertensión arterial y enfermedad cardiovascular
Se deben interrogar y estudiar en la consulta: a) factores genéticos y epigenéticos; b) el rápido aumento postnatal en respuesta al bajo peso al nacer, por lo que los aportes proteico-calóricos deben ser limitados durante la primera infancia;224 c) la aterosclerosis, que siendo un proceso de larga evolución que se inicia desde la niñez y en obesos se hace más temprano y progresa con mayor rapidez, debe sensibilizar para tomar acciones preventivas de inmediato;225 d) los niveles séricos de lípidos cuya elevación durante la infancia tienen valor predictivo positivo de dislipidemia y riesgo elevado de ECV en la adultez.226, 227
Efectos de la obesidad en el desarrollo del esqueleto
En la condición de sobrepeso, la carga adicional sobre el cartílago-placa de crecimiento posiblemente interrumpe su crecimiento y suprime la osificación endocondral, lo que lleva no solo a acortamiento, si no a deformidades. La posición de la rodilla y la alineación general son fundamentales en la evaluación de los efectos del aumento de peso en un niño con sobrepeso por ser la lesión más frecuente.228
Cuándo y a qué edad se debe iniciar una intervención farmacológica
La obesidad se encuentra asociada con un incremento en los riesgos de padecer enfermedades crónicas, que a su vez ocasionan alta morbimortalidad, por lo que el tratamiento farmacológico debe ser una opción a considerar en conjunto con un cambio del estilo de vida y ajustes del comportamiento, a pesar de su baja efectividad.229 El orlistat es a la fecha el único medicamento para el tratamiento de la obesidad aprobado en niños mayores de 12 años.230 La sibutramina, a pesar de haber sido aprobada para adolescentes mayores de 16 años en octubre de 2010, luego de conocerse los resultados del estudio SCOUT, no se aconseja su uso porque los riesgos superaban los beneficios.231
El tratamiento se clasifica por los mecanismos de acción farmacológica en tres grupos: inhibidores del apetito, cuyos prototipos son sibutramina, canabinoides y metformina; los que disminuyen la absorción de grasa, cuyo ejemplo es el orlistat, que será ampliado más adelante por ser el único aprobado; y los que aumentan el gasto energético y la termogénesis, medicamentos no aprobados como la cafeína y la efedrina pertenecen a este grupo; también lo comparte la sibutramina que tiene mecanismo doble.
El orlistat es un inhibidor reversible de la lipasa pancreática aprobado por la FDA para su uso en niños mayores de 12 años en 2003230 que evita la hidrólisis de la grasa de la dieta y previene su absorción en un 30%,232 lo que se traduce en una reducción en la ingesta calórica. En 3 meta-análisis se concluyó que el efecto del orlistat a la dosis de 120 mg 3 veces al día, junto con los cambios en el estilo de vida y las modificaciones en el comportamiento, es modesto.229, 233, 234
Los efectos secundarios incluyen diarrea, flatulencia, distensión y dolor abdominal, esteatorrea, urgencia defecatoria, náuseas y dispepsia, los cuales están relacionados con el aumento de los triglicéridos no absorbidos en el intestino.235 Para la misma referencia, los pacientes tratados con orlistat deben recibir un suplemento de las vitaminas liposolubles A, D, E y K. En las Tablas 7a y 7b se observa el efecto del medicamento; todos los pacientes, tanto en el placebo como en el tratamiento, tenían dieta, y en los niños todos estaban suplementados con vitaminas durante el curso del estudio.235 El daño hepático es raro y solo tiene efecto no significativo sobre el hierro236 y mínima probabilidad de litiasis biliar.237
A pesar de que la FDA solo lo ha autorizado en niños mayores de 12 años, parece que pudiera utilizarse sin riesgos en niños desde los 2 años.238
Tabla 7. A. Valores bajos de vitaminas en adultos. Dos tomas en el primero y segundo año de tratamiento. B. Valores bajos de vitaminas en niños. Dos tomas en el primero y segundo año de tratamiento.
Futuro de los medicamentos para la obesidad
En la actualidad, y solo en adultos, están aprobados por la FDA, lorcaserina un medicamento con efectos serotoninérgicos, otro combinado de fentermina y topirmato, y un tercero también combinado de naltrexona y bupropion.239, 240 Hay otros que están en estudio: leptina, péptido YY y otra larga lista de más de 20 sustancias que exceden el propósito de esta revisión.
Por último, y en los casos que desafortunadamente son cada vez más frecuentes, el exanatide, ha mostrado utilidad en obesidad grave. El medicamento es un péptido similar al glucagón, agonista del receptor GLP-1, aprobado en adultos con DM2. Disminuye el IMC al suprimir el apetito y aumentar la saciedad, por estímulo de los receptores GLP-1 en el hipotálamo.241, 242
Resumen
El tratamiento farmacológico para la obesidad es indispensable como coadyuvante en el manejo de la obesidad con factores de riesgo que se define como P/T > 2 DE e IMC >2 DE en niños de 2 a 4 años; en niños de 5 o más años, IMC > 2 DE y obesidad severa > 3 DE, que con los parámetros de la IOTF corresponde el primero a IMC de 30 kg/m2. Es decir, cuando sobrepase las 2 DE tanto de P/T como de IMC, o IMC de 30 kg/m2, si hay factores de riesgo asociados como síndrome de apnea obstructiva, hígado graso, ovarios poliquísticos, resistencia a la insulina e intolerancia a la glucosa, y en todos lo casos si el IMC es > 3 DE.
Agradecimientos. Los doctores Solange Heller y Adolfo J Ariza revisaron el texto final y el doctor Ramiro Manzano participó en parte del tema “Estrategias de manejo”.
Referencias
- de Onis M, Onango AW, Borghi E, Slyam A, Nishid C, Chermann J. Development of a WHO growth reference for school-aged children and adolescents. Bull World Health Organ 2007; 85: 660-667.
- World Health Organization. Obesity and overweight. In: http:// www.who.int/mediacentre/factsheets/fs311/en/.
- Ogden CL, Carroll MD, Curtin LR, Lamb MM, Flegal KM. Prevalence of high body mass index in US children and adolescents 2007-2008. JAMA 2010; 303: 242-249.
- National Health Service. National Child Measurement Programme: England, 2012/13 school year. The Health and Social Care Information Centre, Diciembre 11 de 2013.
- Ogden CL, Carroll MD, Kit BK, Flegal KM. Prevalence of childhood and adult obesity in the United States, 2011-2012. JAMA 2014; 311: 806-814.
- Cunningham SA, Kramer MR, Narayan KMV. Incidence of childhood obesity in the United States. N Engl J Med 2014; 370: 403-411.
- Skelton JA, Cook SR, Auinger P, Klein JD, Barlow SE. Prevalence and trends of severe obesity among US children and adolescents. Acad Pediatr 2009; 9: 322-329.
- Marcus MD, Baranowski T, DeBar LL, Edelstein S, Kaufman FR, Schneider M, Siega-Riz AM, Staten MA, Virus A, Yin Z. Severe obesity and selected risk factors in a sixth grade multiracial cohort: the HEALTHY study. J Adolesc Health 2010; 47: 604-607.
- Gupta N, Goel K, Shah P, Misra A. Childhood obesity in developing countries: epidemiology, determinants, and prevention. Endocrine Reviews 2012; 33: 48-70.
- Encuesta Nacional de Salud y Nutrición (Ensanut) (2012). Resultados Nacionales. En: http://ensanut.insp.mx/informes/ENSANUT2012ResultadosNacionales.pdf
- Encuesta Nacional de la Situación Nutricional en Colombia 2010 ENSIN. Fonseca Z, Heredia AP, Ocampo R, Forero Y, Sarmiento OL, Álvarez MC, Estrada A, Samper B, Gempeler J, Rodríguez M. Ministerio de la Protección Social – Instituto Colombiano de Bienestar Familiar. Bogotá, Agosto 2011.
- Mendoza H. Sobrepeso y obesidad en adolescentes dominicanos de alto nivel económico. Arch Dom Ped 1990; 26: 45-50.
- CESDEM: Encuesta Nacional Demográfica y Salud en la República Dominicana. ENDESA 2013.
- de Onis M, Onyango AW, Borghi E, Garza C, Yang H; WHO Multicentre Growth Reference Study Group. Comparison of the World Health Organization (WHO) Child Growth Standards and the National Center for Health Statistics/WHO international growth reference: implications for child health programmes. Public Health Nutrition 2005; 9: 942-947.
- de Onis M, Onyango A, Borghi E, Siyam A, Blössner M, Lutter C; WHO Multicentre Growth Reference Study Group Worldwide implementation of the WHO Child Growth Standards. Public Health Nutrition 2011; 15: 1603-1610.
- de Onis M, Garza C, Victora CG, Onyango AW, Frongillo EA, Martines J. The WHO Multicentre Growth Reference Study: planning, study design, and methodology. Food Nutr Bull 2004; 25: S15-S26.
- de Onis M, Onyango AW, Borghi E, Siyam A, Nishida C, Siekmann J. Development of a WHO growth reference for school-aged children and adolescents. Bull World Health Organ 2007; 85: 660-667.
- World Health Organization (WHO). Physical status: the use and interpretation of anthropometry. Report of a WHO Expert Committee. Technical Report Series No. 854. Geneva: World Health Organization; 1995.
- Kaufer-HorwitzM, Toussaint G. Indicadores antropométricos para evaluar sobrepeso y obesidad en pediatría. Bol Med Hosp Infant 2008; 65: 502-518.
- Organización Mundial de la Salud. Curso de Capacitación sobre la evaluación del crecimiento del niño, Ginebra, OMS, 2008. En: http://www.who.int/childgrowth/training/b_midiendo.pdf.
- Ahima RS, Flier JS. Adipose tissue as an endocrine organ. Trends Endocrinol. Metab 2000; 11: 327-332.
- Trayhurn P. Beattie JH, Physiological role of adipose tissue: white adipose Tissue. Proceedings of the Nutrition Society 2001; 60: 329-339.
- Karelis AD, St-pierre DH, Conus F, Rabasa-Lhoret R, Poehlman ET. Metabolic and Body Composition Factors in Subgroups of Obesity: What Do We Know? J Clin Endocrinol Metab 2004; 89: 2569-2575.
- Dulloo AG, Jacquet J, Solinas G, Montani JP, Schutz Y. Body composition phenotypes in pathways to obesity and the metabolic syndrome. International Journal of Obesity 2010; 34: S4-S17.
- Neels JG, Olefsky JM. A New Way to Burn Fat. Science 2006; 23: 1756-1758.
- Langin D, Dicker A, Tavernier G, Hoffstedt J, Mairal A, Ryden M, Arner E, Sicard A, Jenkins CM, Viguerie N, Van Harmelen V, Gross RW, Holm C, Arner P. Adipocyte Lipases and Defect of Lipolysis in Human Obesity. Diabetes 2005; 54: 3190-3197.
- Haemmerle G, Lass A, Zimmermann R, Gorkiewicz G, Meyer C, Rozman J, Heldmaier G, Maier R, Theussl C, Eder S, Kratky D, Wagner EF, Klingenspor M, Hoefler G, Zechner R. Defective Lipolysis and Altered Energy Metabolism in Mice Lacking Adipose Triglyceride Lipase. Science 2006; 312: 734-737.
- Duncan R, Ahmadian M, Jaworski K, Sarkadi-Nagy E, Sook Sul H. Regulation of Lipolysis in Adipocytes. Annu Rev Nutr 2007; 27: 79-101.
- Brun P, Zhang Yang KJ, Lee S, Yuen J, Blaner WS. Potent regulators of metabolism. Biofactors 2013; 39: 151-163.
- Sorisky A, Magun R, Gagnon AM. Adipose cell apoptosis: death in the energy depot. Int J Obes 2000; 24: S3-S7.
- Tchernof A, Be´langer CH, Morisset A, Richard C, Mailloux J, Laberge P, Dupont P. Regional differences in adipose tissue metabolism in women: minor effect of obesity and body fat distribution. Diabetes 2006; 55: 1353-1360.
- Johnson J, Fried S, Pi-Sunyer F, Albu J. Impaired insulin action in subcutaneous adipocytes from women with visceral obesity. Am J Physiol Endocrinol Metab 2001; 280: E40-E49.
- Després JP, Lemieux I, Bergeron J, Pibarot P, Mathieu P, Larose E, Rodés-Cabau J, Bertrand OF, Poirier P. Abdominal obesity and the metabolic syndrome: contribution to global cardiometabolic risk. Arterioscler Thromb Vasc Biol 2008; 28: 1039-1049.
- Primeau V, Coderre L, Karelis AD, Brochu M, Lavoie M-E, Messier V, Sladek R, Rabasa-Lhoret R. Characterizing the profile of obese patients who are metabolically healthy. International Journal of Obesity 2011; 35: 971-981.
- De Lorenzo A, Del Gobbo V, Premrov MG, Bigioni M, Galvano F, Di Renzo L. Normal-weight obese syndrome: early inflammation? Am J Clin Nutr 2007; 85(1): 40-45.
- Cruz-Jentoft A, Baeyens JP, Jürgen M. Baue R, Yves Boirie Y, Cederholm T, Francesco Land F, Finbarr C, Marti N, Michel JP, Rolland Y, Schneider SM, Topinková E, Vandewoude M, Zamboni M. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing 2010; 39: 412-423.
- Fielding RA, Vellas B, Evans WJ, Bhasin S, Morley JE, Newman AB, Abellan van Kan G, Andrieu S, Bauer J, Breuille D, Cederholm T, Chandler J, De Meynard C, Donini L, Harris T, Kannt A, Keime Guibert F, Onder G, Papanicolaou D, Rolland Y, Rooks D, Sieber C, Souhami E, Verlaan S, Zamboni M. Sarcopenia: an undiagnosed condition in older adults. Current consensus definition: prevalence, etiology, and consequences. International working group on sarcopenia. J Am Med Dir Assoc 2011; 12: 249-256.
- Tipton K. Wolfe R. Protein and aminoacids for athletes. Journal of Sports Sciences 2004; 22: 65-79.
- Waterlow JC. Protein turnover with special reference to man. Quart J Exp Physiol 1984; 69: 409-438.
- De Fronzo RA. Lilly y Lecture 1987: The triunvirate: Beta cell, muscle, liver: A collusion responsible for NIDDM. Diabetes 1988; 37: 667-687.
- León HH, Melo CE, Ramírez JF. Role of the myokines production through the exercise. Journal of Sport and Health Research 2012; 4: 157-166.
- Boström P, Wu J, Jedrychowski MP, Korde A, Ye L, Lo JC, Rasbach KA, Boström EA, Choi JH, Long JZ, Kajimura S, Zingaretti MC, Vind BF, Tu H, Cinti S, Højlund K, Gygi SP, Spiegelman BM. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature 481: 463-468.
- Matsuzawa J, Pathophysiology and Molecular Mechanisms of Visceral Fat Syndrome: The Japanese Experience. Diabetes/Metab1997; 13: 3-13.
- Baumgartner RN. Wayne SJ. Waters DL, Janssen I, Gallagher D, Morley JE. Sarcopenic Obesity Predicts Instrumental Activities of Daily Living. Obesity Research 2004; 12: 1995-2004.
- Bouchard D, Dionne IJ, Brochu M. Sarcopenic/obesity and physical capacity in older men and women: data from the Nutrition as a Determinant of Successful Aging (NuAge) – The Quebec longitudinal Study. Obesity (Silver Spring) 2009; 17: 2082-2088.
- Sakuma K, Yamaguchi A. Sarcopenic Obesity and Endocrinal Adaptation with Age. International Journal of Endocrinology2013; 2013: 204164.
- Brown L D. Endocrine regulation of fetal skeletal muscle growth: impact on future metabolic health. J Endocrinol 2014; 221: R13-R29.
- Sanz Y, Santacruz A, Gauffin P. Gut microbiota in obesity and metabolic disorders. Proc Nutr Soc 2010; 69: 434-441.
- Gill SR, Pop M, Deboy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, Gordon JI, Relman DA, Fraser-Liggett CM, Nelson KE. Metagenomic analysis of the human distal gut microbiome. Science 2006; 312: 1355-1359.
- Nieuwdorp M, Gilijamse PW, Pai N, Kaplan LM. Role of the microbiome in energy regulation and metabolism. Gastroenterology 2014; 146: 1525-1533.
- Kanda H, Tateya S, Tamori Y, Kotani K, Hiasa K, Kitazawa R, Kitazawa S, Miyachi H, Maeda S, Egashira K, Kasuga M. MCP-1 contributes to macrophage infiltration into adipose tissue, insulin resistance, and hepatic steatosis in obesity. J Clin Invest 2006; 116: 1494-1505.
- Lumeng CN, Bodzin JL, Saltiel AR. Obesity induces a phenotypic switch in adipose tissue macrophage polarization. J Clin Invest 2007; 117: 175-184.
- Santacruz A, Marcos A, Wärnberg J, Martí A, Martin-Matillas M, Campoy C, Moreno LA, Veiga O, Redondo-Figuero C, Garagorri JM, Azcona C, Delgado M, García-Fuentes M, Collado MC, Sanz Y; EVASYON Study Group. Interplay between weight loss and gut microbiata composition in overweight adolescents. Obesity 2009; 17: 1906-1915.
- Evans CC, LePard KJ, Kwak JW, Stancukas MC, Laskowski S, Dougherty J, Moulton L, Glawe A, Wang Y, Leone V, Antonopoulos DA, Smith D, Chang EB, Ciancio MJ. Exercise prevents weight gain and alters the gut microbiota in a mouse model of high fat diet-induced obesity. PLoS One 2014; 9: e92193.
- Petriz BA, Castro AP, Almeida JA, Gomes CP, Fernandes GR, Kruger RH, Pereira RW, Franco OL. Exercise induction of gut microbiota modifications in obese, non-obese and hypertensive rats. BMC Genomics 2014; 15: 511.
- Kalliomäki M, Collado MC, Salminen S, Isolauri E. Early differences in fecal microbiota composition in children may predict overweight. Am J Clin Nutr 2008; 87: 534-538.
- Bell DSH. Changes seen in gut bacteria content and distribution with obesity: causation or association? Postgrad Med 2015; 127:863-868.
- Alang N, Kelly CR. Weight gain after fecal microbiota transplantation. Open Forum Infect Dis 2015; 2: ofv004.
- Jumpertz R, Le DS, Turnbaugh PJ, Trinidad C, Bogardus C, Gordon JI, Krakoff J. Energy-balance studies reveal associations between gut microbes, caloric load, and nutrient absorption in humans. Am J Clin Nutr 2011; 94: 58-65.
- Nieuwdorp M, Gilijamse PW, Pai N, Kaplan LM. Role of the Microbiome in Energy Regulation and Metabolism. Gastroenterology 2014; 146: 1525-1533.
- Li M, Gu D, Xu N, Lei F, Du L, Zhang Y, Xie W. Gut carbohydrate metabolism instead of fat metabolism regulated by gut microbes mediates high-fat diet-induced obesity. Beneficial Microbes 2014; 5: 335-344.
- Matias I, Gonthier MP, Orlando P, Martiadis V, De Petrocellis L, Cervino C, Petrosino S, Hoareau L, Festy F, Pasquali R, Roche R, Maj M, Pagotto U, Monteleone P, Di Marzo V. Regulation, function, and dysregulation of endocannabinoids in models of adipose and beta-pancreatic cells and in obesity and hyperglycemia. J Clin Endocrinol Metab 2006; 91: 3171-3180.
- Muccioli GG, Naslain D, Bäckhed F, Reigstad CS, Lambert DM, Delzenne NM, Cani PD. The endocannabinoid system links gut microbiota to adipogenesis. Mol Syst Biol 2010; 6: 392.
- Heslehurst N, Bell R, Rankin J. Tackling maternal obesity: the challenge for public health. Perspect Public Health 2011; 131: 161-162.
- Poston L, Harthoorn LF, Van Der Beek EM: Obesity in pregnancy: implications for the mother and lifelong health of the child: a consensus statement. Pediatr Res 2011; 69: 175-180.
- Speliotes EK, Willer CJ, Berndt SI, Monda KL, Thorleifsson G, Jackson AU, Lango Allen H, Lindgren CM, Luan J, Mägi R, Randall JC, Vedantam S, Winkler TW, Qi L, Workalemahu T, Heid IM, Steinthorsdottir V, Stringham HM, Weedon MN, Wheeler E, Wood AR, Ferreira T, Weyant RJ, Segrè AV, Estrada K, Liang L, Nemesh J, Park JH, Gustafsson S, Kilpeläinen TO, Yang J, Bouatia-Naji N, Esko T, Feitosa M, Kutalik Z, Mangino M, Raychaudhuri S, Scherag A, Smith AV, Welch R, Zhao JH, Aben KK, Absher DM, Amin N, Dixon AL, Fisher E, Glazer NL, Goddard ME, Heard-Costa NL, Hoesel V, Hottenga JJ, Johansson A, Johnson T, Ketkar S, Lamina C, Li S, Moffatt MF, Myers RH, Narisu N, Perry JR, Peters MJ, Preuss M, Ripatti S, Rivadeneira F, Sandholt C, Scott LJ, Timpson NJ. Association analyses of 249, 796 individuals reveal 18 new loci associated with body mass index. Nat Genet 2010; 42: 937-948.
- Hull HR, Thornton JC, Ji Y, Paley C, Rosenn B, Mathews P, Navder K, Yu A, Dorsey K, Gallagher D. Higher infant body fat with excessive gestational weight gain in overweight women. Am J Obstet Gynecol 2011; 205: 211e1-211e7.
- Gale C, Logan KM, Santhakumaran S, Parkinson JR, Hyde MJ, Modi N. Effect of breastfeeding compared with formula feeding on infant body composition: a systematic review and meta-analysis. Am J Clin Nutr 2012; 95: 656-669.
- Godfrey KM, Sheppard A, Gluckman PD, Lillycrop KA, Burdge GC, McLean C, Rodford J, Slater-Jefferies JL, Garratt E, Crozier SR, Emerald BS, Gale CR, Inskip HM, Cooper C, Hanson MA: Epigenetic gene promoter methylation at birth is associated with child’s later adiposity. Diabetes 2011; 60: 1528-1534.
- Brune BC, Gerlach MK, Seewald MJ, BruneTG. Early postnatal BMI adaptation is regulated during a fixed time period and mainly depends on maternal BMI. Obesity 2010; 18: 798-802.
- Bradfield JP, Taal HR, Timpson NJ, Scherag A, Lecoeur C, Warrington NM, Hypponen E, Holst C, Valcarcel B, Thiering E, Salem RM, Schumacher FR, Cousminer DL, Sleiman PM, Zhao J, Berkowitz RI, Vimaleswaran KS, Jarick I, Pennell CE, Evans DM, St Pourcain B, Berry DJ, Mook-Kanamori DO, Hofman A, Rivadeneira F, Uitterlinden AG, van Duijn CM, van der Valk RJ, de Jongste JC, Postma DS, Boomsma DI, Gauderman WJ, Hassanein MT, Lindgren CM, Mägi R, Boreham CA, Neville CE, Moreno LA, Elliott P, Pouta A, Hartikainen AL, Li M, Raitakari O, Lehtimäki T, Eriksson JG, Palotie A, Dallongeville J, Das S, Deloukas P, McMahon G, Ring SM, Kemp JP, Buxton JL, Blakemore AI, Bustamante M, Guxens M, Hirschhorn JN, Gillman MW, Kreiner-Møller E, Bisgaard H, Gilliland FD, Heinrich J, Wheeler E, Barroso I, O’Rahilly S, Meirhaeghe A, Sørensen TI, Power C, Palmer LJ, Hinney A, Widen E, Farooqi IS, McCarthy MI, Froguel P, Meyre D, Hebebrand J, Jarvelin MR, Jaddoe VW, Smith GD, Hakonarson H, Grant SF; Early Growth Genetics Consortium. A genome-wide association metaanalysis identifies new childhood obesity loci. Nat Genet 2012; 44: 526-531.
- Cetin I, Mandó C, Calabrese S. Maternal predictors of intrauterine growth restriction. Curr Opin Clin Nutr Metab Care 2013; 16: 310-319.
- Kuzawa C. You are what your mother ate? Am J Clin Nutr 2013; 97: 1157-1158.
- Lewis R, Poore K, Godfrey K. The role of the placenta in the developmental origins of health and disease – Implications for practice. Reviews in Gynaecological and Perinatal Practice 2006; 6: 70-79.
- Larqué E, Ruiz-Palacios M, Koletzko B. Placental regulation of fetal nutrient supply. Curr Opin Clin Nutr Metab Care 2013; 16: 292-297.
- Symonds ME1, Mendez MA, Meltzer HM, Koletzko B, Godfrey K, Forsyth S, van der Beek EM. Early life nutritional programming of obesity: Mother-Child Cohort Studies. Ann Nutr Metab 2013; 62: 137-145.
- Koletzko B, Beyer J, Brands B. Early influences of nutrition on postnatal growth. Nestle Nutr Inst Workshop 2013; 71: 11-27.
- Baird J, Fisher D, Lucas P, Kleijnen J, Roberts H, Law C. Being big or growing fast: systematic review of size and growth in infancy and later obesity. BMJ 2005; 331: 929.
- Monteiro PO, Victora CG. Rapid growth in infancy and childhood and obesity in later life: a systematic review. Obes Rev 2005; 6: 143-154.
- Ong KK, Loos RJ. Rapid infancy weight gain and subsequent obesity: systematic reviews and hopeful suggestions. Acta Paediatr 2006; 95: 904-908.
- Moss BG, Yeaton WH. U.S. children’s preschool weight status trajectories: patterns from 9-month, 2-year, and 4-year Early Childhood Longitudinal Study-Birth cohort data. Am J Health Promot 2012; 26: 172-175.
- Gittner LS, Ludington-Hoe SM, Haller HS. Utilising infant growth to predict obesity status at 5 years. J Paediatr Child Health 2013; 49: 564-574.
- Harrington JW, Nguyen VQ, Paulson JF, Garland R, Pasquinelli L, Lewis D. Identifying the «tipping point» age for overweight pediatric patients. Clin Pediatr (Phila) 2010; 49: 638-643.
- Riumalló J. Obesidad en el lactante. En: Obesidad: un desafío pendiente. Albala C, Kain J, Burrows R, Díaz E. Editorial Universitaria. Primera. Ed. Santiago Chile 2000.
- Setton, Fernández. Nutrición en Pediatría. Bases para la práctica clínica en niños sanos y enfermos. Editorial Panamericana. Buenos Aires 2014.
- Ministerio de Salud. Evaluación del estado nutricional de niñas, niños y embarazadas mediante antropometría. Buenos Aires, 2da. Ed. 2009.
- Cornier MA, Després JP, Davis N, Grossniklaus DA, Klein S, Lamarche B, Lopez-Jimenez F, Rao G, St-Onge MP, Towfighi A, Poirier P; American Heart Association Obesity Committee of the Council on Nutrition; Physical Activity and Metabolism; Council on Arteriosclerosis; Thrombosis and Vascular Biology; Council on Cardiovascular Disease in the Young; Council on Cardiovascular Radiology and Intervention; Council on Cardiovascular Nursing, Council on Epidemiology and Prevention; Council on the Kidney in Cardiovascular Disease, and Stroke Council. Assessing adiposity: a scientific statement from the American Heart Association. Circulation 2011; 124: 1996-2019.
- Fox CS, Massaro JM, Hoffmann U, Pou KM, Maurovich-Horvat P, Liu CY, Vasan RS, Murabito JM, Meigs JB, Cupples LA, D’Agostino RB Sr, O’Donnell CJ. Abdominal Visceral and Subcutaneous Adipose Tissue Compartments: Association With Metabolic Risk Factors in the Framingham Heart Study. Circulation 2007; 116: 39-48.
- Hu HH, Nayak KS, Goran MI. Assessment of abdominal adipose tissue and organ fat content by magnetic resonance imaging. Obes Rev 2011; 12: e504-e515.
- Ross R, Berentzen T, Bradshaw AJ, Janssen I, Kahn HS, Katzmarzyk PT, Kuk JL, Seidell JC, Snijder MB, Sørensen TI, Despre ́s JP. Does the relationship between waist circumference, morbidity and mortality depend on measurement protocol for waist circumference? Obes Rev 2008; 9: 312-325.
- Wang J, Thornton JC, Bari S, et al. Comparisons of waist circumferences measured at 4 sites. Am J Clin Nutr 2003; 77: 379-384.
- Harrington DM, Staiano AE, Broyles ST, Gupta AK, and Katzmarzyk PT. Waist circumference measurement site does not affect relationships with visceral adiposity and cardiometabolic risk factors in children. Pediatr Obes 2013; 8: 199-206.
- Center for Disease Control and Prevention. National Health and Nutrition Examination Survey (NHANES) Anthropometry Procedures Manual 2009. In: http://www.cdc.gov/nchs/data/nhanes/ nhanes_09_10/Lab.pdf
- Fernandez IR, Redden DT, Pietrobelli A, Allison DB. Waist circumference percentiles in nationally representative samples of African-American, European-American and Mexican-American children and adolescents. J Pediatr 2004; 145: 439-444.
- l’Allemand-Jander D. Clinical diagnosis of metabolic and cardiovascular risks in overweight children: early development of chronic diseases in the obese child. Int J Obes 2010; 34: S32-S36.
- Kelly AS, Barlow SE, Rao G, Inge TH, Hayman LL, Steinberger J, Urbina EM, Ewing LJ, Daniels SR. Severe Obesity in Children and Adolescents: Identification, Associated Health Risks, and Treatment Approaches. A Scientific Statement From the American Heart Association. Circulation 2013; 128: 1689-1712.
- Sijtsma A, Bocca G, L’Abée C, Liem ET, Sauer PJJ, Corpeleijn E. Waist-to-height ratio, waist circumference and BMI as indicators of percentage fat mass and cardiometabolic risk factors in children aged 3 – 7 years. Clinical Nutrition 2014; 33: 311-315.
- BakerJL, Nathalie J, Farpour-Lambert P, Nowicka A, Pietrobelli RW. Evaluation of the Overweight/Obese Child practical Tips for the Primary Health Care Provider: Recommendations from the Childhood Obesity Task Force of the European Association for the Study of Obesity. Obes Facts 2010; 3: 131-137.
- Joan C Han, Debbie A Lawlor, Sue Y S Kimm. Childhood obesity. Lancet 2010; 375: 1737-1748.
- Soares BM, Araújo TM, Ramos JA, Pinto LC, Khayat BM, De Oliveira Bahia M, Montenegro RC, Burbano RM, Khayat AS. Effects on DNA repair in human lymphocytes exposed to the food dye tartrazine yellow. Anticancer Res 2015; 35: 1465-1474.
- León Espinosa de los Monteros MT, Rueda Domingo MT, Castillo Sánchez MD, León Espinosa de los Monteros M, Ceballos Atienza R, Fernández Lloret S. Estudio de los aditivos alimentarios y su repercusión en la población infantil. Medicina de Familia 2000; 1: 25-30.
- McCann D, Barrett A, Cooper A, Crumpler D, Dalen L, Grimshaw K, Kitchin E, Lok K, Porteous L, Prince E, Sonuga-Barke E, Warner JO, Stevenson J. Food additives and hyperactive behaviour in 3-year-old and 8/9-year-old children in the community: a randomised, double-blinded, placebo – controlled trial. Lancet 2007; 370: 1560-1567.
- Malik VS, Popkin BM, Bray GA, Després JP, Willett WC, Hu FB. Sugar-sweetened beverages and risk of metabolic syndrome and type 2 diabetes: a meta-analysis. Diabetes Care 2010; 33: 2477-2483.
- Lupton DA. Lay discourses and beliefs related to food risks: an Australian perspective. Sociol Health Illn 2005; 27: 448-467.
- Deshmukh-Taskar PR, Nicklas TA, O’Neil CE, Keast DR, Radcliffe JD, Cho S. The relationship of breakfast skipping and type of breakfast consumption with nutrient intake and weight status in children and adolescents: the National Health and Nutrition Examination Survey 1999-2006. J Am Diet Assoc 2010; 110: 869-878.
- Szajewska H, Ruszczynski M. Systematic review demonstrating that breakfast consumption influences body weight outcomes in children and adolescents in Europe. Cirt Rev Sci Nutr 2010; 50: 113-119.
- Reilly J, Kelly J. Long-term impact of overweight and obesity in childhood and adolescence on morbidity and premature mortality in adulthood: systematic review. International Journal of Obesity 2011; 35: 891-898.
- Franks PW, Hanson RL, Knowler WC, Sievers ML, Bennett PH, Looker HC. Childhood obesity, other cardiovascular risk factors, and premature death. N Engl J Med 2010; 362: 485-493.
- Alonso-Álvarez ML, Cordero-Guevara JA, Terán-Santos J, González-Martínez M, Jurado-Luque MJ, Corral-Peñafiel J4, Duran-Cantolla J, Kheirandish-Gozal L, Gozal D. Obstructive sleep apnea in obese community-dwelling children: the NANOS study. Sleep 2014; 37: 943-949.
- Steinberger J, Daniels SR. American Heart Association Atherosclerosis, Hypertension, and Obesity in the Young Committee (Council on Cardiovascular Disease in the Young); American Heart Association Diabetes Committee (Council on Nutrition, Physical Activity, and Metabolism). Obesity, insulin resistance, diabetes, and cardiovascular risk in children: an American Heart Association scientific statement from the Atherosclerosis, Hypertension, and Obesity in the Young Committee (Council on Cardiovascular Disease in the Young) and the Diabetes Committee (Council on Nutrition, Physical Activity, and Metabolism). Circulation 2003; 107: 1448-1453.
- National Cholesterol Education Program, Executive summary of the third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001; 285: 2486-2497.
- Balkau B, Charles MA: Comment on the provisional report from the WHO consultation. European Group for the Study of Insulin Resistance (EGIR). Diabet Med 1999; 16: 442-443.
- Alberti KG, Zimmet P, Shaw J. IDF Epidemiology Task Force Consensus Group. The metabolic syndrome a new worldwide definition. Lancet 2005; 366: 1059-1062.
- Weiss R, Dziura J, Burgert TS, Tamborlane W, Taksali S, Yeckel C, Allen K, Melinda Lopes RN, Savoye M, Morrison J, Sherwin RS, Caprio S. Obesity and the metabolic syndrome in children and adolescents. N Engl J Med 2004; 350: 2362-2374.
- Costa RF, Santos NS, Goldraich NP, Barski TF, Andrade KS, Kruel LF. Metabolic syndrome in obese adolescents: a comparison of three different diagnostic criteria. J Pediatr (Rio J) 2012; 88: 303-309.
- Cook S, Weitzman M, Auinger P, Nguyen M, Dietz W. Prevalence of a Metabolic Syndrome Phenotype in Adolescents. Arch Pediatr Adolesc Med 2003; 157: 821-827.
- de Ferranti SD, Gauvreau K, Ludwig DS, Neufeld EJ, Newburger JW, Rifai N. Prevalence of the metabolic syndrome in American adolescents: findings from the Third National Health and Nutrition Examination Survey. Circulation 2004; 110: 2494- 2497.
- Schwimmer JB, Deutsch R, Kahen T, Lavine JE, Stanley C, Behling C. Prevalence of fatty liver in children and adolescents. Pediatrics 2006; 118: 1388-93.
- Schwimmer JB, Deutsch R, Rauch JB, Behling C, Newbury R, Lavine JE: Obesity, insulin resistance, and other clinicopathological correlates of pediatric nonalcoholic fatty liver disease. J Pediatr 2003; 143: 500-505.
- Yu Z, Han S, Zhu J, Sun X, Ji C, Guo X. Pre-Pregnancy Body Mass Index in Relation to Infant Birt h Weight and Offspring Overweight/Obesity: A Systematic Review and Meta-Analysis. PLoS One2013; 8: e61627.
- Sridhar SB, Darbinian J, Ehrlich SF, Markman MA, Gunderson EP, Ferrara A, Hedderson MM. Maternal gestational weight gain and offspring risk for childhood overweight or obesity. Am J Obstet Gynecol 2014; 211: 259.
- Suzuki K, Sato M, Zheng W, Shinohara R, Yokomichi H, Yamagata Z. Effect of maternal smoking cessation before and during early pregnancy on fetal and childhood growth. J Epidemiol 2014; 24: 60-66.
- Huh SY, Rifas-Shiman SL, Zera CA, Edwards JW, Oken E, Weiss ST, Gillman MW. Delivery by caesarean section and risk of obesity in preschool age children: a prospective cohort study. Arch Dis Child 2012; 97: 610-616.
- Arenz S, Ruckerl R, Koletzko B, von Kries R. Breast-feeding and childhood obesity – a systematic review. Int J Obes Relat Metab Disord 2004; 28: 1247-1256.
- Rooney BL, Mathiason MA, Schauberger CW. Predictors of Obesity in Childhood, Adolescence, and Adulthood in a Birth Cohort. Matern Child Health J 2010; 7: 7.
- Owen CG, Martin RM, Whincup PH, Smith GD, Cook DG. Effect of infant feeding on the risk of obesity across the life course: a quantitative review of published evidence. Pediatrics 2005; 115: 1367-1377.
- Harder T, Bergmann R, Kallischnigg G, Plagemann A. Duration of breastfeeding and risk of overweight: a meta-analysis. Am J Epidemiol 2005; 162: 397-403.
- Li R, Fein SB, Grummer-Strawn LM. Do infants fed from bottles lack self-regulation of milk intake compared with directly breastfedinfants? Pediatrics 2010; 125: e1386-e1393.
- Gillman MW, Ludwig DS. How early should obesity prevention start? N Engl J Med 2013; 369: 2173-2175.
- Hawkins SS, Cole TJ, Law C; Millennium Cohort Study Child Health Group. An ecological systems approach to examining risk factors for early childhood overweight: findings from the UK Millennium Cohort Study. J Epidemiol Community Health 2009; 63: 147-155.
- Huh SY, Rifas-Shiman SL, Taveras EM, Oken E, Gillman MW. Timing of solid food introduction and risk of obesity in preschool-aged children. Pediatrics 2011; 127: e544-e551.
- de Onis M, Garza C, Onyango AW, Martorell R. WHO child growth standards. Acta Paediatr 2006; 95: S450: 3-101.
- Human energy requirements: report of a joint FAO/WHO/ UNU Expert Consultation, Rome 17-24 October 2001. In: http://www.who.int/nutrition/publications/nutrientrequirements/en/
- Human energy requirements: report of a joint FAO/ WHO/ UNU Expert Consultation. Food Nutr Bull 2005; 26:166.
- Physical Activity Guidelines for Americans 2008. In: http://fitprogram.ucla.edu/
- Organización Mundial de la Salud. Recomendaciones mundiales sobre actividad física para la salud. OMS 2010. In: http://www. who.int/dietphysicalactivity/publications/9789241599979/es/
- Early childhood obesity prevention policies. In: www.nap.edu/ catalog/13124/early-childhood-obesity
- Early Childhood Obesity Prevention Policies Goals, Recommendations, and Potential Action. www.iom.edu/obesityyoungchildren.
- Institute of Medicine (IOM). Early Childhood Obesity Prevention Policies. Washington, DC: The National Academies Press; 2011. Adv Nutr 2012; 3: 56-57.
- Tremblay MS, Barnes JD, Cowie Bonne J. Impact of the active healthy kids Canada report card: a 10-year analysis. J Phys Act Health 2014; 11: S3-S20.
- Chaput JP, Brunet M, Tremblay A. Relationship between short sleeping hours and childhood overweight/obesity: results from the ‘Québec en Forme’ Project. Int J Obes 2006; 30: 1080-1085.
- Iglayreger HB, Peterson MD, Liu D1, Parker CA, Woolford SJ, Sallinen Gafka BJ, Hassan F, Gordon PM. Sleep duration predicts cardiometabolic risk in obese adolescents. J Pediatr 2014; 164: 1085-1090.
- How much sleep do we really need? In: https://sleepfoundation. org/how-sleep-works/how-much-sleep-do-we-really-need
- Organización Panamericana de la Salud. Principios de orientación para la alimentación complementaria del niño amamantado. Organización Mundial de la Salud 2003. En: http://www.who. int/child_adolescent_health/documents/a85622/es/index.html
- Organización Panamericana para la Salud. Principios de orientación de la alimentación de niños no amamantados entre los 6 y los 24 meses de edad. Washington D.C. OPS 2007. En: http:// www2.paho.org/HQ/dmdocuments/2009/Principios-orientacion-para-la-alimentacion-de-los-ninos-no-amamantados.pdf
- La alimentación del lactante y del niño pequeño. OMS 2010. En: http://apps.who.int/iris/bitstre am/10665/44310/1/9789275330944_spa.pdf
- Gil Hernández A, Uauy Dagach R, Dalmau Serra J. Comité de Nutrición de la AEP. Bases for adequate complementary feeding in infants and young children. An Pediatr 2006; 65: 481-495.
- Raiten DJ, Raghavan R, Porter A, Obbagy JE, Spahn JM. Executive summary: evaluating the evidence base to support the inclusion of infants and children from birth to 24 mo of age in the Dietary Guidelines for Americans – “the B-24 Project”. Am J Clin Nutr 2014; 99: 663S-691S.
- Clinton HR. 1,000 Days: change a life, change the future. US Department of State; September 21, 2010. In: http://www.state. gov/secretary/rm/2010/09/147512.htm.
- Krebs NF, Westcott JE, Butler N, Robinson C, Bell M, Hambidge KM. Meat as a first complementary food for breastfed infants: feasibility and impact on zinc intake and status. J Pediatr Gastroenterol Nutr 2006; 42: 207-2014.
- Grote V, Theurich M. Complementary feeding and obesity risk. Curr Opin Clin Nutr Metab Care 2014; 17: 273-277.
- Oddy WH, Mori TA, Huang RC, Marsh JA, Pennell CE, Chivers PT, Hands BP, Jacoby P, Rzehak P, Koletzko BV, Beilin LJ. Early infant feeding and adiposity risk: from infancy to adulthood. Ann Nutr Metab 2014; 64: 262-270.
- Hetherington MM, Schwartz C, Madrelle J, Croden F, Nekitsing C, Vereijken CM. A step by step introduction to vegetables at the beginning of complementary feeding. The effects of early and repeated exposure. Appetite 2014; 84: 280-290.
- Pan L, Li R, Park S, Galuska DA, Sherry B, Freedman DS. A longitudinal analysis of sugar-sweetened beverage intake in infancy and obesity at 6 years. Pediatrics 2014; 134: S29-S35.
- Koletzko B, von Kries R, Closa R, Escribano J, Scaglioni S, Giovannini M. European Childhood Obesity Trial Study Group. Lower protein in infant formula is associated with lower weight up to age 2y: a randomized clinical trial. Am J Clin Nutr 2009; 89: 1836-1845.
- Weber M, Grote V, Closa-Monasterolo R, Escribano J, Langhendries JP, Dain E, Giovannini M, Verduci E, Gruszfeld D, Socha P, Koletzko B; European Childhood Obesity Trial Study Group. European Childhood Obesity Trial Study Group. Lower protein content in infant formula reduces BMI and obesity risk at school age: follow-up of a randomized trial. Am J Clin Nutr 2014; 99: 1041-1051.
- Engle PL, Pelto GH. Responsive feeding: implications for policy and program implementation. J Nutr 2011; 141: 508-511.
- Black MM, Aboud FE. Responsive feeding is embedded in a theoretical framework of responsive parenting. J Nutr 2011; 141: 490-494.
- El estado de las guías alimentarias basadas en alimentos en América Latina y el Caribe, FAO 2014. En: www.fao.org/3/a-i3677s.pdf.
- El plato del bien comer. Facultad de Medicina UNAM. En: http:// www.facmed.unam.mx/deptos/salud/periodico/30%20plato/pdf
- Guías Alimentarias para Costa Rica 2011 – Ministerio de Salud de Costa Rica. En: http://www.ministeriodesalud.go.cr/…/guia_ alimentarias_2011_completo.pdf
- USDA ChooseMyplate.gov. In: http://www.choosemyplate. gov/about.html
- Ogata BN, Hayes D. Position of the Academy of Nutrition and Dietetics: nutrition guidance for healthy children ages 2 to 11 years. J Acad Nutr Diet 2014; 114: 1257-1276.
- Evaluation Obesity Prevention Efforts: A Plan for Measuring Progress (2013). Institute of Medicine of the National Academies. In: http://iom.nationalacademies.org/Reports/2013/Evaluating- Obesity-Prevention-Efforts-A-Plan-for-Measuring-Progress.aspx
- Speiser PW, Rudolf MC, Anhalt H, Camacho-Hubner C, Chiarelli F, Eliakim A, Freemark M, Gruters A, Hershkovitz E, Iughetti L, Krude H, Latzer Y, Lustig RH, Pescovitz OH, Pinhas- Hamiel O, Rogol AD, Shalitin S, Sultan C, Stein D, Vardi P, Werther GA, Zadik Z, Zuckerman-Levin N, Hochberg Z; Obesity Consensus Working Group. Childhood obesity. J Clin Endocrinol Metab 2005; 90: 1871-1887.
- Ivanovic D, Rodríguez MP, Perez H, Alvear J, Diaz N, Leyton B, Almagia A, Toro T, Urrutia MS, Ivanovic R. Twelve-year follow-up study of the impact of nutritional status at the onset of elementary school on later educational situation of Chilean school-age children. European J Clin Nutr 2008; 62: 18-31.
- ENS Encuesta Nacional de Salud de Chile 2009/2010. Ministerio de Salud – Universidad Católica. En: http://web.minsal.cl/ portal/url/item/bcb03d7bc28b64dfe040010165012d23.
- Liberona Y, Castillo O, Engler V, Villarroel L, Rozowski J. Nutritional profile of school children from different socio-economic levels in Santiago, Chile. Public Health Nutrition 2010: 14: 142- 149.
- Vásquez F, Cardona O, Andrade M, Salazar G. Balance de energía, composición corporal y actividad física en preescolares eutróficos y obesos. Rev Chil Pediatr 2005; 76: 266-274.
- Olivares S, Kain J, Lera L, Pizarro F, Vio F, Morón C. Nutritional status, food consumption and physical activity among Chilean school children: a descriptive study. European Journal of Clinical Nutrition 2004; 58: 1278-1285.
- Vásquez F, Salazar G, Rodríguez MP, Andrade M. Comparación entre la ingesta alimentaria de preescolares obesos y eutróficos asistentes a jardines infantiles de JUNJI de la zona Oriente de Santiago. Arch Latin Nutri 2007; 57: 343-348.
- Patrones de Crecimiento Infantil. En: http://www.who. int/childgrowth/es/.
- Ong KK, Loos RJ. Rapid infancy weight gain and subsequent obesity: systematic reviews and hopeful suggestions. Acta Paediatr 2006; 95: 904-908.
- Mihrshahi S, Battistutta D, Magarey A, Daniels LA. Determinants of rapid weight gain during infancy: baseline results from the NOURISH randomized controlled trial. BMC Pediatr 2011; 11: 99.
- Dennison BA, Edmunds LS, Stratton HH, Pruzek RM. Rapid infant weight gain predicts childhood overweight. Obesity (Silver Spring) 2006; 14: 491-499.
- Gillman MW, Rifas-Shiman SL, Berkey CS, Field AE, Colditz GA. Maternal gestational diabetes, birth weight, and adolescent obesity. Pediatrics 2003; 111: e221-e226.
- Oyama M, Nakamura K, Tsuchiya Y, Yamamoto M. Unhealthy maternal lifestyle leads to rapid infant weight gain: prevention of future chronic diseases. Tohoku J Exp Med 2009; 217: 67-72.
- Taveras EM, Rifas-Shiman SL, Belfort MB, Kleinman KP, Oken E, Gillman MW. Weight status in the first 6 months of life and obesity at 3 years of age. Pediatrics 2009; 123: 1177-1183.
- Whitaker RC, Wright JA, Pepe MS, Seidel KD, Dietz WH. Predicting obesity in young adulthood from childhood and parental obesity. N Engl J Med 1997; 337: 869-873.
- Birch LL, Doub AE. Learning to eat: birth to age 2 y. Am J Clin Nutr 2014; 99: 723S-728S.
- Siega-Riz AM, Kinlaw A, Deming DM, Reidy KC. New findings from the Feeding Infants and Toddlers Study 2008. Nestle Nutr Workshop Ser Pediatr Program 2011; 68: 83-100.
- Durmuş B, van Rossem L, Duijts L, Arends LR, Raat H, Moll HA, Hofman A, Steegers EA, Jaddoe VW. Breast-feeding and growth in children until the age of 3 years: the Generation R Study. Br J Nutr 2011; 105: 1704-1711.
- La alimentación del lactante y del niño pequeño: Capítulo Modelo para libros de texto dirigidos a estudiantes de medicina y otras ciencias de la salud. En: http://www.who.int/maternal_ child_adolescent/documents/9789241597494/es/
- Cappuccio FP, Taggart FM, Kandala NB, Currie A, Peile E, Stranges S, Miller MA. Meta-analysis of short sleep duration and obesity in children and adults. Sleep 2008; 31: 619-626.
- Al Mamun A, Lawlor DA, Cramb S, O’Callaghan M, Williams G, Najman J. Do childhood sleeping problems predict obesity in young adulthood? Evidence from a prospective birth cohort study. Am J Epidemiol 2007; 166: 1368-1373.
- Taveras EM, Rifas-Shiman SL, Oken E, Gunderson EP, Gillman MW. Short sleep duration in infancy and risk of childhood overweight. Arch Pediatr Adolesc Med 2008; 162: 305-311.
- Nichols MR, Livingston D. Preventing pediatric obesity: assessment and management in the primary care setting. J Am Acad Nurse Pract 2002; 14: 55-62.
- Whitaker RC. Predicting preschooler obesity at birth: the role of maternal obesity in early pregnancy. Pediatrics 2004; 114: 29-36.
- Dubois L, Girard M. Early determinants of overweight at 4.5 years in a population-based longitudinal study. Int J Obes (Lond) 2006; 30: 610-617.
- Lane C, Hood K, Rollnick S. Teaching motivational interviewing: using role play is as effective as using simulated patients. Med Educ 2008; 42: 637-644.
- Faith MS, Van Horn L, Appel LJ, Burke LE, Carson JA, Franch HA, Jakicic JM, Kral TV, Odoms-Young A, Wansink B, Wylie-Rosett J; American Heart Association Nutrition and Obesity Committees of the Council on Nutrition; Physical Activity and Metabolism; Council on Clinical Cardiology; Council on Cardiovascular Disease in the Young; Council on Cardiovascular Nursing; Council on Epidemiology and Prevention, and Council on the Kidney in Cardiovascular Disease. Evaluating parents and adult caregivers as «agents of change» for treating obese children: evidence for parent behavior change strategies and research gaps: a scientific statement from the American Heart Association. Circulation 2012; 125: 1186-1207.
- Christison AL, Daley BM, Asche CV, Ren J, Aldag JC, Ariza AJ, Lowry KW. Pairing motivational interviewing with a nutrition and physical activity assessment and counseling tool in pediatric clinical practice: a pilot study. Child Obes 2014; 10: 432-441.
- Ariza AJ, Hartman J, Grodecki J, Clavier A, Ghaey K, Elsner M, Moore C, Reina OO, Binns HJ. Linking pediatric primary care obesity management to community programs. J Health Care Poor Underserved 2013; 24: 158-167.
- Ariza AJ, Ruch-Ross H, Sawyer A, Batey S, Maloney M, Wall T, Hines V, Robles K, Sontag D, Haverkamp KS, López S, Binns HJ: Pediatric Practice Research Group. Obesity care strategies in primary care practices. J Pediatr 2012; 161: 152-155.
- Green L, Daniel M, Novick L. Partnerships and coalitions for community-based research. Public Health Rep 2001; 116: 20-31.
- Goodman E, Daniels SR, Meigs JB, Dolan LM: Instability in the diagnosis of metabolic syndrome in adolescents. Circulation 2007; 115: 2316-2322.
- Hill DJ, Prapavessis H, Shoemaker JK, Jackman M, Mahmud FH, Clarson C. Relationship between Birth Weight and Metabolic Status in Obese Adolescents. ISRN Obes 2013; 28: 490923.
- Ponzio C, Palomino Z, Puccini RF, Strufaldi MW, Franco MC. Does low birth weight affect the presence of cardiometabolic risk factors in overweight and obese children? Eur J Pediatr 2013; 172: 1687-1692.
- Eyzaguirre F, Bancalari R, Román R, Silva R, Youlton R, Urquidi C, García H, Mericq V. Prevalence of components of the metabolic syndrome according to birthweight among overweight and obese children and adolescents. J Pediatr Endocrinol Metab 2012; 25: 51-56.
- Barlow SE; Expert Committee recommendations regarding the prevention, assessment, and treatment of child and adolescent overweight and obesity: summary report. Pediatrics 2007; 120: S164-S192.
- Lipshultz SE, Schaechter J, Carrillo A, Sanchez J, Qureshi MY, Messiah SE, Hershorin ER, Wilkinson JD, Miller TL. Can the consequences of universal cholesterol screening during childhood prevent cardiovascular disease and thus reduce long-term health care costs? Pediatr Endocrinol Rev 2012; 9: 698-705.
- Park HK, Hwang JS, Moon JS, Lee JA, Kim DH, Lim JS. Healthy range of serum alanine aminotransferase and its predictive power for cardiovascular risk in children and adolescents. J Pediatr Gastroenterol Nutr 2013; 56: 686-691.
- Daniels SR, Greer FR; Committee on Nutrition. Lipid screening and cardiovascular health in childhood. Pediatrics 2008; 122: 198-208.
- Klünder-Klünder M1, Flores-Huerta S, García-Macedo R, Peralta-Romero J, Cruz M. Adiponectin in eutrophic and obese children as a biomarker to predict metabolic syndrome and each of its components. BMC Public Health 2013; 30(13): 88.
- Papoutsakis C, Yannakoulia M, Ntalla I, Dedoussis GV. Metabolic syndrome in a Mediterranean pediatric cohort: prevalence using International Diabetes Federation-derived criteria and associations with adiponectin and leptin. Metabolism 2012; 61: 140-145.
- Weiss R, Taksali SE, Tamborlane WV, Burgert TS, Savoye M, Caprio S. Predictors of changes in glucose tolerance status in obese youth. Diabetes Care 2005; 28: 902-909.
- American Diabetes Association: Standards of medical care in diabetes – 2014. Diabetes Care 2014; 37: S14-S80.
- Pacifico L, Nobili V, Anania C, Verdecchia P, Chiesa C. Pediatric nonalcoholic fatty liver disease, metabolic syndrome and cardiovascular risk. World J Gastroenterol 2011; 17: 3082-3091.
- Marzuillo P, Miraglia del Giudice E, Santoro N. Pediatric fatty liver disease: role of ethnicity and genetics. World J Gastroenterol 2014; 20: 7347-7355.
- Vajro P, Lenta S, Socha P, Dhawan A, McKiernan P, Baumann U, Durmaz O, Lacaille F, McLin V, Nobili V. Diagnosis of nonalcoholic fatty liver disease in children and adolescents: position paper of the ESPGHAN Hepatology Committee. J Pediatr Gastroenterol Nutr 2012; 54: 700-713.
- Alkhouri N, De Vito R, Alisi A, Yerian L, Lopez R, Feldstein AE, Nobili V. Development and validation of a new histological score for pediatric non-alcoholic fatty liver disease. J Hepatol 2012; 57: 1312-1318.
- Sanyal AJ, Chalasani N, Kowdley KV, McCullough A, Diehl AM, Bass NM, Neuschwander-Tetri BA, Lavine JE, Tonascia J, Unalp A, Van Natta M, Clark J, Brunt EM, Kleiner DE, Hoofnagle JH, Robuck PR; NASH CRN. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. N Engl J Med 2010; 362: 1675-1685.
- Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Microbial ecology: human gut microbes associated with obesity. Nature 2006; 444: 1022-1023.
- Ferrer M, Ruiz A, Lanza F, Haange SB, Oberbach A, Till H, Bargiela R, Campoy C, Segura MT, Richter M, von Bergen M, Seifert J, Suárez A. Microbiota from the distal guts of lean and obese adolescent’s exhibit partial functional redundancy besides clear differences in community structure. Environ Microbiol 2013; 15: 211-226.
- Nobili V, Alisi A, de Ville de Goyet J. Metabolic syndrome and nonalcoholic steatohepatitis recurrence after liver transplantation in children. Liver Transpl 2011; 17: 620-621.
- Daniels S.R. Screening and Treatment of Dyslipidemias in Children and Adolescents. Horm Res Paediatr 2011; 76: 47-51.
- Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents: Summary Report. Pediatrics 2011; 128: 213-256.
- O’Brien LM, Holbrook CR, Mervis CB, Klaus CJ, Bruner JL, Raffield TJ, Rutherford J, Mehl RC, Wang M, Tuell A, Hume BC, Gozal D. Sleep and neurobehavioral characteristics of 5 to 7-year-old children with parentally reported symptoms of attention-deficit/hyperactivity disorder. Pediatrics 2003; 111: 554-563.
- Bhattacharjee R, Kheirandish-Gozal L, Pillar G, Gozal D. Cardiovascular complications of obstructive sleep apnea syndrome: evidence from children. Prog Cardiovasc Dis 2009; 51: 416-433.
- Nisbet LC, Yiallourou SR, Biggs SN, Nixon GM, Davey MJ, Trinder JA, Walter LM, Horne RS. Preschool children with obstructive sleep apnea: the beginnings of elevated blood pressure? Sleep 2013; 36: 1219-1226.
- Bhushan B, Maddalozzo J, Sheldon SH, Haymond S, Rychlik K, Lales GC, Billings KR. Metabolic alterations in children with obstructive sleep apnea. Int J Pediatr Otorhinolaryngol 2014; 78: 854-859.
- Gozal D, Kheirandish-Gozal L, Carreras A, Khalyfa A, Peris E. Obstructive sleep apnea and obesity are associated with reduced GPR 120 plasma levels in children. Sleep 2014; 37: 935-941.
- Gileles-Hillel A, Alonso-Álvarez ML, Kheirandish-Gozal L, Peris E, Cordero-Guevara JA, Terán-Santos J, Martínez MG, Jurado- Luque MJ, Corral-Peñafiel J, Duran-Cantolla J, Gozal D. Inflammatory markers and obstructive sleep apnea in obese children: the NANOS study. Mediators Inflamm 2014; 2014: 605280.
- Singhal A, Cole TJ, Fewtrell M, Kennedy K, Stephenson T, Elias-Jones A, Lucas A. Promotion of faster weight gain in infants born small for gestational age: is there an adverse effect on later blood pressure? Circulation 2007; 115: 213-220.
- Hudson LD, Rapala A, Khan T, Williams B, Viner RM. Evidence for contemporary arterial stiffening in obese children and adolescents using pulse wave velocity: A systematic review and meta-analysis. Atherosclerosis 2015; 241: 376-386.
- Freedman DS, Dietz WH, Srinivasan SR, Berenson GS. The relation of overweight to cardiovascular risk actors among children and adolescents: the Bogalusa heart study, Pediatrics 1999; 103: 1175-1182.
- Quijada Z, Paoli M, Zerpa Y, Camacho N, Cichetti R, Villarroel V, Arata-Bellabarba G, Lanes R. The triglyceride/HDL-cholesterol ratio as a marker of cardiovascular risk in obese children; association with traditional and emergent risk factors. Pediatr Diabetes 2008; 9: 464-471.
- Gettys FK, Jackson JB, Frick SL. Obesity in pediatric orthopaedics. Orthop Clin North Am 2011; 42: 95-105.
- Peirson L, Fitzpatrick-Lewis D, Morrison K, Warren R, Usman Ali M, Raina P. Treatment of overweight and obesity in children and youth: a systematic review and meta-analysis. Cmaj Open 2015; 3: E23-E33.
- FDA Orlistat Update Pediatric Advisory Committee Meeting. March 22, 2010. Lisa L Mathis. In: http://www.fda.gov/downloads/advisorycommittees/committeesmeetingmaterials/pediatricadvisorycommittee/ucm205380
- FDA Drug Safety Communication: FDA Recommends Against the Continued Use of Meridia (sibutramine). [10-8-2010] The U.S. Food and Drug Administration (FDA). In: http://www.fda. gov/drugs/drugsafety/ucm228746.htm
- Guerciolini R. Mode of action of orlistat. Int J Obes Relat Metab Disord 1997; 21: s12-s23.
- Maahs D, de Serna DG, Kolotkin RL, Ralston S, Sandate J, Qualls C, Schade DS. Randomized, double-blind, placebo-controlled trial of orlistat for weight loss in adolescents. Endocr Pract 2006; 12: 18-28.
- Matson KL, Fallon RM. Treatment of obesity in children and adolescents. J Pediatr Pharmacol Ther 2012; 17: 45-57.
- Food and Drugs Administration. Reference ID: 3074639 1. 2012-01-24. In: www.accessdata.fda.gov/drugsatfda_docs/ label/2012/020766s029lbl.
- Zhi J, Moore R, Kanitra L. The effect of short-term (21-day) orlistat treatment on the physiologic balance of six selected macrominerals and microminerals in obese adolescents. J Am Coll Nutr 2003; 22: 357-362.
- Trouillot TE, Pace DG, McKinley C, Cockey L, Zhi J, Häeussler J, Guerciolini R, Showalter R, Everson GT. Orlistat maintains biliary lipid composition and hepatobiliary function in obese subjects undergoing moderate weight loss. Am J Gastroenterol 2001; 96: 1888-1894.
- Norgren S, Danielsson P, Jurold R, Lötborn M, Marcus C. Orlistat treatment in obese prepubertal children: a pilot study. Acta Paediatr 2003; 92: 666-670.
- Khorassani FE, Misher A, Garris S. Past and present of antiobesity agents: focus on monoamine modulators. Am J Health Syst Pharm 2015; 72: 697-706.
- Kakkar AK, Dahiya N. Drug treatment of obesity: current status and future prospects. Eur J Intern Med 2015; 26: 89-94.
- Kelly AS, Metzig AM, Rudser KD, Fitch AK, Fox CK, Nathan BM, Deering MM, Schwartz BL, Abuzzahab MJ, Gandrud LM, Moran A, Billington CJ, Schwarzenberg SJ. Exenatide as a weight-loss therapy in extreme pediatric obesity: a randomized, controlled pilot study. Obesity (Silver Spring) 2012; 20: 364-370.
- Kelly AS, Rudser KD, Nathan BM, Fox CK, Metzig AM, Coombes BJ, Fitch AK, Bomberg EM, Abuzzahab MJ. The effect of glucagon-like peptide-1 receptor agonist therapy on body mass index in adolescents with severe obesity: a randomized, placebo-controlled, clinical trial. JAMA Pediatr 2013; 167: 355-360.
Correspondencia: Fernando Sarmiento Quintero
Correo electrónico: fsarmientoq@unal.edu.co
Acta Gastroenterol Latinoam 2016;46(2): 131-159
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE