Bedini Marianela Patricia,1 Butti Abel Lázaro,1 Juan Horacio Cuoto,2 Gorordo Ipiña Rosa Carolina,1 Martínez Mariano Emanuel,2 Pérez Ana Saralía,2 Trakál Esteban,1 Zárate Fabián Eduardo,1, 2 Trakál Juan José1
1 Clínica Universitaria Reina Fabiola.
2 Hospital Córdoba. Córdoba, Argentina.
Acta Gastroenterol Latinoam 2018;48(2):73-78
Recibido: 05/04/2017 / Aprobado: 15/01/2018 / Publicado en www.actagastro.org el 18/06/2018
Resumen
La tríada de anemia ferropénica, disfagia y membranas esofágicas, conocida como Síndrome de Plummer-Vinson (SPV) o Paterson-Kelly (SPK), se presenta frecuentemente en mujeres de edad media, aunque en la bibliografía existen reportes de casos en otros grupos etarios. A pesar de que existen diversas hipótesis, su patogenia aún no se encuentra totalmente definida; el déficit de hierro es el principal responsable de las alteraciones anatómicas y funcionales que se producen a nivel esofágico.
Su manifestación clínica principal es la disfagia, inicialmente intermitente y luego progresiva, asociada con síntomas atribuibles a ferropenia, como coiloniquia y queilitis, entre otros. El diagnóstico es clínico e imagenológico; la videoendoscopía digestiva alta (VEDA) es una herramienta esencial que permite además el abordaje terapéutico. Su tratamiento consiste tanto en la reposición de hierro como en técnicas endoscópicas que varían de acuerdo con la experiencia y la disponibilidad de cada centro.
Exponemos dos casos clínicos con anemia, disfagia, pérdida de peso, glositis atrófica y queilitis angular, que evidenciaron tanto en el tránsito esófagogastroduodenal como en la VEDA la presencia de una membrana esofágica superior. En uno de ellos, se realizó la ruptura espontánea al efectuar el paso del endoscopio; mientras que en el otro se utilizó la dilatación endoscópica por medio de un balón. Ambos presentaron resolución inmediata de los síntomas y excelente evolución clínica.
Palabras claves. Disfagia, membrana esofágica, Síndrome de Plummer-Vinson, Síndrome Patterson-Kelly, anemia sideropénica.
Plummer-Vinson Syndrome. Report of two cases and literature review
Summary
The triad of iron deficiency anemia, dysphagia, and esophageal membranes, known as Plummer Vinson or Paterson- Kelly Syndrome, occurs infrequently in middle-aged women. Although there are several hypotheses, its pathogenesis is not yet fully defined, with the iron deficiency being the main responsible for the anatomical and functional alterations that occur at the esophageal level.
Its main clinical manifestation is dysphagia, initially intermittent and then progressive, associated with symptoms attributable to iron deficiency, such as coiloniquea, cheilitis, among others. The diagnosis is clinical and imaging; with endoscopy being an essential tool that also allows a therapeutic approach. Its treatment consists of both iron replacement and endoscopic techniques that vary according to the experience and availability of each center.
We report two clinical cases with anemia, dysphagia, weight loss, atrophic glossitis and angular cheilitis, which showed the presence of a superior esophageal membrane in the barium esophagogastroduodenal transit and endoscopy. In one of them, the spontaneous rupture was performed when the endoscopy was made; while in the other endoscopic dilation was used by means of a balloon. Both presented immediate resolution of the symptoms and excellent clinical evolution.
Key words. Dysphagia, esophageal membranes, Plummer-Vinson syndrome, Patterson-Kelly syndrome, sideropenic anemia.
Abreviaturas
SPV: síndrome de Plummer-Vinson.
SPK: síndrome de Patterson Kelly.
VEDA: videoendoscopia digestiva alta.
TEGD: tránsito esófagogastroduodenal.
Caso clínico 1
Paciente de sexo femenino, 48 años, oriunda de Córdoba capital, Argentina, con antecedentes personales de insulinoma y anemia crónica, que acude a la consulta por disfagia intermitente de un año de evolución. La misma se presentó inicialmente ante sólidos, progresó posteriormente a líquidos y se asoció en el último mes con regurgitación de alimentos. Refirió además parestesias en miembros inferiores, astenia y pérdida de peso.
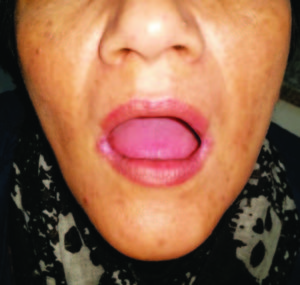
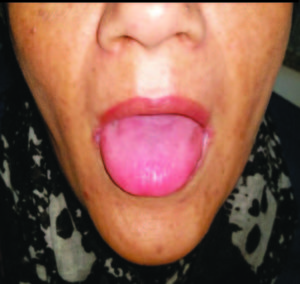
El examen físico inicial reveló solo la presencia de queilitis angular y glositis atrófica (Figura 1 y 2). Laboratorio: anemia microcítica e hipocrómica (hematíes: 451.0000/mm3, Hgb: 9,3 g%, Hto: 32,5%, VCM: 72 fl; HCM: 20,6 pg, CHCM: 28,6 g%); trombocitosis reactiva (plaquetas: 750.000/mm3) y en su perfil ferrocinético se objetivó la disminución franca de los depósitos de hierro (ferremia: 27 ug%, transferrina: 312 ug%, saturación de transferrina: 9%). Los niveles de vitamina B12 (380 pg/ml), el hepatograma, el proteinograma, la función tiroidea y renal se registraron normales.
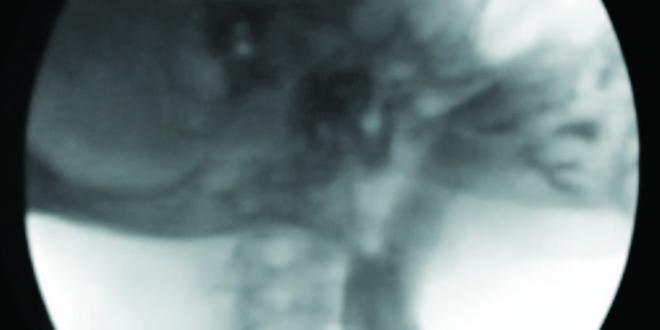
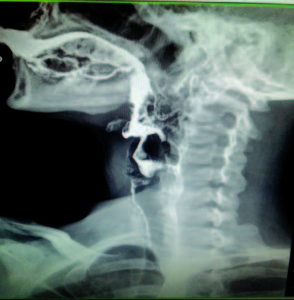
Se efectuó un tránsito esófagogastroduodenal (TEGD) que reveló a nivel esofágico superior la presencia de una ligera membrana que no impedía el pasaje del material de contraste (Figura 3). Se programó la realización de una videoendoscopía digestiva alta (VEDA), objetivándose la presencia de una membrana grisácea en el tercio superior esofágico, la cual ocupaba menos del 25 % de la circunferencia (Figura 4). No se evidenciaron alteraciones patológicas significativas en el duodeno y en el estómago. Se realizó una dilatación esofágica en tres tiempos con balón neumático de expansión radial controlada (Boston Scientific® 10-12 mm), hasta un máximo de 12 atmósferas, sin complicaciones inmediatas ni tardías posteriores al procedimiento (Figura 5).
Las biopsias obtenidas informaron la presencia de una gastritis crónica folicular activa con evidencia de infección por Helicobacter pylori, duodenitis crónica inespecífica y esofagitis moderada con acantosis e hiperqueratosis.
Ante los hallazgos clínicos y de los estudios complementarios se arribó al diagnóstico de SPV.
Figura 3. Membrana esofágica superior en el TEGD.
Figura 4. Membrana esofágica superior, blanco grisácea, que ocupa el 25% de la circunferencia, visualizada durante la realización de la VEDA.
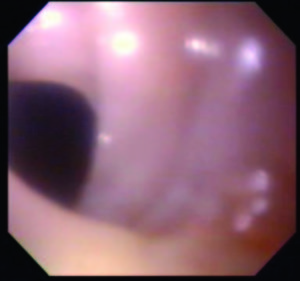
Figura 5. Dilatación endoscópica con balón neumático de expansión radial controlada (Boston Scientific® 10-12 mm) sin complicaciones inmediatas ni tardías posteriores al procedimiento.
La paciente presentó evolución favorable, en tratamiento por su anemia ferropénica en el servicio de hematología, con resolución completa de los síntomas.
Caso clínico 2
Paciente de sexo masculino, 25 años, con antecedentes de diabetes mellitus tipo 1, anemia crónica y litiasis renal, que consultó por disfagia intermitente y progresiva, de 8 meses de evolución, asociada con pérdida de peso, astenia y odinofagia. Además, refirió haber presentado durante los meses previos a la consulta un episodio de impactación de un bolo alimentario con resolución espontánea.
El examen físico reveló signos de deshidratación moderada, glositis, queilitis angular y coiloniquia (Figura 6). Laboratorio: anemia microcítica e hipocrómica (Hgb: 12,4 g/dl, Hto: 36,2%, VCM: 70fl).
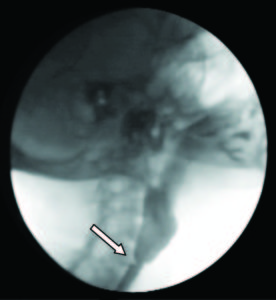
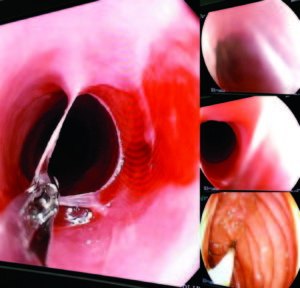
En una videodeglución se demostró la presencia de una membrana a nivel faringoesofágico que provocaba enlentecimiento en el pasaje del material de contraste (Figura 7). La VEDA objetivó a nivel cricofaríngeo una estrechez significativa, correspondiente con una membrana esofágica superior, la cual logró franquearse con el endoscopio, observándose restos de esta adheridas a dicho nivel y la mucosa de aspecto erosivo (Figura 8).
Los resultados anatomopatológicos informaron mucosa esofágica con inflamación crónica moderada, gastritis crónica leve y duodenitis inespecífica. Con los hallazgos previamente descriptos se concluyó como diagnóstico definitivo de SPV.
El TEGD de control demostró deglución conservada y un correcto pasaje del medio de contraste. Posterior al procedimiento, el paciente evolucionó favorablemente, con mejoría notable de su disfagia y buena tolerancia a la dieta.
Figura 6. Al examen físico la presencia de glositis atrófica, coiloniquia y queilitis angular.
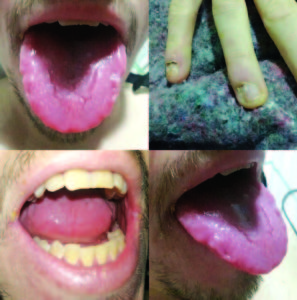
Figura 7. Membrana esofágica en la video deglución.
Figura 8. Se observa la presencia de una membrana durante la realización de la VEDA, con restos de la mucosa erosionada y adherida a nivel esofágico superior.
Discusión
En el año 1912 Plummer describió un conjunto de pacientes que presentaban disfagia secundaria a espasmos esofágicos.1 Vinson en 1922 reportó casos de anemia ferropénica asociada a disfagia, la cual atribuyó predominantemente a trastornos psiquiátricos.2 Sin embargo fueron Paterson y Kelly quienes finalmente establecieron que dicha disfagia en pacientes con anemia sideropénica era producida debido a la presencia de membranas.3 Desde entonces se conoce a la tríada constituida por disfagia, anemia sideropénica y membranas esofágicas como SPV o SPK, entre otros nombres menos frecuentes.
Constituye una entidad rara que ocurre predominantemente en mujeres caucásicas, entre los 40 y los 70 años, y que se presenta esporádicamente en el sexo masculino, niños y/o adolescentes.4, 5
A pesar de que su incidencia es poco conocida, se cree que ha disminuido durante los últimos años debido tanto al avance en los cuidados de la salud, como a la mejoría en el tratamiento de la anemia ferropénica, sobre todo en mujeres embarazadas.6
El síntoma más frecuente es la disfagia orofaríngea, indolora, intermitente, de grado leve a moderado, inicialmente ante alimentos sólidos, con progresión posterior a líquidos.7 Esta lenta evolución lleva en la mayoría de los casos a un retraso diagnóstico. En un estudio prospectivo de 135 pacientes, el promedio de duración de los síntomas hasta la consulta fue de 5 años y 4 meses.5
Asimismo, pueden presentarse otros signos y síntomas secundarios al déficit de hierro, tales como lengua depapilada, queilitis angular y coiloniquia, entre otros. Ocasionalmente se ha asociado con esplenomegalia e hipertrofia tiroidea.8 La anemia ferropénica constituye una forma de presentación de enfermedad celíaca y han sido reportados casos en la literatura de asociaciones con el SPV, por lo que se aconseja la realización de biopsias duodenales durante la endoscopía.9, 10
Las membranas corresponden a estructuras únicas, de epitelio plano estratificado, blanquecinas, que se localizan principalmente en el tercio esofágico superior, aunque pueden desarrollarse en cualquier parte del trayecto esófago-gástrico e inclusive encontrarse más de una de ellas.11 Si bien la mayoría de los casos poseen de manera conjunta anemia y membranas esofágicas, su asociación no es perfecta y existen casos con hemograma y perfil ferrocinético normal.12
Su patogénesis no ha sido esclarecida completamente y han sido propuestas varias hipótesis. La principal de ellas establece que el epitelio del esófago al presentar un recambio celular muy elevado necesita hierro para realizar una correcta síntesis celular.12 Cuando existe déficit de este, la mucosa se atrofia y las células degeneradas producen membranas blanquecinas.8, 12, 13 Existen reportes que establecen que la disfagia es producida también por un trastorno funcional, uno de los cuales fue el efectuado por Dantas y col. Ellos realizaron un examen manométrico en pacientes con SPV y pudieron observar que presentaban contracciones esofágicas de menor intensidad en relación con quienes no poseían dicho síndrome, y que las mismas se normalizaban al mejorar la anemia ferropénica.14 Esto podría ser explicado, ya que la hemoglobina es necesaria para lo producción de óxido nítrico, y debido a su déficit se producen alteraciones tanto en la peristalsis como en la relajación del esfínter esofágico superior.7 Sin embargo, el hecho de que ocurra en pacientes que no presentan anemia ni déficit nutricional, genera la hipótesis de que estarían implicados otros determinantes, como por ejemplo factores inmunológicos, genéticos y medioambientales.15
El diagnóstico se realiza a partir de tres pilares: clínico, radiológico y endoscópico. El TEGD resulta de vital importancia en el estudio de todo paciente con disfagia, por lo que constituye el primer método complementario a realizar. A pesar de ello, membranas con 1-2 mm de proyección pueden no detectarse, observándose en un reciente estudio prospectivo que el 14% que presentaban una membrana esofágica en la endoscopía no evidenciaban alteraciones en los estudios baritados.15
La importancia de esta entidad radica en que constituye una lesión precancerosa.9 Estudios previos sugieren que entre el 3 y 16 % de los pacientes con anemia y déficit de hierro desarrollan algún tipo de cáncer en el tracto digestivo superior.7 Si bien la mayor proporción se producen en el esófago, también pueden producirse en el estómago, la cavidad oral y la hipofaringe.10-16 En la actualidad no hay guías sobre el tiempo de vigilancia endoscópica, sin embargo, la mayoría de los reportes de casos y series prospectivas establecen necesario realizar un seguimiento endoscópico anual.5
El primer paso en el tratamiento consiste en normalizar los depósitos de hierro ya que varias series muestran una franca mejoría posterior a esto, logrando inclusive evitar la utilización de técnicas endoscópicas.4, 7
Pese a esto, la endoscopía es esencial, ya que no solo constituye una importante herramienta diagnóstica sino también terapéutica, que permite descartar la presencia de otras lesiones asociadas. A menudo la ruptura de la membrana ocurre accidentalmente durante la insuflación del esfínter esofágico superior, principalmente cuando la visualización no es directa y la membrana es fina e incompleta.7, 15-17 La terapéutica endoscópica varía ampliamente según los recursos y la experiencia del centro. Entre el 80 y el 90 % de los casos responden exitosamente a la dilatación con bujías de Savary o balón.18 No se encontraron en la literatura diferencias tanto en la resolución de síntomas como en la recurrencia al utilizar una u otra técnica.6 La principal ventaja de la dilatación esofágica consiste en la baja tasa de complicaciones como sangrado o perforación y la franca mejoría posterior al tratamiento. Sin embargo, en algunas series de casos la tasa de recurrencia va del 14 al 30%.5 Uno de los tratamientos de elección es la sección radiada de la membrana mediante criocirugía ya que, a diferencia de las técnicas de dilatación, no presenta recurrencias.10
Cuando se presentan estructuras refractarias o recurrentes se puede considerar realizar dilatación combinada con corticoides,16 mitomicina,17 terapia incisional,10 colocación de stent o cirugía.6 Existen otras técnicas terapéuticas descriptas, como la terapia de coagulación con argón plasma o lisis por láser n-YAG, pero su eficacia y seguridad necesitan ser corroboradas por medio de estudios prospectivos.5-19 En líneas generales su pronóstico es bueno, con excepción de aquellos pacientes que evolucionan a cáncer.
Conclusiones
En ambos casos clínicos se arribó al diagnóstico de SPV. A pesar de que constituye una entidad de baja frecuencia, debemos considerarla en el diagnóstico diferencial de todo paciente con disfagia progresiva, pérdida de peso y anemia ferropénica. La utilización de los métodos complementarios nos permite realizar el diagnóstico de certeza y la terapéutica correspondiente. No debemos olvidar que su condición precancerosa nos obliga al segui-miento periódico y a la resolución de la anemia tan pronto como sea posible. Nos pareció importante realizar el reporte de estos casos clínicos debido a la baja frecuencia de esta patología, la importancia de su diagnóstico temprano, la gran variedad terapéutica disponible y el importante giro diagnóstico/pronóstico que podemos provocar en la actualidad en estos pacientes.
Referencias
- Plummer HS. Diffuse dilatation of the esophagus without anatomic stenosis (cardiospasm): A report of ninety-one cases. JAMA 1912; 58: 2013-2015.
- Vinson PP. A case of cardiospasm with dilatation and angulation of the esophagus. Med Clin North Am 1919; 3: 623-627.
- Kelly AB. Spasm at the entrance of the esophagus. J Laryngol Otol 1919; 34: 285-289.
- Enomoto M, Kohmoto M, Arafa UA, Shiba M, Watanabe T, Tominaga K, Fujiwara Y, Saeki Y, Higuchi K, Nishiguchi S, Shiomi S, Osugi H, Kinoshita H, Arakawa T. Plummer-Vinson syndrome successfully treated by endoscopic dilatation. J Gastroenterol Hepatol 2007; 22: 2348-2351.
- Bakari G, Benelbarhdadi I, Bahije L, El Feydi Essaid A. Endoscopic treatment of 135 cases of Plummer-Vinson web: a pilot experience. Gastrointest Endosc 2014; 80: 738-741.
- Van Boeckel PGA, Siersema PD. Refractory esophageal strictures: what to do when dilation fails. Curr Treat Op Gastroenterol 2015; 13: 47-58.
- Tahara T, Shibata T, Okubo M, Yoshioka D, Ishizuka T, Sumi K, Kawamura T, Nagasaka M, Nakagawa Y, Nakamura M, Arisawa T, Ohmiya N, Hirata I. A case of Plummer-Vinson Syndrome Showing Rapid Improvement of dysphagia and esophageal web after two weeks of iron therapy. Case Rep Gastroenterol 2014; 8: 211-215.
- Lanke G, Koduru P, Bhutani MS. Case Report: Plummer-Vinson syndrome presenting as squamous cell carcinoma of esophagus. J Dig Endosc 2016; 7: 71-73.
- Jessner W, Vogelsang H, Püspök A, Ferenci P, Gangl A, Novacek G, BodischA, Etienne Wenzl M. Letter to Editor: Plummer-Vinson syndrome associated with celiac disease and complicated by postcricoid carcinoma and carcinoma of the tongue. Am J Gastroenterol 2003; 98: 1208-1209.
- Gültepe I, Başaranoğlu M. Two cases with Plummer-Vinson syndrome in the 21st century. Turk J Gastroenterol 2016; 27: 81-82.
- Seo MH, Chun HJ, Jeen YT, Park SC, Keum B, Kim Y-S, Seo YS, Lee HS, Um SH, Kim CD, Ryu HS. Esophageal web resolved by endoscopic incision in a patient with Plummer-Vinson syndrome. Gastrointest Endosc 2011; 74: 1142-1143.
- Mangla A, Agarwal N, Yu J, Telfer M. Clinical Image: Spooning of the nails and webbing of the esophagus: koilonychia and Plummer-Vinson Syndrome. Clin Case Rep 2015; 3: 1054-1055.
- Changela K, Haeri NS, Krishnaiah M, Reddy M. Plummer-Vinson Syndrome with Proximal Esophageal Web. J Gastrointes Surg 2016: 20: 1074-1075.
- Dantas RO, Villanova MG. Esophageal motility impairment in Plummer-Vinson syndrome. Correction by iron treatment. Dig Dis and Sci 1993; 38: 968-971.
- Goel A, Lakshmi CP, Bakshi SS, Soni N, Koshy S. Single-center prospective study of Plummer-Vinson syndrome. Dis Esophagus 2016; 29: 837-841.
- Kim K, Kim MC, Jung GJ. Gastric cancer occurring in a patient with Plummer-Vinson syndrome: A case report. W J Gastroenterol 2005; 11: 7048-7050.
- Katsinelos P, Gkagkalis S, Chatzimavroudis G, Zavos C, Spyridakis J, Kountouras J. Recurrent esophageal web in Plummer-Vinson syndrome successfully treated with post dilation intralesional injection of mitomycin C. Gastrointest Endosc 2012; 75: 1124.
- Kochhar R, Poornachandra KS. Intralesional steroid injection therapy in the management of resistant gastrointestinal strictures. W J Gastrointest Endosc 2010; 2: 61-68.
- González Wellens N, Mínguez S, Lozano M, Olive A. Argon plasma coagulation therapy of upper esophageal web in a patient with Plummer-Vinson syndrome: A new therapeutical option. Cartas al Editor Med Clin (Barc) 2010; 135: 135-142.
Correspondencia: Bedini Marianela Patricia
Estrada 30, Piso Tercero, Departamento D. Córdoba Capital, Córdoba, Argentina
Tel: 0351-152260757
Correo electrónico: marianelabedini@gmail.com
Acta Gastroenterol Latinoam 2018;48(2): 73-78
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE