Gabriel Adrián Mariño Camacho ID· Alejandro Moreira Grecco ID· Andrés Wonaga ID· Carlos Waldbaum ID· Andrés Salcedo ID· Esteban González Ballerga ID
Hospital de Clínicas José de San Martín.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2024;54(3):273-277
Recibido: 16/01/2024 / Aceptado: 05/08/2024 / Publicado online el 30/09/2024 /
https://doi.org/10.52787/agl.v54i3.387
Resumen
La dehiscencia de la anastomosis colorrectal es una complicación postquirúrgica seria que aumenta la morbilidad, mortalidad, la duración de la internación hospitalaria y los costos de la atención médica significativamente. Su frecuencia oscila entre el 4 y el 26%. Depende, entre otros factores de riesgo, de la edad avanzada, una enfermedad maligna, el tiempo prolongado de la cirugía, la radioterapia preoperatoria y la pérdida de sangre perioperatoria o la necesidad de transfusiones. Las manifestaciones clínicas pueden ser variadas, como la presencia de dolor o distensión abdominal, la leucocitosis, la presencia de pus, meteorismo, debito fecal a través de los drenajes o de la incisión quirúrgica y, en los casos más graves, peritonitis y sepsis con falla multiorgánica. El diagnóstico precoz es fundamental y el tratamiento oportuno dependerá de su repercusión clínica. De manera inusual no requieren de una intervención terapéutica activa, pero pueden retrasar el cierre de la ostomía de protección. La mayoría de los pacientes necesitarán tratamiento con antibióticos, drenaje percutáneo o endoscópico y, en los casos con peritonitis y síndrome de respuesta inflamatoria sistémica, una intervención quirúrgica. La terapia de vacío endoluminal es una técnica endoscópica, mínimamente invasiva, que permite el drenaje y la obliteración de los espacios peri-anastomóticos con una tasa de éxito que varía del 75 al 97%, dependiendo de la precocidad del diagnóstico. Se describe el caso de una paciente de 76 años, con antecedentes de obesidad y un adenocarcinoma de recto, a la que se le realizó una anastomosis colorrectal baja y confección de ileostomía de protección, que evolucionó con una fuga anastomótica sintomática que fue exitosamente tratada con una terapia endoscópica de vacío.
Palabras claves. Dehiscencia, terapia de vacío endoluminal, anastomosis, cáncer de recto.
Fistula Resolution and Preservation of the Lower Colorectal Anastomosis with VAC System
Summary
Colorectal anastomotic dehiscence is a serious post-surgical complication that significantly increases morbidity, mortality, length of hospital stay, and medical care costs. Its frequency ranges from 4 to 26%. Risk factors include advanced age, malignancy, prolonged surgical time, preoperative radiation therapy, and perioperative blood loss or transfusion requirements. Clinical manifestations can be varied, including the presence of abdominal pain or distension, leukocytosis, presence of pus, meteorism, fecal leakage through drains or the surgical incision, and in the most severe cases, peritonitis and sepsis with multi-organ failure. Early diagnosis is essential and timely treatment will depend on its clinical repercussions. Rarely, they do not require active therapeutic intervention, but may delay ostomy closure. Most patients require antibiotic treatment, percutaneous or endoscopic drainage, and, in cases of peritonitis and systemic inflammatory response syndrome, surgical intervention. Endoluminal vacuum therapy is a minimally invasive endoscopic technique that allows drainage and obliteration of the peri-anastomotic spaces with a success rate that varies from 75 to 97%, depending on early diagnosis. We describe the case of a 76-year-old female patient with a history of obesity and adenocarcinoma of the rectum who underwent a low colorectal anastomosis and creation of a protective ileostomy, which evolved with a symptomatic anastomotic leak that was successfully treated with endoscopic vacuum therapy.
Keywords. Dehiscence, endoluminal vacuum therapy, anastomosis, rectal cancer.
Abreviaturas
VAC: Terapia de vacío endoluminal.
TAC: Tomografía axial computada.
RMN: Resonancia nuclear magnética.
Introducción
La fuga o fístula anastomótica es una complicación potencialmente grave que puede ocurrir en 4 a 26% de las anastomosis colorrectales. Se relaciona con una mayor morbilidad y mortalidad (6-22%) y ostomas permanentes (56%); también se la ha vinculado a un peor pronóstico oncológico.1 Entre los factores de riesgo se destacan: el sexo masculino, score de ASA mayor a 2, antecedente de radioterapia, corta distancia del tumor al margen anal, experiencia del cirujano, obesidad, alcoholismo, desnutrición, uso de antiinflamatorios no esteroideos, cirugía de larga duración, tipo de sutura, anemia y transfusiones.2
La fístula puede sospecharse por la presencia de signos y síntomas clínicos, como dolor abdominal, distensión, leucocitosis, aumento de la proteína C reactiva, fiebre, peritonitis, eliminación de pus, gases o heces por los drenajes o por la incisión quirúrgica. El diagnostico puede ser semiológico, por imágenes con contraste (TAC, RMN, colon por enema), por vía endoscópica o quirúrgica.3 El diagnóstico temprano es fundamental para minimizar las complicaciones. No existe un algoritmo de tratamiento universalmente aceptado y debe individualizarse en función del estado general del paciente. Las opciones de tratamiento incluyen el drenaje percutáneo, una nueva cirugía con desmantelamiento de la anastomosis y la confección de ostomías. En los pacientes estables o con un defecto pequeño, hay una tendencia al manejo conservador, posponiendo la opción quirúrgica.4
La terapia de cierre asistida por vacío o VAC (vacuum assisted closure therapy system) tiene el beneficio de ser un enfoque mini-invasivo, asegurando un drenaje continuo, promoviendo la granulación y la reducción mecánica del tamaño de la cavidad. Se ha informado que el tratamiento endoscópico se asocia con mejores resultados, incluida la preservación más frecuente de la anastomosis.5
Caso clínico
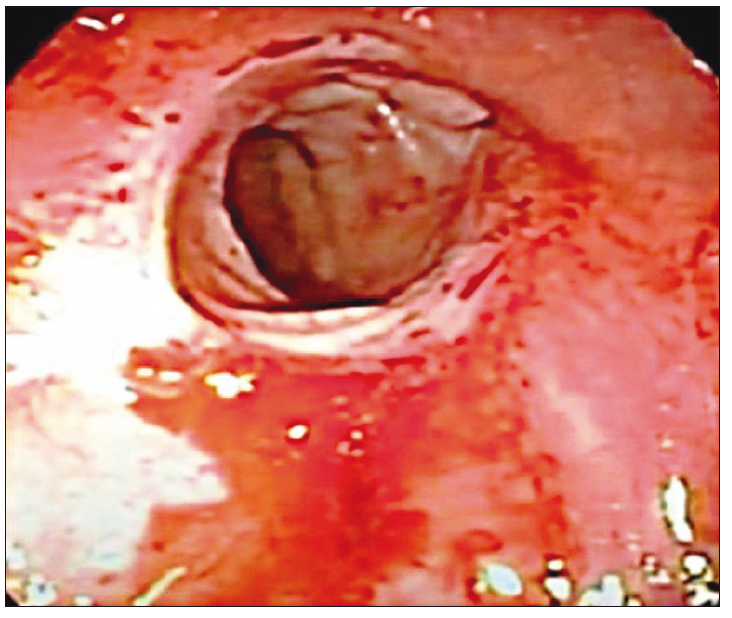
Se presenta el caso de una mujer de 76 años con antecedentes de obesidad y un adenocarcinoma de recto (T2N1M0) por el que se realizó neoadyuvancia con quimioradioterapia (4500cGy) y posteriormente resección anterior del recto por una remisión incompleta, con colorrecto anastomosis baja (6 cm del margen anal) y confección de ileostomía de protección. Luego del alta, al decimoquinto día postoperatorio la paciente refirió dolor abdominal y salida de secreción purulenta y fétida por el ano, por lo que se decidió volver a internarla. En el laboratorio se observó la presencia de anemia normocítica-normocrómica (Hb 10,3 g/dl), sin leucocitosis, plaquetas de 287.000 10^3/uL, tiempo de protrombina de 100%, INR 0,99, con valores de velocidad de eritrosedimentación y proteína C reactiva normales. En la TAC de abdomen y pelvis se observó un aumento de la densidad de la grasa mesentérica a nivel de la región del flanco izquierdo y adyacente al colon descendente, huellas quirúrgicas y, a nivel rectal, una imagen con nivel hidroaéreo contigua a la anastomosis (Figura 1A). La videorectosigmoidoscopía confirmó la presencia de una anastomosis permeable con una dehiscencia del 50% de la circunferencia y una longitud en su eje mayor de 80 mm (Figura 2). Se consideraron diferentes posibilidades terapéuticas, incluyendo el desmantelamiento de la anastomosis, el drenaje transanal con tubo anastomótico, el drenaje percutáneo y los procedimientos endoscópicos avanzados como la colocación de stents, clips o la terapia endoluminal asistida por vacío. Priorizando la preservación de la anastomosis, dado que la paciente no presentaba peritonitis, sepsis o falla multiorgánica, se optó por un tratamiento mínimamente invasivo tipo VAC, tras evaluar los costos, riesgos, beneficios y comorbilidades de la paciente. Por vía endoscópica, se colocó en la cavidad posterior a la dehiscencia un catéter con una esponja de poliuretano en su extremo, conectado a sistema de aspiración negativa continua a 150 mm Hg (Figura 3). Se realizaron sesiones de lavado y de recambio del drenaje y esponja cada 72 horas, requiriendo 3 recambios hasta obtener la obliteración de la cavidad con tejido de granulación. Al realizar el control tomográfico se observó la obliteración de la cavidad presacra, la esponja colocada y el catéter de succión (Figura 1B). Luego de ese último recambio se retiró de manera definitiva el sistema VAC (Figura 4). La paciente presentó una adecuada recuperación y se le otorgó el alta hospitalaria a las 48 horas de haber retirado el sistema VAC. A los tres meses se realizó un control endoscópico en el que se observó la permeabilidad de la anastomosis y la resolución completa de la dehiscencia (Figura 5) y a posteriori se realizó el cierre de la ileostomía de protección.
Figura 1A. Tomografía previa al tratamiento: colección pélvica retroanastomótica presacra proximal a la anastomosis de 7 cm de diámetro con un nivel hidroaéreo (flecha roja). 1B. Tomografía al momento de finalizar el tratamiento: obliteración de la cavidad presacra, esponja colocada y el catéter de succión (flecha amarilla)
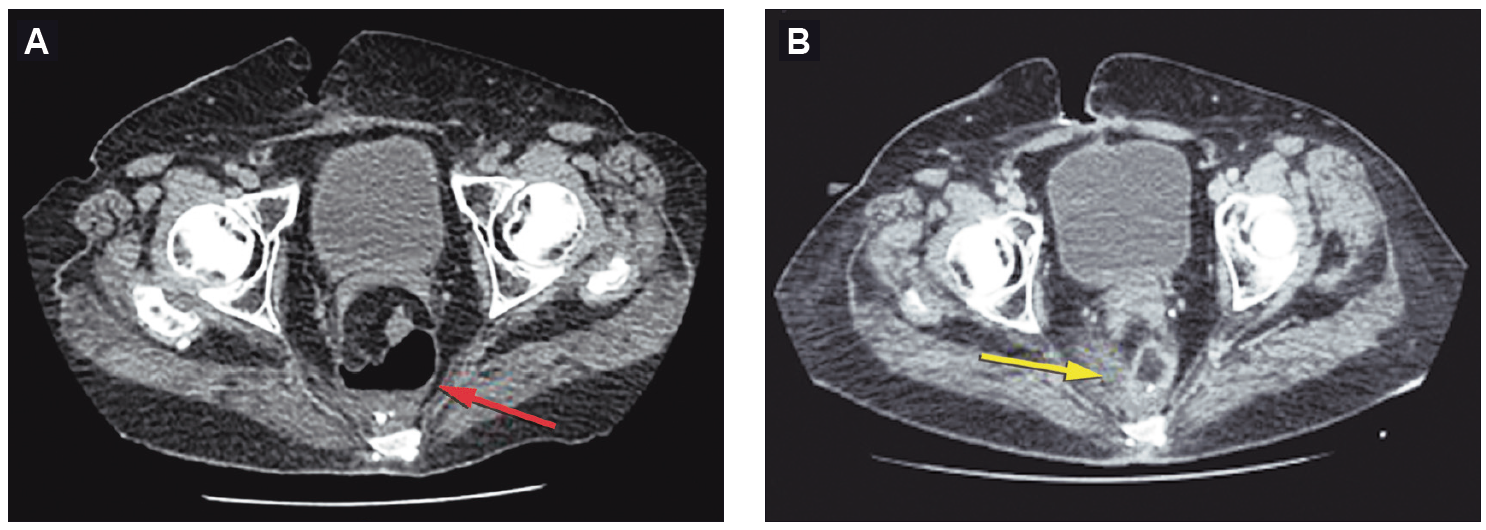
Figura 2. Videorectosigmoidoscopia: cavidad de la dehiscencia (flecha amarilla)
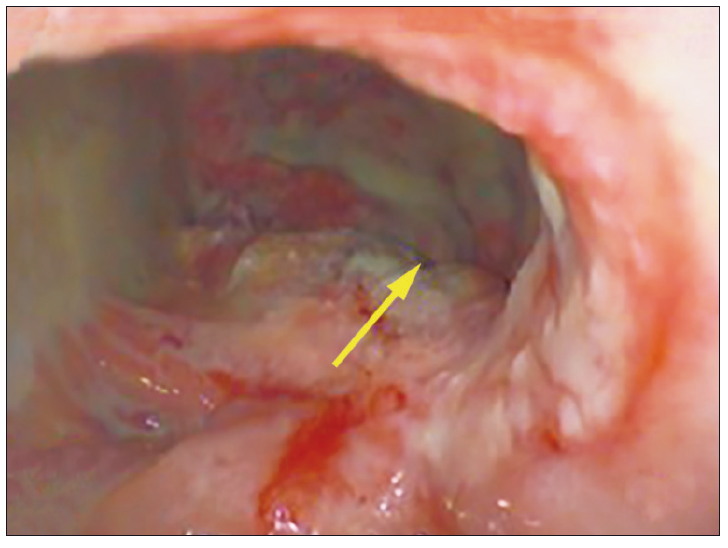
Figura 3. Reducción mecánica del tamaño de la cavidad, presencia de esponja de poliuretano conectada a sonda con succión continua (flecha roja)
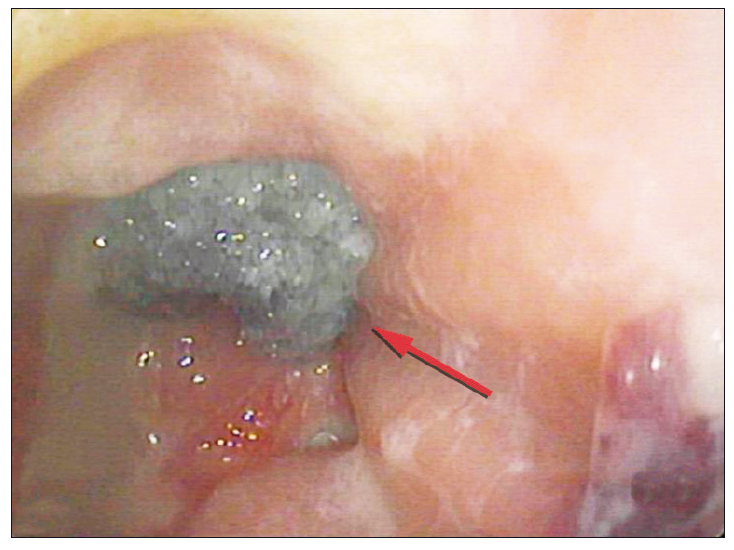
Figura 4. Reducción de la cavidad de la dehiscencia, presencia de tejido fibrinoide de granulación (flecha azul)
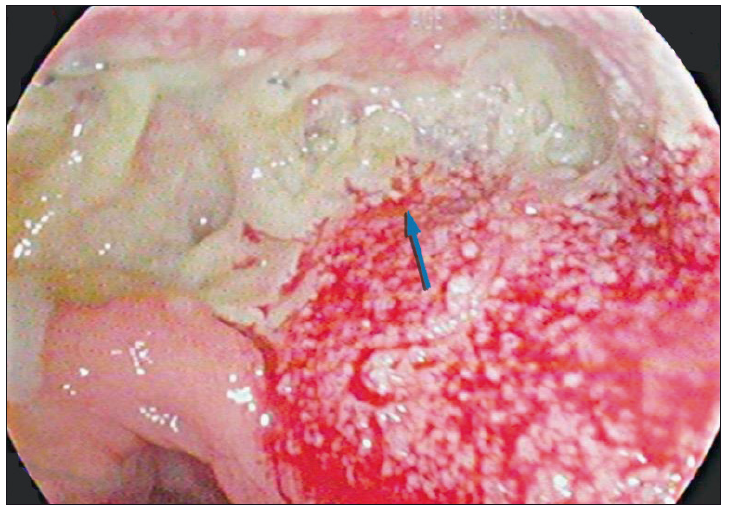
Figura 5. Control endoscópico alejado con anastomosis permeable y ausencia de secuelas
Discusión
En los últimos años hubo un cambio de paradigma en el manejo de la fuga anastomótica y al tratamiento quirúrgico inicial, incorporándose terapéuticas menos invasivas. Las opciones de tratamiento pueden incluir drenaje transanal, drenaje percutáneo o procedimientos endoscópicos desarrollados recientemente, incluida la colocación de stents, clips o VAC. Las ventajas del VAC es que provee un abordaje mini-invasivo y de drenaje continuo.4
El International Study Group of Rectal Cancer propone una clasificación de las dehiscencias en tres tipos según su gravedad. El tipo A consiste en una fuga de contraste por imágenes, sin repercusión clínica ni de laboratorio. En el tipo B se registran síntomas clínicos como dolor abdominal, fiebre, leucocitosis y las imágenes pueden mostrar alguna colección que requiera drenaje y tratamiento antibiótico. El tipo C presenta un cuadro clínico avanzado, con peritonitis/sepsis. En este último caso el tratamiento indicado es la cirugía.6
La terapia VAC es un procedimiento relativamente nuevo, cuyas indicaciones, seguimiento y definición de éxito aún no están estandarizados. Está indicado en filtraciones de anastomosis colorrectales sintomáticas, sin peritonitis ni sepsis, por ejemplo, en las fístulas de tipo B, en las filtraciones con colecciones perianastomóticas y en los pacientes con senos anastomóticos en los que no hay compromiso séptico peritoneal. El objetivo de este procedimiento es obliterar la cavidad y por lo tanto la fistula, con resolución de la sepsis y sin que sea necesario desmantelar la anastomosis.
Técnicamente se realiza introduciendo endoscópicamente un catéter con una esponja de poliuretano de poro abierto en su extremo, preferentemente en la cavidad de la fuga; se mantiene una aspiración continua asistida con una bomba de presión negativa (125 a 150 mm Hg), con recambios del drenaje y lavados de la cavidad periódicos.7 Esta técnica permite la eliminación de secreciones, la reducción del edema, el aumento de la perfusión sanguínea local, la reducción de la colonización bacteriana y la estimulación del crecimiento del tejido de granulación, reduciendo así el tamaño de la cavidad. Es fundamental el comienzo temprano del tratamiento para obtener una respuesta adecuada. El recambio se realiza cada 72 hs. aproximadamente durante 4 a 6 semanas. El tiempo medio de cierre es de 45 días, con una tasa de éxito del 60 al 100%. La terapia de VAC se puede aplicar en casos seleccionados de fistulas con compromiso séptico moderado y colecciones limitadas a pelvis.8
Los estudios comparativos entre la terapia VAC y el tratamiento quirúrgico muestran resultados a favor del primero con cierre precoz, menor tiempo de estadía hospitalaria y costo.9 La principal ventaja que ofrece el sistema VAC es la posibilidad de preservar la anastomosis.
Conclusión
La fuga anastomótica es una complicación grave de la cirugía del tubo digestivo y representa un desafío terapéutico. Entre los recursos mínimamente invasivos la terapia asistida por vacío endoluminal (VAC) resulta prometedora por su alta tasa de éxito, menos complicaciones, rápida recuperación y posibilidad de preservación de la anastomosis.
Consentimiento para la publicación. Para la confección de este manuscrito, se utilizaron datos anonimizados que no han distorsionado su significado científico.
Propiedad intelectual. Los autores declaran que los datos y las figuras presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflictos de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2024 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Mariño Camacho G A, Moreira Grecco A, Wonaga A, y col. Resolución de fístula y preservación de anastomosis colorrectal baja con el sistema VAC. Acta Gastroenterol Latinoam. 2024;54(3):273-277. https://doi.org/10.52787/agl.v54i3.387
Referencias
- Chiarello, M., Bianchi, V., Fransvea, P., & Brisinda, G. (28 de Julio de 2022). Endoluminal vacuum-assisted therapy as a treatment for anastomotic leakage in colorectal surgery. World J Gastroenterol, 28 (28), 3747-3752. DOI:10.3748/wjg.v28.i28.3747
- Daams, F., Luyer, M., & Lange, J. (21 de Abril de 2013). Colorectal anastomotic leakage: Aspects of prevention, detection and treatment. World J Gastroenterol, 19 (15), 2293-2297. DOI:10.3748/wjg.v19.i15.2293
- Fuentes, C., Córdoba Guzmán, A., Daza Castro, E., Aponte, D., González, C., & Sabbagh, L. (2023). Terapia E-VAC como tratamiento de complicaciones en cirugía gastrointestinal en centro de referencia de gastroenterología en Colombia: Serie de casos. Rev Gastroenterol Perú, 43 (2), 110-5. DOI:10.47892/rgp.2023.432.1472
- Lim, M., Akhtar, S., Sasapu, K., Harris, K., Burke, D., Sagar, P., & Finan, P. (Octubre de 2006). Clinical and Subclinical Leaks After Low colorectal anastomosis: a clinical and radiologic study. Dis Colon Rectum, 49 (10), 1611-9. DOI:10.1007/s10350-006-0663-6
- Nagell, C., & Holte, K. (Octubre de 2006). Treatment of anastomotic leakage after rectal resection with transrectal vacuum-assisted drainage (VAC). A method for rapid control of pelvic sepsis and healing. Int J Colorectal Dis, 21 (7), 657-660. DOI:10.1007/s00384-005-0083-4
- Rahbari, N., Weitz, J., Hohenberger , W., Heald, R., Moran, B., Ulrich, A., Büchler, M. (Marzo de 2010). Definition and grading of anastomotic leakage following anterior resection of the rectum: a proposal by the International Study Group of Rectal Cancer. Surgery, 147 (3), 339-51. DOI:10.1016/j.surg.2009.10.012
- Riss, S., Stift, A., Kienbacher, C., Dauser, B., Haunold, I., Kriwanek, S., Bergmann, M. (Septiembre de 2010). Recurrent abscess after primary successful endo-sponge treatment of anastomotic leakage following rectal surgery. World J Gastroenterol, 16 (36), 4570-4574. DOI:10.3748/wjg.v16.i36.4570
- Vignali, A., & De Nardi, P. (14 de Abril de 2022). Endoluminal vacuum-assisted therapy to treat rectal anastomotic leakage: A critical analysis. World J Gastroenterol, 28 (14), 1394-1404. DOI:10.3748/wjg.v28.i14.1394
- Zarnescu, E., Zarnescu, N., & Costea, R. (17 de Diciembre de 2021). Updates of Risk Factors for Anastomotic Leakage after Colorectal Surgery. diagnostics, 11 (12), 2382. DOI:10.3390/diagnostics11122382
Correspondencia: Gabriel Adrián Mariño Camacho
Correo electrónico: gabrielmarcamacho@gmail.com
Acta Gastroenterol Latinoam 2024;54(3):273-277
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE


