Carolina Aristizábal-Henao,1 Laura Torres-Canchala,2 Eliana Manzi,2 Verónica Botero-Osorio3
1 Facultad de Ciencias de la Salud, Universidad Icesi.
2 Centro de investigaciones clínicas, Fundación Valle del Lili.
3 Servicio de Gastroenterología y hepatología pediátrica, Fundación Valle del Lili.
Cali, Colombia.
Acta Gastroenterol Latinoam 2021;51(2):165-172
Recibido: 17/05/2021 / Aceptado: 28/05/2021 / Publicado en www.actagastro.org el 21/06/2021 / https://doi.org/10.52787/cigd4784
Resumen
Introducción. La hepatitis autoinmune es una hepatopatía inflamatoria progresiva poco frecuente en niños, caracterizada por inflamación en la histología hepática, la presencia de autoanticuerpos y niveles altos de inmunoglobulina G. Existen pocos datos en niños en algunos estudios realizados en Latinoamérica, y datos limitados en Colombia. El objetivo del estudio es describir las características demográficas, clínicas, paraclínicas y terapéuticas así como los desenlaces de pacientes pediátricos con hepatitis autoinmune en un centro de alta complejidad del suroccidente colombiano. Métodos. Estudio descriptivo de una cohorte de pacientes pediátricos (≤ 18 años) con diagnóstico de hepatitis autoinmune, atendidos en un hospital colombiano de III nivel entre los años 2011 y 2019. El análisis estadístico se realizó utilizando el programa Stata14.0. Resultados. Se incluyeron 40 pacientes, 57,5% de sexo femenino, con una mediana de edad de 10,5 años (RIC 4-13). El 62,5% debutó como hepatitis aguda y el 20% como falla hepática, un 27,5% con cirrosis al momento del diagnóstico, el 75% presentó biopsia hepática compatible y el 82,5% fueron clasificados como hepatitis autoinmune tipo I. Todos recibieron manejo con esteroides más inmunomodulador, presentando remisión bioquímica en el 75% y recaída en el 22,5%. Cuatro de los pacientes requirieron trasplante hepático. Conclusiones. La hepatitis autoinmune es una entidad poco frecuente, aunque no despreciable, en la edad pediátrica en nuestro medio. Se encontró mayor prevalencia de hepatitis autoinmune tipo I, la mayoría debutó con sintomatología de hepatitis aguda y un mayor porcentaje era de sexo femenino. Las características y respuesta clínica, en esta cohorte, son similares a las descritas en las distintas series en la población a nivel mundial.
Palabras claves. Hepatitis, autoinmune, niños, hígado.
Clinical Profile of Paediatric Patients with Autoimmune Hepatitis in a Tertiary Care Center in South-Western Colombia
Summary
Introduction. Autoimmune hepatitis is a progressive inflammatory liver disease that is rare in children, characterized by inflammation in liver histology, the presence of autoantibodies and high levels of immunoglobulin G. There are few data in children and in some studies performed in Latin America, but limited in Colombia. The aim of this study is to describe the demographic, clinical, paraclinical and therapeutic data as well as, the outcome of paediatric patients diagnosed with autoimmune hepatitis in a tertiary care centre in south-western Colombia. Methods. This is a descriptive study of a retrospective cohort of paediatric patients (≤ 18 years) with a diagnosis of autoimmune hepatitis, attended in a third-level hospital in Colombia between 2011 and 2019. Statistical analyses were performed using the program Stata 14.0. Results. A total of 40 patients were included, 57.5% were female, with a median age of 10.5 years (IQR 4-13). The 62.5% presented with acute hepatitis, 20% had liver failure, a 27.5% with cirrhosis at diagnosis; 75% presented compatible liver biopsy, and 82.5% were classified as type 1 autoimmune hepatitis. All patients received a steroid plus immunomodulator; presenting biochemical remission in 75% relapse in the 22.5%. Four of the patients required liver transplantation. Conclusions. Autoimmune hepatitis is an infrequent entity, although not negligible, in children in our environment. A higher prevalence of type I autoimmune hepatitis was found. Most patients were female and presented with symptoms of acute hepatitis at the initial diagnosis. The characteristics and clinical responses, in this cohort, are similar to those described in different series in the world population.
Keywords. Autoimmune hepatitis, children, liver.
Abreviaturas
HAI: Hepatitis autoinmune.
RIC: Rango intercuartílico.
CIE-10: Código internacional de enfermedades.
GIHAI: Grupo internacional de hepatitis autoinmune.
ANA: Anticuerpos antinucleares.
SMA: Anticuerpos antimúsculo liso.
LKM-1: Anticuerpos microsomales de hígado y riñón.
ALT: Alanino aminotransferasa.
AST: Aspartato aminotransferasa.
HLA: Antígeno leucocitario humano.
Introducción
La hepatitis autoinmune (HAI) fue descrita en 1950.1 Es una hepatopatía inflamatoria progresiva que se caracteriza por la presencia de inflamación con infiltrado linfoplasmocitario y hepatitis de interfase en la histología hepática, asociada a la circulación de autoanticuerpos y niveles altos de inmunoglobulina G.2 Esta entidad es poco frecuente en niños.1
Se clasifica en hepatitis autoinmune tipo I y tipo II, que se diferencian por la presencia de ciertos autoanticuerpos (anticuerpos antinucleares y antimúsculo liso en la tipo I, y anticuerpos microsomales de hígado y riñón en la tipo II).3 Hay un tercer grupo de pacientes que se caracteriza, además, por el compromiso de la vía biliar, conocido como colangitis esclerosante autoinmune (antes llamado síndrome overlap), y un último grupo definido recientemente, en la década de 1990, que corresponde a la hepatitis autoinmune de novo, descrita en pacientes con antecedente de trasplante hepático, en quienes la indicación fue debido a otra patología diferente.4, 5
Las manifestaciones clínicas son muy variables. Los pacientes pueden tener un curso clínico agresivo y debutar con falla hepática fulminante, principalmente en la HAI tipo II, o bien presentar síntomas inespecíficos hasta debutar con hipertensión portal y cirrosis.6 El diagnóstico temprano e inicio precoz del manejo inmunosupresor son fundamentales para la remisión, ya que, si es tratada de forma adecuada, se evita la progresión de la enfermedad y se previene el desarrollo de complicaciones.7
El diagnóstico de HAI es poco común en los niños, pero se asocia con una alta morbilidad y mortalidad. Las variaciones de raza y etnia han influido en la presentación clínica de la HAI.8 En la mayoría de los estudios de HAI en niños, la población es principalmente caucásica.9 En un estudio reciente de HAI se mostró un mayor riesgo de trasplante temprano y recurrencia postrasplante en pacientes pediátricos afroamericanos.10 La población colombiana desciende principalmente de tres grupos raciales (amerindios, europeos y africanos), lo que da lugar a una considerable diversidad genética.11 Se han realizado estudios previos de HAI en México, Brasil y Argentina, que muestran resultados similares a reportes internacionales anteriores, evidenciando una mayor prevalencia de HAI tipo I y predominio en el sexo femenino.12-15 Sin embargo, son limitados los datos sobre la HAI en niños en Colombia.16 La mayor parte de los resultados obtenidos provienen de población adulta o de los pocos estudios en población pediátrica de otros países, pero no se sabe aún si estos hallazgos son equiparables a los de nuestra población. Por lo tanto, el objetivo del presente estudio es describir las características demográficas, clínicas, paraclínicas y terapéuticas así como los desenlaces de pacientes pediátricos diagnosticados con HAI en un centro de alta complejidad del suroccidente colombiano.
Pacientes y métodos
Diseño del estudio, criterios de inclusión y recolección de datos
Cali es la tercera ciudad más grande de Colombia y cuenta con aproximadamente 2,22 millones de habitantes.8 La Fundación Valle del Lili es un hospital de tercer nivel, que se encuentra afiliado a la escuela de Medicina de la universidad Icesi, y funciona como uno de los centros de referencia del suroccidente colombiano, con una cobertura aproximada de diez millones de personas. Cuenta con un servicio de hepatología pediátrica que atiende alrededor de cuatrocientos pacientes con diagnósticos de patología hepática por año. Este estudio corresponde a una investigación sin riesgo y fue realizado bajo los lineamientos de la Declaración de Helsinki, y aprobado por el Comité de Ética de la institución.
Se trata de un estudio descriptivo de una cohorte de pacientes existente en el registro electrónico de historias clínicas. Se incluyeron pacientes de 18 años o menores con diagnóstico de HAI validado por los criterios simplificados para el diagnóstico de HAI del grupo internacional de HAI (GIHAI) (Tabla 1), atendidos en el servicio de consulta externa, urgencias y hospitalización. Se excluyeron los pacientes con uso de drogas intravenosas o transfusión previa al diagnóstico, los que tuvieran menos de dos visitas de seguimiento clínico y aquellos pacientes con datos clínicos, bioquímicos e histológicos incompletos. La recolección de la información se realizó mediante la búsqueda, en el sistema de historia clínica electrónica del hospital, de los pacientes pediátricos con diagnóstico correspondiente al código, según la clasificación internacional de enfermedades CIE-10 K754 para hepatitis autoinmune. Se hizo el seguimiento de los pacientes hasta su última visita en la institución.
Tabla 1. Criterios simplificados para el diagnóstico de HAI del grupo internacional de HAI (GIHAI)
Características clínicas y diagnóstico
Se recolectaron variables demográficas, clínicas, paraclínicas, histológicas y antecedentes clínicos. Se estableció el tipo de presentación, al momento del diagnóstico, clasificándolos en asintomáticos (definido como pacientes con alteración de pruebas de función hepática sin sintomatología asociada), hepatitis aguda (pacientes con síntomas sugestivos tales como fiebre, ictericia, náuseas, dolor abdominal y un patrón de daño hepatocelular en paraclínicos), falla hepática aguda (pacientes con síntomas de hepatitis aguda asociada a coagulopatía o desarrollo de encefalopatía) y hemorragia (para los pacientes que debutaron con sangrado digestivo).1, 3
Se incluyó, además, el resultado de la biopsia hepática, clasificado en no compatible, compatible o típica, según características histológicas y criterios de GIHAI, analizada por patólogo clínico.
Se realizó la clasificación del tipo de HAI en tipo I si presentaba positividad de anticuerpos antinucleares (ANA) y/o anticuerpos antimúsculo liso (SMA), tipo II si había positividad de anticuerpos microsomales de hígado y riñón (LKM-1) y seronegativa en ausencia de anticuerpos.1-3 Además, se determinaron niveles de inmunoglobulina G y se incluyeron niveles de transaminasas y pruebas de función hepática, al momento del diagnóstico y del último seguimiento de cada paciente.
Tratamiento y desenlaces clínicos
En relación con el tratamiento, se identificó el manejo recibido en cada paciente, y se los clasificó en uso de solo esteroides, esteroides más inmunomodulador o solo inmunomodulador. También, se incluyeron pacientes que requirieron trasplante hepático como parte del tratamiento.
Se definió como remisión bioquímica a la reducción de los niveles de transaminasas en sangre a niveles normales para la edad, y remisión parcial al descenso de niveles de transaminasas, pero sin llegar a niveles normales. Se consideró no respuesta al tratamiento en aquellos pacientes que no lograban disminuir, por lo menos, un 25% los niveles de transaminasas.1, 3 Se describieron, además, los eventos adversos relacionados con el tratamiento instaurado.
Se catalogó como complicaciones la aparición de cirrosis, hipertensión portal más várices esofágicas y hemorragia digestiva. Asimismo, se identificaron pacientes que presentaban recaída, la cual se definió como la elevación de transaminasas más de tres veces el límite superior de normalidad después de haber logrado remisión con el tratamiento.1, 3
Análisis estadístico
Se realizó un análisis exploratorio de los datos para verificar y corregir los datos extremos y datos faltantes. Una vez asegurada la calidad y total digitación de la base de datos, se realizó un análisis univariado para determinar el comportamiento de las variables numéricas. La normalidad de las variables se determinó a través de una prueba de Shapiro Wilk; aquellas con una p > 0,05 se consideraron con distribución normal y se presentaban con promedios y desviación estándar, y aquellas que no eran normales presentaban con medianas y rangos intercuartílicos.
Resultados
Entre el 1° de enero de 2011 y el 31 de diciembre de 2019, se atendieron sesenta pacientes con diagnóstico de hepatitis autoinmune. De ellos, veinte cumplían con los criterios de exclusión y se realizó el análisis a los cuarenta restantes. En la Figura 1, se describe el proceso de selección.
Figura 1. Diagrama de selección de pacientes con hepatitis autoinmune
En la Tabla 2, se describen las características clínicas y de diagnóstico de pacientes con HAI. La mediana de edad al diagnóstico fue de 10,5 años (rango intercuartílico [RIC] 4-13), veintitrés pacientes (57,5%) eran de sexo femenino, siete pacientes (17,5%) tenían como antecedente otra enfermedad autoinmune, dentro de las cuales se encontró tiroiditis en dos pacientes y, en los cinco restantes, se encontró lupus eritematoso sistémico (n = 1), diabetes mellitus tipo I (n = 1), colitis ulcerativa (n = 1), artritis reumatoide juvenil (n = 1) y nefropatía por IgA (n = 1). La mediana de seguimiento fue de 30,1 meses (RIC 11,7-55,3).
Tabla 2. Características clínicas, paraclínicas y de diagnóstico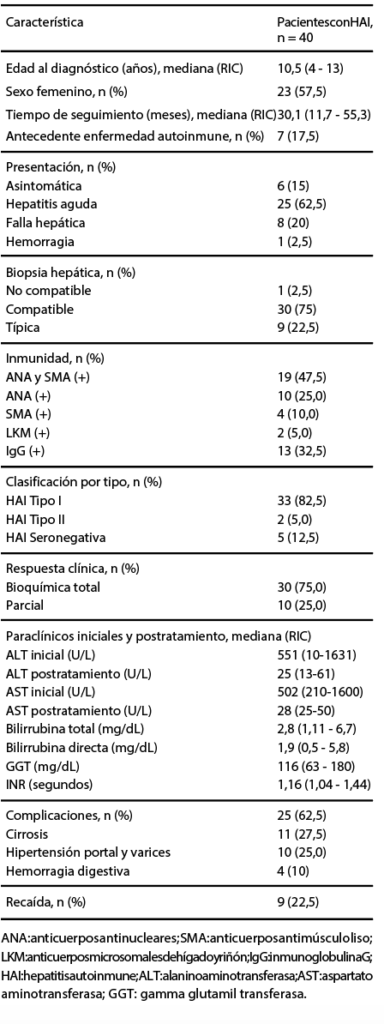 Características clínicas y diagnóstico
Características clínicas y diagnóstico
Veinticinco pacientes (62,5%) debutaron con hepatitis aguda y ocho pacientes (20%) con falla hepática, seis pacientes (15%) fueron asintomáticos y fueron detectados, en su mayoría, por pruebas de función hepática realizadas de rutina. Un paciente, en esta cohorte, debutó con sangrado digestivo superior secundario a varices esofágicas por hipertensión portal. A todos los pacientes se les realizó biopsia hepática: treinta (75%) tuvieron hallazgos histológicos de HAI compatible, y nueve (22,5%) HAI típica. Un paciente no tuvo hallazgos histológicos compatibles con HAI, pero fue manejado bajo este diagnóstico por hallazgos clínicos y analíticos, cumpliendo con los criterios GIHAI.
Treinta y cinco pacientes (87,5%) presentaron anticuerpos positivos, donde diez pacientes (25%) tenían ANAS positivos, cuatro pacientes (10%) SMA positivos y diecinueve pacientes (47,5%) presentaron positividad tanto de ANAS como de SMA. Solo dos pacientes (5%) tenían LKM-1 positivos, lo que se correlaciona con el tipo de presentación de HAI. Treinta y tres pacientes (82,5%) se clasificaron como HAI tipo I, cinco pacientes (12,5%) correspondían a HAI seronegativa, y dos pacientes (5%) a HAI tipo II (Tabla 2).
La mediana de alanino aminotransferasa (ALT) inicial fue de 551 U/L (RIC 10-1631), y postratamiento de 25 U/L (RIC 13-61). Para el aspartato aminotransferasa (AST), la mediana inicial fue de 502 U/L (RIC 210-1600) y postratamiento de 28 U/L (RIC 25-50), encontrando una mayor diferencia en los pacientes que presentaron remisión bioquímica en relación con los pacientes con remisión parcial. Estos resultados se encuentran en la Figura 2.
Figura 2. Niveles de AST y ALT iniciales y postratamiento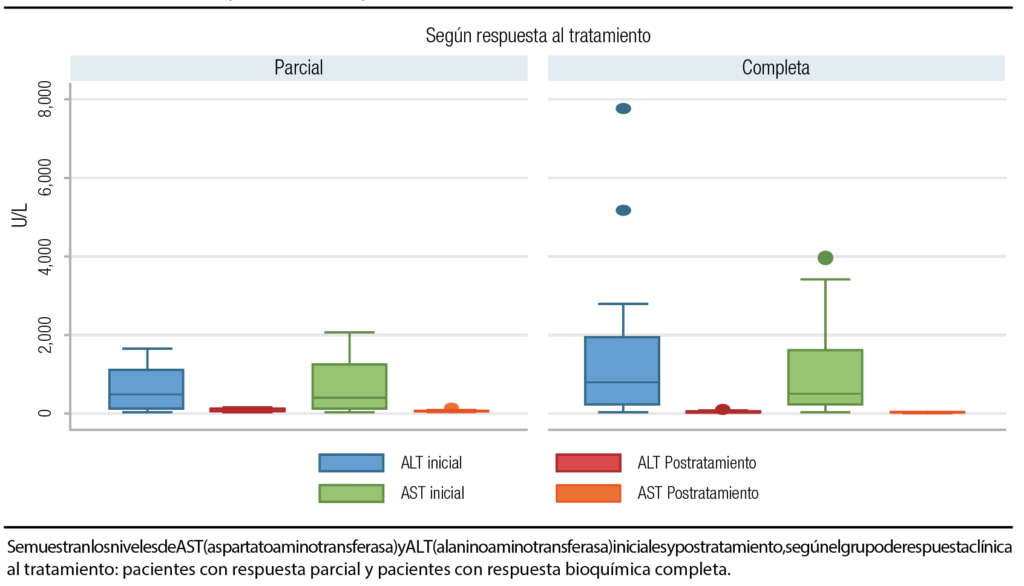
Tratamiento y desenlaces clínicos
Al momento del diagnóstico, todos los pacientes recibieron manejo con esteroides (prednisolona) más inmunomodulador, treinta y seis pacientes (90%) fueron tratados con azatriopina, y los cuatro restantes (10%) con micofenolato mofetil (dos pacientes debido a la presencia de aplasia medular concomitante al momento del diagnóstico y los otros dos por falla hepática fulminante, que requirió trasplante hepático en la primera semana).
Treinta pacientes (75%) alcanzaron remisión bioquímica total y diez pacientes (25%) llegaron a remisión parcial. Nueve pacientes (22,55%) presentaron recaída de la enfermedad: tres fueron por abandono del tratamiento, dos ocurrieron posterior a la disminución de la dosis inmunosupresora, en uno se documentó infección por virus de Ebstein Barr, y en los tres restantes no se logró determinar claramente la causa de recaída.
Tanto en los pacientes que abandonaron el tratamiento como en aquellos en los que había disminuido la dosis inmunosupresora, se inició el mismo esquema que tenían previamente, logrando así una adecuada respuesta, a excepción de un paciente del grupo de abandono del tratamiento (que venía en manejo con azatriopina + prednisolona), quien requirió cambio a segunda línea de tratamiento con micofenolato mofetil + prednisolona. En el resto de los pacientes, se ajustó la inmunosupresión, con mejoría clínica.
Entre los pacientes que recibían manejo inmunomodulador con azatriopina, se evidenciaron efectos adversos en ocho pacientes (20%); de los cuales seis presentaron citopenias (leucopenia, anemia y trombocitopenia), uno dolor abdominal y vómito, y el restante presentó alopecia. En todos ellos, se cambió el esquema a micofenolato mofetil.
Cuatro pacientes (10%) requirieron trasplante hepático, todos con diagnóstico de HAI tipo I, dos de los pacientes debutaron con falla hepática fulminante requiriendo trasplante inicial, los otros dos requirieron trasplante a los 9 meses y 4 años posteriores al diagnóstico, debido a hipertensión portal refractaria al manejo endoscópico. De los pacientes trasplantados hubo disfunción del injerto en tres de ellos, a los 7, 8 y 36 meses postrasplante, respectivamente. Solo en uno de ellos hubo recurrencia de la enfermedad, que se manejó ajustando la inmunosupresión. Otros dos pacientes se encuentran, en el momento, en protocolo de trasplante, ambos también con diagnóstico de HAI tipo I y complicaciones secundarias de cirrosis e hipertensión portal.
Dentro de las complicaciones presentadas en esta cohorte de pacientes, se documentó cirrosis en once pacientes (27,5%), hipertensión portal y várices esofágicas en diez pacientes (25%), y de estos, cuatro presentaron episodios de sangrado digestivo. Ninguno de nuestros pacientes falleció.
Discusión
La HAI es una entidad poco frecuente en la edad pediátrica, aunque no despreciable en nuestro medio. Son pocos los datos epidemiológicos que tenemos sobre esta población y muchos de los conocimientos que se tienen son derivados de estudios en adultos. Este estudio se presenta como una de las primeras cohortes de pacientes pediátricos con HAI publicado en Colombia.
Se evidenció un predominio de HAI tipo I (82,5%), al igual que una mayor prevalencia en el sexo femenino (57,5%). Estos hallazgos son similares a lo reportado en diferentes publicaciones a nivel mundial. Costaguta et al. describen una serie de pacientes pediátricos en la Argentina donde el 90% se presenta como HAI tipo I, con mayor prevalencia en mujeres.9 Esto coincide con los hallazgos encontrados por Porta et al. en la mayor cohorte de pacientes reportada en Brasil (y también para toda Latinoamérica), con una muestra de 828 pacientes, donde el 89,6% se clasificaron como HAI tipo I y fue predominante en el sexo femenino.10 Vale la pena destacar que estos hallazgos no son solo equiparables a los datos presentados en cohortes latinoamericanas, sino que también coinciden con lo reportado en la literatura mundial, como se evidencia en la serie más grande de pacientes asiáticos con HAI descrita por Lee Way et al., donde un 59% de los pacientes correspondían al sexo femenino y la mayoría se presentaron como HAI tipo I, en un 56%.11 Sin embargo, dicho porcentaje es significativamente menor que los descritos anteriormente.
La literatura reporta un predominio de HAI en la población de raza blanca y origen caucásico, pero es claro que hay afectación de pacientes de raza mestiza, la cual predomina en Colombia y el resto de Latinoamérica. Se han reportado diferentes polimorfismos del antígeno leucocitario humano (HLA), en el que se identifican el HLA DQ2 y DR52 como factores de riesgo para el desarrollo de HAI en población latinoamericana y HLA DR3 y DQ2 en población europea y asiática.12 Asimismo, se ha determinado que la presencia de estos polimorfismos determina en parte la presentación clínica y el comportamiento, explicando así la variabilidad entre los pacientes.13 Sería importante contar con estos estudios en nuestra población y poder comparar estos hallazgos.
La HAI tiene un espectro amplio de presentación, que va desde el paciente asintomático hasta el que debuta con falla hepática fulminante.6 En nuestro estudio, el 62,5% de los pacientes se presentaron con síntomas de hepatitis aguda, hallazgo que concuerda con lo descrito por la literatura a nivel mundial.9, 11, 14
Se describió asociación con otras enfermedades autoinmunes, como lupus eritematoso sistémico, tiroiditis, diabetes mellitus tipo 1 y colitis ulcerativa, las cuales fueron también descritas por Porta et al.10 y Costaguta et al.9 En nuestra cohorte, se evidenciaron otras entidades asociadas, como artritis reumatoide juvenil y nefropatía por IgA.
El tratamiento suministrado a todos los pacientes sigue el lineamiento de las guías internacionales de HAI.1, 7 Un 10% de los pacientes requirió trasplante hepático, lo cual es concordante con lo descrito en la literatura.21, 22 En la mayoría de los pacientes (75%), se alcanzó remisión bioquímica total, cifra muy similar a lo encontrado en la cohorte más grande de pacientes con HAI en Brasil, donde presentaron remisión bioquímica un 76,2%.15-17 Se presentó una tasa de recaída del 22,5%, porcentaje mucho menor en relación con lo reportado en la gran mayoría de los estudios.12-23 En nuestra serie, no se presentó mortalidad.
Es claro que un diagnóstico tardío y un retraso en el tratamiento son factores de riesgo para complicaciones y peores desenlaces clínicos en estos pacientes. Influyen, además, factores sociales, que pudieron ser reconocidos en esta cohorte, tales como la mala adherencia al tratamiento, que se identificó como causa clara de recaída, y disfunción del injerto en pacientes trasplantados, lo cual se evidencia también en otros reportes.12, 13, 15
Dentro de las complicaciones descritas, se encontró cirrosis en un 27,5% de los pacientes, dato que concuerda con las series latinoamericanas de la Argentina y Brasil, que describen un 23% y un 22,4%, respectivamente,13, 15 pero difiere de los hallazgos reportados en otros continentes, como lo descrito por Gregorio et al. en Inglaterra y Saadah et al. en Australia, donde se reporta hasta un 69% de prevalencia para cirrosis.23, 24
En esta cohorte, se presentó recaída en un 22,5% de los pacientes, porcentaje menor en relación con lo reportado en la literatura,15, 25 identificándose la falta de adherencia como una de las causas, también descrita previamente.13, 15 Esto debe conducirnos a implementar un mayor acompañamiento y seguimiento de los pacientes en los cuales se identifique algún factor de riesgo para el abandono del tratamiento, o que por su condición social pudiera presentarse. Se encontró también recaída en tres pacientes, en los cuales no se logró identificar una causa clara, atribuyendo una activación como tal de su enfermedad.
Limitaciones y fortalezas
En este estudio se presentan varias limitaciones, y su interpretación debe ser contemplada teniendo en cuenta que se trata de un estudio realizado en un solo centro de referencia de enfermedades hepáticas y que, al tratarse de un estudio retrospectivo, la recolección de datos se limita a los datos existentes en la historia clínica. No obstante, este estudio tiene fortalezas. Es el estudio más grande realizado en el país sobre HAI, lo que permite conocer más a fondo los desenlaces clínicos de estos pacientes a nivel local, por lo que ayuda a tomar decisiones más dirigidas para garantizar mejores resultados. Son necesarios los estudios multicéntricos para evaluar esta patología y obtener resultados extrapolables a otros grupos poblacionales.
Conclusión
La HAI es una entidad poco frecuente en la edad pediátrica, pero no es despreciable en nuestro medio. Se encontró una mayor prevalencia de HAI tipo I, la mayoría de los pacientes debutó con sintomatología de hepatitis aguda y un mayor porcentaje de la población era de sexo femenino. Se evidenció que las características y la respuesta clínica manifestadas, en esta cohorte de pacientes, son similares a las descritas en las distintas series en la población a nivel mundial.
Aviso de derechos de autor © 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
© 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Aristizábal-Henao C, Torres-Canchala L, Manzi E y col. Perfil clínico de pacientes pediátricos con diagnóstico de hepatitis autoinmune en un centro de alta complejidad del suroccidente colombiano. Acta Gastroenterol Latinoam 2021;51(2):165-172. https://doi.org/10.52787/cigd4784
Referencias
- Squires RH. Autoimmune hepatitis in children. Curr Gastroenterol Rep. 2004;6:225-30.
- Heneghan MA, Yeoman AD, Verma S, et al. Autoimmune hepatitis. The Lancet. Elsevier BV. 2013;382:1433-44.
- Mieli-Vergani G, Vergani D, Baumann U, et al. Diagnosis and Management of Pediatric Autoimmune Liver Disease: ESPGHAN Hepatology Committee Position Statement. J Pediatr Gastroenterol Nutr. 2018;66:345-60.
- Roberts EA. Autoimmune hepatitis from the paediatric perspective. Liver Int. 2011;31:1424-31.
- Mieli-Vergani G, Vergani D. Paediatric autoimmune liver disease. Arch Dis Child. 2013;98:1012-7.
- Wang Q, Yang F, Miao Q, et al. The clinical phenotypes of autoimmune hepatitis: A comprehensive review. J Autoimmun. 2016;66:98-107.
- Della Corte C, Sartorelli MR, Sindoni CD, et al. Autoimmune hepatitis in children: An overview of the disease focusing on current therapies. Eur J Gastroenterol Hepatol. 2012;24:739-46.
- Wong RJ, Gish R, Frederick T, et al. The Impact of Race/Ethnicity on the Clinical Epidemiology of Autoimmune Hepatitis. J Clin Gastroenterol. 2012;46:155-61.
- Radhakrishnan KR, Alkhouri N, Worley S, et al. Autoimmune hepatitis in children
- Palle SK, Naik KB, McCracken CE, et al. Racial disparities in presentation and outcomes of paediatric autoimmune hepatitis. Liver Int. 2019;39:976-84.
- Maldonado Gómez H, Sepúlveda CE, Subdirector R, et al. República De Colombia Departamento Administrativo Nacional De Estadística. DANE. 2009:28-38.
- Nares-Cisneros J, Jaramillo-Rodríguez Y. Hepatitis autoinmune en niños: Evolución de 20 casos del norte de México. Rev Gastroenterol Mex. 2014;79:238-43.
- Costaguta A, González A, Pochettino S, et al. Incidence and Clinical Features of Autoimmune Hepatitis in the Province of Santa Fe (Argentina). J Pediatr Gastroenterol Nutr. 2018;67:e107-e110.
- Goldberg AC, Bittencourt PL, Oliveira LC, et al. Autoimmune Hepatitis in Brazil: An Overview. Scand J Immunol. 2007;66:208-16.
- Porta G, Carvalho E de, Santos JL, et al. Autoimmune hepatitis in 828 Brazilian children and adolescents: clinical and laboratory findings, histological profile, treatments, and outcomes. J Pediatr, Rio J. 2019;95:419-27.
- Suárez D, Andrade R, Vera JF, et al. Clinical and histopathological characterization of children with autoimmune hepatitis at a referral center in Bogotá, Colombia. Rev Colomb Gastroenterol. 2019;34:364-9.
- Mileti E, Rosenthal P, Peters MG. Validation and Modification of Simplified Diagnostic Criteria for Autoimmune Hepatitis in Children. Clin Gastroenterol Hepatol. 2012;10:417-21.e2.
- Lee WS, Lum SH, Lim CB, et al. Characteristics and outcome of autoimmune liver disease in Asian children. Hepatol Int. 2015;9:292-302.
- Al-Chalabi T, Underhill JA, Portmann BC, et al. Impact of gender on the long-term outcome and survival of patients with autoimmune hepatitis. J Hepatol. 2008;48:140-7.
- Jossen J, Annunziato R, Kim HS, et al. Liver transplantation for children with primary sclerosing cholangitis and autoimmune hepatitis: UNOS database analysis. J Pediatr Gastroenterol Nutr. 2017;64:e83-e87.
- Perkins JD. Techniques to ensure adequate portal flow in the presence of splenorenal shunts. Liver Transplant. 2007;13:767-8.
- Van Gerven NMF, Verwer BJ, Witte BI, et al. Relapse is almost universal after withdrawal of immunosuppressive medication in patients with autoimmune hepatitis in remission. J Hepatol. 2013;58:141-7.
- Saadah OI, Smith AL, Hardikar W. Long-term outcome of autoimmune hepatitis in children. J Gastroenterol Hepatol. 2001;16:1297-302.
- Gregorio GV, Portmann B, Reid F, et al. Autoimmune hepatitis in childhood: A 20-year experience. Hepatology. 1997;25:541-7.
- Ferreira AR, Roquete MLV, Toppa NH, et al. Effect of treatment of hepatic histopathology
Correspondencia: Carolina Aristizábal Henao
Fundación Valle del Lili, Cali, Colombia
Correo electrónico: caristizabalh@gmail.com
Acta Gastroenterol Latinoam 2021;51(2):165-172
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE


