Rubén Muñoz Cedeño,2, 3 Roberto Salazar Molina,3 Carlos Guachun Rocano,3 Gema Rodríguez Chica,4 Fabricio Vera Zapata1
1 Gastroenterólogo del Hospital General del Norte de Guayaquil IESS Ceibos, Universidad de Guayaquil, Ecuador.
2 Posgradista de Gastroenterología del Hospital de Especialidades Dr. Abel Gilbert Pontón, Universidad de Guayaquil, Ecuador.
3 Posgradista de Gastroenterología del Hospital General del Norte de Guayaquil IESS Ceibos, Universidad de Guayaquil, Ecuador.
4 Médico general del Hospital Universitario de Guayaquil de la Universidad de Guayaquil, Ecuador.
Acta Gastroenterol Latinoam 2020;50(4):463-469
Recibido: 07/01/2020 / Aprobado: 21/10/2020 / Publicado en www.actagastro.org el 14/12/2020
Resumen
El colangiocarcinoma es un adenocarcinoma poco frecuente y agresivo que surge de las células epiteliales del tracto biliar. El intrahepático tiene una incidencia muy baja a nivel mundial: < 10% en relación a los extrahepáticos. Presentamos el caso de una paciente femenina añosa, sin antecedentes de importancia ni factores de riesgo que ayuden a discernir su etiología, los estudios por imagen y la terapéutica que se le brindó mediante la colangiopancreatografía retrógrada endoscópica con colocación de un stent metálico para drenaje biliar como medida paliativa.
Palabras claves. Colangiocarcinoma, colangiocarcinoma intrahepático formador de masa, tumor hepático.
Management and Diagnosis of Mass-forming Cholangiocarcinoma in a Case Report
Summary
Cholangiocarcinoma is a rare and aggressive adenocarcinoma that arises from epithelial cells of the biliary tract, the intrahepatic has a very low incidence worldwide < 10% in relation to extrahepatic patients. We present this case of an elderly female patient with no history of importance and risk factors that help us discern her etiology, imaging studies, therapeutic that were provided by the endoscopic retrograde cholangiopancreatography with the placement of 10 x 80 mm partially covered metallic stent for biliary drainage as a palliative measure.
Key words. Cholangiocarcinoma, intrahepatic mass-forming cholangiocarcinoma, tumor liver.
Introducción
El colangiocarcinoma surge de las células epiteliales de las vías biliares intra y extrahepática. Representa el 3% de las neoplasias malignas gastrointestinales y su incidencia en los EE.UU. es de uno o dos casos por cada 100.000 habitantes.1 La enfermedad perihiliar representa el 50%; la enfermedad distal, el 40%, y la enfermedad intrahepática, < 10%. Son altamente letales porque la mayoría es localmente avanzada en la presentación.2 El colangiocarcinoma intrahepático formador de masa es una tumoración expansiva con un crecimiento radial. El tumor surge de pequeñas ramas del conducto biliar intrahepático y, luego, invade las estructuras adyacentes al parénquima hepático. En las imágenes aparece con márgenes irregulares, pero bien definidos, y puede presentar retracción capsular. Es variable en su presentación clínica: el dolor y la pérdida de peso son síntomas frecuentes, los pacientes tienen menor probabilidad de tener ictericia y en un 30-73% se presentan asintomáticos, con un diagnóstico incidental hasta en un 12 a un 30% de los casos.3
Presentación del caso
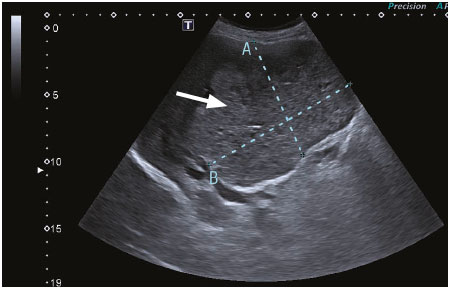
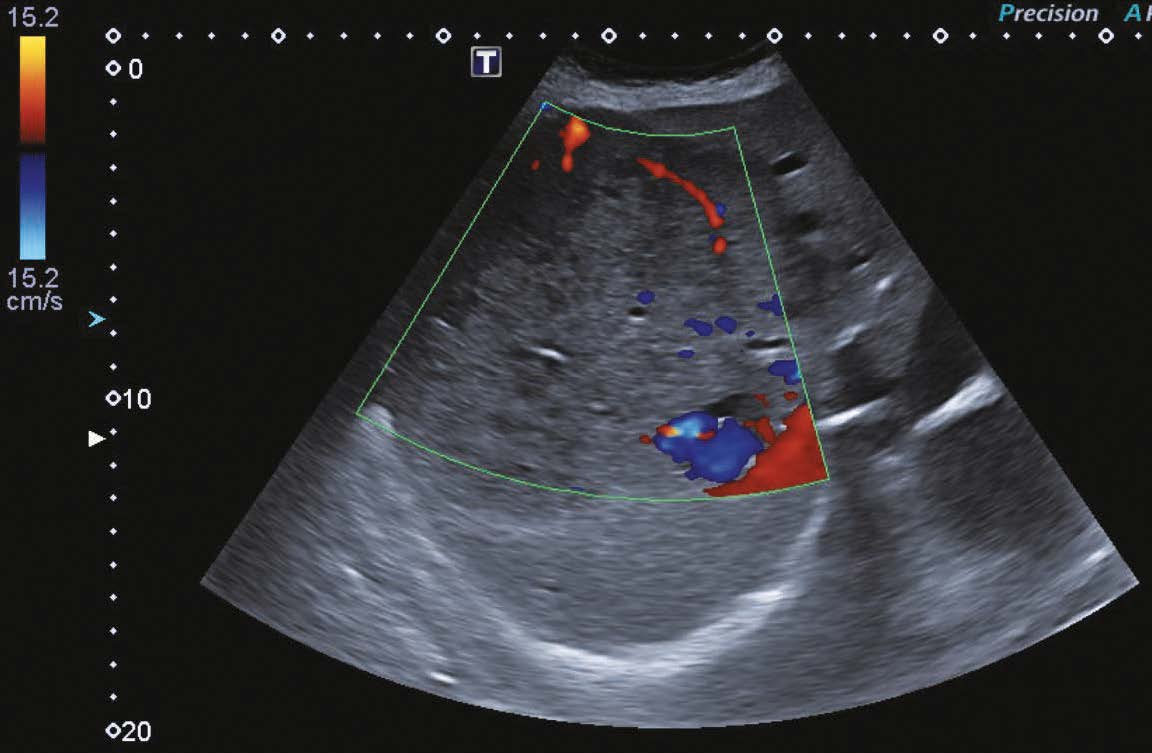
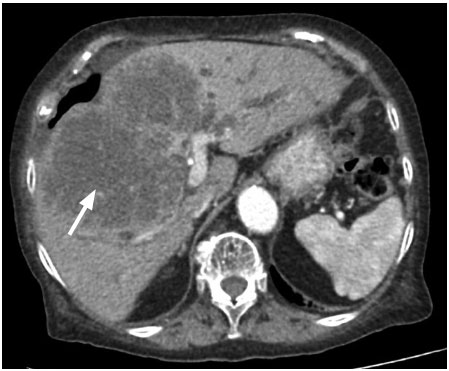
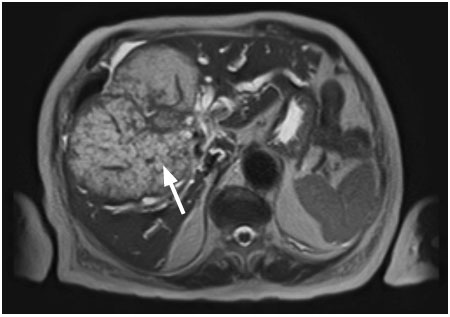
Se trata de una paciente femenina de 94 años, con antecedentes de hipertensión arterial tratada con losartán 50 mg por día, colecistectomizada hace 20 años, que refiere un cuadro clínico de un año de evolución, caracterizado por la pérdida de peso de aproximadamente 50 libras, agregando ictericia de piel y mucosas en las últimas 2 semanas. No presentó dolor abdominal ni episodios de fiebre. En el laboratorio presentaba hemoglobina de 10,2 mg/dl, leucocitos de 5200/mm3, bilirrubina total de 28,93 mg/dl, bilirrubina directa de 24,95 mg/dl, bilirrubina indirecta 3,98 m/dl, aspartato aminotransferasa 230 U/L, aminotransferasa pirúvica 116 U/L, fosfatasa alcalina 561 U/L, gamma-glutamil transferasa 700 U/L, antígeno carcinoembrionario elevado 137,10 ng/dl, alfafetoproteína normal y hepatitis B y C negativas. Se le realizó una ecografía abdominal (Figura 1) observando el hígado aumentado de tamaño a expensas del lóbulo derecho con lesiones hiperecogénicas, heterogéneas con bordes definidos en los segmentos V, VI y VII. El doppler (Figura 2) evidenció una vascularización central y periférica de 121 x 133mm, con vasos suprahepáticos y portales tortuosos y dilatados. Posteriormente, se le realizó una tomografía trifásica de abdomen (Figura 3) visualizando al hígado con un aumento de tamaño, con presencia de una gran masa heterogénea de predominio hipodensa, los contornos lobulados, irregulares, que ocupan los segmentos IV, V, VI y VII, de 144 x 98 x 133 mm, que condiciona una retracción capsular y dilatación de las vías biliares intrahepáticas. Tras la administración de contraste, en fase arterial, presentó un realce periférico que engloba a los vasos suprahepáticos. En fase portal, presentó la captación heterogénea sin imágenes de wash out. Por tal motivo se le realizó una colangioresonancia (Figuras 4 y 5) que evidenció al hígado aumentado de tamaño, en su diámetro anteroposterior de 166 mm, con presencia de una masa heterogénea de predominio hiperintensa en secuencia T2 y T2 FAT – SAT, con los contornos lobulados e irregulares que ocupaban los segmentos IV, V, VI y VII, de 144 x 98 x 133 mm. Se observó una retracción capsular y dilatación de las vías biliares intrahepáticas.
Figura 1. Ecografía abdominal: se observa el lóbulo hepático derecho con un aumento de tamaño y con lesiones hiperecogénicas de bordes definidos (flecha blanca)
Figura 2. Ecografía abdominal doppler: se observa una vascularización central y periférica con los vasos suprahepáticos y portales tortuosos y dilatados
Figura 3. Tomografía trifásica de abdomen: en el hígado se distingue una gran masa heterogénea, hipodensa, con los contornos lobulados e irregulares, con una retracción capsular y una dilatación de las vías biliares intrahepáticas en los segmentos IV, V, VI y VII (flecha blanca)
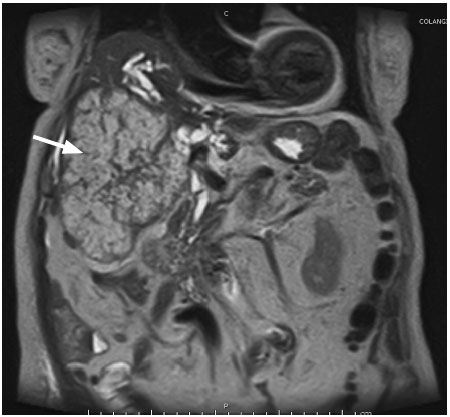
Figura 4. Colangioresonancia: a nivel del hígado, en el corte transversal, se observa una gran masa heterogénea, hiperintensa, bordes lobulados e irregulares, que ocupa los segmentos IV, V, VI y VII (flecha blanca)
Figura 5. Colangioresonancia (corte coronal): se evidencia una gran masa heterogénea, hiperintensa, irregular, con una retracción capsular y una dilatación de las vías biliares intrahepáticas, que ocupa los segmentos VII, VI, V y IV (fecha blanca)
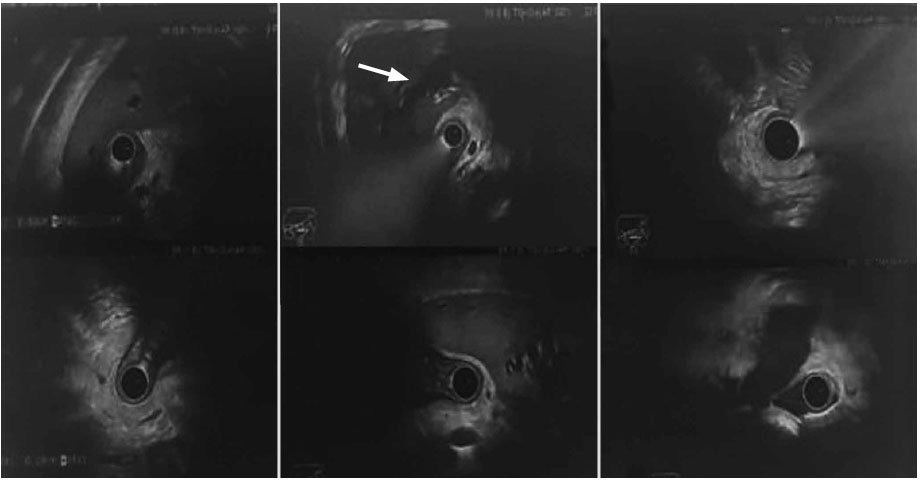
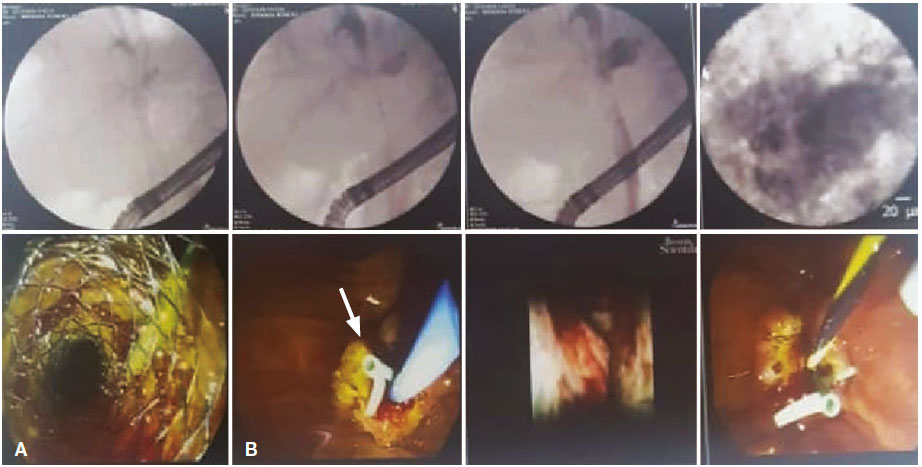
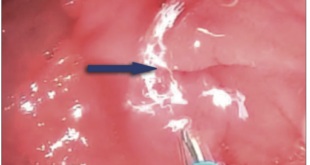
Se le realizó una ecoendoscopía (Figura 6) evidenciando una dilatación de las vías biliares intrahepáticas, asociada a una lesión hiperecogénica con invasión vascular, una disminución del calibre en el tercio proximal y la confluencia compatible con un colangiocarcinoma en estadio IV. Posteriormente, se le efectuó una colangiopancreatografía retrógrada endoscópica (CPRE) con coledocoscopía (Figura 7) que mostró una estenosis de la vía biliar (Clasificación de Bismuth – Corlette III) con neovascularización, por lo que se le realizó una endomicroscopía confocal confirmando el diagnóstico de colangiocarcinoma. Se tomaron biopsias dirigidas. Por tal motivo, se decidió realizar la ablación por radiofrecuencia de la lesión estenosante como un manejo paliativo de la ictericia, con la adecuada resolución del cuadro. Además, se colocó un stent metálico parcialmente cubierto de 10 x 80 mm para drenaje biliar y colocación de prótesis pancreática para evitar una pancreatitis. De forma posterior a los procedimientos, la paciente no presentó complicaciones. La biopsia reportó un colangiocarcinoma de tipo adenocarcinoma. Fue seguida en forma ambulatoria y, a los 3 meses, se encontraba asintomática con cuidados paliativos.
Figura 6. Ecoendoscopía: dilatación de las vías biliares intrahepáticas con disminución del calibre en el tercio proximal y confluencia compatible con un colangiocarcinoma (flecha blanca)
Figura 7. Colangiopancreatografía retrógrada endoscópica. Imagen A: colocación del stent metálico parcialmente cubierto de
10 x 80 mm para drenaje biliar. Imagen B: colocación de la prótesis pancreática para evitar una pancreatitis (flecha blanca)
Todos los procedimientos realizados fueron hechos en otra unidad hospitalaria (Instituto Ecuatoriano de Enfermedades Digestiva – IECED – Guayaquil), ya que nuestro centro hospitalario es una unidad de atención de segundo nivel que no cuenta con los procedimientos
descriptos disponibles.
Discusión
El colangiocarcinoma es un adenocarcinoma poco frecuente y agresivo que surge de las células epiteliales del tracto biliar. Se clasifica en extrahepático, que comprende el 75% de los casos del tracto biliar primario, e intrahepático, que comprende el 25% de todos los colangiocarcinomas. Es el segundo cáncer primario de hígado más frecuente después del carcinoma hepatocelular.2, 4
La incidencia del colangiocarcinoma intrahepático parece haber aumentado en las últimas décadas con una tasa anual de 1,6 por 1.000.000/año desde el 2000. Contrariamente, datos recientes sugieren que la incidencia se ha mantenido desde 1992 a 2007 con leves fluctuaciones. En los Estados Unidos aumentó la incidencia de 0,44 a 1,18 casos por 100.000 personas al año, con una edad media de 67 años al momento del diagnóstico, menor en el sexo femenino, con tasa de incidencia anual (TIR) de 0,80 (IC 95%, 0,75-0,84). El origen étnico hispano, en comparación con el no hispano, se asoció con una mayor incidencia relativa de colangiocarcinoma intrahepático con una TIR de 1,31.1, 5, 6
La presentación clínica del colangiocarcinoma extrahepático se hace manifiesta cuando el tumor obstruye el sistema de drenaje biliar, provocando la ictericia, el prurito y la acolia. Otros síntomas comunes incluyen al dolor abdominal, la pérdida de peso y la fiebre. El dolor generalmente se describe como un dolor sordo, constante, en el cuadrante superior derecho; pueden estar presentes el malestar, la fatiga y los sudores nocturnos.7, 8
El colangiocarcinoma intrahepático puede presentarse de manera diferente con menor probabilidad de ictericia, manifestándose con dolor y pérdida de peso. Pueden ser asintomáticos en un 30 a un 73% de los casos, con un diagnóstico incidental en un 12 a un 30% en estudios por imágenes durante la pesquisa de carcinoma hepatocelular en pacientes con hepatitis virales crónicas y cirrosis. Desafortunadamente, el colangiocarcinoma puede pasar desapercibido hasta que alcanza un gran tamaño.7, 9
Aunque la ecografía abdominal es la prueba inicial en los pacientes con la sospecha de una obstrucción biliar por su alta disponibilidad, es muy imprecisa para detectar la localización, el nivel, y la caracterización del tumor, dificultando la evaluación de su extensión y la resecabilidad. No hay evidencia del papel del contraste ecográfico para detectar los tumores extrahepáticos, aunque puede ser relevante para distinguirlos del barro biliar o para la biopsia guiada de lesión difícil de ver.10
La tomografía computarizada multidetector (TCMD) multifásica tiene una gran resolución espacial tridimensional y amplia cobertura. Esto la convierte en una excelente modalidad para detectar y estadificar los tumores biliares en casi del 94% al 100% de los pacientes, tanto en la invasión vascular como en la diseminación a distancia. Permite calcular el volumen hepático con más facilidad y precisión para la resecabilidad es del 92% y del 85% respectivamente. La resonancia magnética en especial, cuando se plantea la hepatectomía, también puede detectar las anomalías arteriales hepáticas o una invasión tumoral, así como el estrechamiento de la vena porta o el revestimiento tumoral. En la obstrucción biliar crónica con invasión de la vena porta por tumores más avanzados, pueden presentarse como atrofia lobar ipsilateral e hipertrofia lobar contralateral.10, 11, 12
La TCMD está limitada para detectar la extensión longitudinal del conducto biliar en solo un 81% de los casos, en comparación al 100% para detectar diseminación a estructuras y tejidos adyacentes. La sensibilidad para detectar metástasis en los ganglios linfáticos también es limitada y se estima que oscila entre el 35% y el 63%.
La TCMD en combinación con CA 19-9 debe usarse como criterio diagnóstico en los pacientes con colangiocarcinoma intrahepático con formación de masa que no tienen diagnóstico por anatomía patológica, en los casos en los que el tumor es profundo y la biopsia sea difícil o perjudicial para el paciente. Hay estudios que demuestran que un nivel de CA 19-9 de 500 U/L ml posee una especificidad en el diagnóstico de colangiocarcinoma intrahepático del 95,5% y una sensibilidad del 50,6%. Una puntuación en la TCMD mayor a 2 muestra un valor predictivo positivo de más del 90% en el diagnóstico de colangiocarcinoma intrahepático.13
El colangiocarcinoma intrahepático se presenta, más comúnmente, como un formador de masa. El tumor surge de pequeñas ramas del conducto biliar intrahepático, luego invade estructuras adyacentes del parénquima hepático y forma una gran masa intraparenquimatosa bien circunscrita y lobulada. En la colangioresonancia, la señal del borde del tumor es predominante en las imágenes ponderadas en T1, dependiendo de la proporción de fibrosis, necrosis y mucina. Suelen ser hipointensos a isointensos en T1. La intensidad de señal es alta en imágenes ponderadas en T2 y se ven hiperintensos en la mayoría de los casos, donde se observa comúnmente retracción capsular y encapsulación vascular, reflejando la naturaleza desmoplásica del tumor.14, 15
Actualmente, el ultrasonido endoscópico, con sonda de alta frecuencia y alta resolución, es una alternativa viable. La combinación de aspiración con aguja fina guiada por ultrasonido endoscópico (EUS – FNA) y el análisis citológico por la colangiopancreatografía retrógrada endoscópica (CPRE) tuvo una precisión mejorada del 86% en comparación con el 70% de la EUS – FNA o el 67% con ERCP – FNA, demostrando así que el valor predictivo negativo es más bajo para la EUS-FNA (58%).3
La CPRE en los tumores malignos de las vías biliares tiene un papel importante para obtener una muestra anatomopatológica y colocar las prótesis biliares paliativas. El signo radiológico de doble conducto (biliar y pancreático) con estenosis simultánea es considerado tradicionalmente como predictivo del cáncer. Las ventajas de la CPRE son: 1) ayuda a confirmar el diagnóstico de ictericia obstructiva en el paciente con la sospecha de un tumor biliar; 2) obtiene tejido para el diagnóstico de histopatología; 3) establece el nivel exacto de la obstrucción; 4) drena y descomprime el árbol biliar; y 5) facilita la terapia paliativa, braquiterapia intraluminal o terapia fotodinámica intraluminal.16
La coledocoscopía realizada con los videoendoscopios ultradelgados permite acceder al hepatocolédoco, reportar litiasis, lesiones estenosantes al nivel del hilio hepático, tumores de origen del árbol biliar o hepático con compromiso del árbol biliar; y, por medio de biopsias guiadas, permite establecer la naturaleza de la lesión o el tumor. La microendoscopía confocal es una modalidad que contribuye a resaltar las propiedades de la mucosa y mejora la visualización del patrón vascular de la mucosa, constituyendo un valor agregado de la coledocoscopía. Las complicaciones de la coledocoscopía son escasas, siempre que se haya practicado una esfinterotomía de forma previa. Las posibilidades de pancreatitis después del procedimiento son bastante infrecuentes, aunque ha sido descrita en casos sin esfinterotomía previa.17, 18
La microendoscopía confocal (EMF) permite el examen histológico in vivo y en tiempo real de las superficies mucosas, obteniendo imágenes de alta resolución del epitelio pancreatobiliar, aumentando el rendimiento diagnóstico histopatológico estándar con una concordancia del 85% comparado a la histología estándar. En las estenosis biliares indeterminadas o en lesiones pancreáticas, la EMF tiene una sensibilidad del 98% y especificidad del 67 al 73%. Además, posee un excelente perfil de seguridad. Sin embargo, es una técnica costosa y no está disponible fácilmente.19, 20, 21
La colocación de stents autoexpandibles de metal en el colangiocarcinoma infiltrante periductal y el colangiocarcinoma formador de masa fue del 84%. La localización más frecuente del colangiocarcinoma infiltrante es el conducto proximal o medio, donde es preferible el uso del abordaje percutáneo para el implante de la prótesis en comparación con la ruta endoscópica. Según estudios publicados, la permeabilidad de los stents metálicos dura más en comparación con los drenajes plásticos, aumentando la supervivencia global desde el diagnóstico de la enfermedad.22
La mayoría de los pacientes se presentan con una enfermedad irresecable en el momento del diagnóstico, con mal pronóstico y una supervivencia pobre con una mediana reportada de 3 a 6 meses. La tasa de supervivencia a 5 años es mejor para el colangiocarcinoma intrahepático del tipo formador de masa (44%) que para el tipo de infiltración periductal (27%). Es una enfermedad irresecable desde el punto de vista quirúrgico e incurable actualmente. No obstante, cuando la resección hepática es viable, la supervivencia a largo plazo aumenta y es curativo en un número selecto de pacientes.23
Conclusiones
El colangiocarcinoma intrahepático tiene una incidencia muy baja a nivel mundial (< 10%) en relación al extrahepático. La paciente no presentaba antecedentes de importancia ni factores de riesgo que nos ayudasen a discernir su etiología. Los estudios por imágenes fueron determinantes y la terapéutica que se le brindó fue paliativa, ya que la tumoración presentada no cumplía con los criterios de resecabilidad.
Sostén financiero. Propio de los autores.
Referencias
- Patel T. Increasing incidence and mortality of primary intrahepatic cholangiocarcinoma in the United States. Hepatology 2001; 33 (6): 1353-1357.
- Doherty B, Nambudiri VE, Palmer WC. Update on the Diagnosis and Treatment of Cholangiocarcinoma. Curr Gastroenterol Rep 2017; 19 (1): 2.
- Oliveira IS, Kilcoyne A, Everett JM, Mino-Kenudson M, Harisnghani MG, Ganesan K. Cholangiocarcinoma: classification, diagnosis, staging, imaging features, and management. Abdominal Radiology 2017; 42 (6): 1637-1649.
- Castrillón G, Gómez D. Malignant Biliary Obstruction: Usual and Recent Imaging Findings. Rev Colomb Radiol 2015; 26
(4): 4317-4327. - Saha SK, Zhu AX, Fuchs CS, Brooks GA. Forty-Year Trends in Cholangiocarcinoma Incidence in the U.S: Intrahepatic Disease on the Rise. The Oncologist 2016; 21 (5): 594-599.
- Patel T. Worldwide trends in mortality from biliary tract malignancies. BMC Cancer 2002; 2: 10.
- Zhang H, Yang T, Wu M, Shen F. Intrahepatic cholangiocarcinoma: Epidemiology, risk factors, diagnosis and surgical management. Cancer Letters 2016; 379 (2): 198-205.
- Bridgewater J, Galle PR, Khan SA, Llovet JM, Park J-W, et al. Guidelines for the diagnosis and management of intrahepatic cholangiocarcinoma. Journal of Hepatology 2014; 60 (6): 1268-1289.
- Bartella I, Dufour JF. Clinical Diagnosis and staging of Intrahepatic Cholangiocarcinoma. J Gastrointestin Liver Dis 2015; 24 (4): 481-489.
- Esnaola NF, Meyer JE, Karachristos A, Maranki JL, Camp ER, Denlinger CS. Evaluation and management of intrahepatic and extrahepatic cholangiocarcinoma. Cancer 2016; 122 (9): 1349-1369.
- Sainani NI, Catalano OA, Holalkere NS, Zhu AX, Hahn PF, Sahani DV. Cholangiocarcinoma: current and novel imaging techniques. Radiographics 2008; 28 (5): 1263-1287.
- Chung YE, Kim MJ, Park YN, Choi JY, Pyo JY, Kim YC, et al. Varying appearances of cholangiocarcinoma: radiologic-pathologic correlation. Radiographics 2009; 29 (3): 683-700.
- Raunroadroong N, Sriplung H, Lertprasertsuke N, Pojchamarnwiputh S, Chiangmai WN, Sinsuwan W, Thongprasert S. CA 19-9 in combination with abdominal CT scan for the diagnosis of mass-forming intrahepatic cholangiocarcinoma. Hepatic Oncology 2014; 1 (4): 377-386.
- Jhaveri KS, Hosseini-Nik H. MRI of Cholangiocarcinoma. Journal of Magnetic Resonance Imaging 2015; 42 (5): 1165-1179.
- Lee J, Kim SH, Kang TW, Song KD, Choi D, Jang KT. Mass-forming Intrahepatic Cholangiocarcinoma: Diffusion-weighted Imaging as a Preoperative Prognostic Marker. Radiology 2016; 281 (1): 119-128.
- Useche E, Díaz BA. Colangiopancreatografía retrograda endoscópica en tumores malignos de las vías biliares. Gen 2009; 63 (1): 68-71.
- Poleo JR. Coledoscopia con videoendoscopio ultradelgado. Gen 2012; 66 (2): 107-113.
- Löhr JM, Lönnebro R, Stigliano S, Haas SL, Swahn F, Enochsson L, et al. Outcome of probe-base confocal laser endomicroscopy (pCLE) during endoscopic retrograde cholangiopancreatography: A single-center prospective study in 45 patients. United European Gastroenterology Journal 2015; 3 (6): 551-560.
- Al-Mansour MR, Caycedo-Marulanda A, Davis BR, Alawashez A, Docimo S, Qureshi A, Tsuda S. SAGES TAVAC safety and efficacy analysis confocal laser endomicroscopy. Surg Endosc 2020. Disponible en: https://doi.org/10.1007/s00464-020-07607-3
- Martínek J, Kollár M, Krajcíová J, Malušková J, Hucl T, Vacková Z, et al. Confocal laser endomicroscopy in diagnosing indeterminate biliary strictures and pancreatic lesions a prospective pilot study. Rozhl Chir 2020; 99 (66): 258-265.
- Fernandez y Viesca M, Arvanitakis M. Early Diagnosis And Management Of Malignant Distal Biliary Obstruction: A Review On Current Recommendations And Guidelines. Clin Exp Gastroenterol 2019; 12: 415-432.
- Andrašina T, Válek V, Pánek J, Kala Z, Kiss I, Tucek Š, Slampa P. Multimodal Oncological Therapy Comprising Stents Brachytherapy, and Regional Chemotherapy for Cholangiocarcinoma. Gut and Liver 2010; 4 (1): S82-S88.
- Nakano M, Ariizumi SI, Yamamoto M. Intrahepatic cholangiocarcinoma. Seminars in Diagnostic Pathology 2017; 34 (2): 160-166.
Correspondencia: Rubén Muñoz Cedeño
Calle 32 entre Nicolás Augusto González y Rosendo Avilés.
Guayaquil, Ecuador
Correo electrónico: drubenmunoz@gmail.com
Acta Gastroenterol Latinoam 2020;50(4):463-469
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE