Fernando Alonso Medina Monroy1 ID· Andrés Felipe Galindo Ángel2 ID· Michelle Higuera Carrillo3 ID· Juan Pablo Riveros López4 ID· Johon Francisco Garcés Camacho5 ID· Otto Gerardo Calderón-Guerrero6 ID· María Elizabeth Becerra7 ID· Germán Enrique Silva Sarmiento8 ID· Hugo Laignelet9 ID· Francisco Javier Sosa Giraldo10 ID· Ana María Jiménez Fadul11 ID· Jhon Camacho-Cruz12 ID
1 Servicio de Gastroenterología Pediátrica Centro Médico UGANEP, Bucaramanga, Colombia.
2 Subgerencia Regional Centro, Bienestar IPS, Grupo Zentria, Bogotá, Colombia.
3 Universidad Nacional de Colombia, Facultad de Medicina, Universidad El Bosque, Bogotá, Colombia.
4 Universidad El Bosque. Unidad de Gastroenterología Pediátrica, Bogotá, Colombia.
5 Universidad Industrial de Santander. Hospital Internacional de Colombia. Gastroenterólogo y nutriólogo pediatra, Bucaramanga, Santander.
6 Servicio de Gastroenterología Pediátrica, Clínica Imbanaco. Cali, Colombia.
7 Servicio de Pediatría Sura, Dar IPS Bucaramanga, Santander.
8 Consulta pediatría, Bogotá, Colombia.
9 Servicio de Gastroenterología Pediátrica, Departamento de Pediatría, Hospital Militar Central, Bogotá, Colombia.
10 Servicio de Gastroenterología Pediátrica, Departamento de Pediatría. Clínica Somer Rionegro, Colombia.
11 Servicio de Pediatría, Bienestar IPS, Grupo Zentria, Bogotá, Colombia.
12 Universidad Nacional de Colombia, Fundación Universitaria de Ciencias de la Salud (FUCS), Sociedad de Cirugía de Bogota-Hospital San José,
Fundación Universitaria Sanitas, Clínica Reina Sofia Pediátrica y Mujer Colsanitas, Red Colaborativa Pediátrica de Latinoamérica (LARed Network), Bogotá D.C., Colombia.
Acta Gastroenterol Latinoam 2024;54(2):160-191
Recibido: 19/02/2024 / Aceptado: 24/06/2024 / Publicado online el: 30/06/2024 /
https://doi.org/10.52787/agl.v54i2.395
Resumen
Introducción. En los últimos 25 años , el uso de probióticos ha sufrido una importante metamorfosis gracias a la ciencia “ómica”, que ha generado una prolífica información científica y, en consecuencia, un aumento de su uso clínico. Los probióticos se definen como «microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren beneficios a la salud del huésped». La relación entre la microbiota intestinal y el estado de salud de las personas está cada día comprobada, por ello, es importante analizar a partir de la evidencia científica qué probióticos son útiles en determinadas patologías pediátricas. Objetivo. Proporcionar a la comunidad médica un análisis exhaustivo acerca del uso de probióticos y establecer recomendaciones para la población pediátrica. Material y métodos. Esta guía fue desarrollada por un equipo multidisciplinario con apoyo de la Asociación Colombiana de Probióticos y Prebióticos y el Colegio Colombiano de Gastroenterología, Hepatología y Nutrición Pediátricas. Se desarrollaron mesas de trabajo para seleccionar las preguntas de interés clínico, búsquedas sistemáticas de revisiones sistemáticas, metaanálisis, y extracción de la información y recomendaciones para cada pregunta. Expertos en epidemiología realizaron una búsqueda sistemática de la literatura. Las tablas de evidencia y recomendaciones fueron realizadas con base en la metodología Grading of Recommendations Assessment, Development and Evaluation. Las recomendaciones de la guía fueron evaluadas en una reunión de expertos donde se les otorgó el grado de la recomendación. Resultados y conclusiones. Se propusieron 10 preguntas relacionadas con las patologías más frecuentes en pediatría para el uso de los probióticos. En conclusión, el grupo de expertos hizo recomendaciones para las siguientes enfermedades: enterocolitis necrotizante en prematuros, cólico del lactante, diarrea aguda, diarrea secundaria al uso de antibióticos, incidencia de infecciones respiratorias, incidencia de alergias, dolor abdominal funcional, alergia a la proteína de la leche de vaca, enfermedad inflamatoria intestinal y sobrecrecimiento bacteriano del intestino delgado. Las cepas con mejor calidad de evidencia en nuestras guías, sin orden de importancia, fueron: Saccharomyces boulardii cepa CNCM I-745, Limosilactobacillus reuteri cepa DSM 17938 y Lacticaseibacillus rhamnosus GG.
Palabras claves. Probióticos, patologías pediátricas, guías, niños.
Colombian Guideline for the Use of Probiotics in Pediatric Diseases
Summary
Introduction. In the last 25 years the use of probiotics has undergone an important metamorphosis thanks to “omics” science, which has generated a prolific scientific information and, consequently, an increase in clinical use. Probiotics are defined as «live microorganisms that, when administered in adequate quantities, confer health benefits on the host». The relationship between the intestinal microbiota and the state of health of people is proven every day, therefore, it is important to analyze from the scientific evidence which probiotics are useful in certain pediatric pathologies. Objective. To provide the medical community an exhaustive analysis of the use of probiotics and to establish recommendations for he pediatric population. Material and Methods. This guide was developed by a multidisciplinary team with the support of the Colombian Association of Probiotics and Prebiotics and the Colombian College of Pediatric Gastroenterology, Hepatology and Nutrition. Working groups were formed to select questions of clinical interest, systematically search systematic reviews, meta-analysis, and extract information and recommendations for each question. Epidemiology experts performed the systematic literature search. Tables of evidence and recommendations were made based on the Grading of Recommendations Assessment, Development and Evaluation methodology. The recommendations in the guideline were assessed at an expert meeting and assigned a grade of recommendation. Results and conclusions. Ten questions related to the most common pediatric pathologies were proposed for the use of probiotics. In conclusion, the group of experts made recommendations in the following diseases: necrotizing enterocolitis in premature infants, infant colic, acute diarrhea, diarrhea secondary to tantibiotic use, incidence of respiratory infections, incidence of allergies, functional abdominal pain, cow’s milk protein allergy, inflammatory bowel disease, and small intestinal bacterial overgrowth. The strains with the higlest quality of evidence in our guidelines were, in no order of importance: Saccharomyces boulardii strain CNCM I-745, Limosilactobacillus reuteri strain DSM 17938, Lacticaseibacillus rhamnosus GG, Lactobacillus reuteri strain DSM 17938.
Keywords. Probiotics, pediatric pathologies, guidelines, children.
Abreviaturas
AcoPyP: Asociación Colombiana de Probióticos y Prebióticos.
COLGAHNP: Colegio Colombiano de Gastroenterología, Hepatología y Nutrición Pediátricas.
GRADE: Grading of Recommendations Assessment, Development and Evaluation.
ISAPP: Scientific Association of Probiotics and Prebiotics.
PNG: Probióticos de nueva generación.
UE: Unión Europea.
GPC: Guías prácticas clínicas.
PICO: Población, intervención, comparación y resultado.
RS: Revisiones sistemáticas.
RR: Riesgo relativo.
IC: Intervalo de confianza.
GDG: Grupo Desarrollador de la Guía.
ECN: Enteroenterocolitis necrotizante.
PEBN: Peso extremadamente bajo.
S. Boulardii: Saccharomyces Boulardii.
L. rhamnosus GG: Lacticaseibacillus rhamnosus.
L. reuteri DSM 17938: Limosilactobacillus reuteri DSM 17938.
B. clausii: Bacillus clausii.
APLV: Alergia a las proteínas de la leche de vaca.
ECA: Ensayos controlados aleatorizados.
EII: Enfermedad Inflamatoria Intestinal.
ASA: Ácido-aminosalicílico.
SIBO: Sobrecrecimiento bacteriano del intestino delgado.
QoL: Calidad de vida.
SMD: Diferencia media estándar.
ITR: Infección del tracto respiratorio.
IRA: Infección respiratoria aguda.
DM: Diferencia media.
NNTB: Resultado beneficioso adicional.
FODMAP: Fermentable Oligosaccharides, Disaccharides, Monosaccharides, and Polyols.
DAA: Diarrea aguda por antibióticos.
DAR: abdominal recurrente.
Introducción
Debido al rápido crecimiento en el mercado de los probióticos y asociaciones (prebióticos y simbióticos) creemos en la necesidad de realizar una actualización constante en esta área. Además, surgen nuevos conceptos a los que pronto daremos la bienvenida por su acción benéfica al organismo: 1) postbióticos, definidos como “una preparación de microorganismos inanimados y/o sus componentes que confieren un beneficio para la salud del huésped” por el consenso de la International Scientific Association of Probiotics and Prebiotics (ISAPP); 2) parabióticos conceptualizados como “material no viable de origen microbiano1, 2 microorganismos inactivos o fracciones celulares) que habrían demostrado que pueden tener beneficios para la salud humana y/o animal“); 3) probióticos de nueva generación (PNG) como la Akkermansia muciniphila (primer PNG), Faecalibacterium prausnitzii, y mezclas de los grupos de bacterias Clostridium IV y XIVa, Bacteroides fragilis y Bacteroides uniformis y, finalmente, 4) fagobióticos definidos como “virus que infectan bacterias y se proponen como una subcategoría de bacteriófagos específicos que han demostrado efectos positivos en la salud en estudios controlados”.1, 2 Actualmente hay más de 100 cepas bien caracterizadas, con su seguridad evaluada y listas para la producción y formulación en productos comerciales.
Objetivo
El objetivo primordial para la elaboración de una guía en el uso de los probióticos en Colombia, elaborada en conjunto por la Asociación Colombiana de Probióticos y Prebióticos (ACoPyP) y el Colegio Colombiano de Gastroenterología, Hepatología y Nutrición Pediátrica (COLGAHNP), es proveer un instrumento que suministre información actualizada y establecer recomendaciones para su uso en las diferentes patologías pediátricas. Para ello efectuamos una revisión exhaustiva de la literatura, considerando que uno de los objetivos en el actual ejercicio médico es la medicina de precisión, cuyo enfoque es el tratamiento y prevención de enfermedades tomando en cuenta la variabilidad individual en los genes, el ambiente y estilo de vida de cada persona y la manipulación de la microbiota intestinal.
Métodos
El grupo contó con la participación de expertos en gastroenterología pediátrica, pediatras, epidemiólogos y pacientes. Todos los miembros del Grupo Desarrollador de la Guía (GDG), del panel de expertos, así como las personas que participaron en la revisión externa, firmaron una declaración de conflicto de intereses.
Decisión sobre desarrollo de novo o adaptación
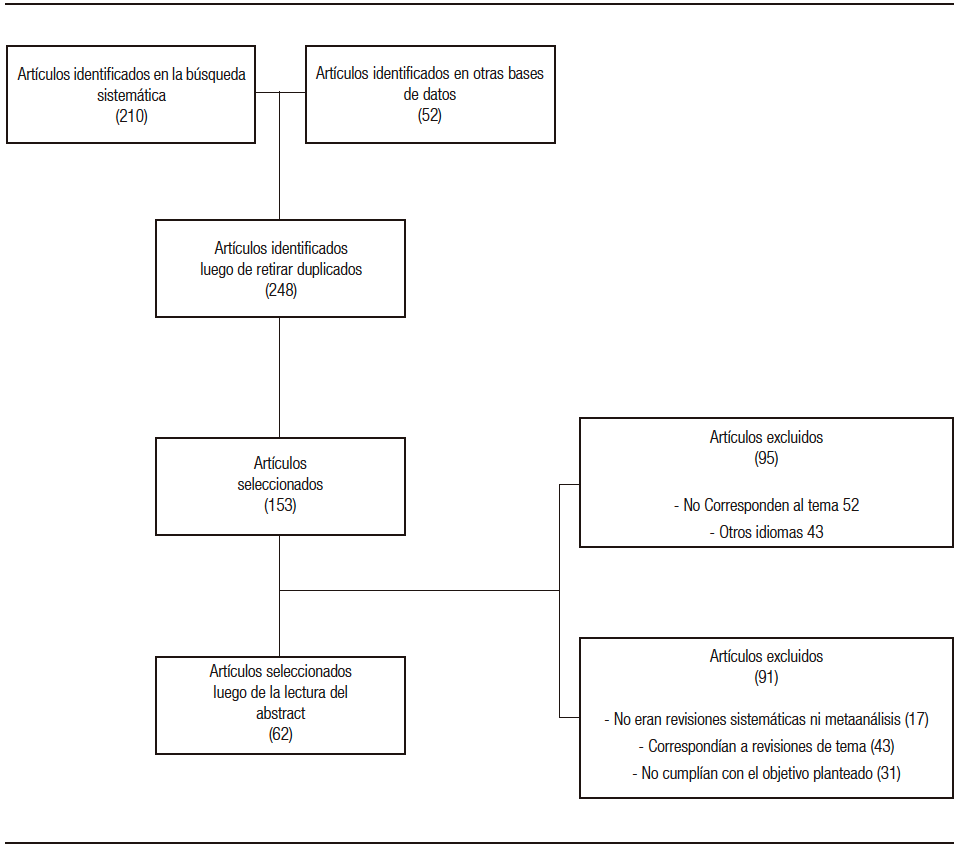
EL GDG procedió a realizar una búsqueda sistemática de la literatura con el objeto de identificar todas las GPC (guías de práctica clínica) nacionales e internacionales que abordaran el uso de probióticos en la población pediátrica y guardaran similitud con los alcances y objetivos propuestos para esta guía. Se evaluó la calidad de las GPC recuperadas con el Instrumento AGREE II3 y cada documento fue calificado independientemente por dos evaluadores con el fin de obtener la calidad global de la guía. Posteriormente se procedió a establecer, a través de una adaptación de una matriz (Ministerio de Salud y Protección Social, 2016), si existía alguna guía susceptible a ser adaptada. La matriz de decisión considera los siguientes aspectos: las guías identificadas deben guardar relación con los alcances y objetivos de la GPC objeto de desarrollo; deben ser recomendadas de acuerdo con la herramienta AGREE II; deben contar con las tablas de evidencia, publicación antes de 4 años y debe usar el enfoque GRADE.4 Con base en los resultados de la matriz de decisión de adaptar la guía, se identificó que no existen guías susceptibles de ser adaptadas y la guía debe ser desarrollada de novo. Todas las preguntas para desarrollar (adaptadas o de novo) se formularon en formato PICO (población, intervención, comparación y resultado) Anexo 1. El primer paso de desarrollo fue una búsqueda sistemática de revisiones sistemáticas (RS) publicadas en diferentes bases de datos. Las RS identificadas se evaluaron utilizando la herramienta AMSTAR.5 Si no se encontraban RS de alta calidad, se procedía a la selección de estudios primarios, los cuales se evaluaron mediante la herramienta Cochrane de Riesgo de Sesgo.6 Se realizó una síntesis de los estudios seleccionados creando un perfil de evidencia en https://www.gradepro.org/ y calificando el nivel de evidencia según la clasificación GRADE (alto, medio, bajo y muy bajo).
Formulación de preguntas clínicas de la guía de práctica clínica
El GDG, conformado por expertos temáticos y epidemiólogos, revisó los aspectos clínicos relevantes que requerían ser abordados, y se formularon en primera instancia preguntas genéricas, que posteriormente se compararon con las GPC seleccionadas, convirtiéndolas en preguntas específicas mediante su estructuración en formato PICO (Población, Intervención, Comparación y Desenlaces).6 Las preguntas clave se encuentran en el Anexo 1. El GDG realizó un ejercicio de priorización de desenlaces con el ánimo de identificar aquellos que resultaran claves y deberían ser incluidos. Se identificaron y priorizaron desenlaces clínicos de seguridad, efectividad, calidad de vida y todo aquello importante para los pacientes. Cada desenlace fue clasificado como crítico, importante no crítico y no importante para los pacientes con base en una escala de 9 unidades propuesta por el grupo GRADE4 (Anexo 2). Una vez que fueron identificadas en la guía las preguntas a responder, se procedió a buscar la evidencia de bases de datos y diligenciar esa plantilla.
Formulación de las recomendaciones
Las recomendaciones fueron formuladas en dos pasos. Primero, el GDG elaboró las recomendaciones preliminares considerando el balance riesgo beneficio, preferencias de los pacientes y el contexto de implementación de cada país según la evidencia local. Segundo, las recomendaciones se discutieron y ajustaron en un panel de expertos con representantes de usuarios y pacientes, quienes contribuyeron a refinar las recomendaciones y definir la fuerza de las recomendaciones.6
La graduación de la fuerza y dirección de cada recomendación se determinó con base en el nivel de evidencia y otras consideraciones adicionales revisadas en pleno por el GDG; esto se realizó por votación del grupo evaluador, teniendo como mayoría el dato a seleccionar. En caso de no haber consenso se realizó un Punto de Buena Práctica.
Nivel de Evidencia
Calidad Global de la evidencia GRADE – Anexo 2
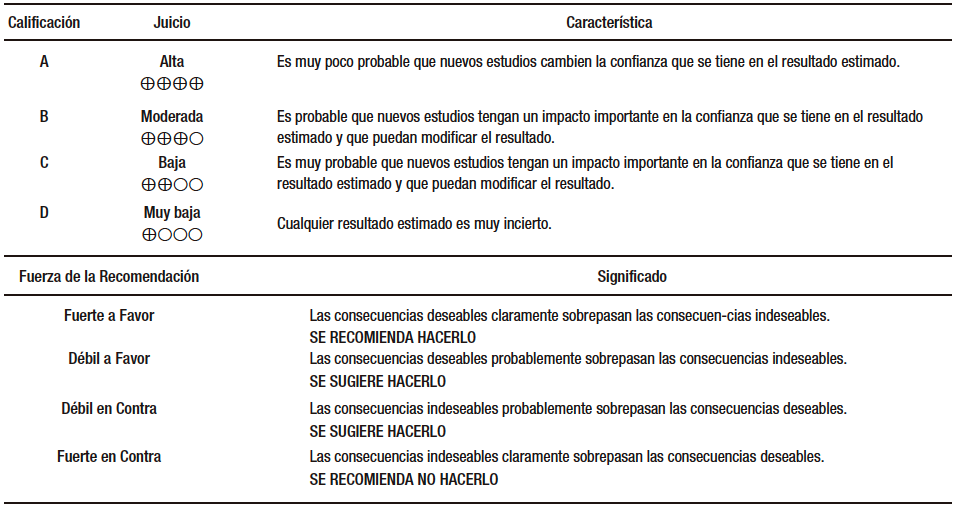
Buenas prácticas
Las buenas prácticas son sugerencias operativas basadas en la experiencia del GDG y de las mesas de trabajo de GRADE donde participaron diferentes grupos de interés que, aunque no son basadas en la evidencia, hacen parte de las buenas prácticas de diagnóstico, tratamiento o seguimiento de los pacientes. Las buenas prácticas tienen como objetivo apoyar las recomendaciones formuladas.
Inclusión de comentarios de los pares evaluadores externos
Esta GPC fue revisada de forma independiente por pares expertos en metodología y contenido temático.
Declaración de independencia editorial
Tanto ACoPyP como COLGHANP participaron como financiadores con recursos propios para la elaboración de la guía, garantizando con ello la transparencia, transferibilidad y aplicabilidad de su contenido al contexto colombiano. El trabajo científico de investigación, así como la elaboración de las recomendaciones incluidas en el presente documento, fueron realizados de manera independiente por el GDG.
Resultados
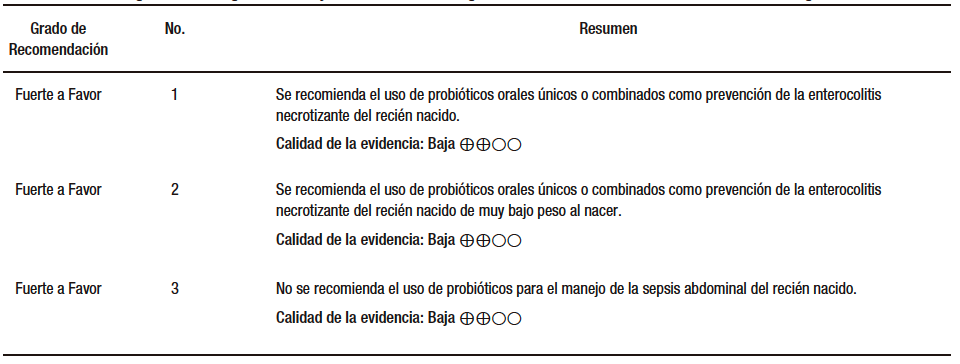
Pregunta 1. ¿Los probióticos, prebióticos y simbióticos son útiles en la prevención de enterocolitis necrotizante en prematuros?
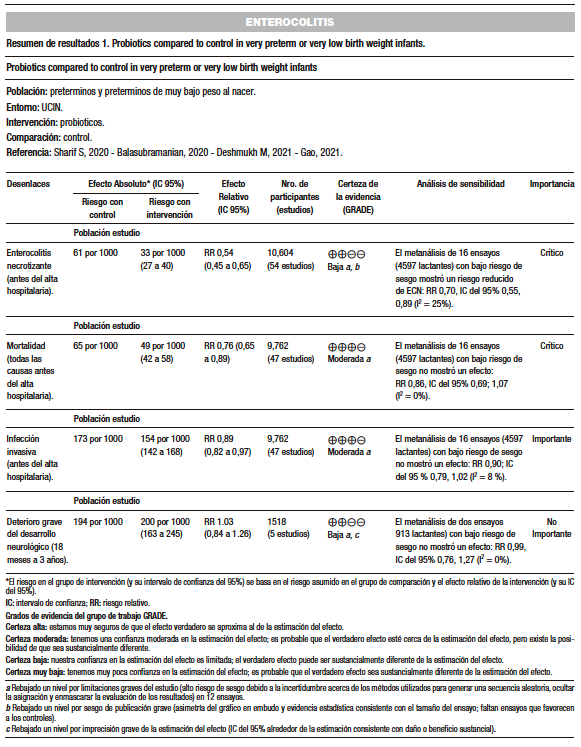
Sharif S y col. (AMSTAR 11/11) incluyeron 56 ensayos en los que participaron 10.812 lactantes. Las preparaciones más utilizadas contenían Bifidobacterium spp., Lacticaseibacillus spp., Saccharomyces spp. y Streptococcus spp. solas o en combinaciones. El metaanálisis mostró que los probióticos podían reducir el riesgo de ECN: con un RR (riesgo relativo) de 0,54 (IC del 95%: 0,45 a 0,65), también mostraron que los probióticos probablemente reducían la mortalidad: RR 0,76 (IC del 95%: 0,65 a 0,89) y la infección invasiva de aparición tardía: RR 0,89 (IC del 95%: 0,82 a 0,97). Además, se evidenció que los probióticos podían tener poco o ningún efecto sobre el deterioro grave del desarrollo neurológico: RR 1,03 (IC del 95%: 0,84 a 1,26). No se encontraron efectos sobre la morbimortalidad asociada para los recién nacidos muy prematuros o de muy bajo peso al nacer, y en particular para los recién nacidos extremadamente prematuros.
Balasubramanian y col. (AMSTAR 9/11) mostraron que el uso de los probióticos presentaba un riesgo reducido de enteroenterocolitis necrotizante (ECN) ≥ Estadio II (RR: 0,36 [IC del 95%: 0,20 a 0,66]; p = 0,0009) en sepsis de inicio tardío y menor mortalidad a favor del grupo probiótico. Además, redujeron el tiempo requerido para lograr la alimentación completa y la duración de la estancia hospitalaria DM: −2,00 días (IC del 95%: −2,46 a −1,53); p < 0,00001).8-13
Deshmukh M y col. (AMSTAR 10/11) demostraron que los probióticos reducían el riesgo de ECN en etapa ≥ II, la sepsis de inicio tardío, la mortalidad por todas las causas y la intolerancia alimentaria en los recién nacidos prematuros. Se señaló su efectividad en recién nacidos con peso al nacer extremadamente bajo (PEBN: < 1000g).
Además, la administración rutinaria de probióticos de múltiples cepas fue más efectiva que el manejo con una sola cepa. Un estudio informó 3 casos no fatales de sepsis probiótica.14-30
Gao (AMSTAR 9/11) incluyó 10 ensayos clínicos aleatorizados (ECA) con 1.264 participantes y evidenció que hubo reducciones significativas en la incidencia de ECN. Sin embargo, no hubo diferencias significativas en cuanto a la presencia de sepsis. Los autores recomendaron el uso de Saccharomyces boulardii para prevenir la ECN, reducir la intolerancia alimentaria, acortar los días de alimentación complementaria y los días de hospitalización. Sin embargo, S. boulardii podría no ser válido en la incidencia de sepsis, la mortalidad y el tiempo para recuperar el peso al nacer.31-34
En conclusión, podemos decir que los probióticos como Lacticaseibacillus rhamnosus- L. rhamnosus GG (en una dosis que varía de 1×109 CFU a 6×109 CFU) o combinaciones de Bifidobacterium infantis BB-02, B. lactis BB-12 y Streptococcus thermophilus TH-4 (dosis 3 a 3,5×108 UFCS) y S. boulardii, solo o en combinaciones, podrían ser útiles para: 1) reducir el riesgo de ECN ≥ Estadio II, 2) reducir la mortalidad de ECN, 3) evitar la aparición de sepsis de inicio tardío, 4) reducir el tiempo requerido para lograr la alimentación completa, 5) disminuir la duración de la estancia hospitalaria con efectividad en recién nacidos que tienen un peso al nacer extremadamente bajo. (Tabla 1)
Tabla 1. Uso de probióticos, prebióticos y simbióticos en la prevención de enterocolitis necrotizante en prematuros
Pregunta 2. ¿Los probióticos pueden ser efectivos para el tratamiento del cólico del lactante?
De las cepas probióticas estudiadas para el manejo del cólico del lactante se encuentra el Limosilactobacillus reuteri DSM 17938, bacteria Gram-positiva indígena del intestino de los mamíferos y las aves, que se logró aislar por primera vez en 1990 de la leche materna en una mujer que amamantaba en los Andes Peruanos.
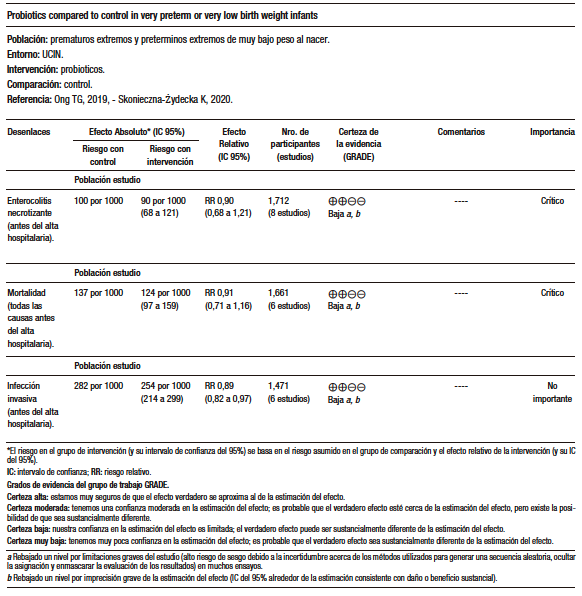
Ong (AMSTAR 11/11) completó 3.284 registros, seis estudios con 1.886 participantes cumplieron con los criterios de inclusión y compararon con placebo. Dos estudios examinaron Limosilactobacillus reuteri DSM 17938, dos examinaron probióticos de múltiples cepas, uno examinó Lacticaseibacillus rhamnosus y uno examinó Lacticaseibacillus paracasei y Bifidobacteriumanimalis subespecie lactis, también conocido como Bifidobacterium lactis (BB-12). El riesgo de sesgo fue bajo para la asignación al azar.35-40
El Limosilactobacillus reuteri DSM 17938 mostró una reducción de 44,26 minutos en el tiempo de llanto diario (IC del 95%: -66.6 a -21.9; I2 = 92%). Si bien, se observó que no hay evidencia clara a favor del uso de los probióticos para prevenir el cólico infantil, si se logró la disminución del tiempo de llanto en el grupo que usó los probióticos, sin tener repercusiones en los efectos adversos. Skonieczna-Żydecka y col. (AMSTAR 9/11), incluyeron 16 estudios con un universo de 1.319 lactantes, desde recién nacidos hasta los seis meses de edad. La cepa utilizada fue el Limosilactobacillus reuteri DSM 17938 observándose nuevamente una reducción en la duración del llanto. El éxito para reducir el llanto cercano al 50% fue 1,98 veces mayor en el grupo que uso el L. reuteri DSM 17938 (p < 0,0001).41-55
Los probióticos acortaron la duración del llanto, pero vale la pena verificar la relación causal en el efecto modulador de los probióticos. Debemos tener en cuenta que muchos estudios siempre relacionan la mejoría del cólico del lactante con el uso de los probióticos en lactantes que estén siendo amamantados con leche materna exclusiva. También se ha logrado observar una disminución de la depresión materna hasta en un 63% cuando se bajan los niveles de irritabilidad del lactante y la ansiedad de los cuidadores.
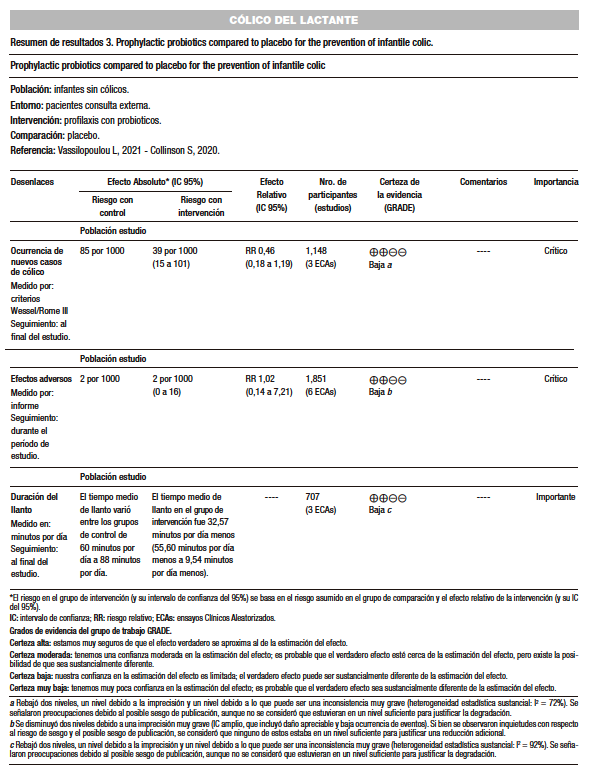
En conclusión, podemos decir que probióticos como el Limosilactobacillus reuteri DSM 17938 (dosis de 108 UFC/día durante al menos 21 días), Lacticaseibacillus rhamnosus, Lacticaseibacillus paracasei y Bifidobacterium animalis ssp lactis (BB-12) podrían ser útiles para disminuir el tiempo del llanto, especialmente en los niños amamantados, pero no fueron útiles para prevenir el cólico del lactante. (Tabla 2)
Tabla 2. Efectividad de los probióticos en el tratamiento del cólico del lactante

Pregunta 3. ¿Cuáles son los probióticos útiles en la diarrea aguda?
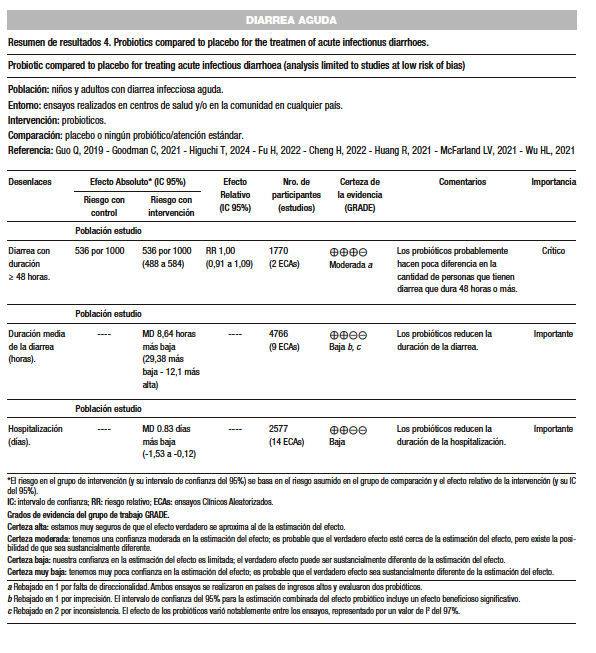
Vassilopoulou y col. (AMSTAR 10/11) estudiaron veinte ensayos con 3.469 pacientes y observó que los probióticos no demostraron suficiente impacto clínico en la reducción de la duración de la diarrea en los niños de los países desarrollados. Los estudios incluidos presentaban riesgo de sesgo variable.56-76
Collinson y col. (AMSTAR 9/11) incluyeron 82 estudios con un total de 12.127 participantes. Estos estudios incluyeron 11.526 niños (edad < 18 años) y 412 adultos (tres estudios reclutaron a 189 adultos y niños). El riesgo de sesgo fue alto o poco claro en muchos de los estudios, y hubo una marcada heterogeneidad estadística cuando los resultados se agruparon en el metaanálisis. En seis ensayos (3.058 participantes; nivel de certeza muy baja), no se detectaron diferencias entre los grupos de probióticos y el grupo control para el riesgo de diarrea mayor o igual a 48 horas, o para la duración de la diarrea (diferencia de medias [DM] de -8,64 horas, IC del 95%: -29,4 horas a 12,1 horas). Se incluyeron análisis limitados a los probióticos L. rhamnosus GG y Saccharomyces boulardii.77
En seis ensayos con 433 participantes de L. reuteri hubo consistencia entre los hallazgos, pero el riesgo de sesgo estuvo presente en todos los estudios incluidos. La duración de la hospitalización fue más corta en los grupos de probióticos que en los grupos de control, con marcada heterogeneidad entre los estudios. En 24 ensayos donde se incluyeron 4.056 participantes, no se detectaron diferencias entre los grupos de probióticos y de control en el número de personas con diarrea y duración ≥ 14 días y, finalmente, en 9 estudios con 2.928 participantes no se atribuyeron eventos adversos graves a los probióticos.
Al revisar los metaanálisis publicados entre 2021 y 2024, se ha encontrado nueva evidencia en constante construcción, lo que implica un desarrollo continuo día tras día en este campo específico.
McFarland y col. (AMSTAR 8/11) incluyeron 22 estudios con un total de 4.059 niños con gastroenteritis aguda en India. Se evaluaron cinco probióticos de una sola cepa y tres combinaciones multicepa. La cepa Saccharomyces boulardii CNCM I-745 mostró la mayor eficacia para reducir la duración de la diarrea con una DM de -1,86 días (IC del 95%: -2,8 a -0,9 días). Tanto Lacticaseibacillus rhamnosus GG como una combinación de cuatro cepas de Bacillus clausii (O/C, SIN, N/R, T) también disminuyeron significativamente la duración de la diarrea en -1,7 y -1,4 días, respectivamente. S. boulardii y L. rhamnosus GG redujeron significativamente la estancia hospitalaria en -1,8 y -1,1 días, respectivamente, mientras que B. clausii no tuvo efecto en ese aspecto. La frecuencia de deposiciones diarias disminuyó significativamente al día 4 para S. boulardii y al día 5 para L. rhamnosus GG. En India, dos tipos de probióticos (S. boulardii CNCM I-745 y L. rhamnosus GG) acortaron significativamente tanto la duración de la diarrea como la estancia hospitalaria en niños con gastroenteritis aguda, con buen perfil de seguridad.78-85
Wu y col. (AMSTAR 8/11) incluyeron 17 ensayos controlados aleatorizados con un total de 2.861 participantes. En comparación con el placebo, los probióticos redujeron significativamente la duración de la diarrea (12 ECA, n = 1907, con una diferencia media de -21,33 horas [IC del 95%: -29,74 a -12,91], aunque con alta heterogeneidad, I2 = 86%). Además, disminuyeron el tiempo de hospitalización (ocho ECA, n = 1606, con una diferencia media de -0,83 días [IC 95%: -1,53 a -0,12] y alta heterogeneidad, I2 = 96%) y el riesgo de diarrea persistente a partir del día 4 (seis ECA, n = 1093, con una diferencia de riesgo de -0,13 [IC 95%: -0,17 a -0,09], sin heterogeneidad). Se concluye que el uso de probióticos junto a la terapia de rehidratación son manejos seguros y eficaces para reducir la duración de la diarrea en niños con diarrea aguda y deshidratación.76,80,83,86-97
Huang y col. (AMSTAR 11/11) analizaron doce artículos con 744 pacientes y encontró que el uso de probióticos resultó en una disminución significativa en la duración de la diarrea en comparación con el grupo de control (SMD: -0,74 [IC del 95%: -1,11 a -0,37], p < 0,001). Además, se observó que la eficacia del tratamiento para la diarrea después de dos días fue mayor en el grupo de probióticos, con un OR de 2,12 (IC del 95%: 1,47-3,05; p < 0,001), y la estancia hospitalaria fue más corta, con una SMD de -0,60 días (IC del 95%: -0,74 a -0,47; p < 0,001).71,98-103
Fu y col. (AMSTAR 9/11) incluyeron 10 estudios con un total de 1.282 niños con gastroenteritis aguda. El uso de Saccharomyces boulardii en estos niños redujo eficazmente la duración de la diarrea en 19,7 horas (IC del 95%: -24,87, -14,52) y disminuyó el tiempo de hospitalización en 0,91 días (IC del 95%: -1,28, -0,54), comparado con el grupo de control. El RR de diarrea persistente después de un día de tratamiento fue significativamente menor en el grupo tratado (RR = -0,31 [IC del 95%: 0,59 a 0,03]), y aún más después de tres días de tratamiento (RR = 0,52 [IC del 95%: 0,41 a 0,66]). Además, la frecuencia de episodios de diarrea se redujo en 1,03 (IC del 95%: -1,53 a 0,53) después de tres días de tratamiento, concluyendo que Saccharomyces boulardii es efectivo y seguro para mejorar los síntomas de la diarrea en niños con gastroenteritis aguda.80,81,89,104-108
Cheng y col. (AMSTAR 10/11), en su revisión sistemática y metaanálisis, incluyó 15 ensayos controlados aleatorizados con 1.765 niños, encontrando que el uso de L. acidophilus redujo la duración de la diarrea en comparación con el placebo o ningún tratamiento; aunque este efecto no fue estadísticamente significativo cuando se usó una sola cepa probiótica. Sin embargo, L. acidophilus mostró efectividad cuando se administró a una dosis diaria de ≥ 109 CFU. La reducción en la duración de la diarrea no mostró diferencias significativas entre niños de países asiáticos, europeos o americanos. Además, L. acidophilus disminuyó la frecuencia de diarrea desde el día 2 hasta el día 5, siendo estadísticamente significativa en el día 3. Cuando se administró a altas dosis, L. acidophilus demostró beneficios tanto en la duración como en la frecuencia de la diarrea, con datos de calidad moderada a baja.70,109-115
Higuchi y col. (AMSTAR 9/11) incluyeron 14 estudios con un total de 878 participantes. Se observó que los niños que recibieron probióticos tuvieron una menor incidencia de diarrea prolongada (más de 48 horas), con una reducción del RR de 0,70 (IC del 95%: 0,59 a 0,83). La duración total de la diarrea fue 23,45 horas más corta en el grupo que recibió probióticos (IC del 95%: 18,22-26,69). Además, la hospitalización se redujo en 17,73 horas (IC del 95%: 6,9-28,56) en los niños tratados con probióticos. El uso de probióticos en la gastroenteritis aguda infantil podría mejorar los síntomas y acortar la duración de la diarrea aproximadamente un día con evidencia limitada.116
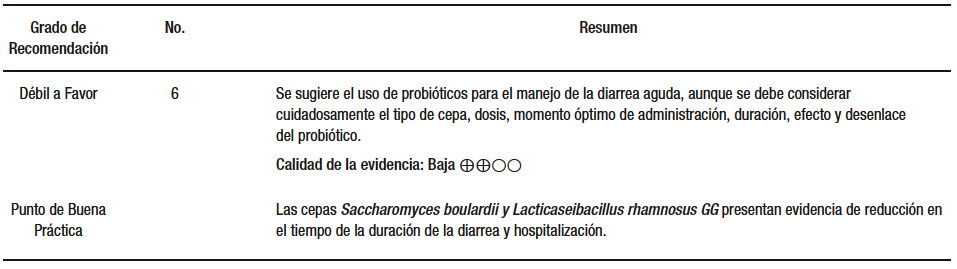
En conclusión, y concordancia con las guías realizadas por las sociedades europeas (ESPGHAN/ESPID) para el manejo de la diarrea aguda en niños, dada la heterogeneidad de los estudios, podemos decir que las cepas probióticas L. rhamnosus GG, Saccharomyces boulardii CNCM I-745 (dosis de ≥ 1010 UFC/día y 250-750 mg/día durante 5 a 7 días respectivamente) poseen una certeza de la evidencia baja y un grado de recomendación débil. L. reuteri DSM 17938 tiene muy baja calidad de evidencia para la reducción de la duración de la diarrea y débil grado de recomendación con dosis de 108 – 4×108 UFC/día durante 5 días. Respecto a las cepas que no tienen recomendación o suficiente evidencia de recomendación encontramos a Bifidobacteriumlactis BB 12, Escherichia coli Nissle 1917, Bacillus clausii, y combinaciones de L helveticus R0052 y L rhamnosus R001, B. lactis B12 + S. thermophilus TH4L, L. acidophius. acidophilus + B. bifidum L. acidophilus + B. infantis. (Tabla 3)
Tabla 3. Utilidad de los probióticos en la diarrea aguda
Pregunta 4. ¿Cuáles son los probióticos útiles en la diarrea secundaria al uso de antibióticos?
La diarrea secundaria al uso de antibióticos ha sido una patología que se ha incrementado desde la utilización indiscriminada de los mismos, creando resistencia y destruyendo una gran cantidad de cepas microbianas en el intestino.
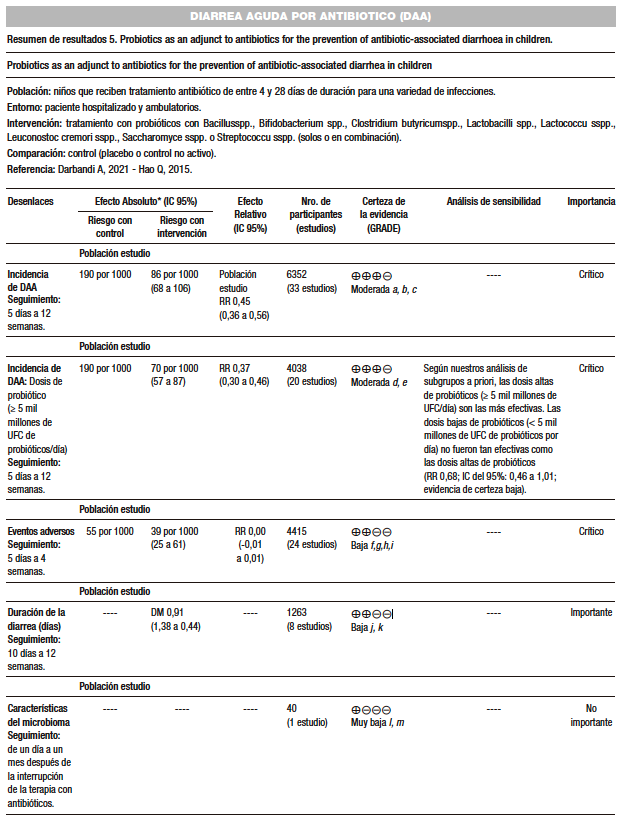
Guo y col. (AMSTAR 11/11) incluyeron 33 estudios con 6.352 participantes. Los probióticos evaluados fueron: Bacillus spp., Bifidobacterium spp., Clostridium butyricum, Lactobacilli spp., Lactococcus spp., Leuconostoc cremoris, Saccharomyces spp., o Streptococcus spp., solos o en combinación. Todos los ensayos informaron efectos beneficiosos de los probióticos en comparación con el grupo control, el placebo, o el control con ningún tratamiento. Después de cinco días a 12 semanas de seguimiento, la incidencia de DAA en el grupo de probióticos fue del 12% en comparación con el 19% en el grupo de control (RR 0,61 [IC del 95%: 0,49 a 0,77]; p < 0,00001; I² = 70%). También se observó que al utilizar dosis altas (mayor de 5 mil millones de UFC por día) la respuesta era mucho más efectiva. Los efectos adversos (EA) por el uso de los probióticos se reportaron en mínimos porcentajes en un metaanálisis con 24 ensayos con 4.415 participantes y fueron valorados después del uso entre 5 días a 4 semanas. El 4% de los participantes que recibieron probióticos tuvo un EA en comparación con el 6% de los participantes del grupo de control
(p < 0,00001). Los EA más comunes fueron erupción, náuseas, gases, flatulencias, distensión abdominal y estreñimiento.117
Aunque no se observaron eventos adversos graves entre los niños hospitalizados y ambulatorios, otros estudios observacionales no incluidos en esta revisión han reportado eventos adversos graves en niños con compromiso inmunológico y por el uso de catéteres intravenosos centrales, debido a la translocación bacteriana y/o fúngica.
Goodman y col. (AMSTAR 9/11) incluyeron 42 estudios con 11.305 participantes; reportaron que la administración en conjunto de probióticos y antibióticos redujeron el riesgo de DAA en adultos en un 37% (IC del 95%: 0,54 a 0,73), p < 0,00001). Además, las dosis altas tuvieron un mejor efecto protector (p < 0,01), y los géneros Lactobacillus y Bifidobacteria fueron los más efectivos.118-126
Se concluye que los probióticos Lacticaseibacillus rhamnosus GG o el S. boulardii CNCM I-745, endosis altas e iniciados simultáneamente con el tratamiento antibiótico son efectivos para prevenir la DAA, sin atribuirles eventos adversos graves con su uso. (Tabla 4)
Tabla 4. Utilidad de los probióticos en la diarrea secundaria al uso de antibióticos

Pregunta 5. ¿Los probióticos son útiles para reducir la incidencia de infecciones respiratorias?
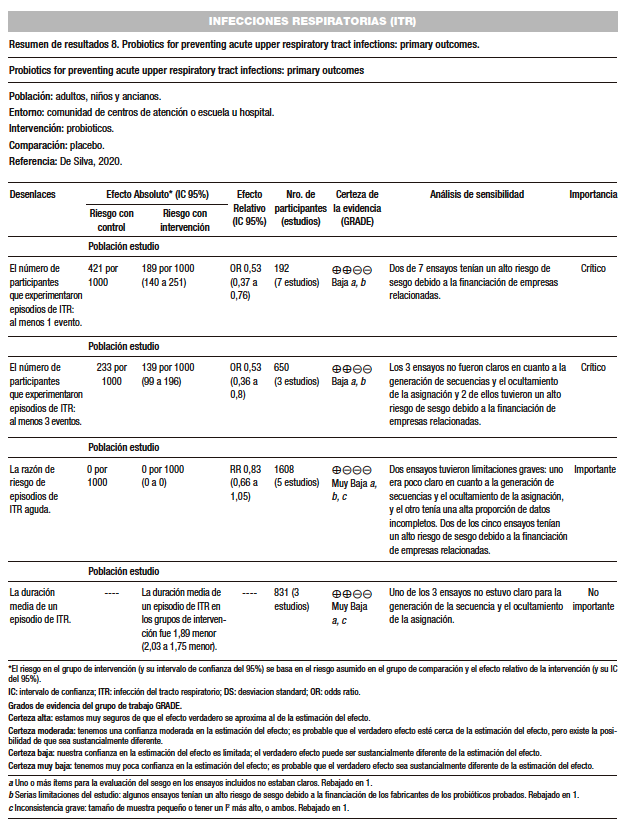
Darbandi y col. (AMSTAR 10/11) revisaron un total de 27 ensayos clínicos realizados en 9.433 pacientes con infección del tracto respiratorio (ITR), y se encontró que los probióticos podrían aumentar significativamente los niveles plasmáticos de citoquinas, además de potenciar el efecto de la vacuna contra la influenza y la calidad de vida, reducir la titulación viral, la incidencia y duración de las infecciones respiratorias. Por lo tanto, sugerimos que los probióticos podrían constituir un tratamiento complementario racional para las enfermedades con ITR y ser una opción viable para respaldar una recuperación más rápida. Sin embargo, la calidad de la evidencia fue baja o muy baja.127-134
Hao y col. (AMSTAR 9/11) investigaron el impacto de los probióticos en la incidencia de infecciones respiratorias agudas (IRA) en un total de 12 ensayos que incluyeron 3.720 participantes de diversas edades, tanto niños, adultos como personas mayores. Los resultados indicaron que los probióticos fueron más efectivos que el placebo en varios aspectos evaluados, ya que se observó una reducción significativa en el número de participantes que experimentaron episodios de IRA (evidencia de baja calidad). Además, se encontró una disminución en la duración media de los episodios de IRA (DM: -1,89 [IC del 95%: -2,03 a -1,75]; p < 0,001, evidencia de baja calidad).135
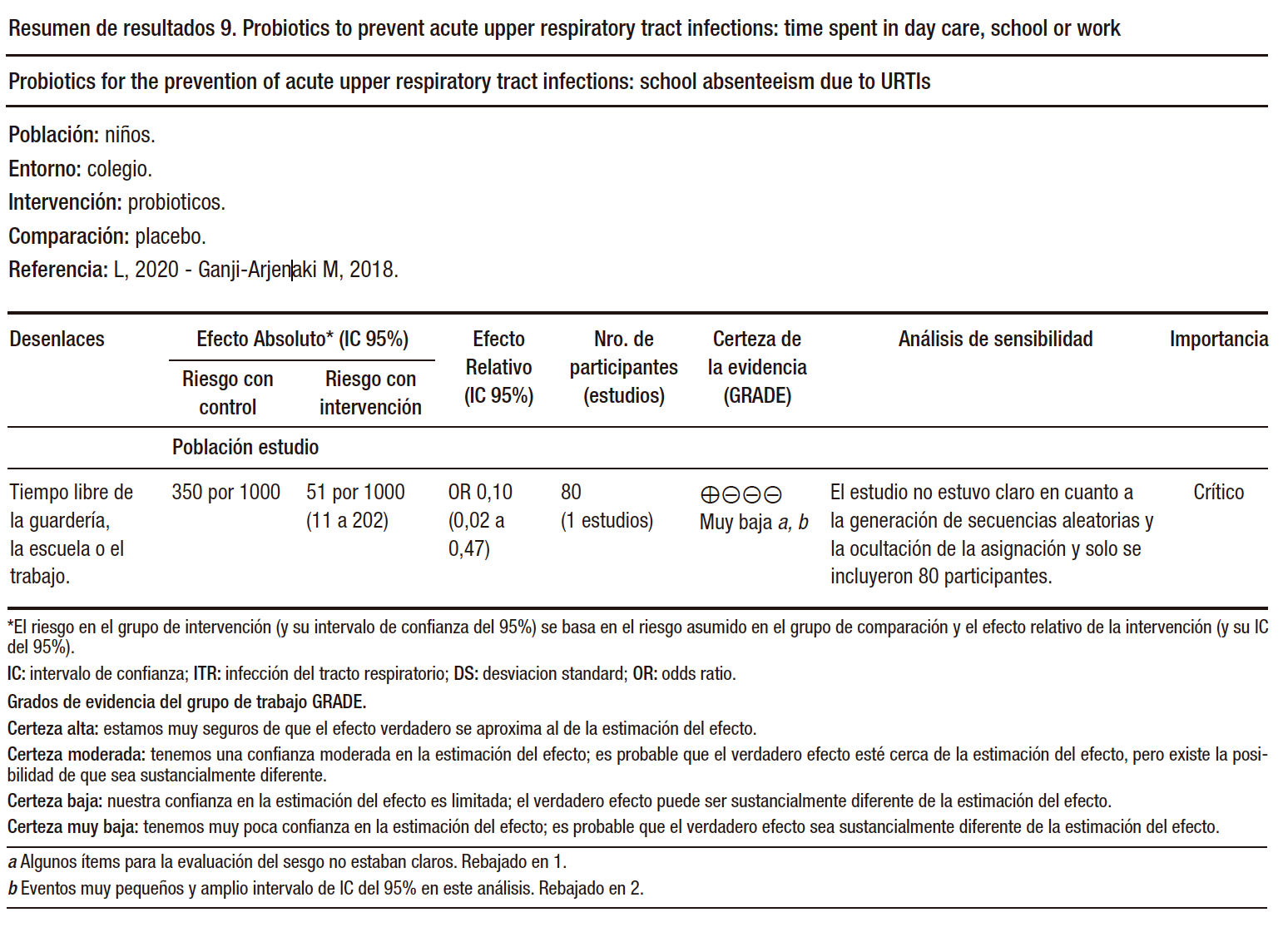
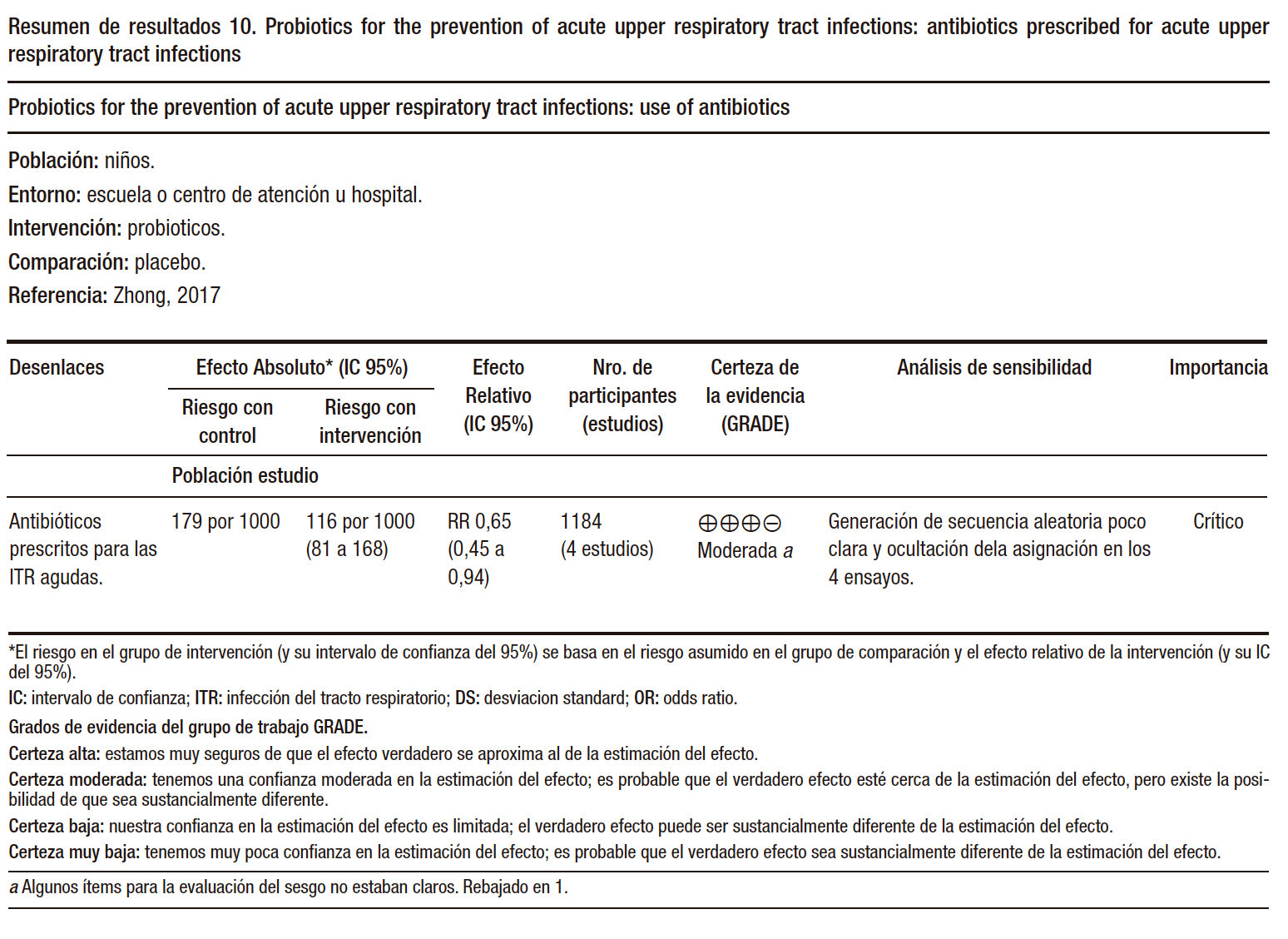
En cuanto a la prescripción de antibióticos para las IRA, se observó una reducción significativa (OR 0,65 [IC del 95%: 0,45 a 0,94], evidencia de calidad moderada), así como en el ausentismo escolar relacionado con resfriados (OR 0,10 [IC del 95%: 0,02 a 0,47], evidencia de calidad muy baja).
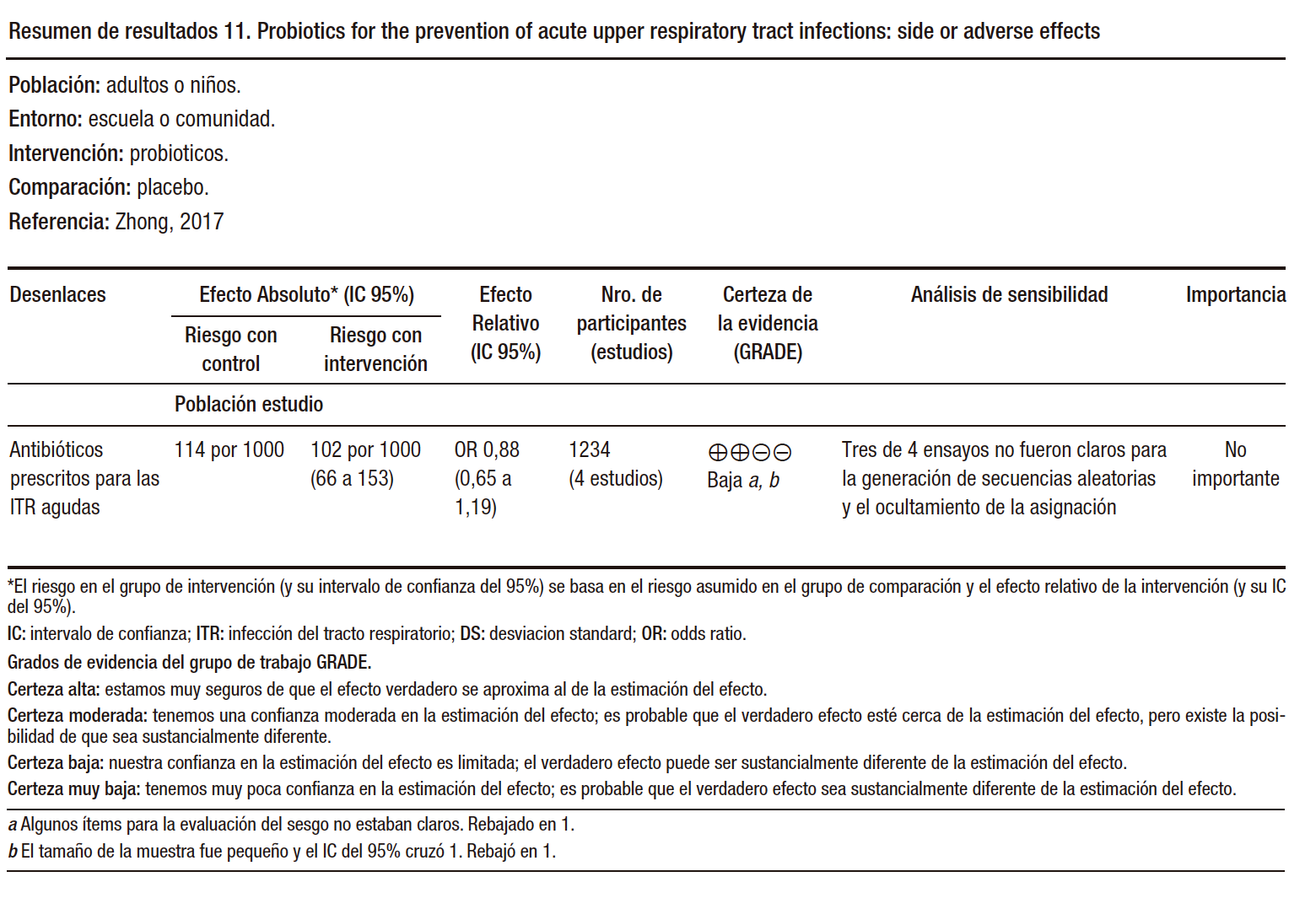
Sin embargo, no se encontraron diferencias significativas entre los probióticos y un placebo en la razón de tasas de episodios de IRA (razón de tasas 0,83 [IC del 95%: 0,66 a 1,05]; p = 0,12, evidencia de calidad muy baja) ni en la incidencia de eventos adversos (OR 0,88 [IC del 95%: 0,65 a 1,19]; p = 0,40, evidencia de baja calidad).
Los efectos secundarios de los probióticos fueron mínimos, siendo los síntomas gastrointestinales los más comunes. Además, se encontró heterogeneidad significativa en algunos subgrupos analizados, lo cual afectó la calidad baja o muy baja de la evidencia obtenida.
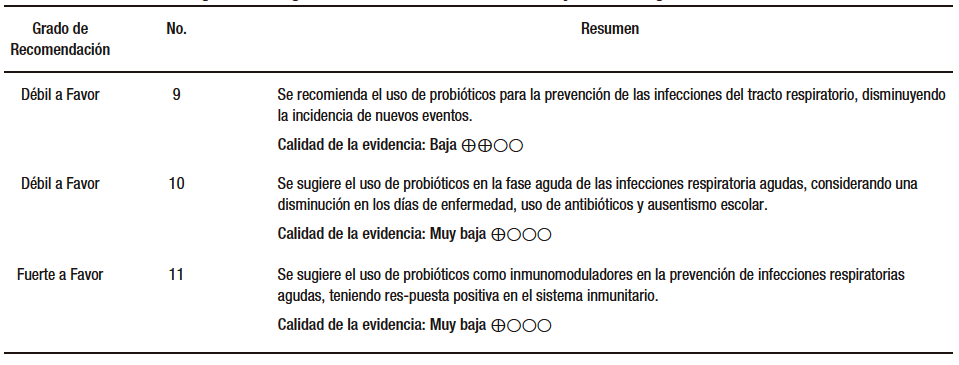
En resumen, este estudio sugiere que los probióticos podrían ser beneficiosos en la prevención y manejo de las IRA al reducir el número episodios y la duración media de cada episodio de IRA, disminuir el uso de los antibióticos y el ausentismo escolar relacionado con el resfriado, con calidad de la evidencia baja o muy baja. (Tabla 5)
Tabla 5. Utilidad de los probióticos para disminuír la incidencia de infecciones respiratorias
Pregunta 6. ¿Los probióticos son útiles para tener una menor incidencia de alergias?
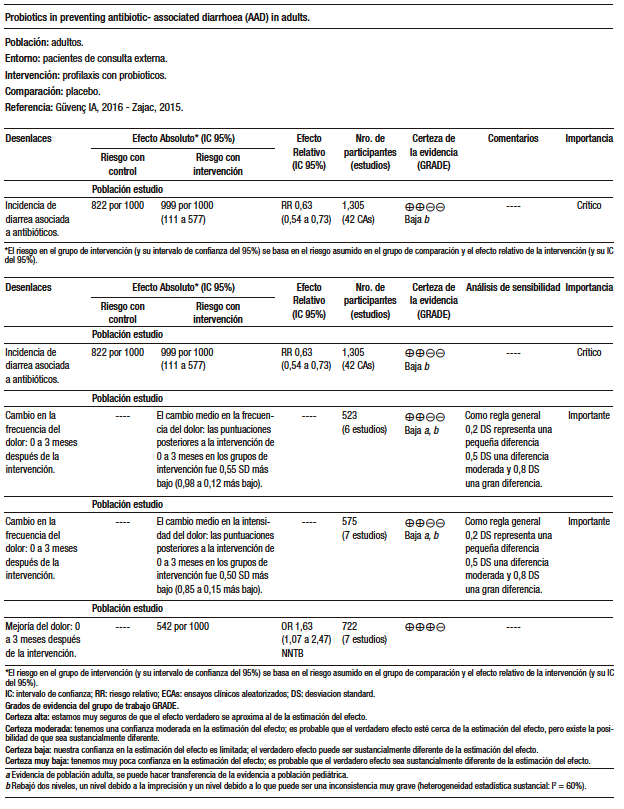
Güvenç y col. (AMSTAR 9/11) incluyeron 22 estudios aleatorizados, doble ciego, controlados con placebo. Diecisiete ensayos mostraron un beneficio clínico significativo de los probióticos, mientras que ocho ensayos mostraron una mejora significativa en los parámetros inmunológicos en comparación con el placebo. Los cinco estudios con cepas de Lacticaseibacillus paracasei (LP-33) demostraron mejoras clínicamente significativas en comparación con el placebo. Los probióticos mostraron una reducción significativa en los puntajes de síntomas nasales y oculares, además de mejoría en los índices de calidad de vida (QoL) en cuanto a síntomas totales, nasales y oculares en comparación con placebo (SMD (diferencia media estándar) 1,84; p 0,001; SMD 2,30; p 0,006; y SMD 3,11; p 0,005, respectivamente). Aunque la heterogeneidad fue alta, en el análisis de subgrupos la SMD para los síntomas nasales y oculares totales de los pacientes con AR estacional y para las puntuaciones de QoL nasal para estudios con la cepa LP-33 fueron significativas y homogéneas. Las puntuaciones de obstrucción nasal, rinorrea y prurito nasal fueron significativamente más bajas en el grupo de probióticos en comparación con el placebo.136-150
Zajac (AMSTAR 9/11) identificó un total de 23 estudios con 1.919 pacientes. Diecisiete estudios mostraron un beneficio clínico significativo del uso de probióticos en comparación con el placebo, mientras que 6 ensayos no mostraron ningún beneficio. Entre los ensayos elegibles para el metaanálisis, el uso de probióticos dio como resultado una mejora significativa en las puntuaciones del score de calidad de vida para rinitis (RQLQ) en comparación con el placebo. Los probióticos no tuvieron efecto sobre el score total de síntomas de rinitis (RTSS) la SMD (diferencia media estándar) fue de −0,36; p = 0,13 y en los niveles de IgE total (SMD 0,01; p = 0,94), aunque hubo una tendencia hacia una reducción de la IgE específica de antígeno (SMD 0,20; p = 0,06) en el grupo placebo en comparación con el probiótico.142-144,151-153
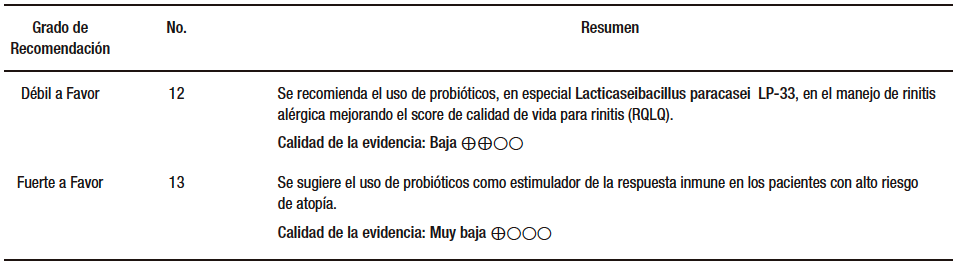
En conclusión, se evidencia un beneficio potencial de los probióticos en el tratamiento de las alergias respiratorias, especialmente con el Lacticaseibacillus paracasei (LP-33). Esto se demostró tanto clínica como inmunológicamente. La rinorrea, la obstrucción y el prurito nasal, además de la relación Th1:Th2, disminuyeron con el uso de los probióticos. (Tabla 6)
Tabla 6. Utilidad de los probióticos para tener una incidencia menor de alergias
Pregunta 7. ¿Son útiles los probióticos para el dolor abdominal funcional?
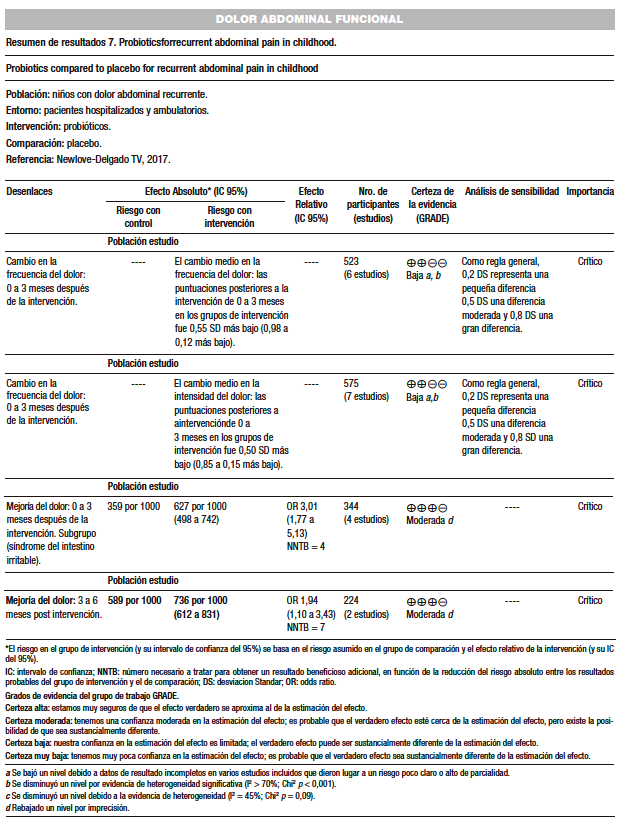
Newlove-Delgado y col. (AMSTAR 10/11) incluyeron 19 ECA con un total de 1.453 participantes, con un seguimiento que varió de uno a cinco meses. Los participantes tenían entre 4 y 18 años, provenían de ocho países diferentes, y fueron reclutados principalmente de clínicas de gastroenterología pediátrica. La edad media en el momento del reclutamiento osciló entre 6,3 y 13,1 años. Los estudios se dividieron en cuatro categorías: ensayos de intervenciones basadas en probióticos (13 estudios), ensayos de intervenciones basadas en fibra (cuatro estudios), un ensayo de dieta baja en FODMAP (oligosacáridos, disacáridos, monosacáridos y polioles fermentables) y un ensayo de dieta restringida en fructosa. Se encontró que los niños tratados con probióticos informaron una mayor reducción en la frecuencia del dolor entre cero y tres meses después de la intervención comparado con el placebo (DME: -0,55, [IC del 95%: -0,98 a -0,12]) en seis ensayos que incluyeron 523 niños. También hubo una disminución en la intensidad del dolor en el grupo de intervención (DME: -0,50 [IC del 95%: -0,85 a -0,15]) en siete estudios con 575 niños. Sin embargo, la evidencia de estos resultados se consideró de baja calidad mediante GRADE. El número estimado necesario para tratar a fin de lograr un resultado beneficioso adicional (NNTB) fue de ocho, lo que significa que ocho niños necesitarían recibir probióticos para que uno experimente una mejoría en el dolor en esa escala de tiempo. La evidencia de este resultado se consideró de calidad moderada debido a la heterogeneidad significativa. Los niños con síntomas de síndrome del intestino irritable tratados con probióticos tenían más probabilidades de experimentar una mejoría en el dolor entre cero y tres meses después de la intervención, y más probabilidades de experimentar una mejoría del dolor entre tres y seis meses. Se encontró que los niños tratados con intervenciones basadas en fibra no tenían más probabilidades de experimentar una mejoría en el dolor entre cero y tres meses después de la intervención que los niños que recibieron placebo, tampoco hubo reducción en la intensidad del dolor en comparación con el placebo. No fue posible realizar ningún metaanálisis de los estudios de las dietas bajas en FODMAP y las dietas restringidas en fructosa, debido a que no hubo suficientes estudios que incluyeran estos resultados o usaran medidas comparables para evaluarlos.154
En conclusión, los probióticos pueden ser efectivos para mejorar el dolor abdominal en los niños con DAR. El L. reuteri DSM 17938 (dosis de 108 CFU a 2×108 CFU/día) podrían reducir la intensidad del dolor abdominal con certeza de la evidencia moderada, grado de recomendación débil; y el L. rhamnosus GG (dosis de 109 CFU a 3×109 CFU dos veces al día) podría reducir la frecuencia e intensidad del dolor en niños con síndrome del intestino irritable con certeza de la evidencia moderada y grado de recomendación débil. (Tabla 7)
Tabla 7. Utilidad de los probióticos para el dolor abdominal funcional

Pregunta 8. ¿Son útiles los probióticos en la alergia a las proteínas de leche de vaca (APLV)?
De Silva y col. (AMSTAR 10/11) incluyeron un total de 10 ECA (n = 845; probióticos, 422; control, 423) con riesgo de sesgo de bajo a incierto. El objetivo fue revisar sistemáticamente la eficacia y la seguridad de los probióticos en el tratamiento de la APLV. Los resultados primarios fueron la resolución de la hematoquecia y la adquisición de tolerancia a la proteína de leche de vaca (PLV) a los 6, 12, 24 y 36 meses. Los resultados secundarios incluyeron el efecto sobre los síntomas alérgicos (índice SCORAD), crecimiento, microbiota intestinal y efectos adversos. El metaanálisis mostró que la suplementación con probióticos no se asoció con una resolución más temprana de la hematoquecia (n = 87; RR: 1,45 (IC del 95%: 0,96-2,18), p = 0,08; nivel de evidencia muy bajo), en presunta APLV. En la APLV confirmada, los probióticos se asociaron con una mayor tasa de adquisición de tolerancia a la PLV al final de los 3 años en comparación con el placebo (RR: 1,47 [IC del 95%: 1,17-1,84]; p = 0,0009) con un nivel de evidencia bajo.155
En conclusión, encontramos una evidencia limitada y de baja calidad a favor, esto indica que la administración de suplementos de probióticos podría estar asociada con una adquisición más temprana de tolerancia a la PLV en niños con APLV. (Tabla 8)
Tabla 8. Utilidad de los probióticos en la alergia a la proteína de leche de vaca

Pregunta 9. ¿Los probióticos pueden utilizarse en el tratamiento durante la remisión y el mantenimiento de las formas leves de enfermedad inflamatoria intestinal (EII)?
Kaur y col. (AMSTAR 11/11) incluyeron 14 estudios con 865 participantes. Doce de los estudios evaluaron participantes adultos y dos estudios evaluaron participantes pediátricos con colitis ulcerativa leve a moderada (edad promedio entre 12,5 y 47,7 años). Los estudios compararon probióticos con placebo, probióticos con 5-ASA (Ácido 5-aminosalicílico) y una combinación de probióticos más 5-ASA en comparación con solo 5-ASA. Solo 7 estudios usaron una sola cepa probiótica y siete usaron una mezcla de cepas. La duración de los estudios varió entre 2 y 52 semanas. Se encontró que los probióticos podían inducir la remisión clínica en comparación con el placebo (RR: 1,73 [IC del 95%: 1,19 a 2,54]). El riesgo de sesgo fue alto. Los eventos adversos informados incluyeron distensión abdominal y molestias, sin presentarse eventos adversos graves.156
En un solo estudio se demostró que los probióticos combinados con 5ASA mejoraban levemente la inducción de la remisión.
Ganji-Arjenaki y col. (AMSTAR 10/11) incluyeron un total de 9 ECA que evaluaron específicamente la eficacia de los probióticos para lograr una respuesta clínica en pacientes con enfermedad inflamatoria intestinal (EII). También se evaluó la eficacia de especies variantes de probióticos en diferentes condiciones y la influencia de la calidad del estudio en los resultados de los ensayos controlados aleatorios (ECA).157-162
El análisis de 9 ensayos mostró que los probióticos no tuvieron un efecto significativo sobre la enfermedad de Crohn (EC) (p = 0,07), pero el análisis de 3 ensayos en niños con EII reveló una ventaja significativa (p < 0,01). El análisis de 18 ensayos reveló que los probióticos en pacientes con colitis ulcerativa (CU) en diferentes condiciones tenían efectos significativos (p = 0,007). Los probióticos VSL#3 en pacientes con CU tuvieron un efecto significativo (p < 0,01). La combinación de probióticos Lacticaseibacillus y prebióticos tuvo un efecto significativo (p = 0,03) solo en pacientes con CU. La combinación de probióticos Saccharomyces boulardii, Lacticaseibacillus y VSL#3 también mostró una tendencia hacia la eficacia (p = 0,057).
En conclusión, en niños con EII, la combinación de Lacticaseibacillus con probióticos VSL#3 tuvo un efecto significativo (p < 0,01). Los probióticos son beneficiosos en la EII, especialmente los combinados en la CU (Tabla 9).
Tabla 9. Utilidad de los probióticos durante la remisión y el mantenimiento en formas leves de enfermedad inflamatoria intestinal 
Pregunta 10. ¿Se pueden utilizar los probióticos en los casos de sobrecrecimiento bacteriano del intestino delgado (SIBO)? ¿Qué ventajas tienen?
Zhong (AMSTAR 9/11) realizó un metaanálisis con 14 artículos a texto completo, 8 resúmenes, y 18 estudios para evaluar la eficacia de los probióticos en la prevención o el tratamiento del sobrecrecimiento bacteriano del intestino delgado (SIBO). La eficacia de la prevención se evaluó mediante la incidencia de SIBO en el grupo probiótico, y la eficacia del tratamiento mediante la tasa de descontaminación de SIBO, la reducción de la concentración de H2 y la mejora de los síntomas. Los pacientes tratados con probióticos mostraron una tendencia insignificante hacia una baja incidencia de SIBO (RR = 0,54 [IC del 95%: 0,19-1,52]; p = 0,24). La tasa conjunta de descontaminación por SIBO fue del 62,8% (IC del 95%: 51,5% a 72,8%). El grupo probiótico mostró una tasa de descontaminación de SIBO significativamente mayor que el grupo no probiótico (RR: 1,61 [IC 95%: 1,19-2,17]; p < 0,05). Asimismo, la concentración de H2 se redujo significativamente entre los usuarios de probióticos (DMP = 36,35 ppm [IC 95%: 44,23 a 28,47 ppm]; p < 0,05).163-167
Aunque los probióticos produjeron una marcada disminución de las puntuaciones de dolor abdominal, no redujeron significativamente la frecuencia diaria de deposiciones. Por otra parte, podrían descontaminar eficazmente el SIBO, disminuir la concentración de H2 y aliviar el dolor abdominal, pero fueron ineficaces para prevenir el SIBO. Por lo tanto, no se puede hacer ninguna recomendación a favor o en contra del uso de probióticos en el tratamiento o la prevención del SIBO, con calidad de evidencia muy baja (Tabla 10).
Tabla 10. Utilidad de los probióticos en SIBO

Conclusión
La aplicación de los probióticos en pediatría podría representar un campo bastante prometedor para mejorar la salud infantil. Los probióticos con suficiente evidencia son Saccharomyces boulardii CNCM I-745, Limosilactobacillus reuteri strain DSM 17938, Lacticaseibacillus rhamnosus GG y Lactobacillus reuteri DSM 17938. Se ha visto un efecto favorable en la enterocolitis necrotizante, la diarrea aguda en los niños, la diarrea por uso de antibióticos y en el cólico del lactante. En otras patologías, como el SIBO, son necesarios más estudios para verificar su verdadera acción; sin embargo, en el síndrome de intestino irritable su acción al parecer es adecuada, disminuyendo el dolor y la distensión abdominal. En la APLV se observó una evidencia limitada y estaría justificada para una adquisición más temprana de tolerancia a la PLV. Respecto al uso de los probióticos en el estímulo del sistema inmunológico y la mejora de alergias y enfermedades respiratorias, se encontró evidencia favorable para el tratamiento de las mismas. Probablemente, en el futuro tendremos más evidencia del uso de probióticos no solo en las patologías aquí referidas, sino también en otras, con nuevas cepas específicas individualizando los tratamientos.
Propiedad intelectual. Los autores declaran que los datos, las figuras y las tablas presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Asociación Colombiana de Probióticos y Prebióticos (ACoPyP). Colegio Colombiano de Gastroenterología, Hepatología y Nutrición Pediátricas (COLGAHNP).
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2024 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Alonso Medina Monroy F, Galindo Ángel A F, Higuera Carrillo M y col. Guía colombiana para el uso de probióticos en patologías pediátricas. Acta Gastroenterol Latinoam. 2024;54(2):160-191. https://doi.org/10.52787/agl.v54i2.402
Referencias
- Hill C, Guarner F, Reid G, et al. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol 2014; 11: 506-514.
- Lomax AR, Calder PC. Probiotics, immune function, infection and inflammation: a review of the evidence from studies conducted in humans. Curr Pharm Des 2009; 15: 1428-1518.
- Brouwers MC, Kho ME, Browman GP, et al. AGREE II: advancing guideline development, reporting, and evaluation in health care. Prev Med 2010; 51: 421-424.
- Guyatt GH, Oxman AD, Vist GE, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ 2008; 336: 924-926.
- Shea BJ, Grimshaw JM, Wells GA, et al. Development of AMSTAR: a measurement tool to assess the methodological quality of systematic reviews. BMC Med Res Methodol 2007; 7: 10.
- Higgins JPT, Thomas J, Chandler J, et al. Cochrane Handbook for Systematic Reviews of Interventions. John Wiley & Sons, 2019.
- Sharif S, Meader N, Oddie SJ, et al. Probiotics to prevent necrotising enterocolitis in very preterm or very low birth weight infants. Cochrane Database Syst Rev 2023; 7: CD005496.
- Balasubramanian H, Ananthan A, Rao S, et al. Probiotics for Preterm Infants in India – Systematic Review and Meta-Analysis of Randomized Controlled Trials. Indian J Pediatr 2020; 87: 817-825.
- Shashidhar A, Suman Rao PN, Nesargi S, et al. Probiotics for Promoting Feed Tolerance in Very Low Birth Weight Neonates – A Randomized Controlled Trial. Indian Pediatr 2017; 54: 363–367.
- Dutta S, Ray P, Narang A. Comparison of stool colonization in premature infants by three dose regimes of a probiotic combination: a randomized controlled trial. Am J Perinatol 2015; 32: 733–740.
- Roy A, Chaudhuri J, Sarkar D, et al. Role of Enteric Supplementation of Probiotics on Late-onset Sepsis by Candida species in Preterm Low Birth Weight Neonates: A Randomized, Double Blind, Placebo-controlled Trial. N Am J Med Sci 2014; 6: 50–57.
- Samanta M, Sarkar M, Ghosh P, et al. Prophylactic probiotics for prevention of necrotizing enterocolitis in very low birth weight newborns. J Trop Pediatr 2009; 55: 128-131.
- Tewari VV, Dubey SK, Gupta G. Bacillus clausii for Prevention of Late-onset Sepsis in Preterm Infants: A Randomized Controlled Trial. J Trop Pediatr 2015; 61: 377-385.
- Deshmukh M, Patole S. Prophylactic Probiotic Supplementation for Preterm Neonates-A Systematic Review and Meta-Analysis of Nonrandomized Studies. Adv Nutr 2021; 12: 1411–1423.
- Luoto R, Matomäki J, Isolauri E, et al. Incidence of necrotizing enterocolitis in very-low-birth-weight infants related to the use of Lactobacillus GG. Acta Paediatr 2010; 99: 1135–1138.
- Patole SK, Rao SC, Keil AD, et al. Benefits of Bifidobacterium breve M-16V Supplementation in Preterm Neonates – A Retrospective Cohort Study. PLoS One 2016; 11: e0150775.
- Rolnitsky A, Ng E, Asztalos E, et al. A Quality Improvement Intervention to Reduce Necrotizing Enterocolitis in premature infants with Probiotic Supplementation. Pediatr Qual Saf 2019; 4: e201.
- Dang S, Shook L, Garlitz K, et al. Nutritional outcomes with implementation of probiotics in preterm infants. J Perinatol 2015; 35: 447-450.
- Denkel LA, Schwab F, Garten L, et al. Protective Effect of Dual-Strain Probiotics in Preterm Infants: A Multi-Center Time Series Analysis. PLoS One 2016; 11: e0158136.
- Escribano E, Zozaya C, Madero R, et al. Increased incidence of necrotizing enterocolitis associated with routine administration of InfloranTM in extremely preterm infants. Benef Microbes 2018; 9: 683-690.
- Guthmann F, Arlettaz Mieth RP, Bucher HU, et al. Short courses of dual-strain probiotics appear to be effective in reducing necrotising enterocolitis. Acta Paediatr 2016; 105: 255-259.
- Hoyos AB. Reduced incidence of necrotizing enterocolitis associated with enteral administration of Lactobacillus acidophilus and Bifidobacterium infantis to neonates in an intensive care unit. Int J Infect Dis 1999; 3: 197-202.
- Janvier A, Malo J, Barrington KJ. Cohort study of probiotics in a North American neonatal intensive care unit. J Pediatr 2014; 164: 980-985.
- Lambæk ID, Fonnest G, Gormsen M, et al. Probiotics to prevent necrotising enterocolitis in very preterm infants. Dan Med J; 63, https://www.ncbi.nlm.nih.gov/pubmed/26931192 (2016)
- Li D, Rosito G, Slagle T. Probiotics for the prevention of necrotizing enterocolitis in neonates: an 8-year retrospective cohort study. J Clin Pharm Ther 2013; 38: 445-449.
- Patel S, Chaudhari M, Kadam S, et al. Standardized feeding and probiotic supplementation for reducing necrotizing enterocolitis in preterm infants in a resource limited set up. Eur J Clin Nutr 2018; 72: 281-287.
- Singh B, Shah PS, Afifi J, et al. Probiotics for preterm infants: A National Retrospective Cohort Study. J Perinatol 2019; 39: 533-539.
- Sharpe J, Way M, Koorts PJ, et al. The availability of probiotics and donor human milk is associated with improved survival in very preterm infants. World J Pediatr 2018; 14: 492-497.
- Samuels N, van de Graaf R, Been JV, et al. Necrotising enterocolitis and mortality in preterm infants after introduction of probiotics: a quasi-experimental study. Sci Rep 2016; 6: 31643.
- Robertson C, Savva GM, Clapuci R, et al. Incidence of necrotising enterocolitis before and after introducing routine prophylactic Lactobacillus and Bifidobacterium probiotics. Arch Dis Child Fetal Neonatal Ed 2020; 105: 380-386.
- Gao X, Wang Y, Shi L, et al. Effect and Safety of Saccharomyces boulardii for Neonatal Necrotizing Enterocolitis in Pre-term Infants: A Systematic Review and Meta-Analysis. J Trop Pediatr; 67. Epub ahead of print 2 July 2021. DOI: 10.1093/tropej/fmaa022
- Xu L, Wang Y, Wang Y, et al. A double-blinded randomized trial on growth and feeding tolerance with Saccharomyces boulardii CNCM I-745 in formula-fed preterm infants. J Pediatr 2016; 92: 296-301.
- Demirel G, Erdeve O, Celik IH, et al. Saccharomyces boulardii for prevention of necrotizing enterocolitis in preterm infants: a randomized, controlled study. Acta Paediatr 2013; 102: e560-5.
- Costalos C, Skouteri V, Gounaris A, et al. Enteral feeding of premature infants with Saccharomyces boulardii. Early Hum Dev 2003; 74: 89-96.
- Ong TG, Gordon M, Banks SS, et al. Probiotics to prevent infantile colic. Cochrane Database Syst Rev 2019; 3: CD012473.
- Baldassarre ME, Di Mauro A, Mastromarino P, et al. Administration of a Multi-Strain Probiotic Product to Women in the Perinatal Period Differentially Affects the Breast Milk Cytokine Profile and May Have Beneficial Effects on Neonatal Gastrointestinal Functional Symptoms. A Randomized Clinical Trial. Nutrients; 8. Epub ahead of print 27 October 2016. DOI: 10.3390/nu8110677
- Indrio F, Riezzo G, Raimondi F, et al. The effects of probiotics on feeding tolerance, bowel habits, and gastrointestinal motility in preterm newborns. J Pediatr 2008; 152: 801-806.
- Indrio F, Di Mauro A, Riezzo G, et al. Prophylactic use of a probiotic in the prevention of colic, regurgitation, and functional constipation: a randomized clinical trial. JAMA Pediatr 2014; 168: 228-233.
- Kukkonen K, Savilahti E, Haahtela T, et al. Long-term safety and impact on infection rates of postnatal probiotic and prebiotic (synbiotic) treatment: randomized, double-blind, placebo-controlled trial. Pediatrics 2008; 122: 8-12.
- Kukkonen K, Savilahti E, Haahtela T, et al. Probiotics and prebiotic galacto-oligosaccharides in the prevention of allergic diseases: a randomized, double-blind, placebo-controlled trial. J Allergy Clin Immunol 2007; 119: 192-198.
- Skonieczna-Żydecka K, Janda K, Kaczmarczyk M, et al. The Effect of Probiotics on Symptoms, Gut Microbiota and Inflammatory Markers in Infantile Colic: A Systematic Review, Meta-Analysis and Meta-Regression of Randomized Controlled Trials. J Clin Med Res; 9. Epub ahead of print 2 April 2020. DOI: 10.3390/jcm9040999
- Savino F, Vandenplas Y. Probiotics and Prebiotics in Pediatrics. MDPI, 2019.
- Savino F, Galliano I, Savino A, et al. Lactobacillus reuteri DSM 17938 Probiotics May Increase CC-Chemokine Receptor 7 Expression in Infants Treated With for Colic. Front Pediatr 2019; 7: 292.
- Szajewska H, Gyrczuk E, Horvath A. Lactobacillus reuteri DSM 17938 for the management of infantile colic in breastfed infants: a randomized, double-blind, placebo-controlled trial. J Pediatr 2013; 162: 257-262.
- Sung V, Hiscock H, Tang MLK, et al. Treating infant colic with the probiotic Lactobacillus reuteri: double blind, placebo controlled randomised trial. BMJ 2014; 348: g2107.
- Aloisio I, Prodam F, Giglione E, et al. Three-Month Feeding Integration With Bifidobacterium Strains Prevents Gastrointestinal Symptoms in Healthy Newborns. Front Nutr 2018; 5: 39.
- Baldassarre ME, Di Mauro A, Tafuri S, et al. Effectiveness and Safety of a Probiotic-Mixture for the Treatment of Infantile Colic: A Double-Blind, Randomized, Placebo-Controlled Clinical Trial with Fecal Real-Time PCR and NMR-Based Metabolomics Analysis. Nutrients; 10. Epub ahead of print 10 February 2018. DOI: 10.3390/nu10020195
- Chau K, Lau E, Greenberg S, et al. Probiotics for infantile colic: a randomized, double-blind, placebo-controlled trial investigating Lactobacillus reuteri DSM 17938. J Pediatr 2015; 166: 74-78.
- Savino F, Cordisco L, Tarasco V, et al. Lactobacillus reuteri DSM 17938 in infantile colic: a randomized, double-blind, placebo-controlled trial. Pediatrics 2010; 126: e526-33.
- Savino F, Galliano I, Garro M, et al. Regulatory T cells and Toll-like receptor 2 and 4 mRNA expression in infants with colic treated with Lactobacillus reuteri DSM17938. Benef Microbes 2018; 9: 917-925.
- Kianifar H, Ahanchian H, Grover Z, et al. Synbiotic in the management of infantile colic: a randomised controlled trial. J Paediatr Child Health 2014; 50: 801-805.
- Fatheree NY, Liu Y, Taylor CM, et al. Lactobacillus reuteri for Infants with Colic: A Double-Blind, Placebo-Controlled, Randomized Clinical Trial. J Pediatr 2017; 191: 170-178.e2.
- Mi G-L, Zhao L, Qiao D-D, et al. Effectiveness of Lactobacillus reuteri in infantile colic and colicky induced maternal depression: a prospective single blind randomized trial. Antonie Van Leeuwenhoek 2015; 107: 1547-1553.
- Nocerino R, De Filippis F, Cecere G, et al. The therapeutic efficacy of Bifidobacterium animalis subsp. lactis BB-12® in infant colic: A randomised, double blind, placebo-controlled trial. Aliment Pharmacol Ther 2020; 51: 110-120.
- Gerasimov S, Gantzel J, Dementieva N, et al. Role of Lactobacillus rhamnosus (FloraActiveTM) 19070-2 and Lactobacillus reuteri (FloraActiveTM) 12246 in Infant Colic: A Randomized Dietary Study. Nutrients; 10. Epub ahead of print 13 December 2018. DOI: 10.3390/nu10121975
- Vassilopoulou L, Spyromitrou-Xioufi P, Ladomenou F. Effectiveness of probiotics and synbiotics in reducing duration of acute infectious diarrhea in pediatric patients in developed countries: a systematic review and meta-analysis. Eur J Pediatr 2021; 180: 2907-2920.
- Isolauri E, Juntunen M, Rautanen T, et al. A human Lactobacillus strain (Lactobacillus casei sp strain GG) promotes recovery from acute diarrhea in children. Pediatrics 1991; 88: 90-97.
- Isolauri E, Kaila M, Mykkänen H, et al. Oral bacteriotherapy for viral gastroenteritis. Dig Dis Sci 1994; 39: 2595-2600.
- Shornikova AV, Casas IA, Isolauri E, et al. Lactobacillus reuteri as a therapeutic agent in acute diarrhea in young children. J Pediatr Gastroenterol Nutr 1997; 24: 399-404.
- Shornikova AV, Casas IA, Mykkänen H, et al. Bacteriotherapy with Lactobacillus reuteri in rotavirus gastroenteritis. Pediatr Infect Dis J 1997; 16: 1103-1107.
- Guarino A, Canani RB, Spagnuolo MI, et al. Oral bacterial therapy reduces the duration of symptoms and of viral excretion in children with mild diarrhea. J Pediatr Gastroenterol Nutr 1997; 25: 516-519.
- Guandalini S, Pensabene L, Zikri MA, et al. Lactobacillus GG administered in oral rehydration solution to children with acute diarrhea: a multicenter European trial. J Pediatr Gastroenterol Nutr 2000; 30: 54-60.
- Rosenfeldt V, Michaelsen KF, Jakobsen M, et al. Effect of probiotic Lactobacillus strains in young children hospitalized with acute diarrhea. Pediatr Infect Dis J 2002; 21: 411-416.
- Rosenfeldt V, Michaelsen KF, Jakobsen M, et al. Effect of probiotic Lactobacillus strains on acute diarrhea in a cohort of nonhospitalized children attending day-care centers. Pediatr Infect Dis J 2002; 21: 417-419.
- Szymański H, Pejcz J, Jawień M, et al. Treatment of acute infectious diarrhoea in infants and children with a mixture of three Lactobacillus rhamnosus strains–a randomized, double-blind, placebo-controlled trial. Aliment Pharmacol Ther 2006; 23: 247-253.
- Chen C-C, Kong M-S, Lai M-W, et al. Probiotics have clinical, microbiologic, and immunologic efficacy in acute infectious diarrhea. Pediatr Infect Dis J 2010; 29: 135-138.
- Nixon AF, Cunningham SJ, Cohen HW, et al. The effect of Lactobacillus GG on acute diarrheal illness in the pediatric emergency department. Pediatr Emerg Care 2012; 28: 1048-1051.
- Lee DK, Park JE, Kim MJ, et al. Probiotic bacteria, B. longum and L. acidophilus inhibit infection by rotavirus in vitro and decrease the duration of diarrhea in pediatric patients. Clin Res Hepatol Gastroenterol 2015; 39: 237-244.
- Freedman SB, Sherman PM, Willan A, et al. Emergency Department Treatment of Children With Diarrhea Who Attend Day Care: A Randomized Multidose Trial of a Lactobacillus helveticus and Lactobacillus rhamnosus Combination Probiotic. Clin Pediatr 2015; 54: 115-1166.
- Park MS, Kwon B, Ku S, et al. The Efficacy of Bifidobacterium longum BORI and Lactobacillus acidophilus AD031 Probiotic Treatment in Infants with Rotavirus Infection. Nutrients; 9. Epub ahead of print 16 August 2017. DOI: 10.3390/nu9080887
- Freedman SB, Williamson-Urquhart S, Farion KJ, et al. Multicenter Trial of a Combination Probiotic for Children with Gastroenteritis. N Engl J Med 2018; 379: 2015-2026.
- Schnadower D, Tarr PI, Casper TC, et al. Lactobacillus rhamnosus GG versus Placebo for Acute Gastroenteritis in Children. N Engl J Med 2018; 379: 2002-2014.
- Pearce JL, Hamilton JR. Controlled trial of orally administered lactobacilli in acute infantile diarrhea. J Pediatr 1974; 84: 26-262.
- Vandenplas Y, De Hert SG, PROBIOTICAL-study group. Randomised clinical trial: the synbiotic food supplement Probiotical vs. placebo for acute gastroenteritis in children. Aliment Pharmacol Ther 2011; 34: 862-867.
- Passariello A, Terrin G, Cecere G, et al. Randomised clinical trial: efficacy of a new synbiotic formulation containing Lactobacillus paracasei B21060 plus arabinogalactan and xilooligosaccharides in children with acute diarrhoea. Aliment Pharmacol Ther 2012; 35: 782-788.
- Francavilla R, Lionetti E, Castellaneta S, et al. Randomised clinical trial: Lactobacillus reuteri DSM 17938 vs. placebo in children with acute diarrhoea–a double-blind study. Aliment Pharmacol Ther 2012; 36: 363-369.
- Collinson S, Deans A, Padua-Zamora A, et al. Probiotics for treating acute infectious diarrhoea. Cochrane Database Syst Rev 2020; 12: CD003048.
- McFarland LV, Srinivasan R, Setty RP, et al. Specific Probiotics for the Treatment of Pediatric Acute Gastroenteritis in India: A Systematic Review and Meta-Analysis. JPGN Rep 2021; 2: e079.
- Burande MA. Comparison of efficacy of Saccharomyces boulardii strain in the treatment of acute diarrhea in children: A prospective, single-blind, randomized controlled clinical trial. J Pharmacol Pharmacother 2013; 4: 205-208.
- Das S, Gupta PK, Das RR. Efficacy and Safety of Saccharomyces boulardii in Acute Rotavirus Diarrhea: Double Blind Randomized Controlled Trial from a Developing Country. J Trop Pediatr 2016; 62: 464-470.
- Riaz M, Alam S, Malik A, et al. Efficacy and safety of Saccharomyces boulardii in acute childhood diarrhea: a double blind randomised controlled trial. Indian J Pediatr 2012; 79: 478-482.
- Aggarwal S, Upadhyay A, Shah D, et al. Lactobacillus GG for treatment of acute childhood diarrhoea: an open labelled, randomized controlled trial. Indian J Med Res 2014; 139: 379-385.
- Basu S, Chatterjee M, Ganguly S, et al. Efficacy of Lactobacillus rhamnosus GG in acute watery diarrhoea of Indian children: a randomised controlled trial. J Paediatr Child Health 2007; 43: 837-842.
- Basu S, Paul DK, Ganguly S, et al. Efficacy of high-dose Lactobacillus rhamnosus GG in controlling acute watery diarrhea in Indian children: a randomized controlled trial. J Clin Gastroenterol 2009; 43: 208-213.
- Misra S, Sabui TK, Pal NK. A randomized controlled trial to evaluate the efficacy of lactobacillus GG in infantile diarrhea. J Pediatr 2009; 155: 129-132.
- Wu H-L, Zhan X. Systematic review with meta-analysis: Probiotics for treating acute diarrhoea in children with dehydration. J Paediatr Child Health 2021; 57: 431-439.
- Dutta P, Mitra U, Dutta S, et al. Randomised controlled clinical trial of Lactobacillus sporogenes (Bacillus coagulans), used as probiotic in clinical practice, on acute watery diarrhoea in children. Trop Med Int Health 2011; 16: 555-561.
- Dalgic N, Sancar M, Bayraktar B, et al. Probiotic, zinc and lactose-free formula in children with rotavirus diarrhea: are they effective? Pediatr Int 2011; 53: 677-682.
- Dinleyici EC, Kara A, Dalgic N, et al. Saccharomyces boulardii CNCM I-745 reduces the duration of diarrhoea, length of emergency care and hospital stay in children with acute diarrhoea. Benef Microbes 2015; 6: 415-421.
- Dinleyici EC, PROBAGE Study Group, Vandenplas Y. Lactobacillus reuteri DSM 17938 effectively reduces the duration of acute diarrhoea in hospitalised children. Acta Paediatr 2014; 103: e300-5.
- Erdoğan O, Tanyeri B, Torun E, et al. The comparition of the efficacy of two different probiotics in rotavirus gastroenteritis in children. J Trop Med 2012; 2012: 787240.
- Pant AR, Graham SM, Allen SJ, et al. Lactobacillus GG and acute diarrhoea in young children in the tropics. J Trop Pediatr 1996; 42: 162-165.
- Simakachorn N, Pichaipat V, Rithipornpaisarn P, et al. Clinical evaluation of the addition of lyophilized, heat-killed Lactobacillus acidophilus LB to oral rehydration therapy in the treatment of acute diarrhea in children. J Pediatr Gastroenterol Nutr 2000; 30: 68-72.
- Ritchie BK, Brewster DR, Tran CD, et al. Efficacy of Lactobacillus GG in aboriginal children with acute diarrhoeal disease: a randomised clinical trial. J Pediatr Gastroenterol Nutr 2010; 50: 619-624.
- Teran CG, Teran-Escalera CN, Villarroel P. Nitazoxanide vs. probiotics for the treatment of acute rotavirus diarrhea in children: a randomized, single-blind, controlled trial in Bolivian children. Int J Infect Dis 2009; 13: 518-523.
- Salazar-Lindo E, Miranda-Langschwager P, Campos-Sanchez M, et al. Lactobacillus casei strain GG in the treatment of infants with acute watery diarrhea: a randomized, double-blind, placebo controlled clinical trial [ISRCTN67363048]. BMC Pediatr 2004; 4: 18.
- Huang Y-F, Liu P-Y, Chen Y-Y, et al. Three-combination probiotics therapy in children with salmonella and rotavirus gastroenteritis. J Clin Gastroenterol 2014; 48: 37-42.
- Huang R, Xing H-Y, Liu H-J, et al. Efficacy of probiotics in the treatment of acute diarrhea in children: a systematic review and meta-analysis of clinical trials. Transl Pediatr 2021; 10: 3248-3260.
- Dinleyici EC, Dalgic N, Guven S, et al. Lactobacillus reuteri DSM 17938 shortens acute infectious diarrhea in a pediatric outpatient setting. J Pediatr 2015; 91: 392-396.
- Maragkoudaki M, Chouliaras G, Moutafi A, et al. Efficacy of an Oral Rehydration Solution Enriched with Lactobacillus reuteri DSM 17938 and Zinc in the Management of Acute Diarrhoea in Infants: A Randomized, Double-Blind, Placebo-Controlled Trial. Nutrients; 10. Epub ahead of print 1 September 2018. DOI: 10.3390/nu10091189
- Sindhu KNC, Sowmyanarayanan TV, Paul A, et al. Immune response and intestinal permeability in children with acute gastroenteritis treated with Lactobacillus rhamnosus GG: a randomized, double-blind, placebo-controlled trial. Clin Infect Dis 2014; 58: 1107-1115.
- Lai H-H, Chiu C-H, Kong M-S, et al. Probiotic Lactobacillus casei: Effective for Managing Childhood Diarrhea by Altering Gut Microbiota and Attenuating Fecal Inflammatory Markers. Nutrients; 11. Epub ahead of print 23 May 2019. DOI: 10.3390/nu11051150
- Mourey F, Sureja V, Kheni D, et al. A Multicenter, Randomized, Double-blind, Placebo-controlled Trial of Saccharomyces boulardii in Infants and Children With Acute Diarrhea. Pediatr Infect Dis J 2020; 39: e347-e351.
- Fu H, Li J, Xu X, et al. Effectiveness and Safety of Saccharomyces Boulardii for the Treatment of Acute Gastroenteritis in the Pediatric Population: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Comput Math Methods Med 2022; 2022: 6234858.
- Billoo AG, Memon MA, Khaskheli SA, et al. Role of a probiotic (Saccharomyces boulardii) in management and prevention of diarrhoea. World J Gastroenterol 2006; 12: 4557-4560.
- Villarruel G, Rubio DM, Lopez F, et al. Saccharomyces boulardii in acute childhood diarrhoea: a randomized, placebo-controlled study. Acta Paediatr 2007; 96: 538-541.
- Kurugöl Z, Koturoğlu G. Effects of Saccharomyces boulardii in children with acute diarrhoea. Acta Paediatr 2005; 94: 44-47.
- Grandy G, Medina M, Soria R, et al. Probiotics in the treatment of acute rotavirus diarrhoea. A randomized, double-blind, controlled trial using two different probiotic preparations in Bolivian children. BMC Infect Dis 2010; 10: 253.
- Cheng H, Ma Y, Liu X, et al. A Systematic Review and Meta-Analysis: Lactobacillus acidophilus for Treating Acute Gastroenteritis in Children. Nutrients; 14. Epub ahead of print 6 February 2022. DOI: 10.3390/nu14030682.
- Hegar B, Waspada IMI, Gunardi H, et al. A double blind randomized trial showing probiotics to be ineffective in acute diarrhea in Indonesian children. Indian J Pediatr 2015; 82: 410-414.
- Dinleyici EC, Dalgic N, Guven S, et al. The effect of a multispecies synbiotic mixture on the duration of diarrhea and length of hospital stay in children with acute diarrhea in Turkey: single blinded randomized study. Eur J Pediatr 2013; 172: 459-464.
- Chen K, Xin J, Zhang G, et al. A combination of three probiotic strains for treatment of acute diarrhoea in hospitalised children: an open label, randomised controlled trial. Benef Microbes 2020; 11: 339-346.
- Lee MC, Lin LH, Hung KL, et al. Oral bacterial therapy promotes recovery from acute diarrhea in children. Acta Paediatr Taiwan 2001; 42: 301-305.
- Shamir R, Makhoul IR, Etzioni A, et al. Evaluation of a diet containing probiotics and zinc for the treatment of mild diarrheal illness in children younger than one year of age. J Am Coll Nutr 2005; 24: 370-375.
- Kluijfhout S, Trieu T-V, Vandenplas Y. Efficacy of the Probiotic Probiotical Confirmed in Acute Gastroenteritis. Pediatr Gastroenterol Hepatol Nutr 2020; 23: 464-471.
- Higuchi T, Furuichi M, Maeda N, et al. Effects of probiotics in children with acute gastroenteritis: A systematic review and meta-analysis focusing on probiotics utilized in Japan. J Infect Chemother 2024; 30: 337-342.
- Guo Q, Goldenberg JZ, Humphrey C, et al. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database Syst Rev 2019; 4: CD004827.
- Goodman C, Keating G, Georgousopoulou E, et al. Probiotics for the prevention of antibiotic-associated diarrhoea: a systematic review and meta-analysis. BMJ Open 2021; 11: e043054.
- Can M, Beşirbellioglu BA, Avci IY, et al. Prophylactic Saccharomyces boulardii in the prevention of antibiotic-associated diarrhea: a prospective study. Med Sci Monit 2006; 12: PI19-22.
- Allen SJ, Wareham K, Wang D, et al. Lactobacilli and bifidobacteria in the prevention of antibiotic-associated diarrhoea and Clostridium difficile diarrhoea in older inpatients (PLACIDE): a randomised, double-blind, placebo-controlled, multicentre trial. Lancet 2013; 382: 1249-1257.
- Beausoleil M, Fortier N, Guénette S, et al. Effect of a fermented milk combining Lactobacillus acidophilus Cl1285 and Lactobacillus casei in the prevention of antibiotic-associated diarrhea: a randomized, double-blind, placebo-controlled trial. Can J Gastroenterol 2007; 21: 732-736.
- Beniwal RS, Arena VC, Thomas L, et al. A randomized trial of yogurt for prevention of antibiotic-associated diarrhea. Dig Dis Sci 2003; 48: 2077-2082.
- Chatterjee S, Kar P, Das T, et al. Randomised placebo-controlled double blind multicentric trial on efficacy and safety of Lactobacillus acidophilus LA-5 and Bifidobacterium BB-12 for prevention of antibiotic-associated diarrhoea. J Assoc Physicians India 2013; 61: 708-712.
- Cimperman L, Bayless G, Best K, et al. A randomized, double-blind, placebo-controlled pilot study of Lactobacillus reuteri ATCC 55730 for the prevention of antibiotic-associated diarrhea in hospitalized adults. J Clin Gastroenterol 2011; 45: 785-789.
- Cindoruk M, Erkan G, Karakan T, et al. Efficacy and safety of Saccharomyces boulardii in the 14-day triple anti-Helicobacter pylori therapy: a prospective randomized placebo-controlled double-blind study. Helicobacter 2007; 12: 309-316.
- Duman DG, Bor S, Ozütemiz O, et al. Efficacy and safety of Saccharomyces boulardii in prevention of antibiotic-associated diarrhoea due to Helicobacterpylori eradication. Eur J Gastroenterol Hepatol 2005; 17: 1357-1361.
- Darbandi A, Asadi A, Ghanavati R, et al. The effect of probiotics on respiratory tract infection with special emphasis on COVID-19: Systemic review 2010-20. Int J Infect Dis 2021; 105: 91-104.
- Namba K, Hatano M, Yaeshima T, et al. Effects of Bifidobacterium longum BB536 administration on influenza infection, influenza vaccine antibody titer, and cell-mediated immunity in the elderly. Biosci Biotechnol Biochem 2010; 74: 939-945.
- Fonollá J, Gracián C, Maldonado-Lobón JA, et al. Effects of Lactobacillus coryniformis K8 CECT5711 on the immune response to influenza vaccination and the assessment of common respiratory symptoms in elderly subjects: a randomized controlled trial. Eur J Nutr 2019; 58: 83-90.
- Akatsu H, Nagafuchi S, Kurihara R, et al. Enhanced vaccination effect against influenza by prebiotics in elderly patients receiving enteral nutrition. Geriatr Gerontol Int 2016; 16: 205-213.
- Davidson LE, Fiorino A-M, Snydman DR, et al. Lactobacillus GG as an immune adjuvant for live-attenuated influenza vaccine in healthy adults: a randomized double-blind placebo-controlled trial. Eur J Clin Nutr 2011; 65: 501-507.
- Jespersen L, Tarnow I, Eskesen D, et al. Effect of Lactobacillus paracasei subsp. paracasei, L. casei 431 on immune response to influenza vaccination and upper respiratory tract infections in healthy adult volunteers: a randomized, double-blind, placebo-controlled, parallel-group study. Am J Clin Nutr 2015; 101: 1188-1196.
- Maruyama M, Abe R, Shimono T, et al. The effects of non-viable Lactobacillus on immune function in the elderly: a randomised, double-blind, placebo-controlled study. Int J Food Sci Nutr 2016; 67: 67-73.
- Rizzardini G, Eskesen D, Calder PC, et al. Evaluation of the immune benefits of two probiotic strains Bifidobacterium animalis ssp. lactis, BB-12® and Lactobacillus paracasei ssp. paracasei, L. casei 431® in an influenza vaccination model: a randomised, double-blind, placebo-controlled study. Br J Nutr 2012; 107: 876-884.
- Hao Q, Dong BR, Wu T. Probiotics for preventing acute upper respiratory tract infections. Cochrane Database Syst Rev 2015; CD006895.
- Güvenç IA, Muluk NB, Mutlu FŞ, et al. Do probiotics have a role in the treatment of allergic rhinitis? A comprehensive systematic review and meta-analysis. Am J Rhinol Allergy 2016; 30: 157-175.
- Nishimura I, Igarashi T, Enomoto T, et al. Clinical efficacy of halophilic lactic acid bacterium Tetragenococcus halophilus Th221 from soy sauce moromi for perennial allergic rhinitis. Allergol Int 2009; 58: 179-185.
- Kawase M, He F, Kubota A, et al. Effect of fermented milk prepared with two probiotic strains on Japanese cedar pollinosis in a double-blind placebo-controlled clinical study. Int J Food Microbiol 2009; 128: 429-434.
- Singh A, Hacini-Rachinel F, Gosoniu ML, et al. Immune-modulatory effect of probiotic Bifidobacterium lactis NCC2818 in individuals suffering from seasonal allergic rhinitis to grass pollen: an exploratory, randomized, placebo-controlled clinical trial. Eur J Clin Nutr 2013; 67: 161-167.
- Helin T, Haahtela S, Haahtela T. No effect of oral treatment with an intestinal bacterial strain, Lactobacillus rhamnosus (ATCC 53103), on birch-pollen allergy: a placebo-controlled double-blind study. Allergy 2002; 57: 243-246.
- Chen Y-S, Jan R-L, Lin Y-L, et al. Randomized placebo-controlled trial of lactobacillus on asthmatic children with allergic rhinitis. Pediatr Pulmonol 2010; 45: 1111–1120.
- Wang MF, Lin HC, Wang YY, et al. Treatment of perennial allergic rhinitis with lactic acid bacteria. Pediatr Allergy Immunol 2004; 15: 152-158.
- Peng G-C, Hsu C-H. The efficacy and safety of heat-killed Lactobacillus paracasei for treatment of perennial allergic rhinitis induced by house-dust mite. Pediatr Allergy Immunol 2005; 16: 433-438.
- Costa DJ, Marteau P, Amouyal M, et al. Efficacy and safety of the probiotic Lactobacillus paracasei LP-33 in allergic rhinitis: a double-blind, randomized, placebo-controlled trial (GA2LEN Study). Eur J Clin Nutr 2014; 68: 602-607.
- Yonekura S, Okamoto Y, Okawa T, et al. Effects of daily intake of Lactobacillus paracasei strain KW3110 on Japanese cedar pollinosis. Allergy Asthma Proc 2009; 30: 397-405.
- Lin W-Y, Fu L-S, Lin H-K, et al. Evaluation of the effect of Lactobacillus paracasei (HF.A00232) in children (6-13 years old) with perennial allergic rhinitis: a 12-week, double-blind, randomized, placebo-controlled study. Pediatr Neonatol 2014; 55: 181-188.
- Tamura M, Shikina T, Morihana T, et al. Effects of probiotics on allergic rhinitis induced by Japanese cedar pollen: randomized double-blind, placebo-controlled clinical trial. Int Arch Allergy Immunol 2007; 143: 75-82.
- Ivory K, Chambers SJ, Pin C, et al. Oral delivery of Lactobacillus casei Shirota modifies allergen-induced immune responses in allergic rhinitis. Clin Exp Allergy 2008; 38: 1282-1289.
- Giovannini M, Agostoni C, Riva E, et al. A randomized prospective double blind controlled trial on effects of long-term consumption of fermented milk containing Lactobacillus casei in pre-school children with allergic asthma and/or rhinitis. Pediatr Res 2007; 62: 215-220.
- Nagata Y, Yoshida M, Kitazawa H, et al. Improvements in seasonal allergic disease with actobacillus plantarum No. 14. Biosci Biotechnol Biochem 2010; 74: 1869-1877.
- Zajac AE, Adams AS, Turner JH. A systematic review and meta-analysis of probiotics for the treatment of allergic rhinitis. Int Forum Allergy Rhinol 2015; 5: 524-532.
- Lue K-H, Sun H-L, Lu K-H, et al. A trial of adding Lactobacillus johnsonii EM1 to levocetirizine for treatment of perennial allergic rhinitis in children aged 7-12 years. Int J Pediatr Otorhinolaryngol 2012; 76: 994-1001.
- Lin T-Y, Chen C-J, Chen L-K, et al. Effect of probiotics on allergic rhinitis in Df, Dp or dust-sensitive children: a randomized double blind controlled trial. Indian Pediatr 2013; 50: 209-213.
- Newlove-Delgado TV, Martin AE, Abbott RA, et al. Dietary interventions for recurrent abdominal pain in childhood. Cochrane Database Syst Rev 2017; 3: CD010972.
- de Silva D, Halken S, Singh C, et al. Preventing food allergy in infancy and childhood: Systematic review of randomised controlled trials. Pediatr Allergy Immunol 2020; 31: 813-826.
- Kaur L, Gordon M, Baines PA, et al. Probiotics for induction of remission in ulcerative colitis. Cochrane Database Syst Rev 2020; 3: CD005573.
- Ganji-Arjenaki M, Rafieian-Kopaei M. Probiotics are a good choice in remission of inflammatory bowel diseases: A meta analysis and systematic review. J Cell Physiol 2018; 233: 2091-2103.
- Tamaki H, Nakase H, Inoue S, et al. Efficacy of probiotic treatment with Bifidobacterium longum 536 for induction of remission in active ulcerative colitis: A randomized, double-blinded, placebo-controlled multicenter trial. Dig Endosc 2016; 28: 67-74.
- Fedorak RN, Feagan BG, Hotte N, et al. The probiotic VSL#3 has anti-inflammatory effects and could reduce endoscopic recurrence after surgery for Crohn’s disease. Clin Gastroenterol Hepatol 2015; 13: 928-35.e2.
- Yoshimatsu Y, Yamada A, Furukawa R, et al. Effectiveness of probiotic therapy for the prevention of relapse in patients with inactive ulcerative colitis. World J Gastroenterol 2015; 21: 5985-5994.
- Petersen AM, Mirsepasi H, Halkjær SI, et al. Ciprofloxacin and probiotic Escherichia coli Nissle add-on treatment in active ulcerative colitis: a double-blind randomized placebo controlled clinical trial. J Crohns Colitis 2014; 8: 1498-1505.
- Bourreille A, Cadiot G, Le Dreau G, et al. Saccharomyces boulardii does not prevent relapse of Crohn’s disease. Clin Gastroenterol Hepatol 2013; 11: 982-987.
- Zhong C, Qu C, Wang B, et al. Probiotics for Preventing and Treating Small Intestinal Bacterial Overgrowth: A Meta-Analysis and Systematic Review of Current Evidence. J Clin Gastroenterol 2017; 51: 300-311.
- Gaon D, Garmendia C, Murrielo NO, et al. Effect of Lactobacillus strains (L. casei and L. Acidophillus Strains cerela) on bacterial overgrowth-related chronic diarrhea. Medicina 2002; 62: 159-163.
- Woodard GA, Encarnacion B, Downey JR, et al. Probiotics improve outcomes after Roux-en-Y gastric bypass surgery: a prospective randomized trial. J Gastrointest Surg 2009; 13: 1198-1204.
- Stotzer PO, Blomberg L, Conway PL, et al. Probiotic treatment of small intestinal bacterial overgrowth by Lactobacillus fermentum KLD. Scand J Infect Dis 1996; 28: 615-619.
- Attar A, Flourié B, Rambaud JC, et al. Antibiotic efficacy in small intestinal bacterial overgrowth-related chronic diarrhea: a crossover, randomized trial. Gastroenterology 1999; 117: 794-797.
ANEXOS
Anexo 1. Preguntas clave
Anexo 2. Tablas Grade
Resumen de resultados 2. Probiotics compared to control in very preterm or very low birth weight infants.
Resumen de resultados 6. Probiotics for the prevention of antibiotic- associated diarrhoea.
Correspondencia: Michelle Higuera Carrillo
Correo electrónico: michellehiguera@yahoo.com
Acta Gastroenterol Latinoam 2024;54(2):160-191
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE