Leysi Carvache1 ID· John Daluz1 ID· Andrés Pereira-Reinosa2 ID· Kléber Coppiano3 ID· Byron Bermeo4 ID· Alberto Campodónico5 ID· Miguel Puga-Tejada6 ID
1Medicina Interna, Hospital Federico Bolaños Moreira. Milagro, Ecuador.
2Unidad de Cuidados Intensivos, Clínica Ensenada. Santiago de Chile, Chile.
3Universidade Paranaense (UNIPAR). Umuarama, Brasil.
4Unidad de Cuidados Intensivos, Instituto Nacional del Tórax. Santiago de Chile, Chile.
5Facultad de Ciencias de la Salud, Universidad Católica de Santiago de Guayaquil (UCSG). Guayaquil, Ecuador.
6División de Investigación Clínica y Bioestadística, Instituto Ecuatoriano de Enfermedades Digestivas (IECED). Guayaquil, Ecuador.
Acta Gastroenterol Latinoam 2025;55(1):37-44
Recibido: 25/02/2025 / Aceptado: 27/03/2025 / Publicado online el 31/03/2025 /
https://doi.org/10.52787/agl.v55i1.474
Resumen
Introducción. Es probable que, al determinar la prevalencia de gastritis atrófica crónica y metaplasia intestinal a partir de muestras procedentes de hospitales de tercer nivel, se sobreestime su frecuencia. Objetivo. Estimar la frecuencia de lesiones histológicas premalignas del estómago en un hospital de segundo nivel. Materiales y métodos. Estudio observacional, retrospectivo, descriptivo, transversal, epidemiológico. Se llevó a cabo en pacientes quienes ya se habían realizado una videoendoscopía digestiva altadiagnóstica independientemente del motivo clínico. Se excluyeron a pacientes con hemorragia digestiva, tumores o sin biopsia. Resultados. Se recuperaron 4454 casos, de los cuales 115 (2,6%, IC 2,2 – 3,1) tenían gastritis atrófica crónica. En comparación a la gastritis no atrófica, la presencia de gastritis atrófica crónica fue más frecuente en adultos mayores (43,5% vs. 24,9%;
p < 001) y con síntomas de dispepsia (35,7% vs. 19,9%; p < 0,001), y menos frecuente en poblaciones económicamente activas (47,8% vs. 64,9%; p < 0,001). En los pacientes con gastritis atrófica crónica en comparación con los pacientes con gastritis no atrófica presentó Helicobacter pylori positivo (47,8% vs. 25,6%; p < 0,001). La infección por Helicobacter pylori incrementó casi tres veces el riesgo de contraer gastritis atrófica crónica (Odds Ratio 2,65; p < 0,001). Conclusión. En un hospital de segundo nivel, la prevalencia de lesiones histológicas premalignas es considerablemente menor a la reportada por estudios locales realizados en hospitales de tercer nivel. La presencia de gastritis atrófica crónica se asoció con edad avanzada, indicación de videoendoscopía digestiva alta por dispepsia e infección por Helicobacter pylori; mientras que la indicación por regurgitación se asoció a su ausencia.
Palabras claves. Gastritis atrófica crónica, endoscopía, histología.
Chronic Atrophic Gastritis in Hispanics Treated at a Second-Level Hospital: Results of a Retrospective and Single-Center Study
Summary
Introduction. The prevalence of chronic atrophic gastritis and intestinal metaplasia based on samples from third-level hospitals, may overestimate their frequency. Objetive. To estimate the frequency of premalignant histological lesions of the stomach in a second-level hospital. Material and methods. Observational, retrospective, descriptive, cross-sectional, epidemiological study. It was conducted with patients who had already undergone diagnostic upper digestive endoscopy, regardless of the clinical reason. Patients with gastrointestinal bleeding, tumors or without biopsy were excluded. Results. A total of 4454 cases were reviewed, of which 115 (2.6%, CI 2.2 – 3.1) had chronic atrophic gastritis. Compared to non-atrophic gastritis, the presence of chronic atrophic gastritis was more frequent in older adults (43.5% vs. 24.9%; p < 001) and in those with dyspepsia symptoms (35.7% vs. 19.9%; p < 0.001); and less frequent in economically active population (47.8% vs. 64.9%; p < 0.001). Among patients with chronic atrophic gastritis, nearly twice as many tested positive for Helicobacter pylori (47.8% vs. 25.6%;
p < 0.001). Helicobacter pylori infection nearly tripled the risk of developing chronic atrophic gastritis (Odds Ratio 2.65; p < 0.001). Conclusion. In a second-level hospital, the prevalence of premalignant histological lesions is significantly lower than that reported by local studies conducted in third-level hospitals. The presence of chronic atrophic gastritis was associated with older age, indication for upper digestive endoscopy for dyspepsia, and Helicobacter pylori infection; while the indication for regurgitation was associated with its absence.
Keywords. Chronic atrophic gastritis, endoscopy, histology.
Abreviaturas
GAC: Gastritis atrófica crónica.
GNA: Gastritis no atrófica.
MI: Metaplasia intestinal.
VEDA: Videoendoscopía digestiva alta.
IC: Intervalo de confianza.
OLGA: Sistema de estadificación de la gastritis (Operative Link on Gastritis Assessment).
OLGIM: Sistema de estadificación de la metaplasia intestinal gástrica (Operative Link for Gastric Intestinal Metaplasia Assessment).
NBI: Imagen de banda estrecha (Narrow banding imaging).
pCLE: Endomicroscopía láser confocal con sonda (Probe-based confocal laser endomicroscopy).
STROBE: Declaración de la Iniciativa STROBE (Strengthening the Reporting of Observational Studies in Epidemiology).
IBP: Inhibidor de la bomba de protones.
AINES: Antiinflamatorio no esteroideo.
HD-WLE: Endoscopia de luz blanca de alta definición
(High-definition white light endoscopy).
ERGE: Enfermedad por reflujo gastroesofágico.
Introducción
El cáncer de estómago constituye el segundo y cuarto tumor más incidentes en hombres y mujeres, respectivamente en Ecuador.1 La Helicobacter pylori es la causa de infección bacteriana crónica más común en el mundo y el principal agente carcinogénico asociado al cáncer de estómago.2 La cascada de Correa describe el desarrollo del cáncer de estómago mediante la siguiente secuencia: gastritis no atrófica (GNA) crónica, gastritis atrófica crónica (GAC), GAC con metaplasia intestinal (MI) completa e incompleta.3
Las biopsias endoscópicas de rutina son el estándar en la evaluación y el seguimiento de las GAC (con o sin MI) como lesiones histológicas premalignas del estómago.4 Un análisis conjunto de cinco estudios ecuatorianos realizados entre 2013 y 2018 estimó, basándose en biopsias tomadas por videoendoscopía digestiva alta (VEDA), que la prevalencia de GAC es del 38,1% (IC del 95%: 28,5 – 49,0).5-9 Se estima que en occidente, la prevalencia de GAC es inferior al 50%. Estudios similares en China y en Japón revelan una mayor prevalencia.10
Frente a la presencia de GAC (con o sin MI) se toman distintas conductas: sin necesidad de controles posteriores, seguimiento endoscópico o tratamiento específico.11 Sin embargo, las evaluaciones histológicas son susceptibles de errores de muestreo de hasta 20-30%, errores de interpretación, sitios de muestreo inadecuados con fórceps de biopsia o número reducido de biopsias adquiridas.12 El diagnóstico endoscópico e histológico de lesiones premalignas tiene una baja concordancia, especialmente en el cuerpo gástrico.13
Para disminuir potenciales subestimaciones, el sistema de Sydney (1990), actualizado en el Consenso Internacional de Houston (1994), propuso estratificar la GAC como ausente, leve, moderada y severa, empleando una escala analógica visual.13 Más adelante se propuso el Sistema de estadificación de la gastritis (Operative Link on Gastritis Assessment u OLGA, por sus siglas en inglés) y el Sistema de estadificación de la metaplasia intestinal gástrica (Operative Link for Gastric Intestinal Metaplasia Assessmentu OLGIM, por sus siglas en inglés).14
En los últimos diez años, siete estudios han descrito distintas frecuencias de lesiones histológicas premalignas del estómago en Ecuador. Todos fueron realizados en unidades de endoscopía de hospitales de tercer nivel, cinco de ellos en la ciudad de Quito y dos en un centro de Guayaquil.4-9,15 Las unidades de endoscopía de hospitales de tercer nivel cuentan con equipos endoscópicos de mayor resolución: cromoendoscopía del tipo imágenes de banda estrecha (narrow banding imaging o NBI, por sus siglas en inglés) u optical enhancement (CE), yendomicroscopíaconfocal (probe confocal laser endomicroscopy op CLE, por sus siglas en inglés), lo cual permite un seguimiento más protocolizado de las lesiones histológicas premalignas. Por este motivo, son reconocidos como centros de referencia en este aspecto. No obstante, no son lugares adecuados para determinarla prevalencia de GAC (con o sin MI) puesto que están lejos de la realidad poblacional.
Una mejor comprensión de la frecuencia local de lesiones histológicas premalignas del estómago sirve para definir las recomendaciones respecto al seguimiento endoscópico o tratamiento específico de dichos hallazgos en la localidad correspondiente. Asimismo, podría contribuir al diseño de estudios encaminados a comprender mejor la aplicabilidad de nuevas técnicas endoscópicas en este contexto. Desde lo asistencial, este tipo de estimaciones es importante a fin de facilitar la familiarización de los patólogos locales con las lesiones histológicas premalignas de estómago más frecuentemente encontradas.
El objetivo del presente estudio busca estimar la frecuencia de lesiones histológicas premalignas del estómago (GAC con o sin MI) a partir de los estudios histopatológicos obtenidos en las biopsias tomadas mediante VEDA en un hospital de segundo nivel de Ecuador. Como objetivo específico se persigue verificar la potencial asociación entre la identificación de determinadas lesiones histológicas premalignas del estómago (GAC con o sin MI) y las características sociodemográficas y clínico-patológicas.
Material y métodos
Diseño de estudio
Estudio observacional, retrospectivo, descriptivo, transversal, epidemiológico. Su diseño se adaptó a lo descripto en la Declaración de la Iniciativa STROBE (Strengthening the Reporting of Observational Studies in Epidemiology). Se llevó a cabo en pacientes en quienes se realizó una VEDA con toma de biopsia en el Hospital Federico Bolaños Moreira (hospital de segundo nivel. Milagro, Ecuador) desde enero hasta diciembre de 2019. Todos los pacientes firmaron el correspondiente consentimiento informado previo a la realización de la VEDA.
Población y muestra
Se incluyeron pacientes a los que se había realizado previamente una VEDA diagnóstica independientemente del motivo clínico. No fueron incluidos aquellos que habían tomado algún inhibidor de la bomba de protones (IBP), antiinflamatorio no esteroideo (AINES) o antibiótico durante los quince días previos a la realización de la VEDA, pacientes con hemorragia digestiva alta o cualquier otra causa que disminuya la calidad de la VEDA, pacientes en quienes se identificaron lesiones malignas, pacientes en quienes no se tomaron biopsias de estómago mediante el protocolo de Sydney y pacientes con historias clínicas incompletas.
Abordaje endoscópico e histológico
La VEDA fue realizada bajo sedación con propofol, con soporte ventilatorio mediante cánula de oxígeno y empleando una endoscopía de luz blanca de alta definición (high-definition white light endoscopy o HD-WLE, por sus siglas en inglés). Se realizó toma de biopsias siguiendo el protocolo de Sydney (dos muestras de cuerpo y dos de antro). La identificación de la Helicobacter pylori fue realizada mediante tinción con Giemsa.
Recuperación y gestión de datos
Se solicitó al Departamento de Estadística del nosocomio anfitrión el listado de pacientes a quienes se les había realizado una VEDA durante el periodo de estudio propuesto. Se realizó una revisión manual de los expedientes clínicos a partir del sistema informático hospitalario correspondiente. Los datos fueron recuperados en una base de datos electrónica, encriptada y en línea, compatible con Microsoft Access.
Análisis estadístico
Consideraciones técnicas. Se consideró un valor p < 0,05 como estadísticamente significativo. El análisis estadístico fue realizado por un médico gastroenterólogo con certificación universitaria en bioestadística (M.P-T.) utilizando el programa R v.3.6.3 (R Foundation for Statistical Computing; Viena, Austria).
Cálculo de la muestra. Considerando la frecuencia de lesiones histológicas premalignas de estómago previamente citada entre hospitales ecuatorianos de tercer nivel (38%), se estimó una muestra de 363 casos, con un intervalo de confianza (IC) del 95% y un margen de error del 5%.
Estadística descriptiva. Las variables numéricas fueron descriptas en media (desviación estándar) o mediana (rango mínimo-máximo), de acuerdo con su distribución estadística (prueba de Kolmogórov-Smirnov). Las variables descriptivas fueron descriptas en frecuencias (porcentajes).
Estadística analítica. Las variables numéricas fueron contrastadas con la presencia de GAC (con o sin MI), mediante prueba t de Student o U de Mann-Whitney, de acuerdo con su distribución estadística (prueba de K-S y Levene). Las variables categóricas fueron contrastadas con la presencia de GAC (con o sin MI), mediante prueba chi-cuadrado o la prueba exacta de Fisher según se requiera. La asociación entre la presencia de GAC (con o sin MI) y edad, sexo, cobertura sanitaria, motivo de realización de VEDA e infección por Helicobacter pylori fue demostrada mediante regresión logística múltiple (Odds Ratio, OR). La variable edad fue incluida en la regresión como continua. Las variables sexo e infección por Helicobacter pylori, como binomial. La variable cobertura sanitaria y motivo de realización de VEDA como categórica ordinal.
Nociones éticas
Todos los pacientes firmaron el correspondiente consentimiento informado. La presente investigación respetó lo estipulado por el código de Núremberg de 1947 y la declaración de Helsinki de 1964 con sus posteriores enmiendas (última versión 2013). Este estudio fue aprobado por un comité de ética en investigación independiente al nosocomio anfitrión (Universidad Católica de Santiago de Guayaquil. Guayaquil, Ecuador).
Resultados
Durante el periodo de estudio se recuperaron 8695 casos en los que se practicó VEDA. De estos, 48,7% correspondieron a casos en los que no se tomó biopsia por ser una VEDA realizada en el contexto de una hemorragia digestiva (alta, baja, oculta, control de hemorragia previa), porque se identificó algún tumor endoscópicamente epitelial que no ameritó la toma de biopsia de la mucosa gástrica, u alguna otra situación por la cual no se indicó la toma de biopsia (por ejemplo: urgencias endoscópicas tales como ingesta de cáusticos). Finalmente se recuperaron 4454 casos, de los cuales 115 (2,6%, IC 2,2 – 3,1) tenían GAC (Figura 1).
Figura 1. Flujograma STROBE de selección de casos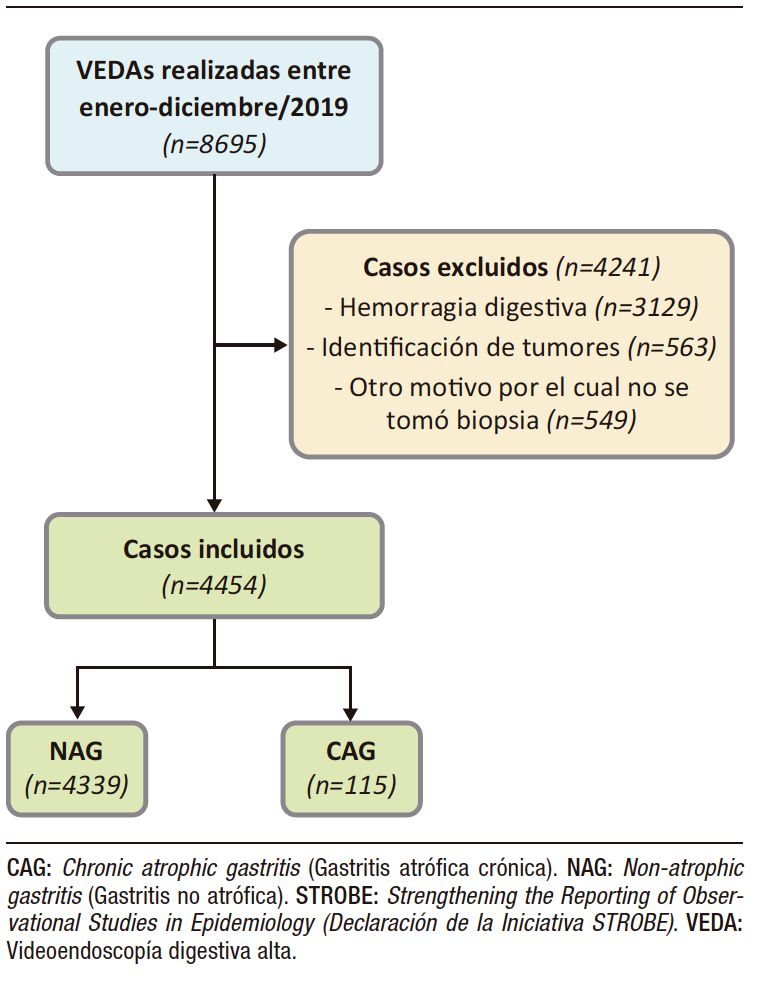
En la Tabla 1 se resumen las características de la población del estudio. La edad promedio fue de 52,1 años; siendo en su mayoría adultos (47,8%) o adultos mayores (25,4%). La relación sexo femenino vs. masculino fue 1:1. El 64,5% de los casos correspondió a población económicamente activa, el 21,5% a jubilados y el 14% a cobertura por subvención del estado. En el 44,2% de los casos se realizó VEDA por síntomas de reflujo gastroesofágico y en el 20,3% por dispepsia. En el resto de los casos fue por anemia, control endoscópico de lesiones preexistentes y pérdida de peso. En los 114 casos en los que se determinó GAC, esta fue leve, moderada y severa en 72 (62,6%), 32 (27,8%) y 11 (9,6%), respectivamente. En este mismo grupo se documentó metaplasia completa e incompleta en 40 (34,8%) y 19 (16,5%) casos, respectivamente. Hubo infección por Helicobacter pylori en el 26,2% de los casos estudiados. No se identificaron casos de gastritis autoinmune, gastritis por otros gérmenes o enfermedad de Crohn gastroduodenal.
Tabla 1. Características de la población de estudio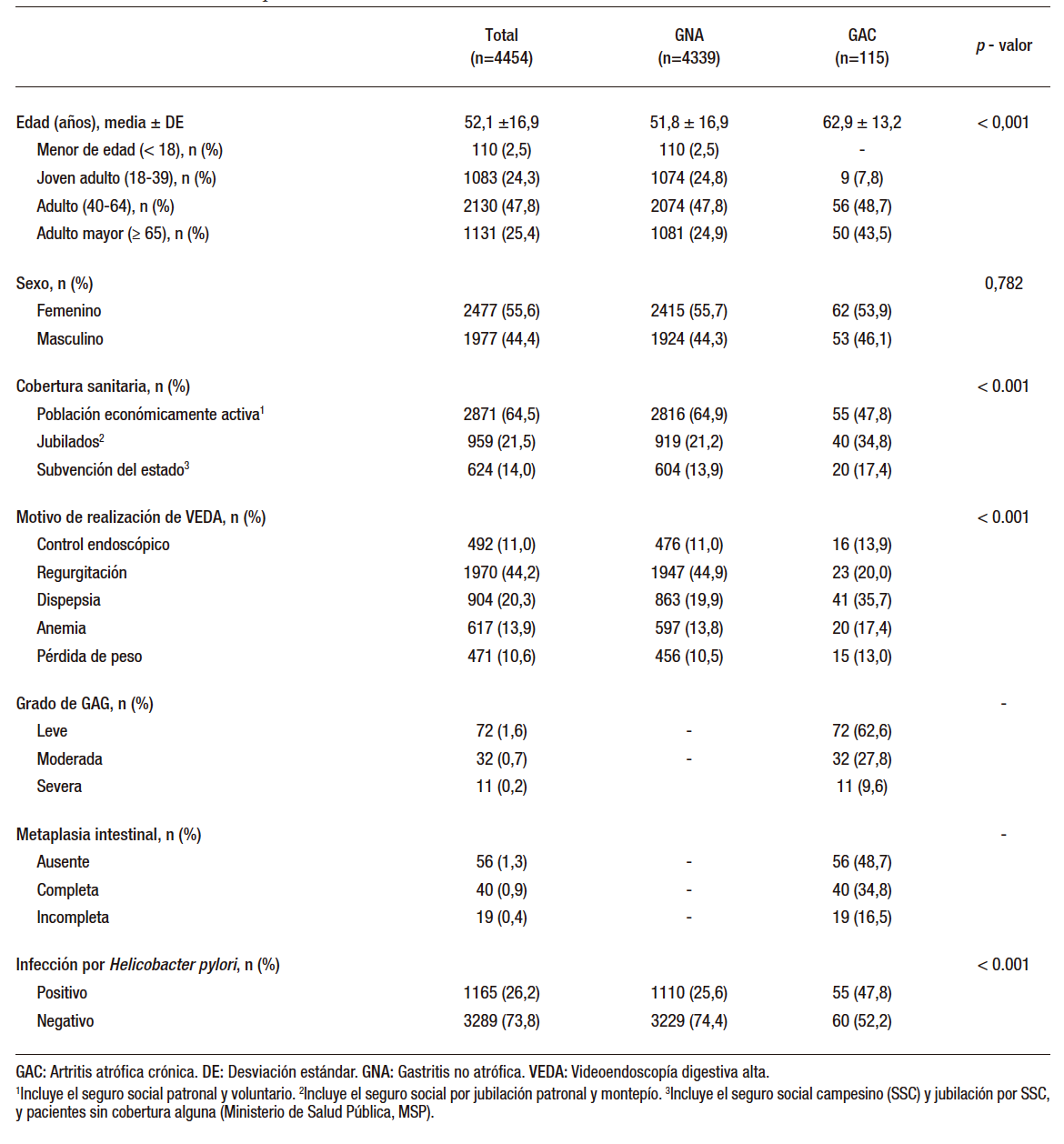
La edad, la cobertura sanitaria, el motivo de realización de VEDA y la infección por Helicobacter py-
lori fueron factores estadísticamente asociados a la presencia de GAC. La presencia de GAC se concentró principalmente en adultos (48,7%) y adultos mayores (mayores de 65 años, 43,5%). En los pacientes con GAC hubo menor representación de la población económicamente activa en comparación con aquellos con GNA (47,8% vs. 64,9%, p < 0,001), con el consecuente aumento en la frecuencia de pacientes jubilados (34,8% vs. 21,2%, p < 0,001) o con cobertura sanitaria por subvención del estado (17,4% vs. 13,9%; p < 0,001). En los pacientes con GAC hubo más síntomas de dispepsia (35,7% vs. 19,9%; p < 0,001) y menos de reflujo gastroesofágico (20% vs. 44,9%;
p < 0,001). En los pacientes con GAC hubo casi el doble de casos con infección por Helicobacter pylori (47,8% vs. 25,6%; p < 0,001).
Mediante regresión logística multivariada se confirmaron las siguientes características como predictores independientes de GAC, con o sin MI: edad mayor a 65 años, dispepsia como motivo de realización de VEDA (OR 1,62; IC 95% 1,17 – 2,21; p = 0,0028) e infección por Helicobacter pylori (OR 2,65; IC 95% 1,82-3,86; p < 0,001). El síntoma de regurgitación como motivo de realización de VEDA fue un predictor independiente de ausencia de GAC (OR 0,47; IC 95% 0,31 – 0,68; p < 0,001) (Tabla 2).
Tabla 2. Regresión logística multivariada que describe los factores asociados a la presencia de gastritis atrófica crónica (GAC ), con o sin metaplasia intestinal (MI)
Discusión
La GAC como entidad premaligna hace necesaria la apropiada evaluación tanto endoscópica como histopatológica de la mucosa gástrica, pues en caso de ser diagnosticada, será imperativa la vigilancia endoscópica en determinados casos. Actualmente se considera a la GAC como el factor básico de progresión hacia el cáncer de estómago.3 Sin embargo, el proceso adaptativo que conlleva al diagnóstico histológico de la GAC es amplio y complejo, principal motivo por el cual la correlación endoscópica-histopatológica ha presentado constantes limitaciones.
Actualmente, falta un consenso universal en cuanto a los sistemas de clasificación para GAC y GNA; está disponible el basado en una escala analógica cualitativa que limita su reproducibilidad y la concordancia entre observadores, con variabilidad durante la interpretación del diagnóstico.15 Así, como se concluyó durante el Grupo de Trabajo sobre Gastritis de Houston de 1994, el consenso existente es aún muy subjetivo y difícil de reproducir.5 Histológicamente, endoscópicamente o mediante pCLE, el éxito de un sistema de clasificación propuesto apunta a caracterizar con precisión a la GAC con una alta reproducibilidad.14
Un análisis combinado de cinco estudios ecuatorianos entre 2013 y 2018 estimó una prevalencia de GAC basada en biopsias por endoscopía del 38,1% (IC del 95% 28,5-49,0).5-9 Dicho porcentaje es mucho mayor al descripto en el presente estudio, que se aproxima al 2%. Aunque en los países occidentales la prevalencia estimada de GAC es inferior al 50%, estudios de China y Japón revelan una prevalencia más alta. Este hallazgo es importante porque las investigaciones recientes de detección de GAC a través de pCLE provienen de poblaciones chinas, y los patólogos deben estar familiarizados con los tipos específicos de gastritis prevalentes en sus respectivas localidades.12 Sin embargo, es importante recalcar que estos resultados publicados por otros estudios son realizados en hospitales terciarios y de alta complejidad, en donde la prevalencia de GAC suele ser más alta. Otro hallazgo importante de este estudio es la asociación entre la presencia de GAC (con o sin MI) y edad avanzada, síntoma de dispepsia como motivo de VEDA o infección por Helicobacter pylori, mientras que la presencia de regurgitación se asoció a la ausencia de GAC. Cuando la infección por Helicobacter pylori induce GAC, da lugar a una menor secreción ácida. Esto puede explicar la relación entre síntomas de regurgitación y la ausencia de GAC. Es por tal razón que algunos autores recomiendan tratar los síntomas de regurgitación en contexto de enfermedad por reflujo gastroesofágico (ERGE) previo al tratamiento de la Helicobacter pylori.16,17
La endoscopía NBI ha mostrado una buena sensibilidad y especificidad para detectar lesiones precancerosas gástricas. Sin embargo, no hay acuerdo sobre si el patrón NBI se asocia con lesiones precancerosas gástricas. Tao Liu y col. diseñaron un estudio observacional en el que encontraron una mayor precisión de pCLE para detectar GAC (84,7%) en comparación con cromoendoscopía (81,7%) y NBI (79,8%).
La VEDA es un método útil en el cribado y diagnóstico de GAC. Un estudio comparativo que incluyó
119 pacientes evaluó la suficiencia diagnóstica de las biopsias no dirigidas tomadas mediante HD-WLE siguiendo el sistema de Sydney-Houston en contraste con aquellas biopsias guiadas por endoscopía NBI. A fin de predecir apropiadamente la atrofia, la sensibilidad, la especificidad y la precisión general de las biopsias no dirigidas tomadas mediante HD-WLEvs. NBI fueron del 86% vs. 62%, 100% vs. 97% y 93% vs. 80%, respectivamente. Para metaplasia intestinal fueron 80% vs. 72%, 100% vs. 93% y 90% vs. 82%, respectivamente. Estos resultados fueron ligeramente mejores para las biopsias de protocolo no dirigidas. Esto solo fue significativo con respecto a la detección de atrofia (p = 0,03) y no de metaplasia intestinal o displasia.
Conclusión
En un hospital de segundo nivel, la prevalencia de lesiones histológicas premalignas (GAC con o sin GNA) es significativamente menor (aproximadamente el 2%) a la reportada por estudios locales realizados en hospitales de tercer nivel (38,1%). Entre los factores asociados a la presencia de GAC se encuentran edad avanzada, indicación de VEDA por dispepsia e infección por Helicobacter pylori, mientras que la indicación de VEDA por regurgitación está asociada con la ausencia de GAC.
Consentimiento para la publicación. Para la confección de este manuscrito, se utilizaron datos anonimizados, que no han distorsionado su significado científico.
Propiedad intelectual. Los autores declaran que los datos, las figuras y las tablas presentes en el manuscrito son originales y se realizaron en la institución perteneciente.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2025 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Carvache L, Daluz J, Pereira-Reinosa A y col. Gastritis atrófica crónica en hispanos atendidos en un hospital de segundo nivel: resultados de un estudio retrospectivo y unicéntrico. Acta Gastroenterol Latinoam. 2025;55(1):37-44. https://doi.org/10.52787/agl.v55i1.474
Referencias
- Quinto R. Registro de Tumores Solca Matriz 2017. Rev Oncologia Ecu. 2017.
- Konturek PC, Brzozowski T, Konturek SJ, Kwiecień S, Pajdo R, Drozdowicz D, et al. Functional and morphological aspects of Helicobacter pylori-induced gastric cancer in Mongolian gerbils. Eur J Gastroenterol Hepatol. 2003;15(7):745-54.
- Ruiz B, Garay J, Johnson W, Li D, Rugge M, Dixon MF, et al. Morphometric assessment of gastric antral atrophy: Comparison with visual evaluation. Histopathology. 2001;39(3):235-42.
- Robles-Medranda C, Puga-Tejada M, Ospina J, Soria-Alcívar M, Bravo-Velez G, del Valle R, et al. Grading Atrophic Gastritis by a New Quantitative Method Using Confocal LASER Endomicroscopy Probe (P-CLE): First Resultas of a Prospective Cohort Study. Gastrointest Endosc [Internet].
2015;81(5):AB464. Availablefrom: http://dx.doi.org/10.1016/j.gie.2015.03.1670 - Vásquez Buitrón PC, Febres-Cordero R. Prevalencia de infección por Helicobacter pylori y asociación con patologías gástricas en pacientes adultos de chequeo ejecutivo desde enero del 2010 hasta septiembre del 2012 del Hospital Metropolitano de Quito- Ecuador. [Quito-Ecuador]; 2013.
- Barreno Robalino RC, Abarca Ruíz JW. Validación de la relación pepsinógeno I/pepsinógeno II como test de screening en sujetos con atrofia gástrica. [Quito-Ecuador]; 2018.
- Guevara Aguirre MC, Guthemberg Morillo AA. Correlación del tratamiento farmacológico erradicador del Helicobacter pylori respecto a los cambios histopatológicos de la mucosa gástrica. [Quito-Ecuador]; 2014.
- Núñez Acurio DK, Escalante Vanoni S. Detección de los genes vacA y cagA en cepas de Helicobacter pylori obtenidas de un hospital de la ciudad de Quito y su asociación con el grado de lesión gástrica. [Quito-Ecuador]; 2017.
- Guamán-Guamán MI, Abarca-Ruíz JW. Validación endoscópica de la cromoendoscopía virtual (FICE) en la detección de lesiones preneoplásicas gástricas vs histopatología. [Quito-Ecuador]; 2018.
- Yo HP, Nayoung K. Review of Atrophic Gastritis and Intestinal Metaplasia as a Premalignant Lesion of Gastric Cancer. J Cancer Prev [Internet]. 2015 [cited 2020 Apr 28];20(1):25-2015. Available from: www.jcpjournal.org – https://www.jcpjournal.org/journal/view.html?doi=10.15430/JCP.2015.20.1.25
- Pimentel-Nunes P, Libânio D, Marcos-Pinto R, Areia M, Leja M, Esposito G, et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Port. Endoscopy. 2019;51(4):365-88.
- Robles-Medranda C, Vargas M, Ospina J, Puga-Tejada M, Valero M, Soria M, et al. Clinical impact of confocal laser endomicroscopy in the management of gastrointestinal lesions with an uncertain diagnosis. World J Gastrointest Endosc. 2017;9(8):389.
- Dixon MF, Genta RM, Yardley JH, Correa P, Batts KP, Dahms BB, et al. Classification and grading of Gastritis: The updated Sydney system. Am J Surg Pathol. 1996 Oct;20(10):1161-81.
- Crafa P, Russo M, Miraglia C, Barchi A, Moccia F, Nouvenne A, et al. From Sidney to OLGA: an overview of atrophic gastritis. Acta Biomed [Internet]. 2018 [cited 2020 Apr 15];89(Supplement 8):93-9. Availablefrom: www.actabiomedica.it
- Robles-Medranda C, Valero M, Puga-Tejada M, Oleas R, Baquerizo-Burgos J, Soria-Alcívar M, et al. High-definition optical magnification with digital chromoendoscopy detects gastric mucosal changes in dyspeptic-patients. World J Gastrointest Endosc. 2020;12(1):23-32.
- Zhao T, Liu F, Li Y. Effects of Helicobacter pylori eradication on esophageal motility, esophageal acid exposure, and gastroesophageal reflux disease symptoms. Front Cell Infect Microbiol. 2023 Mar 8;13:1082620.
- Lee YY, Prakash H, Talebi A, Abadi B, Iijima K, Koike T, et al. Reflux esophagitis triggered after Helicobacter pylori eradication: a noteworthy demerit of eradication therapy among the Japanese? Front Microbiol [Internet]. 2015 [cited 2025 Mar 15];6(JUN):566. Available from: https://pmc.ncbi.nlm.nih.gov/articles/PMC4460561/
Correspondencia: Miguel Puga-Tejada MD MSc
Correo electrónico: miguel.puga01@hotmail.com
Acta Gastroenterol Latinoam 2025;55(1):15-25
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE