Karen Velásquez Vanegas1 ID· Carlos Augusto Cuadros Mendoza2 ID· María José Daniels García3 ID Viviana Parra Izquierdo4 ID
1 Hospital Internacional de Colombia.
2 Pediátra, gastroenterólogo, Hospital Internacional de Colombia.
3 Residente, Universidad de Cartagena.
4 Gastroenteróloga y reumatóloga, Hospital internacional de Colombia.
Acta Gastroenterol Latinoam 2023;53(4):395-400
Recibido: 13/03/2023 / Aceptado: 04/12/2023 / Publicado online el 29/12/2023 /
https://doi.org/10.52787/agl.v53i4.331
Resumen
Introducción. Se describe la experiencia con el uso de tofacitinib en dos pacientes pediátricas con diagnóstico de colitis ulcerativa, en el Hospital Internacional de Colombia, y se realiza una revisión del estado del arte. Casos clínicos. Se presentan 2 pacientes de sexo femenino, de 14 y 15 años de edad, en las que se intenta inicialmente el manejo convencional de la colitis ulcerativa, sin respuesta adecuada después de dos años de tratamiento. En el primer caso se logró la remisión clínica a la semana de inicio del tratamiento con tofacitinib. En el segundo caso se logró la remisión clínica a las 3 semanas y la endoscópica a las 6 semanas de inicio del tratamiento. Discusión. Recientemente, se ha demostrado la eficacia del tofacitinib como terapia de inducción y mantenimiento en pacientes adultos con colitis ulcerativa activa de moderada a grave, con un perfil de seguridad aceptable. Sin embargo, en la edad pediátrica la información sobre su uso es limitada. Conclusión. El tofacitinib es una alternativa promisoria para el tratamiento de la colitis ulcerativa sin respuesta o con pérdida de respuesta al tratamiento convencional. Presentamos la experiencia de dos pacientes adolescentes en las que se logró la remisión clínica de la enfermedad antes de lo esperado, documentándose también la remisión endoscópica e histológica en una de ellas.
Palabras claves. Colitis ulcerativa, tofacitinib, adolescencia, pediatría, quinasas Janus, terapia biológica.
Experience in the Use of Tofacitinib in the Treatment of Ulcerative Colitis in Two Pediatric Patients: Two Case Reports
Summary
Introduction. In this report, the experience using tofacitinib in two pediatric patients diagnosed with ulcerative colitis at the International Hospital of Colombia is described. A review of the current state of the art is also carried out. Cases. Both patients had already undergone conventional management without an adequate response for almost two years. In case 1, clinical remission was achieved one month after initiating sustained treatment with tofacitinib. In case 2, clinical and endoscopic remissions were achieved two months after initiating treatment. Discussion. Studies have demonstrated its efficacy as induction and maintenance therapy for moderate to severe active ulcerative colitis, with an acceptable safety profile. However, information about the use of tofacitinib within the treatment arsenal is limited in the pediatric age group. Conclusion. Tofacitinib is a promising alternative for the treatment of ulcerative colitis with no response or loss of response to conventional treatment. We present the experience of two adolescent patients in whom clinical remission of the disease was achieved earlier than expected, also documenting endoscopic and histologic remission in one of them.
Keywords. Ulcerative colitis, tofacitinib, adolescence, pediatrics, Janus kinase, biological therapy.
Abreviaturas
CU: Colitis ulcerativa.
PUCAI: Índice de actividad de colitis ulcerativa pediátrica, por sus siglas en inglés.
TNF: Factor de necrosis tumoral, por sus siglas en inglés.
JAK: Quinasas Janus, por sus siglas en inglés.
FDA: Food and Drug Administration.
Introducción
La colitis ulcerativa (CU) es una enfermedad inflamatoria de etiología multifactorial y comportamiento crónico, que casi siempre afecta al recto y puede extenderse a todo el colon, caracterizada por períodos de remisión y recaídas.1,2,3 Su prevalencia e incidencia mundial han venido en incremento. Tiene una mayor prevalencia en países desarrollados, particularmente en la edad pediátrica.2,3,4 Cuando inicia en la infancia o en la adolescencia, a menudo se caracteriza por una rápida progresión,3 y una mayor severidad y extensión de la enfermedad. Presenta compromiso de todo el colon en hasta el 70%-80% de los casos, en comparación con solo el 20%-40% en los adultos.5 Lo expuesto anteriormente hace que su tratamiento sea un desafío en esta edad de presentación. La severidad de la CU en niños se define por el índice de actividad de colitis ulcerativa pediátrica (PUCAI), el cual tiene una puntuación máxima de 85.6
Los pacientes con CU a menudo requieren terapia médica de por vida para controlar los síntomas y evitar la progresión de la enfermedad, la hospitalización y la colectomía.7 Las terapias convencionales (aminosalicilatos, corticoides e inmunomoduladores como azatioprina/mercaptopurina y ciclosporina/tacrolimus) han mostrado no ser efectivas en todos los pacientes con CU, lo que ha hecho necesaria la búsqueda de nuevas estrategias farmacológicas. En este sentido, la incorporación de terapias biológicas, como los antagonistas del factor de necrosis tumoral (TNF) (infliximab, adalimumab y golimumab), antiintegrinas (vedolizumab) y anti-p40 IL-12/23 (ustekinumab), ha permitido aumentar las posibilidades de alcanzar los objetivos propuestos.8 A pesar de ello, la tasa de remisión clínica a las 2 semanas de tratamiento con cualquiera de los agentes biológicos disponibles en la actualidad es inferior al 60%. En la mayoría de los casos, se alcanza entre las semanas 8 y 14 semanas.9 Además, se ha reportado que entre el 20% y el 40% de los pacientes que responden a los antagonistas del TNF experimentarán una pérdida secundaria de la respuesta.10 Esta es la razón por la que se están desarrollándose un gran número de principios activos, denominados inhibidores de moléculas pequeñas, que actúan sobre la transducción de señales en el interior de la célula. Entre estos fármacos, se encuentra el tofacitinib, un inhibidor de las quinasas Janus (JAK).3,11,12
Se presentan dos pacientes en edad pediátrica con CU en los que el tratamiento con tofacitinib logró remisión clínica de la enfermedad. En uno de ellos, se pudo documentar también la remisión endoscópica e histológica.
Caso clínico 1
Paciente femenina con diagnóstico de CU a los 15 años de edad, Paris E4S1 con actividad severa (PUCAI: 85), tratada inicialmente con un ciclo de inducción con prednisona por 1 mes con posterior descenso de la dosis y mantenimiento con mesalazina y azatioprina. Tuvo una respuesta inicial favorable, pero presentó una recaída de la enfermedad a los 6 meses de inicio del tratamiento, debido a una mala adherencia. Se realizó un nuevo ciclo de inducción con prednisona, se aumentó la dosis de mesalazina oral y se iniciaron enemas de mesalazina. Continuó con actividad leve de la enfermedad, con una nueva exacerbación a los 16 años de edad, con PUCAI de 60, que requirió hospitalización. Se indicó un nuevo ciclo de inducción con esteroide endovenoso (EV), lográndose la remisión de la enfermedad (PUCAI: 0).
En ese momento, se documentó como complicación una trombosis venosa profunda del miembro inferior izquierdo, por lo que se inició anticoagulación con enoxaparina subcutánea por 3 meses, lográndose su resolución, documentada por doppler. Continuó con mantenimiento con azatioprina y mesalazina (vía oral y en enemas). A los 16 años y 8 meses, por persistencia de actividad moderada de la enfermedad (PUCAI: 45), se inició infliximab EV 5mg/kg/dosis, administrado en las semanas 0, 2 y 6, lográndose la remisión clínica de la enfermedad (PUCAI: 0). Sin embargo, por mala adherencia al tratamiento, 6 meses después presentó una nueva recaída clínica (PUCAI: 50). Se reinició infliximab 10mg/kg/dosis en las semanas 0, 2 y 4, sin respuesta después de la tercera dosis, por lo que se hospitalizó nuevamente con actividad severa de la enfermedad (PUCAI: 85). Se indicó terapia de inducción acelerada con infliximab, administrándose dosis semanales de
10 mg/kg/dosis por 4 semanas, sin lograr mejoría de la enfermedad, persistiendo con PUCAI entre 60 y 85.
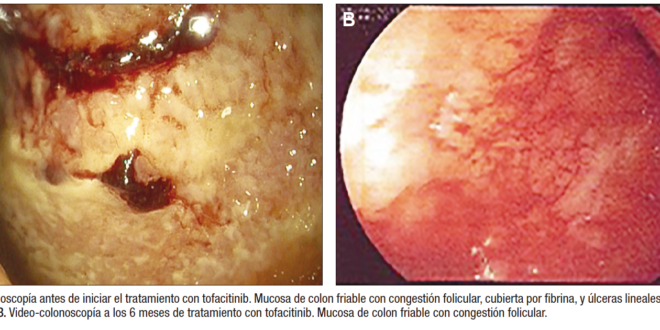
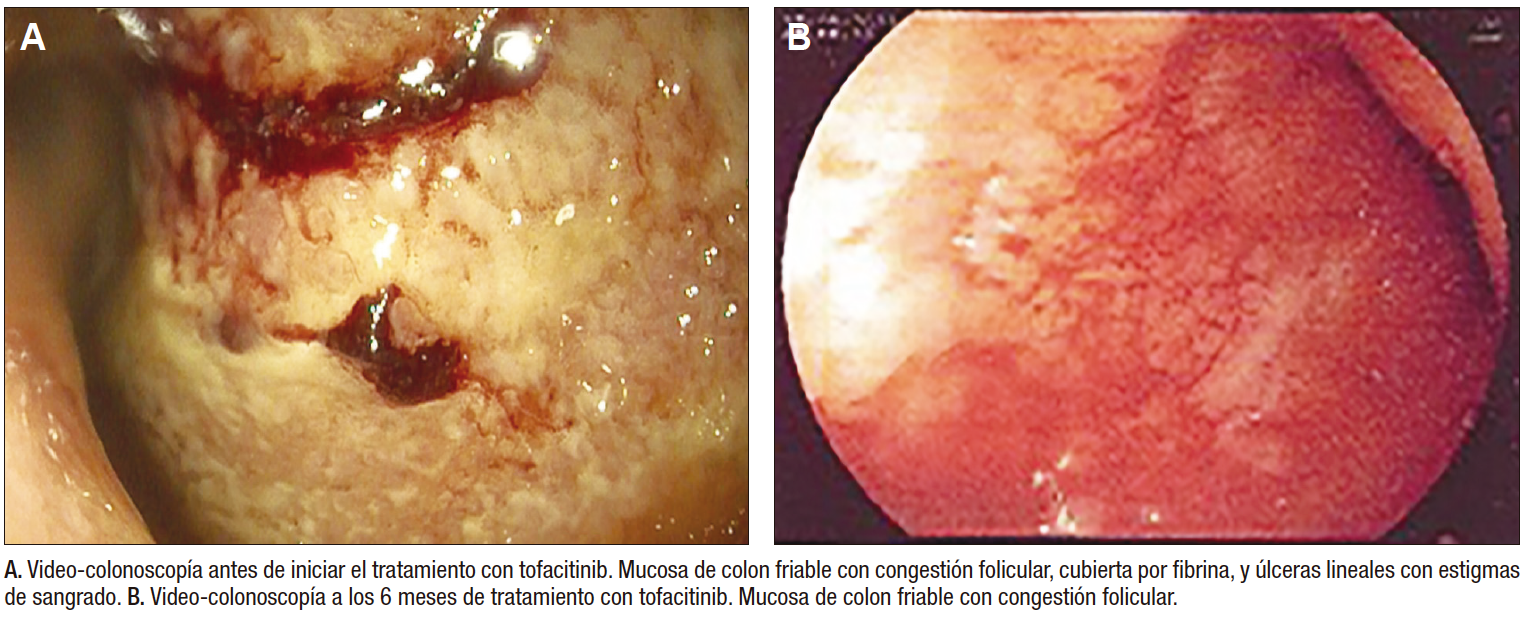
A los 17 años y 4 meses, ante el riesgo inminente de colectomía, se decidió iniciar tofacitinib a dosis de 5 mg vía oral cada 12 horas, lográndose la remisión clínica de la enfermedad (PUCAI: 0) a la semana de inicio. A los 6 meses del inicio del tratamiento con tofacitinib, la calprotectina en materia fecal era de 613 µg/g y la videocolonoscopía con biopsias documentó proctocolitis crónica moderada (Figura 1). Se decidió aumentar la dosis de tofacitinib a 10mg cada 12 horas, con lo que la paciente mantuvo la remisión clínica de la enfermedad (PUCAI: 0) durante el seguimiento por 12 meses. Se encuentra en plan de nuevo control endoscópico, a la espera de autorización por parte de su asegurador.
Caso clínico 2
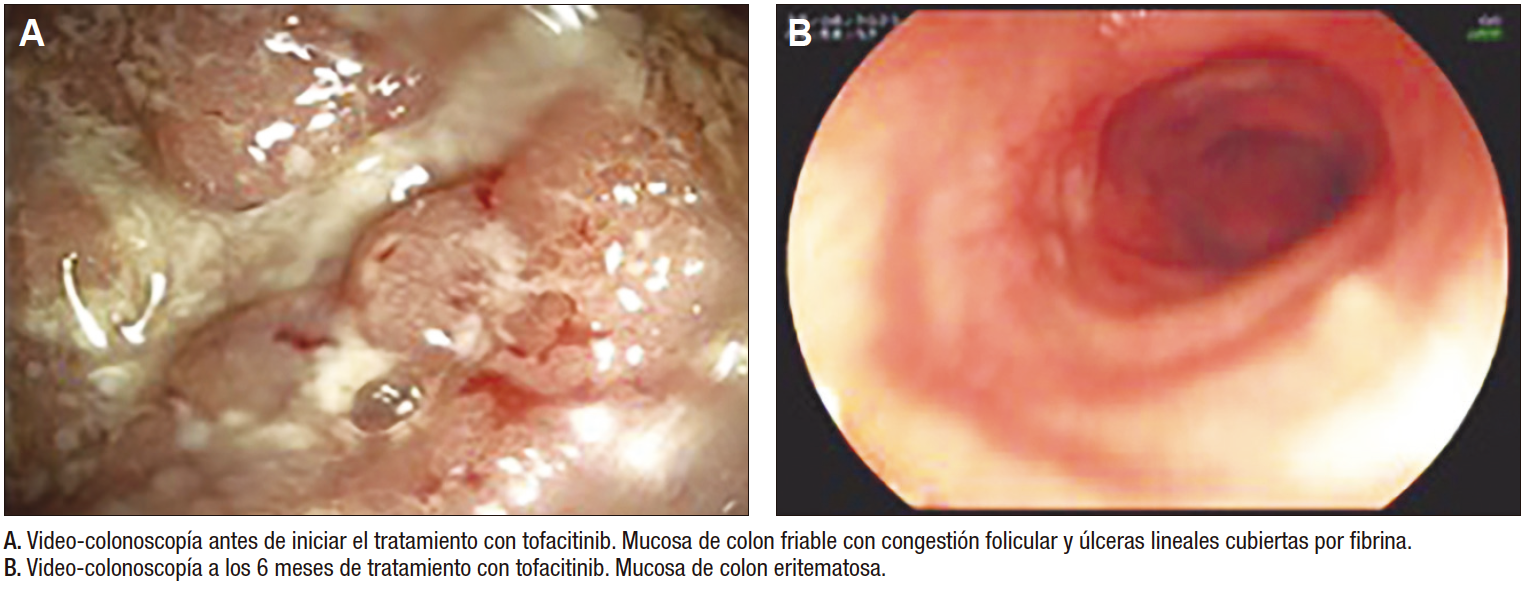
Paciente femenina con diagnóstico de CU a los 14 años de edad, Paris E2S1, a quien se le inició tratamiento inmunosupresor con esteroide EV por 5 días. A continuación, se realizó switch a la vía oral con prednisona, azatioprina y mesalazina (vía oral e intrarrectal), con recaída a los 2 días, por lo que se consideró una paciente corticorresistente. Se inició infliximab EV 5mg/kg/dosis en las semanas 0, 2 y 6, lográndose remisión clínica a las 2 semanas. Se continuó con infusiones cada 8 semanas, manteniéndose la remisión clínica de la enfermedad durante 12 dosis. No obstante, a los 16 años de edad, presentó una recaída sintomática con PUCAI 40. Se realizó control endoscópico, que documentó pancolitis ulcerativa de predominio izquierdo (UCEIS: 7), niveles de anticuerpos antiinfliximab positivos y calprotectina fecal 800 µg/g. Ante la presencia de anticuerpos anti inflizimab, se decidió iniciar tratamiento con tofacitinib vía oral 5 mg cada 12 horas, con mejoría clínica a los 5 días, lográndose la remisión clínica al cumplir 3 semanas de tratamiento. A los 3 meses del inicio del tratamiento, presentó calprotectina de 25 µg/g y a los 6 meses se documentó la remisión endoscópica e histológica (Figura 2). Durante el seguimiento de 24 meses desde el inicio del tratamiento, la paciente mantuvo la remisión clínica de la enfermedad (PUCAI: 0).
Discusión
El objetivo a corto plazo del tratamiento en la CU activa es controlar los síntomas y los signos de la enfermedad (tratamiento de inducción). Una vez que esto se ha logrado, el objetivo a largo plazo es mantener la remisión clínica de la enfermedad.3,7 En los últimos años, se ha recomendado la curación de la mucosa como un objetivo adicional del tratamiento, ya que se observó que los pacientes en remisión clínica con frecuencia persisten con actividad endoscópica e histológica residual, lo que se asocia con un mayor riesgo de recaída a mediano plazo.5
El tofacitinib es una pequeña molécula que pertenece a la familia de los inhibidores de JAK. Inhibe las proteínas tirosín-quinasas JAK1 y JAK3 (vía JAK-STAT) que participan en la activación celular y en la liberación de citoquinas mediante la fosforilación intracitoplasmática de receptores.9 Recientemente, se ha demostrado su eficacia como terapia de inducción y mantenimiento en pacientes adultos con CU activa de moderada a grave, con un perfil de seguridad aceptable.12 En 2018, el tofacitinib en combinación con metotrexato obtuvo la autorización de la Agencia Europea de Medicamentos para el tratamiento de la CU en pacientes adultos con enfermedad activa moderada a grave con intolerancia, respuesta insuficiente o pérdida de respuesta a tratamientos previos.3 El tofacitinib fue aprobado recientemente por la FDA para su uso en la artritis idiopática juvenil pediátrica. También se informó que es seguro y eficaz en el tratamiento de la psoriasis en pediatría. Sin embargo, los datos sobre el uso de tofacitinib en la enfermedad inflamatoria intestinal pediátrica son limitados.4
Los estudios OCTAVE Induction 1 y 2 son ensayos clínicos de fase III, aleatorizados, doble ciego y controlados con placebo de idéntico diseño. En el OCTAVE Induction 1, la remisión a las 8 semanas se logró en el 18,5% de los pacientes en el grupo de tofacitinib de 10 mg frente al 8,2% en el grupo placebo (p = 0,007). En el OCTAVE Induction 2, la remisión se produjo en el 16,6% en el grupo tofacitinib frente al 3,6% en el grupo placebo (p < 0,001). Aquellos pacientes que respondieron en ambos estudios fueron posteriormente realeatorizados en el estudio OCTAVE Sustain, que evaluó la remisión a las 52 semanas, la cual se alcanzó en el 34,3% de los pacientes en el grupo de tofacitinib de 5 mg y en el 40,6% en el grupo de tofacitinib de 10 mg; frente al 11,1% en el grupo de placebo (p < 0,001).7,12 Por otra parte, los pacientes que no respondieron en los estudios OCTAVE Induction 1 y 2 fueron reclutados en el estudio OCTAVE Open en el que, después de 12 meses de tofacitinib 5 mg dos veces al día, el 68,3% de los pacientes estaban en remisión, el 73,9% tenían mejoría endoscópica y el 77,5% tenían respuesta clínica.7,11,13 En los 2 pacientes presentados, el tratamiento con tofacitinib logró la remisión clínica de la enfermedad antes de las 8 semanas, sostenida durante el tiempo de seguimiento (12 y 24 meses respectivamente). En uno de los pacientes se documentó también la remisión endoscópica e histológica a los 6 meses desde el inicio del tratamiento.
Un estudio de cohorte francés incluyó a pacientes adultos con CU refractaria a los antagonistas del TNF y a vedolizumab, que recibieron tratamiento con tofacitinib, de los cuales un tercio logró la remisión clínica libre de esteroides en la semana 14 y el 70% evitó la colectomía al año, con un perfil de seguridad aceptable.14 Un estudio retrospectivo realizado en el hospital de Filadelfia, Pensilvania, incluyó a 21 pacientes de entre 15 y 20 años de edad con CU refractaria al tratamiento estándar que iniciaron tofacitinib. El 42,9% de los casos mostró una respuesta clínica en la semana 12, con un 33,3% de remisión clínica sin esteroides.4
En 2021, la FDA concluyó que el uso de tofacitinib tiene un riesgo aumentado de eventos cardiovasculares serios (ictus e infarto) y de cáncer (de piel y de pulmón), en comparación con los antagonistas del TNF. También puede elevar el riesgo de tromboembolismo en pacientes de alto riesgo. Está contraindicado en pacientes con trombosis venosa profunda, infecciones graves y activas, tuberculosis activa, infecciones oportunistas, embarazo y lactancia. La evidencia en CU es escasa y limitada a pequeñas cohortes retrospectivas.9,10,11 En nuestros pacientes no se observaron eventos adversos durante el período de seguimiento.
En Colombia, solo contamos con un estudio observacional descriptivo multicéntrico en pacientes adultos con CU, que recibieron tratamiento con tofacitinib en fase de inducción durante 8 semanas y luego terapia de mantenimiento. El 58,8% de los pacientes lograron remisión clínica, bioquímica y endoscópica. Durante el mantenimiento, el 76,9% de los pacientes a las 26 semanas y el 66,6% a las 52 semanas presentaron remisión clínica. Ocho pacientes presentaron eventos adversos, ninguno de ellos cardiovascular o tromboembólico.15
Conclusión
El tofacitinib es una alternativa promisoria para el tratamiento de la CU sin respuesta o con pérdida de respuesta al tratamiento convencional, con un perfil de seguridad aceptable. Presentamos la experiencia de dos pacientes adolescentes en las que se logró la remisión clínica de la enfermedad antes de lo esperado, documentándose también la remisión endoscópica e histológica en una de ellas.
Consentimiento para la publicación. Para la confección de este manuscrito, se utilizaron datos anonimizados que no han distorsionado su significado científico.
Propiedad intelectual. Los autores declaran que los datos y las figuras presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflictos de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2023 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como:
Velásquez Vanegas K, Cuadros Mendoza C A, Daniels García M J y col. Experiencia en el uso de tofacitinib para el tratamiento de colitis ulcerativa en dos pacientes en edad pediátrica: reporte de casos. 2023;53(4):395-400. https://doi.org/10.52787/agl.v53i4.331
Referencias
- Kucharzik T, Koletzko S, Kannengiesser K, Dignass A. Algoritmos diagnósticos y terapéuticos de la colitis ulcerosa. Dtsch Arztebl Int. 2020;117(33-34):564-74. DOI: 10.3238/arztebl.2020.0564
- Juliao F, Grillo CF, Alfaro I, et al. Update of the PANCCO clinical practice guidelines for the treatment of ulcerative colitis in the adult population. Rev Gastroenterol Mex (Engl Ed). 2022;87(3):342-61. DOI: 10.1016/j.rgmxen.2022.04.006
- Panés, J, Gisber JP. Eficacia de tofacitinib en el tratamiento de la colitis ulcerosa. Gastroenterol Hepatol. 2019;42(6):403-12. DOI: 10.1016/j.gastrohep.2019.0
- Moore H, Dubes L, Fusillo S, Baldassano R, Stein R. Tofacitinib Therapy in Children and Young Adults With Pediatric-onset Medically Refractory Inflammatory Bowel Disease. JPGN. 2021;73:e57-e62.
- Stallard L, Hussey S. Endoscopic and Histologic Predictors of Outcomes in Pediatric Ulcerative Colitis-Caveat Emptor. Front Pediatr. 2021;9:678132. DOI: 10.3389/fped.2021.678132
- Turner D, Ruemmele FM, Orlanski-Meyer E, Griffiths AM, de Carpi JM, Bronsky J, et al. Management of Paediatric Ulcerative Colitis, Part 2: Acute Severe Colitis-An Evidence-based Consensus Guideline from the European Crohn’s and Colitis Organization and the European Society of Paediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2018;67(2):292-310. DOI: 10.1097/MPG.0000000000002036
- Colombel JF, Osterman MT, Thorpe AJ, Salese L, Nduaka CI, Zhang H, et al. Maintenance of Remission with Tofacitinib Therapy in Patients With Ulcerative Colitis. Clinical Gastroenterology and Hepatology. 2022;20(1):116-25. DOI.org/10.1016/j.cgh.2020.10.004
- Quera R, Flores L, Núñez P, Ibáñez P. Tofacitinib en el tratamiento de la colitis ulcerosa: casos clínicos. Rev. Méd. 2020;148(7):1039-43.
- Del Brío R. Nuevas terapias en enfermedad inflamatoria intestinal. Canarias Pediátrica. 2022;46(2): 206-12.
- Sedano R, Ma C, Jairath V, Feagan BG. Janus Kinase Inhibitors for the Management of Patients with Inflammatory Bowel Disease. Gastroenterol Hepatol. 2022;18:14-27.
- López A, Esplugues JV, Domènech E. Farmacología y seguridad de tofacitinib en colitis ulcerosa. Gastroenterol Hepatol. 2021;44:39-48.
- Sandborn W, Su C, Sands B, D’Haens G, Vermeire S, Schreiber S, et al. Tofacitinib as Induction and Maintenance Therapy for Ulcerative Colitis. N Eng J Med. 2017;376(18):1723-36. DOI: 10.1056/nejmoa1606910
- Singh S, Murad MH, Fumery M, Dulai PS, Sandborn WJ. First- and Second-Line Pharmacotherapies for Patients with Moderate to Severely Active Ulcerative Colitis: An Updated Network Meta-Analysis. Clin Gastroenterol Hepatol. 2020;18(10):2179-91.e6. DOI: 10.1016/j.cgh.2020.01.008
- Lair-Mehiri L, Stefanescu C, Vaysse T, Laharie D, Roblin X, Rosa I, et al. Real-world evidence of tofacitinib effectiveness and safety in patients with refractory ulcerative colitis. Dig Liver Dis. 2020; 52(3):268-73. DOI: 10.1016/j.dld.2019.10.003.
- Parra V, Frías JS, Márquez JR, Juliao F, Galindo P, Cuadros C, et al. Tofacitinib en el tratamiento de la colitis ulcerosa de moderada a grave en Colombia: experiencia en mundo real. Gastroenterol Hepatol. 2023;46(7):512-21. DOI: 10.1016/j.gastrohep.2022.10.020
Correspondencia: Karen Velásquez
Correo electrónico: karen.10.kvv@gmail.com
Acta Gastroenterol Latinoam 2023;53(4)395-400
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE