Mónica González Y,1 Juan Cristóbal Ossa,2 Francisco Alliende G,3 Paulina Canales R,4 Colomba Cofré D,5 Rossana Faúndez,6 Marcela Toledo,7 Verónica Busoni,8 Mónica Contreras,9 Marcela Fabeiro,10 Raquel Furnes,11 Marta Wagener,12 Silvia Bravo,13 Marina Orsi,8 Mabel Zacur de Jiménez,14 Lidia Ortiz,15 Magaly Rodríguez,16 Lucía Vivar,17 José Mayen,18 Nelson Ramírez Rodríguez,19 Claudio Iglesias,20 María Noel Tanzi,20 Laura Delgado20
1 Hospital de Niños Dr. Roberto del Río, Clínica Las Condes.
2 Hospital Luis Calvo Mackenna, Clínica Las Condes.
3 Clínica Alemana.
4 Hospital Exequiel González Cortés, Clínica Santa María.
5 Pontificia Universidad Católica de Chile.
6 Hospital San Juan de Dios, Clínica Santa María.
7 Hospital de Niños Dr. Roberto del Río, Clínica Dávila.
Santiago, Chile.
8 Hospital Italiano de Buenos Aires.
9 Hospital Nacional de Pediatría Juan P Garrahan, Hospital Alemán.
Ciudad Autónoma de Buenos Aires, Argentina.
10 Hospital de Niños de La Plata. La Plata, Argentina.
11 Hospital Privado de Córdoba. Córdoba, Argentina.
12 Hospital de Niños Dr. O Alassia. Sante Fe, Argentina.
13 Hospital de Niños Víctor J Vilela. Rosario, Argentina.
14 Universidad de Asunción (FCM-UNA). Asunción, Paraguay.
15 Hospital Nacional Itaugua, Clínica Universidad Católica Nuestra Señora de la Asunción. Campus Guairá, Paraguay.
16 Hospital de Niños JM de los Ríos. Caracas, Venezuela.
17 Hospital Nacional Pedro de Betancourth, San Felipe de Jesús. Antigua Guatemala, Guatemala.
18 Clínica Privada Gastrokids. Ciudad de Guatemala, Guatemala.
19 Hospital Materno Infantil CNS. La Paz, Bolivia.
20 Centro Hospitalario Pereira Rossell. Montevideo, Uruguay.
Acta Gastroenterol Latinoam 2018;48(3):226-241
Recibido: 02/10/2017 / Aprobado: 19/06/2018 / Publicado en www.actagastro.org el 17/09/2018
Resumen
La Enfermedad Inflamatoria Intestinal (EII) incluye enfermedad de Crohn (EC), colitis ulcerosa (CU) y colitis indeterminada. Existe un incremento mundial en la prevalencia e incidencia en adultos y en niños. Los pacientes pediátricos difieren respecto de la presentación y evolución
de la enfermedad. Objetivos. Actualizar la epidemiología y patogenia de la EII en pediatría. Revisar su presentación clínica, pronóstico, costos y calidad de vida. Proponer esquema de estudio, manejo terapéutico y nutricional. Métodos. SLAGHNP nombró un coordinador que convocó a subcoordinadores y colaboradores para la revisión de los distintos aspectos relacionados con la EII. Se escogió bibliografía con la mejor evidencia disponible y se procedió a unificar y editar los contenidos. Resultados. El documento destaca que: 1) la incidencia y prevalencia de EII se ha incrementado tanto en países desarrollados como en los paises en vía de desarrollo; 2) la EII resulta de la interacción entre el ambiente, la microbiota y los genes; 3) los pacientes pediátricos tienen un compromiso más extenso y presentan una progresión continua dentro de los primeros 5 a 7 años del diagnóstico; 4) el estudio diagnóstico de la enfermedad es similar al de los adultos; 5) el manejo terapéutico difiere de los adultos en el uso de la terapia nutricional 6) la terapia debe ser más agresiva en ciertas condiciones, evitando el sobreuso de corticoides; 7) actualmente se dispone de calprotectina fecal como un buen marcador biológico de ayuda en el seguimiento de esta enfermedad. Conclusiones. Ha habido avances en el entendimiento de la patogénesis de la EII, lo que ha conducido al desarrollo de nuevas terapias para su manejo. El desafío actual es conocer cómo la susceptibilidad genética modifica la respuesta inmune y cómo esta susceptibilidad determinará la respuesta a determinada terapia. Por otro lado, la población pediátrica presenta nuevos desafíos: aumento de su incidencia y con fenotipos más agresivos en relación con la enfermedad del adulto por lo cual se requiere un diagnóstico precoz y con manejo individualizado. Esta guía propone hacer una puesta al día en la EII pediátrica.
Palabras claves. Enfermedad inflamatoria intestinal, colitis ulcerosa, enfermedad de Crohn, colitis indeterminada.
Pediatric Inflammatory Bowel Disease (IBD): review and update. Working group of Latin American Society of Gastroenterology, Hepatology and Pediatric Nutrition (LASPGHAN)
Summary
Inflammatory Bowel Disease (IBD) includes Crohn’s Disease (CD), Ulcerative Colitis (UC) and indeterminate colitis. There is a worldwide increase in prevalence and incidence in adults and children. Pediatric patients differ regarding the presentation and course of the disease. Objectives. Update epidemiology and pathogenesis. Review its clinical presentation, prognosis, costs and quality of life. Propose scheme of study, therapeutic and nutritional management. Methods. LAPSGHAN appointed to a coordinator who called sub-coordinators and collaborators to review the different aspects related to IBD. The literature with the best evidence was chosen and the contents were unified and edit. Results. The document highlights: 1) incidence and prevalence of IBD has increased in developed countries as well as in countries in developing path; 2) IBD results from the interaction between the environment, the microbiota and genes; 3) pediatric patients have an extensive commitment and have a continuous progression within the first 5-7 years of diagnosis; 4) the diagnostic workup is similar to adults; 5) the therapeutic management differs from adults regarding the nutritional therapy which should be more aggressive in children; 6) in some conditions the therapy should be more aggressive, avoiding the overuse of steroids; 7) at this moment we have fecal calprotectin as a good biological marker for the follow up of this disease. Conclusions. There have been advances in the pathogenesis of IBD, which has led to the development of new therapies for management. The current challenge is to understand how the genetic susceptibility modifies the immune response and how this susceptibility will determine the response to specific therapy. On the other hand, the pediatric population presents new challenges: an increase in its incidence, with more aggressive phenotypes related to adult disease, which requires an early diagnosis and individualized management. This guide proposes an update in pediatric IBD.
Key words. Inflammatory bowel disease, ulcerative colitis, Crohn’s disease, indeterminate colitis.
La enfermedad inflamatoria intestinal (EII) abarca: enfermedad de Crohn (EC), colitis ulcerosa (CU) y colitis indeterminada; enfermedades distintas pero relacionadas, que afectan crónicamente al tracto gastrointestinal (GI) y comparten ciertas características, pero que, sin embargo, poseen importantes diferencias clínicas. Esta enfermedad puede presentarse a lo largo de toda la edad pediátrica, siendo la edad de presentación más frecuente la segunda década de la vida. La etiología como la patogenia aún no están bien establecidas. Los pacientes pediátricos diagnosticados se verán enfrentados de por vida a los efectos y consecuencias de una enfermedad crónica.
Epidemiología
La EII puede presentarse a cualquier edad, con un pico que oscila entre la segunda y tercera década de la vida.1, 2 El estudio multicéntrico de EII de Comienzo Precoz (NEOPICS) ha logrado reunir casos de presentación de EII en niños menores de 6 años e incluso en menores de 1 año. En este grupo de pacientes se han descubierto distintas mutaciones en genes reguladores de inmunidad (IL-10, NADPH, XIAP entre otros), que se manifiestan en una EII de fenotipo más extenso, generalmente colónico y que presenta importantes dificultades en el manejo terapéutico con respecto a la EII en niños de edad mayor a 6 años.3, 4
Dicho lo anterior, la EII aumenta desde el primer año de vida, observándose tasas más altas en adolescentes. Del total de diagnósticos de EII, un 25% se realiza durante la infancia y adolescencia, siendo la CU más común que la EC en preescolares y, al contrario, la EC más frecuente en niños mayores.5 Con respecto al género, en pediatría existiría una ligera predominancia masculina, a la inversa de lo que ocurre en adultos.1
Existe un incremento a nivel mundial en la prevalencia e incidencia.5 Las mayores tasas están en Europa, el Reino Unido y América del Norte, pero también, la EII puede ocurrir en otras zonas como Asia, América Latina y África.6 La prevalencia de EC en América del Norte es de 26,0 a 198,5 casos por 100.000 habitantes y para CU de 37,5 a 229 casos por 100.000. La incidencia de EC es de 3,1 a 14,6 por 100.000 personas por año, y para CU 2,2 a 14,3 casos por 100.000 personas por año.2 Estudios pediátricos de revisión sistemática, como el de Benchimol realizado en el 2011, analizaron las tendencias epidemiológicas de la EII en los últimos 50 años. De los artículos seleccionados (28 en total) un 78% demostró un aumento significativo en la incidencia de esta patología. La EC mostró un aumento significativo en la incidencia al igual que la CU, pero esta última en menor grado.7 Por otro lado, un estudio canadiense demostró un aumento de la incidencia de EC pediátrica de 9,5 a 11,4 por 100.000 habitantes/año, durante un período de observación de 11 años; mientras la incidencia de CU no mostró cambios.1, 2, 5 En contraste, en América Latina, particularmente en Argentina, la incidencia de EII es mucho menor con reportes recientes de 0,4/100.000 en < 18 años 8 y, al igual que en Europa, el Reino Unido y América del Norte hay un aumento en la prevalencia de EC. Por lo anterior, se hace necesario en el futuro contar con un mejor y mayor cantidad de estudios epidemiológicos para tener clara la tendencia de la EII pediátrica.
Estudios epidemiológicos sugieren diferencias geográficas en EII, especialmente para EC, siendo más frecuente en países del hemisferio norte, comparados con regiones de menor latitud.1, 6 Dentro de los riesgos asociados a EII están los ambientales. Entre estos, el tabaco predispone a mayor riesgo de EC, aumenta el riesgo de cirugía y recurrencia; versus en CU que tendría efecto protector. La apendicectomía tendría un rol protector para la aparición de CU.6
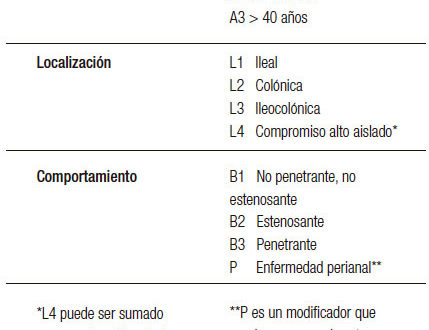
Los pacientes pediátricos al debut de enfermedad tienen compromiso más extenso en comparación con la población adulta y presentan progresión continua dentro de los primeros 5 a 7 años del diagnóstico.2 En todos los estudios de cohorte o registros de EII pediátrica, la inflamación íleo colónica (L3 +/- L4 según la clasificación de Montreal (Tabla 1) es la presentación más frecuente para EC, y la pancolitis (E3) para CU, en contraste con cohortes adultas.1
Tabla 1. Clasificación de Montreal.
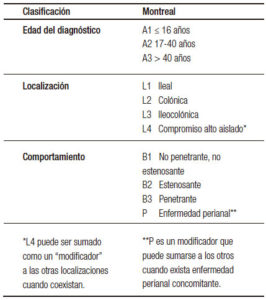
Además de las diferencias en edad de inicio y localización, la EII pediátrica difiere de la adulta por tener mayor tendencia a complicarse a lo largo de los años. El registro francés EPIMAD mostró que la progresión a complicación penetrante (B2) o estenosante (B3) de la EC se observó en 29% de niños al diagnóstico y en 59% al seguimiento. Esto en contraste con estudios de adultos en que solo 16% presentan complicación (paso B2 o B3) precozmente luego del diagnóstico.1
Todos lo anterior apoya la necesidad de un diagnóstico e inicio de tratamiento precoz y potente con el fin de evitar la progresión de la EII pediátrica y sus importantes consecuencias en la salud del niño.
Patogenia
La EC y la CU son desórdenes complejos que resultan de la interacción ambiental, la microbiota y los genes.9, 10 Dentro de los factores ambientales se destaca la dieta, siendo difícil identificar la contribución de los nutrientes de forma individual. Los estudios tanto de caso control como de metaanálisis muestran que una occidentalización de la dieta en Europa del Este, Asia y Japón se correlaciona con un aumento de la EC.11, 12 La ingesta excesiva de ácidos grasos poliinsaturados, y de azúcares refinados aumenta el riesgo, a diferencia de los vegetales, frutas, pescados y fibra, que lo disminuyen. La única intervención nutricional de prevención recomendada en 4 metaanálisis es el aporte de leche materna con odds radio para EC 0,45 (IC95%: 0,26-0,79) y para CU 0,56 (IC95%: 0,38-0,81).12
Las bacterias gastrointestinales y sus productos, en asociación con un epitelio gastrointestinal (GI) alterado y/o desencadenantes ambientales, propagan y desregulan la respuesta inmune, provocando una inflamación crónica, predispuesta genéticamente en algunos individuos.5 Es así como algunos estudios han demostrado un aumento de bacterias patógenas (Bacteroides y E. Coli) y una disminución de bacterias beneficiosas (Lactobacilus y Firmicutes) en pacientes con EII.2, 6
Uno de los mayores avances para entender la patogenia ha sido el desarrollo de investigación en el campo de la genética. Existen muchos estudios dirigidos a la búsqueda del gen específico que gatilla la EII. El estudio del genoma ampliado ha identificado 99 locus susceptibles no superpuestos para EC y 28 compartidos con CU. Aproximadamente el 50% de los locus susceptibles se asocian a otras enfermedades inmunes.6 Todos los estudios posteriores demuestran que tanto EC como CU no son enfermedades monogénicas, sino que responden a un patrón poligénico complejo.1 Es así como un número creciente de genes están involucrados en la patogenia de ambas enfermedades. En EC algunos de los genes implicados están vinculados a inmunidad innata que se activa en forma inmediata cuando ingresa un antígeno al organismo, jugando un rol clave en la inflamación, y otros genes están vinculados con la inmunidad adaptativa que involucra una respuesta inmunomediada más compleja con antígenos más específicos, liberándose diversas citoquinas que mantienen esta inflamación activa en forma persistente. Al parecer son diferentes los tipos de citoquinas que intervienen en la inflamación en EC y en CU, aunque existen nuevas evidencias que sugieren que puede haber superposición de estas.6, 13, 14
Estudios genéticos de vinculación identificaron los primeros locus para EC en el cromosoma 16. Con posteriores clonaciones mostraron mutaciones presentes en el gen NOD2/CARD15 como el locus que más se asocia con EC. NOD2 es un receptor intracelular que actúa en el reconocimiento y presentación de las bacterias al sistema inmune innato; la presencia de este gen se asocia a un debut más temprano de EC y al desarrollo hacia un fenotipo fibroestenosante de íleon terminal. El segundo susceptible locus es el IBD5, presente en el cromosoma 5q31.10
La heredabilidad es mayor para EC que para CU, sin embargo, la prevalencia difiere en las distintas etnias; es así como las mutaciones NOD2/CARD15 están ausentes en los asiáticos. No está claro si el IBD5 juega un rol similar en EC o CU en las diferentes etnias. No se ha demostrado influencia del IBD5 en la progresión de la enfermedad.10
Existen otros locus de susceptibilidad identificados para EII. Uno de estos es el gen relacionado a autofagia 16 like1 (ATG16L1). El gen ATG16L1 se localiza en el cromosoma 2, en 2q37.1, y, codifica una proteína que está involucrada en la formación de autofagosomas durante la autofagia. La autofagia es un sistema de degradación no selectiva que tiene un rol en la adaptación e inanición, en el clearance de proteínas y organelos intracelulares, en el proceso de antienvejecimiento, en la eliminación de microorganismos, en la muerte celular, en la supresión de tumores y en la presentación de antígenos, todo lo cual contribuye a la tolerancia intestinal. La autofagia ha sido implicada en respuestas inmunes innatas y adaptativas. El rol específico de ATG16L1 en estos procesos no está claro. ATG16L1 no solo se expresa en las células intraepiteliales, sino también en linfocitos y macrófagos, e interactúa con otras dos proteínas ATG5 y ATG12 para formar un complejo esencial para cumplir su acción.2, 15
Recientemente, las mutaciones en el receptor de IL23 se han asociado al riesgo de desarrollar tanto EC como CU. La IL23 afecta el camino de la acción de la IL17, secretada por los linfocitos Th17 y que están involucrados en la patogénesis de la EII.2
El descubrimiento de los genes susceptibles para desarrollar EII ha sido un avance para poder entender las causas de esta enfermedad, así como la relación de los eventos fisiopatológicos de una manera más precisa. La observación del inicio de la EII en una determinada edad probablemente se asocia a la severidad de la enfermedad en algunos pacientes, pero la mayoría de los pacientes con diferente tipo de enfermedad y con mecanismos moleculares distintos presentan generalmente fenotipos clínicos superpuestos.1
Diagnóstico
El diagnóstico de EII debe basarse en la combinación de historia, examen físico, laboratorio y estudio endoscópico (esofagogastroduodenoscopía e ileocolonoscopía) con histología, y estudio del intestino delgado. Se debe descartar al inicio infecciones entéricas bacterianas, incluyendo el Clostridium difficile.
A. Cuadro clínico
La CU provoca una inflamación crónica y difusa de la mucosa del colon. Compromete el recto y una extensión variable del colon, extendiéndose de manera continua hacia el proximal, pudiendo llegar al ciego.6
En los niños suele debutar como pancolitis (70%), siendo menos frecuentes las colitis izquierdas y las proctitis.6 Cuando comienza con extensión limitada en corto plazo suele progresar hacia colitis extensa o pancolitis.5 La extensión se asocia con severidad por lo que la enfermedad que se presenta en la infancia tiene un fenotipo más severo.
La diarrea con sangre es el síntoma más habitual. Puede presentarse dolor abdominal y síntomas proctálgicos (pujo, tenesmo, urgencia evacuatoria).5
Los síntomas se correlacionan con la extensión de la enfermedad y pueden ir desde sangrado rectal intermitente en pacientes con proctitis leve, hasta urgencia defecatoria, tenesmo, dolor abdominal, pérdida de peso, e incluso perforación del colon en enfermedad severa extensa.6
La EC afecta cualquier parte del tracto digestivo, desde la boca al ano. En pediatría es preferentemente ileocolónica y con menor frecuencia se compromete el colon de manera aislada (colitis de Crohn). En pediatría el 50% tiene compromiso proximal (estómago o duodeno).5 Compromete la pared intestinal de manera transmural, su compromiso intestinal es discontinuo, pudiendo coexistir zonas de mucosa sana y enferma.5, 6 Al ser transmural puede fistulizarse y la inflamación crónica puede dar estenosis, produciendo obstrucción intestinal parcial o total. Es característica la enfermedad perianal con “tags” de piel: abscesos, fisuras profundas y/o fístulas, y se asocia con mayor frecuencia a manifestaciones extraintestinales, que pueden cursar en forma concomitante o independiente de la actividad de la enfermedad.5 Estas manifestaciones pueden darse en: piel (eritema nodoso, pioderma gangrenoso), ojos (epiescleritis, uveítis), huesos (osteoporosis), articulaciones (artritis, artralgias, sacroileitis, espondilitis), hígado (hepatitis autoinmune, colangitis esclerosante primaria en EC de colon) y páncreas (pancreatitis).5
En la EC los síntomas dependen de las zonas comprometidas del tracto digestivo.6 Las molestias más frecuentes incluyen dolor abdominal y diarrea crónica.5 En caso de compromiso colónico la diarrea es disentérica. Ocasionalmente puede haber disfagia o dolor retroesternal en compromiso esofágico y náuseas, dolor epigástrico o vómitos en el compromiso gástrico.5 La presencia de vómitos alerta sobre obstrucción intestinal.
Los síntomas GI de la EC pediátrica son similares a los de adultos, sin embargo, en la edad pediátrica existen manifestaciones características: retardo de crecimiento lineal y retardo puberal (5). Varios factores contribuyen al deterioro del crecimiento (lineal y puberal): la desnutrición, el proceso inflamatorio en sí y el tratamiento con esteroides.16-19 En el 25% de los pacientes el retardo del crecimiento antecede a la aparición de otros síntomas y al diagnóstico.17
En cuanto al proceso inflamatorio, la circulación de citoquinas proinflamatorias (TNF-alfa, IL-6, IL-1, etc.) interfieren con el factor de crecimiento insulino-símil I (IGF-I), mediador clave de los efectos de hormona de crecimiento en la placa de crecimiento ósea; se piensa que también estas citoquinas pueden interferir con los esteroides sexuales y, por lo tanto, en el retardo de la maduración sexual.5, 16, 17, 19
La desnutrición crónica se correlaciona con el retraso del crecimiento.16, 17 Su etiología es multifactorial: anorexia mediada por citoquinas, miedo a comer por el empeoramiento de los síntomas GI, saciedad precoz, náusea o dolor abdominal.5, 16, 17, 19 Los pacientes además presentan pérdidas de nutrientes por las heces; el daño de la mucosa producto de la inflamación lleva a enteropatía perdedora de proteínas; si existe enfermedad difusa de la mucosa del intestino delgado o resección de segmentos del intestino delgado puede haber esteatorrea.16-18 Los pacientes pueden presentar también deficiencias de micronutrientes y vitaminas (hierro, cobre, zinc, selenio, ácido fólico, vitamina B12, vitamina D).17
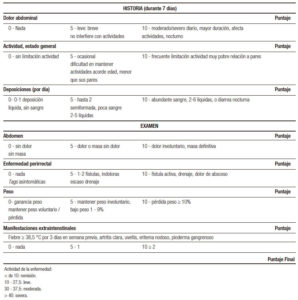
Existen índices de actividad de EII que permiten, entre otras cosas, determinar el tratamiento a seguir: PUCAI (pediatric ulcerative colitis activity index) y el PCDAI (pediatric Crohn´s disease activity index) (Tabla 2 y 3).
El PUCAI se basa únicamente en parámetros clínicos tales como: número de deposiciones al día, consistencia de ellas, presencia de sangre, deposiciones nocturnas, dolor abdominal y nivel de actividad diaria. Clasifica la enfermedad en leve, moderada y severa.
El PCDAI es el estándar utilizado durante los últimos 20 años de evaluación clínica de la EC, sin embargo, tiene limitaciones debido a incorporación de datos de laboratorio, velocidad de crecimiento (no siempre disponible) y examen perianal. Se han realizado esfuerzos en acortar o simplificar este índice, pero aún no existe una versión abreviada óptima que reemplace el índice original.20
Alrededor del 10% de los pacientes tienen una colitis indeterminada21 y corresponden a aquellos pacientes con inflamación intestinal crónica en los cuales el patrón de la enfermedad no permite hacer claramente la diferencia entre CU y EC después de repetidas colonoscopías y biopsias endoscópicas o incluso colectomía.22 A medida que la enfermedad evoluciona, la diferencia se esclarece y se puede diagnosticar una u otra enfermedad; con mayor frecuencia se reclasifica hacia colitis ulcerosa.5
B. Evaluación endoscópica
Permite la visualización directa de la mucosa colónica e ileal. Evalúa la severidad y extensión y, permite obtención de muestras histológicas.22 La evaluación inicial debe incluir esofagogastroduodenoscopía e ileocolonoscopía.22-24
En la CU existe compromiso de recto, aunque los niños pequeños pueden tener una presentación atípica con recto respetado. La inflamación progresa hacia el proximal de manera continua, con clara demarcación entre la mucosa sana y la enferma. Existe pérdida de transparencia vascular, eritema e hiperemia, friabilidad, erosiones, microulceraciones, exudado purulento y granularidad, y se pueden encontrar pseudopólipos. Los hallazgos dependen de la severidad de la enfermedad y del tiempo de evolución.22
El segmento distal del íleon terminal puede presentar eritema sin erosiones, o edema si existe una pancolitis con compromiso de válvula íleocecal (‘backwash ileitis’). En todas las otras presentaciones de CU el íleon terminal debe estar normal.22
En una CU severa se debe evitar una colonoscopía extensa por riesgo de perforación. Se sugiere realizar sigmoidoscopía para confirmar el diagnóstico con biopsias y descartar infección por citomegalovirus.22
En la EC la inflamación GI y colónica es discontinua, con recto respetado o parcialmente comprometido.22 Se pueden ver erosiones, úlceras lineales o serpiginosas, pseudopólipos, mucosa con aspecto de “empedrado”, áreas de inflamación y estenosis.1 El íleon distal está involucrado frecuentemente, incluso con áreas normales del colon. Por ello es importante intubar el íleon rutinariamente durante la colonoscopía.
Dado que la EC puede comprometer segmentos del intestino delgado, es importante intentar evaluar su compromiso tanto con técnicas endoscópicas como de imágenes. En algunos centros pediátricos existe la capacidad de hacer endoscopía profunda del intestino delgado, enteroscopía asistida por balón (BAE), ya sea con balón único (SBE) o doble balón (DBE). El enteroscopio de doble balón tiene un enteroscopio y un sobretubo, ambos con un balón de látex en sus extremos; a diferencia del enteroscopio de balón único, en el que solo el sobretubo posee un balón de silicona en el extremo. Ambos enteroscopios tienen un alance de 200 cm. La enteroscopía total asistida por balón (BAE) se define como una evaluación completa del intestino delgado, ya sea con un abordaje simple o combinado oral (proximal o anterógrada) – anal (distal o retrógrado). Esta técnica no siempre es posible en todos los pacientes, con una frecuencia de éxito en un rango del 16 al 86%.25 Las ventajas de la BAE consisten en la posibilidad de la toma de tejido para estudio, realizar intervenciones terapéuticas y recuperar cápsulas retenidas sin necesidad de cirugía. Las principales limitaciones de la BAE son su naturaleza invasiva, con riesgo de sangrado y perforación (0,8% para procedimientos diagnósticos y 4% para los terapéuticos), duración prolongada del procedimiento, evaluación limitada de la totalidad del intestino en un solo paso y la necesidad de personal especializado.25 Su indicación es para la obtención de biopsias intestinales para patología cuando el estudio imageneológico o endoscópico ha sido inconcluso o se requiere realizar intervención terapéutica o recuperar por ejemplo capsula retenida.
En pacientes sin obstrucción intestinal, una alternativa a la enteroscopía es la video-endoscopía con cápsula. La videocápsula es un instrumento que puede tener utilidad para diagnosticar la presencia de inflamación en el intestino delgado o para encontrar la causa de sangrado oculto digestivo, pólipos o tumores ocultos. Las principales limitaciones actuales de la videocápsula es que no puede tomar muestras de tejido, que en niños puede ser dificultoso tragar la cápsula y debe ser colocada mediante endoscopía en el duodeno, y por último, que requiere una limpieza del intestino intensiva.23, 25
La cápsula endoscópica (CE) contiene una cámara de vídeo en miniatura con una batería con autonomía de 8 horas, un transmisor y una antena. La unidad grabadora se lleva fuera del cuerpo. Ingerida la cápsula, viaja a través de todo el tracto gastrointestinal tomando 2 imágenes por segundo luego de lo que se excreta generalmente después de 8 a 72 horas. Las imágenes se procesan utilizando un software. En el caso de existir estenosis la cápsula puede quedar atrapada, por lo que se recomienda realizar una prueba previa con cápsulas para tal fin.23
La principal indicación de la CE en pediatría es definir la extensión y la severidad así como también la mejoría de la mucosa en EC. La mayoría de los pacientes pediátricos con EC tienen lesiones en el íleon terminal o en el colon, pero en un 30% las lesiones están limitadas al intestino delgado. Mientras la CE puede detectar las lesiones mucosas y así definir la actividad de la enfermedad, las imágenes pueden determinar el compromiso transmural y las lesiones extraintestinales.23
Si bien la CE ha mostrado mejorar el diagnóstico en adultos con EII, los reportes pediátricos son escasos y la mayoría son retrospectivos o incluyen solo un pequeño número de casos. En un metaanálisis reciente de 12 estudios que abarcó 428 pacientes con sospecha de EC no estenosante comparando CE con ileocolonoscopía, enteroscopía con balón, estudios baritados de tránsito intestinal, TAC abdominal y RNM, la CE obtuvo un incremento en el diagnóstico de 22-50% respecto del resto de los métodos diagnósticos.23
Lo recomendado entonces es realizar el estudio con CE en niños y adolescentes con alta sospecha de EC cuando la endoscopía y la colonoscopía convencional junto con las imágenes no son concluyentes. Las imágenes se deben realizar según la disponibilidad y experiencia de cada centro y deben preceder al uso de CE para evitar el riesgo de retención.23
C. Histología
En la CU la inflamación se limita a la mucosa. A nivel de la lámina propia se puede observar congestión, edema y aumento del número de células plasmáticas. Existe distorsión de las vellosidades y criptas, daños sugerentes de cronicidad. Presencia de agregados linfoides basales e infiltrado inflamatorio crónico; depleción de mucina en células caliciformes. Puede observarse criptitis (neutrófilos en pared de la cripta), abscesos crípticos (neutrófilos en interior de la cripta) o destrucción de las criptas. Una característica de la CU es la mayor severidad del compromiso histológico hacia segmentos distales del colon.22
En la EC la histología se caracteriza por la presencia de granulomas no caseosos, alteración focal de la arquitectura de las criptas (segmentaria o discontinua), inflamación crónica focal o en parches y preservación de la mucina en sitios activos. La ausencia de granulomas no descarta la enfermedad de Crohn ya que solo están presentes en un 20-40%.22
D. Laboratorio
La evaluación inicial debe incluir hemograma, enzimas hepáticas, albúmina, velocidad de eritrosedimentación (VSG), perfil de hierro y proteína C reactiva (PCR). Además, se debe solicitar un coprocultivo y estudio de Clostridium difficile.
El hemograma muestra signos de anemia (ferropénica o de enfermad crónica), leucocitosis y trombocitosis. Las proteínas totales y la albúmina sérica pueden estar bajas debido a pérdida intestinal; la VSG y PCR pueden estar aumentadas, pero su falta de elevación no excluye inflamación activa.5
Actualmente se utiliza en el estudio inicial de pacientes con EII, independiente de la localización y del tipo, un marcador de inflamación intestinal presente en deposiciones y que es superior a los marcadores séricos de inflamación: la calprotectina fecal.26 Esta es una proteína que se encuentra en los gránulos del citosol de los neutrófilos y que, por lo tanto, se eleva en los estados de inflamación intestinal.4 Inicialmente puede servir como medición basal para luego monitorizar la respuesta a terapia. En el seguimiento, la calprotectina se correlaciona con la severidad colónica y con la actividad de la CU, y tiene un rol detectando reactivaciones tiempo antes de que se hagan clínicamente evidentes.26 Un corte de 50 ug/g da una sensibilidad de 0,83 (IC95%: 0,73-0,90) y una especificidad de 0,85 (CI95%: 0,77-0,91), alcanzándose una sensibilidad/especificidad óptima con cortes de 200-300 ug/g.26, 27
Los marcadores serológicos como pANCA (anticuerpo anticitoplasma perinuclear de neutrófilo) y ASCA (anticuerpo anti-Saccharomyces cerevisiae), OmpC I2, Cbir1 pueden ser útiles para diferenciar CU de EC.19 No se recomiendan rutinariamente, solo en casos de dificultad diagnóstica. La ausencia no excluye EII, especialmente en niños. ASCA IgA e IgG tiene especificidad para EC (95% uno de los dos o 100% ambos) y pANCA tiene una especificidad de 92% para CU.28
E. Imágenes
Como se señaló anteriormente, en el estudio de una EC es importante evaluar el intestino delgado para determinar la extensión de la enfermedad. Estas imágenes pueden ayudar a determinar si existe inflamación, estenosis o una combinación de ambas, y también a evaluar si existen complicaciones (abscesos, fistulas u otras).
La elección del método radiológico a utilizar debiera, entre otras cosas, ser guiado por el nivel de radiación que emite debido a que se trata de pacientes jóvenes y que requerirán durante su vida estudios a repetición.22 De todos los pacientes expuestos a > 10 mSv de radiación, 1 de cada 1.000 desarrollará una afección maligna. Actualmente uno de cada 10 pacientes con EC está expuesto a > 50 mSv de radiación, lo cual aumenta su riesgo.24
Radiografía simple de abdomen
Este estudio es muy útil en una CU severa como parte de su evaluación inicial para descartar un megacolon tóxico; cuadro clínico que consiste en la dilatación del colon transverso, medido por radiografía, con un diámetro de 56 mm o más en niños mayores de 10 años, o de más de 40 mm en menores, en un paciente con evidencia de toxicidad sistémica.23 En una EC puede sugerir la presencia de obstrucción intestinal en un paciente con vómitos. En pacientes con signos peritoneales, la radiografía puede mostrar aire libre, indicativo de perforación intestinal.
Tránsito intestino delgado (TID)
El TID fue durante años la piedra angular del estudio de imágenes en pacientes con sospecha de EC del intestino delgado. Proporciona buena información sobre la mucosa intestinal y el calibre luminal, así como la identificación de fístulas y estenosis. Es no invasivo y accesible, y no requiere exhaustiva preparación.29 La desventaja es que no permite evaluar la inflamación transmural ni tampoco la presencia de complicaciones extraluminales.23 El TID entrega una dosis ionizante por estudio de aproximadamente 1,8 – 2,2 miliSieverts (mSv).23, 29
Tomografía computarizada (CT) con enteroclisis o enterografía
La CT no es invasiva, es rápida y ofrece la posibilidad de obtener imágenes de múltiples planos al estudiar el intestino delgado. Es necesario administrar contraste intravenoso y es imperativo lograr una adecuada distensión intestinal mediante la ingesta de líquidos por boca o sonda nasogástrica, porque las asas no dilatadas pueden dar lugar a errores de interpretación. La CT con enteroclisis requiere de la administración enteral de líquidos vía sonda nasoyeyunal, que es poco tolerada en niños. Con la CT con enteroclisis (CTE) pueden obtenerse niveles adecuados de distensión de asas, utilizando diversos tipos de fluidos enterales, como agua, poletilenglicol o una solución de manitol. Estos pueden proveer un buen contraste del contenido intestinal, destacando la pared con el uso de contraste intravenoso.23, 29 Algunos hallazgos característicos en la CT son el engrosamiento de la pared intestinal, la separación de asas de intestinales, y el signo del peine (producido por dilatación y tortuosidad de los vasos y amplia separación de los vasa recta).23
Debe tenerse presente que pueden existir errores de interpretación de las imágenes debido a la limitada resolución anatómica secundaria a la escasa grasa mesentérica de los niños. La dosis efectiva de una CT es significativamente mayor que la de TID (3,8 mSv vs 1,8-2,2 mSv para TID.29
Enterografía por resonancia (MRE)
La MRE es una técnica establecida en el estudio de imágenes de la EC que tiene la gran ventaja de no someter al paciente a radiación ionizante y al mismo tiempo proveer imágenes de partes blandas multiplano de la más alta calidad.23, 29
La mejoría en el software y el hardware incluyen la disminución de la duración del estudio, el aumento de la capacidad de resolución y la disponibilidad de secuencias rápidas sin respirar.29 La MRE puede detectar anomalías transmurales, aspecto de empedrado, engrosamiento de la pared, ulceración, estenosis, dilatación pre-estenótica y reforzamiento intestinal. Existe clara evidencia que la MRE puede ayudar a diferenciar la enfermedad activa.29
Las manifestaciones extraintestinales de la EC, tales como el edema mesentérico, el signo del peine, los ganglios linfáticos mesentéricos, abscesos, fístulas y tractos sinusales, pueden ser fácilmente detectados. La resolución de contraste de la MRE es superior a la del CT, y resulta en una mejor caracterización de las anomalías murales y un mejor patrón de los segmentos afectados, lo que ayuda a definir el índice de actividad.23, 29 La MRE es el gold standard establecido para la evaluación de las complicaciones perineales de la EC.23, 29
Ultrasonografía (US)
La evaluación ecográfica del intestino delgado ha mejorado desde el desarrollo de los transductores de alta frecuencia (típicamente 7-12 MHz) que permiten una evaluación detallada de este. La compresión graduada permite que las asas intestinales adyacentes se desplacen y las asas que se desea analizar sean aisladas. El grosor normal de la pared intestinal es 1,5-2,5 mm a nivel del íleon terminal. En la EC temprana la submucosa hiperecoica se engrosa, probablemente por linfedema. El intestino inflamado se muestra con una pared engrosada (> 3mm), frecuentemente no es compresible y la peristalsis está reducida o ausente. El doppler color puede ser utilizado para para evaluar inflamación. En la pared intestinal normal no se ven vasos, pero la pared intestinal inflamada aparece hiperémica en el doppler color. Puede observarse la presencia de ganglios aumentados de tamaño.23, 29
La actividad inflamatoria se puede valorar también con ecogafía doppler de la arteria mesentérica superior (AMS) y de la arteria mesentérica inferior (AMI), midiendo la velocidad o el flujo, basándose en que la neovascularización de la pared inflamada produce un aumento del flujo de las arterias y venas mesentéricas. Existen estudios que han encontrado relación significativa entre actividad inflamatoria medida con el CDAI y los parámetros doppler de la AMS o de la AMI. En estos estudios, en los casos con enfermedad activa se observó tanto un incremento de la velocidad como del flujo, así como una disminución del índice de resistencia por aumento del flujo diastólico. Otros estudios, sin embargo, no han encontrado correlación con la actividad clínica. La ecografía doppler de los vasos mesentéricos es una exploración larga, difícil técnicamente, con una tasa de fracasos del 30-40%.30
La US tiene la ventaja de estar disponible en la mayor parte de los hospitales y clínicas, y puede dar información valiosa sin radiación ionizante. Sirve como primera aproximación al diagnóstico y luego como seguimiento en pacientes con diagnóstico establecido de EC.
Medicina nuclear
La cintigrafía utilizando leucocitos marcados con tecnecio 99 (ScLmTc99) puede ser utilizada para evaluar la distribución de la enfermedad, y la actividad e inflamación del intestino. Tiene la ventaja de no ser invasiva y de no requerir preparación intestinal. Es particularmente útil para evaluar recurrencias o para monitorizar el tratamiento. Tiene una sensibilidad del 90% y una especificidad del 97% en niños con EII. Ofrece una imagen de distribución e intensidad de la inflamación en 30 minutos en la mayoría de los niños. Puede además detectar el componente inflamatorio de una estenosis detectada por TID.23, 29, 31
En cuanto a desventajas y limitaciones cabe señalar que la dosis efectiva de radiación de la ScLmTc99 es de 3 mSv, no demuestra los detalles anatómicos tales como estenosis, fístulas o dilataciones pre-estenóticas y si bien la sensibilidad es alta, la resolución espacial es pobre. La distinción entre intestino delgado y colon puede ser difícil si la captación es focal y la cantidad de sangre necesaria difícil de obtener en niños pequeños.
La tomografía por emisión de positrones (PET) con F flourodeoxyglucosa también ha sido usada para estudiar EII en niños. La sensibilidad para detectar segmentos inflamados del intestino es del 71% con una especificidad del 81%. El papel de la PET aún debe ser definido.29
Tratamiento
El tratamiento comprende dos fases: inducción a la remisión y mantención de ella. Hasta hace poco, alcanzar estos objetivos consideraba solo parámetros clínicos y de laboratorio, sin embargo, actualmente, al igual que para los adultos, se debe alcanzar también mejoría histológica o curación de la mucosa y de esta manera evitar complicaciones. Junto con ello se debe asegurar un adecuado estado nutricional, optimizar el crecimiento y minimizar los efectos colaterales de las drogas utilizadas.5
En relación con los medicamentos utilizados en EII, los corticoides (prednisona/metilprednisolona) son efectivos en inducir la remisión tanto en EC como en CU, sin embargo, dados los efectos colaterales sistémicos solo deben usarse con ese fin.32 Actualmente es inaceptable su uso en la mantención, así como en la corticodependencia, por lo que el paso a otras terapias es mandatario. La budesónida, corticoide de liberación controlada, tiene un primer paso de metabolización hepática lo que disminuye su biodisponibilidad sistémica y con esto sus efectos colaterales. Su uso está recomendado en la EC ileal y de colon derecho para inducir remisión.31 Recientemente la nutrición enteral exclusiva (NEE) ha surgido como alternativa de primera elección (versus corticoides) en el tratamiento de la inducción de remisión en la EC luminal. Su uso va a depender del centro y del paciente.34, 35
Los aminosalicilatos (5-ASA) ejercen un efecto antiinflamatorio en la mucosa colónica. Pueden ser administrados vía oral y tópica (gel, supositorios, espuma). Están indicados en la remisión y mantenimiento de la CU leve a moderada. En ocasiones su uso combinado (oral y tópico) es más efectivo que su uso por una sola vía. En la EC no tienen eficacia demostrada.33-35
Los antibióticos en la EC tienen su indicación frente a la enfermedad fistulizante severa (metronidazol + ciprofloxacina) generalmente como puente al uso de biológicos. El uso de azitromicina y rifaximina se puede considerar para la inducción de la remisión en la EC luminal de actividad leve a moderada. En la CU los antibióticos no están indicados de rutina, con excepción de su uso en pouchitis. El uso de probióticos (VSL #3) se puede considerar en la CU leve en pacientes intolerantes a 5-ASA o con actividad residual mínima.33, 35
La azatioprina y su metabolito activo 6-mercaptopurina son inmunomoduladores y actúan como inhibidores de las purinas. La azatioprina demora de 8 a 12 semanas en ejercer su efecto y puede presentar efectos adversos como: mielosupresión, alteración de enzimas hepáticas y pancreatitis, por lo que su monitorización es mandataria. Actualmente se dispone de la medición de la enzima tiopurinametiltransferasa (TPMT) encargada de metabolizar la droga. La determinación de su actividad o genotipo permite ajustar la dosis y así evitar efectos adversos. Por otro lado, la azatioprina eleva levemente el riesgo de linfoma a largo plazo con un riesgo absoluto de 4,5 en 10.000 pacientes versus 0,6 por 10.000 pacientes en la población general. Tanto en la EC como en la CU esta droga se usa para la etapa de mantenimiento libre de esteroides.34-36
El metrotrexato es otro inmunomodulador que actúa como inhibidor de las purinas y ha demostrado eficacia en el tratamiento para la remisión de la EC; también puede ser usado en el mantenimiento o frente a la intolerancia a las tiopurinas. Su administración puede ser oral, subcutánea o intramuscular, siendo recomendada esta última vía. El metotrexato también puede producir nauseas importantes, mielo supresión y elevación de enzimas hepáticas por lo que es importante la monitorización de estos parámetros. Su eficacia en la CU no está demostrada por lo que actualmente no se recomienda su uso.35
Los agentes biológicos infliximab (Remicade®) y adalilumab (Humira®) se conocen por ser medicamentos anti-TNF, y actúan bloqueando la acción de esta citoquina proinflamatoria.37 Su uso fue demostrado inicialmente en la inducción primaria y mantenimiento en pacientes con enfermedad perianal activa y fistulizante, en combinación con la intervención quirúrgica adecuada y uso de antibióticos, sin embargo, actualmente su uso está indicado para la inducción de remisión en niños con EC activa refractaria al uso de esteroides y también para la inducción de la remisión y mantenimiento de la EC luminal crónica activa a pesar de haber optimizado el uso de inmunomoduladores.
Es importante destacar el uso precoz de los biológicos en un grupo selecto de niños que tenga alto riesgo de desarrollar una enfermedad de mal pronóstico:
- Presencia de úlceras profundas en la colonoscopía.
- Persistencia de EC severa a pesar de una adecuada inducción.
- Enfermedad de Crohn extensa (pan-entérica).
- Retardo de crecimiento, > -2,5 z score para la talla.
- Osteoporosis severa.
- Enfermedad estenosante y penetrante al debut.
- Enfermedad perianal severa.
También se debe considerar su uso precoz en pacientes con manifestaciones extraintestinales como artritis severa y pioderma gangrenoso.35, 38
Para la EC en pacientes naïve a terapia anti-TNF, tanto el infliximab (administración endovenosa) como el adalilumab (administración subcutánea) presentan igual eficacia y perfil de eventos adversos. La elección entre uno o el otro va a depender de la disponibilidad, la preferencia del paciente, el costo, el método de administración y las regulaciones locales.
En CU el uso de infliximab se debe considerar como tratamiento de mantenimiento en niños con CU crónicamente activa, o dependiente de esteroides, a pesar de optimizar los 5-ASA y tiopurinas. También se debe considerar en la CU refractaria a esteroides. Si infliximab se inicia durante un episodio agudo en un paciente naϊve a tiopurinas, se puede usar como tratamiento puente a tiopurinas y puede ser discontinuado luego de 4 a 8 meses, así también, puede ser usado como terapia de segunda línea en el manejo de la crisis aguda severa de CU, cuando esta es refractaria a los esteroides (PUCAI > 65 al día 5). En pacientes pediátricos, a diferencia de los adultos (en los cuales es indistinto), el adalilumab en la CU y se debe usar solo en los pacientes que perdieron respuesta o son intolerantes a infliximab.34, 39, 40
Todos los pacientes que inicien terapia anti-TNF deben tener previo a su inicio screening de tuberculosis, mediante la toma de una radiografía de tórax y test de tuberculina (PPD) y/o test de secreción de interferón (quantiFERON). Además, chequeo de inmunidad a virus varicela y hepatitis B, hepatitis A, hepatitis C, HIV, Epstein-Barr (ver guías ECCO).
El tratamiento con anti-TNF debe ser regular y no episódico, de esta manera se evita la formación de anticuerpos contra el agente, y, la consecuente pérdida de respuesta. Su uso está contraindicado en pacientes con presencia de abscesos, signos de infección activa, historia de tuberculosis e infecciones oportunistas.35
Existen anticuerpos contra los anti-TNF que causan reacciones agudas durante la infusión (RAI), reacciones de hipersensibilidad retardada y pérdida de respuesta.
Los síntomas de RAI son sensación de ahogo, enrojecimiento facial, nauseas, cefalea, hipoxemia y taquicardia. Estas reacciones responden a la detención momentánea de la infusión o a la disminución de su velocidad. Si existe reacción aguda severa como hipotensión, hipoxia y disnea, estas constituyen una contraindicación al tratamiento. Reacciones de hipersensibilidad retardada pueden ocurrir al menos 1 día post infusión, y se caracteriza por artralgia y artritis con fiebre y o rash cutáneo.35, 41
Respecto de la pérdida de respuesta, esta puede ser primaria, si ocurre dentro de las primeras 6 semanas; si ocurre más allá de las 6 semanas se considera pérdida de respuesta secundaria. Las causas son variadas e incluyen niveles inadecuados de la droga en sangre, formación de anticuerpos, persistencia de inflamación severa, falla de adherencia o tratamiento subóptimo. La medición de niveles y/o anticuerpos contra anti-TNF ayuda a esclarecer la causa y según los resultados se procederá a: aumento de la dosis, disminución del intervalo o cambio de anti-TNF.35
El uso de terapia combinada (anti-TNF + tiopurina o MTX) puede ser una alternativa inicial efectiva en la disminución de la formación de anticuerpos. Incluso puede ser útil iniciar la combinación luego de instalada la monoterapia en el paciente que ya perdió la respuesta por anticuerpos. La elección entre tiopurina o MTX va a depender según el caso. Su uso se recomienda al menos durante 6 meses de iniciada la terapia. Dado que existe el antecedente de que el uso de tiopurinas se asocia a aparición de linfoma (con especial precaución en varones jóvenes y el riesgo de linfoma T hepatoesplénico), actualmente se prefiere el uso de metotrexato como alternativa en la terapia combinada.42
En el tratamiento con anti-TNF se ha descrito la ocurrencia de infecciones que en algunos casos estas han sido severas: sepsis, meningitis, neumonía, abscesos, infecciones por herpes, virus varicela, linfohistiocitosis hemofagocítica asociada a VEB, infecciones fúngicas y oportunistas como reactivación de tuberculosis (TBC). Existen también casos de reactivación del virus de hepatitis B. Por esta razón es indispensable al inicio el screening de TBC, e inmunidad VHB y virus varicela; además, se sugiere la vigilancia activa de infecciones.
La seguridad a largo plazo de los anti-TNF está mermada por el riesgo potencial de malignidad. Se han reportado casos de linfoma T hepatoesplénico, que es muy agresivo y de alta mortalidad; se ha descrito en más de 30 pacientes (hombres jóvenes) que habían usado infliximab, sin embargo, todos también habían recibido tiopurinas. Se sabe que las tiopurinas aumentan el riesgo de cáncer, por lo que es posible que la malignidad se asocie más a tiopurinas que a infliximab y que este a actúe solo como catalizador. Se describe también la ocurrencia de linfomas y cánceres cutáneos cuando se usan ambos medicamentos. Aún este tema no está del todo dilucidado, por lo que la monitorización regular de los pacientes recibiendo anti-TNF es fundamental.36
Previo inicio del tratamiento inmunosupresor (corticoides/inmunomoduladores/biológicos) es importante evaluar el estado de la inmunidad a virus vivos (por ejemplo varicela) así como también a virus de hepatitis, y según esto considerar vacunar antes del inicio del tratamiento inmunosupresor y esperar al menos 4 semanas para iniciar su uso.43
En pediatría la estrategia medicamentosa debe plantearse en forma personalizada, evaluando riesgos y beneficios y siempre teniendo en cuenta el compromiso intestinal y sistémico, asociado a un rápido progreso de la enfermedad. La comunicación clara con la familia exponiendo estos puntos es clave para la decisión del tratamiento y asegurar una buena adherencia.44, 45
Ver Tabla 4 para el manejo terapéutico de EC y CU.
El rol de la cirugía en la CU es clave frente a la crisis grave de CU en que no hay respuesta a terapia médica (corticoides, inmunomoduladores y anti-TNF). La cirugía de elección es la proctocolectomía restauradora con reservorio íleo-anal o anastomosis con reservorio íleo-anal. Por lo general en pediatría el reservorio ileal se prefiere a la anastomosis íleorrectal. El abordaje laparoscópico es seguro y da buenos resultados cosméticos, sin embargo, esta técnica depende de los centros y su experiencia en este procedimiento. La cirugía también es el tratamiento de elección frente a la presencia de displasia en la CU de larga data.46
Tabla 4. Manejo farmacológico enfermedad de Crohn (EC) y colitis ulcerosa (UC).

Asistencia nutricional
Inicialmente en todo paciente se debe realizar una evaluación nutricional que consiste en:
- Evaluación de la duración y severidad de la enfermedad, presencia de resección intestinal y ostomías.
- Evaluación de la ingesta, cantidad y calidad de alimentos, presencia de intolerancia. Se recomienda el uso de los estándares para niños normales, peso, talla, IMC expresados en desviaciones estándar o percentiles. Estas evaluaciones deben ser seriadas con registro de peso y talla en cada visita, con cálculo de Z score que refleja con mayor exactitud el deterioro del crecimiento. No se recomienda el uso rutinario del IMC ya que puede subestimar la desnutrición.
- Evaluación del desarrollo puberal de acuerdo con el estadio de Tanner.
- Evaluación de estado de nutrición proteica a través de la determinación de albumina y prealbumina.
El objetivo primario es restablecer y mantener el estado nutricional, ayudar a controlar síntomas y disminuir la inflamación. Una inadecuada ingesta de energía, proteínas y micronutrientes puede inducir cambios en las propiedades de barrera y alterar la respuesta inmune intestinal. Así, la ingesta está deteriorada en el 54% de niños con EC.47
Deben evitarse alimentos que exacerban síntomas como: lactosa, alcohol, condimentos y sal, especialmente en aquellos con tratamiento esteroidal.
Las intolerancias habitualmente son individuales y deben ser determinadas caso a caso. Las estrategias incluyen desde ingesta oral con suplementos de proteínas, energía y micronutrientes hasta nutrición enteral y/o nutrición parenteral.48
No existe una correlación directa entre el gasto energético y la actividad de enfermedad.49 Se recomienda para cálculo de necesidades energéticas el uso de fórmulas de Schofield según la edad y el sexo. Se sugiere ingesta adecuada de micronutrientes, uso de fórmulas vitamínicas para embarazadas y niños mayores de 8 años y suplementación de vitamina D, 2000 UI. Considerar realización de densitometría ósea.50
Nutrición enteral exclusiva (NEE)
Consiste en aporte de dieta líquida exclusiva con exclusión de componentes de una dieta normal. Esta estrategia está dirigida al manejo de la EC. La forma de realizarla es variable, incluyendo: tipo de fórmula (polimérica v/s semi o elemental), tiempo de duración y dispositivos para lograrlo (vía oral, sondas de alimentación, goteo continuo, etcétera).
Según algunas guías la NEE puede constituir la primera opción en inducción de tratamiento para EC, más aún en pediatría considerando los efectos adversos de los esteroides sobre la talla y el metabolismo óseo; también debe considerarse cuando el tratamiento con corticoesteroides no es posible o como coadyuvante de apoyo nutri cional al tratamiento.51
La NEE es más efectiva que la parcial, mientras que una fórmula baja en grasa podría ser más favorable. Los porcentajes de remisión son variables (rango: 20-84%), es posible incluso sanar la mucosa, objetivo final de cualquiera de los tratamientos para esta condición.
Los mecanismos de acción de la NEE son muchos e incluyen:
- Alteración en la flora bacteriana.
- Reducción de la carga antigénica, eliminación de componentes dietarios específicos.
- Restitución de la composición corporal.
- Provisión de nutrientes específicos.
- Disminución de la carga de sales biliares a nivel colónico.
- Efecto de regulación inmune directo.
- Reducción de la grasa total (ácido linoleico).
El mecanismo más citado es en el que la NEE modifica la flora bacteriana, así los pacientes con enfermedad activa tienen altas concentraciones de bacterias a nivel ileal.12 Evidencia más reciente sugiere que la NEE induce profundas modificaciones en la flora, conduciendo a cambios estables en las especies bacterianas en el tiempo, un aumento en la actividad de la enfermedad se asocia con un aumento en la adherencia de bacterias fecales a los enterocitos.13, 14 La reducción de la carga antigénica que puede acompañar a la NE exclusiva puede contribuir en parte al reposo intestinal.
La NEE puede tener un efecto directo sobre la respuesta inmune a través del restablecimiento adecuado del estado nutricional, así la malnutrición proteica se asocia a una pobre función inmunológica. En modelos animales la deprivación proteica produce una depleción de células T que controlan la tolerancia oral.16
Más recientemente se ha sugerido un efecto directo del contenido luminal sobre la expresión génica dentro del intestino, así los ácidos grasos de cadena corta pueden inducir secreción de factores de crecimiento como IGFBP.17
También se ha sugerido que la presencia o ausencia de ciertos componentes en las fórmulas enterales son importantes en la regulación inmunológica, así la presencia de citokinas como TGF-B (factor de transformación de crecimiento beta) tiene la capacidad de disminuir la producción de citokinas inflamatorias.18
Por último, la NEE también puede jugar un rol directo en los mecanismos de reparación de la mucosa, contribuyendo a la proliferación de línea celulares que secretan péptidos citoprotectores y contribuye a la mantención del estado nutritivo mejorando el crecimiento linear y restableciendo los niveles de insulina a un nivel normal en pacientes con EC.
Es probable que todos los mecanismos citados con anterioridad contribuyan en mayor o menor grado, siendo lo fundamental el microambiente luminal en la expresión de la enfermedad mucosa, de esta forma la regulación de este microambiente constituye un desafío.19
Tipo de fórmulas (elementales o hidrolizadas v/s poliméricas)
Las fórmulas poliméricas son mejor toleradas y muchos niños pueden beberlas evitando la necesidad de una sonda nasogástrica. Las tasas de remisión son similares en ambos casos.20 Algunas unidades permiten el consumo de otros productos líquidos, tales como limonada, té o café con el objetivo de mejorara la adherencia al tratamiento nutricional, sin embargo, no existen datos publicados al respecto.
Duración
El tiempo de duración de la terapia es muy variable: va entre 4 y 12 semanas, siendo 8 semanas lo que se menciona en la mayoría de los estudios. Algunos sugieren que el efecto antiinflamatorio sucede durante las primeras 4 semanas.21 Otros sugieren que los beneficios continúan más allá de este período, con mejoría en los marcadores inflamatorios y ganancia de peso.
La longitud del tratamiento con NEE probablemente resulte del balance entre los efectos antiinflamatorios y las consecuencias de excluir una dieta normal, y también puede ser variable el tiempo para inducir remisión en niños con cierto patrón de enfermedad y la localización de esta (ileal o colónica). El compromiso de colon puede determinar una mayor duración de la terapia, aunque podría ser variable de un caso a otro, siendo muy difícil establecer plazos fijos; de tal manera que la respuesta en términos de mediadores inflamatorios podría ser una estrategia válida.22
Calidad de vida (CV)
La CV de un niño o adolescente con EII no solo tiene implicancias a nivel físico, sino también a nivel emocional y psicosocial dado que la enfermedad afecta tanto a los padres como al paciente. La CV es un concepto amplio que incluye el estándar de vida del propio paciente y de la familia entera en la comunidad. Estudios demuestran que la imagen corporal (ej.: talla baja, ganancia de peso), síntomas físicos (por ejemplo: diarrea) y acudir constantemente al baño son hechos muy relevantes entre niños y adolescentes con EII. Los adolescentes específicamente manifiestan una menor CV en actividad física y psicosocial como también en su autonomía. Un estudio argentino reciente muestra que tanto padres como pacientes muestran una menor CV en todos los ítems estudiados salvo en lo emocional, donde la percepción de los padres es menor que la del propio paciente.52
Costos
El costo estimado en Canadá (2012) fue de $2.800 billones de dólares ($12.000/paciente). El mayor costo actual es directo por el uso de biológicos, a diferencia de lo que sucedía antiguamente en que los costos mayores eran indirectos por la hospitalización.53
Pronóstico
En los últimos 15 años ha habido grandes avances que permiten entender los procesos involucrados en la patogénesis de ambas enfermedades inflamatorias, EC y CU. Inicialmente se pensó que estos procesos se basaban en respuestas adaptativas autoinmunes, pero nuevos conceptos han surgido y han conducido al desarrollo de nuevas terapias para su manejo. Un desafío mayor ha sido determinar la respuesta adaptativa que predomina en cada subgrupo de pacientes. Se requieren aún nuevos estudios para conocer cómo la susceptibilidad genética modifica la respuesta inmune y cómo esta susceptibilidad determinará la respuesta a una determinada terapia. Análisis combinados de fenotipos clínicos, genotipos y perfiles de citoquinas periféricas y de mucosa nos permitirán predecir la respuesta a las diferentes terapias, incluyendo terapia biológica; de hecho, los estudios demuestran que iniciando terapia biológica precozmente e identificando los pacientes que fenotípicamente desarrollarán una enfermedad más agresiva, el control de la enfermedad mejora a largo plazo sobre todo en los niños, que tienen varias décadas de enfermedad por delante.3, 4
Así, la identificación de la vía inflamatoria dominante antes o en el momento del diagnóstico permitirá individualizar la terapia específica y el hallazgo de nuevos marcadores serológicos y de mucosa permitirá estratificar a los pacientes en aquellos fenotípicamente con enfermedad más o menos agresiva para así otorgar una terapia médica y quirúrgica individualizada y lograr un mejor seguimiento y calidad de vida de esta compleja enfermedad.3, 4
Agradecimientos. Agradecemos en especial al Dr. Juan Cristóbal Ossa por su participación y por la mirada crítica en la revisión del presente artículo y a la Dra. Marina Orsi por sus enriquecedoras recomendaciones.
Referencias
- Ruemmele FM. Pediatric inflammatory bowel diseases: coming of age. Current Opinion in Gastroenterology 2010; 26: 332-336.
- Szigethy E, McLafferty L, Goyal A. Inflammatory bowel disease. Child Adolesc Psychiatric Clin N Am 2010; 19: 301-318.
- Oliva-Hemker M, Hutfless S, Al Kazzi ES, Lerer T, Mack D, Le Leiko N, Griffiths A, Cabrera J, Otley A, Rick J, Bousvaros A, Rosh J, Grossman A, Saeed S, Kay M, Carvalho R, Keljo D, Pfefferkorn M, Faubion W Jr, Kappelman M, Sudel B, Schaefer ME, Markowitz J, Hyams J. Clinical presentation and five-year therapeutic management of very early-onset inflammatory bowel disease in a large north american cohort. J Pediatr 2015; 167: 527- 532.
- Uhlig HH, Schwerd T, Koletzko S, Shah N, Kammermeier J, Elkadri A, Ouahed J, Wilson DC, Travis SP, Turner D, Klein Ch, Snapper SB, Muise AM. The diagnostic approach to monogenic very early onset inflammatory bowel disease. Gastroenterology 2014; 147: 990-1007.
- Day AS, Ledder O, Leach ST, Lemberg DA. Crohn´s and colitis in children and adolescents. World J Gastroenterol 2012; 18: 5862-5869.
- Denmark VK, Mayer L. Inflammatory bowel diseases Fifth ed. Elsevier Inc 2014; Chapter 60: 873-888.
- Benchimol EI, Fortinsky KJ, Gozdyra P, Van den Heuvel M, Van Limbergen J, Griffith. Epidemiology of pediatric inflammatory bowel disease: a systemic review of international trends 2011; 17: 423-439.
- Vicentín R, Wagener M, Pais A, Contreras M, Orsi M. Registro prospectivo durante 1 año de enfermedad inflamatoria intestinal en población pediátrica argentina. Arch Argent Pediatr 2017; 115: 533-540.
- Kaakoush NO, Mitchell HM. Campylobacter concisus a new player in intestinal disease. Front Cell Infect Microbiol 2012; 2: 1-15.
- Wong J, Wang X, Yang H, Wu D, Wang L, Quian J. Contribution of the IBD5 locus to inflammatory bowel disease: a meta-analysis. Hum Genet 2011; 129: 597-609.
- Lakatos PL, Kiss LS, Miheller P. Nutritional influences in selected gastrointestinal diseases. Dig Dis 2011; 29: 154-165.
- Scholz D. The role of nutrition in the etiology of inflammatory bowel disease. Curr Probl Pediatr Adolesc Health Care 2011; 41: 246-253.
- Glocker EO, Kotlarz D, Klein Ch, Shah N, Grimbacher B. IL-10 and IL-10 receptor defects in humans. Ann N Y Acad Sci 2011; 1246: 102-107.
- Hölttä V, Klemetti P, Salo HM, Koivusalo A, Pakarinen M, Westerholm-Ormio M, Kolho KL, Vaarala O. Interleukin- 17 immunity in pediatric Crohn disease and ulcerative colitis. JPGN 2013; 57: 287-292.
- Cheng JF, Ning YJ, Zhang W, Lu ZH, Lin L. T300A polymorphism of AT16L1 and susceptibility to inflammatory bowel diseases: A meta- anylisis. World J Gastroenterol 2010; 16: 1258-1266.
- Walters ThD, Griffiths AM. Mechanisms of growth impairment in pediatric Crohn´s disease. Nat Rev Gastroenterol Hepatol 2009; 6: 513-523.
- Gerasimidis K, Morgan P, Edwards CA. The aetiology and impact of malnutrition in pediatric inflammatory bowel disease. J of Hum Nutr Diet 2011; 24: 313-326.
- Hartman C, Eliakim R, Shamir R. Nutritional status and nutritional therapy in Inflammatory bowel disease. World J Gastroenterol 2009; 15: 2570-2578.
- Ezri J, Marques-Vidal P, Nydegger A. Impact of disease and treatments on growth and puberty of pediatric patients with inflammatory bowel disease. Digestion 2012; 85: 308-319.
- Turner D, Griffiths A, Walters ThD, Seah T, Markowitz J, Pfefferkorn M, Keljo D, Waxman J, Otley A, Leleiko NS, Mack D, Hyams J, Levine A. Mathematical weighting of the pediatric Crohn´s disease, activity index (PCDAI) and comparison with its other short versions. Inflamm Bowel Dis 2012; 18: 55-62.
- Tremaine WJ. Is Indeterminate colitis determinable? Curr Gastroenterol Rep 2012; 14: 162-165.
- Vucelic B. Inflammatory Bowel Diseases: Controversies in the use of diagnostic procedures. Dig Dis 2009; 27: 269-277.
- Di Nardo G, Aloi M, Oliva S, Civitelli F, Casciani E, Cucchiara S. Investigation of small bowel in pediatric Crohn´s disease. Inflamm Bowel Dis 2012; 18: 1760-1776.
- Giles E, Barclay AR, Chippington S, Wilson DC. Systematic review: MRI enterography for assessment of small bowel involvement in pediatric Crohn´s disease. Aliment Pharmacol Ther 2013; 37: 1121-1131.
- Di Nardo G, de Ridder L, Oliva S, Casciani E, Escher JC, Cucchiara S. Enteroscopy in pediatric Crohn´s disease. Dig Liver Dis 2013; 45: 351-355.
- Henderson P, Casey A, Lawrence SJ, Kennedy NA, Kingstone K, Rogers P, Gillett PM, Wilson DC. The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease. Am J Gastroenterol 2012; 107: 941-949.
- Henderson P, Anderson NH, Wilson DC. The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease: a systematic review and meta-analysis. Am J Gastroenterol 2014; 109: 637-645.
- Ruemmele FM, Targan SR, Levy G, Dubinsky M, Braun J, Seidman EG. Diagnostic accuracy of serological assays in pediatric inflammatory bowel disease. Gastroenterology 1998; 115: 822-829.
- Stuart S, Conner T, Ahmed A, Steward M, Maclachlan J, Wulie P, Beal I. The smaller bowel: Imaging the small bowel in pediatric Crohn´s disease. Postgrad Med J 2011; 87: 288-297.
- Gómez S, Poza J, Martin M, Suárez J. Utilidad de la ecografía abdominal en la enfermedad de Crohn. RAPD 2014; 37.
- Caobelli F, Panarotto MB, Andreoli F, Ravelli A, De Agostini A, Giubbini R. Is 99m Tc-HMPAO granulocyte scan an alternative to endoscopy in pediatric chronic inflammatory bowel disease (IBD). Eur J Pediatr 2011; 170: 51-57.
- Pineton de Chambrun G, Peyrin-Biroulet L, Lémann M, Colombel JF. Clinical implications of mucosal healing for the management of IBD. Nat Rev Gastroenterol Hepatol 2010; 7: 15-29.
- Sherlock ME, Griffiths AM. Medical therapy for pediatric inflammatory bowel disease. Curr Gastroenterol Rep 2012; 14: 166-173.
- Turner D, Levine A, Escher JC, Griffiths AM, Russell RK, Dignass A, Dias JA, Bronsky J, Braegger CP, Cucchiara S, de Ridder L, Fagerberg UL, Hussey S, Hugot JP, Kolacek S, Kolho KL, Lionetti P, Paerregaard A, Potapov A, Rintala R, Serban DE, Staiano A, Sweeny B, Veerman G, Veres G, Wilson DC, Ruemmele FM; European Crohn’s and Colitis Organization; European Society for Paediatric Gastroenterology, Hepatology, and Nutrition.Management of pediatric ulcerative colitis: joint ECCO and ESPGHAN evidence-based consensus guidelines. J Pediatr Gastroenterol Nutr 2012; 55: 340-361.
- Ruemmele FM, Veres G, Kolho KL, Griffiths A, Levineg A, Escher JC, Amil Dias J, Barabinoj A, Braegger CP, Bronsky J, Buderus S, Martín de Carpi J, de Ridder L, Fagerberg UL, Hugot JP, Kierkus J, Kolacekt S, Koletzko S, Lionetti P, Miele E, Navas López VM, Paerregaardy A, Russell RK, Serbanaa DE, Shaoul R, Van Rheenenac P, Veeremanad G, Weiss B, Wilsonaf D, Dignass A, Eliakimaj A, Winter H, Turner D. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn’s disease. Journal of Crohn´s and Colitis 2014; 8: 1179- 2017.
- Dulai PS, Siegel CA, Dubinsky MC. Balancing and communicating the risks and benefits of biologics in pediatric inflammatory bowel disease. Inflamm Bowel Dis 2013; 19: 2927- 2936.
- Silva LCR, Ortigosa LCM, Benard G. Anti-TNF-a agents in the treatment of immune-mediated inflammatory diseases: mechanisms of action and pitfalls. Immunotherapy 2010; 2: 817-833.
- Hyams J, Crandall W, Kugathasan S, Griffiths A, Olson A, Johanns J, Liu G, Travers S, Heuschkel R, Markowitz J, Cohen S, Winter H, Veereman-Wauters G, Ferry G, Baldassano R; REACH Study Group. Induction and maintenance infliximab therapy for the treatment of moderate-to-severe Crohn’s disease in children. Gastroenterology 2007; 132: 863-873.
- Turner D, Travis SPL, Griffiths AM, Ruemmele FM, Levine A, Benchimol EI, Dubinsky M, Alex G, Baldassano RN, Langer JC, Shamberger R, Hyams JS, Cucchiara S, Bousvaros A, Escher JC, Markowitz J, Wilson DC, van Assche G, Russell RK. Consensus for managing acute severe ulcerative colitis in children: A Systematic Review and Joint Statement From ECCO, ESPGHAN, and the Porto IBD Working Group of ESPGHAN. Am J Gastroenterol 2011; 106: 574-588.
- Hyams J, Damaraju L, Blank M, Johanns J, Guzzo C, Winter HS, Kugathasan S, Cohen S, Markowitz J, Escher JC, Veereman– Wauters G, Crandall W, Baldassano R, GriffithsA for the T72 Study Group. Induction and maintenance therapy with infliximab for children with moderate to severe ulcerative colitis. Clin Gastroenterol Hepatol 2012; 10: 391-399.
- Lichtenstein L, Ron Y, Kivity S, Ben-Horin S, Israeli E, Fraser GM, Dotan I, Chowers Y, Confino-Cohen R, Weiss B. Infliximab-related infusion reactions: Systematic Review. Journal of Crohn´s and Colitis 2015; 9: 806-815.
- Cozijnsen MA, Escher JC, Griffiths A, Turner D, de Ridder L. Benefits and risks of combining Anti-Tumor necrosis factor with immune modulator therapy in pediatric inflammatory bowel disease. Inflamm Bowel Dis 2013; 21: 951-961.
- Lu Y, Bousvaros A. Immunizations in children with inflammatory bowel disease treated with immunosuppressive therapy. Gastroenterol Hepatol (NY) 2014; 10: 355-363.
- Kim MJ, Lee JS, Lee JH, Kim JY, Choe YH. Infliximab therapy in children with Crohn’s disease: a one-year evaluation of efficacy comparing ‘top-down’ and ‘step-up’ strategies. Acta Pediátrica 2011; 100: 451–455.
- Hyams JS. Risk/benefit strategies must be employed in the management of pediatric Crohn’s disease. Dig Dis 2009; 27: 291-296.
- Baillie CT, Smith JA. Surgical strategies in pediatric inflammatory bowel disease. World J Gastroenterol 2015; 21: 6101-6116.
- Kelts D, Grand R, Shen G, Watkins J. Nutritional basis of growth failure in children and adolescents with Crohn’s disease. Gastroenterology 1979; 76: 720-727.
- Barnes JL, Kelly A. Tappenden. Nutritional management of inflammatory bowel disease and short bowel syndrome. nutrition in the prevention and treatment of disease. 3rd Edition. Elsevier Inc. Chapter 39; 739-756.
- Wiskin AE, Wootton SA, Culliford DJ, Afzal NA, Jackson AA, Beattie RM. Impact of disease activity on resting energy expenditure in children with inflammatory bowel disease. Clin Nutr 2009; 28: 652-656.
- Gurram B, Joeckel R, Stephens M. Nutrition in pediatric inflammatory bowel disease. Practical Gastroenterology 2012; 56-62.
- Lochs H, Dejong C, Hammarqvist F, Hebuterne X, Leon-Sanz M, Schütz T, van Gemert W, van Gossum A, Valentini L, DGEM (German Society for Nutritional Medicine), Lübke H, Bischoff S, Engelmann N, Thul P, ESPEN (European Society for Parenteral and Enteral Nutrition). ESPEN guidelines on enteral nutrition: Gastroenterol Clin Nutr 2006; 25: 260-274.
- Gallo J, Grant A, Otley AR, Orsi M, Mac Intyre B, Gauvry S, Lifschitz C. Do parents and children agree? Quality-of-life assessment of children with inflammatory bowel disease and their parents. JPGN 2014; 58: 481-485.
- Rocchi A, Benchimol E, Bernstein ChN, Bitton A, Feagan B, Panaccione R, Glasgow KW, Fernandes A, Ghosh S. Inflammatory bowel disease: A Canadian burden of illness review. Can J Gastroenterol 2012; 26: 811-817.
Correspondencia: Mónica González Y
Hospital de Niños Dr. Roberto del Río, Clínica Las Condes. Santiago, Chile
Correo electrónico: monigonzaya@gmail.com
Acta Gastroenterol Latinoam 2018;48(3): 226-241
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE