Andrea Natalia Odzak,1 Carolina Herrera,1 María Florencia Arcondo,1 Patricia Cravero,2 María Luján Pestalardo,3 Marcelo Amante,3 Adolfo Wachs,1 Roberto Mazure,4 Marcelo Zylberman1
1 Servicio de Clínica Médica. Hospital Gral de Agudos “Dr Cosme Argerich”. Ciudad Autónoma de Buenos Aires, Argentina.
2 Servicio de Hematología. Hospital Gral de Agudos “Dr Cosme Argerich”. Ciudad Autónoma de Buenos Aires, Argentina.
3 Servicio de Anatomía Patológica. Hospital Gral de Agudos “Dr Cosme Argerich”. Ciudad Autónoma de Buenos Aires, Argentina.
4 Sección Intestino Delgado. Hospital de Gastroenterología “Dr Carlos Bonorino Udaondo”. Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2017;47(2):126-130
Recibido: 14/05/2016 / Aprobado: 07/03/2017 / Publicado en www.actagastro.org el 03/07/2017
Resumen
La enfermedad celíaca (EC) es una afección sistémica desencadenada por la ingestión de gluten caracterizada por la inflamación crónica autoinmune que afecta al intestino delgado en individuos genéticamente susceptibles. La dieta libre de gluten constituye su pilar terapéutico. La enfermedad celíaca refractaria (ECR) no responde a la dieta y puede evolucionar a yeyunitis ulcerativa y neoplasias gastrointestinales, principalmente linfoma intestinal asociado a enteropatía y adenocarcinoma. Presentamos un caso de EC en una mujer joven con persistencia de anemia y síntomas gastrointestinales evaluada inicialmente como ECR y cuyo diagnóstico final fue un raro sarcoma intestinal denominado tumor maligno de la vaina del nervio periférico. Este tumor suele observarse en pacientes con neurofibromatosis y la localización intestinal es poco frecuente. No hemos encontrado en la literatura descripciones de este tipo tumoral en pacientes celíacos.
Palabras claves. Enfermedad celíaca, complicaciones, schwanoma maligno.
Celiac disease and bowel malignant peripherical nerve sheath tumor (MPNST)
Summary
Celiac disease (CD) is a systemic condition characterized by chronic autoimmune inflammation affecting the small intestine in genetically susceptible individuals. It´s triggered by eating gluten and gluten-free diet is the therapeutic pillar. Refractory celiac disease (RCD) does not respond to diet and can evolve into ulcerative jejunitis and gastrointestinal malignancies, mainly intestinal enteropathy-associated lymphoma and adenocarcinoma. We report a case of CD in young women with persistent anemia and gastrointestinal symptoms initially evaluated as RCD and whose final diagnosis was a rare intestinal sarcoma called malignant peripheral nerve sheath tumor. This tumor is usually seen in patients with neurofibromatosis and intestinal presentation is very uncommon. No descriptions were found in the literature of this tumor type in celiac patients.
Key words. Celiac disease, complications, malignant schwannoma.
Abreviaturas
EC: enfermedad celíaca.
DLG: dieta libre de gluten.
ECR: enfermedad celíaca refractaria.
YU: yeyunitis ulcerativa.
LTAE: linfoma T asociado a enteropatía.
TMVNP: tumor maligno de la vaina de los nervios periféricos.
NF1: neurofibromatosis tipo 1.
La enfermedad celiaca (EC) es una enfermedad sistémica desencadenada por la ingestión de gluten caracterizada por la inflamación crónica autoinmune que afecta al intestino delgado en individuos genéticamente susceptibles, la cual conduce a la atrofia vellositaria.1
Las formas típicas de la enfermedad se caracterizan por síntomas predominantemente gastrointestinales (esteatorrea, distensión y dolor abdominal) mientras que las formas atípicas carecen de síntomas gastrointestinales y suelen manifestarse por malabsorción de nutrientes específicos (anemia, osteoporosis, bajo peso, bajo desarrollo pondoestatural o infertilidad).1, 2
La dieta libre de gluten (DLG) estricta es fundamental para revertir los síntomas causados por la respuesta inmune que afecta al tubo digestivo. Se denomina enfermedad celíaca refractaria (ECR) a la condición clínica y serológica de los pacientes no respondedores a la DLG. Las complicaciones a largo plazo en pacientes con ECR incluyen a la yeyunitis ulcerativa (YU) y las neoplasias gastrointestinales,1, 3 principalmente el linfoma T asociado a enteropatía (LTAE) y en menor proporción el adenocarcinoma de intestino delgado.4, 5
El tumor maligno de la vaina de los nervios periféricos (TMVNP) es un tipo de sarcoma especialmente descripto en pacientes con neurofibromatosis.6 No hemos encontrado casos de TMVNP intestinal descriptos en pacientes celíacos.
Objetivo
Presentar un caso de EC con persistencia de anemia y síntomas gastrointestinales evaluada inicialmente como ECR y cuyo diagnóstico final fue un TMVNP intestinal.
Caso Clínico
Mujer de 27 años con EC diagnosticada 6 meses antes de su admisión en el contexto de anemia y dolor abdominal (biopsia y serología positivas). Se interna por pérdida de peso, sudoración nocturna, vómitos alimentarios y dolor abdominal difuso, continuo y con predominio epigástrico. Refería adecuada adherencia a la DLG. Examen físico: desnutrida, peso 36,3 kg, IMC: 14.17, abdomen excavado, depresible, doloroso a la palpación profunda en epigastrio, reptación de asas con períodos de dolor, ruidos hidroaéreos presentes y normales, catarsis conservada. Sin visceromegalias ni adenopatías periféricas.
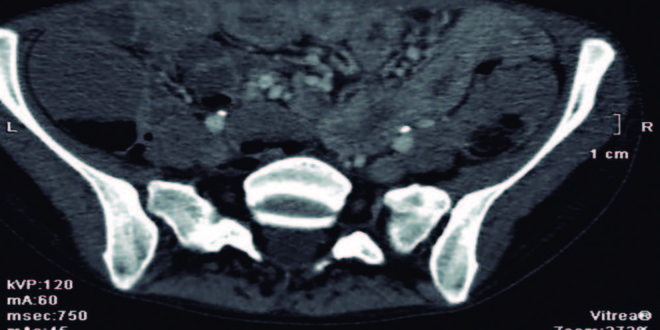
Laboratorio: Hto 34,5%, albúmina: 2,8 g/L, LDH: 310 UI/dl, VSG: 12 mm. Serología VIH negativa. IgA total 191 mg/dl, antitransglutaminasa activada recombinante humana tipo IgA: 132 U/ml (VN: 20 UI/ ml) e IgG: 275 U/ml (VN: 20 UI/ml). Anticuerpos antigliadina IgA 96 U/ml e IgG 126 U/ml (VN < 25 UI/ ml), anticuerpos antiendomisio IgA e IgG positivos, anticuerpos antipéptido deamidado de gliadina IgA 61 U/ ml e IgG: 78 U/ml (VN < 20 UI/ml). VEDA: cardias incontinente, gastropatía crónica atrófica, a predominio del fórnix. Bulbo y segunda porción duodenal con mucosa granular, con pliegues disminuídos de tamaño, festoneados, con signo del peinado. Se toma una biopsia gástrica y tres biopsias duodenales (bulbo y segunda porción). Biopsia: gastritis crónica con infiltrado linfoplasmocitario moderado a severo y acúmulos linfoides intramucosos. Duodenitis crónica activa con atrofia vellositaria subtotal y linfocitos intraepiteliales, Marsh IIIB. EnteroTC (Figura 1): engrosamiento difuso de la pared intestinal en el yeyuno, buen pasaje distal del contraste oral, escasa cantidad de líquido libre, hígado con aisladas imágenes quísticas menores a 10 mm, sin adenomegalias mesentéricas. Coproparasitológico: quistes de Giardia Lamblia.
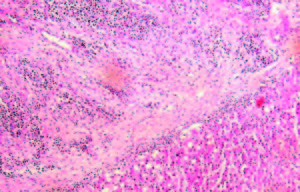
Evolucionó con vómitos y dolor abdominal persistentes a pesar del tratamiento sintomático. Realizó tratamiento con metronidazol por la giardiasis intestinal. Por mala tolerancia a la alimentación enteral se inició alimentación parenteral. Presentó melena con caída del hematocrito y requerimiento transfusional; se realizó una nueva VEDA, sin cambios macroscópicos ni evidencia de sangrado activo. Enteroscopía anterógrada con doble balón: mucosa de duodeno y yeyuno con nodularidad y aspecto mucoso en «peinado», dilatación de asa a 250 cm con mucosa de aspecto conservado y abundante cantidad de líquido yeyunal oscuro que dificultaba la progresión del enteroscopio. Con diagnóstico de suboclusión intestinal se realizó una laparotomía exploradora, constatándose la presencia de un tumor estenosante del intestino delgado y una lesión focal en el lóbulo hepático derecho. Se resecaron 20 cm de intestino delgado y se realizó una enteroanastomosis latero-lateral. En el postoperatorio inmediato la paciente evolucionó con shock refractario y falleció a las 48 horas. Anatomía patológica de la pieza quirúrgica: lesión macroscópica exofítica, indurada, blanquecina y amarillenta de 3 cm de longitud, que ocupaba el 100% de la circunferencia intestinal y ocluía el 95% de la luz del asa, con infiltración de la grasa mesentérica (Figura 2). Examen microscópico: proliferación de células neoplásicas pequeñas, algunas de tipo fusiformes y otras de aspecto epitelioide, con núcleos de contornos irregulares, cromatina laxa granular y nucléolo evidente (Figura 3). Inmunohistoquímica: negativa para CD56, cromogranina, sinaptofisina, ACL, CD20, CD3, AE1 AE3, CD68, CD34, CD117, AML, CD99, MYOD1, HMB45, MELANA, EMA Y GFAP. Vimentina y S100 positivos. Ki 67 positivo en el 26% de las células tumorales (Figura 4). Diagnóstico: tumor maligno de la vaina del nervio periférico (TMVNP) con estadificación: PT1B PN1 PM1. La muestra hepática presentó características histológicas similares (Figura 5).
Figura 1. EnteroTC: engrosamiento difuso de la pared intestinal en el yeyuno.
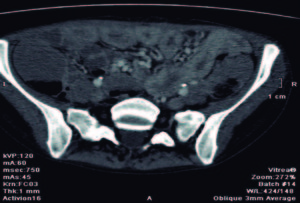
Figura 2. Macroscopía: resección del intestino delgado. Se destaca un tumor estenosante y un ganglio en la raíz mesentérica.
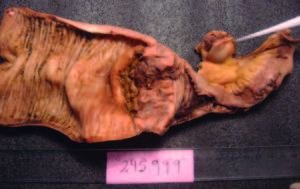
Figura 3. Microscopía óptica. H y E. 40x. Proliferación de células neoplásicas pequeñas, algunas de tipo fusiformes y otras de aspecto epitelioide, con núcleos de contornos irregulares.
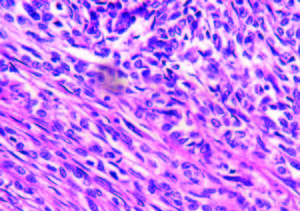
Figura 4. Microscopía óptica. 40x. Inmunohistoquímica. S100, vimentina y Ki 67.
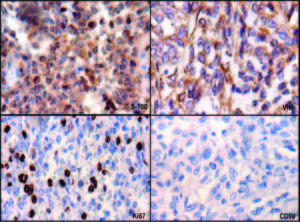
Figura 5. Microscopía óptica. H y E. 4x. Metástasis hepática.
Discusión
La mayoría de los pacientes con EC responden clínica e histológicamente a la DLG. La persistencia de los síntomas debe plantear una búsqueda sistemática de la causa por la cual no se produce la mejoría.2, 3, 7
En primer lugar, se debe evaluar la adherencia a la DLG. El no cumplimiento dietario, ya sea por razones deliberadas o accidentales, constituye la primera causa de persistencia de los síntomas. Se sugiere realizar una anamnesis nutricional minuciosa, preferentemente a cargo de un nutricionista experto. La persistencia de la ingestión de gluten suele correlacionar con títulos positivos de anticuerpos antitransglutaminasa y antiendomisio.1
Si se considera que el paciente cumple DLG y no existe mejoría clínica luego de 6 a 12 meses, se debe: a) confirmar por serología y nueva biopsia duodenal que se está en presencia de una EC, y b) excluir otras causas de atrofia vellositaria. El límite definido entre 6 y 12 meses es arbitrario, pero considerado por la mayoría de los autores.3
Excluidas estas causas, se debe considerar el diagnóstico de refractaria (ECR). Los pacientes pueden ser primariamente refractarios (nunca respondieron a la DLG) o secundariamente refractarios (existe una primera respuesta a la DLG y luego recurren los síntomas). A su vez, la ECR se define en tipo 1 o tipo 2 según el aspecto fenotípico de los linfocitos T intraepiteliales hallados en la biopsia duodeno-yeyunal. En la ECR tipo 2 existe una población predominante clonal de linfocitos T aberrantes que predispone a peor respuesta al tratamiento y mayor progresión a linfoma intestinal.1, 2
En nuestra paciente se constató una correcta adherencia a la DLG, se confirmó el diagnóstico serológico e histológico de EC y considerando la severidad de los síntomas (dolor abdominal y descenso de peso) se procedió antes del año a una evaluación minuciosa con el objetivo de identificar complicaciones intestinales de la EC.
Se considera que la presencia de fiebre, sudor nocturno, dolor abdominal recurrente y /o sangrado intestinal son los factores que deben acelerar la sospecha de linfoma T asociado a enteropatía en pacientes con EC.4
La yeyunitis ulcerativa (YU) es una complicación severa de la ECR. Se define por la presencia de múltiples úlceras de aspecto benigno que pueden eventualmente conducir a estructuras intestinales, suboclusión, oclusión e incluso perforación de asas del intestino delgado.4 Es considerada un linfoma “in situ” por presentar linfocitos intraepiteliales aberrantes y se han descripto casos de progresión a Linfoma T asociado a enteropatía.8
Para lograr un correcto diagnóstico anatómico del sitio afectado se proponen los siguientes métodos: entero TAC, RNM con enteroclisis, PET, enteroscopía con videocápsula y enteroscopía anterógrada con doble balón. El objetivo es lograr un diagnóstico topográfico y de extensión de la lesión intestinal y obtener una muestra de mucosa duodeno-yeyunal para evaluar el rearreglo clonal de los receptores de linfocitos T intraepiteliales por técnica de PCR. Se considera que la presencia de un engrosamiento de la pared intestinal, linfadenopatías mesentéricas, intususcepción o hipoesplenismo (bazo con volumen menor a 120 cc) se asocia a ECR y linfoma asociado a enteropatía.4
La entero TC de nuestra paciente describía el compromiso de la pared intestinal, por lo que se optó por la enteroscopía anterógrada con doble balón para tener acceso a la región yeyunal aparentemente afectada. El hallazgo de un asa yeyunal dilatada con la imposibilidad del pasaje del enteroscopio motivó la laparotomía exploratoria con diagnóstico clínico de suboclusión intestinal (paciente con vómitos escasos, tránsito intestinal conservado y dolores cólicos con reptación de asas en períodos de dolor).
El análisis posterior de la pieza de la exéresis quirúrgica diagnosticó un TMVNP que estenosaba el 95% de la luz intestinal con compromiso focal hepático.
Los TMVNP constituyen una rara variedad de sarcomas con alto grado de malignidad. Representan el 5 al 10% de los sarcomas de partes blandas.9 El término TMVNP agrupa a los tumores tradicionalmente referidos como schwanoma maligno, neurilenoma maligno o neurofibrosarcoma.10, 11 Su prevalencia en la población general es del 0,001% y aumenta al 4,6% cuando se asocia a la neurofibromatosis tipo 1 (NF1).12 Los casos esporádicos de TMVNP constituyen aproximadamente el 50% e igual porcentaje se asocia a NF1. Pueden originarse en nervios periféricos de cualquier localización; en orden de frecuencia aparecen en extremidades, tronco, cabeza y cuello. Son capaces de producir metástasis a distancia desde etapas tempranas sobre todo a nivel hepático y pulmonar.10
Rara vez el TMVNP se localiza en el aparato digestivo y es muy infrecuente la localización en intestino delgado. El crecimiento puede ser tanto intraluminal como intramural. La sintomatología es variable e incaracterística, presentándose frecuentemente con dolor abdominal, vómitos, pérdida de peso, hemorragia digestiva o masa palpable.6, 11, 13 El diagnóstico suele ser dificultoso y tardío. El tratamiento es quirúrgico, con resección amplia y quimioterapia adyuvante si los márgenes de resección fueran incompletos, hubiera enfermedad a distancia o se diera la imposibilidad de su extirpación. La mayoría de los estudios relatan elevadas cifras de mortalidad, recurrencia y metástasis a distancia. La edad del paciente, el tamaño tumoral, el porcentaje de necrosis y el índice mitótico son los principales factores pronósticos a considerar.6
No existen casos de TMVNP intestinal descriptos en pacientes celíacos. Nuestra paciente no tenía antecedentes personales ni familiares de NF1.
Tabla 1. Causas de atrofia vellositaria.

Conclusión
La persistencia de síntomas en EC obliga a una minuciosa anamnesis, examen físico y estudios complejos, no debiéndose soslayar la posibilidad de otras enfermedades coexistentes. No hallamos casos descriptos en la literatura médica de TMVNP intestinal en paciente con EC.
Referencias
- Fasano A, Catassi C. Celiac disease. NEJM 2012; 367: 2419- 2426.
- Admou B, Essaadouni L, Krati K, Zaher K, Sbihi M, Chabaa, Belaabidia B, Alaoui-Yazidi A. A typical celiac disease: from recognizing to managing. Gastroenterol Res Pract 2012; ID 637187: 1-9.
- Mooney PD, Evans KE, Singh S, Sanders DS. Treatment failure in coeliac disease: a practical guide of investigation and treatment of non-responsive and refractory coeliac disease. J Gastrointestin Liver Dis 2012; 21: 197-203.
- Van de Water J, Cillessen SA, Visser OJ, Verbeek WH, Meijer CJ, Mulder CJ. Enteropathy associated T-cell lymphoma and its precursor lesions. Best Pract Res Clin Gastroenterol 2010; 24: 43-56.
- Freeman H. Malignancy in adult celiac disease. World J Gastroenterol 2009; 15: 1581-1583.
- Mena Ochara V, Palomino Portillo E, Robles Valverde W, Palacios Arroyo V. Tumor de la vaina de nervio periférico en intestino delgado: reporte de un caso. Rev Per Obs Enf 2008; 2: 126-132.
- Dewar DH, Donnelly SC, McLaughlin SD, Johnson MW, Ellis HJ, Ciclitira PJ. Celiac disease: management of persistent symptoms in patients on a gluten-free diet.World J Gastroenterol 2012; 28:1348-1356.
- Ashton-Key M, Diss TC, Pan L, Du MQ, Isaacson PG. Molecular analysis of T-cell clonality in ulcerative jejunitis and enteropathy-associated T-cell lymphoma. Am J Pathol 1997; 151: 493-498.
- Weiss – Goldblum. Enzinger and Weiss. Soft tissue tumors. 5th edition. Mosby 2008.
- Kolberg M, Holand M, Agesen TH, Brekke HR, Liestol K, Hall KS, et al. Survival meta-analyses for >1800 malignant peripheral nerve sheath tumor patients with and without neurofibromatosis type 1. Neuro Oncol 2013: 15: 135-147.
- Martin G, Redondo C, Artigues E, Fabra R, Roig JV. Tumor maligno de la vaina de los nervios periféricos en intestino delgado. Cir Esp 2011; 89: 113-124.
- Ducatman BS, Scheithauer BW, Piepgras DG, Reiman HM, Ilstrup DM. Malignant peripheral nerve sheath tumors. A clinicopathologic study of 120 cases. Cancer 1986; 57: 2006-2021.
- Nozu T, Takahashi A, Asakawa H, Uehara A, Kohogo Y, Suzuki T. Malignant intestinal schwannoma: a case report and a review of the literature in Japan. Intern Med 1995; 34: 1101-1105.
Correspondencia: Andrea Natalia Odzak
Dirección: Pi y Margall 750. 1er piso. Clínica Médica.
Ciudad Autónoma de Buenos Aires, Argentina. Cel: 15 5496 6467
Correo electrónico: andreaodzak@gmail.com
Acta Gastroenterol Latinoam 2017;47(2):126-130
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE