Walter Masson ID
Jefe Prevención Cardiovascular. Servicio de Cardiología. Hospital Italiano de Buenos Aires.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2024;54(2):115-116
Recibido: 23/05/2024 / Aceptado: 19/06/2024 / Publicado online el 30/06/2024 / https://doi.org/10.52787/agl.v54i2.418
Los ensayos clínicos representan el más alto nivel de evidencia para la toma de decisiones médicas, tal como se indica en las guías clínicas bajo la recomendación de clase I. Sin embargo, estos estudios presentan ciertas limitaciones, como el tiempo y los costos requeridos, la dificultad para obtener muestras de algunas poblaciones y las barreras éticas. Para acelerar el desarrollo de nuevos fármacos, es esencial contar con una definición clara de biomarcadores pronósticos o predictivos y con criterios de valoración bien establecidos. Además, las limitaciones de personal pueden obstaculizar el progreso de los ensayos clínicos.
Por este motivo, y con el avance de nuevas metodologías, la digitalización de la información y la inteligencia artificial (IA) favorecerán un cambio en la estructura del diseño de los ensayos clínicos, así como en su generalización. El mundo de los ensayos clínicos está en plena transformación, tanto en la conducción de los estudios como en la generación de diferentes tratamientos.
El futuro de los diseños y la metodología
Se requieren estrategias de investigación innovadoras para aumentar la participación de los pacientes y producir evidencia de la más alta calidad que permita la rápida traducción de diagnósticos y terapias desde entornos de investigación a entornos clínicos para mejorar la salud de la población. La enfermedad del coronavirus 2019 (COVID-19) ha acelerado el desarrollo de ensayos clínicos de próxima generación, obligándolos a centrarse más en el paciente.
Los estudios futuros estarán basados en IA, aprendizaje automático y redes neuronales profundas para mejorar el descubrimiento de fármacos, la interpretación de imágenes, la racionalización de los datos de los registros médicos electrónicos y la mejora del flujo de trabajo de los ensayos. Estos estudios también se adaptarán a los avances recientes en inmunología y medicina de precisión. Los protocolos maestros, que comprenden subestudios como estudios generales, estudios de canasta, estudios de plataforma y ensayos observacionales maestros, se utilizarán para mejorar el diseño de ensayos clínicos.
Los estudios clínicos futuros serán más descentralizados y virtualizados, y comprenderán criterios de valoración digitalizados para un seguimiento más realista y estandarizado de las experiencias del paciente en el mundo real. Los ensayos pragmáticos son una aproximación a este enfoque y permitirán el monitoreo remoto.
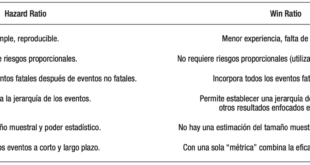
Otra característica de los futuros ensayos es la capacidad de responder a múltiples preguntas de investigación mediante técnicas avanzadas como el big data y la IA. Actualmente, los criterios de valoración pueden ser multidimensionales y abarcar resultados metabólicos, cardiovasculares y renales en un solo estudio, y pueden combinarse con resultados centrados en el paciente mediante técnicas como el win ratio. Por lo tanto, es importante utilizar nuevos diseños que permitan la integración con los registros de salud pública, utilizando estudios aleatorizados basados en registros y datos fiables de los registros clínicos electrónicos.
Los criterios de valoración que incluyan bienestar, calidad de vida y duración de la estadía hospitalaria pueden proporcionar información sustancial más allá de la morbimortalidad, y así mejorar el cuidado de los pacientes, especialmente de aquellos con una corta expectativa de vida, donde la calidad es más importante que la cantidad.
Otro punto a considerar es el avance de los biomarcadores y los estudios de imágenes asociados a la IA, donde esta información mejorará la inclusión de pacientes en los estudios y el enfoque en subgrupos específicos que se beneficiarían de una terapia en particular o de un objeto de investigación. Es decir, pasaremos de diseños de estudios «de un solo órgano» a un enfoque multiorgánico, con el entrecruzamiento de información de diferentes sistemas. Un ejemplo de esto es el síndrome metabólico, donde interactúan el corazón, el riñón, el microbioma, el hígado y el cerebro.
Por otro lado, el avance de los sensores y dispositivos portátiles permite la recolección de datos y el monitoreo remoto, lo cual representa otro punto de mejora en la eficiencia de los estudios en el futuro. Todas estas consideraciones sobre el avance de la tecnología deben tener un sustento fundamental: la confiabilidad y calidad de los datos disponibles. Sin ello, persistirá el sesgo de inclusión, y los resultados y su generalización se verán seriamente afectados.
En conclusión, el avance de la tecnología, que favorecerá una inclusión menos restrictiva de la población, un enfoque centrado en el paciente, diseños más pragmáticos e identificación de subgrupos como objetivo de investigación, mejorará la calidad de la evidencia con mayor eficiencia en la generalización y en la gestión de poblaciones hasta ahora excluidas de los ensayos clínicos.
Los puntos centrales del futuro de los ensayos clínicos podrían ser resumidos en:
– Centrados en el paciente.
– Utilización de tecnología y estudios descentralizados para reducir y simplificar la carga de trabajo.
– Mejora en la exactitud de los datos mediante la incorporación de bases electrónicas más parametrizadas y confiables.
– Mayor disponibilidad y calidad de datos del mundo real.
– Énfasis en la experiencia del paciente.
– Agilización, adaptación y flexibilización del diseño de estudios (diseños híbridos) para adaptarse a los cambios de contexto.
– Mayor eficiencia en la infraestructura de la investigación clínica, incluyendo telemedicina, captura de datos electrónicos y monitoreo remoto.
Propiedad intelectual. El autor declara que los datos presentes en el manuscrito son originales y se realizaron en la institución a la cual pertenece.
Financiamiento. El autor declara que no hubo fuentes de financiación externas.
Conflicto de interés. El autor declara no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2024 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Masson W. El futuro de los ensayos clínicos. Acta Gastroenterol Latinoam. 2024;54(2):115-116. https://doi.org/10.52787/agl.v54i2.418
Referencias
Zanna dF, Pitt B. The Future of Clinical Trials. Circulation 2024;149:1783-1785.
Subbiah V. The next generation of evidence based medicine. Nature Medicine 2023;29:49-58.
Hernandez AF, Lindsell CJ. The Future of Clinical Trials: Artificial to Augmented to Applied Intelligence. JAMA 2023;330:2061-2063.
Correspondencia: Walter Masson
Correo electrónico: walter.masson@hospitalitaliano.org.ar
Acta Gastroenterol Latinoam 2024;54(2):115-116
The Future of Clinical Trials
Walter Masson ID
Chief of Cardiovascular Prevention, Hospital Italiano.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2024;54(2):117-118
Received: 23/05/2024 / Accepted: 19/06/2024 / Published online 30/06/2024 /
https://doi.org/10.52787/agl.v54i2.418
Clinical trials represent the highest level of evidence for medical decision-making, as indicated in clinical guidelines under the class I recommendation. However, these studies present limitations, such as the time and costs required, difficulty obtaining samples from some populations, and ethical barriers. A clear definition of prognostic or predictive biomarkers and well-established endpoints are essential to accelerate the development of new drugs. In addition, personnel limitations can hinder the progress of clinical trials.
For this reason, and with the advance of new methodologies, the digitalization of information and artificial intelligence (AI) will favor a change in the structure of the design of clinical trials, as well as in their generalization. The world of clinical trials is in full transformation, both in the conduct of studies and in the development of different treatments.
The Future of Design and Methodology
Innovative research strategies are required to increase patient engagement and produce the highest quality evidence, enabling rapid translation of diagnostics and therapies from research to clinical settings to improve population health. Coronavirus disease 2019 (COVID-19) has accelerated the development of next-generation clinical trials, forcing trials to become more patient-centered.
Future studies will rely on AI, machine learning and deep neural networks to improve drug discovery, image interpretation, streamlining electronic medical record data and improving trial workflow. These studies will also accommodate recent advances in immunology and precision medicine. Master protocols, comprising sub-studies such as general studies, basket studies, platform studies and master observational trials, will be used to improve clinical trial design.
Future clinical trials will be more decentralized and virtualized and will comprise digitized endpoints for more realistic and standardized monitoring of real-world patient experiences. Pragmatic trials are one step towards this approach and will enable remote monitoring.
Another feature of future trials is the ability to answer multiple research questions using advanced techniques such as big data and AI. Currently, endpoints can be multidimensional, spanning metabolic, cardiovascular and renal outcomes in a single study, and combined with patient-centered outcomes using techniques such as win ratio. It is therefore important to use new designs that allow integration with public health registries, using randomized studies based on reliable registry and electronic clinical record data.
Endpoints including well-being, quality of life, and length of hospital stay may provide substantial information beyond morbidity and mortality, improving patient care, especially in those with a short life expectancy, where quality is more important than quantity.
Another point to consider is the advancement of biomarkers and imaging studies associated with AI, where this information will improve the inclusion of patients in studies and the focus on specific subgroups that would benefit from a particular therapeutics or research target. That is, we will move from «single organ» study designs to a multi-organ approach, with cross-linking of information from different systems. An example of this is metabolic syndrome, where the heart, kidney, microbiome, liver and brain interact.
On the other hand, the advance of sensors and portable devices allows data collection and remote monitoring, which represents another point of improvement in the efficiency of studies in the future. All these considerations on the advancement of technology must have a fundamental basis: the reliability and quality of the available data. Otherwise, inclusion bias will persist, and the results and their generalization will be seriously affected.
In conclusion, the advance of technology, which will favor a less restrictive inclusion of the population, a patient-centered approach, more pragmatic designs and the identification of subgroups as research targets, will improve the quality of evidence with greater efficiency in generalization and in the management of populations yet excluded from clinical trials.
The focal points of the future of clinical trials could be summarized as:
– Patient-centered.
– Use of technology and decentralized studies to reduce and simplify the workload.
– Improved data accuracy by incorporating the most parameterized and reliable electronic databases.
– Increased availability and quality of real-world data.
– Emphasis on patient experience.
– Streamlining, adapting and making study design more flexible (hybrid designs) to adapt to changing contexts.
– Increased efficiency in clinical research infrastructure, including telemedicine, electronic data capture and remote monitoring.
Intellectual property. The author declares that the data in the manuscript is original and were prepared at his belonging institution.
Funding. The author declares that there were no external sources of funding.
Conflict of interest. The author declares that he has no conflicts of interest related to this article.
Copyright
© 2024 Acta Gastroenterológica latinoamericana. This is an open-access article released under the terms of the Creative Commons Attribution (CC BY-NC-SA 4.0) license, which allows non-commercial use, distribution, and reproduction, provided the original author and source are acknowledged.
Cite this article as: Masson W. The Future of Clinical Trials. Acta Gastroenterol Latinoam. 2024;54(2):117-118. https://doi.org/10.52787/agl.v54i2.418
References
Zanna dF, Pitt B. The Future of Clinical Trials Circulation 2024;
149:1783-1785.
Subbiah V. The next generation of evidence-based medicine. Nature Medicine 2023;29:49-58.
Hernandez AF, Lindsell CJ. The Future of Clinical Trials: Artificial to Augmented to Applied Intelligence. JAMA 2023;330:2061-2063.
Correspondence: Walter Masson
Mail: masson@hospitalitaliano.org.ar
Acta Gastroenterol Latinoam 2024;54(2):117-118
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE