Diego Haberman ID· Mariano Volpacchio ID· Augusto Centellas ID· Fabrizio Acosta ID· Karen García ID· Joaquín Vidal ID
Centro Rossi. Diagnóstico por imagen.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2025;55(1):15-25
Recibido: 16/01/2025 / Aceptado: 06/02/2025 / Publicado online el 31/03/2025 /
https://doi.org/10.52787/agl.v55i1.462
Resumen
Las anomalías congénitas del páncreas se originan como consecuencia del fracaso en la adecuada migración y/o fusión durante el desarrollo embriológico. Habitualmente son diagnosticadas en la edad adulta, de manera incidental en estudios imagenológicos realizados por otros motivos. Algunos pacientes pueden desarrollar síntomas como dolor abdominal o incluso generar condiciones clínicas relevantes, incluyendo obstrucción al tracto de salida gástrico, pancreatitis aguda y recurrente. En este artículo revisaremos las características imagenológicas de las anomalías congénitas pancreáticas más importantes, con énfasis en la utilización de la colangiopancreatografía por resonancia magnética.
Palabras claves. Páncreas, anomalías del desarrollo, conducto pancreático, tomografía computada, colangiopancreatografía por resonancia magnética.
Diagnostic Imaging in the Developmental Anomalies of the Pancreas
Summary
Congenital anomalies of the pancreas result from failure of proper migration and/or fusion during embryologic development. They are usually diagnosed in adulthood, incidentally in imaging studies performed for other reasons. Some patients may develop symptoms such as abdominal pain or even relevant clinical conditions including gastric outflow tract obstruction, acute and recurrent pancreatitis. In this article we will review the imaging features of the most important congenital pancreatic anomalies, with emphasis on magnetic resonance cholangiopancreatography.
Keywords. Pancreas, developmental anomalies, pancreatic duct, computed tomography, magnetic resonance cholangiopancreatography.
Abreviaturas
colangio-RM: Colangiopancreatografía por resonancia
magnética.
CPP: Conducto pancreático principal.
PA: Pancreatitis aguda.
PAR: Pancreatitis aguda recurrente.
Introducción
Las anomalías del desarrollo del páncreas corresponden a alteraciones en la rotación y/o fusión de los brotes pancreáticos durante la embriogénesis. Pueden involucrar al parénquima o al sistema ductal e incluso en ocasiones podemos encontrar formas combinadas. Suelen encontrarse incidentalmente en estudios por imágenes realizados por otros motivos. El adecuado conocimiento de los rasgos radiológicos de estas entidades tiene gran relevancia para un correcto diagnóstico y tratamiento del paciente. Los médicos especialistas en diagnóstico por imágenes cumplen un papel importante no solo efectuando un diagnóstico preciso de cada anomalía (evitando interpretarlas erróneamente como patologías más graves), sino también colaborando con el equipo multidisciplinario en juzgar adecuadamente su impacto clínico. Entre los estudios por imágenes no invasivos, la colangiopancreatografía por resonancia magnética (Colangio-RM) con contraste intravenoso es el método ideal. Permite apreciar con gran detalle la anatomía ductal, evaluando las características morfológicas, el recorrido y la desembocadura del conducto pancreático. Debido a su gran resolución tisular, utilizando distintas secuencias de ponderación tisular y contraste intravenoso, es posible analizar la anatomía del parénquima glandular y detectar patologías asociadas.
Embriología
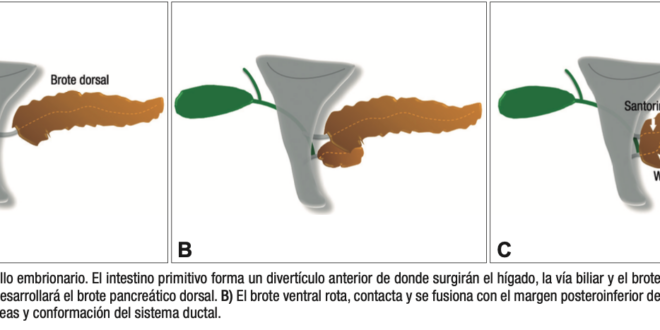
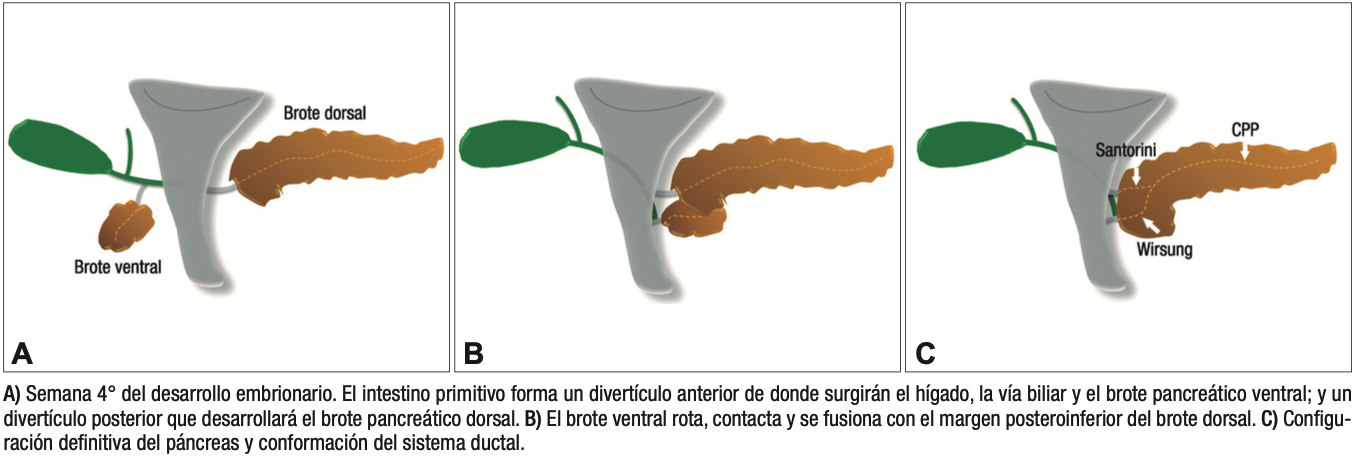
En la 4° semana de la embriogénesis surgen los brotes ventral y dorsal del páncreas, provenientes del intestino primitivo. En la 7° semana el brote ventral gira en sentido de las agujas del reloj y se fusiona con el margen posteroinferior del brote dorsal, quedando conformada de esta manera la glándula pancreática. Es así como la región posteroinferior de la porción cefálica y el proceso uncinado derivan del brote ventral mientras que la porción anterior de la cabeza, el cuello, el cuerpo y la cola lo hacen del brote dorsal. Al mismo tiempo se produce la fusión de los conductos, con el surgimiento de un nuevo ducto que conecta el conducto pancreático principal (CPP) (páncreas dorsal) con el conducto de Wirsung (páncreas ventral), drenando las secreciones glandulares en la papila mayor. La prolongación distal del conducto del páncreas dorsal, puede obliterarse o bien persistir como un pequeño conducto (Santorini) que drena en la papila menor.1-3
Figura 1. Esquemas del desarrollo embriológico del páncreas
Anomalías congénitas
Se clasifican en anomalías de la migración/rotación y en anomalías de la fusión, incluso pueden existir formas mixtas o combinadas. Cada una de estas entidades puede predisponer a patologías específicas, con diferentes implicancias clínicas.4
Páncreas divisum
Es la anomalía del desarrollo pancreático más frecuente, presente en 4 a 14% de la población según lo publicado en diferentes series.5
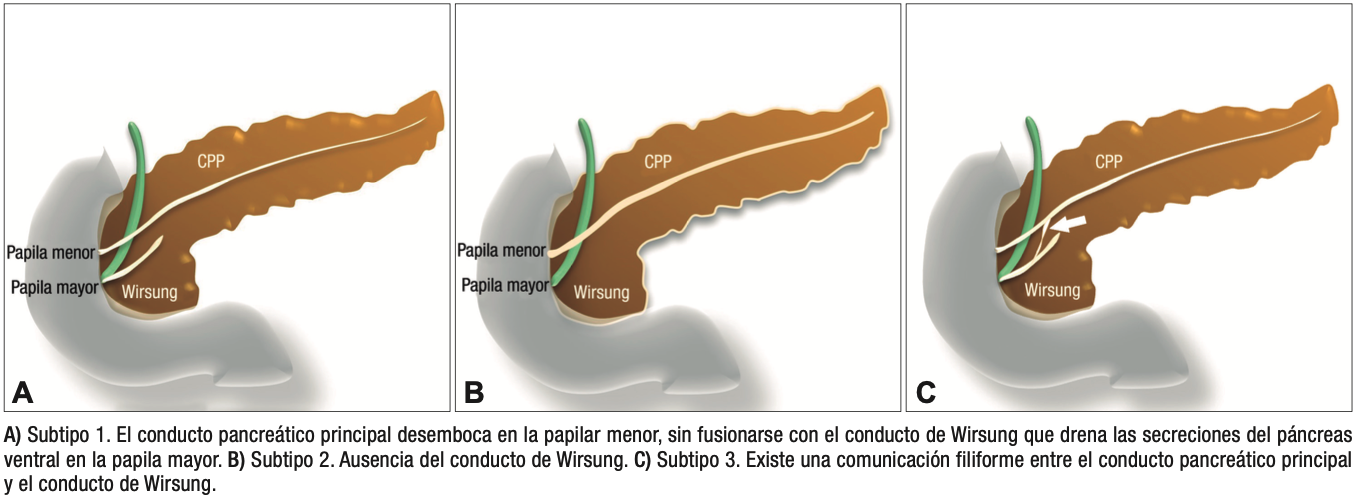
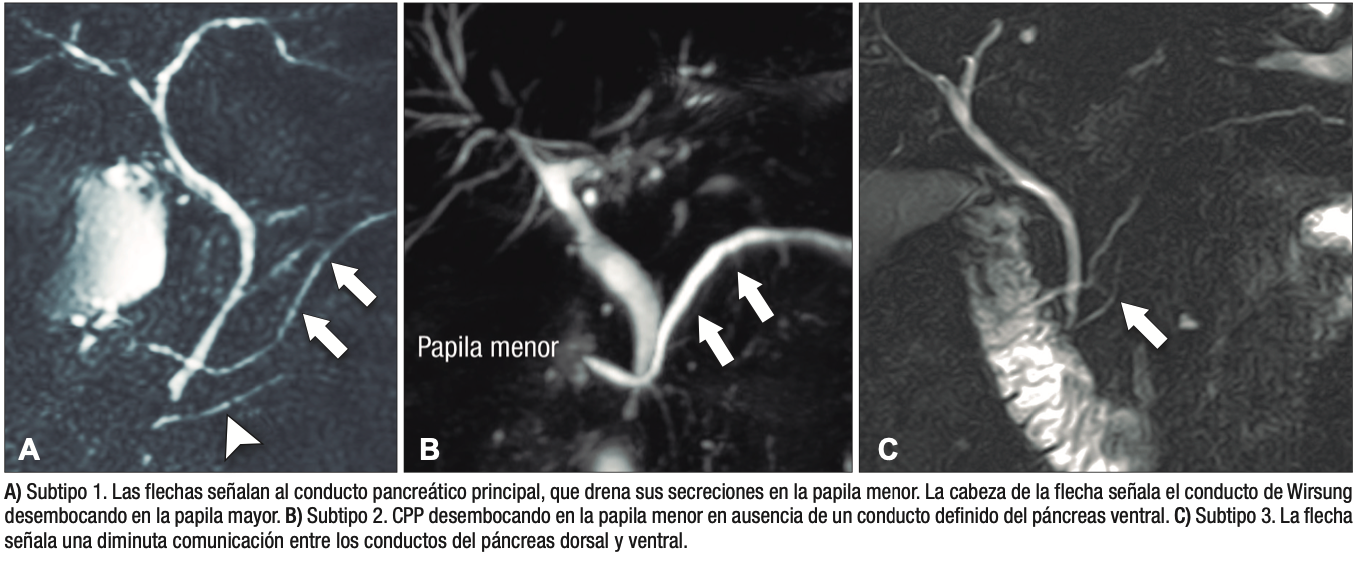
En esta condición hay una falta de fusión de los conductos del páncreas dorsal con el ventral, por ende, la mayoría de las secreciones de la glándula desembocarán en la papila menor. Se han descripto tres subtipos de páncreas divisum. Tipo 1 o clásico, con falta completa de fusión, pudiendo identificarse ambos conductos claramente separados; tipo 2, donde el conducto dorsal es dominante y drena en la papila menor, mientras que el conducto de Wirsung (páncreas ventral) está ausente; y tipo 3 o funcional, donde hay una rama comunicante filiforme entre ambos conductos (Figura 2).6, 7
Figura 2. Esquemas de los diferentes subtipos de páncreas divisum
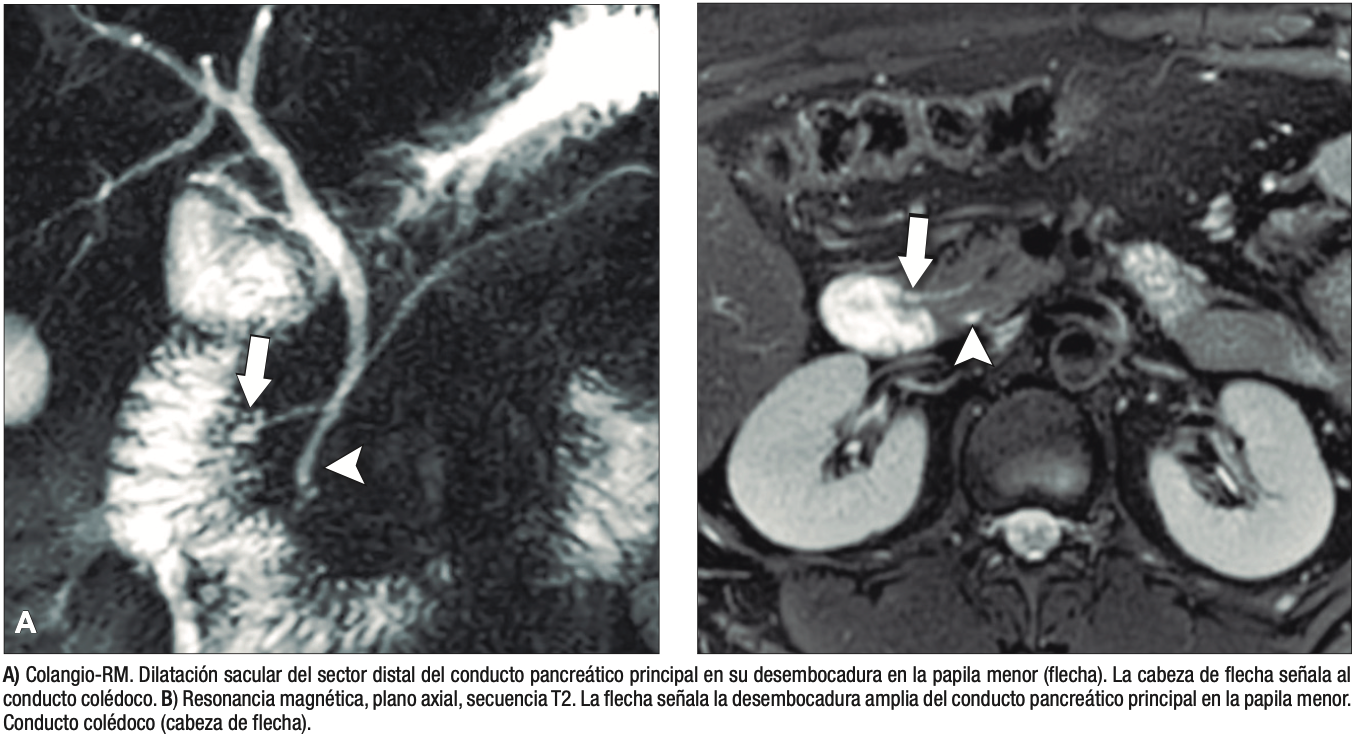
Los individuos con páncreas divisum suelen ser asintomáticos y diagnosticados incidentalmente en estudios de colangio-RM realizados por otros motivos (Figura 3).
Se ha descripto su potencial rol como desencadenante de eventos de pancreatitis aguda (PA) y pancreatitis aguda recurrente (PAR). La hipótesis es que la papila menor, más pequeña, es insuficiente para permitir el drenaje adecuado del volumen de secreciones originadas en el páncreas corpocaudal, que habitualmente derivan hacia la papila mayor. Actualmente se acepta que la PAR es una condición de origen multifactorial y que el páncreas divisum actúa como cofactor, habitualmente asociado a otras entidades, como son las mutaciones genéticas (genes CFTR, PRSS1). La sola presencia de páncreas divisum como “gatillo” de pancreatitis es controversial, fundamentalmente debido a que no se ha demostrado mayor prevalencia de esta condición en pacientes con PA, comparativamente con la población general.8, 9
Figura 3. Páncreas divisum. Colangiopancreatografía por resonancia magnética
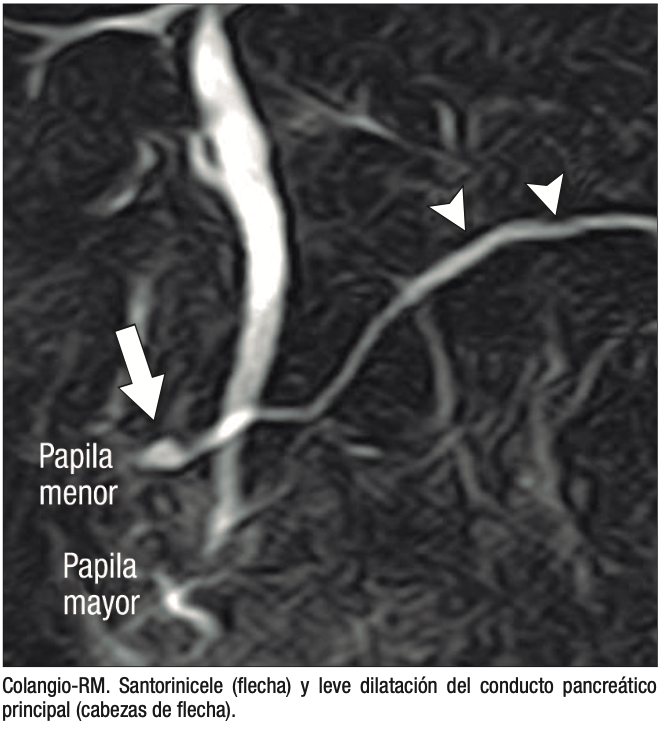
En la colangio-RM podemos encontrar algunos e-lementos imagenológicos que sugieren un posible aumento de la presión del CPP y por lo tanto una mayor influencia del páncreas divisum como factor etiológico de pancreatitis. La dilatación ductal mayor a los 3 mm y/o la presencia de una dilatación sacular en la desembocadura (Santorinicele), son hallazgos imagenológicos que sugieren un rol en el desarrollo de eventos (Figuras 4 y 5). Por otra parte, la colangio-RM, por su gran resolución de tejidos, puede demostrar signos incipientes de pancreatitis crónica que orienten hacia el potencial impacto del páncreas divisum.10-13
Conducto biliopancreático común largo
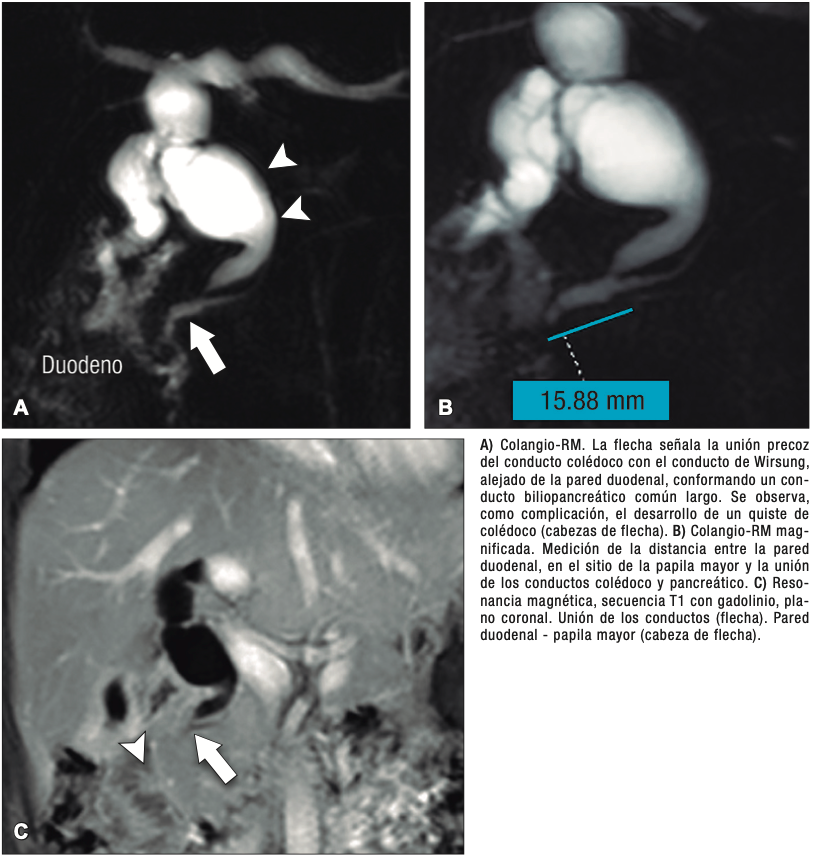
La unión entre el conducto colédoco y el conducto pancreático ocurre de diversas maneras, la mayoría son consideradas variantes normales y no tienen implicancias clínicas. Suelen confluir en un canal común con una longitud menor a los 5 mm y con un ángulo variable, alternativamente puede existir un ingreso al duodeno de ambos conductos por separado. En el canal común biliopancreático largo existe una unión precoz del colédoco con el conducto pancreático, con confluencia proximal al esfínter de Oddi por fuera de la pared duodenal. Para su diagnóstico se requiere una distancia mayor o igual a 15 mm entre la papila mayor y la confluencia de ambos conductos (Figura 6). Este conducto común largo permite el reflujo de las secreciones pancreáticas al colédoco, aumentando la presión intraductal y favoreciendo el desarrollo de quistes coledocianos. También favorece el reflujo de bilis hacia el conducto pancreático y, como consecuencia, predispone a la PA y PAR.14,15
Figura 6. Esquema del conducto biliopancreático común largo
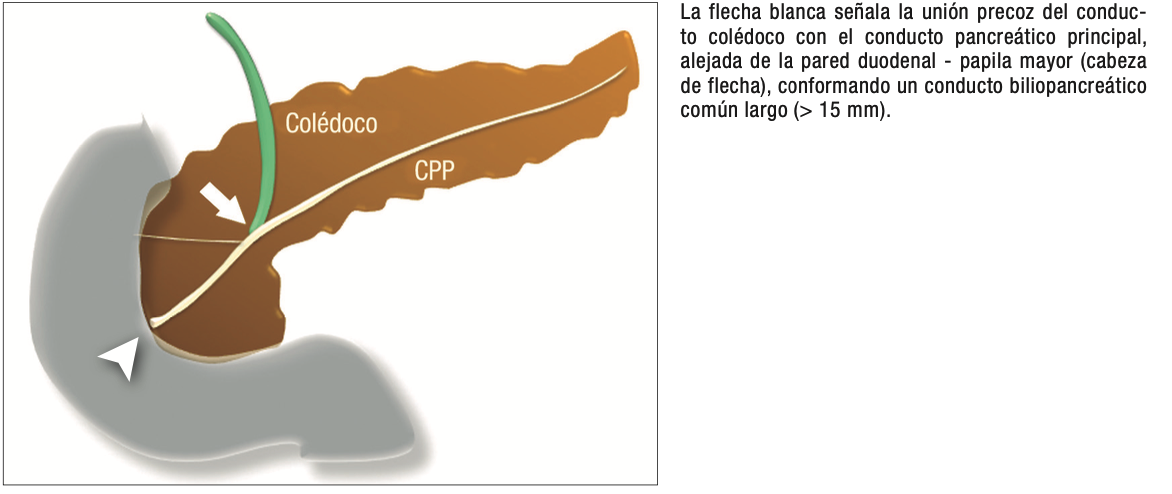
Figura 7. Conducto biliopancreático común largo
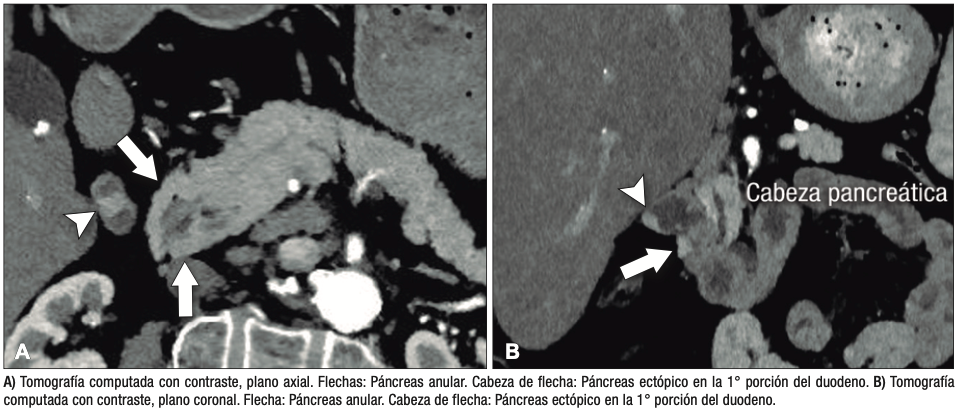
Páncreas Anular
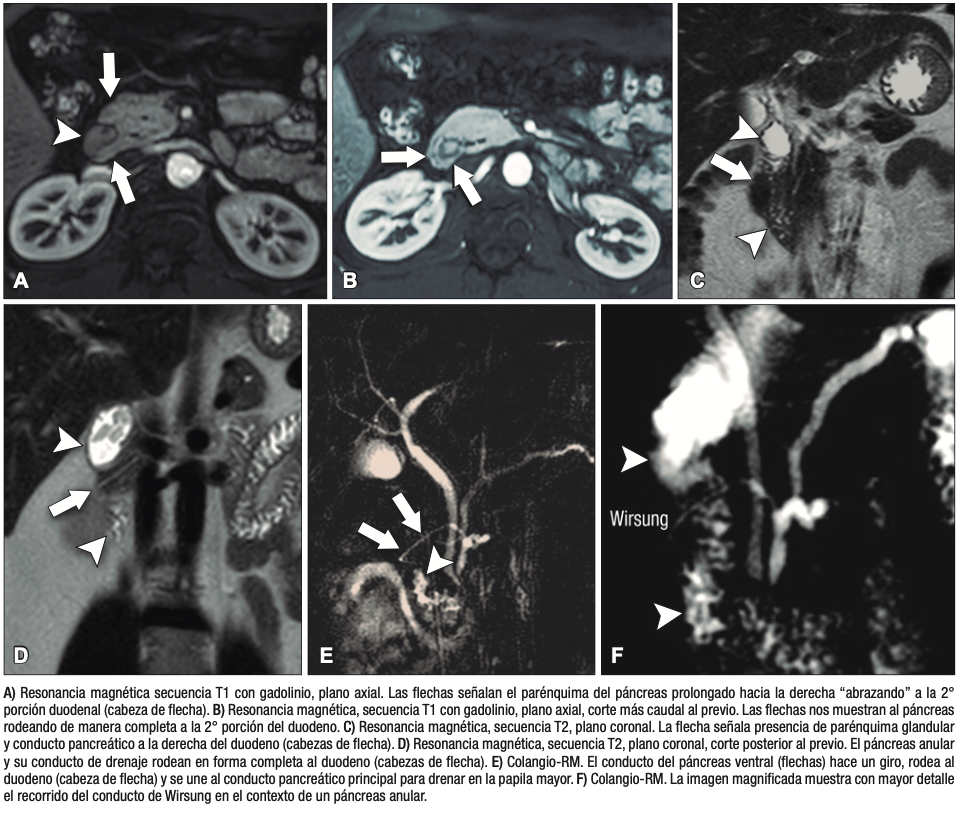
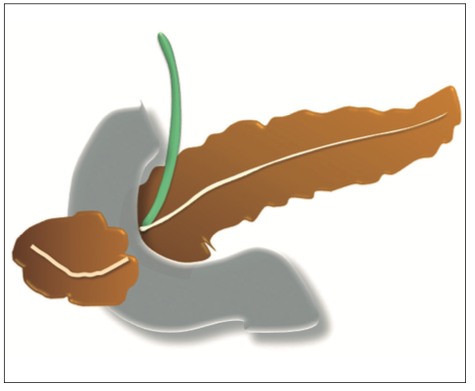
Consiste en una anomalía de la migración del brote pancreático ventral, el cual no rota o lo hace de manera incompleta, resultando en la presencia de tejido glandular pancreático a la derecha del duodeno, rodeando a su 2° porción (Figura 8). Han sido descriptos dos subtipos: el extramural, donde el conducto de Wirsung rodea al duodeno uniéndose al conducto pancreático principal; y el intramural, donde el tejido pancreático se entremezcla con la pared duodenal y sus secreciones drenan directamente a la luz a través de conductos muy pequeños.16
Figura 8. Esquema del páncreas anular
En las imágenes encontramos parénquima pancreático rodeando a la 2° porción duodenal, habitualmente en toda su circunferencia y en ocasiones de manera incompleta. En la colangio-RM es posible visualizar al conducto pancreático a la derecha del duodeno, con un recorrido que se dirige a la ubicación de la papila mayor (Figura 9).17
El páncreas anular en neonatos, cuando es sintomático, provoca síndrome de obstrucción gástrica, clínicamente manifestado con vómitos como consecuencia de la compresión y estenosis de la 2° porción duodenal. En los adultos también puede originar obstrucción gastrointestinal, y los pacientes presentan dolor abdominal, habitualmente postprandial y/o vómitos. En menor medida puede predisponer a PAR o bien a úlcera péptica, esta última descripta particularmente en la forma intramural.
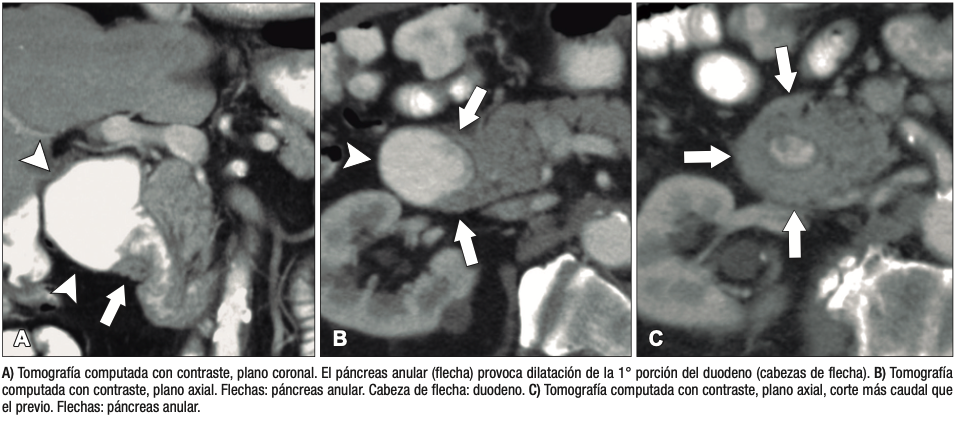
Más allá del diagnóstico de esta anomalía debemos buscar signos imagenológicos indirectos de obstrucción gastrointestinal, como son la dilatación gástrica y de la 1° porción duodenal (Figura 10), con estrechez de la luz del duodeno en el sitio por donde transcurre a través del páncreas anular.18,19
Figura 10. Páncreas anular con obstrucción del tracto de salida gastrointestinal
Páncreas ectópico
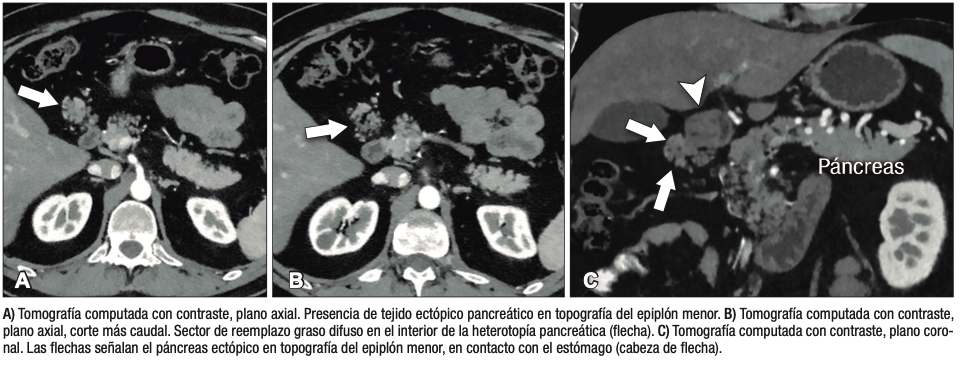
Se refiere a la presencia de tejido pancreático fuera de su ubicación normal y sin conexión con el parénquima glandular principal. Su localización más frecuente es en el tracto gastrointestinal, con mayor prevalencia en el estómago y duodeno, aunque también puede estar presente en otros sitios como el mesenterio, epiplones e incluso en el hígado (Figuras 11 y 12). La hipótesis más aceptada es que corresponde a la proliferación de tejido pancreático a partir de restos celulares de los brotes embriológicos.
Figura 12. Combinación de páncreas ectópico y anular
Si bien suele ser asintomática la heterotopía pancreática está formada por tejido funcionante que por lo tanto es susceptible a sufrir las mismas patologías que el páncreas normotópico, pudiendo desarrollar pancreatitis e incluso dar lugar a tumores exocrinos (adenocarcinoma) y endocrinos.20
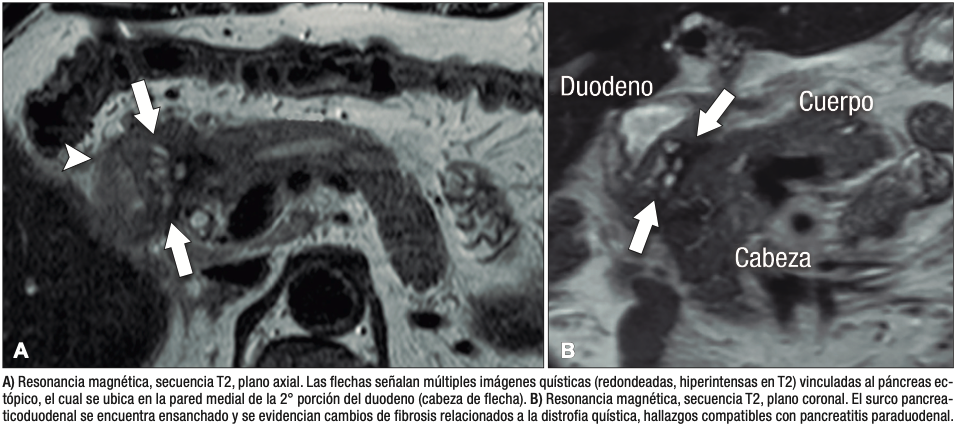
Una complicación infrecuente del páncreas ectópico es la distrofia quística, que se postula representa la dilatación tubular y sacular de los conductos en el interior del tejido heterotópico (Figura 13). Es posible hallarla en el estómago y sobre todo en la 2° porción del duodeno, donde puede conducir a una pancreatitis paraduodenal, también denominada pancreatitis del surco.21,22
Figura 13. Distrofia quística en páncreas ectópico duodenal
El diagnóstico diferencial del páncreas ectópico es con las lesiones extramucosas gástricas y duodenales, en particular el tumor del estroma gastrointestinal. En los estudios imagenológicos la heterotopía muestra un aspecto “glandular” similar al del páncreas. Por otra parte, exhibe refuerzo similar al páncreas en las secuencias dinámicas post-contraste obtenidas en las fases arterial-parenquimatosa pancreática y portal. La colangio-RM, debido a su mayor resolución tisular, ofrece ventajas frente a la TC, mostrando el tejido ectópico con similar intensidad de señal (en todas las secuencias de pulso) a la glándula pancreática.23,24
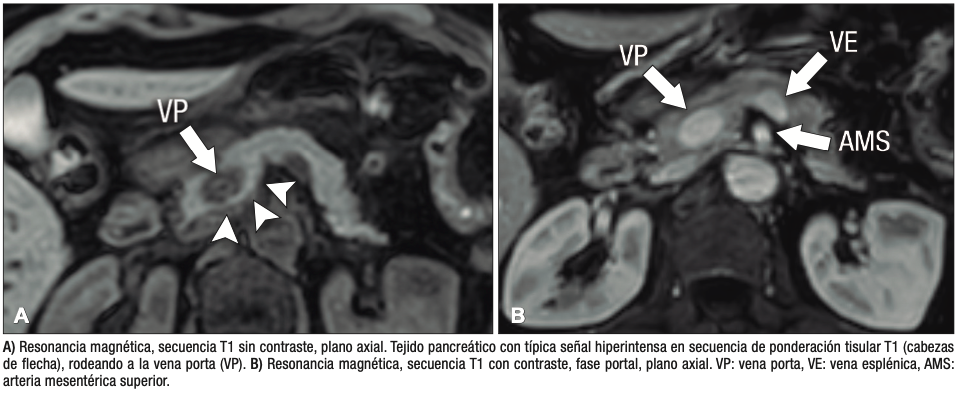
Páncreas Circumportal
El páncreas engloba a la vena mesentérica superior o vena porta, en lugar de rodear al duodeno como sucede en el páncreas anular (Figura 14). Tiene una prevalencia de hasta 2,5% según algunas series, por ende, no es tan infrecuente encontrarlo en estudios por imágenes. Se postula que su origen está relacionado con una anomalía en la rotación y fusión del brote ventral con el dorsal. Es una condición asintomática, pero cobra relevancia reconocerla e informarla en pacientes que serán sometidos a cirugía del páncreas, con el fin de reducir complicaciones, particularmente la fístula pancreática.25, 26
Figura 14. Páncreas circumportal
Hipoplasia pancreática
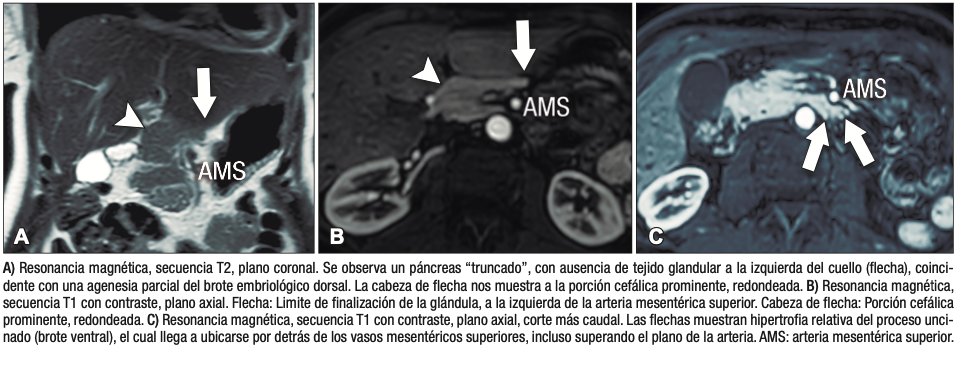
La agenesia pancreática completa es incompatible con la vida y extremadamente infrecuente. La agenesia parcial o hipoplasia puede involucrar el brote ventral o dorsal, con mayor frecuencia este último. Puede ser una condición aislada o bien estar asociada al síndrome de heterotaxia – poliesplenia. En la hipoplasia del páncreas dorsal se observa la porción cefálica y el proceso uncinado de aspecto redondeado, con ausencia del cuello, cuerpo y cola. Suele observarse relativa prominencia del proceso uncinado, que se prolonga por detrás de los vasos mesentéricos (Figura 15). Es imprescindible efectuar el diagnóstico diferencial y descartar exhaustivamente una lesión neoplásica que provoque atrofia del páncreas corpocaudal, distal al tumor. Los individuos con agenesia del páncreas dorsal suelen ser asintomáticos, aunque se ha descripto un riesgo incrementado de padecer diabetes debido a que el mayor porcentaje de los islotes de células de Langerhans se hallan en el páncreas distal.27
Figura 15. Hipoplasia pancreática (Agenesia parcial del brote dorsal)
Conclusión
Las anomalías del desarrollo del páncreas se encuentran con frecuencia en individuos asintomáticos que se realizan estudios de imágenes por otros motivos. La colangio-RM con contraste intravenoso es la modalidad de elección, ya que evalúa tanto el sistema ductal como el parénquima pancreático, establece con precisión cada una de las anomalías del desarrollo, reconoce posibles complicaciones y permite efectuar diagnósticos diferenciales con otras entidades.
Fuentes de financiamiento. Los autores declaran que no hubo financiacion externa.
Propiedad intelectual. Los autores declaran que los datos, figuras y tablas en el presente manuscrito son originales provenientes de sus instituciones
Conflicto de interés. Los autores declaran no tener conflicto de interes con relacion a este articulo.
Aviso de derechos de autor
© 2025 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Haberman D, Volpacchio M, Centellas A y col. Diagnóstico por imágenes en las anomalías del desarrollo del páncreas. Acta Gastroenterol Latinoam. 2025;55(1):15-25. https://doi.org/10.52787/agl.v55i1.462
Referencias
- Langman J, Sadler T. Medical embryology. 12th ed. Baltimore: Lippincott, Williams & Wilkins, 2020;220-222.
- Schulte SJ. Embryology, normal variation, and congenital anomalies of the pancreas. Margulis and Burhenne alimentary tract radiology. 5th ed. St Louis, Mo: Mosby, 1994;1039-1051.
- Rizzo RJ, Szucs RA, Turner MA. Congenital abnormalities of the pancreas and biliary tree in adults. Radiographics 1995;15(1),49-68.
- Borghei P, Sokhandon F, Shirkhoda A, Morgan D. Anomalies, anatomic variants, and sources of diagnostic pitfalls in pancreatic imaging. Radiology. 2013;266(1),28-36.
- Agha FP, Williams KD. Pancreas divisum: incidence, detection, and clinical significance. Am J Gastroenterol. 1987;82(4):315-20.
- Ferri V, Vicente E, Quijano Y, Ielpo B, Duran H, Diaz E, Caruso R. Diagnosis and treatment of pancreas divisum: A literature review. Hepatobiliary & Pancreatic Diseass International. 2019;18(4),332-336.
- Kim SS, Shin HC, Hwang JA. Various congenital abnormalities and anatomic variants of the pancreas: A pictorial review. Journal of the Belgian Society of Radiology. 2019;103(1).
- Bertin C, Pelletier AL, Vullierme MP, Bienvenu T, Rebours V, Hentic O, et al. Pancreas divisum is not a cause of pancreatitis by itself but acts as a partner of genetic mutations. Official journal of the American College of Gastroenterology ACG. 2012;107(2),311-317.
- Yu J, Turner MA, Fulcher AS, Halvorsen RA. Congenital anomalies and normal variants of the pancreaticobiliary tract and the pancreas in adults: part 2, pancreatic duct and pancreas. American Journal of Roentgenology. 2006;187(6),1544-1553.
- Eisen G, Schutz S, Metzler D, Baillie J, Cotton PB. Santorinicele: new evidence for obstruction in pancreas divisum. Gastrointestinal endoscopy. 1994;40(1),73-76.
- Türkvatan A, Erden A, Türkoğlu MA, Yener Ö. Congenital variants and anomalies of the pancreas and pancreatic duct: imaging by magnetic resonance cholangiopancreaticography and multidetector computed tomography. Korean journal of radiology. 2013;14(6),905-913.
- Manfredi R, Costamagna G, Brizi MG, Spina S, Maresca G, Vecchioli A, et al. Pancreas divisum and “santorinicele”: diagnosis with dynamic MR cholangiopancreatography with secretin stimulation. Radiology. 2000;217(2),403-408.
- Bret PM, Reinhold C, Taourel P, Guibaud L, Atri M, Barkun AN. Pancreas divisum: evaluation with MR cholangiopancreatography. Radiology. 1996;199(1),99-103.
- Misra SP, Gulati P, Thorat VK, Vij JC, Anand BS. Pancreaticobiliary ductal union in biliary diseases: an endoscopic retrograde cholangiopancreatographic study. Gastroenterology. 1989;96(3),907-912.
- Sugiyama M, Haradome H, Takahara T, Abe N, Tokuhara M, Masaki T, et al. Anomalous pancreaticobiliary junction shown on multidetector CT. American Journal of Roentgenology. 2003;180(1),173-175.
- Mortelé KJ, Rocha TC, Streeter JL, Taylor AJ. Multimodality imaging of pancreatic and biliary congenital anomalies. Radiographics. 2006;26(3), 715-731.
- Leyendecker JR, Elsayes KM, Gratz BI, Brown JJ. MR cholangiopancreatography: spectrum of pancreatic duct abnormalities. American Journal of Roentgenology. 2002;179(6),1465-1471.
- Zyromski NJ, Sandoval JA, Pitt HA, Ladd AP, Fogel EL, Mattar WE, et al. Annular pancreas: dramatic differences between children and adults. Journal of the American College of Surgeons. 2008;206(5),1019-1025.
- Jimenez JC, Emil S, Podnos Y, Nguyen N. Annular pancreas in children: a recent decade’s experience. J Pediatr Surg. 2004; 39(11):1654-1657.
- Rezvani M, Menias C, Sandrasegaran K, Olpin JD, Elsayes KM, Shaaban AM. Heterotopic pancreas: histopathologic features, imaging findings, and complications. Radiographics. 2017:37(2),484-499.
- Vullierme MP, Vilgrain V, Fléjou JF, Zins M, O’Toole D, Ruszniewski P, et al. Cystic dystrophy of the duodenal wall in the heterotopic pancreas: radiopathological correlations. Journal of computer assisted tomography. 2000;24(4),635-643.
- Adsay NV, Zamboni G. Paraduodenal pancreatitis: a clinico-pathologically distinct entity unifying “cystic dystrophy of heterotopic pancreas, ”para-duodenal wall cyst,” and “groove pancreatitis”. In Seminars in diagnostic pathology 2004, November (Vol. 21, No. 4, pp. 247-254). WB Saunders.
- Cho JS, Shin KS, Kwon ST, Kim JW, Song CJ, Noh S M et al. Heterotopic pancreas in the stomach: CT findings. Radiology. 2000;217(1),139-144.24.
- Kim JY, Lee JM, Kim KW, Park HS, Choi JY, Kim SH et al. Ectopic pancreas: CT findings with emphasis on differentiation from small gastrointestinal stromal tumor and leiomyoma. Radiology. 2009;252(1),92-100.
- Leyendecker JR, Baginski SG. Complete pancreatic encasement of the portal vein (circumportal pancreas): imaging findings and implications of a rare pancreatic anomaly. Journal of computer assisted tomography. 2008;32(1),61-64.
- Tappouni R, Perumpillichira J, Sekala M, Hosseinzadeh K, Clark C, Leyendecker J. Circumportal pancreas: imaging findings in 40 patients. Abdominal imaging. 2015;40,521-530.
- Lång K, Lasson Å, Müller M F, Thorlacius H, Toth E, Olsson R. Dorsal agenesis of the pancreas-a rare cause of abdominal pain and insulin-dependent diabetes. Acta Radiologica. 2012;53(1),2-4.
Correspondencia: Diego Haberman
Correo electrónico: diegohaberman@gmail.com
Acta Gastroenterol Latinoam 2025;55(1):15-25
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE