Osvaldo M Tiscornia,1, 2 Simmy Bank,3 Fabiana N López Mingorance,1, 2 Graciela Otero,1 Selene Rodríguez,1 Maria B Di Carlo,2 Patricia G. Tiscornia-Wasserman,1, 4 Gustavo A Negri 1, 2
1 Programa de Estudios Pancreáticos, Hospital de Clínicas, UBA. Argentina.
2 Departamento de Bioquímica Clínica, Hospital de Clínicas, FFyB, INFIBIOC, UBA. Argentina. 3 Department of Gastroenterology of Long Island Medical Hospital, EE.UU. 4 Department of Cytopathology, Columbia University, EE.UU.
Acta Gastroenterol Latinoam 2017;47: 44-52
Recibido: 10/03/2016 / Aprobado: 18/01/2017 / Publicado en www.actagastro.org el 05/04/2017
Resumen
Introducción. Como primera referencia en la literatura describimos las fibras nerviosas que “saltan” el hiato duodeno-pancreático. Concebimos una pista plexual entérica en la que impulsos neurales cursan carriles virtuales. Su región peri-vateriana es un centro colinérgico en el que arcos reflejos autonómicos son revelados. La región íleo-cecal es zona de partida de una onda inhibitoria ascendente que transporta impulsos simpático-colinérgicos-peptidérgico inhibitorios. Barreras cicatrizales (BC) supra-vaterianas (s.V) e infra-vaterianas (i.V) o la desconexión quirúrgica del plexo del hiato duodeno-pancreático (PHDP) inducen cambios significativos en una prueba de tolerancia a la glucosa. Objetivos. Con el objetivo de validar nuestra postulación, que, a través de las BC o la sección del PHDP se modifica la resistencia insulínica (índice HOMA) debido al incremento del tono colinérgico intrahepático generado, trabajamos con ratas macho Wistar distribuidas en: un grupo control Sham n = 7 y uno experimental n = 23 con BC s.V e i.V o desconexión del PHDP. Al año, una PTG fue efectuada. Glucemia, insulinemia, valores acumulados de 60 min y el índice HOMA fueron evaluados. Resultados. Los hallazgos revelan un incremento del tono colinérgico intrahepático que favorece al incremento del “factor hepático” o HISS (hepatic insulin sensitizing substance) de Lautt, el que disminuye significativamente el índice HOMA a través de una mejor disponibilidad de la glucosa por los sistemas vasculares del músculo esquelético, miocardio y riñones.
Palabras claves. Cirugía bariátrica, barrera cicatrizal, pista plexual entérica, HOMA, onda inhibitoria ascendente.
Peri-Vaterian barrier. Insulin resistance depression
Summary
Introduction. We described, the first time in the literature, that neural fibers jump the duodeno-pancreatic cleft. We conceived a “neural-plexual-freeway” where neural impulses follow virtual lanes. Its peri-Vaterian-region (PVR) is a cholinergic center where autonomic arc reflexes are elicited. Its ileo-cecal-region is the starting point of an “ascending-inhibitory-wave” which carries sympathetic plus cholinergic inhibitory peptide impulses flowing up to the PVR. Cicatrizal barriers (CB), supra-Vaterian (s.V) and infra-Vaterian (i.V) or surgical disconnection of the duodeno-pancreatic neural plexus (DPNP) induce significant effects on a glucose tolerance test (GTT). Objetive. To validate our posture that either the CB or sectioning of the DPNP exerts their influence on insulin resistance, HOMA index, through an enhanced hepatic cholinergic tone. Results. Male Wistar rats were distributed in a control Sham group (Sh) n = 7 and an experimental one (E) n = 23 with either s. V and i. V CB or neural disconnection along the DPNP. One year after, in comparison with the “Sh” group, a GTT was carried out. Glycemia, insulinemia, 60 minute cumulative values and the HOMA index were evaluated. We conclude that findings are intimately related with an enhanced hepatic cholinergic tone which it is known allows the release of the Lautt’s hepatic factor HISS, this concerned with insulin sensitization through its glucose disposal effect in skeletal muscle, heart and kidneys vascular systems.
Key words. Bariatric surgery, cicatrizal barriers, neural plexual freeway, HOMA, ascending inhibitory wave.
Abreviaturas
HISS: hepatic insulin sensitizing substance.
RPV: región peri-vateriana.
s.V: supra-vaterianas.
i.V: infra-vaterianas.
PHDP: plexo del hiato duodeno-pancreático.
SNA: sistema nervioso autónomo.
PPE: pista-plexual-entérica.
SNC: sistema nervioso central.
CM: centros moduladores.
BC: barrera cicatrizal.
AF: antro-fúndica.
PV: peri-vateriana.
IC: íeo-cecal.
ARA: arcos reflejos autonómicos.
SPE: secreción pancreática exocrina.
CNVB: complejo nuclear vagal bulbar.
PTG: prueba de tolerancia a la glucosa.
OIA: onda inhibitoria ascendente.
En la cátedra de anatomía de la Facultad de Medicina de Buenos Aires, mediante la disección anatómica macroscópica en cadáveres humanos, reportamos por primera vez en la literatura que fibras nerviosas conectan el duodeno al páncreas a través del plexo que decursa en el hiato entre ambos, especialmente a nivel de la región peri-vateriana (RPV) (Figura 1).1-4 Este hallazgo fue confirmado por Kirchgessner y Gershon,5 y por el grupo de Rozé,6 en base a estudios histoquímicos y distintos tipos de trazadores, ratificando la existencia de un plexo del hiato duodeno-pancreático (PHDP).
En el sistema nervioso autónomo (SNA) deben considerarse componentes simpático (tóraco-lumbar), parasimpático (cráneo-sacro) y peptidérgico.7 Este último se halla inmerso en tres sistemas: el esplácnico-solar, el vagal y el entero-pancreático.8, 9 Nuestro grupo ha plasmado el concepto de pista-plexual entérica (PPE)10 (Figura 2). En ella, los impulsos nerviosos fluyen siguiendo “carriles virtuales”. Esto favorece el intercambio de influencias entre distintos segmentos del tracto gastro-duodeno-yeyuno-ileal y/o el de éstos con otras estructuras, como por ejemplo el tracto biliar, el hígado, el páncreas y el plexo solar.11 La PPE es, en verdad, un sugestivo equivalente de las vías de conducción nerviosa en el sistema nervioso central (SNC) pero, muy especialmente, con el tracto retículo-espinal. En éste, es realmente notable que sus impulsos activantes (“ascending reticular activating system”) (ARAS) son esenciales para que el cerebro logre mantener el estado consciente.12
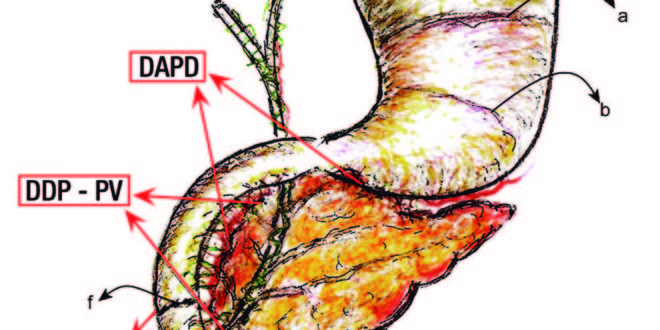
Figura 1. Detalles anatomoquirúrgicos experimentales en la rata.
a Interacción rumen-fúndica.
b Interacción antro-fúndica.
c Plexo del hiato duodeno-pancreático.
d Barrera cicatrizal infra-Vateriana.
e Región peri-Vateriana (RPV).
f Barrera cicatrizal supra Vateriana.
SRA-PV: sección y reanastomosis peri-vateriana.
DDP-PV: desconexión duodeno pancreática peri-vateriana.
DADP: desconexión antro-duodeno-pancreática.
Nuestros hallazgos en el animal nos llevaron a concebir en la PPE tres centros moduladores (CM): el antro-fúndico (AF), el peri-vateriano (PV) y el íleo-cecal (IC) (Figura 1 y 3). La delineación de ellas fue el resultado de efectuar “barreras cicatrizales” (BC), resultantes de la sección y la reanastomosis de la pared entérica. La efectuada en la rata a la altura de la unión antro-fúndica (AF) permitió demostrar, inesperadamente, que ello da origen a una úlcera péptica típica en plena cara antral.13 Siguien do este mismo encuadre, BC efectuadas por encima y por debajo de la papila de Vater, permitieron poner en evidencia un segundo CM, el de la región peri-vateriana (RPV).14-16 Una línea divisoria, trazada a la altura de la papila de Vater, facultó demostrar respuestas fisiológicas con características cualitativas opuestas entre el segmento superior y el inferior de la PPE. Una observación de la escuela de Dreiling es muy reveladora.17 En efecto, la instilación de 50 ml de etanol al 30% en el estómago incrementa la presión ductal en un 55%, en cambio, cuando el mismo procedimiento se efectúa en el duodeno distal (i.V), se constata una caída de la tensión en un 40%. Este mismo protocolo, repetido en animales vagotomizados a nivel cervical, no reveló cambios significativos de la presión intraductal pancreática.
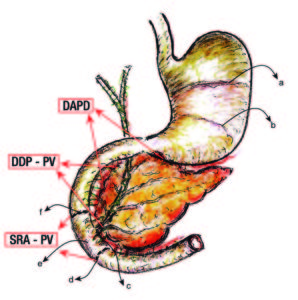
Figura 2. Complejos inervatorios autonómicos.

I: vagal.
II: esplácnico-solar (ES).
III: pista plexual entérica (PPE).
RPV: región peri-vateriana, zona clave de la PPE. Propuesta como un real núcleo parasimpático.
a Fibra aferente vagal.
a’ Rama hepática vagal.
a» Ramas gástricas.
b Rama celíaca vagal.
c Fibra preganglionar simpática.
d Fibra aferente del simpático.
e Neuronas comando colinérgicas en la RPV.
f Gánglio celíaco.
g Neurona postganglionar en el ganglio intrapancreático. Grp: ganglio de la raíz posterior.
h Shunts arterio-venosos en el árbol vascular intrapancreático.
i Cadena simpática paravertebral.
Islote -pancreón: unidades anátomo-funcionales pancreáticas.
En el devenir de los hallazgos observados en la PPE fueron llamativos aquellos constatados luego de crear una BC s.V y otra i.V en ratas portadoras de nuestro modelo de fístula bilio-pancreática.18-19 Con ellas se hicieron estudios sin y con recirculación duodenal de la secreción basal bilio-pancreática. Se pudo establecer que esta RPV es una zona de descarga al páncreas de impulsos vagales que, provenientes de los núcleos hipotalámico-bulbares, hacen su recorrido previo por lo que hemos considerado como “cerebros autonómicos”: “antral” y “duodenal proximal” (Figura 3). La RPV es, sin duda, un centro colinérgico importante en la PPE. Un detalle crucial en él es la presencia de “neuronas comando” del sistema vagal.19, 20 En verdad, es nuestra convicción que esta zona de la PPE es, prácticamente, un núcleo parasimpático. Certificación de lo precedente es que la anestesia tópica del duodeno a nivel de la papila de Vater, tanto en la rata como en el perro, deprime el tono colinérgico de la glándula pancreática en un 70%. Este porcentaje se atenúa a medida que uno se aleja de este punto crítico. Detalle anátomo-fisiológico crucial es que la BC s.V interrumpe la llegada al páncreas de las fibras vagales finas de Pavlov, principales activantes de las células secretorias de PP; éstas localizadas en la periferia de los islotes de Langerhans, especialmente abundantes en el “procesus uncinatus”. En cuanto a la BC infra-vateriana, nuestra postulación es que ella interfiere con la entrada en el tracto biliar hepático de un flujo colinérgico inhibitorio, fruto de una asociación simpático-peptidérgica que asciende por el segmento distal de la PPE desde su CM inferior, la región íleo-cecal (RIC).
Figura 3. Localización de las barreras cicatrizales.
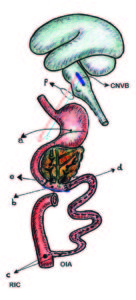
a Intersección antro-fúndica.
b Región peri-vateriana (RPV).
c Región ileo-cecal (RIC).
d BC: barrera cicatrizal, interrupción de la OIA.
e BC: barrera cicatrizal, supra-vateriana.
f Fibras vagales excitatorias
e inhibitorias.
CNVB: complejo nuclear vagal bulbar.
OIA: onda inhibitoria ascendente.
Otro detalle anátomo-fisiológico clave es que la RPV es la zona de activación y “disparo” de arcos reflejos autonómicos (ARA). De ellos fundamentalmente tres: a) el vagal, que conduce a la hipertonía del esfínter de Oddi y, por ende, al incremento de la presión intraductal biliar y pancreática; b) el esplácnico solar, el que, a través de la apertura de “shunts” arterio-venosos, desencadena la isquemia de la microcirculación capilar pancreática; y c) el pseudo-axónico, pivote de la “inflamación neurogénica”, con importante compromiso de la permeabilidad capilar (Figura 2).19, 21
Con nuestro modelo experimental, en la rata, el del “asa duodenal cerrada de corto tiempo” (< de 20 min) logra desencadenar los tres ARA descriptos, que, estimamos, constituyen, realmente, el mecanismo básico esencial de la pancreatitis aguda biliar humana.15, 19
En etapas subsecuentes de nuestro devenir experimental, en la escuela de Sarles (Marsella), en perros provistos con cánulas de Thomas en estómago, íleon y ciego (Figura 5), demostramos que la instilación de ácido oleico en la RIC induce una respuesta inhibitoria de la secreción pancreática exocrina (SPE), estimulada con una perfusión continua de secretina.22 Este hallazgo fue confirmado por el grupo de Harper en gatos,23-25 en quienes los extractos de la mucosa ileal y colónica, lograron poner en evidencia, además, la presencia de un factor inhibidor de la SPE, el “pancreotone”.24 Respecto de este influjo frenador simpático-peptidérgico inhibitorio, este supuesto factor íleo-colónico, pancreotone, es en verdad, según Conter y col,26 el PYY. Este péptido, de la misma familia que el PP y el NPY, es el componente que explica, en conjunción con el simpático, los efectos depresores sobre el tono colinérgico intrapancreático con la consecuente caída del plateau secretorio, inducido por una perfusión continua de secretina. El PYY, en los segmentos inferiores de la PPE (colon derecho, íleon, yeyuno) y el PP, en el superior (duodeno distal), seguramente, tienen el rol principal de inhibir la secreción pancreática exocrina. Esto fue observado en una larga serie de experiencias en el Laboratorio de Dreiling, en el Mt Sinai Hospital de New York, del que fuimos parte.27 Ello fue confirmado apelando a la distensión, con balón de sonda Foley, en los respectivos segmentos analizados. En virtud de lo que antecede, nuestra convicción es, como ya lo hemos adelantado, que una “onda inhibitoria ascendente” (OIA) fluye desde la RIC a la RPV (Figuras 3 y 4).
En caso de no existir obstáculo proximal al curso de la OIA, en la PPE, su penetración en el tracto biliar le permite ejercer un rol modulador del tono colinérgico de la glándula hepática. En el caso del implante de una BC en el duodeno i.V, cabe inferir, un hipertono parasimpático de la glándula hepática (Figura 4). En cuanto a crear una BC s.V, ésta da lugar per se, a una disminución secretoria del PP. Consecuentemente, esto genera una disminución del “freno” ejercido por éste en el “complejo nuclear vagal bulbar” (CNVB). Es de presumir en esta condición una liberación incrementada de descargas parasimpáticas desde el CNVB a la glándula hepática. En nuestro protocolo experimental, en el que se asocia la BC s.V a la i.V, cabe presumir, en el páncreas, una caída secretoria del péptido insular PP. Concomitante con ello, se da la entrada en vigencia de un arco neuro-endocrino largo en el que la disminución del “freno” por el PP en el CNVB genera, desde éste, descargas neurales incrementadas hacia la glándula hepática.
En una situación contextual como la precedente, se justifica poner en consideración los originales hallazgos del grupo canadiense de Lautt,28-32 ellos en lo tocante a la puesta en evidencia de un “factor hepático” descripto con el acrónimo HISS (“hepatic insulin sensitizing substance”). Este hallazgo es realmente destacable porque ha demostrado que sensibiliza significativamente la respuesta insulínica. Ello como consecuencia, en verdad, de facilitar la entrada en juego, en el período alimentario, de complejos vasculares adicionales: miocardio, músculo esquelético y renal (Figuras 3 y 4).
En esta presentación fue nuestro objetivo el certificar, en la rata adulta, apelando a una prueba de tolerancia a la glucosa (PTG), al año de haber realizado modificaciones simples en la PPE, sea BC en la RPV o desconexiones neurales del plexo-hiato-duodeno-pancreática (PHDP), de cambios, respecto de un grupo control “Sham” (Sh), en los valores de glucemia, insulinemia y en los del índice HOMA que explicita el grado de resistencia insulínica.
Las consideraciones precedentes nos fueron conduciendo, progresivamente, a considerar la posibilidad, al que “de initio” le otorgamos una alta probabilidad de certeza, que el implantar, en nuestra PPE, sobre todo a nivel i.V, una BC podría inducir un cambio trascendente en el tono autonómico de la glándula hepática. En esencia, en la sugestiva observación que el incremento del tono parasimpático del órgano favorece la secreción del “factor hepático”, la putativa hormona HISS y su interesante influencia en elevar la sensibilidad de respuesta a la insulina, ello con la asociada depresión consiguiente del índice de resistencia HOMA. En esta primera postura hipotética, la de la BC i.V, la secuencia giraría en la interferencia a la entrada en el árbol ductal hepático de nuestra sugerida “OIA”, fruto de una asociación simpático-colinérgico inhibitoria originada en la región íleo-cecal. La lógica caída del influjo inhibitorio sobre el “tono autonómico”, seguido de la consiguiente elevación del componente parasimpático, daría lugar a los ya comentados efectos que pivotean en torno al factor hipotético HISS.28-32
Figura 4. Barrera cicatrizal (BC) y sensibilidad insulínica.
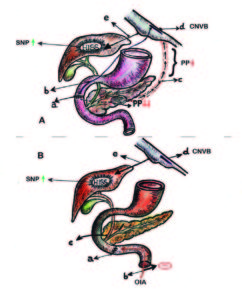
A-
a BC: barrera cicatrizal supra-vateriana (interrupción fibras finas de Pavlov).
b Interrupción de fibras vagales finas de Pavlov (frenadoras del tono colinérgico pancreático).
c Caída secretoria del PP.
d Reducción del freno en el complejo nuclear vagal bulbar (CNVB).
e Incremento de la descarga colinérgica desde el CNVB (hipertono parasimpático hepático).
B-
a BC: barrera cicatrizal infra-vateriana (inhibición OIA).
b OIA: onda inhibitoria ascendente .
c Interrupción de la OIA en el tracto biliar.
d Complejo nuclear vagal bulbar (CNVB)
e Disminución del freno simpático-colinérgico inhibitorio. Hipertono parasimpático hepático.
HISS: factor hepático sensibilizante insulínico.
SNP: sistema nervioso parasimpático.
Figura 5. Modelo quirúrgico experimental canino.
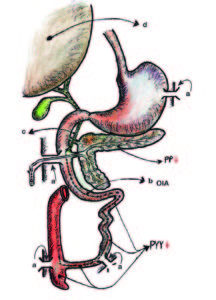
a Cánula de Thomas (esófago, duodeno, íleon y ciego) permitió demostrar la OIA.
b OIA (onda inhibitoria ascendente).
c Colédoco.
d Glándula hepática.
Freno simpático-colinérgico inhibitorio ligado al PYY en los sectores bajos y al PP en los sectores altos de la PPE.
Teniendo en cuenta lo comentado en los antecedentes, cabe considerar una segunda postura hipotética. Ésta surgiendo de una BC implantada en región supra-vateriana de la PPE. El razonamiento que sigue también sería válido para una tercera, la de aquellas experiencias efectuadas con la sección quirúrgica de las fibras nerviosas que “saltan” el hiato duodeno pancreático, sobre todo a la altura de la papila de Vater. En estas dos alternativas, nuestra larga serie de casos nos permite afirmar que la secuencia de hechos a esperar es, en primer lugar, la caída secretoria del PP; ello seguido como resultante de la pérdida del “freno” ejercido por éste sobre el CNVB, de una incrementada descarga parasimpática desde este complejo nuclear a la glándula hepática.
Los cambios subsecuentes, por supuesto, giran como ya consignamos en las influencias ejercidas por el HISS.
Todo lo mencionado y comentado nos ha imbuido de un razonamiento que, sorprendentemente, no ha sido motivo de ninguna consideración por parte de todos los investigadores que han abordado este tema,33-35 ello especialmente de experiencias que involucraron el tener que seccionar y reanastomosar el tubo digestivo a distintos niveles.
Nosotros desde el comienzo de nuestro emprendimiento hemos estado estimulados por la probabilidad que consideramos alta y justificada, que quizás la cirugía bariátrica actual podría ser exitosamente suplantada si todos los efectos positivos consignados con los protocolos actuales pudieran ser plasmados con una simple BC efectuada en sectores apropiados de nuestra PPE.
Material y métodos
Ratas machos, Wistar, de un peso inicial de 150 a 200 gr fueron distribuidas en un grupo «Sham» (Sh), n = 7 y otro experimental (E), n = 23; este último consistió de tres tipos: 1) sección y reanastomosis peri-vateriana (supra e infra) (SRA-PV) (n = 5); 2) desconexión neural duodeno- pancreática a nivel peri-vateriana (DDP-PV), n = 8; y 3) desconexión neural antro-duodeno-pancreática (DADP), n = 10 (Figura 1).
La interrupción neural a nivel del PHDP, se efectuó con la ayuda de un microscopio disector (Wild).
Al año de haberse completado estos modelos experimentales, se procedió al análisis de los cambios funcionales respectivos. En las tres series experimentales, en comparación con el grupo control Sh, los animales fueron anestesiados con tiopental y equipados con un catéter en la vena yugular. En todos se efectuó una prueba de tolerancia a la glucosa (PTG). En una muestra basal y, a los 30 y 60 minutos post-instilación intragástrica de glucosa, se determinaron los siguientes parámetros: glucemia (método enzimático para la determinación de la glucosa-oxidasa) (Wiener Lab); insulinemia (método ELISA Alpco, EE.UU.), valores acumulados de 60 minutos de ambos parámetros y el índice HOMA de resistencia a la insulina. El análisis estadístico de los resultados se efectuó mediante el test «t» de Student para muestras no apareadas. Un valor de p < 0,05 fue considerado como significativo.
Resultados
Luego del lapso de un año de completado la serie control Sh, y las tres variedades experimentales, se procedió a la exploración funcional PTG. Los parámetros justipreciados fueron: glucemia, insulinemia y el índice de resistencia HOMA. Los tipos quirúrgicos analizados fueron: el 1ro, limitado al segmento duodenal comprendido en extensión entre las dos BC, supra e infra-vateriana. El 2do y el 3ro, fueron el de la desconexión quirúrgica del PHDP, siempre efectuada con la ayuda del microscopio disector Wild. Concerniente a la amplitud del procedimiento de interrupción neural, ésta estuvo limitada a la RPV, es decir, la zona muy próxima a la desembocadura del conducto común bilio-pancreático, o bien, comprendiendo tanto ésta como la duodenal proximal y la antro-gástrica. En el examen funcional se puso especial énfasis en los valores acumulados (Vac).
Un resultado llamativo fue el del porcentaje de caída y grado de significación, respecto del grupo «Sh», de la insulinemia (-56%) y el del índice de resistencia HOMA (-60%) (Tabla 1). Indudablemente el resultado clave del presente enfoque experimental es el del incremento de la sensibilidad de respuesta insulínica.
Tablas 1, 2 y 3. Prueba de tolerancia a la glucosa (PTG), Valores Acumulados (VAc) de 60 min.
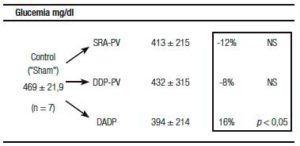
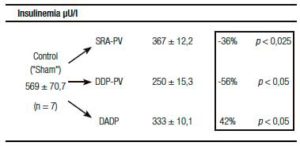
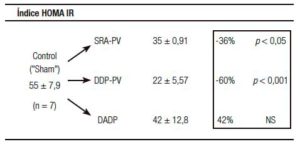
Cambios inducidos por dos variantes de desconexión duodeno-pancreática.
a En la pared entérica peri-Vateriana (PV), mediante sección y reanastomósis (SRA), contituyendo una barra cicatrizal (BC), grupo: SRA-PV.
b En el hiato duodeno-pancreático: 1) en la zona comprendida entre las BC supra e infra vateriana, grupo DDP-PV. 2) interrupción neural ampliada al duodeno proximal y antro-gástrico, grupo DADP.
Los resultados se expresan como media del valor acumulado (basal, 30 y 60) minutos ± el desvío estándar. Realizado sobre animales controles y experimentales. Se destaca la diferencia porcentual respecto del control correspondiente así como la probabilidad.
SRA-PV: sección y re anastomosis peri-Vateriana.
DDP-PV: desconexión duodeno pancreática peri-Vateriana.
DADP: desconexión antro-duodeno-pancreática.
Discusión
La depresión manifiesta de la resistencia insulínica, expresada por un valor de -60% del índice HOMA respecto del grupo control «Sh», es la consecuencia de haber efectuado, un año antes, dos enfoques técnicos. El 1ro de ellos, centrado en la creación de dos BC en la RPV de la PPE; éstas realizadas, respectivamente, a nivel supra e i V. El 2do, consistente en la sección de las fibras nerviosas del PHDP. Nuestra elaboración, en cuanto a la interpretación de los resultados obtenidos, nos condujo hacia dos postulaciones fisiopatogénicas. El detalle digno de destacar y remarcar es que ambas confluyen a un final común, el del incremento manifiesto del tono colinérgico hepático.
En cuanto al mecanismo íntimo de este cambio del control autonómico en la glándula hepática, nosotros estimamos, restringiéndonos al 1er enfoque técnico, el de las BC, que ello acontece por dos vías diferentes. El que pivotea en torno a la BC i V, obedece a la interferencia, por parte de éste, a la entrada, en el tracto biliar del hígado, de nuestra ya mencionada «onda inhibitoria ascendente» (OÍA). Ésta, resultante de una asociación simpático-peptidérgica-colinérgico inhibitoria (PYY) que, originándose en los segmentos inferiores de la PPE, la RIC, y completar su ascenso al duodeno distal, penetrando en el árbol biliar, ejerce un rol de “freno» modulador del “tono parasimpático hepático”.
Por contraste, siempre dentro del 1er enfoque técnico, pero en lo relativo a la BC s V, el mecanismo desencadenante del hipertono parasimpático hepático se desenvuelve a través de una vía indirecta. En efecto, es nuestra postulación que la BC supra-valeriana interrumpe la llegada al páncreas de fibras vagales, las descriptas por Pavlov como fibras vagales finas que tienen un destino muy particular, el ser un agente desencadenante muy específico, el del freno (“brake”) colinérgico de la glándula pancreática. Éste centrado, esencialmente en el polipéptido pancreático (PP), con una muy probable participación de la somatostatina.
La caída secretoria del PP, con la consecuente disminución de su normal “freno”, ejercida por la vía humoral, sobre el complejo nuclear vagal bulbar, da lugar al aumento de impulsos colinérgicos desde éste hacia el hígado, generándose así, por una vía indirecta, un “hipertono parasimpático hepático”.
En lo tocante al 2do enfoque técnico, el quirúrgico sobre el PHDP, su mecanismo de acción sería equivalente al de este último.
Llegado a este nivel, y al entrar en el tema de la sensibilización alimentaria de la respuesta insulínica (SARI), es decir, el ejercido sobre la capacidad de captación (“uptake”) de la glucosa (“disposal effect”) por parte de diferentes sistemas celulares, el hallazgo clave es el referido por la escuela canadiense de Lautt (Figura 4). Ello en cuanto a que el mecanismo del “SARI” es el resultado de la entrada en juego de señales de orden nervioso (autonómico parasimpático) y químico, que dan lugar a la liberación de un “factor hepático” u “hormona putativa”, “HISS” (“hepatic insulin sensitizing substance”), el que, se constata, activa la disponibilidad de la glucosa por el árbol vascular de los músculos esqueléticos, el miocardio y los riñones. Su acción se agota progresivamente, hasta su anulación completa con el ayuno.31 Vale enfatizar que el mecanismo fisiopatogénico descripto ha sido bien demostrado en la rata, hámster, gato, perro y humano.
En lo que atañe al síndrome de “respuesta de resistencia insulínica” (RRI), éste, en el estadío de ayuno, es fisiológico. En el período de ingesta alimentaria, la RRI puede ser inducida cuando el “factor hepático” es deprimido o anulado por mecanismos interferentes de alguno de los dos o de ambos agentes permisivos, el neural y el químico. El primero puede ser anulado mediante cirugía denervatoria parasimpática del hígado, o bien, por el bloqueo de los receptores colinérgicos muscarínicos del hígado. Es interesante que cuando el mecanismo sensibilizante insulínico es normal, el depósito de energía alimentaria se efectúa como glucógeno en el músculo. En caso de RRI, aparece hiperglucemia e hiperinsulinemia compensadora. Los niveles elevados de insulina dan lugar a hiperlipidemia y depósito energético como grasas. Es indudable que la RRI define al síndrome metabólico y que la obesidad es una manifestación temprana de la misma.36-38
Conclusión
En nuestra propuesta PPE, una simple interrupción cicatrizal (BC) de su flujo neural al nivel de la RPV induce, en un test PTG, una caída significativa del índice HOMA. Ello a través de un hipertono parasimpático hepático mediador del factor HISS, sensibilizante insulínico al ampliar la disponibilidad de acceso de la glucosa hacia sistemas vasculares claves como el del músculo esquelético, miocardio y riñones.
Todo lo referido, sugiere una alta probabilidad simplificadora de la metodología terapéutica bariátrica actual, en la que sugestivamente se efectúan interferencias de la PPE en diferentes niveles.33-35
Agradecimientos
A la enfermera Aideé Sueldo por su labor asistencial durante las cirugías.
Al técnico de Bioterio Luis A Lagos por su diligente labor en el cuidado de los animales.
Referencias
- Tiscornia OM, Martinez JL, Sarles H. Some aspects of human and canine pancreas innervation. Am J Gastroenterol 1976; 66: 353-361.
- Tiscornia OM. Contròle nerveux cholinergique du pancreas. Biol Gastroenterol 1976; 9: 255-275.
- Tiscornia OM. The neural control of exocrine and endocrine pancreatic secretion. Am J Gastroenterol 1977; 67: 541-560.
- Tiscornia OM, Sarles H, Voirol M, Levesque D, Dzieniszewski J, Palasciano G, Cavarzan A, Teixeira A, Bretholz A, Lauqier R, Singer M, Demol P. Evidence for duodeno-pancreatic reflexes and an anti-CCK factor with lidocaine infused intravenously and sprayed topically on pancreatic papilla in non-alcoholic and alcohol-fed dogs. Am J Gastroenterol 1976; 66: 221-240.
- Kirchgessner AL, Gershon MD. Innervation of the pancreas by neurons in the gut. J Neurosci 1990; 10: 1626-1642.
- Chariot De La Tour J, Anglade P, Rozé C. Cholinergic mechanisms in the pancreas after extrinsic denervation in the rat. Am J Physiol 1987, 15: G755-G760.
- Tiscornia OM. The Autonomic Nervous System in the Normal Control and Pathophysiology of the Exocrine Pancreas. Autonomic Nervous System in Health and Disease. Editado por: Liana Bolis and J. Licinio. Publicado por Marcel Dekker Inc. New York 2003. Chapter 16.
- Tiscornia OM, Dreiling D, Yacomotti J, Farache S. Neural control of the exocrine pancreas: An analysis of the cholinergic, adrenergic and peptidergic analysis and their positive and negative components. Part 1: Neural Mechanisms The Mt Sinai J of Med 1987; 54: 366-383.
- Tiscornia OM, Dreiling D, Yacomotti J, Kurtzbart R, De La Torre A, Farache S. Neural control of the exocrine pancreas, Part 2: Neuro-Endocrine Interaction. The Mt Sinai J of Med 1988; 55: 126-131.
- Tiscornia OM, Hamamura S, Lehmann ES, Gonzalez E, Vaccaro MI, Otero G, Cerini C, Waisman H. Una visión de la inervación gastro-entero-pancreática. El concepto de “Pista-Plexual-Entérica”. Pren Méd Argent 1998; 85: 443-503.
- Tiscornia OM, Farache S, Yacomotti J, Cresta MA, Vaccaro MI, Negri G, Celener D, Hamamura S, Bustos Fernández L. Inervación macroscópica duodeno-pancreática en la rata. Cambios secretorios del “pancreón” inducidos por la solarectomía, vaguectomía y doble duodenotomía peri-Vateriana. Acta Gastroenterol Latino Amer 1990; 20: 230-232.
- Nolte J. The ascending reticular activating system (ARAS). En: The Human Brain. Editorial: C.V. Mosby, St. Louis, Mossouri 1988; pág 164.
- Tiscornia OM, De Paula J, Celener D, Dreiling D. A laboratory preparation mimicking human peptic ulceration: A chronic antral peptic ulcer post section and reanastomosis at the antral-fundic junction in the rat. The Mt Sinai J of Medicine 1988; 55: 357-361.
- Tiscornia OM, Cresta MA, Vaccaro MI, Celener D, Negri G, Bustos Fernández L. Reflejos duodeno-pancreáticos: “Neuronas Comando” en el “Gatillo” (duodeno peri-Vateriano) del “Revolver Pancreático”. Acta Gastroenterológica Latinoam 1990; 20: 236.
- Tiscornia OM. Importancia de la región Vateriana en la patología bilio-pancreática. Puesta en evidencia de reflejos duodeno-pancreáticos. Rev Argent Cirug 1979; 36: 232-239.
- Tiscornia OM, Yacomotti J, Losardo RJ. Investigación y revisión conceptual de la inervación gastro-duodeno-pancreática en ratas. Rev Chil Anat 2002; 20: 37-48.
- Klein ES, Gateron H, Rudick J, Dreiling D. Pancreatic intraductal pressure. A consideration of regulatory factors. Amer J Gastroenterol 1987; 78: 507-509.
- Tiscornia OM, Dreiling D. Is basal bile-pancreatic secretion influenced by gastric juice diversion in the rat? Mt Sinai J of Med 1986; 53: 368-376.
- Tiscornia OM, Lehmann E, Otero G, Waisman H, Tiscornia- Wasserman P, Bank S. Biliary Acute Pancreatitis: A Review. World J Gastroenterol 2000; 6: 157-168.
- Tiscornia OM, Celener D, Cresta MA, Perec C, Tumilasei O, Dreiling D. Trophic and antitrophic circuits controlling pancreatic weight in the rat. Mt Sinai J of Med 1987; 54: 366-383.
- Tiscornia OM, García HA, Affani J, Tiscornia-Wasserman P. Acute pancreatitis in the opossum induced by balloon distention of the peri-Vaterian duodenum. Blood biochemical changes. Influences of previous truncal vagotomy and bilateral splachnicectomy. Am J Gastroenterol 1998; 93: 1661-1662.
- Hage G, Tiscornia OM, Palasciano G, Sarles H. Inhibition of pancreatic exocrine secretion by intra-colonic oleic acid infusion in the dog. Biomedicine 1974; 21: 263-267.
- Harper AA, Hood JC, Mushens J, Smy JR. Inhibition of external pancreatic secretion by intracolonic and intraileal infusions in the cat. J Physiol 1979; 292:445-454.
- Harper AA, Hood JC, Mushens J, Smy JR. Pancreotone, an inhibitor of pancreatic secretion in extracts of ileal and colonic mucosa. J Physiol 1979; 292: 455-467.
- Hally AD, Harper AA, Hood JC, Mushens J, Smy JR. Effect of pancreotone on pancreatic growth in rats. J Physiol 1978; 295: 34.
- Conter RL, Rualyn IJ, Taylor IL. Effects of peptide PYY on gallbladder motility. Am J Physiol 1987; 852: G736-G740.
- Dreiling DA. Enteropancreatic reflexes: The effect on pancreatic exocrine secretion of ileal, colonic, gallbladder and common bile duct, esophageal and duodenal. Mt Sinai J of Med 1986; 53: 315-336.
- Lautt WW. The HISS story overview. A novel hepatic neuro-humoral regulation of peripheral sensitivity in health and diabetes. Can J Physiol Pharmacol 1999; 77: 553-562.
- Xiett H, Lautt WW. Insulin resistance caused by hepatic cholinergic interruption and reversal by an acetylcholine administration. Am J Physiol 1996; 271: E587-E592.
- Lautt WW. Obesity as an early symptom of the AMIS syndrome. J Clin Med 2014; 3: 1178-1190.
- Hui HW, Kawshik, Chowdhury, Lautt WW. A synergistic balanced antioxidant cocktail protects aging rats from insulin resistance and absence of meal-induced insulin sensitization (AMIS) syndrome. Molecules 2015; 20: 669-682.
- Afonso RA, Gaspar JM, Lamarão I, Lautt WW, Macedo MP. Postprandial insulin action relies on meal composition and hepatic parasympathetics: dependency on glucose and amino acids: Meal, parasympathetics & insulin action. J Nutr Biochem 2016; 27: 70-78.
- Rubino F, Forgione A, Cummings DE, Vix M, Gnuli D, Mingrone G, Castagneto M, Marescaux J. The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes. Ann Surg 2006; 244: 741-749.
- Salinari S1, le Roux CW, Bertuzzi A, Rubino F, Mingrone G. Duodenal-jejunal bypass and jejunectomy improve insulin sensitivity in Goto-Kakizaki diabetic rats without changes in incretins or insulin secretion. Diabetes 2014; 63: 1069-1078.
- Patel RT, Shukla AP, Ahn SM, Moreira M, Rubino F. Surgical control of obesity and diabetes: The role of intestinal vs gastric mechanisms in the regulation of body weight and glucose homeostasis. Obesity 2014; 22: 159-169.
- Berthoud HR. The vagus nerve, food intake and obesity. Regulatory Peptides, 2008, 149: 15-25.
- Brooks VL, Shi Z, Holwerda SW, Fadel PJ. Obesity-induced increases in sympathetic nerve activity: sex matters. Autonomic Neuroscience: Basic and Clinical 2015; 187: 18-26.
- Tiscornia OM, Negri GA, Otero G, López Mingorance F, Waisman H, Tiscornia-Wasserman P. Pancreatic polypeptide: a review of its involvement in neuro-endocrine reflexes, islet acinar interactions and ethanol-evoked physiopathologic pancreatic gland changes. Acta Gastroenterol Latinoam 2015; 45: 155-164.
Correspondencia: Osvaldo Manuel Tiscornia
Dirección: J. E. Uriburu 1044 – 1º piso. Depto 15. CABA.
Teléfono: 4823-1843. Celular: 15 5404 9779
Correo electrónico: fabiannen@gmail.com
Acta Gastroenterol Latinoam 2017;47(1): 44-52
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE