Adriana Bosolino,1 Raquel Ratto2
1 Sanatorio Municipal Dr. Julio A. Méndez.
2 Universidad de Buenos Aires – Universidad Católica Argentina.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2017;47(3):230-236
Recibido: 07/09/2016 / Aprobado: 15/05/2017 / Publicado en www.actagastro.org el 02/10/2017
Resumen
Desde el punto de vista endoscópico, los adenomas colorrectales se dividen en dos grupos: a) tipo protruido y, b) planos o “chatos” (Laterally Spreading Tumors – LST). Pero las alteraciones genéticas y epigenéticas de los LST avanzados son aún poco conocidas. Se definen como lesiones > 10 mm de diámetro, de expansión lateral y con un patrón histológico de adenomas con cierto potencial de malignidad. La mutación K-ras es muy importante en relación con la ubicación de las lesiones en el colon, con transiciones G-A en codones 12 y 13, significativamente mayores, para algunos autores, en los LST que en los tipo protruidos. Se clasifican en granulares y no granulares, con diferencias histológicas en cada uno de ellos y también en cuanto a la posibilidad de resección endoscópica. El objetivo de esta revisión es incorporar los conocimientos de las alteraciones genéticas encontradas y analizarlas junto a los hallazgos histológicos de los LST, comparando las similitudes y diferencias entre los tipos granulares y no granulares. Se concluye que estas alteraciones juegan un papel muy importante en el desarrollo de los adenomas planos avanzados, lo que sugiere que las lesiones planas avanzadas y las protruidas tienen características genéticas y epigenéticas diferentes.
Palabras claves. Adenomas planos de colon, adenomas chatos, alteraciones genéticas en los adenomas planos de colon avanzados.
Colon planar adenomas. Predictors of colorectal carcinoma?
Summary
Endoscopically, colorectal adenomas can be divided in two groups, protruded-type and flat-type. However, the accurate frequencies of genetic and epigenetic alterations in flat-type colorectal advanced adenomas (laterally spreading tumors -LST) have remained unknown. They are generally defined as lesions >10 mm in diameter, characterized by lateral expansion along the luminal wall with a low vertical axis. In contrast to other forms of tumor, LSTs are generally considered to have a superficial growth pattern and the potential for malignancy. The K-ras mutation seems to be very important. K-ras mutation in G-to-A transitions at codons 12 and 13 was detected in a significantly higher percentage of flat-type adenomas than in protruded-type adenomas. They are also classified into granular (LST-G) and non-granular (LST-NG) types, being a good indication for endoscopic treatment. It might be assumed that some histological differences exist between these subtypes. The aim of this revision is to analyze the genetic alterations, the histological features of LST and compare the similarities and differences between the granular and the nongranular types. K-ras mutation was frequently detected in flat-type advanced adenomas while epigenetic alterations infrequently occurred in flat-type advanced adenomas, suggesting that they have different genetic and epigenetic alterations from those of protruded-type advanced adenomas.
Key words. Flat adenomas, laterally spreading tumors, genetic alterations in advanced flat colonic adenomas.
Abreviaturas
LST: laterally spreading tumors.
DAG: displasia de alto grado.
LST – G: laterally spreading tumors – granulares.
LST – NG: laterally spreading tumors – no granulares.
CCR: carcinoma colorrectal.
EMR: resección mucosa endoscópica.
ESD: disección mucosa endoscópica.
Los adenomas colorrectales pueden ser divididos, desde el punto de vista endoscópico y según su morfología, en dos grandes grupos:
a) lesiones elevadas y b) lesiones planas o “chatas”, estas últimas más difíciles de detectar, aun para el endoscopista entrenado.
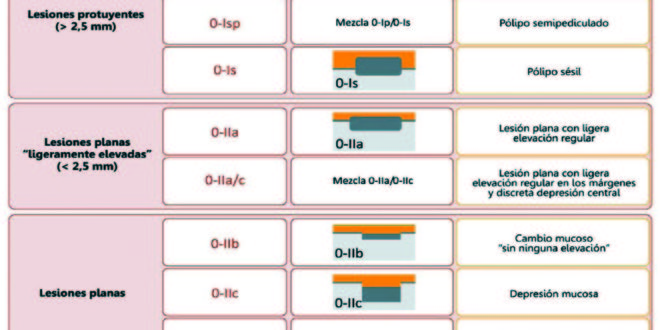
Las lesiones planas tienen generalmente una altura menor que la mitad de su diámetro, y la clasificación de París las compara por su altura, tomando como base las cucharas de una pinza de biopsia cerrada (2,5 mm): todas aquellas lesiones que no sobrepasan esa altura son consideradas lesiones planas.1
Denominadas también “carpet lesions” o “lesiones en carpeta” (Estados Unidos) y “laterally spreading tumors” (tumores de extensión lateral – LST) en Japón, fueron descriptas por Muto y Kamiya2 en 1985 como lesiones endoscópicas de colon caracterizadas por una superficie plana, que se extienden lateralmente sobre la mucosa, con ligera elevación y coloración rojiza.2
Estas lesiones, llamadas “lesiones planas” o adenomas planos, eran de pequeño tamaño, generalmente menores o iguales a 10 mm. y en su histología: adenomas verdaderos. El espesor de la lesión no superaba el doble de la mucosa circundante. Originalmente se pensó que los adenomas planos, aun los más pequeños, mostraban una mayor incidencia de displasia de alto grado (DAG) y aneuploidía (contenido de ADN anormal), comparados con los adenomas de tipo polipoide del mismo tamaño. Presentaban, además, un mayor índice de carcinoma submucoso y el grado de atipia celular parecía ser mayor al aumentar el tamaño de la lesión. De tal modo, los adenomas planos fueron considerados como posibles precursores del carcinoma colorrectal, hallazgo que, hasta el momento, no ha sido completamente confirmado.3
Sin embargo, estudios dirigidos hacia el perfil genómico pusieron de manifiesto un total de aproximadamente 180 genes que expresarían la diferencia entre los adenomas planos y la mucosa de colon normal, incluyendo metalloproteinasa 7 (MMP7), cadherin 3 (CDH3) y dual oxidasa 2 (DU OX2), análisis confirmados además en la inmunohistoquímica.
Definición
Como se dijo anteriormente, las LST son lesiones caracterizadas por un patrón de crecimiento que se extiende horizontalmente y con un eje vertical plano. Por definición son, en general, mayores o iguales a 10 mm y están subdivididas histológicamente en dos tipos:
- Las que presentan componente granular homogéneo total (tipo o variedad granular – LST-G),
- aquellas sin componente granular (variedad no granular – LST-NG).8, 9
A su vez las LST-G se subdividen en “tipo homogéneo” y “tipo nodular mixto” y las LST-NG en “plano-elevadas” y “pseudodeprimidas”. Se considera que las LST-NG tienen mayor potencial maligno que las granulares, debiendo realizarse, dentro de las posibilidades, la disección mucosa endoscópica (ESD), tratando de evitar así la resección en piecemeal,10 lo cual impide un estudio histológico adecuado y que podría arribar a diagnósticos erróneos.
Es importante también determinar dónde la mutación K-ras participa en mayor proporción en la formación tumoral de estos dos subtipos de LST. Se han realizado estudios anatomopatológicos de resecciones endoscópicas de estos tumores (LST) para determinar si existen características particulares, desde lo histológico, en los distintos subgrupos. Uno de ellos, publicado por Goto y Sakamoto se centró en 3 parámetros:
- la disposición de la muscular de la mucosa,
- la densidad de los vasos y
- la fibrosis de la submucosa.10, 11
Se utilizaron técnicas de histoquímica e inmunohistoquímica como herramientas complementarias de diagnóstico. Para medir el espesor de la muscular de la mucosa se utilizó el marcador alfa-actina músculo liso; para determinar la densidad de los vasos de la submucosa, los marcadores CD31, CD34, factor VIII, D2-40 y Elástica de Van Gieson, y para evidenciar mejor la fibrosis, técnica de tricrómico de Masson.
Analizados los resultados con método estadístico, se pudo demostrar que los LST no granulares tenían una muscular de la mucosa más delgada, sin protrusiones de la submucosa pero con una densidad vascular mayor que los LST granulares. No se observó diferencia significativa en el grado de fibrosis submucosa.7
El adenoma plano, según observaciones del National Polyp Study,12 se caracteriza por ser un adenoma no-polipoide de menor altura que el doble de la mucosa adyacente. Estos adenomas, de baja frecuencia en Occidente, existen también en poblaciones asintomáticas y se dificulta diferenciarlos de otras lesiones poco elevadas como suelen ser los pólipos hiperplásicos y los adenomas aserrados.14 Pueden abarcar entre el 6,8% y el 44,4% de todos los adenomas colorrectales.15
Se consideran adenomas chatos o planos avanzados a los que miden 10 mm o más de diámetro, con displasia de alto grado (incluyendo el carcinoma intramucoso). Wolber y Owen enfatizaron en que estas lesiones muestran extensión radial o lateral del epitelio displásico en la mucosa, sin extensión vertical a la base de las criptas.13
Las características clinicomorfológicas de los adenomas colorrectales planos avanzados, en una casuística de más de 100 pólipos, comparativamente con los adenomas protruídos dieron los siguientes resultados:
- La edad promedio de los pacientes con adenomas planos fue significativamente mayor que en los que presentaban adenomas protruidos,
- En cuanto al sexo, los primeros (adenomas planos) se observaron más frecuentemente en mujeres, y en relación a la localización predominaron en colon proximal, a diferencia de los protruidos que, como ya es conocido, se ubican preferentemente en el distal.16
Las particularidades endoscópicas de estos adenomas se visualizan mejor después de la insuflación, cromoendoscopía, y/o equipamientos de alta magnificación, y la denominación usada desde entonces es de “flat adenomas”.
Existen crecientes evidencias de que los adenomas planos contribuyen a una mayor incidencia de CCR. Estas lesiones fueron descriptas primeramente en Japón, siendo menos frecuentes en los países occidentales. En la actualidad, se considera que aproximadamente entre el 10 al 20% de los CCR pueden originarse en este tipo de lesiones.7
La discrepancia surge de las diferentes hipótesis en cuanto al origen y progresión de las lesiones planas: los autores que se inclinan por la secuencia adenoma-carcinoma sugieren que los carcinomas originados en estas lesiones lo harían a través de un “adenoma intermediario”, por la ulceración de un pólipo, o bien, a través de la formación directa de un adenoma plano. Otros afirman que la aparición de CCR sin un componente histológico de adenoma sugiere la aparición “de novo” de un carcinoma a partir de una lesión plana.16, 17
Mecanismos de carcinogénesis
Es aceptado que la principal vía de la carcinogénesis colorrectal es la secuencia adenoma-cáncer. La mutación K-ras, la cual se detecta en alrededor del 50% de los pólipos adenomatosos y en los CCR, se cree que está relacionada con la progresión adenoma-cáncer (más frecuente mutación K-ras: Codón 12 en ambos: CCR y adenomas), relación estudiada en adenomas morfológicamente de tipo protruidos. Se cree que las lesiones planas o plano-deprimidas, no polipoideas (laterally spreading tumors -LST) y carcinomas en estadios tempranos progresarían al cáncer avanzado más rápidamente que los pólipos adenomatosos protruidos.15, 16
De acuerdo con algunos autores18, 19 la incidencia de mutación K-ras en el CCR sería principalmente en recto, colon proximal y, en menor escala, en el colon distal. En la mayoría de los estudios, la mutación K-ras fue las lesiones adenomatosas planas que en las protruidas, con una transición G-A y además se detectó mutación BRAF y B-catenina, a diferencia de la metilación de los genes que fue mayor en las lesiones protruidas.7
Muchos años han pasado desde que Kudo (1993)20, 21 definió esta nueva categoría de lesiones colónicas con mutaciones K-ras, B-catenina y p 53, con una sobreexpresión COX2 y proteína-gastrina hasta la actualidad. Trabajos publicados, como el de Takahashi, Nosho y Yamamoto en el Modern Pathology,7 estudiaron en Japón las alteraciones genéticas y epigenéticas en 110 adenomas chatos colorrectales y 68 adenomas protruidos, usando la secuenciación directa del DNA y PCR. Los mismos concluyeron que la mutación K-ras fue detectada en el 35% de los adenomas planos en relación con los protruidos (13%), siendo la diferencia más significativa si se tenía en cuenta solo el colon distal con patrón mutacional del K-ras en la transición G-A en codones 12 y 13.
En muestras más pequeñas, Kusaka y col en el año 200120 mostró un 50% de mutación K-ras – Codón 12 en tejido de 18 adenomas chatos. Con una única excepción, todos tenían el mismo patrón mutacional. Mukawa y col (2005)4 reportó mutación K-ras en el 50% de lesiones planas y 50% de lesiones protruidas. Y Noro y col (2003),5 mutaciones K-ras en 21% y 26% en lesiones planas y elevadas respectivamente. La discrepancia de los patrones mutacionales puede deberse al número de muestras tomadas y/o diferencias en los métodos genéticos de estudios, pero no se puede ser concluyente al respecto. Algunos autores6 reportaron, además, que la mutación K-ras fue menos frecuente en las lesiones en carpeta con áreas de depresión, que en aquellas que no la poseían.
Figura 2. Disposición de la muscularis mucosae en los LST. La longitud de la lesión en línea recta (A: línea verde) y la longitud de la muscularis mucosae (MM) (B: línea roja) fueron medidas digitalmente. A: la disposición irregular de la MM en el tipo granular se refleja en mayor proporción entre ambas medidas (B/A). B: En contraste, la MM de los LST no granulares son planos y ambas longitudes son similares.
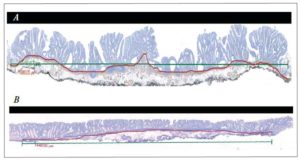
Figura 3. Diagrama que ilustra el paso genético de los LST avanzados y los “tipo protruidos” (también avanzados), con progresión a carcinoma colorrectal. Ambos tendrían alteraciones genéticas y epigenéticas diferentes. (Fuente: Takahashi T, Nosho K, Yamamoto H, Mikami, M, Taniguchi H, Miyamoto N, Adachi Y, Itoh F, Imai K, Shinomura Y. Flat-type colorectal advanced adenomas (laterally spreading tumors) have different genetic and epigenetic alterations from protruded-type advanced adenomas. Mod Pathol 2007; 20: 139-1477
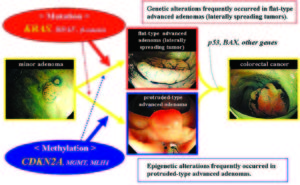
Figura 4. Densidad vascular submucosa de los LST: se contaron los vasos ≥ 5 μm de diámetro, así como arteriolas y vénulas. A: LST – no granular con alta densidad vascular (56,3 vasos/ mm2). B: LST c con un total de 31,7 vasos/mm2. C: doble fijación con Factor VIII + Elástica Van Gieson facilita la identificación de arteriolas y vénulas en un LST no granular. D: LST – Granular con magnificación 20X. Fuente: Goto S, Sakamoto N, Mitomi H, Murakami T, Ritsuno H, Ueyama H, Matsumoto K, Shibuya T, Osada T, Nagahara A, Ogihara T, Yao T, Watanabe S. Histological Distinction between the Granular and Non-granularTypes of Laterally Spreading Tumors of the Colorectum. Gastroenterology Research and Practice 2014; 2014: Article ID 153935, 8 pages.10
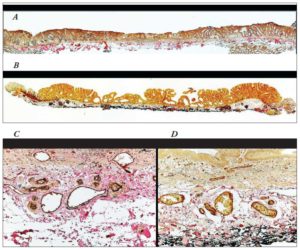
La hipermetilación provee un mecanismo epigenético para la transcripción de genes represores tales como MGMT, CDKN2A y MLH1. La metilación aberrante de esos genes, en asociación con otras alteraciones genéticas, demuestra ser un importante mecanismo de la carcinogénesis colorrectal.22
Mutaciones de BRAF y B-catenina fueron detectadas solo en algunos adenomas planos, y la metilación, al menos 1 gen se halló en un porcentaje significativamente bajo de los adenomas planos en relación con los protruidos. Con estos resultados los autores sugieren que los adenomas planos avanzados tienen distintas características genéticas y epigenéticas que los adenomas protruidos avanzados.
Con respecto a la mutación BRAF, fue más frecuentemente detectada en las lesiones planas de tipo “adenomas serrados”. Se sabe que la mutación BRAF se encuentra asociada con la secuencia pólipo hiperplásico – adenoma serrado – carcinoma, no solo en las lesiones planas, sino también en las protruidas. La mutación B-catenina fue detectada en alrededor del 8% en los adenomas planos. La B-catenina interviene en la adhesión celular, por lo que su anormalidad jugaría un rol muy importante, no solo en la génesis tumoral, sino también en la morfología de los LST.23, 24
En numerosos reportes de la literatura, estas lesiones han sido definidas en base a los hallazgos histológicos (por ejemplo, comparación del grosor de la mucosa neoplásica y la circundante), pero nunca por su aspecto endoscópico, a pesar de que con técnicas de cromoendoscopía y/o alta magnificación se mejora su diagnóstico.
Conclusiones
Esta revisión pretende demostrar que los adenomas planos colorrectales se encuentran con frecuencia variable en las poblaciónes examinadas, en los diferentes estudios multicéntricos. Numerosos factores pueden tener influencia sobre esto: la identificación de las lesiones y remoción de las mismas requiere experiencia por parte del operador, así como también en la utilización de cromoendoscopía, alta magnificación y técnicas de resecciones mucosas. Como ya se dijo anteriormente, la utilización de índigo carmín mejora la detección de las pequeñas LST deprimidas. La preparación colónica es esencial para la visualización correcta de la mucosa, especialmente en colon derecho y ángulo esplénico ya que es, como se sabe, la ubicación preferencial de estas lesiones. Esto podría tener implicancias importantes en el screening del carcinoma colorrectal, por la dificultad en la visión endoscópica.
La relevancia clínica más importante de estas lesiones es su alto riesgo de poseer displasia de alto grado (DAG) o bien, carcinoma in situ (CIS) con mayor frecuencia que las lesiones protruidas. En la diferenciación histológica, las lesiones no granulares, con una muscular de la mucosa más delgada y densa vascularización submucosa, son consideradas de mayor potencialidad maligna, lo cual sería muy importante en el momento de decidir la técnica de resección endoscópica (EMR vs. ESD). La gran expresión del nivel de apoptosis relacionada entre otros genes con el BCL2 podría actuar como un disparador que determine la morfogénesis tumoral y ser uno de los genes responsables del crecimiento horizontal de los LST.11
En resumen, la mutación K-ras fue frecuentemente detectada en el tejido de los adenomas planos avanzados y el patrón mutacional, en la mayoría de las mutaciones K-ras, con transición G-A.7 Estas alteraciones genéticas parecen jugar un importante rol en el desarrollo de los LST avanzados, especialmente en el colon distal. Las alteraciones epigenéticas son menos frecuentes en los LST avanzados que en los protruidos. Presentan similitudes y diferencias: entre las primeras, la mutación K-ras, y entre las diferencias, la baja frecuencia en la mutación del B-catenina e hipermetilación del CX2NA. Por lo antes expresado, se concluiría que: las lesiones planas avanzadas y las protruidas tienen características genéticas y epigenéticas diferentes.25–27
Los LST mayores de 20 mm estudiados presentan distinta localización y diferente histología. Como ya se ha mencionado, los LST de mayor tamaño se localizan preferentemente en el colon proximal28-31 y presentan adenocarcinoma invasivo y/o no invasivo con una frecuencia del 2,5 al 7%.32-34 A pesar de ser baja, las LST coexisten en poblaciones totalmente asintomáticas y en ocasiones se vuelve dificultoso diferenciarlas de otras lesiones poco elevadas, como suelen ser los pólipos hiperplásicos y los adenomas aserrados.14
Por otra parte, la prevalencia de adenomas sincrónicos con displasia de alto grado es significativamente mayor en pacientes con LST de gran tamaño (mayor a 20 mm), también con displasia de alto grado y/o carcinoma in situ. Basado en estos datos, se reconoció como causa de esta mayor prevalencia el incremento en el tamaño de los pólipos, la localización de los de mayor tamaño en el recto -sigma y la edad avanzada.
En contraste, el sexo, la ubicación y el número total de pólipos sincrónicos no tuvieron gran repercusión en la histología de los pólipos de mayor tamaño. Las biopsias de las lesiones previas a la EMR en los LST asociados a adenomas sincrónicos no detectaron la presencia de adenocarcinoma en la mayoría de los casos.35, 36
En el futuro se podrán determinar los aspectos epidemiológicos de estas lesiones, así como las técnicas endoscópicas que las identifiquen. No se descartan otros estudios por imágenes que puedan detectarlas (tomografía computada o resonancia magnética), pero siempre se deberá recurrir a un procedimiento que permita su resección y posterior examen histológico, inmunohistoquímico y, eventualmente, genético.
Consideraciones a tener en cuenta
- Los adenomas chatos son lesiones plano-deprimidas. Sin embargo, no todas las lesiones planas son adenomas.
- Su frecuencia es variable, menor en Occidente, y también observada en poblaciones asintomáticas.
- Su riesgo se ve incrementado si son de mayor tamaño y tienen depresión central.
- La localización izquierda se asocia más frecuentemente con displasia de alto grado y carcinoma.
- El exacto potencial de malignidad de estas lesiones es todavía incierto.
Referencias
- The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach and colon. Gastrointest Endosc 2003; 58: S3- S43.
- Muto T, Kamiya J, Atkin S. Small ”flat adenomas” of the large bowel with special references to its clinic-pathologic features. Dis Colon Rectum 1985; 28: 847-851.
- Diebold MD, Samalin E, Merle C, Winaber S, Hart AR. Colonic flat neoplasia: frequency and concordance between endoscopic appearance and histologic diagnosis in a French prospective series. Am J Gastroenterology 2004; 99: 1795-1800.
- Mukawa K, Fujii S, Takeda J, Murakami T, Hayashi S. Analysis of K-ras mutations and expression of cyclooxygenase-2 and gastrin-protein in laterally spreading tumors. J Gastroentrol Hepatol 2005; 20: 1584-1590.
- Noro A, Sugai T, Habano W. Analysis of K-ras and p53 gene mutations in laterall y spreading tumors of the colorectum. PatholInt 2003; 53: 828-836.
- Umetani N, Sasaki S, Masaki T, Kudo S. Involvement of APC and K-ras mutation in non-polypoid colorectal tumorigenesis. Br J Cancer 2000; 82: 9-15.
- Takahashi T, Nosho K, Yamamoto H, Mikami M, Taniguchi H, Miyamoto N, Adachi Y, Itoh F, Imai K, Shinomura Y. Flat –type colorectal advanced adenomas (laterally spreading tumors) have different genetic and epigenetic alterations from protruded-type advanced adenomas. Mod Pathol 2007; 20: 139-147.
- Kudo S, Kashida H, Tamura T, Tsuda S. Colonoscopic diagnosisandmanagement of non polypoidearly colorectal cancer. World Journal of Surgery 2000; 24: 1081-1090.
- Lambert R, Kudo S, Vieth M, Sanders DS, Matsumoto A. Pragmatic classification of superficial neoplastic colorectal lesions, Gastrointestinal Endoscopy 2000; 70: 1182-1199.
- Goto S, Sakamoto N, Mitomi H, Murakami T, Ritsuno H, Ueyama H, Matsumoto K, Shibuya T, Osada T, Nagahara A, Ogihara T, Yao T, Watanabe S. Histological Distinction between the Granular and Non-granular Types of Laterally Spreading Tumors of the Colorectum. Gastroenterology Research and Practice 2014; 2014: Article ID 153935, 8 pages.
- Minemura S, Tanaka T, Arai M, Okimoto K, Oyamada A, Keiko S, Maruoka D, Matsumura T, Nakagawa T, Katsuno T, Kishimoto T and Yokosuka O. BMC Gastroenterology 2015; 15: 64.
- O’Brien M, Winawer S, Zauber A, Bushey MJ, Sternberg S, Gottlieb L, Bond J, Waye J, Schapiro M. for the National Polyp Study Work Group. Flat Adenomas in the National Polyp Study: Is There Increased Risk for High-Grade Dysplasia Initially or During Surveillance? Clinical Gastroenterology and Hepatology 2004; 2: 905-911.
- Wolber RA, Owen DA. Flat adenomas of the colon. Hum Pathol 1991; 22:17-24.
- Hart AR, Kudo S, Mackay EH, Mayberry W, Atkin S. Flat adenomas exist in asymptomatic people: important implications for colorectal cancer screening programmes. Gut 1998; 43: 229-231.
- Geboes K, De Hertogh G, Bisschops R, Geboes, KP. Flat adenomas, significance, detection, treatment. Current View. Annals of Gastroenterology 2010, 23: 266-269.
- Soetikno R, Friedland S, Kaltenbach T, Chayama K, Tanaka S. Non-polypoid (flat and depressed) colorectal neoplasms. Gastroenterology 2006; 130: 566-576.
- Ross A, Waxman I. Flat and depressed neoplasms of the colon in Western population. The American Journal of Gastroenterology 2006; 101: 172-180.
- Church JM, Muto T, Appau K. Flat lesions of the colorectal mucosa: differences in recognition between Japanese and American endoscopists. Dis Colon Rectum 2004; 47: 1462-1466.
- Kudo S. Endoscopic mucosal resection of flat and depressed types of early colorectal cancer. Endoscopy1993; 25: 455-461.
- Kusaka T, Fukui H, Sano Y, Takeda J, Mikami M. Analysis of K-ras codon 12 mutations and p53 over expression in colorectal nodule-aggregating tumors. J Gastroenterol Hepatol 2001; 15: 1151-1157.
- Uraoka T, Saito Y, Matsuda T, Ikehara H, Gotoda T, Saito D. Endoscopic indication for endoscopic mucosal resection of laterally spreading tumor in the colorectum. Gut 2006; 55: 1592-1597.
- Tanaka S, Tamegai Y, Tsuda S, Saito Y, Yahagi N, Yamano H. Multicenter questionnaire survey on the current situation of colorectal endoscopic submucosal dissection in Japan. Digestive Endoscopy 2010; 22: S2-S8.
- Ogino S, Brahmandam M, Kawasaki T, Yoshida M, Yamamoto H. Epigenetic profiling of synchronous colorectal neoplasias by quantitative DNA methylation analysis. Mod Pathol 2006; 19: 1083-1090.
- Kita H, Hikichi Y, Hikami K, Mitomi H, Taniguchi H. Differential gene expression between flat adenoma and normal mucosa in the colonin a micro-array analysis. J Gastroenterol 2006; 41:1053-1063.
- Kurahashi T, Kazuhiro K, Shinomura Y, Saito D. Colorectal carcinoma with special reference to growth-pattern classifications: clinic-pathologic characteristics and genetic changes. Journal of Gastroenterology 2002; 37: 354-362.
- Swan MP, Bourke MJ, Alexander S, Moss A, Williams SJ. Large refractory colonic polyps: is it time to change our practice? A prospective study of the clinical and economic impact of a tertiary referral colonic mucosal resection and polypectomy service (with videos). Gastrointest Endosc 2009; 70: 1128-1136.
- Buchner AM, Guarner-Argente C, Ginsberg GG. Outcomes of EMR of defiant colorectal lesions directed to an endoscopy referral center. Gastrointest Endosc 2012; 76: 255-263.
- Conio M, Repici A, Demarquay J-F, Blanchi S, Dumas R, Filiberti R. EMR of large sessile colorectal polyps. Gastrointest Endosc 2004; 60: 234-241.
- Knabe M, Pohl J, Gerges C, Ell C, Neuhaus H, Schumacher B. Standardized Long-term follow-up after endoscopic resection of large, non-pedunculated colorectal lesions: a prospective two-center study. Am J Gastroenterol 2014; 109: 183-189.
- Moon CM, Cheon JH, Choi EH, Kim ES, Park JJ, Han SY. Advanced synchronous adenoma but not simple adenoma predicts the future development of metachronous neoplasia in patients with resected colorectal cancer. J Clin Gastroenterol 2010; 44: 495-501.
- Zhan T, Hahn F, Hielscher T, Betge J, Kâler G, Ebert M, Belle S. Frequent co-occurrence of high-grade dysplasia in large flat colonic polyps (>20 mm) and synchronous polyps. BMC Gastroenterology 2015; 15: 82.
- Cunliffe WJ, Hasleton PS, Tweedle DEF, Schofield PF. Incidence of synchronous and metachronous colorectal carcinoma. Br J Surg1984; 71: 941-943.
- Brigic A, Cahill RA, Bassett P, Clark SK, Kennedy RH. A prospective case controlled study of the short term outcome following hemicolectomy for benign compared with malignant colonic polyps. Colorectal Dis 2014; 16: 179-185.
- Rickert A, Aliyev R, Belle S, Post S, Kienle P, Kähler G. Oncologic colorectal resectionafter endoscopic treatment of malignant polyps: does endoscopy havean adverse effect ononcologic and surgical outcomes? Gastrointest Endosc 2014; 79: 951-960.
- Hurlstone DP, Sanders DS, Cross, SS, Appau K. Colonoscopic resection of lateral spreading tumors: a prospective analysis of endoscopic mucosal resection. Gut 2004; 53: 1334-1339.
- Zauber A, Winawer S, O’Brien M, Bond J, Schapiro M, Waye J. Colonoscopic – Polypectomy and Long-Term Prevention of Colorectal-Cancer Deaths. N Engl J Med 2012; 366: 687-696.
Correspondencia: Adriana Bosolino
Amenábar 2308 3º “A”. Ciudad Autónoma de Buenos Aires, Argentina
Correo electrónico: abosolino@intramed.net
Acta Gastroenterol Latinoam 2017;47(3): 230-236
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE