Martín Oricchio, Yéssica Pontet, Andrés Taullard, Carolina Olano
Clínica de Gastroenterología, Hospital de Clínicas “Dr. Manuel Quintela”. Montevideo, Uruguay.
Acta Gastroenterol Latinoam 2021;51(2):207-212
Recibido: 05/02/2020 / Aceptado: 17/05/2021 / Publicado en www.actagastro.org el 21/06/2021 / https://doi.org/10.52787/nyjh2553
Resumen
La dermatitis herpetiforme forma parte de un espectro de trastornos desencadenados por la ingesta de gluten. Para su correcto diagnóstico, es fundamental tener en consideración la presentación clínica y serológica, así como los hallazgos de la biopsia de piel perilesional con inmunofluorescencia directa. La mayoría de los pacientes no presentan síntomas gastrointestinales, y la enteropatía sería más leve que en los casos de enfermedad celíaca. Se ha reportado que estos pacientes no tendrían un riesgo incrementado de mortalidad, linfoma no Hodgkin o neoplasias gastrointestinales, en comparación con la población general. Se presenta y discute el caso de un paciente asintomático desde el punto de vista digestivo, al que, luego del debut de una dermatitis herpetiforme, se le solicita una videogastroscopía para búsqueda de atrofia vellositaria, en la que se detecta un adenocarcinoma en duodeno con células en anillo de sello.
Palabras claves. Dermatitis herpetiforme, enfermedad celíaca, adenocarcinoma duodenal.
Duodenal Adenocarcinoma in a Patient with Dermatitis Herpetiformis. A Case Report
Summary
Dermatitis herpetiformis is part of a spectrum of disorders triggered by gluten intake. For its correct diagnosis, it is essential to take into account the clinical and serological presentation, as well as the findings of perilesional skin biopsy with direct immunofluorescence. Most patients have no gastrointestinal symptoms, and enteropathy would be milder than in celiac disease cases. It has been reported that these patients would not have an increased risk of mortality, non-Hodgkin’s lymphoma or gastrointestinal malignancies compared to the general population. We present the case of an asymptomatic patient who, after the debut of a dermatitis herpetiformis, was requested a gastroscopy to search for villous atrophy, in which is detected an adenocarcinoma in the duodenum with signet ring cells.
Keywords. Dermatitis herpetiformis, celiac disease, duodenal adenocarcinoma.
Abreviaturas
DH: Dermatitis herpetiforme.
EC: Enfermedad celíaca.
Introducción
La dermatitis herpetiforme (DH) tiene un curso crónico con recaídas y su diagnóstico es clínico, serológico, histológico e inmunopatológico.1, 2 Forma parte de un grupo de patologías desencadenadas por la ingesta de gluten, entre las que se encuentran la enfermedad celíaca (EC) y la ataxia por gluten.3
La dermatitis herpetiforme es considerada la manifestación cutánea específica de la enfermedad celíaca. Ambas enfermedades comparten los mismos haplotipos HLA y mejoran con dieta libre de gluten.
Sin embargo, no todos los pacientes a los que se les diagnostica DH tienen atrofia vellositaria al momento del diagnóstico. Se detecta atrofia vellositaria, en dos tercios de los pacientes, el resto presenta cambios mínimos (linfocitosis intraepitelial).
La asociación con HLA es la misma que la de la EC: la mayoría de los pacientes son positivos para HLA DQ2, y casi todos los restantes para DQ8.4, 5
A diferencia de la EC, no se ha encontrado un incremento de mortalidad ni de riesgo de neoplasia en los pacientes con DH. No está claro si las diferencias en el grado de inflamación intestinal podrían explicar estos hallazgos.6
Se presenta el caso de un paciente que debuta con DH, asintomático desde el punto de vista digestivo, y que, en la endoscopía diagnóstica, se evidencia como hallazgo una lesión compatible con un carcinoma indiferenciado de duodeno con células en anillo de sello.
Caso clínico
Hombre de 49 años, tabaquista de larga data, hermano con diagnóstico de EC, sin otros antecedentes médicos a destacar. Se realizó el diagnóstico de DH cuatro meses antes de la consulta gastroenterológica, por la presencia de máculas hiperpigmentadas, erosiones con costra hemática, microvesículas y pápulas eritematosas, pruriginosas, a nivel de codos, región sacra y pliegues interglúteos (Figura 1). El diagnóstico fue confirmado por biopsia lesional y perilesional con inmunofluorescencia directa (Figura 2) y se inició DLG desde esa fecha. Se encontraba asintomático en lo digestivo, sin repercusión general ni otras manifestaciones extraintestinales evidentes. El examen físico fue normal. No presentaba lesiones en la piel, al momento de la evaluación.
Figura 1. Máculas hiperpigmentadas, erosiones con costra hemática y microvesículas en codo, sacro y pliegues interglúteos. Imágenes cedidas por la Cátedra de Dermatología del Hospital de Clínicas.
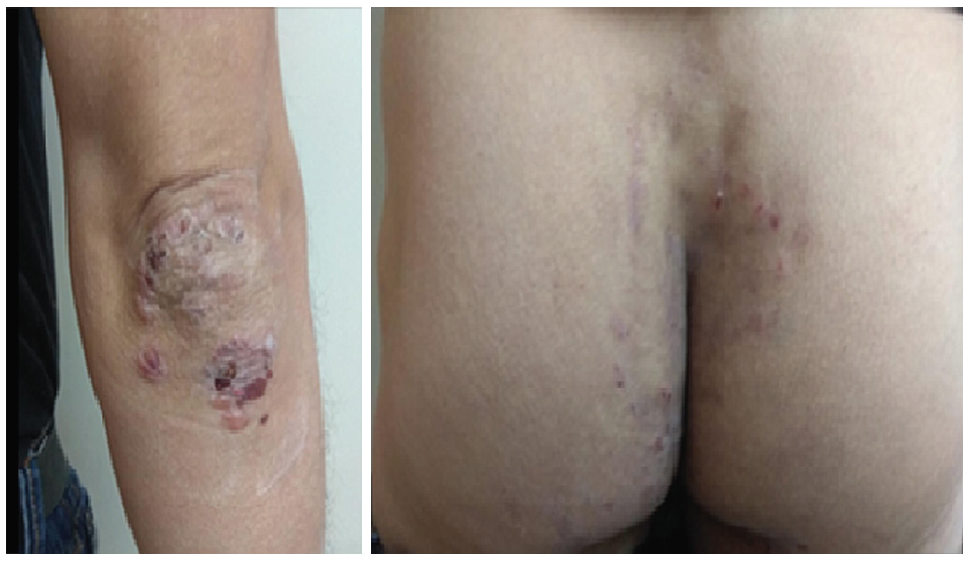
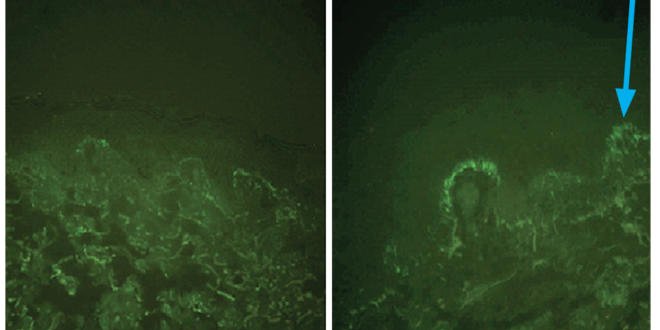
Figura 2. Depósito de IgA granular en la unión dermoepidérmica detectada por IFD. Imagen cedida por Cátedra de Dermatología del Hospital de Clínicas.

Presentaba anticuerpos anti transglutaminasa (Anti-Ttg IgA) de 116 UI (VN hasta 20 UI/ml), anticuerpos anti péptidos deaminados de gliadina de 50 UI (VN hasta 20 UI/ml) y anticuerpos anti endomisio (Anti-EMA IgA) positivos. De los exámenes complementarios se destacaba: Hb: 14,8 g/dl; VCM: 91,2 fL; leucocitos: 8470 y plaquetas: 338.000. La función renal, ionograma con calcemia, hepatograma, glicemia, TSH, dosificación de ácido fólico, vitamina B12 y metabolismo del hierro se encontraban dentro de la normalidad.
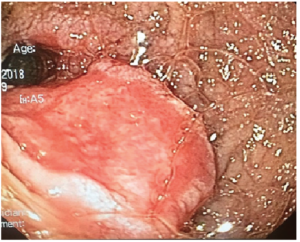
Se realizó videogastroscopía con el objetivo de tomar biopsias duodenales para el análisis histopatológico, pero evidenció a nivel de la segunda porción duodenal una lesión ulcerada de 40 mm que ocupaba media circunferencia, permitiendo el paso del endoscopio. Dicha lesión asentaba sobre mucosa de aspecto atrófico (Figura 3). Se tomaron múltiples biopsias de la lesión y de segunda porción duodenal. La histología reveló mucosa duodenal ulcerada, en la que se destacó infiltración difusa de la lámina propia por proliferación celular atípica, que se dispone en napa de células poco cohesivas, con núcleos hipercromáticos irregulares, vesiculosos y moderada cantidad de citoplasma anfófilo. Algunas células presentaron vacuolización citoplasmática (anillo de sello). No se detectó atrofia vellositaria ni aumento de LIEs en DII.
Figura 3. Lesión ulcerada de 40 mm a nivel de la segunda porción duodenal.
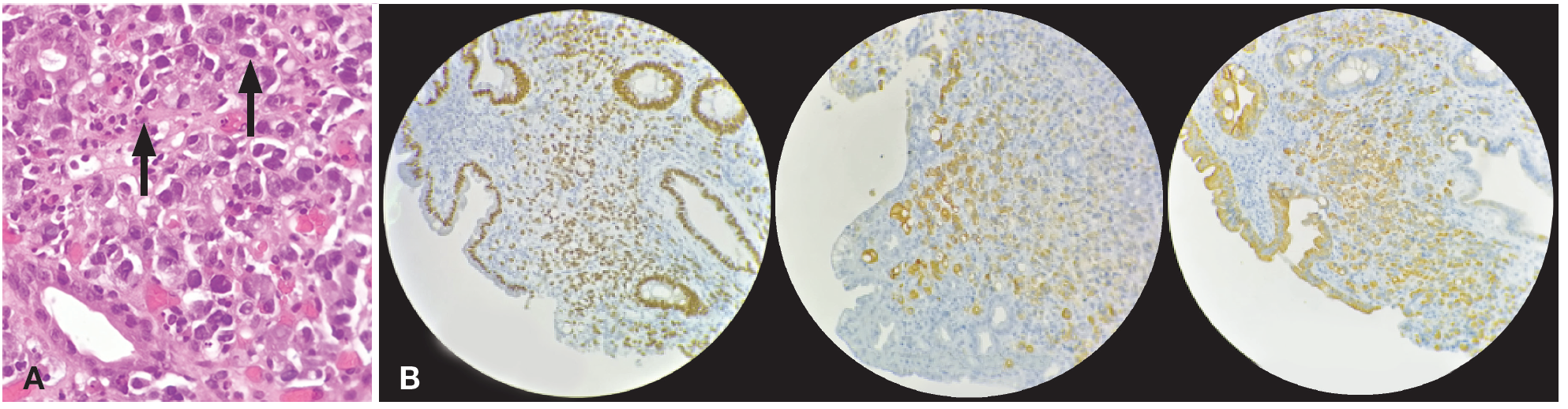
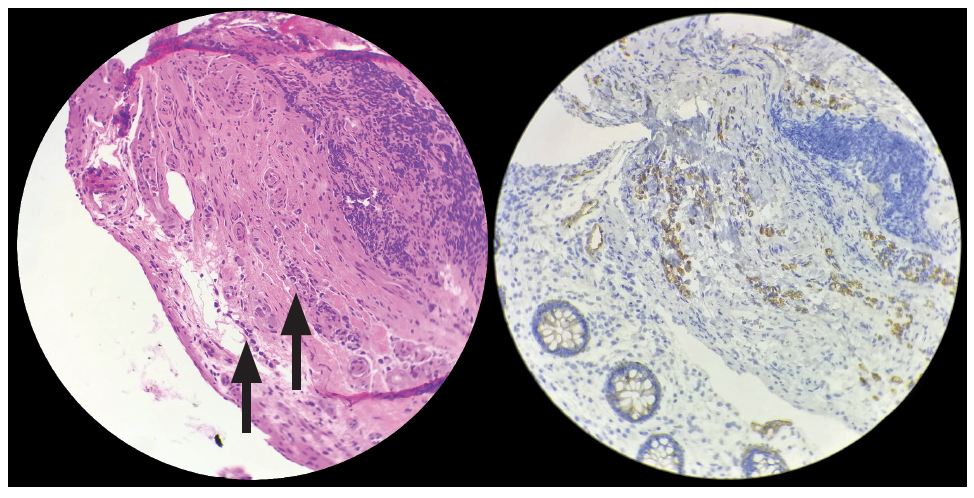
Se realizó estudio inmunohistoquímico que evidenció el siguiente perfil: CK 7 positiva heterogénea, CK 20 positiva heterogénea, CDX2 positiva intensa difusa, CEA positiva intensa difusa, CA 19-9 positiva heterogénea, cromogranina A y sinaptofisina negativas. Con este resultado, se concluyó que la mucosa duodenal se encontraba infiltrada por un carcinoma pobremente diferenciado, con células en anillo de sello con perfil inmunohistoquímico sugestivo de origen gastrointestinal alto gástrico, duodenal, ampular y más alejado biliopancreático (Figuras 4 A y B).
Figura 4. A) Biopsia de lesión en DII. HE. Células en anillo de sello. B) Inmunohistoquímica de biopsia de DII. Neoplasia + CK7, CK20 y CDX2.
La TC de tórax, abdomen y pelvis evidenció un engrosamiento parietal circunferencial a nivel de duodeno II-III, sin otras lesiones. Se realizó duodenopancreatectomía cefálica. La anatomía patológica de la pieza informó un adenocarcinoma pobremente diferenciado de 50 mm de eje mayor. Predominantemente sólido, poco cohesivo, con presencia de células en anillo de sello y escasa formación de túbulos. Infiltraba todo el espesor parietal, sin infiltración de la serosa en las secciones examinadas. Los márgenes de resección duodenal proximal, distal y margen pancreático se encontraban libres de lesión. Se estudiaron diez ganglios linfáticos peripancreáticos, cuatro de ellos metastásicos. Por tanto, se completó la estadificación con el análisis anatomopatológico de la pieza de resección quirúrgica: T3N2MO.
Recibió tratamiento adyuvante con capecitabina y oxaliplatino, con un total de nueve ciclos, y fue necesario suspender el oxaliplatino por neuropatía.
Un año después de la cirugía, presentó ascenso gradual de marcadores tumorales CEA y CA 19-9. En este contexto, se le solicitó videocolonoscopía, la que evidenció, en colon ascendente, un sector de mucosa inflamada que se extendía por 10 cm, comprometiendo toda la hemicircunferencia colónica, con edema, eritema y friabilidad. Se tomaron múltiples biopsias y la anatomia patológica informó muestras de mucosa colónica con mucosa conservada y en un fragmento focalmente a nivel de la muscular de la mucosa y submucosa reguero de células en anillo de sello. Se realizó inmunohistoquímica a dichas células, con positividad para CKAEI/AE3 y CK20, CK7 no concluyente. La morfología es compatible con su antecedente, evidenciando compromiso colónico secundario por la neoplasia de células en anillo de sello, previamente diagnosticada en duodeno (Figura 5).
Figura 5. Biopsias de colon. HE: reguero de células neoplásicas infiltrando la submucosa. Inmunohistoquímica: células atípicas + con Pan citoqueratina AE1/AE3.
Discusión
La DH es considerada la manifestación cutánea de una enteropatía sensible al gluten, precipitada por la exposición a este.7 Para su diagnóstico, es importante tener en cuenta la presentación clínica, así como los hallazgos serológicos e histológicos de la biopsia de piel perilesional. Se caracteriza clínicamente por la presencia de pápulas y vesículas pruriginosas, como las que exhibió el caso presentado, que se distribuyen principalmente en las superficies extensoras y en glúteos. A diferencia de la EC, es ligeramente más común en hombres, como en este caso.8 Además, el paciente tenía al momento 49 años, lo que concuerda con series clínicas en adultos con DH en Europa y América del Norte, que han demostrado una edad promedio al diagnóstico de entre 40 y 50 años.9, 10 En contraste a lo que sucede con la EC, esta afección es rara en la infancia.8 Estudios en Finlandia y el Reino Unido han evidenciado que, si bien en los últimos treinta años la incidencia de EC se ha incrementado, la de DH ha disminuido.11
Si bien todos los pacientes con DH son sensibles al gluten, la gran mayoría no desarrolla síntomas digestivos, como en este caso. Sin embargo, en un 65-75% de los casos se evidencia atrofia vellositaria. Incluso en casos con biopsias aparentemente normales, podrían encontrarse cambios sutiles en la mucosa, tales como el aumento de los LIES.3
Se ha estimado que aproximadamente el 5% de los pacientes con EC desarrollarán DH a lo largo de su vida. En un estudio de Finlandia, se concluyó que, si bien la mayoría de los casos de DH se detectan sin un diagnóstico previo de EC, en algunos casos podría evidenciarse un cambio de fenotipo hacia la manifestación cutánea de DH. Este cambio se detectó varios años luego del diagnóstico de EC, y particularmente en pacientes que continuaron consumiendo gluten.12
En lo que respecta a los tests serológicos en la DH, algunos autores han demostrado una especificidad mayor a 90% y una sensibilidad del 47-95% de los anticuerpos Anti-Ttg IgA. Por su parte, los anticuerpos Anti-EMA IgA han mostrado una especificidad cercana al 100% y una sensibilidad de entre 52-100% para su diagnóstico.2
En el caso expuesto, las biopsias cutáneas perilesionales fueron fundamentales para confirmar el diagnóstico. En general, evidencian microabscesos neutrofílicos en las papilas dérmicas y grados variables de infiltrado inflamatorio en la dermis superficial. Esto no es específico y puede encontrarse en otras enfermedades cutáneas autoinmunes. El método ideal para el diagnóstico de esta entidad es el hallazgo de depósitos de IgA granular en la unión dermoepidérmica, en biopsias de la piel perilesional, el cual es considerado un hallazgo patognomónico.8
El tratamiento consiste en el cumplimiento de una dieta libre de gluten a largo plazo, incluso luego de la desaparición de las lesiones cutáneas. Dado que el control de la DH puede tardar varios meses, podría emplearse como terapia adyuvante agentes farmacológicos como Dapsona, aunque su uso se analiza para cada caso en particular.13
En los pacientes con EC, se ha demostrado un incremento en el riesgo de neoplasias, como linfoma no Hodgkin, adenocarcinoma de intestino delgado, carcinoma escamoso de esófago y de la mortalidad global, pero es controversial el riesgo incrementado de desarrollar linfomas en pacientes con DH.8 Si bien ha sido observado un incremento en el riesgo de mortalidad y de neoplasias en algunos estudios pequeños,14, 15 en un estudio epidemiológico de 846 pacientes con DH no se reveló una mayor mortalidad o riesgo incrementado de linfomas o neoplasias gastrointestinales en estos pacientes, en comparación con la población general.6 Por su parte, en un estudio poblacional sueco, se identificaron 135 neoplasias en 1354 pacientes con DH. En este estudio, tampoco se encontró un incremento estadísticamente significativo del riesgo de malignidad.16 Una de las hipótesis para rechazar la relación, aunque aún no se ha confirmado, consiste en que la enteropatía de la DH sería más leve en comparación con la de la EC.6, 8 Estas diferencias en el riesgo de neoplasias y mortalidad entre pacientes con DH y EC podría deberse, en parte, a las diferencias en la expresión y la actividad del fenotipo transglutaminasa tisular involucrado.6
En este caso, el diagnóstico de carcinoma fue un hallazgo en la endoscopía digestiva. El diagnóstico anatomopatológico fue de un carcinoma duodenal pobremente diferenciado. Dado el perfil inmunohistoquímico de expresión de citoqueratina 7, 20, CDX2, y CEA, orienta, en primer lugar, a un carcinoma de origen en el tubo digestivo alto (estómago, duodenal o biliopancreático). El origen gástrico quedó descartado, a pesar de la presencia de células en anillo de sello, por la ausencia de lesión gástrica en la videogastroscopía. El origen biliopancreático también se descartó por la ausencia de compromiso de páncreas y de la vía biliar en la pieza de duodenopancreatectomía. Por lo tanto, se trata de un carcinoma extraampular, ya que la papila de Vater se encontraba libre de lesión. La expresión de citoqueratina 20 y CDX2 marca diferenciación intestinal, y la expresión de citoqueratina 7 se observa más a nivel de intestino delgado.
Al año del diagnóstico, se detectó, en la videocolonoscopía, un sector en colon derecho de mucosa de aspecto inflamatorio con edema, eritema y friabilidad, que no presentaba el aspecto de lesión vegetante y voluminosa, como en los casos de un neoplasma primario de colon derecho. En la histología, se evidenció, en un fragmento focalmente a nivel muscular de la mucosa y submucosa, regueros de células en anillo de sello, con un perfil de inmunohistoquímica positivo para CKAE1/AE3 y CK20, con CK7 no concluyente.
Por tanto, dado las características de la presentación de la lesión duodenal, junto con la ausencia de adenomegalias pélvicas en la TC abdominal, así como la no detección de lesión colónica en el intraoperatorio, nos orientamos a un tumor primario duodenal con secundarismo colónico.
La literatura indica que entre el 3-6% de los tumores gastrointestinales provienen del intestino delgado, de los cuales un 30-45% corresponden a adenocarcinomas.17
Se observa una supervivencia a los treinta meses del 58% para el adenocarcinoma de intestino delgado. Esta es inversamente proporcional a la estadificación en el momento del diagnóstico, pero presenta mejor pronóstico que los casos de linfoma.18 Según varias series retrospectivas, la mayoría de los adenocarcinomas se encuentran en un estadio avanzado, al momento del diagnóstico, en relación con la clasificación TNM (6,9% en estadio I; 26,2% en estadio II, 31,8% en estadio III; 35,1% en estadio IV).19
El tratamiento del adenocarcinoma de intestino delgado es difícil y se basa en la resección quirúrgica, con una supervivencia a los cinco años, en caso de resección del 32,5%.19 Los factores de riesgo que se identificaron con un peor pronóstico son: sexo masculino, edad superior a 55 años, raza negra, localización (duodenal o ileal), tumores difusos, estadio (T4, afectación linfática), grado de diferenciación, afectación de los bordes y número de ganglios afectados.19 Este paciente presentaba las siguientes características asociadas a un peor pronóstico: sexo masculino, tumor localizado en duodeno, pobremente diferenciado con células en anillo de sello y compromiso linfático en 4/10 ganglios resecados.
Si bien algunos estudios retrospectivos sugieren un beneficio en la supervivencia luego de quimioterapia en pacientes con adenocarcinoma avanzado, el beneficio del tratamiento adyuvante, tras una resección completa, no está definido, debido a la falta de ensayos clínicos randomizados.20 En este caso, el equipo de oncología decidió realizar tratamiento adyuvante con capecitabina y oxaliplatino.
Conclusión
La dermatitis herpetiforme es la manifestación cutánea de una enteropatía mediada por el sistema inmunitario y desencadenada por la ingesta de gluten. Su diagnóstico se basa en las lesiones de piel características, anticuerpos específicos y el estudio con IFD de la biopsia de piel perilesional.
No se ha reportado riesgo incrementado de neoplasias en estos pacientes, por lo que resulta interesante el caso clínico que se discute, en el cual, luego del debut de una dermatitis herpetiforme, se detectó como hallazgo un adenocarcinoma de duodeno con células en anillo de sello.
Aviso de derechos de autor
 © 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
© 2021 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Oricchio M, Pontet Y, Taullard A y col. Adenocarcinoma duodenal en un paciente con dermatitis herpetiforme. Reporte de un caso. Acta Gastroenterol Latinoam. 2021;51(2):207-212. https://doi.org/10.52787/nyjh2553
Referencias
- Ludvigsson JF, Leffler DA, Bai JC, Biagi F, Fasano A, Green PH, Hadjivassiliou M, Kaukinen K, Kelly CP, Leonard NJ, Lundin KE, Murray JA, Sanders DS, Walker MM, Zingone F, Ciacci C. The Oslo definitions for coeliac disease and related terms. Gut. 2013;62:43-5.
- Caproni M, Antiga E, Fabbri P. Italian Group for Cutaneous Immunopathology. Guidelines for the diagnosis and treatment of dermatitis herpetiformis. J Eur Acad Dermatol Venereol. 2009;23:633-8.
- Sapone A, Bai JC, Ciacci C, Dolinsek J, Green PH, Hadjivassiliou M, Kaukinen K, Rostrami K, Sanders DS, Schumann M, Ullrich R, Villalta D, Volta U, Catassi C, Fasano A. Spectrum of gluten-related disorders: consensus on new nomenclature and classification. BMC Med. 2012;10:13.
- Zone JJ. Skin Manifestations of celiac disease. Gastroenterology. 2005;128:S87-91.
- Collin P, Reunala T. Recognition and management of the cutaneous manifestations of celiac disease: a guide for dermatologists. Am J Clin Dermatol. 2003;4:13-20.
- Lewis NR, Logan RFA, Hubbard RB, West J. No increase in risk of fracture, malignancy or mortalitiy in dermatitis herpetiformis: a cohort study. Aliment Pharmacol Ther. 2008;27:1140-7.
- Ludvigsson JF, Bai JC, Biagi F, Card TR, Ciacci C, Ciclitira PJ, Green PH, Hadjivassiliou M, Holdoway A, Van Heel DA, Kaukinen K, Leffler DA, Leonard JN, Lundin KE, McGough N, Davidson M, Murray JA, Swift GL, Walker MM, Zingone F, Sanders DS; BSG Coeliac Disease Guidelines Group; British Society of Gastroenterology. Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology. Gut. 2014;63:1210-28.
- Herrero-González JE. Clinical guidelines for the diagnosis and treatment of dermatitis herpetiformis. Actas Dermosifiliogr. 2010;101:820-6.
- Mansikka E, Salmi T, Kaukinen K, Collin P, Huhtala H, Reunala T, Hervonen K. Diagnostic delay in dermatitis herpetiformis in a high-prevalence area. Acta Derm Venereol. 2018;98:195-9.
- Alonso-Llamazares J, Gibson LE, Rogers RS 3rd. Clinical, pathologic, and immunopathologic features of dermatitis herpetiformis: review of the Mayo Clinic experience. Int J Dermatol. 2007;46:910-9.
- Reunala T, Salmi TT, Hervonen K, Kaukinen K, Collin P. Dermatitis Herpetiformis: A Common Extraintestinal Manifestation of Coeliac Disease. Nutrients. 2018;10.
- Salmi TT, Hervonen K, Kurppa K, Kaukinen K, Reunala T. Celiac disease evolving into dermatitis herpetiformis in patients adhering to normal or gluten-free diet. Scand J Gastroenterol. 2015;50:387-92.
- Pinto-Sánchez MI, Bercik P, Verdu EF, Bai JC. Extraintestinal manifestations of celiac disease. Dig Dis. 2015;33:147-54.
- Viljamaa M, Kaukinen K, Pukkala E, Hervonen K, Reunala T, Collin P. Malignancies and mortality in patients with coeliac disease and dermatitis herpetiformis: 30-year population-based study. Dig Liver Dis. 2006;38:374-80.
- Hervonen K, Vornanen M, Kautiainen H, Collin P, Reunala T. Lymphoma in patients with dermatitis herpetiformis and their first-degree relatives. Br J Dermatol. 2005;152:82-6.
- Askling J, Linet M, Gridley G, Halstensen TS, Ekström K, Ekbom A. Cancer incidence in a population-based cohort of individuals hospitalized with celiac disease or dermatitis herpetiformis. Gastroenterology. 2002;123:1428-35.
- Rondonotti E, Koulaouzidis A, Yung DE, Reddy SN, Georgiou J, Pennazio M. Neoplastic Diseases of the Small Bowel. Gastrointest Endosc Clin N Am. 2017;27:93-112.
- Howdle PD, Jalal PK, Holmes GK, Houlston RS. Primary small-bowel malignancy in the UK and its assocciation with coeliac disease. QJM. 2003;96:345-53.
- Halfdanarson TR, McWilliams RR, Donohue JH, Quevedo JF. A single-institution experience with 491 cases of small bowel adenocarcinoma. Am J Surg. 2010;199:797-803.
- Derikx MH, Bisseling TM. Untreated celiac disease in a patient with dermatitis herpetiformis leading to a small bowel carcinoma. Case Rep Gastroenterol. 2012;6:20-5.
Correspondencia: Martín Oricchio
Avenida Italia S/N, Hospital de Clínicas (piso 4). Montevideo, Uruguay
Correo electrónico: martinoricchio@hotmail.com
Acta Gastroenterol Latinoam 2021;51(2):207-212
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE