Claudia Fuxman, Franco Ciotola, Juan Martín Riganti, Alejandro Nieponice, Adolfo Badaloni, Fabio Nachman
Instituto para el Tratamiento de las Enfermedades del Esófago, Servicio de Gastroenterología y Cirugía Esofagogástrica, Hospital Universitario Fundación Favaloro, Ciudad Autónoma de Buenos Aires, Argentina.
Resumen
La radiofrecuencia endoscópica utiliza energía térmica para ablacionar la capa superficial del esófago donde se localiza el tejido característico del Esófago de Barrett (EB). Pacientes y métodos. Se incluyeron 50 pacientes adultos con diagnóstico de EB de acuerdo a la clasificación de Viena. Objetivos. Se evaluó la seguridad y la eficacia de la ablación por radiofrecuencia (ARF) en pacientes con EB. Resultados. Fueron tratados 50 pacientes con una mediana de seguimiento de 18 meses. La mediana de edad fue de 58 años. Hasta lograr la erradicación del EB se realizaron 1,4 sesiones de ARF por paciente. La morbilidad del procedimiento fue del 6% y la complicación más frecuente fue la estenosis esofágica (dos casos). No se observó recurrencia de la metaplasia intestinal durante el seguimiento. Conclusiones. En nuestra experiencia la ARF es un procedimiento seguro con baja morbilidad. Los resultados a mediano y largo plazo publicados son estimulantes y permiten comenzar a reevaluar los protocolos de seguimiento vigentes.
Palabras claves. Esófago de Barrett, ablación por radiofrecuencia, adenocarcinoma de esófago.
Radiofrequency ablation for Barrett’s esophagus. Preliminary experience
Summary
Endoscopic radiofrequency ablation makes use of warm energy to ablate the esophagus’s surface where the epithelial anomaly is located. Patients and Methods. 50 adults patients with the diagnosis of EB according to Vienna Classification were included. Objectives. To evaluate the security and efficacy of ARF in patients with EB. Results. 50 ARF treated patients were included with a medium follow up of 18 months. The median age was 58 years. 1.4 sessions of ARF per patient were made to obtain EB erradication. The procedure morbidity was 6%, the more frequent complication was the esophageal stenosis (two cases). During the follow up, intestinal metaplasia recurrence was not observed. Conclusions. In the experience of our team, ARF is a secure procedure with low morbidity. These observations added to the published results help to evaluate the current follow up protocols.
Key words. Barrett’s esophagus, radiofrequency ablation, esophagus adenocarcinoma.
El esófago de Barrett (EB), definido como el reemplazo del epitelio escamoso estratificado del esófago por un epitelio columnar de tipo intestinal, se desarrolla en parte como consecuencia de la injuria crónica del contenido gastroduodenal sobre la mucosa esofágica. Esta condición representa un factor de riesgo de adenocarcinoma (ADC) esofágico. Las estadísticas mundiales sobre la prevalencia del EB en la población general son divergentes y varían entre 0,9% al 6%.1 La tasa de incidencia anual de ADC en pacientes con EB está estimada en 0,5% por paciente por año.2 Esto implica un aumento en el riesgo de sufrir ADC de 30-60 veces mayor en pacientes con EB. Asimismo, la incidencia de EB parece estar aumentando paralelamente a la prevalencia de ADC.3
El manejo del EB tiene dos objetivos: 1) tratar la enfermedad por reflujo, y 2) evitar el aumento de la incidencia de ADC. Las estrategias dirigidas a este último objetivo incluyen: a) la erradicación del epitelio metaplásico o displásico, y b) la vigilancia endoscópica a los efectos de detectar lesiones en estadios tempranos.4
En los últimos años, se han desarrollado nuevos métodos para la erradicación del EB. Los más aplicados son la terapia con argón, la resección endoscópica de la mucosa, la resección submucosa, la crioterapia, la terapia fotodinámica y más recientemente, la ablación por radiofrecuencia (ARF).5-8 Este último método utiliza energía térmica para ablacionar la capa superficial del esófago donde se localiza el tejido característico del EB y estimula el proceso de reepitelización:9 el epitelio columnar patológico y con anormalidades moleculares es reemplazado por un epitelio neoescamoso genéticamente normal.10 La ARF se realiza de manera controlada en profundidad, lo que le confiere mayor seguridad. Estudios recientes han demostrado que se trata de un método confiable y efectivo con una tasa baja de complicaciones y alta tasa de erradicación de la metaplasia intestinal y de la displasia como asimismo de una disminución de la progresión al cáncer.11
El objetivo del presente trabajo fue evaluar la seguridad y la eficacia de la ARF en un grupo de pacientes con EB tratados en nuestra institución.
Material y métodos
Pacientes
Se incluyeron 50 pacientes adultos, con diagnóstico de EB confirmado por dos anatomopatólogos, tratados con ARF. Los criterios de inclusión fueron: edad de 18 a 75 años, diagnóstico histológico de metaplasia intestinal del epitelio esofágico con o sin displasia o neoplasia intraepitelial con ecoendoscopía sin invasión profunda (T1a). Criterios de exclusión: carcinoma no resecable por endoscopía, estenosis esofágica o faríngea, neoplasia indiferenciada en la biopsia.
Los pacientes se clasificaron en cuatro grupos de acuerdo a la clasificación de Viena:12 EB no displásico (EBND), displasia de bajo grado (DBG), displasia de alto grado (DAG) y ADC temprano. Los pacientes con EBND incluidos en este trabajo presentaban factores de riesgo para ADC como obesidad, reflujo severo, hombres caucásicos, fumadores, antecedentes familiares de cáncer de esófago y/o EB largo.
Diseño del estudio
Estudio prospectivo, no controlado, de registro de datos.
Endoscopía
Todos los procedimientos fueron realizados por los médicos integrantes del grupo, con endoscopía de alta resolución y cromoendoscopía (VEDA/FICE), de forma ambulatoria y bajo sedación profunda con control anestésico. En los pacientes con irregularidades de la mucosa o enfermedad nodular se les realizó ecoendoscopía. Si la lesión nodular no infiltraba más allá de la submucosa, se realizó mucosectomía. Una vez confirmada por patología la estadificación de la lesión, se realizó la ARF del EB remanente.
Ablación por radiofrecuencia (ARF)
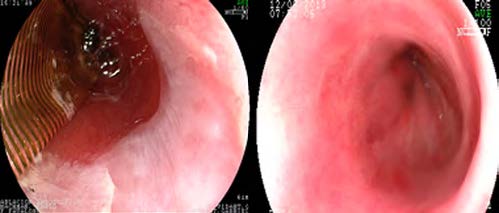
Las ablaciones se realizaron con sistema HALO (Covidien Inc, Mansfield, MA). Este sistema incluye un catéter balón (HALO360) y dispositivos montados endoscópicos (HALO90,60). En los casos de EB circunferencial se utilizó el HALO360 con doble disparo de triple secuencia sin limpieza entre los disparos (Figura 1). En los casos de lengüetas únicas o islotes remanentes, se utilizó el HALO90 con triple disparo sin limpieza entre los mismos. Este sistema entrega una ráfaga corta de energía ablativa de alto poder al epitelio esofágico anormal. Esta energía provee tratamiento uniforme hasta una profundidad de 500 μm. Esta profundidad involucra únicamente a la capa mucosa, por lo tanto, el riesgo de estenosis es significativamente menor comparado con otras técnicas ablativas.13-15
Figura 1. Ablación por radiofrecuencia. A: Ablación con HALO360. B: Seguimiento a los 12 meses.
Resección endoscópica de mucosa (REM)
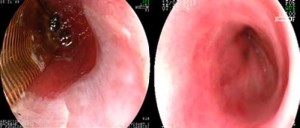
En los pacientes con lesiones nodulares limitadas, que por ecoendoscopía no invadían más allá de la submucosa, se realizó REM mediante el método de ligadura multibanda Duette (Cook, Purdue, EE.UU.). Se delimitó el área a resecar mediante puntos de electrocauterio que quedan incluidos en la resección para asegurar un margen de seguridad y orientación de la pieza. Una vez delimitada, se succionó el área a resecar dentro del capuchón del kit y se aplicó una ligadura por banda como tratamiento hemostático. El corte se realizó con un ansa endoscópica por debajo de la ligadura (Figura 2).
Figura 2. Resección endoscópica de mucosa. A: Ligadura con banda. B: Lecho de la resección.
Resección endoscópica de submucosa (RES)
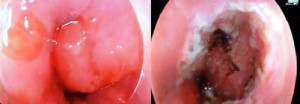
En los casos donde los tumores eran más extensos, con alta sospecha de invasión submucosa o en zonas como la unión esófago-gástrica donde es más complicado obtener una buena resección y orientación con una REM, se realizó una RES que permite obtener una pieza en bloque y mayor área submucosa, lo que permite al patólogo un análisis más preciso de la histopatología, los márgenes y la profundidad de invasión. Se delimitó el área tumoral a ser resecada mediante puntos de electrocauterio. Luego se infiltró el espacio submucoso con solución salina y mediante el uso de cuchillos de disección endoscópica FlushKnife (Fujinon) o TTknife (Olympus) se abordó ese espacio uniendo los puntos de electrocauterio hasta obtener la resección total en una sola pieza (Figura 3).
Figura 3. Resección endoscópica de mucosa. A: Ligadura con banda. B: Lecho de la resección.
Cronograma de seguimiento post-ablación
Se realizó con VEDA/FICE con toma de biopsia según el protocolo de Seattle.16 Luego de dos meses de realizada la primera sesión de ARF se realizó VEDA/FICE a todos los pacientes. En función del grado de displasia al momento del diagnóstico del EB, se estableció el cronograma de seguimiento posterior:
- EBND: control luego de un año de realizado el procedimiento.
- DBG: control a los seis meses del procedimiento. Si es normal, al año del procedimiento, luego una vez por año.
- DAG: cada tres meses el 1er año, cada seis meses el segundo año y luego anualmente.
- ADC: una vez por mes durante tres meses, luego cada tres meses hasta completar el año. Cada seis meses durante el segundo año, luego control anual.
En los casos de VEDA/FICE patológica, se tomó biopsia y al confirmar la persistencia de la metaplasia, se realizó una nueva ablación.
Análisis estadístico
Las variables continuas se expresan como mediana y percentilos 25-75 y las categóricas en porcentajes. El análisis estadístico se realizó con SPSS 17,0 paquete (SPSS, Chicago, IL).
Resultados
Se incluyeron un total de 50 pacientes (82% hombres) tratados con ARF desde agosto de 2011 hasta noviembre de 2014 con una mediana de seguimiento de 18 meses. La mediana de edad fue de 58 años (percentilos:25-75 42- 67). La longitud media del EB fue de 4,8 cm (percentilos:25-75 3-7 cm).
Del total de los pacientes incluidos, 35 (70%) correspondieron a EBND, 7 (14%) a DBG y 1 (2%) a DAG. Además, 7 pacientes (14%) tenían diagnóstico de ADC sobre EB: cinco de ellos recibieron un tratamiento con REM y ARF; uno con RES y ARF, y otro con RES, REM y ARF.
En el 64% de los pacientes se utilizó HALO360 en la primera sesión de ARF y HALO90 en todos los casos que requirieron nueva ablación sobre lesiones remanentes luego de una primera sesión. El 60% de los pacientes lograron la erradicación del EB en una sola sesión de ARF. En el 40% restante se erradicó con una segunda sesión, excepto dos pacientes que requirieron una tercera. Todos los casos que no lograron la erradicación con una sesión presentaban un EB largo con una mediana de 7 cm.
No se desarrollaron complicaciones en el 94% de los casos, excepto en tres casos: un paciente evolucionó con estenosis esofágica asintomática que no requirió terapéutica, el segundo con dolor post-procedimiento que resolvió con AINES y el tercero con una estenosis esofágica que se trató con dilataciones con balón. Se registró la pérdida de un paciente durante el seguimiento. Hasta la fecha no se observó progresión histológica en ningún paciente.
Discusión
En este trabajo presentamos la experiencia inicial de un centro universitario con alto volumen de pacientes con patología esofágica. Los resultados obtenidos en el manejo del EB con ARF han mostrado una alta tasa de efectividad y seguridad. La mayoría de los casos que hemos incluido corresponden a pacientes con EBND, en menor medida a DBG, y por último, casos de DAG con ADC. Esto es un reflejo de la práctica diaria.
La última guía publicada de la American Colleges of Gastroenterology recomienda terapia endoscópica o esofagectomía en pacientes con DAG y, únicamente vigilancia endoscópica en casos de EBND o con DBG.4 En caso de pacientes disciplinados, la vigilancia resulta una buena estrategia. Esta situación no es la más habitual: la compliance de los pacientes, y en muchos casos también la de los médicos, es pobre. Sumado a esto, la vigilancia no ha demostrado ser costo-efectiva y no se han realizado hasta el momento estudios randomizados comparando esta estrategia con la historia natural del EB.10 En cambio, se han llevado a cabo estudios comparando la vigilancia con tratamientos endoscópicos (terapia fotodinámica; ARF) y los resultados muestran una menor tasa de progresión neoplásica.17-18
Los datos publicados hasta la fecha muestran resultados alentadores. Fleischer publicó un estudio multicéntrico que incluyó a 70 pacientes con diagnóstico de EBND, a quienes se les realizó ARF. Luego de un seguimiento de 2,5 años observaron una respuesta completa de la metaplasia intestinal sin presentar complicaciones como estenosis, persistencia de glándulas profundas ni progresión hacia neoplasia.19 Luego de cinco años de seguimiento, esta misma cohorte continuó con respuesta completa en el 92% de los casos.20 En otro estudio multicéntrico que incluyó a 429 pacientes, de los cuales 326 correspondían a EBND con una media de seguimiento de 20 meses, se observó la respuesta completa de la metaplasia intestinal en el 76%, sin que se presentaran eventos adversos serios. Se reportaron en distintos centros similares resultados en seguridad y eficacia utilizando ARF en pacientes con EBND.21-22
Con respecto a la DBG, también han sido descriptos trabajos que avalan su seguridad y eficacia. Shaheen ha publicado un estudio multicéntrico donde 64 pacientes con diagnóstico de EB con DBG fueron randomizados para recibir ARF o placebo.18 La erradicación completa de la displasia fue observada en el 91% de los casos en el grupo que recibió ARF comparado con el 23% del grupo control. Sharma trató con ARF circunferencial o focal a diez pacientes con DBG y fueron seguidos por endoscopía con biopsia luego de 1, 3, 6, 12 y 24 meses de realizada la ablación.23 Un seguimiento de dos años observó una respuesta completa de la displasia en el 100% de los pacientes respectivamente. No se observaron eventos adversos. En un tercer estudio, este mismo investigador describe la aplicación de ARF en 39 pacientes con DBG.24 Con una media de seguimiento de 24 meses, la respuesta completa de la displasia se observó en el 95% de los casos y no presentaron eventos adversos. Recientemente, Bergman randomizó 136 pacientes con EB con DBG: la mitad de ellos realizó controles y la otra mitad a ARF. Luego de un seguimiento de 3 años la ARF demostró reducir el riesgo de progresión neoplásica. Debido a estos resultados se recomendó la finalización precoz del protocolo.25
Existen razones para modificar el paradigma actual de la vigilancia y considerar la intervención endoscópica: 1. No es posible predecir qué paciente progresará hacia la DAG o al ADC. 2. Tampoco es posible predecir en qué tiempo esta progresión va a ocurrir si es que ocurre. 3. Existe el riesgo de falta de diagnóstico por una inadecuada toma de las muestras o simplemente porque la toma de las muestras se realizó en un sitio donde la lesión era de menor grado: la displasia no está asociada con anormalidades identificables en la endoscopía.26-28 La falta de diagnóstico también puede deberse a la no compliance de los pacientes o al desacuerdo en la interpretación histológica por parte de los patólogos.
Sumado a lo recientemente expuesto, se asume que la progresión del EB es de una forma ordenada: EBND hacia la DBG, luego la DAG hasta el ADC, pero esto en la práctica no es lo usual. Sharma publicó que la incidencia de ADC en pacientes con EB fue del 0,5% por paciente por año de seguimiento, pero también demostró que es posible desarrollar cáncer a pesar de tener EBND como peor grado histológico inmediatamente antes del diagnóstico de ADC.29
Además de todas estas razones, para tomar una conducta activa frente al EBND o con DBG existe una que no debe ser ignorada: la ansiedad de los pacientes. Saberse portadores de una patología preneoplásica, a pesar de la relativa baja tasa de progresión hacia la malignidad, afecta negativamente su calidad de vida.30 Por lo tanto, como no es posible identificar qué paciente va a desarrollar cáncer, ni en cuánto tiempo y la vigilancia endoscópica como única estrategia es imperfecta, la ablación en los casos de EBND y con DBG es una opción que debe ser tenida en cuenta.
Como conclusión, si bien la seguridad de la ARF es alta y la morbilidad baja, su alto costo, las posibles recurrencias y la necesidad de mantener la vigilancia, hacen que su indicación en pacientes con EB con o sin displasia aparezca como una de las principales controversias. Esta disyuntiva y las realidades de la mayoría de los sistemas de salud a nivel mundial han hecho que la disponibilidad de datos y casuísticas sobre EB sin displasia sea limitada. En América Latina no existen reportes sistematizados sobre el uso de ARF en EB. El objetivo de este trabajo fue evaluar el registro de datos de nuestra experiencia en un centro de alto volumen de patología esofágica para entender la efectividad de la ARF en la erradicación de la metaplasia intestinal con o sin displasia y su duración en el seguimiento a mediano plazo.
Hasta el presente no existe una forma práctica de distinguir qué pacientes con diagnóstico de EB desarrollaran cáncer. La estrategia de la vigilancia endoscópica puede detectar la neoplasia pero no prevenirla. Existen modalidades terapéuticas como la ARF que permiten la remoción del tejido metaplásico o displásico en forma completa, segura y efectiva. Los resultados a mediano y largo plazo publicados son estimulantes y permiten comenzar a reevaluar los protocolos de seguimiento vigentes.
Referencias
- Ronkainen J, Aro P, Storksrubb T, et al. Prevalence of Barrett’s esophagus in the general population: an endoscopic study. Gastroenterology 2005; 129: 1825-1831.
- Cameron AJ. Epidemiology of columnar lined esophagus and adenocarcinoma. Gastroenterol Clin North Am 1997; 26: 487-494.
- Coleman HG, Bhat S, Murray LJ, et al. Increasing incidence of Barrett’s oesophegus: a population-based study. Eur J Epidemiol 2011; 26: 739-745.
- Wang KK, Sampliner RE. Updated guidelines 2008 for the diagnosis, surveillance and therapy of Barrett´s esophagus. Am J Gastroenterol 2008; 103: 788-797.
- Dabrowski WP, Szczepanik AB, Misiak A. Radiofrequency ablation in the management of Barrett’s esophagus preliminary own experience. Pol Przegl Chir 2011; 3: S44.
- Konda VJ, Dalal K. Optimal management of Barrett’s oesophagus: pharmacologic, endoscopic, and surgical interventions. The Clin Risk Manag 2011; 7: 447-458.
- Sharma P, McQuaid K, Dent J, et al. A critical review of the diagnosis and management of Barrett’s esophagus. Gastroenterology 2004; 127: 310-330.
- Van Vilsteren FG, Pauw RE, Seewald S, et al. Stepwise radical endoscopic resection versus radiofrequency ablation for Barrett’s oesophagus with high-grade dysplasia or early cancer: a multicenter randomized trail. Gut 2011; 765-773.
- Bulsiewicz WJ, Shaheen NJ. The role of radiofrequency ablation in the management of Barrett’s esophagus. Gastrointest Endosc Clin N Am 2011; 21: 95-109.
- Fleischer D, Odze R, Overholt BF, et al. The case for endoscopic treatment of non-dysplastic and low-grade dysplastic Barrett’s esophagus. Dig Dis Sci 2010; 55: 1918-1931.
- Orman ES, Kim HP, Bulsiewicz WJ, et al. Intestinal metaplasia recurs infrequently in patients successfully treated for Barrett’s esophagus with radiofrequency ablation. The American Journal of Gastroenterology 2013; 187-195.
- Falk GW. Update on the use of radiofrequency ablation for the treatment of Barrett’s esophagus. Gastroenterology & Hepatology 2013; 9: 447-449.
- Schlemper RJ, Riddell RH, Kato Y, et al. The Vienna classification of gastrointestinal epithelial neoplasia. Gut 2000; 47: 251-255.
- Bennett C, Vakil N, Bergman J et al. Consensus statements for management of Barrett’sdysplasia and early-stage esophageal adenocarcinoma, based on a Delphi process. Gastroenterology 2012; 143: 336-346.
- Semlitsch T, JK, Schoefl R, Horvath K, et al. A systematic review of the evidence for radiofrequency ablation for Barrett’s esophagus. Surg Endosc 2010; 24: 2935-2943.
- Ganz RA, Overholt OB, Sharma VK, et al, Circumferential ablation of Barrett’s esophagus that contains high-grade dysplasia: a U.S. Multicenter Registry. Gastrointest Endosc 2008; 68: 35-40.
- Peters FP, Curvers WL, Rosmolen WD, et al. Surveillance history of endoscopically treated patients with early Barrett’s neoplasia: nonadherence to the Seattle biopsy protocol leads to sampling error. Dis Esophagus 2008; 21: 475-479.
- Overholt BF, Lightdale CJ, Wang KK, et al. Photodynamic therapy with porfimer sodium for ablation of high-grade dysplasia in Barrett’s esophagus: international, partially blinded, randomized phase III trial. Gastrointest Endosc 2005; 62: 488-498.
- Shaheen NJ, Sharma P, Overholt BF, et al. Radiofrequency ablation in Barrett’s esophagus with dysplasia. N Engl J Med 2009; 360: 2277-2288.
- Fleischer DE, Overholt BF, Sharma VK, et al. Endoscopic ablation of Barrett’s esophagus: a multicenter study with 2.5 year follow-up. Gastrointest Endosc 2008; 68: 867-876.
- Fleischer DE, Overholt BF, Sharma VK, et al. Endoscopic radiofrequency ablation for Barrett’s esophagus: 5-years outcomes from prospective multicenter trial. Gastrointest Endosc 2010; 42: 781-789.
- Velanovich V. Endoscopic endoluminal radiofrequency ablation of Barrett’s esophagus: inicial results and lessons learned. Surg Endosc 2009; 23: 2175-2180.
- Eldaif SM, Lin E, Singh KA, et al. Radiofrequency ablation for Barrett’s esophagus: short-term results. Ann Thorac Surg 2009; 87: 405-410.
- Sharma VK, Kim HJ, Das A, et al. A prospective pilot trial of ablation for Barrett’s esophagus with low-grade dysplasia using stepwise circumferential and focal ablation (HALO system). Endoscopy 2008; 40: 380-387.
- Sharma VK, Kim HJ, Das A, et al. Circumferential and focal ablation of Barrett’s esophagus containing dysplasia. Am J Gastroenterol 2009; 104: 310-317.
- Phoa KN1, van Vilsteren FG1, Weusten BL2, et al. Radiofrequency ablation vs endoscopic surveillance for patients with Barrett esophagus and low-grade dysplasia: a randomized clinical trial. JAMA 2014; 311: 1209-1211.
- Odze RD. Diagnosis and grading of dysplasia in Barrett’s oesophagus. J Clin Pathol 2006; 59: 1029-1038.
- Gatenby PA, Ramus JR, Caygill CP, et al. Relevance of the detection of intestinal metaplasia in non-dysplastic columnar-lined oesophagus. Scand J Gastroenterol 2008; 43: 524-530.
- Harrison R, Perry I, Haddadin W, et al. Detection of intestinal metaplasia in an observational comparator study suggests the need for a minimum of eight biopsies. Am J Gastroenterol 2007; 102: 1154-1161.
- Sharma P, Falk GW, Weston AP, et al. Dysplasia and cancer in a large multicenter cohort of patients with Barrett’s esophagus. Clin Gastroenterol Hepatol 2006; 4: 566-572.
- Crockett SD, Lippmann QK, Dellon ES, Shaheen NJ. Health-related quality of life in patients with Barrett’s esophagus: a systematic review. Clin Gastroenterol Hepatol 2009; 7: 613-623.
Correspondencia: Fabio Nachman
Av Belgrano 1746, 7mo piso, (CP: C1093AAS), Ciudad Autónoma de
Buenos Aires, Argentina
Tel: 541143781200 (Int 1748)
Correo electrónico: fnachman@ffavaloro.org
Acta Gastroenterol Latinoam 2015;45(2):117-121
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE