Luis María Bustos-Fernández,1 Ignacio Hanna-Jairala2
1Centro Médico Bustos-Fernández (CMBF). Ciudad Autónoma de Buenos Aires, Argentina.
2Servicio de Gastroenterología Hospital Alcívar.
Guayaquil, Ecuador.
Acta Gastroenterol Latinoam 2019;49(4):381-393
Recibido: 13/05/2019 / Aprobado: 18/06/2019 / Publicado en www.actagastro.org el 17/12/2019
Resumen
El síndrome de intestino irritable (SII) es un trastorno funcional del aparato digestivo en el que el dolor abdominal recurrente se asocia con alteraciones en la defecación o cambios en el hábito evacuatorio. La falta de un esquema de eficacia óptima y la fisiopatogenia multifactorial son algunas de las razones por las que se ha intentado tratar esta condición con intervenciones que van desde modificaciones de la dieta hasta psicoterapia. La etiopatogenia del SII y de los trastornos funcionales gastrointestinales es consecuencia de una concatenación de factores que incluyen alteraciones de motilidad, hipersensibilidad visceral, liberación de mediadores de inflamación, interacciones del eje cerebro-intestino, factores psicosociales y alteraciones de la microbiota intestinal que se relacionan con sobrecrecimiento bacteriano del intestino delgado (SIBO) y disbiosis del colon. Partiendo de este modelo multifactorial se plantea un tratamiento en tres niveles: enfoque tradicional o periférico que busca solucionar el síntoma principal, enfoque central con la utilización de psicofármacos y/o terapias psicológicas, y modulación de la microbiota intestinal con dieta, prebióticos, probióticos y antibióticos.
Palabras claves. Síndrome de Intestino Irritable, fisiopatogenia multifactorial, alternativas de tratamiento, enfoque tradicional, enfoque central, modulación de microbiota.
Update in the Treatment of Irritable Bowel Syndrome. A new perspective based on experience and evidence
Summary
Irritable bowel syndrome (IBS) is a gastrointestinal functional disorder in which recurrent abdominal pain is associated with changes in bowel movements or evacuation habits. The lack of consensus on the therapeutic regimen and the multifactorial pathophysiology are some of the reasons why this condition has been treated with interventions ranging from diet modifications to psychotherapy. The etiopathogenesis of IBS and gastrointestinal functional disorders is the consequence of a concatenation of factors that include alterations of motility, visceral hypersensitivity, inflammation, brain-gut axis interactions, psychosocial factors and gut microbiota alterations that are related with small intestinal bacterial overgrowth (SIBO) and dysbiosis of the colon. A treatment is proposed based in this multifactorial model, with three levels: traditional or peripheral approach where the main symptom is sought; central approach with the use of psychotropic drugs and/or psychological therapies, and modulation of the intestinal microbiota with diet, prebiotics, probiotics and antibiotics.
Key words. Irritable bowel syndrome, multifactorial pathophysiology, treatment alternatives, traditional approach, central approach, modulation of microbiota.
Abreviaturas
SII: Síndrome de intestino irritable.
SIBO: Sobrecrecimiento bacteriano del intestino delgado/Small intestinal bacterial overgrowth.
RMP: Relación médico-paciente.
FODMAPs: Fermentables, oligosacáridos, disacáridos, monosacáridos y polioles.
LFD: Dieta baja en FODMAPs/Low FODMAPs diet.
NNT: Número necesario para tratar.
ECA: Ensayo controlado aleatorizado.
SII/D: Síndrome de intestino irritable con predominio de diarrea.
SII/C: Síndrome de intestino irritable con predominio de constipación.
DLG: Dieta libre de gluten.
FDA: Food and Drugs Administration.
NND: Número necesario para dañar.
PEG: Polietilenglycol.
TCA: Antidepresivos tricíclicos.
SSRIS: Inhibidores selectivos de la recaptación de serotonina.
FOS: Fructooligosacáridos.
GOS: Galactooligosacáridos.
TGOS: Transgalacto-oligosacáridos.
FMT: Trasplante de microbiota fecal.
WGO: World Gastroenterology Organisation.
RPM: Relación médico-paciente.
El síndrome de intestino irritable (SII) es un trastorno funcional del aparato digestivo en el que el dolor abdominal recurrente se asocia con alteraciones en la defecación o cambios en el hábito evacuatorio, y la distensión es una característica comúnmente asociada.1
De acuerdo al último Consenso de Roma, los pacientes que padecen esta condición deben tener un tiempo de evolución de al menos seis meses con síntomas, los cuales deben estar presentes durante los últimos tres meses, con una frecuencia mínima de un día a la semana para poder establecer el diagnóstico.1
El tratamiento del SII incluye diversas alternativas. La falta de un esquema de eficacia óptima y la fisiopatogenia multifactorial son algunas de las razones por las cuales se ha intentado tratar esta condición con intervenciones que van desde modificaciones de la dieta hasta la psicoterapia.
Durante muchos años se consideró que el SII, así como los trastornos funcionales gastrointestinales en general, tenían una etiopatogenia que era consecuencia de una concatenación de factores que incluían alteraciones de motilidad intestinal, hipersensibilidad visceral, liberación de mediadores de inflamación e interacciones del eje cerebro-intestino, las cuales eran detonadas por factores psicosociales. En los últimos años se incluyó como parte de esta cadena a las alteraciones en la composición de la microbiota intestinal que se relacionan con el sobrecrecimiento bacteriano del intestino delgado (SIBO) y la disbiosis en el colon.
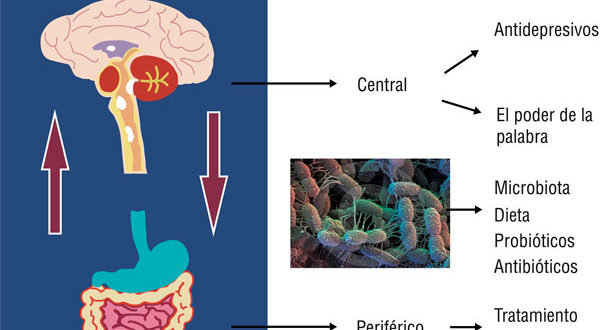
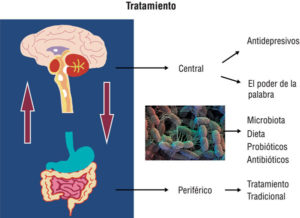
Partiendo de este modelo multifactorial se podría plantear el tratamiento del SII en tres niveles. El primero, un enfoque tradicional o periférico que busca solucionar el síntoma principal (dolor, diarrea, constipación). El segundo sería el central, con la utilización de psicofármacos y/o terapias psicológicas, y el tercero la modulación de la microbiota intestinal con dieta, prebióticos, probióticos y antibióticos (Figura 1).
El objetivo de esta revisión es evaluar la evidencia más relevante en relación con las distintas alternativas terapéuticas propuestas para el SII en los tres niveles previamente explicados, y de esta forma tener una perspectiva más científica al elegir un tratamiento.1, 2
Figura 1. Tratamiento del SII en tres niveles: 1) tradicional o periférico, 2) psicofármacos y/o terapias psicológicas, y 3) modulación de la microbiota intestinal con dieta, prebióticos, probióticos y antibióticos.
1. Tratamiento general
1.1 Relación médico-paciente
La relación médico-paciente (RMP) parece ser fundamental en pacientes con SII. Así se evidencia en un metaanálisis publicado en el año 2017 en el que se evaluó el efecto placebo de las terapias psicológicas en los pacientes con SII. En este, la tasa de respuesta al placebo fue de 41,4%, comparable con la respuesta placebo de las intervenciones farmacológicas empleadas en estos pacientes.3
Construir una RMP óptima es fundamental como elemento de comunicación, es por esto que se deben considerar ciertos puntos clave que el médico debe transmitir a su paciente con SII. Entre estos se incluye trasmitir que el SII es una condición real que afecta la calidad de vida, que tiene curso crónico y aparición intermitente y que, aunque no hay una “píldora mágica” para tratarlo, existen alternativas para controlar síntomas por períodos largos. Esto da validez a los síntomas, demuestra empatía con el paciente y establece expectativas reales. También es necesario explicar que el SII no causa cáncer ni acorta el tiempo de vida, y que el estrés puede desencadenar los síntomas. Esto reduce la ansiedad, incita a explorar el papel de los factores psicológicos y enfatiza la necesidad de un enfoque conjunto y colaborativo.4
1.2 Dieta
En los últimos años parece haber un renovado interés en el papel de la dieta en el SII, debido al reconocimiento cada vez mayor de desencadenantes potenciales como los FODMAPs y el gluten.5
1.2.1 Dieta baja en FODMAPs (LFD)
Los FODMAPs (oligosacáridos, disacáridos, monosacáridos fermentables y polioles) son pequeñas moléculas osmóticamente activas de lenta absorción intraluminal que aumentan el contenido de agua intestinal y que pueden ser fermentados rápidamente dando lugar a la formación de hidrógeno, CO2 y metano, cuya presencia en el intestino se relaciona con distensión y dolor abdominal.6
Se han publicado muchos estudios utilizando LFD en el tratamiento del SII, con diferencias estadísticamente significativas. El número necesario para tratar (NNT) de estos ensayos varía entre 3 y 11, con un valor promedio de 5.7
En el 2017, una revisión sistemática publicada por Pourmand y col incluyó 15 ensayos controlados aleatorizados (ECA) con 984 pacientes que evaluaron la LFD en el tratamiento de SII. En 8 ECAs incluidos se encontró diferencia significativa en favor de la LFD en cuanto a mejoría global de síntomas de SII, y un ECA mostró mejoría en todos los síntomas excepto constipación. Un ECA no encontró diferencia significativa entre LFD y la administración oral de lactobacillus GG, y otro no encontró diferencia significativa entre la LFD y una dieta tradicional para SII. Otro de los ECAs analizados reportó que la LFD mejoró la diarrea en el 75% de los pacientes. Otros síntomas como mejoría de dolor abdominal y reducción de flatulencia también se reportaron entre los pacientes que hicieron LFD. En las conclusiones de la revisión se demostró eficacia de LFD en el control de síntomas de SII, eficacia que parece ser mayor en pacientes con SII con predominio de diarrea (SII/D) que en aquellos con SII con predominio de constipación (SII/C).6
Posteriormente se publicó un metaanálisis que incluyó 7 ECAs con 397 pacientes. Los ensayos incluyeron comparaciones contra placebo, dietas alternativas, dieta alta en FODMAPs y dieta común, observándose diferencias estadísticamente significativas en favor de la LFD en los últimos tres grupos. Los resultados finales del metaanálisis mostraron una mejoría global de síntomas del 60% en los pacientes que usaron LFD.8
La LFD puede modificar la microbiota intestinal. Se han descrito trabajos en donde se produce una disminución en la cantidad de bifidobacterias en pacientes que siguieron esta dieta.9 Recientemente se publicó un estudio donde se comparó una dieta con prebióticos contra LFD: ambas produjeron mejoría de síntomas, pero al suspenderlas el grupo de pacientes que recibió prebióticos mantuvo la mejoría, no así el grupo de LFD.10
1.2.2 Dieta libre de gluten
Una de las áreas más controversiales en la dieta del SII es la inclusión del trigo. Entre los puntos de controversia se destaca que contiene gluten, que es un alérgeno con alto contenido de fructanos y que es parte de la familia de carbohidratos fermentables.11
Existen 5 ECAs que sugieren que los pacientes con SII pueden beneficiarse de la dieta libre de gluten (DLG). Sin embargo, la evidencia disponible para recomendarla es controversial.11, 12
En un ECA doble ciego cruzado, 59 pacientes fueron asignados aleatoriamente a dietas con gluten sin fructano, fructano sin gluten o placebo durante siete días. Los resultados mostraron que los síntomas gastrointestinales fueron significativamente más frecuentes en el grupo al que se asignó fructano en comparación con el grupo gluten; asimismo, no hubo diferencia significativa entre los grupos gluten y placebo, por lo que se concluye que los pacientes con SII empeoran sus síntomas con el consumo de fructano, mas no con la inclusión de gluten en la dieta.12
1.2.3 Intolerancia y sensibilidad a alimentos
La sensibilidad al consumo de alimentos ha sido postulada como factor detonante para la aparición de síntomas en el SII. Los alimentos más vinculados con este fenómeno son los lácteos y los granos. Si bien en algunos ensayos se han probado dietas de exclusión que mostraron beneficios, no se recomienda la exclusión basada en anticuerpos IgG4 contra alimentos específicos, debido a la falta de evidencias de calidad que respalden esta práctica.7, 10
En relación con la intolerancia hay que destacar que la lactosa es mal tolerada en 1/3 de los pacientes con SII. La fructosa es otro azúcar frecuentemente relacionado con los síntomas del SII. El diagnóstico de malabsorción de fructosa se puede realizar mediante una prueba de aliento, pero este método y su implicación clínica es controversial porque se realiza sin glucosa; esto sobrevalora su malabsorción13 debido a que la absorción de fructosa se encuentra asociada a la de la glucosa; sin embargo, el 67% de pacientes con SII con una prueba de aliento positiva mejora sus síntomas durante períodos largos con una dieta baja o libre de fructosa, sorbitol y/o lactosa.14
Existen otros alimentos, como alcohol, café, grasas y picantes, que también parecen ser mal tolerados en pacientes con SII; sin embargo, no existe evidencia que respalde esta hipótesis.7, 10
1.2.4 Fibra
El rol de la fibra tanto medicamentosa como en alimentos en el tratamiento del SII es controversial. Existen estudios que muestran beneficios del uso del psillium/ispaghula, con NNTs que varían entre 4 a 25, con un valor promedio de 7.7
En el año 2008 se publicó un metaanálisis que evaluó el efecto de la fibra en el tratamiento del SII. Se incluyeron 6 ECAs con psillium/ispaghula y 5 ECAs con salvado de trigo en pacientes con SII, con el objetivo de evaluar mejoría de síntomas globales y de dolor abdominal contra grupos control. Las conclusiones mostraron diferencias estadísticamente significativas en el grupo de estudios que utilizó psillium, no así en el grupo de ensayos con salvado.15
2. Enfoque tradicional sintomático o “periférico”
2.1 Cuando el síntoma predominante es el «dolor»
2.1.1 Antiespasmódicos tradicionales
Los antiespasmódicos tradicionales se utilizan desde hace décadas en el tratamiento del SII; sin embargo, la mayor parte de los ensayos publicados presentan limitaciones metodológicas. La mayoría de los antiespasmódicos usados en el mercado no han sido autorizados por la FDA (Food and Drugs Administration) en EE.UU., lo cual disminuye la cantidad de ensayos con estos productos.2, 16
Los antiespasmódicos se indican con la intención de mejorar síntomas como dolor abdominal, distensión y urgencia evacuatoria. Existen antiespasmódicos que actúan sobre la relajación del músculo liso intestinal y otros que tienen propiedades anticolinérgicas o antimuscarínicas.2, 5, 15, 16
A pesar de las limitaciones metodológicas de los ensayos clínicos, se han publicado varios metaanálisis que sugieren que los antiespasmódicos son útiles en el tratamiento del SII, mostrando mejoría significativa de dolor abdominal y síntomas globales, con NNTs que varían entre 4 y 8, con un valor promedio de 5. Además, son fármacos que cuentan con un perfil de seguridad favorable, ya que sus efectos adversos no son estadísticamente significativos.5, 15
A continuación, mostramos de forma individual los resultados de los agentes antiespasmódicos más utilizados en el tratamiento del SII.
2.1.1.1 Hiosciamina
La hiosciamina o butil bromuro de hioscina es un anticolinérgico antimuscarínico regulado por la FDA; la evidencia de su uso en SII es limitada. Dos metaanálisis citan 3 ECAs que evidencian diferencias estadísticamente significativas en cuanto a mejoría global de síntomas; sin embargo, solo uno de estos ensayos reportó su eficacia en el manejo del dolor abdominal en SII y los resultados no mostraron diferencias significativas contra el grupo placebo. Su utilización se asocia con efectos adversos no significativos en incidencia comparados con placebo, como sequedad de boca, mareos y visión borrosa, cuya incidencia se relaciona con la dosis. La constipación y la confusión son otros efectos adversos reportados.2, 5, 15, 16
2.1.1.2 Diciclomina
La diciclomina, también llamada dicicloverina, tiene un mecanismo de acción similar al de la hiosciamina, con similares efectos adversos. La evidencia de este agente en el tratamiento de SII se limita a un ECA con 97 pacientes, que mostró diferencias significativas en cuanto a mejoría global de síntomas, dolor y distensión abdominal y mejoría de hábito evacuatorio.2, 5, 15, 16
2.1.1.3 Bromuro de cimetropio
Este agente anticolinérgico antimuscarínico también ha sido utilizado en el tratamiento del SII. Un metaanálisis publicado en el 2001 incluyó 4 ECAs con 188 pacientes, que evaluaron la mejoría global de síntomas de SII en pacientes que usaron cimetropio contra placebo, encontrando diferencias estadísticamente significativas en el grupo de la droga. En cuanto a mejoría de dolor abdominal solo se encuentra un ECA con 30 pacientes, con diferencia significativa en favor del cimetropio. Los efectos adversos no parecen ser diferentes de los del placebo.17
2.1.2 Reguladores del músculo liso
2.1.2.1 Mebeverina
La mebeverina es un antiespasmódico con acción muscolotrópica directa sobre el músculo liso del intestino, por lo que no se relaciona con efectos adversos anticolinérgicos. Los resultados en ECAs individuales muestran discordancia. Sin embargo, al analizar la data disponible en forma de metaanálisis no se observan diferencias estadísticamente significativas en favor de la droga en cuanto a mejoría global de síntomas, distensión o dolor abdominal.17, 18
2.1.2.2 Bromuro de otilonio
El bromuro de otilonio es un antiespasmódico con acción sobre los receptores muscarínicos y bloqueante de canales de calcio que ha sido ampliamente usado en el tratamiento del SII. En un metaanálisis publicado en 2012 se incluyen 4 ECAs que evaluaron bromuro de otilonio contra placebo, observándose diferencias estadísticamente significativas en favor de la droga en cuanto a mejoría global de síntomas, con un NNT de 7, y de dolor abdominal, con un NNT de 8. Los efectos adversos del otilonio fueron similares a los del grupo placebo.17, 19
2.1.2.3 Citrato de alverina
El citrato de alverina es un antiespasmódico bloqueante de canales de calcio que comúnmente se asocia a simeticona en el tratamiento del SII. Se han publicado varios ECAs evaluando su eficacia, evidenciándose diferencia significativa en favor del tratamiento en relación con mejoría global de síntomas y dolor abdominal, reportando NNTs de 8 y 11 respectivamente. El citrato de alverina ha mostrado también mejoría estadísticamente significativa de distensión abdominal y calidad de vida en estudios individuales. Además, parece tener un perfil de seguridad alto, con efectos adversos que no difieren de los grupos placebo.19, 20
2.1.2.4 Bromuro de pinaverio
El bromuro de pinaverio es un antiespasmódico bloqueante de canales de calcio usado en el tratamiento del SII, tanto solo como formando parte de combinaciones. En un metaanálisis realizado por Cochrane en 2011 se incluyó 4 ECAs que evaluaron mejoría global de síntomas de SII en pacientes tratados con bromuro de pinaverio, obteniéndose diferencia significativa en favor del grupo de tratamiento. En tres de estos ECAs se evaluó también la eficacia de esta droga en la mejoría de dolor abdominal, con diferencia significativa en favor del pinaverio. Otro metaanálisis publicado en 2012 evaluó los beneficios del pinaverio asociado a simeticona en dos ECAs, uno de los cuales mostró beneficios significativos de la asociación en cuanto a mejoría de distensión abdominal; el otro no mostró beneficios contra placebo en cuanto a mejoría global de síntomas y dolor abdominal. Tanto solo como asociado, el bromuro de otilonio parece ser una droga segura cuyos efectos adversos no difieren de los del placebo.17-19
2.1.2.5 Maleato de trimebutina
La trimebutina es un antiespasmódico bloqueante de los canales de calcio que se emplea en el tratamiento del SII que, en altas concentraciones, reduce la amplitud de las contracciones espontáneas y de los potenciales de acción. También tiene una acción analgésica, actuando como agonista débil de receptores opioides mu. Un metaanálisis publicado en el 2001 muestra diferencias estadísticamente significativas en favor de la trimebutina en cuanto a mejoría global de síntomas, y otro metaanálisis previamente citado en esta revisión muestra beneficios significativos en cuanto a mejoría de dolor abdominal. Sin embargo, los estudios con trimebutina han sido realizados con un número bajo de pacientes, lo cual explica que al incluir o dejar de incluir algún ensayo difieran las conclusiones de los distintos metaanálisis publicados. En cuanto a efectos adversos, no se reportan diferencias contra placebo en ninguna de las publicaciones evaluadas para esta revisión.17-19
2.1.2.6 Aceite de menta
El aceite de menta es bloqueante de los canales de calcio, antagonista de los receptores opiáceos κ, y antagonista de receptores 5-HT3. Es por esto que además de tener propiedades antiespasmódicas produce efectos como la normalización del tiempo de tránsito orocecal.21
La evidencia sobre su utilización en el tratamiento del SII parece más sólida que la de los antiespamódicos convencionales, así lo muestra un metaanálisis en el que se observa mejoría significativa de dolor abdominal y síntomas globales con NNTs de 4 y 3 respectivamente. En esta revisión se reportaron efectos adversos como náuseas, vómitos y pirosis. Este último parece disminuir cuando el fármaco es administrado en tabletas con triple cubierta.21, 22
2.1.3 Eluxadonina
La eluxadolina es un agonista de los receptores opioides tipo mu y kappa, y antagonista del receptor opioide tipo delta del sistema nervioso entérico. La acción agonista de receptores mu promueve el retardo de vaciamiento gástrico, el enlentecimiento del tránsito intestinal y el aumento de la presión del esfínter anal, mientras que el efecto antagonista de receptores delta contrarresta la constipación resultante y aumenta la analgesia.7, 23
La eluxadolina se ha indicado en el tratamiento del SII/D mostrando NNTs que oscilan entre 8 y 33, con valores promedio de 12,5. En un metaanálisis publicado en el año 2017 que incluyó 2427 pacientes, se observó mejoría estadísticamente significativa en cuanto a dolor abdominal, consistencia de evacuaciones, síntomas globales y calidad de vida relacionada con el SII; sin embargo, se observaron efectos adversos significativos que incluyeron náuseas, vómitos, dolor abdominal y constipación. También se observó una mayor incidencia de pancreatitis y espasmo del esfínter de Oddi, principalmente en pacientes previamente colecistectomizados. Debido a la aparición de estos eventos, la FDA contraindica el uso de eluxadolina en pacientes con historia de trastornos biliares, pancreatitis, insuficiencia hepática grave o alcoholismo, así como en pacientes colecistectomizados.7, 23, 24
2.2 Cuando el síntoma predominante es la diarrea
2.2.1 Loperamida
La loperamida es el único agente antidiarreico evaluado con ECAs en pacientes con SII con diarrea. Sin embargo, el número de artículos es escaso, de corta duración y con un número pequeño de pacientes. El American College of Gastroenterology evaluó la respuesta a la loperamida en el SII con diarrea en 2 ECAs que sumaron 42 pacientes, en los que fue más efectiva que el placebo para el tratamiento de la diarrea, al disminuir la frecuencia y mejorar la consistencia de las deposiciones, pero no hubo mejoría significativa de síntomas globales, distensión y dolor abdominal.5, 7, 25, 26
2.2.2 Secuestradores de sales biliares
Los secuestradores de sales biliares (colestiramina, colestipol, colesevelam) se usan en el tratamiento de SII con diarrea sobre la base de la hipótesis fisiopatológica de que hasta el 50% de estos pacientes tienen malabsorción de ácidos biliares. Su uso se limita por sus efectos adversos (distensión, flatulencia, malestar abdominal y constipación) y por la escasa evidencia científica que lo respalda, ya que se reporta un solo ECA con 24 pacientes con SII con diarrea en el que se utilizó colesevelam (1.875 g dos veces al día) contra placebo, aumentando el tiempo de tránsito colónico en comparación con el grupo control.27, 28
2.2.3 Antagonistas de los receptores 5HT3
Los angonistas 5HT3 como el cilansetrón, el ramosetrón y el alosetrón modulan la actividad visceral aferente intestinal, disminuyendo la motilidad y la secreción del colon. Se han realizado ECAs con estos agentes, evidenciando mejoría significativa de dolor abdominal, síntomas globales y disconfort abdominal en pacientes con SII.2, 7, 29-31
El alosetrón fue el primer fármaco aprobado por la FDA para el tratamiento del SII con diarrea, mostrando NNTs que oscilan entre 5 y 16 con valores promedio de 7,5. En un metaanálisis publicado en el 2017 se observó mejoría significativa de síntomas globales, dolor abdominal, hábito evacuatorio y consistencia de las heces. No obstante, se observaron efectos adversos como constipación grave y colitis isquémica, por lo que se retiró del mercado en EE.UU. y posteriormente se reintrodujo con restricciones, siendo indicado únicamente en mujeres con SII/D sin respuesta a otros tratamientos durante 6 meses previos.2, 7, 29-31
2.3 Cuando el síntoma predominante es la constipación
2.3.1 Secretagogos
2.3.1.1 Lubiprostona
La lubiprostona es un ácido graso funcional bicíclico de acción local derivado de la prostaglandina E1, que activa los canales de cloro produciendo la secreción intestinal de un líquido rico en cloruro y aumentando la motilidad intestinal.5, 7, 32
La lubiprostona se recomienda para el tratamiento del SII/C con base en resultados de varios ECAs, que muestran NNTs de entre 8 y 25, con valores promedio de 12,5. El efecto adverso más común de la lubiprostona son las náuseas relacionadas con la dosis, que ocurren en 8% y 29% con 8 μg y 24 μg respectivamente, comparados con 4% y 3% de pacientes con placebo.5, 7
En un metaanálisis que incluyó a 2309 pacientes, la lubiprostona demostró eficacia a corto plazo en pacientes con SII/C, mejorando significativamente la frecuencia de movimientos intestinales espontáneos por semana, la consistencia de la materia fecal, el esfuerzo evacuatorio, la distensión y el dolor abdominal, con mínimos efectos adversos.32
2.3.1.2 Agonistas de guanilatociclasa C
La activación de los receptores guanilatociclasa aumenta la guanosina-3′, 5′-monofosfato cíclico intracelular, incrementando la secreción intestinal de cloruro y bicarbonato, así como la velocidad de tránsito gastrointestinal.5, 7, 33
La linaclotida y la plecanatida son agonistas de guanilatociclasa que reducen la contracción muscular y disminuyen el dolor visceral al aumentar guanosina-3′, 5′-monofosfato cíclico extracelular. Debido a la excesiva secreción intestinal, la diarrea es un efecto secundario que parece ser menos frecuente en ECAs con plecanatida.33
En el año 2018 se publicó un metaanálisis con 10.369 pacientes que evaluó linaclotida y plecanatida en cuanto a eficacia, frecuencia de diarrea como efecto adverso y frecuencia de abandono de tratamiento. La respuesta terapéutica fue medida en función de la disminución en el promedio semanal del peor dolor abdominal en más de un 30%, y aumento de movimientos intestinales espontáneos completos ≥1 por semana durante al menos el 50% de las semanas durante 12 semanas. Los resultados demostraron diferencias significativas de ambas drogas en el tratamiento de los pacientes con SII con constipación, con NNTs de 6 y 9 para linaclotida y plecanatida, respectivamente. La diarrea también fue un efecto adverso significativo, con NND (número necesario para dañar) de 6 y 27 para linaclotida y plecanatida respectivamente. Sin embargo, el NND para abandono de tratamiento por diarrea fue amplio, registrándose 32 para linaclotida y más de 100 para plecanatida.33
2.3.1.3 Laxantes estimulantes/prucaloprida y polietilenglycol
Los laxantes estimulantes como sen, bisacodilo, aceite de ricino o cáscara sagrada aumentan las evacuaciones promoviendo la secreción de líquido y electrolitos en el colon, o induciendo la peristalsis colónica; la prucaloprida, en cambio, mejora la constipación a través de su acción agonista de receptores 5HT4.5, 34
Se han publicado ECAs con prucaloprida, bisacodilo y picosulfato de sodio en el tratamiento de pacientes con constipación funcional. Sin embargo, no hay ECAs publicados que evalúen estos agentes en SII/C, por lo que su utilización en este grupo específico de pacientes no es recomendable. Por otra parte, en los estudios realizados en pacientes con constipación se reportan efectos adversos significativos, principalmente diarrea y dolor abdominal.5, 34
Con respecto al polietilenglycol (PEG), a pesar de la sólida evidencia de su eficacia en pacientes con constipación funcional, su beneficio en pacientes adultos con SII/C es menos claro. Hasta la actualidad solo se han publicado 2 ECAs que evalúan al PEG en el tratamiento de adultos con SII/C: en uno de ellos el PEG se asoció a tegaserod, lo cual impide la evaluación correcta de las conclusiones. Aunque ambos ensayos mostraron mejoría en la frecuencia de las evacuaciones, ninguno mostró alivio de dolor o reducción de síntomas globales, y en ambos se reportaron efectos adversos significativos como dolor abdominal y diarrea.5, 34, 35
2.4 Otros tratamientos menos utilizados
2.4.1 Antinflamatorios no esteroidales
No hay estudios de calidad que respalden su uso. Además, su utilización no es recomendable por el riesgo elevado de efectos adversos.36, 37
2.4.2 Narcóticos (morfina)
Mejoran el dolor mediados por receptores opioides. Sin embargo, el riesgo de habituación y los efectos adversos como constipación, vómitos e intestino narcótico limitan su utilización en el SII.36, 38
2.4.3 Benzodiazepinas
Se deben considerar exclusivamente para tratar a pacientes que concomitantemente presentan trastornos de ansiedad.36, 39 En los países latinoamericanos se utilizan con frecuencia diazepam, bromazepam o alprazolam, tanto solos como asociados a los antiespasmódicos, pero no existen ECAs que avalen su utilización.36, 39
2.4.4 Clonidina
Es un agonista adrenérgico alfa-2, que en estudios pequeños parece aliviar el dolor abdominal y mejorar globalmente los síntomas de SII. Sin embargo, sus efectos adversos (somnolencia, sequedad de boca y sueño) limitan su uso.36, 40, 41
2.4.5 Mesalazina
Se han publicado pocos estudios con mesalazina en el tratamiento de SII, y sus resultados son tan contradictorios que sus NNTs varían entre 5 y 50, motivo por el cual no existen bases sólidas para su utilización.7, 36
2.4.6 Gabapentina/pregabalina
Se han publicado varios ECAs de pequeña escala con este grupo de fármacos en el tratamiento de SII. En ellos el dolor abdominal, la urgencia evacuatoria y la distensión mejoraron significativamente, por lo que podrían ser una opción a considerar, a falta de estudios con muestras más grandes.36, 42, 43
2.4.7 Tenapanor
Es un inhibidor del intercambiador de protones de sodio que tiene acción secretagoga en el intestino. Recientemente se ha publicado un ECA con 356 pacientes con SII/C en el que se observó mejoría significativa de dolor abdominal y frecuencia evacuatoria. Sin embargo, la evidencia aún es limitada para su recomendación.44
2.4.8 Ketotifeno
Es un estabilizador de mastocitos. En un ECA con 60 pacientes mostró disminución significativa de dolor abdominal y aumento de tolerancia a la distensión rectal. Sus efectos adversos (somnolencia) fueron bien tolerados y no limitaron su utilización.36, 45
2.4.9 Cromoglicato
Estabilizador de mastocitos. En un ECA con 66 pacientes con SII/D mostró mejoría significativa de síntomas globales. Sin embargo, no se cuenta con estudios que evalúen su efecto sobre el dolor.36, 46
3. Enfoque central
3.1 Antidepresivos
Los pacientes con SII parecen tener mayor incidencia de ansiedad y depresión; sin embargo, los antidepresivos también tienen propiedades analgésicas, por lo que sus efectos van más allá de modificar el estado de ánimo de los pacientes.5, 7, 47
Se han realizado varios estudios para evaluar la eficacia de los antidepresivos en el SII. La evidencia más sólida la tienen los antidepresivos tricíclicos (TCA), siendo los más utilizados imipramina, desipramina y amitriptilina. Menos concluyentes son los resultados con inhibidores selectivos de la recaptación de serotonina (SSRIS), como fluoxetina, paroxetina y citalopram.5, 7, 19, 47, 48
Los TCA, a través de su acción anticolinérgica, también disminuyen el tiempo de tránsito intestinal, lo que puede proporcionar beneficios en el SII-D, con NNTs que promedian valores de 4. Por este motivo se deben usar con precaución en pacientes con estreñimiento. Por el contrario, los SSRIS tienen efectos proquinéticos por lo que se recomiendan en el SII-C, con NNTs que promedian valores de 5.5, 7
Se han publicado varios metaanálisis evaluando la respuesta a los antidepresivos en pacientes con SII. En todas las diferencias son estadísticamente significativas en favor del tratamiento en relación con la mejoría global de síntomas y el dolor abdominal. En el análisis individualizado según el mecanismo de acción, las evidencias parecen ser más sólidas en los estudios que usaron TCA. Sin embargo, ni los TCA ni los SSRIS mostraron diferencia significativa contra placebo al analizar el abandono del tratamiento por efectos adversos.19, 47, 48
3.2 Terapia psicológica
Se han empleado varias modalidades de terapia psicológica para el tratamiento del SII, que han sido evaluadas individualmente en ECAs con resultados dispares. Los NNTs son estadísticamente significativos cuando se analizan colectivamente, con resultados que varían entre 3,5 y 5,5, con valores promedio de 4.7, 49
En un metaanálisis publicado en el 2017 se analizaron distintas modalidades de terapia psicológica. Los resultados en el análisis colectivo mostraron diferencia significativa en cuanto a mejoría global de síntomas en favor de la terapia psicológica contra placebo. En el análisis individual, la terapia cognitiva, la hipnosis y la terapia dinámica mostraron diferencia significativa; las terapias de relajación no aportaron beneficios significativos. Estos resultados son concordantes con los de un metaanálisis previo; sin embargo, este último también incluyó resultados de estudios con terapias psicológicas multicomponentes que, tanto administradas personalmente como por vía telefónica, mostraron resultados favorables. Por el contrario, las terapias de relajación, el manejo de estrés, la meditación y la terapia cognitiva autoadministrada o vía internet no mostraron beneficios.48, 50
4. Estrategias para la estabilización y modulación de la microbiota intestinal
La manipulación de la microbiota es una alternativa dirigida a corregir la disbiosis intestinal con la intención de mejorar síntomas del SII. Las estrategias utilizadas con esta finalidad incluyen dieta, prebióticos, probióticos, antibióticos y trasplante de microbiota fecal.51, 52
4.1 Prebióticos
Los prebióticos son ingredientes alimentarios no digeribles que promueven la proliferación de bacterias gastrointestinales.51, 52
Los prebióticos se subdividen en disacáridos como la lactulosa, oligosacáridos como los fructooligosacáridos (FOS), los galactooligosacáridos (GOS), los isomalto-oligosacáridos, los xilo-oligosacáridos, los transgalacto-oligosacáridos (TGOS) y los oligosacáridos de soja, y los polisacáridos como la inulina de fructano, el almidón, la celulosa, la hemicelulosa y la pectina. De forma natural se encuentran en alimentos como cereales, frutas, plátanos, espárragos, alcachofas, tomates, ajo, cebolla, linaza, avena, cebada y trigo. En algunos casos son producidos artificialmente como la lactulosa, GOS, FOS, maltooligosacáridos, ciclodextrinas y lactosacarosa.51, 52
En cuanto a evidencias, se han publicado algunos ECAs utilizando inulina, TGOS y FOS. En ellos se ha observado mejoría clínica significativa de síntomas globales, flatulencia y distensión en pacientes con SII, así como cambios en la composición de la microbiota, entre los que se destaca un aumento de la proporción de bifidobacterias, con una consecuente generación de ácidos grasos de cadena corta, cuya presencia en el intestino se asocia con mejoría de síntomas en pacientes con SII.51-53
4.2 Probióticos
Los probióticos son «microorganismos vivos» que, administrados en cantidades adecuadas, confieren un efecto beneficioso en la salud del huésped. Los probióticos se han usado ampliamente, demostrando mejorar la función de barrera intestinal, estimular el sistema inmune, producir efectos antibacterianos, modular la motilidad intestinal y reducir dolor visceral.51, 52
Inicialmente se publicaron revisiones sistemáticas y metaanálisis agrupando ECAs que evaluaban la eficacia de probióticos monocepa en el tratamiento de SII. Los resultados mostraban beneficios en cuanto a mejoría global de síntomas y disminución de dolor, distensión y flatulencia.54 En el año 2009 se publicó una revisión sistemática que hacía diferenciaciones entre las distintas cepas probióticas, concluyendo que el bifidobacterium infantis 35624 mejoraba significativamente el dolor abdominal, malestar, distensión y/o dificultad evacuatoria, y que ningún otro probiótico mostraba mejoría significativa en el SII.55 Estas conclusiones no pudieron ser ratificadas en un metaanalisis publicado en el 2017, en el que se observaron diferencias significativas en cuanto a mejoría de distensión pero no en cuanto al dolor abdominal en pacientes con SII tratados con bifidobacterium infantis 35624. Sin embargo, en este estudio se observó que la mejoría del dolor abdominal era significativa en aquellos pacientes que utilizaron bifidobacterim infantis 35624 como parte de una fórmula multicepa.56
Actualmente existe una tendencia a utilizar fórmulas multicepa en detrimento de los probióticos individuales. Un metaanálisis de 2014 que incluyó fórmulas multicepa reportó un NNT de 7 en cuanto a mejoría global de síntomas en pacientes con SII. También se reportaron diferencias significativas en cuanto a mejoría de dolor abdominal, distensión y flatulencia.57
En el 2018 se publicó un documento internacional de consenso sobre la utilidad de los probióticos en el tratamiento de síntomas gastrointestinales bajos. Esta revisión sistemática que incluyó 70 ECAs (54 productos y 108 cepas) concluyó con un 100% de acuerdo, basándose en evidencias de nivel alto, de que existen probióticos específicos que reducen significativamente los síntomas generales y el dolor abdominal en pacientes con SII, con un perfil de seguridad favorable.58
4.3 Antibióticos
4.3.1 Rifaximina
La rifaximina es un antibiótico oral no absorbible de amplio espectro, que se aprobó en el 2015 para el tratamiento de SII/D (550 mg tres veces por día durante 2 semanas), siendo bien tolerado y con un perfil de seguridad similar al placebo.59, 60
Varios estudios sugieren que la rifaximina disminuye la respuesta proinflamatoria del huésped a productos bacterianos, restablece la diversidad microbiana de la microbiota y tiene eficacia antibiótica contra el SIBO, que ocupa un papel importante en el SII.60
Un metaanálisis que incluyó 5 ECAs con 1803 pacientes mostró diferencias significativas con rifaximina en relación a mejoría global de síntomas y dolor abdominal en SII. Sin embargo, el NNT obtenido en ambos casos fue 10, estadísticamente significativo, aunque clínicamente discutible.61 En el 2016 se publicó otro metaanálisis que incluyó los mismos ECAs, en el que se observó que la mejoría global de síntomas y la distensión abdominal eran significativas después de 10 semanas de seguimiento.62
Existen estudios en los que se utilizó rifaximina en pacientes con constipación, mostrando mejoría de síntomas al asociarlo a neomicina.63 Se demostró también que la administración de rifaximina reduce la producción de metano y acelera el tránsito colónico.64
4.4 Trasplante de microbiota fecal (FMT)
Se han publicado varios estudios utilizando FMT en el SII; sin embargo, son muestras pequeñas. Se reportan tasas de respuesta a corto plazo (1-3 meses) de entre 70 a 85%, mientras a largo plazo (6 meses a > 1 año) varían entre 45% y 60%. Se informó alivio considerable de síntomas globales y mejoría en la calidad de vida. La disminución de los efectos con el tiempo sugiere que debe repetirse el FMT a intervalos regulares.65
Conclusiones
El SII es uno de los motivos más frecuentes de consulta tanto a médicos generalistas como a gastroenterólogos. En EE.UU. da cuenta de 2,4 a 3,5 millones de consultas anuales, lo que lo transforma en el diagnóstico más frecuente de la práctica gastroenterológica (aproximadamente 28%) y uno de los más frecuentes de las consultas de atención primaria (aproximadamente 12%). No constituye una enfermedad que ponga en peligro la vida; sin embargo, tiende a aparecer y desaparecer a lo largo de la misma, produciendo deterioro en la calidad de vida del paciente. De las personas que lo padecen, solo el 10% buscan atención médica, mientras que otros recurren a la automedicación. Se estima que el SII afecta al 10-20% de la población, de acuerdo con distintos criterios diagnósticos.1, 2
A pesar de que la mayoría de las guías diagnósticas-terapéuticas nos proponen el tratamiento de acuerdo al síntoma principal, creemos que la búsqueda de una explicación fisiopatológica más profunda nos permitiría un tratamiento más eficaz para estos pacientes.
Es así que planteamos el tratamiento del SII en tres niveles. El primero, clásico, comenzando con una buena relación médico paciente seguida de un enfoque tradicional donde se busca solucionar el síntoma principal (dolor, diarrea, constipación). El segundo, central, con la utilización de psicofármacos y/o terapias psicológicas, y el tercero la modulación de la microbiota intestinal. Estos tratamientos no requieren un orden preestablecido y se pueden proponer en forma conjunta.
La evidencia analizada sugiere que los probióticos, la rifaximina, los antiespasmódicos, los antidepresivos, los agonistas de guanilatociclasa C y la lubiprostona parecen ser de utilidad en el control de síntomas de SII, con un perfil de seguridad favorable.1, 2, 5, 7
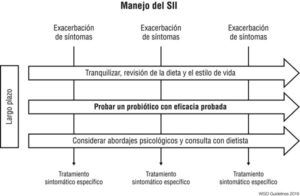
La guía de la WGO nos propone un formato para el manejo de SII que puede ser de utilidad para nuestros pacientes (Figura 2).66
El avance del conocimiento de la fisiopatología del SII nos va permitir continuar con nuevas alternativas terapéuticas, cada vez más eficaces.
Conflicto de interés. Los autores declaran no tener conflicto de interés al momento de la elaboración de este artículo.
Sostén financiero. Nada que declarar.
Figura 2. Guía de la WGO que propone el manejo del SII.
Referencias
- Lacy B, Mearin F, Chang L, Chey W, Lembo A, Simren M, Spiller R. Rome IV Diagnostic Criteria for Functional Gastrointestinal Disorders. Bowel Disorders Gastroenterology 2016; 150: 1393-1407.
- Mearín F. Drug treatment of irritable bowel syndrome: an unmet need. Gastroenterol Hepatol 2007; 3: 130-137.
- Flik CE, Bakker L, Laan W, van Rood YR, Smout AJ, de Wit NJ. Systematic review: The placebo effect of psychological interventions in the treatment of irritable bowel syndrome. World J Gastroenterol 2017; 23: 2223-2233.
- Halpert A. Irritable Bowel Syndrome: Patient-Provider Interaction and Patient Education. J Clin Med 2018; 7: 3.
- Chey WD. A Review of an Adjunct Clinical Symposium of the American College of Gastroenterology Meeting October 16, 2016. Las Vegas, Nevada. Gastroenterol Hepatol (NY) 2017; 13: 1-16.
- Pourmand H, Esmaillzadeh A. Consumption of a Low Fermentable Oligo-, Di-, Mono-saccharides, and Polyols Diet and Irritable Bowel Syndrome: A Systematic Review. Int J Prev Med 2017; 8: 104.
- Ford AC, Moayyedi P, Chey WD, Harris LA, Lacy BE, Saito YA, Quigley EMM. ACG Task Force on Management of Irritable Bowel Syndrome. American College of Gastroenterology Monograph of management of IBS. Am J Gastroenterol 2018; 113: 1-18.
- Dionne J, Ford AC, Yuan Y, Chey WD, Lacy BE, Saito YA, Quigley EMM, Moayyedi P. A Systematic Review and Meta-Analysis Evaluating the Efficacy of a Gluten-Free Diet and a Low FODMAPs Diet in Treating Symptoms of Irritable Bowel Syndrome. Am J Gastroenterol 2018; 113: 1290-1300.
- Staudacher HM, Lomer MC, Anderson JL. Fermentable carbohydrate restriction reduces luminal bifidobacteria and gastrointestinal symptoms in patients with irritable bowel syndrome. J Nutr 2012; 142: 1510-1518.
- Huaman JW, Mego M, Manichanh C. Efects of prebiotics vs. diet low in Fodmaps in patients with functional gut disorders. Gastroenterol 2018; 155: 1004-1007.
- Singh R, Salem A, Nanavati J, Mullin GE. The Role of Diet in the Treatment of Irritable Bowel Syndrome: A Systematic Review. Gastroenterol Clin N Am 2018; 47: 107-137.
- Skodje GI, Sarna VK, Minelle IH, Rolfsen KL, Muir JG, Gibson PR, Veierød MB, Henriksen C, Lundin KEA. Fructan, Rather Than Gluten, Induces Symptoms in Patients With Self-Reported Non-Celiac Gluten Sensitivity. Gastroenterology 2018; 154: 529.
- Gibson PR, Newnham E, Barrettt JS, Shepherd SJ, Muir JG. Review article: fructose malabsorption and the bigger picture. Aliment Phamacol Ther 2007; 25: 349-363.
- Shepherd SJ, Lomer MC, Gibson PR. Short chain carbohydrates and functional gastrointestinal disorders. Am J Gastroenterol 2013; 108: 707-717.
- Ford AC, Talley NJ, Spiegel BM, Foxx-Orenstein AE, Schiller L, Quigley EM, Moayyedi P. Effect of fibre, antispasmodics, and peppermint oil in the treatment of irritable bowel syndrome: systematic review and meta-analysis. The BMJ 2008; 337: a2313.
- Trinkley K, Nahata MC. Medication management of irritable bowel syndrome. Digestion 2014; 89: 253-267.
- Poynard T, Naveau S, Mory B, Chaput JC. Meta-analysis of smooth muscle relaxant in the treatment of irritable bowel syndrome. Aliment Pharmacol Ther 1994; 8: 499-510.
- Martínez-Vázquez MA, Vázquez-Elizondo G, González-González JA, Gutiérrez-Udave R, Maldonado-Garza HJ, Bosques-Padilla FJ. Effect of antispasmodic agents, alone or in combination, in the treatment of Irritable Bowel Syndrome: Systematic review and meta-analysis. Revista de Gastroenterología México 2012; 77: 82-90.
- Ruepert L, Quartero AO, de Wit NJ, van der Heijden GJ, Rubin G, Muris JW. Bulking agents, antispasmodics and antidepressants for the treatment of irritable bowel syndrome. Cochrane Database Syst Rev 2011; 8: CD003460.
- Ducrotte P, Grimaud JC, Dapoigny M, Personnic S, O’Mahony V, Andro-Delestrain MC. On-demand treatment with alverine citrate/simeticone compared with standard treatments for irritable bowel syndrome: results of a randomised pragmatic study. Int J Clin Pract 2014; 68: 245-254.
- Khanna R, MacDonald JK, Levesque BG. Peppermint Oil for the Treatment of Irritable Bowel Syndrome A Systematic Review and Meta-analysis. J Clin Gastroenterol 2014; 48: 505-512.
- Cash BD, Epstein MS, Shah SM. A novel delivery system of peppermint oil is an effective therapy for irritable bowel syndrome symptoms. Dig Dis Sci 2016; 61: 560-571.
- Fragkos KC. Spotlight on eluxadoline for the treatment of patients with irritable bowel syndrome with diarrhea. Clin Exp Gastroenterol 2017; 10: 229-240.
- Harinstein L, Wu E, Brinke A. Postmarketing cases of eluxadoline-associated pancreatitis in patients with or without a gallbladder. Aliment Pharmacol Ther 2018; 47: 809-815.
- Brandt LJ, Chey WD, Foxx-Orenstein AE, Schiller LR, Schoenfeld PS, Spiegel BM, Talley NJ, Quigley EM. An evidence-based position statement on the management of irritable bowel syndrome. Am J Gastroenterol 2009; 104: S1-S35.
- Efskind PS, Bernklev T, Vatn MH. A Double-Blind Placebo-Controlled Trial with Loperamide in Irritable Bowel Syndrome. Scand J Gastroenterol 1996; 31: 463468.
- Odunsi-Shiyanbade ST, Camilleri M, McKinzie S, Burton D, Carlson P, Busciglio IA, Lamsam J, Singh R, Zinsmeister AR. Effects of chenodeoxycholate and a bile acid sequestrant, colesevelam, on intestinal transit and bowel function. Clin Gastroenterol Hepatol 2010; 8:159.
- Camilleri M. Bile Acid diarrhea: prevalence, pathogenesis, and therapy. Gut Liver 2015; 9: 332-339.
- Friedel D, Thomas R, Fisher RS. Ischemic colitis during treatment with alosetron. Gastroenterology 2001; 120: 557-560.
- Bielefelldt K. Ischemic Colitis as a complication of medication use: An analysis of the Ferderal Adverse Event Reporting System. Dig Dis Sci 2016; 61: 2655-2665.
- Zheng Y, Yu T, Tang Y, Xiong W, Shen X, Jiang L, Lin L. Efficacy and safety of 5-hydroxytryptamine 3 receptor antagonists in irritable bowel syndrome: A systematic review and meta-analysis of randomized controlled trials. PLoS One 2017; 12: e0172846.
- Li F, Fu T, Tong WD, Liu BH, Li CX, Gao Y, Wu JS, Wang XF, Zhang AP. F Lubiprostone Is Effective in the Treatment of Chronic Idiopathic Constipation and Irritable Bowel Syndrome: A Systematic Review and Meta-Analysis of Randomized Controlled Trials Mayo Clin. Proc 2016; 91: 456-468.
- Shah ED, Kim HM, Schoenfeld P. Efficacy and Tolerability of Guanylate Cyclase-C Agonists for Irritable Bowel Syndrome with Constipation and Chronic Idiopathic Constipation: A Systematic Review and Meta-Analysis. Am J Gastroenterol 2018; 113: 329-338.
- Camilleri M. Ford AC. Pharmacotherapy for Irritable Bowel Syndrome. Journal of Clinical Medicine 2017; 6: 101.
- Chapman RW, Stanghellini V, Geraint M, Halphen M. Randomized Clinical Trial: Macrogol / PEG 3350 Plus Electrolytes for Treatment of Patients With Constipation Associated With Irritable Bowel Syndrome. Am J Gastroenterol 2013; 108: 1508-1515.
- Chen L, Ilham SJ, Feng B. Pharmacological Approach for Managing Pain in Irritable Bowel. Syndrome: A Review Article. Anesth Pain Med 2017; 7: e42747.
- Locke GR 3rd, Zinsmeister AR, Talley NJ, Fett SL, Melton LJ. Risk factors for irritable bowel syndrome: role of analgesics and food sensitivities. Am J Gastroenterol 2000; 95:157-165.
- Szigethy E, Schwartz M, Drossman D. Narcotic bowel syndrome and opioid-induced constipation. Curr Gastroenterol Rep 2014; 16: 410.
- Salari P, Abdollahi M. Systematic review of modulators of benzodiazepine receptors in irritable bowel syndrome: is there hope? World J Gastroenterol 2011; 17: 4251-4257.
- Camilleri M, Busciglio I, Carlson P, McKinzie S, Burton D, Baxter K, Ryks M, Zinsmeister AR. Pharmacogenetics of low dose clonidine in irritable bowel syndrome. Neurogastroenterol Motil 2009; 21: 399-410.
- Viramontes BE, Malcolm A, Camilleri M, Szarka LA, McKinzie S, Burton DD, Zinsmeister AR. Effects of an alpha (2)-adrenergic agonist on gastrointestinal transit, colonic motility, and sensation in humans. Am J Physiol Gastrointest Liver Physiol 2001; 281: G1468-G1476.
- Houghton LA, Fell C, Whorwell PJ, Jones I, Sudworth DP, Gale JD. Effect of a second-generation alpha2delta ligand (pregabalin) on visceral sensation in hypersensitive patients with irritable bowel syndrome. Gut 2007; 56: 1218-1225.
- Lee KJ, Kim JH, Cho SW. Gabapentin reduces rectal mechanosensitivity and increases rectal compliance in patients with diarrhoea-predominant irritable bowel syndrome. Aliment Pharmacol Ther 2005; 22: 981-988.
- Chey WD, Lembo AJ, Rosenbaum DP. Tenapanor Treatment of Patients With Constipation-Predominant Irritable Bowel Syndrome: A Phase 2, Randomized, Placebo-Controlled Efficacy and Safety Trial. Am J Gastroenterol 2017; 112: 763-774.
- O`Sullivan M. Therapeutic potential of ketotifen in irritable bowel syndrome (IBS) may involve changes in mast cells at sites beyond the rectum. Gut 2011; 60: 423.
- Leri O, Tubili S, De Rosa FG, Addessi MA, Scopelliti G, Lucenti W, De Luca D. Management of diarrhoeic type of irritable bowel syndrome with exclusion diet and disodium cromoglycate. Inflammopharmacology 1997; 5: 153-158.
- Xie C, Tang Y, Wang Y, Yu T, Wang Y, Jiang L, Lin L. Efficacy and Safety of Antidepressants for the Treatment of Irritable Bowel Syndrome: A Meta-Analysis. PLoS One 2015; 10: e0127815.
- Ford AC, Lacy BE, Harris LA, Quigley EMM, Moayyedi P. Effect of Antidepressants and Psychological Therapies, Including Hypnotherapy, in Irritable Bowel Syndrome: Systematic Review and Meta-Analysis. Am J Gastroenterol 2014; 109: 1350-1365.
- Kisinger S. Cognitive-behavioral therapy for patients with irritable bowel syndrome: current insights. Psychology Research and Behavior Management 2017; 10: 231-237.
- Laird KT, Tanner-Smith EE, Russell AC, Hollon SD, Walker LS, Comparative efficacy of psychological therapies for improving mental health and daily functioning in irritable bowel syndrome: A systematic review and meta-analysis. Clinical Psychology Review 2017; 51: 142-152.
- Matthew J. Plummer NT. Part 2: Treatments for Chronic Gastrointestinal Disease and Gut Dysbiosis. Integrative Medicine 2015; 14: 25-33.
- Sterm E. Brenner DM. Gut Microbiota-Based Therapies for Irritable Bowel Syndrome Clinical and Translational. Gastroenterology 2018; 9: e134.
- Rodin˜o-Janeiro BK, Vicario M, Alonso-Cotoner C, Pascua-García R, Santos J. A Review of Microbiota and Irritable Bowel Syndrome: Future in Therapies. Adv Ther 2018; 35: 289-310.
- Hoveyda N, Heneghan C, Mahtani KR, Perera R, Roberts N, Glasziou P. A systematic review and meta-analysis: probiotics in the treatment of irritable bowel syndrome. BMC Gastroenterol 2009; 9: 15.
- Brenner D, Moeller MJ, Chey WD, Schoenfeld PS. The Utility of Probiotics in the Treatment of Irritable Bowel Syndrome: A Systematic Review. Am J Gastroenterol 2009; 104: 1033-1049.
- Yuan F, Ni H, Asche CV, Kim M, Walayat S, Ren J. Efficacy of Bifidobacterium infantis 35624 in patients with irritable bowel syndrome: a metaanalysis. Curr Med Res Opin 2017; 33: 1191-1197.
- Ford A, Quigley EM, Lacy BE, Lembo AJ, Saito YA, Schiller LR, Soffer EE, Spiegel BM, Moayyedi P. Efficacy of Prebiotics, Probiotics, and Synbiotics in Irritable Bowel Syndrome and Chronic Idiopathic Constipation: Systematic Review and Meta-analysis. Am J Gastroenterol 2014; 109: 1547-1561.
- Hungin A, Mitchell CR, Whorwell P, Mulligan C, Cole O, Agréus L, Fracasso P, Lionis C, Mendive J, Philippart de Foy JM, Seifert B, Wensaas KA, Winchester C, de Wit N; European Society for Primary Care Gastroenterology Systematic review: probiotics in the management of lower gastrointestinal symptoms – an updated evidence-based international consensus. Aliment Pharmacol Ther 2018; 47: 1054-1070.
- Ford AC, Moayyedi P, Lacy BE, Lembo AJ, Saito YA, Schiller LR, Soffer EE, Spiegel BM, Quigley EM; Task Force on the Management of Functional Bowel Disorders. American College of Gastroenterology monograph on the management of irritable bowel syndrome and chronic idiopathic constipation. Am J Gastroenterol 2014; 109: S26-S27.
- Pimentel M. Review article: potential mechanisms of action of rifaximin in the management of irritable bowel syndrome with diarrhoea. Aliment Pharmacol Ther 2016; 43: 37-49.
- Menees SB, Maneerattannaporn M, Kim HM, Chey WD. The Efficacy and Safety of Rifaximin for the Irritable Bowel Syndrome: A Systematic Review and Meta-Analysis Am J Gastroenterol 2012; 107: 28-35.
- Jun L, Zhu W, Liu W, Wu Y, Wu B. Rifaximin for Irritable Bowel Syndrome A Meta-Analysis of Randomized Placebo-Controlled Trials. Medicine (Baltimore) 2016; 95: e2534.
- Pimentel M, Chang C, Chua KS, Mirocha J, DiBaise J, Rao S, Amichai M. Antibiotic treatment of Constipation-Predominant Irritable Bowel Syndrome. Dig Dis Sci 2014; 59: 1278-1285.
- Ghoshal UC, Srivastava D, Misra A. A randomized double-blind placebo-controlled trial showing rifaximin to improve constipation by reducing methane production and accelerating colon transit: A pilot study. Indian J Gastroenterol 2018; 37: 416-423.
- El-Salhy M, Mazzawi T. Fecal microbiota transplantation for managing irritable bowel syndrome. Expert Review of Gastroenterology & Hepatology 2018; 12: 439-445.
- Quigley EM, Fried M, Gwee KA, Khalif I, Hungin AP, Lindberg G, Abbas Z, Bustos Fernández LM, Bhatia SJ, Schmulson M, Olano C, LeMair A; Review Team: World Gastroenterology Organisation Global Guidelines Irritable Bowel Syndrome: A Global Perspective Update September 2015. J Clin Gastroenterol 2016; 50: 704-713.
Correspondencia: Ignacio Hanna Jairala
Cañar 609 y Coronel. Hospital Alcivar, Centro Médico 1, Piso 2. Guayaquil, Ecuador / Tel.: +59342344259 / +593999420867
Correo electrónico: ihann@hotmail.com
Acta Gastroenterol Latinoam 2019;49(4):381-393
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE