Seguimiento biomédico del proceso de trasplante intestinal y su correlación con los distintos eventos fisiopatológicos que atraviesa el paciente.
Gabriel E Gondolesi,1-5 Dominik Meier,1-3 Carolina Rumbo,1-3 Diego Ramisch,1 Constanza Echevarría,1 Fabio Nachman,1 Melisa Pucci Molineris,1, 3 María Inés Martínez,1 Pablo Barros Schelotto,1 Ana Cabanne,1 Héctor Solar,1 Martín Rumbo 1, 3, 6
1 Unidad de Soporte Nutricional, Rehabilitación y Trasplante Intestinal. Hospital Universitario Fundación Favaloro.
2 Unidad de Hepatología, Cirugía Hepatobiliar y Trasplante Hepático. Hospital Universitario Fundación Favaloro.
3 Unidad de Investigación Traslacional e Inmunología Asociada al Trasplante. Universidad Favaloro.
4 Adjunct Associate Profesor of Surgery, Recanati/Miller Transplantation Institute, Mount Sinai Hospital, New York.
5 Investigador Clínico del CONICET.
6 Investigador del CONICET.
Recibido: 26/12/2014 / Aprobado: 03/08/2015
* Trabajo que obtuvo la 1ra Mención al Mérito, Premio Anual Florencio Fiorini año 2014 en el tema: “Avances en Gastroenterología”.
Resumen
Uno de los mayores avances de la gastroenterología y la cirugía de los últimos 50 años ha sido el poder trasplantar los distintos órganos del aparato digestivo abdominal por separado o en su conjunto. La complejidad del trasplante intestinal llevó a la necesidad de crear equipos multidisciplinarios dedicados al manejo de pacientes con insuficiencia intestinal para definir la necesidad de soporte nutricional, rehabilitación o trasplante intestinal. Asimismo, cabe agregar que como parte de este núcleo se debe contar con áreas de investigación básica que permitan dar respuestas a problemas de la clínica aún no resueltos. El objetivo del siguiente trabajo es el de establecer la situación actual del trasplante intestinal, presentar los avances y resultados alcanzados en nuestro centro, enfatizando el desarrollo logrado en el área clínica y las contribuciones hechas como producto de estudios de investigación traslacional y de la inmunología de mucosas en una unidad integral de insuficiencia intestinal, rehabilitación y trasplante. Lo reportado en el mismo permitirá mostrar que el trasplante intestinal se ha establecido como una opción terapéutica en nuestro país y Latinoamérica con resultados a largo plazo que ubican a nuestro servicio al nivel de los mejores centros del mundo con publicaciones clínicas, básicas y traslacionales que nos han permitido constituirnos como referentes en la especialidad.
Palabras claves. Intestino, trasplante, mucosa, inmunología, investigación traslacional.
Intestinal transplantation from the clinic to translational research
Summary
One of the greatest achievements in gastroenterology and surgery of the last 50 years has been the capability to transplant different abdominal organs of the digestive system separately or as a whole. The complexity of the intestinal transplantation demands a multidisciplinary team engaged in the ma nagement of patients with intestinal failure responsible for defining the need for nutritional support, rehabilitation, or intestinal transplantation. This team should include a basic research area to provide answers to unresolved clinical problems. The aim of this work is to update the current status of intestinal transplantation, and to show the progress and results of our center; emphasizing our achievements in the clinical area, and the contributions of the translational research and mucosal immunology studies as part of the integral unit of intestinal failure, rehabilitation and transplantation. The data reported here demonstrate that the intestinal transplantation has been established as a therapeutic option in our country and Latin America, with long term results that have ranked our service at the level of the best centers in the world positioning us as referent in the specialty.
Key words. Intestine, transplantation, mucosa, immunology, translational research.
Abreviaturas
TxI: trasplante intestinal.
II: insuficiencia intestinal.
NPT: nutrición parenteral total.
TIA: trasplante de intestino aislado.
TMV: trasplante multivisceral.
TMVm: trasplante multivisceral modificado.
TC: trasplante combinado hígado-intestino.
Uno de los mayores avances de la gastroenterología y la cirugía de los últimos 50 años ha sido el de poder trasplantar los distintos órganos del aparato digestivo abdominal por separado o en su conjunto. Desde su descripción inicial, la experiencia mundial ha ido creciendo en un número limitado de centros con resultados que comienzan a compararse al de los trasplantes de otros órganos sólidos.1-4 A pesar de los recientes avances, las indicaciones, el momento oportuno de la derivación, la morbimortalidad asociada al procedimiento y el seguimiento post-trasplante continúan siendo una incógnita para muchos profesionales de la salud que se encuentran al cuidado de posibles candidatos. De la misma manera, términos como insuficiencia intestinal (II) o falla a la nutrición parenteral total (NPT), no son parte del conocimiento básico durante la formación médica; como tampoco se ha establecido aún la necesidad de integrar la NPT, la rehabilitación intestinal y el trasplante como el trípode básico para la evaluación pronóstica, la atención primaria y el planeamiento estratégico de las opciones terapéuticas a corto, mediano y largo plazo en pacientes con II.
El objetivo del siguiente trabajo es establecer la situación actual del trasplante intestinal (TxI) y presentar los avances y resultados alcanzados en nuestro centro, enfatizando el desarrollo logrado en el área clínica y las contribuciones hechas como producto de estudios de investigación traslacional y de la inmunología de las mucosas, en una unidad integral de II, rehabilitación y trasplante.
Reseña histórica
Los primeros trabajos experimentales sobre TxI se remontan a principios del siglo pasado (1901) como parte de las experiencias realizadas por Alexis Carrel con anastomosis vasculares.5, 6 Recién más de medio siglo después, en 1959, Richard Lillehei en la Universidad de Minnesota, desarrolló el primer modelo canino de trasplante de intestino aislado (TIA), seguido al poco tiempo por Thomas Starzl, quien concibió el primer trasplante multivisceral (TMV) incluyendo como parte del injerto no sólo el intestino, sino también hígado, estómago, páncreas, duodeno y colon.7 Si bien ambos logran demostrar su factibilidad técnica, la sobrevida alejada se vio comprometida por la falta de inmunosupresión adecuada. Simultáneamente, la NPT se encontraba en sus inicios y los pacientes con catástrofes intestinales eran tratados sólo con medidas de soporte hasta que se compensaban o morían de desnutrición en cuidados paliativos. A pesar de los resultados obtenidos, rápidamente se pasó del laboratorio a la clínica y en 1964 Ralph Deterling en Boston realiza el primer TIA en humanos (caso no publicado), seguido nuevamente por Lillehei, quien en 1967 publica el primer TIA en humanos. A esta experiencia inicial le siguieron siete casos más, los cuales tuvieron las mismas causas de fracaso observadas en el laboratorio: rechazo y sepsis.8 Estas vivencias fueron repetidas por Starzl en Pittsburgh con las mismas causas de fracaso.5-7 En 1968, Okumura y colaboradores realizan en San Pablo, Brasil, las primeras dos experiencias clínicas en Latinoamérica en receptores adultos, quienes fallecen en el post-trasplante inmediato.9
La carrera por el desarrollo de este trasplante se detuvo hasta la década del `80 con la aparición de la ciclosporina llevando a reiniciar la experiencia clínica, la cual fue entonces necesaria no sólo por el hecho de mostrar la factibilidad del procedimiento sino porque se empezaron a observar, con frecuencia progresiva, las complicaciones asociadas a la NPT:10 la pérdida de accesos vasculares, la sepsis recurrente del catéter y la colestasis asociada a la NPT; esto generó la incógnita de qué ofrecerles después a estos pacientes, quienes fueron considerados como portadores de “falla” al soporte parenteral y eran derivados para trasplante, en condiciones extremadamente críticas y en general como candidatos a trasplante de hígado e intestino. En esta década Delta and Kiel en Alemania, David Grant en Canadá11 y nuevamente el grupo de Thomas Starzl publicaron los primeros casos y series de TIA, trasplante combinado (TC) en bloque y TMV con sobrevida alejada (57% y 50% a 1 y 3 años respectivamente). En la década del `90 la aparición del FK-506 o tacrolimus, el desarrollo de diferentes innovaciones técnicas y la experiencia alcanzada por centros dedicados hicieron que el TxI sea aceptado como una opción terapéutica válida para pacientes con II e imposibilidad de continuar en soporte parenteral, estimulándose además la derivación precoz que llevaría finalmente a la mejoría de los resultados.5-6 Finalmente, en octubre del año 2000 el TxI deja de ser una práctica experimental para ser considerado una práctica clínica estándar y aprobada para su financiamiento por el Health Care Financial Administration en Estados Unidos, sólo en centros con una experiencia mayor a diez trasplantes y sobrevida mínima del paciente de 65% al año. Sólo cuatro centros calificaron para esta aprobación, Mount Sinai Medical Center (Nueva York) y los centros médicos de las Universidades de Pittsburgh, Miami y Nebraska.4 El último reporte del registro mundial de trasplante intestinal presentado en Oxford en junio de 2013 mostró que desde enero de 1985 a febrero del 2013, un total de 2.887 trasplantes intestinales han sido realizados, 1.309 fueron TIA (45,3%), 898 TC (31,2%) y 539 TMV (23,5%), observándose desde el año 2007 una reducción en el número de procedimientos anuales realizados, como resultado de la mejoría en el manejo del soporte nutricional y de las técnicas de rehabilitación intestinal.12
Insuficiencia intestinal
Se define a la II como la incapacidad del tracto gastrointestinal para digerir y absorber suficientes nutrientes para mantener un balance hidroelectrolítico normal, permitir el crecimiento y garantizar el estado de salud.13 Estos individuos requieren de soporte nutricional parenteral para mantener el equilibrio calórico, hídrico y/o electrolítico, además de permitir el crecimiento en los niños.12, 13 Según la duración, la II puede ser aguda (menor a 6 meses) o crónica (mayor a ese lapso) y, de acuerdo a la reversibilidad del cuadro, puede dividirse en transitoria (reversible) o permanente (irreversible). Desde el punto de vista fisiopatológico hay dos tipos de II: la primera es consecuencia de una reducción de la masa o longitud intestinal total, cuyo principal exponente es el síndrome de intestino corto secundario a una resección masiva del intestino delgado (se define a su vez como masiva la resección cuando el remanente de intestino delgado medido desde el ángulo de Treitz es menor a 150 cm en adultos y 40 cm en niños). En el segundo tipo de II, la longitud intestinal es normal pero existe un trastorno en la función motora (pseudo-obstrucción crónica intestinal, la enfermedad de Hirschsprung de segmento extendido, miopatías viscerales) o absortiva epitelial (enteropatía tuffting, displasia intestinal o la enfermedad por inclusión por microvellosidades) que determina la existencia de la insuficiencia.2 Las etiologías más frecuentes de la II son sin duda las responsables del síndrome de intestino corto.14-16
Todo paciente portador de II, independientemente de su causa, deberá ser evaluado en forma multidisciplinaria con el objetivo de estimar las posibilidades de rehabilitación intestinal. La premisa actual de las unidades especializadas en el tratamiento de la II es que “todo paciente que ingresa para evaluación a una unidad de trasplante debe ser primero un potencial candidato a rehabilitación”. La mejor manera de favorecer la rehabilitación intestinal es incrementar en forma progresiva el aporte enteral de nutrientes, prevenir y tratar el déficit de vitaminas y oligoelementos como así también el sobrecrecimiento bacteriano. La cirugía puede tener lugar en aquellos que tengan fístulas, ostomías terminales o existan segmentos de intestino abandonados en el abdomen (cirugía de reconstrucción autóloga) o bien la dilatación intestinal en el contexto de un síndrome de intestino corto los convierta en candidatos a cirugía de elongación intestinal (Bianchi o STEP).17, 18 Existen predictores anátomo-clínicos de dependencia a la NPT (es decir, que la II sea irreversible), habiéndose identificado que pacientes adultos con < 100 cm de intestino delgado o pediátricos con < 30 cm, que presentan una yeyunostomía terminal o la falta de la válvula ileocecal y > 2 años en NPT, tendrán > 90% de posibilidades de necesitar soporte nutricional parenteral permanente. Se ha estimado que del grupo de pacientes a permanecer indefinidamente en NPT sólo 15 a 20% podrán ser candidatos a TxI. Los pacientes portadores de II irreversible requerirán de NPT, para mantener el equilibrio hídrico, calórico y electrolítico; la NPT en su forma domiciliaria ha permitido extender la sobrevida de estos pacientes constituyéndose como la alternativa terapéutica primaria.19, 20
Indicaciones actuales del trasplante intestinal y tipos de trasplante a indicar
Las indicaciones para el TxI son aquellas complicaciones que llevan a la imposibilidad de continuar con la NPT. De ellas la insuficiencia hepática asociada a la NPT, la pérdida de accesos vasculares y la sepsis recurrente a punto de partida del acceso vascular han sido aceptadas internacionalmente como las principales causas que llevan a indicar el trasplante.21 La tasa de complicaciones asociadas a la NPT es de 0,9/paciente/año; otra forma de expresarlo es decir que los pacientes en NPT desarrollarán uno a cuatro infecciones del catéter/1.000 días de soporte, 5 al 28% de ellos desarrollarán trombosis de sus accesos y que en general el 47% desarrollarán alteraciones bioquímicas o histológicas hepáticas a cinco años de iniciado el soporte.22, 23 Si un paciente es portador de II y falló la NPT pero con función hepática normal, deberá indicarse un TIA, de igual forma si dentro de los signos de falla al soporte parenteral presenta colestasis pero con biopsia hepática con fibrosis leve (< a grado 3) ya que se ha podido demostrar la regresión de la misma luego del TIA.24 Si por el contrario la biopsia excede este criterio, debemos indicar un TC. La indicación del TMV actualmente se encuentra limitada a aquellos pacientes portadores de trombosis porto-mesentérica difusa o tumores que comprometen el mismo eje y que sólo serán resecables con el reemplazo de los órganos involucrados; en estos casos los pacientes serán beneficiarios de esta opción quirúrgica sin ser portadores de criterios de II. Otras indicaciones están dadas por existir alguna necesidad técnica agregada a la II y hepática. El último tipo de trasplante multivisceral desarrollado es el denominado TMV modificado (TMVm) y consiste en implantar todo el tubo digestivo, es decir, estómago, páncreas, intestino y colon derecho de un donante cadavérico, pero preservando el hígado del receptor, éste ha sido uno de los mayores avances técnicos y tiene indicaciones muy precisas como son tumores de la raíz del mesenterio o el síndrome de Peutz-Jegher.25-29
Aspectos técnicos del trasplante intestinal
Como fuera descripto en sus comienzos hace más de 50 años, el trasplante de intestino consiste en la utilización del yeyuno-íleon como parte de un injerto único o como parte de un injerto multiorgánico, existiendo tres procedimientos básicos: TIA, TC y TMV (Figura 1) con claras indicaciones ya expuestas y cuyos detalles quirúrgicos se mencionarán en esta sección.
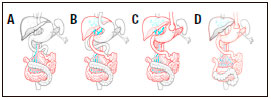
Figura 1. Tipos de trasplante intestinal. A. Trasplante de intestino aislado (TIA). B. Trasplante combinado hepato-intestinal (TC). C. Trasplante multivisceral (TMV). D. TMV modificado (TMVm). En colores se destacan los órganos trasplantados en cada tipo de procedimiento y en gris los órganos remanentes del receptor.
- Trasplante de intestino aislado (TIA): Este tipo de trasplante tiene dos variantes de acuerdo al territorio venoso de drenaje de la vena mesentérica superior del injerto, con drenaje venoso mesentérico o con drenaje sistémico (a vena cava inferior). En aquellos receptores que cuentan con dominio abdominal, como los pacientes portadores de pseudoobstrucción crónica intestinal, el implante se realiza sobre los vasos mesentéricos. Este procedimiento es el más fisiológico ya que conserva el pasaje hepático, pero el 80% de los potenciales receptores son pacientes con síndrome de intestino corto, motivo por el cual no será posible proceder con el implante propuesto previamente. En estos casos, una vez completa la enterectomía del intestino insuficiente residual, se procede a exponer la arteria aorta y la vena cava infrarrenal, donde se colocan injertos de interposición libres utilizando la arteria y la vena ilíaca cadavérica del mismo donante para luego sobre ellos implantar los vasos mesentéricos del injerto. El restablecimiento de la continuidad intestinal se inicia colocando un tubo de gastro-yeyunostomía para luego realizar la anastomosis proximal yeyuno-yeyunal, y finalmente realizar la reconstrucción distal mediante una anastomosis latero-terminal íleo-cólica, aproximadamente a 20 cm proximal al extremo del íleon, el cual se exteriorizará mediante una ileostomía terminal necesaria para el monitoreo del injerto con ileoscopías y biopsias de protocolo. Los conductos linfáticos no son reconstituidos; este punto tendrá importancia en las líneas de investigación traslacional.1, 7, 8, 27, 31
- Trasplante combinado hepato-intestinal (TC): Este procedimiento es quizá el más laborioso de los tres tipos básicos de TxI, sobre todo en la población pediátrica. Como se explicó previamente está indicado en aquellos pacientes con II que han desarrollado además cirrosis hepática asociada a la NPT. En líneas generales, el procedimiento combina la hepatectomía con preservación de la vena cava, como se hace en el trasplante hepático, y la enterectomía descripta para el TIA. Cuando el procedimiento se hace en bloque, se debe agregar un paso extra a lo ya explicado, que es la confección de un shunt porto-cava término-lateral o término terminal a la vena cava infra-hepática del hígado del donante, para asegurar el drenaje venoso del estómago, el duodeno-páncreas y el bazo nativos. En los pacientes adultos se puede realizar el trasplante en forma no compuesta, es decir, el hígado se implanta como si fuese un trasplante hepático clásico, no siendo necesaria la confección del shunt porto-cava; y el injerto intestinal se implanta como un TIA. La continuidad intestinal se establecerá en forma similar a la descripta en el trasplante aislado.32-36
- Trasplante multivisceral (TMV): Esta denominación ha sido utilizada clásicamente para la variante de trasplante que incluye estómago-duodeno-páncreas-yeyuno-íleon e hígado en bloque. Este procedimiento es el llamado clásico para diferenciarlo de aquel en el que el hígado no es utilizado por lo que se lo ha denominado: “multivisceral modificado” (TMVm). La diferencia con el trasplante combinado radica en que durante la exenteración abdominal se remueven también el estómago, el duodeno-páncreas y el bazo por lo que no se debe realizar el shunt porto-cava para asegurar el drenaje venoso. Se realiza en bloque una anastomosis venosa suprahepática-cava, implantándose un conducto arterial de la aorta del donante a la aorta infrarrenal del receptor. La continuidad intestinal se restablece proximalmente mediante la realización de una anastomosis esófago-gástrica, se realiza una piloromiotomía y piloroplastia, además de la colocación de un tubo de gastro-yeyunostomía a nivel proximal, y distalmente, de igual forma que en los procedimientos anteriores, se realiza una anastomosis íleo-colónica con ileostomía en chimenea. Como se mencionó previamente, en la actualidad se tiende a dejar el bazo como parte de este procedimiento y no es poco frecuente la necesidad de incluir un injerto renal, el cual se deja en continuidad con la vena cava inferior.15, 16, 27, 29-31, 34
Material y métodos
En marzo de 2006 se inicia la actividad de la Unidad de Soporte Nutricional, Rehabilitación y Trasplante Intestinal de nuestra institución; la misma fue creada siguiendo las normas del INCUCAI (Instituto Nacional Central Único Coordinador de Ablación e Implante, resolución no 151/01), bajo el modelo de trabajo multidisciplinario (gastroenterólogos, nutricionistas, cirujanos, radiólogos, enfermeros, trabajadores sociales, psicólogos, infectólogos, terapistas, pediatras) en el que los diferentes expertos participan en la atención de cada paciente con el objetivo de brindar a cada uno la mejor alternativa que permita devolverle la suficiencia nutricional, considerando al trasplante como la última de ellas.
Paralelamente y con el objetivo de cumplimentar la tarea asistencial con docencia e investigación se crea en la Universidad la Unidad de Investigación Traslacional e Inmunología Asociada al Trasplante. En la misma, investigadores básicos se suman al área clínica con el objetivo de interactuar y establecer líneas de investigación que contribuyan al seguimiento biomédico del paciente trasplantado y permitan devolver al área clínica respuestas sobre dudas que se presentan en la actividad diaria de disciplinas de alta complejidad.
Sobre esta base de trabajo clínico y básico integral, y luego de la aprobación por parte del Comité de Ética y de Docencia e Investigación de nuestra institución [DDI (1125)-511; nº 408/11; Acta Nº 308], se realizó el presente trabajo que tendrá como objetivos:
- Presentar el análisis retrospectivo y descriptivo actualizado de los pacientes trasplantados de intestino desde el inicio de las actividades del programa, que incluye variables demográficas, indicaciones, evolución y resultados de nuestro programa.
- Análisis de las células inmunes drenantes de la cavidad abdominal, descripción de una nueva técnica para evaluar el tráfico linfocitario y su correlación con la evolución clínica inmediata post-trasplante intestinal.
- Reporte de efecto de la inmunosupresión primaria en la constitución y función de las estructuras linfoides en el seguimiento alejado post-trasplante intestinal.
El reporte de los mismos se efectuará en tres módulos. Los estudios estadísticos realizados se describirán en cada uno de los reportes de resultados y fueron realizados utilizando SPSS versión 17 (Statistical Package for the Social Sciences, SPSS Inc., Chicago, IL, EE.UU.). Los estudios de investigación traslacional fueron financiados por fondos obtenidos PICT-2007, PICT-2012 de la Agencia (Ministerio de Ciencia y Tecnología).
Resultados
1) Análisis retrospectivo y descriptivo de los pacientes trasplantados de intestino
Entre marzo de 2006 y abril de 2014, el grupo médico registró los datos del seguimiento clínico de cada paciente en forma prospectiva incluyendo toda variable necesaria para el trasplante y junto a los investigadores de ciencias básicas se tomaron las muestras y procesó toda determinación específica para cada proyecto de investigación original, centralizado en lo que se dio a llamar: seguimiento biomédico del proceso de TxI y su correlación con los distintos eventos fisiopatológicos que atraviesa el paciente.
En el período de estudio recibimos 252 consultas de pacientes con II crónica irreversible y 4 consultas por pacientes sin II pero con la necesidad de evaluación para TxI; 147 pacientes adultos (adul) y 109 pacientes menores de 18 años (ped), (mediana: 33,8 años; rango: 0,3-85,4). De ellos, 88 fueron evaluados para trasplante: 26 adul, 62 ped (mediana: 4,7 años; rango: 0,1- 68,5). Del total de los pacientes evaluados, 8 están activos en lista de espera, 2 recibieron trasplante hepático aislado y 40 recibieron algún tipo de trasplante que incluyó el intestino (13 adul y 27 ped) y constituirán el grupo de estudio aquí presentado.
Del total de pacientes evaluados primariamente con II, solo en el 19% se ofreció el trasplante como alternativa para devolver la suficiencia intestinal; a 32% se le ofreció algún tipo de cirugía de rehabilitación y 49% continúan en soporte nutricional. La mediana de edad a la evaluación fue de 41,2 años (rango: 20,8-68,5) en los pacientes adul y de 1,4 años en los receptores ped (rango: 0,1-19,6). Los diagnósticos que causaron la II fueron: vólvulo intestinal (n: 10), enfermedad de Hirschsprung (n:6), isquemia intestinal (n: 3), atresia intestinal (n: 3), gastrosquisis (n: 2), trauma (n: 4), pseudoobstrucción crónica intestinal (POCI) (n: 2), enteritis necrotizante (n: 2), enfermedad por inclusión de microvellosidades (n: 2), complicaciones post-operatorias (n: 1), linfangioma quístico de la raíz del mesenterio (n: 1), trombosis porto-mesentérica difusa (n: 1) y síndrome de Peutz-Jeghers (n: 1); recientemente dos nuevas indicaciones asociadas al propio trasplante como son el re-trasplante por rechazo celular agudo en un caso o por rechazo crónico en otro. El 79% fueron portadores de síndrome de intestino corto al momento de la evaluación para el trasplante.
Los motivos que llevaron a la necesidad de la evaluación para el trasplante fueron: falta de accesos vasculares en 16 casos (40%); enfermedad hepática asociada a la nutrición parenteral e II en 9 casos (22,5%); sepsis recurrente del acceso central en 6 casos; alteraciones hidroelectrolíticas severas en 3 casos; trombosis porto-mesentérica difusa y sangrados digestivos recurrentes en 1 caso; tumor con compromiso del eje hepatoespleno-portal en 1 caso y otras en 5 casos. Debemos destacar que en los casos de trombosis porto-mesentérica difusa y el paciente con síndrome de Peutz-Jeghers el trasplante se indicó por la condición primaria no encontrándose los mismos en soporte parenteral.
El tiempo promedio en lista de espera fue de 179 ± 190 meses, fue significativamente menor en pacientes adul (53 ± 43,3 meses) vs ped (226 ± 176,4 meses) (p < 0,006). Cuatro pacientes se encontraban hospitalizados al momento del trasplante y 36 (90%) en su domicilio.
Del total de trasplantes realizados, 13 fueron adultos, todos trasplantes primarios y 27 trasplantes fueron realizados en 25 receptores ped (2 fueron re-trasplantes, 1 TIA y el segundo TMV).
De los 13 adultos, 10 recibieron TIA, 2 fueron TMV y 1 fue TMVm. De los trasplantes ped, 21 pacientes recibieron TIA, 3 fueron TC y 3 TMV. De los 31 TIA, 26 (84%) fueron realizados con drenaje venoso a la vena cava y 5 a la vena mesentérica superior. En 4 casos se implantó el colon derecho y 11 pacientes recibieron además un trasplante de la vaina del músculo recto anterior del abdomen del mismo donante para poder completar el cierre de la pared abdominal, debido a la pérdida del dominio abdominal.
Treinta y cinco trasplantes fueron realizados con donante isogrupo y 5 con heterogrupo compatibles. Todos los trasplantes se realizaron con pruebas de compatibilidad cruzada negativa prospectiva.
La longitud promedio del intestino implantado medido desde el ángulo de Treitz hasta la válvula íleo-cecal al final de la reperfusión fue de 324,7 ± 63,6 cm. El tiempo de isquemia total promedio fue de 7 hs 55 m ± 2 hs 3 min; el tiempo de isquemia caliente fue de 40 ± 10,8 min; no existiendo diferencias entre receptores adul y ped, ni por el tipo de trasplante.
El tiempo promedio de internación post-trasplante fue de 43 ± 40 días (48 ± 64 días adul y de 40 ± 21 días ped; p = NS). La permanencia en la unidad de cuidados intensivos fue menor en receptores adul (8,4 ± 9,5 días) comparado con el grupo de pacientes ped (18 ± 17 días), pero no fue estadísticamente significativa (p = NS).
Catorce pacientes recibieron como terapia inmunosupresora inducción con globulina anti-linfocítica: 5 TMV, 1 TMVm, 2 TC y 6 TIA (por cumplir condiciones de alto riesgo inmunológico pre-trasplante: recibir órganos heterogrupo o por estar hipersensibilizados y haber recibido tratamiento de desensibilización pre-trasplante) según protocolo. El resto recibió inducción con anticuerpos anti-receptor de interleucina 2, por ser considerados de bajo riesgo inmunológico pre-trasplante. La terapia inicial de mantenimiento se realizó con tacrolimus y corticoides en todos los casos, y como tercer droga se indicó sirolimus en el grupo de alto riesgo y micofenolato en los de bajo riesgo.
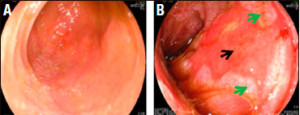
La prevalencia de rechazo celular agudo durante los primeros tres meses post-trasplante fue del 51% (18/35 pacientes que sobrevivieron > de 30 días); de ellos 11 fueron leves, 3 moderados y 4 severos (Figura 2). Ningún paciente con rechazo severo temprano perdió el injerto. No se observaron diferencias en el número de eventos de rechazo entre los grupos de alto o bajo riesgo inmunológico (p= NS). Dos pacientes con rechazo severo exfoliativo tardío (> 1.000 días post-trasplante) perdieron el injerto. Dos pacientes evolucionaron con rechazo crónico en el seguimiento alejado, ambos fueron pacientes hipersensibilizados del grupo de alto riesgo inmunológico; hasta el momento ningún paciente del grupo de bajo riesgo presentó esta complicación.
Figura 2. Visión endoscópica del injerto. A. Intestino normal. B. Intestino con rechazo severo. La flecha negra indica ulceración. La flecha verde señala islotes de reparación.
El tiempo promedio en NPT pre-trasplante fue de 1.571 ± 1.839 días (mediana: 913 días, rango: 213- 6.570), en 38/40 pacientes trasplantados con II. El tiempo promedio de suspensión de la NPT de los pacientes con sobrevida alejada fue de 71 ± 59 días (mediana: 47 días; rango: 9-232) (p = 0,001, comparado al tiempo de soporte pre-trasplante); fue mayor en pacientes ped 77 ± 62 comparado con los pacientes adul 52 ± 49 días, aunque no estadísticamente diferente (p = 0.4).
Nueve pacientes fallecieron en NPT durante el post-operatorio temprano y cuatro volvieron a NPT en seguimiento alejado, 2 por rechazo celular agudo exfoliativo, que requirieron enterectomía (luego 1 de ellos fue re-trasplantado); 2 por desarrollo de rechazo crónico (1 fue re-trasplantado y el último se encuentra en lista para re-trasplante).
La mediana de seguimiento de los pacientes fue de 29 meses, con un promedio de 37 ± 33 meses (rango: 0-94,5). La sobrevida actuarial global del paciente a 1, 3 y 5 años es de 72%, 67% y 63%, respectivamente; la supervivencia del injerto a igual período es de 72%, 65% y 62%, respectivamente.
No se observaron diferencias significativas en la supervivencia alejada (5 años) del paciente o del injerto entre población adul (61%) y ped (64,5%) (Log Rank; p = 0,65). Sí se observaron diferencias significativas entre las supervivencias a 5 años de los TIA (75%) vs los TC+TMV (22%) (p = 0,001).
2) Análisis de las células inmunes drenantes de la cavidad abdominal, descripción de una nueva técnica para evaluar el tráfico linfocitario y su correlación con la evolución clínica inmediata post-trasplante intestinal
El seguimiento clínico del paciente se realiza mediante la evaluación clínica diaria que incluye las características de la ostomía, del débito de la misma y de los estudios en sangre periférica; por otra parte, durante los días inmediatos posteriores al trasplante se controla el volumen y aspecto del líquido recogido por el drenaje de la cavidad abdominal, el cual es en general removido al cabo de las dos a tres primeras semanas. De la integración del grupo de trabajo y basados en el concepto mencionado que los linfáticos del injerto no son reconstruidos, siendo ellos la vía principal de egreso de las células inmunes de la mucosa intestinal hacia el compartimento sistémico, surgió la hipótesis de estudiar el líquido recogido por el drenaje y valorar si era posible aislar linfocitos, poder discernir su origen (donante vs receptor) y ponderar el valor predictivo de sus cambios ante distintas condiciones clínicas del receptor.
Como fue descripto, la metodología de este procedimiento original permite evaluar, por consiguiente, el tráfico celular que emigraría del intestino delgado al compartimiento sistémico, lo que permite un análisis detallado de poblaciones celulares y marcadores en forma no invasiva para el paciente.37 De este primer análisis y mediante la técnica de DNA finger printing de células T CD8 positivo sorteadas del líquido de la cavidad abdominal hemos demostrado que el 50% de estas células tienen el origen del donante, al primero y segundo día post-trasplante; mientras que por el contrario el día once post-trasplante esta proporción disminuyó a menos del 1%, lo cual demostró que existe un recambio y repoblación de las estructuras linfoides del intestino por células del receptor luego del trasplante.
Aquí presentaremos la segunda fase de nuestro estudio que tiene como objetivo evaluar la correlación entre el cambio de la composición de células aisladas en el efluente abdominal con los eventos clínicos post-trasplante.
Materiales y métodos
Veintitrés pacientes trasplantados de intestino entre 2007 y 2013 fueron incluidos en el estudio (19 TIA, 3 TMV, y 1 TC). En cada uno de ellos se analizaron en forma diaria muestras de sangre periférica y del drenaje por contador hematológico. A su vez se registró el volumen de drenaje diario, así como los cambios físicos del mismo. Todo evento clínico adverso fue registrado y correlacionado con cambios en la constitución celular en sangre y en efluente.
Citometría de flujo: después de filtrar y lavar las células con solución buffer de fosfato (PBS), 500.000 células por tinción fueron incubadas con anticuerpos monoclonales específicos por 30 minutos, luego las células fueron lavadas con PBS y analizadas en un citómetro de flujo modelo FACS Calibur de BD Biosciences. Los marcadores de superficie celular CD3, CD4 y CD69 fueron utilizados en el estudio.
Resultados
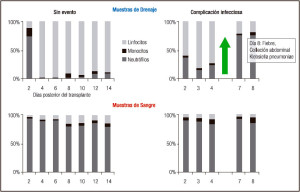
En 14 de los 23 pacientes trasplantados se pudieron observar complicaciones post-operatorias que se clasificaron como: infecciones bacterianas (3 pacientes), rechazo (3 pacientes) o eventos inflamatorios no infecciosos (8 pacientes; pancreatitis, ascitis quilosa, diarrea, hematoma en la pared abdominal). En los 9 pacientes que no presentaron eventos clínicos, la constitución del líquido drenante mantuvo las características descriptas en nuestra publicación original del método, es decir, hubo un predominio linfocitario (más del 80% del total de células) a partir del cuarto día post-trasplante, mientras que en los pacientes con eventos clínicos infecciosos o no infecciosos se produjo una modificación en la constitución de las células del líquido drenante, con la aparición de granulocitos (neutrófilos) en el drenaje abdominal. Estos cambios en la composición celular no fueron reflejados en los análisis hematológicos realizados en paralelo (Figura 3). En todos los casos el cambio observado en la composición del líquido drenante fue concomitante con la aparición de los síntomas clínicos, o incluso anterior, lo que indica la utilidad del análisis para anticipar cambios en el estado clínico del paciente.
Figura 3. Cambio de celularidad en la muestra de drenaje en paciente con complicación infecciosa. Comparación de muestras de drenaje con muestras de sangre de un paciente sin eventos clínicos y un paciente con una complicación infecciosa (fiebre, colección abdominal, positivo por Klebsiella pneumoniae) diagnosticada al día ocho post-trasplante. Las muestras fueron analizadas con un contador hematológico.
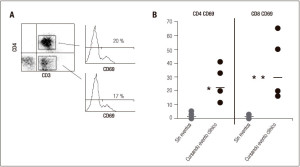
Por otra parte, a fin de determinar la factibilidad del uso de la activación linfocitaria como predictor de eventos de rechazo o de otra sintomatología clínica, analizamos los niveles de expresión de CD69 mediante citometría de flujo en poblaciones linfocitarias. Este marcador indica la activación de la población linfocitaria en cuestión. Si bien el número de casos analizados no permite concluir respecto a la correlación de este parámetro con distintas situaciones clínicas, en todos los casos en que el paciente cursaba un evento clínico se notó un aumento en el porcentaje de la población linfocitaria que expresa este marcador (Figura 4).
Estos estudios indican que mediante un sencillo análisis de recuento diferencial leucocitario sobre una muestra hasta ahora ignorada por los programas de trasplante intestinal, se puede obtener información relevante para el monitoreo del status del paciente en el post-trasplante inmediato, etapa que resulta la de mayor incidencia de complicaciones, tanto infecciosas como no infecciosas. Por otra parte, los estudios sobre las poblaciones celulares drenantes indican que esta muestra es una fuente invalorable de células inmunes provenientes directamente del injerto para estudios de inmunobiología del trasplante intestinal.
Figura 4. Correlación de la expresión de CD69 en linfocitos con el curso de eventos clínicos. A. Las células drenantes fueron analizadas mediante citometría de flujo empleando distintos marcadores. Las poblaciones CD3+ CD4+ y CD3+ CD8+ fueron a su vez discriminadas de acuerdo a su expresión del marcador CD69. B. Porcentaje de expresión de CD69 en las distintas poblaciones linfocitarias en presencia o ausencia de eventos infecciosos o rechazo. (* p < 0,05; ** p < 0,01).
3) Reporte de efecto de la inmunosupresión primaria en la constitución y función de las estructuras linfoideas en el seguimiento alejado post-trasplante intestinal
A diferencia de cualquier otro órgano trasplantado, el TxI ofrece la oportunidad de contar con un acceso directo al órgano trasplantado a través de la ileostomía o colostomía creada al momento de la cirugía y nos permite el monitoreo endoscópico posterior, ya que la endoscopía y la biopsia son la única forma de monitorear el injerto para valorar el desarrollo de rechazo.38 En el caso particular del intestino humano, existe aún hoy, un gran desconocimiento respecto a las estructuras histológicas y las funciones propias del sistema inmune de las mucosas, tales como los folículos linfoides aislados y las poblaciones celulares de distintos compartimentos como el intraepitelial o el de la lámina propria. El intestino natural o el injerto trasplantado tienen que cumplir con su función de barrera, es decir, mantener el equilibrio inmunológico que le permita al individuo tolerar bacterias comensales y neutralizar patógenos en la mucosa intestinal.39 Recientemente se ha mostrado en modelos de ratones, que los folículos linfoides aislados (FLA) tienen como función importante, este equilibrio homeostático.40 Pero esto aún no se ha demostrado en humanos ni se ha descripto si funcionalmente las estructuras linfoideas post-trasplante son comparables a las normales o cuál es el efecto del uso crónico de inmunosupresión sobre las mismas. Por lo que hemos planteado la presente hipótesis. Desarrollar metodologías originales para la identificación, aislamiento y análisis celular de estructuras linfoides en tejido intestinal, como los FLA, evaluar la funcionalidad de las mismas, y por último, analizar el efecto de las distintas terapias inmunosupresoras sobre los circuitos homeostáticos que mantienen estas estructuras.
Material y métodos
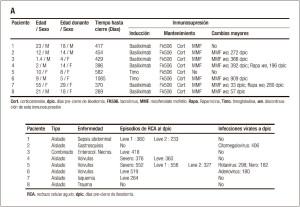
Las biopsias de íleon distal de 8 pacientes trasplantados al momento del cierre de la ileostomía y de 10 controles no trasplantados fueron obtenidas al momento de la realización de procedimientos quirúrgicos de cirugía general (Tablas 1 a y b). El consentimiento informado fue obtenido previo al procedimiento. El análisis histológico de las muestras fue realizado por dos anatomopatólogos entrenados en la lectura de biopsias de intestino trasplantado. Posteriormente se compararon los folículos linfoides del íleon distal de pacientes trasplantados con folículos de pacientes no trasplantados vía citometría de flujo, PCR en tiempo real e inmunohistología.
Aislamiento de folículos linfoides aislados: Luego de la resección del íleon terminal, la pieza quirúrgica fue lavada empleando Hank’s Balanced Salt Solution (HBSS; Life Technologies, Carlsbad, CA). Las capas serosa y muscular fueron removidas por disección mecánica a partir de la capa submucosa. La capa mucosa remanente fue incubada en HBSS suplementado con 20 mM de ácido etilendiaminotetracético (EDTA; Sigma, St Louis, MO) y 100 U/mL penicilina-estreptomicina (Sigma) durante 20 minutos en agitación a temperatura ambiente. Luego el tejido fue lavado en HBSS con agitación enérgica cinco veces durante 30 segundos cada vez. El tejido remanente fue examinado en una lupa estereoscópica a fin de identificar, contar y disecar los FLAs. Los FLAs así aislados fueron homogeneizados mecánicamente y resuspendidos en 0,5 mL solución buffer salina-fosfato de (DPBS; Sigma) suplementado con 2% suero fetal bovino (PAA, Pasching, Austria) y procesados para tinción y análisis por citometría o procesados para aislamiento de ARN en buffer de lisis RA1 (GE Healthcare, Little Chalfont, UK).
Tabla 1. A. Datos de pacientes trasplantados, B. Pacientes no trasplantados
Citometría de flujo: Las tinciones fueron realizadas con distintos anticuerpos monoclonales en oscuridad durante 20 minutos y luego las células fueron lavadas y resuspendidas en DPBS para su análisis por citometría de flujo (FACS Calibur, BD Biosciences). Los datos fueron analizados empleando el programa Flow Jo (Tree Star, Ashland, OR).
Inmunohistología: El tejido fue fijado en formalina neutra al 10% y luego embebido en parafina para su corte en micrótomo. Cortes de 4 μm fueron montados en portaobjetos Superfrost Plus (BioGenex, Fremont, CA). La deparafinización fue realizada luego de preincubar las muestras a 60ºC durante una hora. La recuperación de epítopes fue realizada luego de la rehidratación de las muestras empleando buffer citrato pH 6,0 (BioGenex) por calentamiento en microondas durante 15 minutos. Luego se realizó la inactivación de peroxidasa endógena por incubación en reactivo bloqueante comercial (BioGenex) y a posteriori se realizó un bloqueo contra el pegado inespecífico empleando solución bloqueante comercial (BioGenex) mediante incubaciones de 15 minutos en ambos casos. Los anticuerpos primarios se incubaron una hora a temperatura ambiente y luego se empleó el sistema comercial de detección multilink-HRP (BioGenex) y 3-amino-9-ethylcarbazol (AEC) como sustrato. La contra coloración fue realizada con hematoxilina y a posteriori se realizó el montaje empleando soluciones de montaje acuosas comerciales (BioGenex).
Resultados
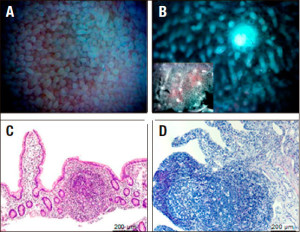
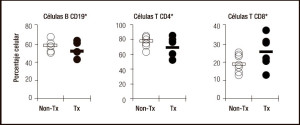
Hemos establecido una técnica para identificar y aislar FLA en tejido humano del intestino delgado (Figuras 5 A y B). El procedimiento incluye el procesamiento por disección manual y una serie de etapas de incubación/ lavados con EDTA a fin de remover el mucus y la capa epitelial, lo que permite una clara visualización de las estructuras foliculares (Figuras 5 C y D). Encontramos que leucocitos repueblan rápidamente los folículos linfoides en el injerto y que la terapia inmunosupresora (tacrolimus y corticosteroides) no tiene efecto sobre la composición celular y la función de estas estructuras (Figura 6).
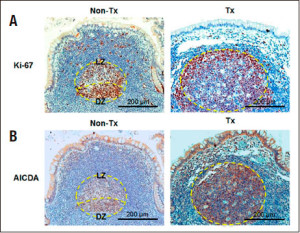
Contrariamente a lo pensado, hemos analizado que estos folículos linfoides tienen un estado de maduración y activación más alto en los pacientes trasplantados que los pertenecientes a pacientes no trasplantados. Usamos dos anticuerpos monoclonales diferentes, el anti-Ki-67, que marca proliferación y el anti-AICDA (Activation-induced cytidine deaminase) que marca actividad en el centro germinal (Figura 7).
Figura 5. Identificación y aislamiento de folículos linfoides aislados (FLA) a partir del injerto. A. Imagen representativa de la vista de la superficie mucosa desde la cara luminal mediante estereomicroscopio. B. Identificación de los FLA luego de la remoción de la capa epitelial y el mucus. El inset muestra a menor magnificación la distribución de los FLAs en un fragmento de tejido una vez removidas las capas muscular y serosa. C. H&E de una sección de tejido conteniendo un FLA luego de la disección manual de capas. D. FLA en una muestra de tejido disecada a posteriori de los lavados con EDTA que remueven la capa epitelial.
Figura 6. El régimen inmunosupresor no afecta la composición de los compartimentos linfocitarios B y T en los FLA. Se ilustra el porcentaje relativo de distintas poblaciones linfocitarias en pacientes trasplantados y casos control (n = 7). (Non Tx: pacientes no trasplantados; Tx: pacientes trasplantados).
Figura 7. Comparación de estructuras de centro germinal en FLA en pacientes trasplantados y no trasplantados. (A) Tinción con el marcador de proliferación Ki-67 en cortes en parafina. Se observa el típico cuadro de distribución de células Ki-67+ formando centroblastos en la zona oscura (DZ) y una menor proporción de células B Ki-67+ en la zona clara (LZ) (panel izquierdo). En las muestras de trasplante la separación en zonas LZ y DZ es menos notable (panel derecho). (B) Tinción inmunohistoquímica empleando anticuerpos anti-AICDA en secciones de íleon. Se observa tinción positiva en todo el centro germinal, especialmente en las muestras trasplantadas. La distribución asimétrica en LZ y DZ es notable en las muestras control y menos notable en las muestras del intestino trasplantado. Se muestran imágenes representativas del análisis de ocho casos de trasplante intestinal y seis controles apareados por sexo y edad. Magnificación 200x (Non Tx: pacientes no trasplantados; Tx: pacientes trasplantados).
Discusión
La creación de la Unidad de Soporte Nutricional, Rehabilitación y Trasplante Intestinal de nuestra institución en marzo de 2006 se realizó sobre la base de un grupo multidisciplinario constituido por gastroenterólogos, nutricionistas, cirujanos, enfermeros, terapistas, radiólogos, patólogos, psicólogos y trabajadores sociales especializados en la evaluación y tratamiento de pacientes con diferentes grados de II con la capacidad para definir la mejor opción terapéutica en cada caso e iniciar la actividad de trasplante, que al igual que en todo el mundo, fue la última en concretarse por su complejidad: el TxI.1, 12, 14, 41
Los objetivos, al igual que en programas similares en el mundo, son: 1) asistir a pacientes con II aguda y crónica, como así también a portadores de complicaciones asociadas a la NPT, en un proceso que se inicia con la confirmación del diagnóstico de II crónica e irreversible y la determinación de qué pacientes pueden ser candidatos a rehabilitación médica, quirúrgica o combinada para devolverles la suficiencia nutricional e independizarlos del soporte nutricional, y solo de no ser posible, indicarles el trasplante;18, 42 2) sus miembros debemos volcarnos a realizar tareas de educación a la comunidad y a los profesionales tanto en el pre como en el post-grado, ya que la II es aún la única insuficiencia orgánica que no forma parte del cuerpo educativo, ni de la literatura médica en el pregrado, como tampoco existía una favorable opinión respecto a la existencia y los resultados del este tipo de trasplante; y 3) desde el inicio, y conociendo que el número de procedimientos es de menor volumen comparado con el de otros órganos, para terminar de integrar la experiencia clínica y educativa debemos desarrollar un área de investigación clínica y básica, que nos permitirá dar respuestas a situaciones observadas en forma cotidiana y en las cuales aún no se ha trabajado y devolver a la atención del paciente lo aprendido, es decir, realizar investigación traslacional. Para concretar este último objetivo se desarrollaron en nuestra universidad dos áreas de investigación y un laboratorio de microcirugía experimental donde se replicaron los modelos de trasplante en roedores y la Unidad de Investigación Traslacional e Inmunología Asociada al Trasplante, con la incorporación de investigadores especialistas en microcirugía, inmunología y biología molecular.
Los frutos del trabajo conjunto de una unidad que puede integralmente concretar asistencia, docencia e investigación se pueden ver reflejados en este trabajo. El poder concretar en forma exitosa esta especialidad ha permitido poner en práctica en nuestro medio uno de los mayores y más difíciles avances de la gastroenterología y la cirugía, es decir, el poder concretar el TxI aislado y el de todos los órganos digestivos del abdomen en su conjunto.
La dificultad de realizarlo puede valorarse si revisamos la historia del mismo. Latinoamérica inició la experiencia solo un año después que se realizara el primer procedimiento en el mundo y fue en el programa del Hospital Das Clínicas de Sao Pablo, Brasil, en 1968, con experiencias aisladas y negativas; varias experiencias aisladas posteriores no lograron resultados positivos, incluyendo los primeros intentos en Argentina (1999) y México (1999). En el año 2000, en el Hospital de la Santa Casa de San Pablo se realizó el primer TIA pediátrico que alcanzó una sobrevida mayor a 100 días, pero recién en el año 2004, el grupo de la Clínica las Condes de Chile alcanzó sobrevida mayor al año en una receptora adulta que hoy se convirtió en la paciente con mayor sobrevida en Latinoamérica. Ese mismo año en el Hospital de la Universidad de São José do Rio Preto, de San Pablo, Brasil, se inició el tercer intento de desarrollo para ese país de un programa de TxI, realizando tres TIA en receptores adultos, los 2 primeros pacientes fallecieron al día cinco y diez del post-operatorio y el tercer receptor perdió el injerto en el post-operatorio inmediato por trombosis arterial, pero sobrevivió y continúa en NPT. El programa del Hospital Pablo Tobon Uribe, de Colombia, inició sus actividades en febrero de 2006, concretó 26 procedimientos, que junto a nuestro programa con cuarenta casos son los de mayor experiencia en este continente. Como se expresa en este párrafo, casi cuarenta años después del primer procedimiento y solo con la constitución de equipos multidisciplinarios se alcanzó el objetivo de concretarlo.5, 6, 9, 42, 43
La indicación del trasplante a un paciente requiere analizar la extensión de la enfermedad estimada por el compromiso de más de un órgano. Asimismo, se deben analizar aspectos fundamentales como son: la condición psicológica y social, la permeabilidad vascular, la función e histología hepática, y la situación inmunológica. Con esta información se podrá definir la posibilidad de ser candidato a trasplante y el tipo de trasplante a indicar como se precisó en la introducción de este manuscrito. El proceso de evaluación debe establecer la suficiencia del resto de los parénquimas y sistemas, pues no es infrecuente que esta población tenga alteraciones de la función respiratoria, cardíaca, renal o hepática, así como alteraciones neurológicas que puedan condicionar su evolución posterior incrementando el riesgo del procedimiento.1, 4, 18, 25-28 El conocer el grado de afectación hepática, incluso en aquellos pacientes con alteración crónica del hepatograma es mandatario, con biopsia hepática para determinar si fuera necesario realizar un TC. Otro factor de alta relevancia es conocer la presencia de anticuerpos preformados contra un potencial donante, por lo que muchos centros recomiendan la realización prospectiva y periódica de “cross match” o prueba cruzada de compatibilidad contra panel en aquellos receptores de TIA, no siendo necesario en los candidatos de TC o TMV que incluya el hígado.44 En aquellos candidatos que tengan elevados títulos de anticuerpos contra panel se recomienda la utilización de alguna estrategia de inmunomodulación previa al trasplante.45
La derivación oportuna a un centro multidisciplinario dedicado al soporte nutricional y al TxI ha permitido además innovar en terapias como son la de ofrecer TMVm a un paciente con suficiencia intestinal pero con una enfermedad de Puetz-Jegher extensa con pólipos de más de 6 centímetros y biopsias con displasia severa;25, 26 o evaluar a pacientes con trombosis porto-mesentérica difusa para TMV46 y así asignarles los órganos, pero favorecer en el intraoperatorio la realización de un trasplante hepático (como en 2 de nuestros pacientes evaluados), redistribuyendo en ese momento el resto de los órganos a otros pacientes en lista, es decir, desarrollar nuevas estrategias que nos permitan dar una solución en la condición más adversa pero pensando en realizar aquel procedimiento que más beneficie al paciente.
El establecer la condición del paciente en la evaluación permitirá categorizarlo en lista de espera. Actualmente en la Argentina existen dos categorías en lista de espera para el TIA: categoría de urgencia y categoría electiva.47 Los criterios para poder ser inscripto en categoría de urgencia son: la presencia de enfermedad hepática progresiva asociada a la II y a la NPT, y la pérdida de accesos vasculares. La intención para que exista esta categoría es la de trasplantar precozmente a algunos candidatos antes del desarrollo de enfermedad hepática terminal, y por lo tanto, antes de necesitar un doble trasplante (TC). Por otro lado, la pérdida de accesos centrales (el otro grupo dentro de esta categoría) con el trasplante precoz se debería evitar la pérdida total de los mismos y así la contraindicación al TxI. Por último, integran la categoría electiva todos aquellos candidatos a trasplante de intestino aislado que tienen indicación de trasplante pero que no cumplen con los criterios enunciados anteriormente para ingresar en urgencia. Los candidatos a TC o TMV que incluyen el hígado como parte del injerto son inscriptos en lista de espera para trasplante hepático y compiten a través del valor del MELD o PELD con los candidatos a hígado aislado. Como estos pacientes tienen una elevada mortalidad en lista de espera, de las más altas observadas en órganos sólidos (cuatro a seis veces más que el receptor de trasplante de hígado aislado y sin contar con opciones como el donante vivo relacionado o la bipartición hepática), y ésta es a su vez significativamente mayor que la esperada por su valor numérico de MELD o PELD, en Argentina como en otros países del mundo,2 actualmente se les adjudica un puntaje suplementario de 25 puntos sobre el MELD o PELD real luego de ser evaluado cada caso por el comité de expertos del INCUCAI. El impacto de esta norma sobre la mortalidad en lista aún no se ha reportado. La Argentina ha sido el primer país de Latinoamérica en el que se ha legislado cada etapa de este procedimiento desde el año 2006.47-51
Previo al trasplante un punto no menor en el resultado final es la adecuada selección del donante: este criterio ha evolucionado junto con el desarrollo de la especialidad.52 Sigue prefiriéndose la utilización de donantes cadavéricos a corazón batiente. En un principio sólo se consideraban como donantes aquellos que fueran isogrupo, sin antecedente de paro cardiorrespiratorio y en lo posible que no necesitaran inotrópicos para su mantenimiento. Actualmente se aceptan todos aquellos donantes que cumplan con criterios de muerte encefálica, mayores a 1 mes de edad hasta aproximadamente los 50 años, que sean isogrupo o heterogrupo compatible para ABO, como hemos reportado en esta serie, cuya serología sea negativa para HIV, HTLV I y II, Chagas, VHB, VHC, VDRL y brucelosis. La positividad para CMV ha dejado de ser una contraindicación.34 Se eligen donantes en los que haya sido posible optimizar el mantenimiento, que tengan valores bioquímicos de función hepática normales o con tendencia a normalizarse y en los que se haya podido estabilizar su situación hemodinámica con bajas dosis de inotrópicos (≤ a 10 μg/kg/min de dopamina).34-53 A diferencia de otros órganos, el factor clave en la buena selección de un donante es la valoración antropométrica del mismo, sobre todo si el receptor es pediátrico y más si es portador de intestino ultracorto con pérdida asociada del dominio abdominal. En estos casos se recomienda que las medidas del donante sean entre un 25 y 50% menores que las del receptor. La gran dificultad en nuestros receptores es la pérdida del dominio abdominal. Para resolver esta problemática recientemente se han propuesto diversas técnicas como la ablación de la pared abdominal del donante, ya sea para trasplante como injerto vascularizado o para utilización de la vaina anterior o posterior del músculo recto del abdomen, como injerto no vascularizado.54-57
Terminado el procedimiento quirúrgico, el manejo post-trasplante es altamente demandante y requiere un minucioso monitoreo endoscópico y ajuste de la terapia inmunosupresora, detección precoz y tratamiento agresivo de los posibles episodios de rechazo y/o de complicaciones quirúrgicas o infecciosas, sobre todo en pacientes pediátricos, como así también, de una meticulosa optimización de la nutrición enteral, para lograr la discontinuación del soporte parenteral.1, 4, 14, 18, 25, 27, 41, 42, 58, 59
Como se ha mencionado, el intestino es el más inmunogénico de los órganos que se trasplantan. La evolución en esta terapia ha sido uno de los pilares en la mejoría de los resultados.44, 52, 61, 62 Los principios generales de la terapia inmunosupresora aprendidos con otros órganos han sido aplicados al intestino, pero en sus inicios los elevados niveles propuestos impactaron en forma negativa en los resultados tempranos y alejados debido a una mayor incidencia de síndrome linfoproliferativo post-trasplante, enfermedad de injerto contra huésped y enfermedades infecciosas; es por esto que durante la última década se concluyó que la terapia inmunosupresora en el TxI debe ser adecuada a cada paciente y al monitoreo del rechazo, como al seguimiento de posibles enfermedades infecciosas.52, 61, 62 Resultados obtenidos a través del registro internacional de TxI (International Intestinal Transplant Registry) (datos aún no publicados) han mostrado la utilidad de la terapia de inducción, es decir, la administración de anticuerpos anti-linfocíticos mono o policlonales en un período corto durante el procedimiento y en el post-trasplante inmediato. Esta terapia agresiva inicial busca reducir la respuesta inmune del huésped al injerto, induciendo el efecto de condicionamiento en el receptor, repletando la carga linfocitaria del mismo, además de brindar una ventana terapéutica para la introducción progresiva de inhibidores de calcineurina (tacrolimus).62 El uso de esta terapia y la aplicación de un protocolo original presentado por nuestro grupo y basado en la condición inmunológica pre-trasplante como se mencionó previamente nos permitió reducir significativamente la incidencia de rechazo celular agudo temprano de valores históricos reportados del 100% en los primeros tres meses a valores próximos al 50%, pero con reducción asociada en la severidad del rechazo, lo cual nos permitió también maximizar la posibilidad de respuesta al tratamiento.4, 43, 61
Es importante mencionar que el tratamiento de los episodios de rechazo debe ser agresivo, ya que la evolución de rechazo leve a severo puede ser muy rápida si no es bien monitorizada. El desarrollo de rechazo severo es causa no sólo de la pérdida del injerto sino de mortalidad para el receptor y su manejo requiere de experiencia ya que la pérdida de la barrera mucosa lleva a desarrollar traslocación bacteriana y sepsis que sólo mejorará en la medida en que se recupere la barrera mucosa para lo cual se necesita agresiva terapia inmunosupresora y adecuada cobertura antibiótica durante el tratamiento del mismo. Los rechazos severos requieren tratamiento de siete a catorce días con anticuerpos anti-linfocíticos. De acuerdo al grupo de Pittsburgh, 8% de los pacientes sufrirán rechazo crónico, el cual se manifiesta generalmente con desarrollo progresivo de II paralelo a atrofia vellositaria en las biopsias, y es motivo de pérdida alejada del injerto, sobre todo en pacientes con TIA; en esta serie la prevalencia ha sido del 5%, observándose en los pacientes hipersensibilizados pre-trasplante, por lo que desde hace un año estamos monitoreando los títulos de anticuerpos específicos contra donante como parte del seguimiento de rutina en nuestros pacientes.1, 4, 44, 45, 48, 52, 62
El rechazo sigue siendo la primera causa de pérdida del injerto y la presencia de rechazo subclínico ha llevado a todos los programas a instituir la utilización de la visión endoscópica y la biopsia ileal dirigida por endoscopía (incluso con magnificación endoscópica con zoom), como los métodos de elección para el diagnóstico precoz de disfunción del injerto, ya sea por rechazo o por intercurrencia viral o tumoral.1 Debemos agregar que no existe aún un marcador serológico de disfunción del injerto intestinal como la creatinina en el caso del trasplante renal o el hepatograma en el caso del trasplante hepático.63 La frecuencia de las biopsias de protocolo varía de acuerdo al programa. En nuestra unidad se efectúan dos endoscopías con biopsias (al menos cinco tomas) por semana las primeras seis semanas, una por semana las siguientes seis semanas, una cada dos semanas hasta el sexto mes post-trasplante y luego mensualmente hasta el final del primer año. La presencia de clínica con hallazgos negativos en el íleon obliga a realizar endoscopía y biopsias del yeyuno y del duodeno nativo, ya que hasta en un 20% de los casos se puede observar rechazo yeyunal.1
El objetivo primario del TxI es devolver la suficiencia intestinal al receptor y por ende la autonomía nutricional y la calidad de vida. No existiendo ninguna complicación quirúrgica, de injuria por preservación o inmunológica, al quinto día post-operatorio se efectuará una seriada gastrointestinal y la primera endoscopía con biopsia, que de ser normal, permitirán iniciar la nutrición enteral. La misma se inicia con sales de hidratación para pasar posteriormente a fórmulas semi-elementales e hipograsas y paralelamente dieta oral progresiva, eligiendo alimentos con bajo contenido en grasas, debido al riesgo de desarrollar ascitis quilosa en las primeras semanas post-trasplante, por no realizarse reconstrucción de la red linfática mesentérica durante el TxI. Una vez alcanzado el 75% de aporte enteral se comenzará a reducir el aporte parenteral. La progresión de las fórmulas enterales iniciales se realiza en primera instancia a expensas del volumen y luego en la concentración, llegando en corto plazo a incorporar fórmulas poliméricas. En general se espera que entre treinta a sesenta días post-trasplante se logre discontinuar el soporte parenteral, objetivo último del procedimiento como lo mencionamos en nuestros resultados.64-66
De la alta demanda diaria en el seguimiento de estos pacientes y producto de la interacción entre las distintas especialidades ha surgido la hipótesis de trabajo que nos ha llevado a investigar o revisar conceptos que en la gastroenterología y la medicina habían quedado como resueltos. Uno de ellos fue el de estudiar la longitud real del intestino humano, cuyo valor real es de aproximadamente el 60% de lo reportado por la literatura clásica. El conocerlo y empezar a valorar los cambios ocurridos en la longitud con el crecimiento antropométrico del individuo nos permitió explicar por qué nacemos con una longitud intestinal que es aproximadamente cuatro veces mayor que la altura del recién nacido y esta proporción baja a menos de dos en la adultez como también lo hace la necesidad del aporte calórico con la edad, hallazgo que tiene implicancias directas en el manejo pre y post-trasplante de nuestros pacientes.37, 67 De la misma manera, el evaluar en forma diaria algo tan simple como el volumen del débito de un drenaje abdominal, acto común y diario en la actividad quirúrgica, del cual habitualmente se espera nos muestre la presencia de sangre, bilis, orina, quilo,65 contenido intestinal o material purulento. Pero en el contexto de pacientes en los que se colocan sobre la superficie del mesenterio, luego de un procedimiento en el que los conductos linfáticos no son re-canalizados, nos llevó a plantear la posibilidad de medir en el efluente la existencia de células linfáticas, ver si existía correlación con la clínica del paciente y tratar de describir si las mismas provenían del donante o del receptor.67 Los resultados de este estudio son parte del segundo componente del presente manuscrito, el cual motivó la publicación de este nuevo método. El mismo nos permitió en forma sencilla demostrar que el líquido recogido por el drenaje, a diferencia de la sangre, es rico en células linfáticas y que permite analizar en forma directa el origen de las mismas del donante o del receptor, avance que abre una nueva perspectiva de estudio y valoración inmunológica para éste y otros órganos, no solo en la inmunología sino en el seguimiento del paciente.37, 67-70 En el post-operatorio temprano observamos que el volumen recogido es mayor en el TIA comparado con el TC; en el segundo la sección de la raíz del mesenterio es menor, ya que se preserva la continuidad del eje mesentérico, seccionándose solo el mesocolon ascendente. También observamos que los linfocitos (CD4, CD8 y B en menor proporción) constituyen la principal población celular que abandona los canales linfáticos a la cavidad abdominal para ser recogidos por el drenaje y que pertenecen primariamente al donante (día 1 y 2 post-operatorio) y que con el correr de los días los mismos pasan a ser casi en su totalidad del receptor. Este cambio observado demostró por primera vez en humanos el tráfico linfocitario y la repoblación sospechada de la población linfoide por células del receptor y su pasaje linfático a la cavidad abdominal hasta que la red linfática sea reconstituida. El tiempo en lograrlo no es conocido aún en humanos pero en animales se inicia a las dos semanas y se requieren seis semanas para su constitución.68, 69 Aquí también reportamos que existe un cambio en la composición del líquido a monocitos y/o granulocitos en los pacientes que desarrollan complicaciones post-operatorias infecciosas o inflamatorias con antelación a la existencia de cambios en el recuento celular en sangre periférica o la presentación clínica, lo cual devuelve a la práctica médica un nuevo armamento diagnóstico a considerar en el seguimiento de estos pacientes. Para validar estos hallazgos actualmente estamos dirigiendo un nuevo estudio multicéntrico internacional.
El poder contar con material adecuado en términos de pacientes en seguimiento y con especialistas en inmunología nos llevó a tratar de profundizar el conocimiento aún muy básico sobre las estructuras linfoides humanas.72-74 Para ello, se desarrolló la metodología para poder aislarlas en biopsias endoscópicas y quirúrgicas, y para poder estudiar no solo su constitución, sino también la capacidad funcional.75 El poder hacerlo nos permitiría evaluar el impacto del uso crónico de la terapia de inmunosupresión en las mismas y en su función de barrera. Los resultados reportados en el tercer componente de este manuscrito reflejan los avances realizados y resultados obtenidos. En primer lugar, se logró poner a punto la técnica de aislamiento de las principales estructuras linfoides humanas, pudiendo discriminar aquellas que son Placas de Peyer, encontradas en el 20% de los especímenes estudiados, y las que más frecuentemente estén, que son los FLA, en el 95% de los examinados. Este estudio confirmó los hallazgos mencionados previamente, es decir, que los FLA son re-poblados con más del 80% de linfocitos del receptor al momento del cierre de la ostomía, entre el sexto mes y el año post-trasplante, pero ya en biopsias del sexto día las células eran del receptor, por lo que la re-población se inicia en forma temprana, como se mostró en el trabajo de tráfico a través del drenaje. Este estudio además muestra por primera vez, que la proporcionalidad de células que los constituyen no difiere de la de los pacientes sanos; ni que las drogas inmunosupresoras afecten la composición celular, lo cual también fue visto por Junker.76 Pero avanzando un paso más pudimos ver que la funcionalidad de los FLA tampoco se ve afectada por la terapia inmunosupresora de mantenimiento.
Estos avances realizados sobre muestras de trasplante humano abren nuevas líneas de trabajo y estudios futuros sobre el efecto de diferentes regímenes inmunosupresores en el sistema inmune de mucosas del injerto, incluyendo el potencial efecto de terapias de inmunomodulación local sobre el intestino y la inmunidad a nivel sistémico, en busca del tan deseado efecto de tolerancia,77 demostrando que es posible realizar un seguimiento biomédico del proceso de TxI y correlacionarlo con los distintos eventos fisiopatológicos que atraviesa el paciente en la práctica médica actual y en nuestro país.
El Registro Internacional de Trasplante Intestinal a cargo del Dr David Grant, permite acceder a la información voluntariamente reportada por la mayoría de los centros del mundo involucrados en esta especialidad.2 Este reporte se actualiza cada dos años y los resultados son presentados durante el congreso mundial de la Asociación de Trasplante Intestinal (Intestinal Transplant Association). El último reporte fue presentado en el 2013, en el encuentro realizado en Oxford, Reino Unido (aún no publicado), el que informó: hoy en el mundo hay 87 centros registrados, de los cuales solo 47 reportan actividad de trasplante. En Latinoamérica solo cuatro centros han mostrado actividad (dos en Argentina y dos en Colombia) desde el año 2006, y la producción lograda por dos de estos programas ha hecho que nuestro continente haya sido el de mayor desarrollo proporcional en los últimos cinco años. Menos del diez por ciento del total de los programas activos han podido desarrollar el complemento aquí presentado de actividad clínica, asistencia e investigación básica.
El resultado final de este trabajo se ve en las supervivencias alejadas de los pacientes, las cuales son comparables a las de los mejores centros del mundo, por lo que para concluir, queremos expresar que el TxI se ha instalado como una opción terapéutica en nuestro país y en Latinoamérica, al igual que en el resto del mundo. Debe empezar a ser considerado como una opción a futuro para todos aquellos pacientes ped y adu que desarrollen II, como para aquellos que sin poseerla tengan alguna indicación por la que la puedan requerir; debe promoverse en cada país de nuestro continente el desarrollo del soporte nutricional, ya que así como no hay trasplante renal sin pacientes en diálisis, no habrá TxI sin pacientes en soporte, pero además debe extenderse a otras indicaciones.78, 79 Se debe estimular el desarrollo de unidades especializadas en soporte nutricional, esto favorecerá la sobrevida de los pacientes con mejores resultados a largo plazo y menor morbimortalidad asociada. De la misma manera, y debido al escaso número de candidatos por país, pocos centros deben concentrar la experiencia inicial del trasplante hasta que la cantidad de potenciales receptores permita que los resultados internacionalmente aceptados puedan reproducirse en más de un centro por país.
Sostén Financiero. Agencia Nacional de Promoción de la Ciencia y la Tecnología ANPCYT (PICT 01799, PICT2530), Subsidio Fundación Florencio Fiorini para la Investigación en Ciencias Biomédicas (2006) y Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET PIP 5241).
Referencias
- Fishbein T, Gondolesi G, Kaufman S. Intestinal Trasplantation for Gut Failure. Gastroenterology 2003; 124: 1615-1628.
- Intestinal Transplant Registry, disponible en www.intestinaltransplant.org.
- Pompfret E, Fryer J, Sima CS. Liver and intestine transplantation in the United States, 1996-2005. Am J Transplant 2007; 7: 1376-1389.
- Fishbein TM, Kaufman SS, Florman SS, Gondolesi GE, Schiano T, Kim-Schluger L, Magid M, Harpaz N, Tschernia A, Leibowitz A, LeLeiko NS. Isolated Intestinal Transplantation: Proof of clinical efficacy. Transplantation 2003; 76: 636-640.
- Kuss R, Bourget P. El Intestino. En: Una historia ilustrada del trasplante de órganos. La gran aventura del siglo. 1ra ed. Copyright Studio, Laboratorio Sandoz, 1992:100-103.
- Langnas A. The History of Intestinal Failure and Transplantation. En: Langnas A, Goulet O, Quigley M, and Tappenden K. Intestinal Failure, Diagnosis, Management and Transplantation. 1ra Ed. Blackwell Publishing, 2008: 245-253.
- Starzl TE, Kaupp HA Jr., Brock DR, Butz GW Jr., Linman JW. Homotransplantation of multiple visceral organs. Am J Surg 1962; 103: 219-229.
- Lillehei RC, Goott B, Miller FA. Homografts of the small bowel. Surg Forum 1959; 10: 197-199.
- da Silva R, de Paula A, Arroyo Jr P, Gonzales A, Marchini J, Duca W, de Faria W, Rocha M, de Felicio H, Abbud-Filho M and da Silva RC. Report of Initial Experience in Small Bowel Transplantation at São José do Rio Preto Medical School Hospital. Transplant P 2008; 40: 827-829.
- Dudrick Sj, Wilmore DW, Vars HM, Rhoads JE. Can intravenous feeding as thesole means of nutrition support growth in the child and restore weight loss in the adult? An affirmative answer. Ann Surg 1969; 169: 974-984.
- Grant D, Wall W, Mimeault R. Successful small-bowel/liver transplantation. Lancet 1990; 335: 181-184.
- Beath S, Pironi L, Gobe S. Collaborative strategies to reduce mortality and morbidity in patients with chronic intestinal failure including those who are referred for small bowel transplantation. Transplantation 2008; 1378-1384.
- Milla P. Intestinal failure in children. En: Nightingale J. Intestinal Failure. Ed. Greenwich Medical Media, 2001: 109-122.
- Abu-Elmaghd K. Intestinal transplantation for short bowel syndrome and gastrointestinal failure: Current consensus, rewarding outcomes, and practical guidelines. Gastroenterology 2006; 130: S132-S137.
- Vianna RM, Mangus RS, Tector AJ. Current status of small bowel and multivisceral transplantation. Adv Surg 2008; 42: 129-150.
- Tzakis AG, Kato T, Levi DM, Defaria W, Selvaggi G, Weppler D, Nishida S, Moon J, Madariaga JR, David AI, Gaynor JJ, Thompson J, Hernández E, Martínez E, Cantwell GP, Augenstein JS, Gyamfi A, Pretto EA, Dowdy L, Tryphonopoulos P, Ruiz P. 100 multivisceral transplants at a single center. Ann Surg 2005; 242: 480-490.
- Thompson JS. Surgical approach to the short bowel syndrome, procedures to slow intestinal transit. Eur J Ped Surg 1999; 9: 263-266.
- Sudan D, Di Baise J, Torres C, Thompson J, Raynor S, Gilroy R, Horslen S, Grant W, Botha J, Langnas A. A multidisciplinary approach to the treatment of intestinal failure. J Gastroint Surg 2005; 9: 165-177.
- Messing B, Crenn P, Beau P, Boutron-Ruault MC, Rambaud JC, Matuchansky C. Long term survival and parenteral nutrition dependence in adult patients with the short bowel syndrome. Gastroenterology 1999; 117: 1043-1050.
- Wilmore DW. Factors correlating with successful outcome following extensive intestinal resection in newborn infants. J Pediatr 1972; 80: 88-95.
- Cavicchi M, Beau P, Crenn P, Degott C, Messing B. Prevalence of liver disease and contributing factors in patients receving home parenteral nutrition for permanent intestinal failure. Ann Intern Med 2000; 132: 525-532.
- Mims T, Fishbein T, Fierman D. Management of small bowel trasplant with complicated central venous access in a patient with asymptomatic superior and inferior vena cava obstruction. Transplantation Proc 2004; 36: 388-391.
- OASIS, Home Nutritional Support Patient Registry. Annual Report, 1989 Data. The Oley Foundation, Albany, New York, and A.S.P.E.N., Silver Spring, Md.
- Fiel MI, Sauter B, Wu HS, Rodríguez-Laiz G, Gondolesi G, Iyer K, Schiano TD. Regression of hepatic fibrosis after intestinal transplantation in total parenteral nutrition liver disease. Clin Gastroenterol Hepatol 2008; 6: 926-933.
- Pironi L, Spinucci G, Paganelli F, Merli C, Masetti M, Miglioli M, Pinna AD. Italian guidelines for intestinal transplantation: potential candidates among the adult patients managed by a medical referral center for chronic intestinal failure. Transplant Proc 2004; 36: 659-661.
- Pironi L, Hébuterne X, Van Gossum A, Messing B, Lyszkowska M, Colomb V, Forbes A, Micklewright A, Villares JM, Thul P, Bozzetti F, Goulet O, Staun M. Candidates for intestinal transplantation: a multicenter survey in Europe. Am J Gastroenterol 2006; 101: 1633-1643.
- Abu-Elmagd K. Intestinal transplantation: Indications and patients selection. En: Langnas A, Goulet O, Quigley M, and Tappenden K. Intestinal Failure, Diagnosis, Management and Transplantation. 1ra ed. Blackwell Publishing, 2008; 245-253.
- Martin D, Ezzelarab M, Bond G, Reyes J, Mazariegos G, Abu-Elmagd K. Patient profile and candidacy for intestinal transplantation at the University of Pittsburgh. Transplant Proc 2002; 34: 1897-1898.
- Matsumoto CS, Fishbein T. Modified multivisceral transplantation with splenopancreatic preservation. Transplantation 2007; 83: 234-236.
- Kato T, Selvaggi G, Gaynor JJ, Takahashi H, Nishida S, Moon J, Levi D, Smith L, Hernandez E, Ruiz P, Tzakis A. Inclusion of Donor Colon and Ileocecal Valve in Intestinal Transplantation. Transplantation 2008; 86: 293-297.
- Abu-Elmagd KM. Preservation of the native spleen, duodenum, and pancreas in patients with multivisceral transplantation: nomenclature, dispute of origin, and proof of premise. Transplantation 2007; 84: 1208-1209.
- Sudan DL, Iyer KR, Deroover A, Chinnakotla S, Fox IJ Jr, Shaw BW Jr, Langnas AN. A new technique for combined liver/small intestinal transplantation. Transplantation 2001; 72: 1846-1848.
- Fishbein T, Florman S, Gondolesi G, Decker R. Non composites simultaneous liver and intestinal transplantation. Transplantation 2003; 75: 564-565.
- Gondolesi G, Fauda M. Technical refinements in small bowel transplantation. Curr Opin Organ Transplant 2008; 13:259-265.
- Langnas A, Chinnakotla S, Sudan D, Horslen S, Mc Cashland T, Schafer D, Sorrell M, Vanderhoof J, Iyer K, Fox I, Shaw B. Intestinal transplantation at the University of Nebraska Medical Center: 1990 to 2001. Transplant Pro 2002; 3: 958-960.
- Gondolesi GE, Rodriguez-Davalos M, Soltys K, Florman S, Kaufman S, Fishbein T. End-to-end portocaval shunt for venous drainage of the native foregut in combined liver-intestinal transplantation. Pediatr Transplant 2006; 10: 98-100.
- Meier D, Cagnola H, Ramisch D, Rumbo C, Chirdo F, Docena G, Gondolesi GE, Rumbo M. Analysis of immune cells draining from the abdominal cavity as a novel tool to study intestinal transplant immunobiology. Clin Exp Immunol 2010; 162: 138-145.
- Ruiz P, Bagni A, Brown R, Cortina G, Harpaz N, Magid MS, Reyes J. Histological criteria for the identification of acute cellular rejection in human small bowel allografts: results of the pathology workshop at the VIII International Small Bowel Transplant Symposium. Transplant Proc 2004; 36: 335-337.
- Newberry RD, Lorenz RG. Organizing a mucosal defense. Immunol Rev 2005; 206: 6-21.
- Lorenz RG, Newberry RD. Isolated lymphoid follicles can function as sites for induction of mucosal immune responses. Ann N Y Acad Sci 2004; 1029: 44-57.
- Nucci A, Burns RC, Armah T, Lowery K, Yaworski JA, Strohm S, Bond G, Mazariegos G, Squires R. Interdisciplinary management of pediatric intestinal failure: a 10-year review of rehabilitation and transplantation. J Gastrointest Surg 2008; 12: 429-443.
- Trentadue J, Rumbo C, García Hervás MD, Saá G, Martínez MI, Orce G, Fernández A, Gondolesi G. Intestinal transplantation in pediatrics. Analysis of the first recipient series in Argentina. Arch Argent Pediatr 2011; 109: 135-141.
- Gondolesi GE, Rumbo C, Fernández A, Mauriño E, Ruf A. Intestinal transplant. Review and description of its evolution in Latin America. Acta Gastroenterol Latinoam 2009; 39: 63-80.
- Bond G, Reyes J, Mazariegos G, Wu T, Schaefer N, Demetris J, Fung JJ, Starzl TE, Abu-Elmagd K. Theimpact of positive T-cell lymphocytotoxiccrossmatch on intestinal allograft rejection and survival. Transplant Proc 2000; 32: 1197-1198.
- Gondolesi G, Blondeau B, Maurette R, Hoppenhauer L, Rodriguez-Laiz G, Schiano T, Boros P, Bromberg J, Akalin E, Sauter B. Pretransplantimmunomodulation of highly sensitized small bowel transplant candidates with intravenous immune globulin. Transplantation 2006; 81: 1743-1746.
- Vianna R, Giovanardi RO, Fridell JA, Tector AJ. Multivisceral transplantation for diffuse portomesenteric thrombosis in a patient with life-threatening esophagogastroduodenal bleeding. Transplantation 2005; 80: 534-535.
- Criterios de inclusión em lista de espera para Tx de Intestino, INCUCAI, disponible en:http://cresi.incucai.gov.ar/cresi/.
- Freeman RB Jr, Steffick DE, Guidinger MK, Farmer DG, Berg CL, Merion RM. Liver and intestine transplantation in the United States, 1997-2006. Am J Transplant 2008; 8: 958-976.
- Horslen S. Organ allocation for liver-intestine candidates. Liver Transpl 2004; 10: S86-S89.
- Fryer J, Pellar S, Ormond D, Koffron A, Abecassis M. Mortality in candidates waiting for combined liver-intestine transplants exceeds that for other candidates waiting for liver transplants. Liver Transpl 2003; 9: 748-753.
- Desschans B, Van Gelder F, Van Hees D, de Rocy J, Monbaliu D, Aerts R, Coosemans W, Pirenne J. Evolution in allocation rules for renal, hepatic, pancreatic and intestinal grafts. Acta Chir Belg 2008; 108: 31-34.
- Kaufman SS. Small bowel transplantation: selection criteria, operative techniques, advances in specific immunosuppression, prognosis. Curr Opin Pediatr 2001; 13: 425-428.
- Matsumoto CS, Kaufman SS, Girlanda R, Little CM, Rekhtman Y, Raofi V, Laurin JM, Shetty K, Fennelly EM, Johnson LB, Fishbein TM. Utilization of donors who have suffered cardiopulmonary arrest and resuscitation in intestinal transplantation. Transplantation 2008; 86: 941-946.
- Levi DM, Tzakis AG, Kato T, Madariaga J, Mittal NK, Nery J, Nishida S, Ruiz P. Transplantation of the abdominal wall. Lancet 2003; 361: 2173-2176.
- Gondolesi G, Selvaggi G, Tzakis A, Rodríguez-Laiz G, González- Campaña A, Fauda M, Angelis M, Levi D, Nishida S, Iyer K, Sauter B, Podesta L, Kato T. Use of the abdominal rectus fascia as a nonvascularized allograft for abdominal wall closure after liver, intestinal, and multivisceral transplantation. Transplantation 2009; 87: 1884-1888.
- Abu-Elmagd K, Fung J, Bueno J, Martin D, Madariaga JR, Mazariegos G, Bond G, Molmenti E, Corry RJ, Starzl TE, Reyes J. Logistics and technique for procurement of intestinal, pancreatic, and hepatic grafts from the same donor. Ann Surg 2000; 232: 680-687.
- Carlsen BT, Farmer DG, Busuttil RW, Miller TA, Rudkin GH. Incidence and management of abdominal wall defects after intestinal and multivisceral transplantation. Plast Reconstr Surg 2007; 119: 1247-1255.
- Grant W. Surgical complications of intestinal transplant. En: Langnas A, Goulet O, Quigley M, and Tappenden K. Intestinal Failure, Diagnosis, Management and Transplantation. 1ra ed. Blackwell Publishing, 2008: 3-9.
- Hauser GJ, Kaufman SS, Matsumoto CS, Fishbein TM. Pediatric intestinal and multivisceral transplantation: a new challenge for the pediatric intensivist. Intensive Care Med 2008; 34: 1570-1579.
- Fryer JP. Intestinal transplantation: current status. Gastroenterol Clin North Am 2007; 36: 145-519.
- Fishbein TM, Florman S, Gondolesi G, Schiano T, LeLeiko N, Tschernia A, Kaufman S. Intestinal transplantation before and after the introduction of sirolimus. Transplantation 2002; 73: 1538-1542.
- Abu-Elmagd KM, Costa G, Bond GJ, Wu T, Murase N, Zeevi A, Simmons R, Soltys K, Sindhi R, Stein W, Demetris A, Mazariegos G. Evolution of the immunosuppressive strategies for the intestinal and multivisceral recipients with special reference to allograft immunity and achievement of partial tolerance. Transpl Int 2009; 22: 96-109.
- Gondolesi G, Ghirardo S, Raymond K, Hoppenhauer L, Surillo D, Rumbo C, Fishbein T, Sansaricq C, Sauter B. The value of plasma citrulline to predict mucosal injury in intestinal allografts. Am J Transplant 2006; 6: 2786-2790.
- Matarese LE, Costa G, Bond G, Stamos J, Koritsky D, O’Keefe SJ, Abu-Elmagd K. Therapeutic efficacy of intestinal and multivisceral transplantation: survival and nutrition outcome. Nutr Clin Prac 2007; 22: 474-481.
- Weseman RA. Review of incidence and management of chylous ascites after small bowel transplantation. Nutr Clin Pract 2007; 22: 482-484.
- O’Keefe SJ, Emerling M, Koritsky D, Martin D, Stamos J, Kandil H, Matarese L, Bond G, Abu-Elmagd K. Nutrition and quality of life following small intestinal transplantation. Am J Gastroenterol 2007; 102: 1093-1100.
- Rothkotter HJ, Hriesik C, Pabst R. Many newly formed T lympho- cytes leave the small intestinal mucosa via lymphatics. Adv Exp Med Biol 1994; 355: 261-263.
- Schmid T, Korozsi G, Oberhuber G, Klima G, Margreiter R. Lym-phatic regeneration after small-bowel transplantation. Transplant Proc 1990; 22: 2446.
- Kiyozaki H, Kobayashi E, Toyama N, Miyata M. Segmental small bowel transplantation in the rat: comparison of lipid absorption between jejunal and ileal grafts. J Parenter Enteral Nutr 1996; 20: 67-70.
- Rothkotter HJ, Hriesik C, Pabst R. More newly formed T than B lymphocytes leave the intestinal mucosa via lymphatics. Eur J Immunol 1995; 25: 866-869.
- Rothkotter HJ, Hriesik C, Barman NN, Pabst R. B and also T lymphocytes migrate via gut lymph to all lymphoid organs and the gut wall, but only IgA+ cells accumulate in the lamina propria of the intestinal mucosa. Eur J Immunol 1999; 29: 327-333.
- Herbrand H, Bernhardt G, Forster R, Pabst O. Dynamics and function of solitary intestinal lymphoid tissue. Crit Rev Immunol 2008; 28: 1-13.
- Pabst O, Herbrand H, Worbs T, Friedrichsen M, Yan S, Hoffmann MW, Körner H, Bernhardt G, Pabst R, Förster R. Cryptopatches and isolated lymphoid follicles: Dynamic lymphoid tissues dispensable for the generation of intraepithelial lymphocytes. Eur J Immunol 2005; 35: 98-107.
- Brandtzaeg P, Kiyono H, Pabst R, Russell MW. Terminology: Nomenclature of mucosa-associated lymphoid tissue. MucosalImmunol 2008; 1: 31-37.
- Meier D, Docena H, Ramisch D, Toscanini U, Berardi G, Gondolesi G, Rumbo M. Immunological Status of Isolated Lymphoid Folicles alter Intestinal Trasnplantation. Am J Trasnplat 2014; 14: 2148-2158.
- Junker Y, Bode H, Wahnschaffe U, Kroesen A, Loddenkemper C, Duchmann R, Zeitz M, Ullrich R. Comparative analysis of mononuclear cells isolated from mucosal lymphoid follicles of the human ileum and colon. Clin Exp Immunol 2009; 156: 232-237.
- Meier D, Rumbo M, Gondolesi GE. Current status of allograft tolerance in intestinal transplantation. Int Rev Immunol 2014; 33: 245-260.
- Mangus RS, Tector AJ, Kubal CA, Fridell JA, Vianna RM. Multivisceral transplantation: expanding indications and improving outcomes. J Gastrointest Surg 2013; 17: 179-186.
- Abu-Elmagd KM, Kosmach-Park B, Costa G, Zenati M, Martin L, Koritsky DA, Emerling M, Murase N, Bond GJ, Soltys K, Sogawa H, Lunz J, Al Samman M, Shaefer N, Sindhi R, Mazariegos GV. Long-term survival, nutritional autonomy, and quality of life after intestinal and multivisceral transplantation. Ann Surg 2012; 256: 494-508.
Correspondencia: Gabriel E Gondolesi MAAC, FACS
Av Belgrano 1782, 1er piso (CP: AAS-1093),
Ciudad Autónoma de Buenos Aires, Argentina
Tel: 54-11-43781366
Fax: 54-11-43781392
Correo electrónico: ggondolesi@ffavaloro.org
Acta Gastroenterol Latinoam 2015;45(3):233-251
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE