Oscar Laudanno1 ID· Arnoldo Riquelme2 ID· Patricio Medel-Jara3 ID
1 Gastroenterólogo. Instituto de Investigaciones Médicas Alfredo Lanari, Universidad de Buenos Aires.
2 Gastroenterólogo, Facultad de Medicina
3 Programa de Doctorado en Epidemiología, Escuela de Salud Pública, Facultad de Medicina, Pontificia Universidad Católica de Chile. Programa de Farmacología y Toxicología, Facultad de Medicina, Pontificia Universidad Católica de Chile, Santiago, Chile.
Acta Gastroenterol Latinoam 2024;54(4):299-309
Recibido: 06/12/2024 / Aceptado: 24/12/2024 / Publicado online el 30/12/2024 /
https://doi.org/10.52787/agl.v54i4.456
Resumen
El cáncer gástrico es una enfermedad multifactorial, y la infección crónica por Helicobacter pylori es una de sus principales causa. En Occidente recibe poca atención, con escasas políticas preventivas, en especial en países como Argentina, considerada de “bajo riesgo”. Pero tanto en Argentina como en Estados Unidos, la población es heterogénea, con inmigración permanente de países con riesgo alto o intermedio, a lo que se agrega una mayor susceptibilidad en la población masculina. Se estima que la frecuencia aumentará, dado el envejecimiento poblacional. En los últimos años ha surgido nueva evidencia para su prevención. La principal estrategia para la prevención primaria es la erradicación del Helicobacter pylori, mientras que la prevención secundaria para países heterogéneos como Argentina se basa en la identificación de los grupos de riesgo, particularmente mediante la identificación de las denominadas lesiones precursoras del cáncer gástrico. Esta revisión narrativa explora todas estas estrategias con un “fuerte sesgo” hacia la situación en Argentina, Chile y Latinoamérica.
Palabras claves. Cáncer gástrico, prevención, screening, Helicobacter pylori.
Gastric Cancer Prevention: Latin American Context and Experience
Summary
Gastric cancer is a multifactorial disease, and chronic Helicobacter pylori infection is one of its main causes. It receives little attention in the West, with few preventive policies, especially in countries such as Argentina, which is considered ‘low risk.’ But both in Argentina and in the United States, the population is heterogeneous, with permanent immigration from countries with high or intermediate risk, with the highest susceptibility in the male population. It is estimated that the incidence will increase due to the aging of the population. In recent years, new evidence for its prevention has emerged. The main strategy for primary prevention is the eradication of Helicobacter pylori, while secondary prevention for heterogeneous countries such as Argentina is based on the identification of risk groups, particularly those with the so-called precursor lesions of gastric cancer. This narrative review explores all these strategies with a ‘strong bias’ towards the situation in Argentina, Chile and Latin America.
Keywords. Gastric cancer, prevention, screening, Helicobacter pylori.
Abreviaturas
CG: Cáncer gástrico
H. pylori: Helicobacter pylori.
VEDA: Endoscopía digestiva alta.
MIG: Metaplasia intestinal gástrica.
RR: Riesgo relativo.
NNT: Número necesario a tratar.
ERGE: Enfermedad por reflujo gastroesofágico.
OLGA: Operative Link for Gastritis Assessment.
OLGIM: Operative Link on Gastric Intestinal Metaplasia assessment.
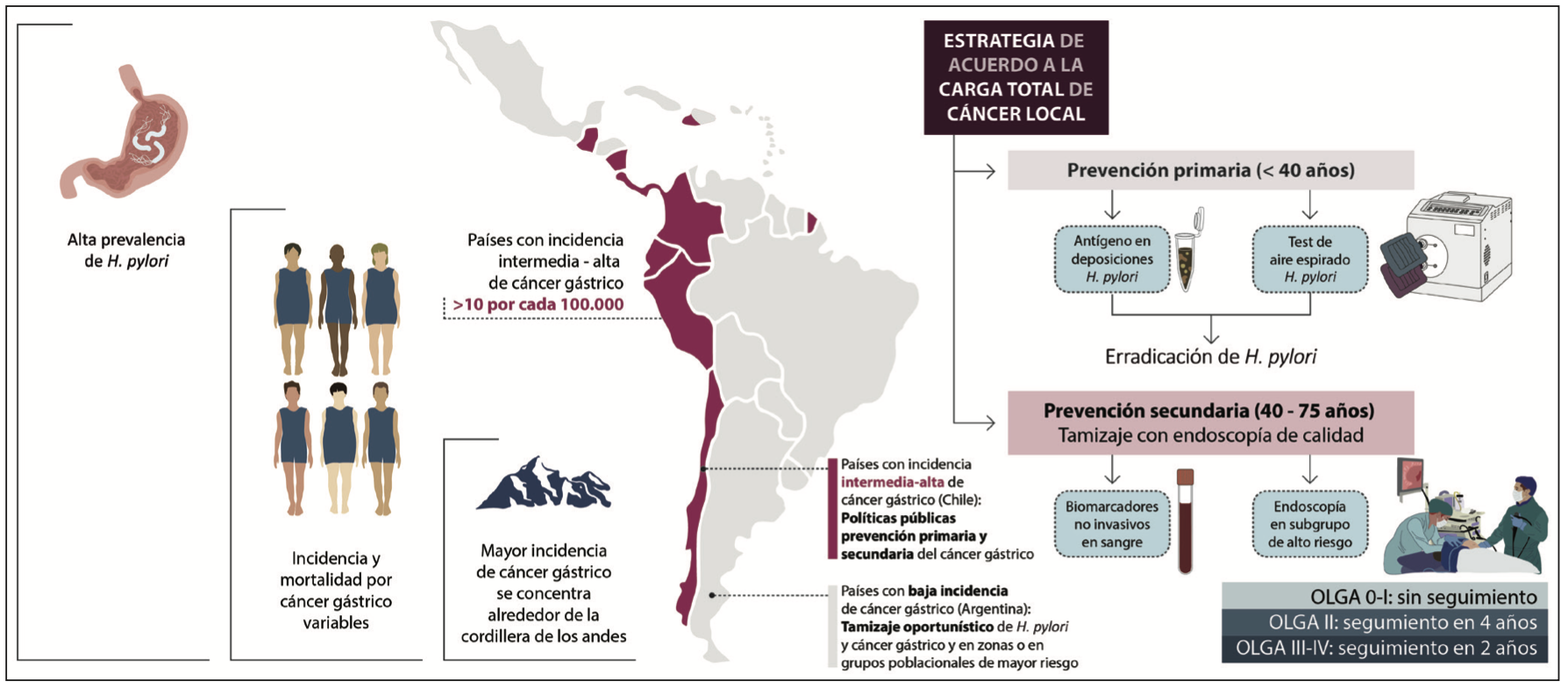
Figura 1. Aspectos claves de la prevención del cáncer en Latinoamérica
Introducción
El cáncer gástrico (CG) continúa siendo un cáncer frecuente a nivel mundial. De acuerdo con los datos del Global Cancer Observatory (GLOBOCAN) 2022 es el 6° cáncer en incidencia a nivel mundial.1 El tipo más común de CG en Latinoamérica es el non-cardia, que se vincula a la infección por Helicobacter pylori (H. pylori) y el modelo oncogénico conocido como la cascada de Pelayo-Correa, donde la atrofia gástrica y su evolución a la metaplasia intestinal y la displasia se identifican como lesiones precursoras.2
El pronóstico del CG depende del momento de diagnóstico. Su detección en estadios iniciales implica un muy buen pronóstico, dado que tiene una sobrevida a 5 años > 90% mientras que en los estadios avanzados es de 20-40%. En Latinoamérica, la mayoría de los pacientes con CG son diagnosticados en etapas avanzadas, por lo que la media de la sobrevida a 5 años es menor al 35%.3 En Centro América rural se encuentra el escenario menos favorable, con una sobrevida a 5 años menor al 10%.4 Considerando estas circunstancias, la implementación de estrategias de prevención es relevante y depende mucho del riesgo de cada país. El riesgo de CG de un país se define en base a la tasa de incidencia anual ajustada por edad. Una región o país presenta alto riesgo cuando la incidencia anual es mayor a 20 casos/100.000 habitantes, riesgo intermedio entre 10 y 20 casos/100.000 y de bajo riesgo si es < a 10 casos/100.000 habitantes.
La implementación de estrategias de prevención depende mucho del riesgo de cada país, debido a la heterogeneidad del riesgo tanto a nivel poblacional como individual.
En los últimos años se han producido cambios importantes para su prevención primaria y secundaria y por ese motivo se encuentran en marcha muchas iniciativas para su prevención.
El presente artículo busca sintetizar la información relevante sobre la prevención primaria y secundaria del CG en el contexto latinoamericano.
Situación epidemiológica del cáncer gástrico en Latinoamérica
El CG es una de las principales causas de muerte relacionadas a neoplasias en la región latinoamericana, con aproximadamente 58.000 muertes por año.3 El impacto se concentra en las zonas montañosas del litoral del océano Pacífico.5 De acuerdo con GLOBOCAN, los países con la mayor incidencia y mortalidad son Chile, Guatemala, Perú, Ecuador, Colombia y Costa Rica. En contraste, los países con la incidencia más baja son Trinidad y Tobago, Guyana, Surinam, Belice y Barbados.6 Argentina se considera un país de bajo riesgo de CG. Tiene una tasa de incidencia ajustada de 6,7 casos/100.000 habitantes/año, pero si discriminamos por sexo, la tasa de incidencia ajustada en el varón es de 10 casos/100.000 habitantes/año (riesgo intermedio) y de 4,1 en la mujer (riesgo bajo).1
Existe evidencia respecto a los factores de riesgos de CG en Latinoamérica basada en estudios de casos y controles. Se identifica la infección por H. pylori como el principal factor de riesgo.7 La prevalencia del H. pylori es alta, estimada en alrededor del 50% a nivel mundial, siendo mayor al 60% en la mayoría de los países en Latinoamérica.8 Un metaanálisis con información de los años 1987 a 2012 muestra una prevalencia del 69.3%.9 Respecto a los otros factores de riesgo, una revisión sistemática con la información disponible identificó como factores de riesgo el tabaquismo (OR 1,47), consumo de alcohol (OR 1,61), consumo de ají (OR 2,30), consumo total de carne (OR 1,14), consumo de carnes procesadas (OR 1,64), consumo de carnes rojas (OR 1,73), uso de sal en la mesa (OR 2,24). Los factores protectores identificados en la población latinoamericana son: alto nivel de educación (OR: 0,48), consumo de frutas (OR 0,68), consumo de vegetales (OR 0,58) y consumo de pescado (OR 0,86). Estos factores y su magnitud son similares a los identificados en otras partes del mundo.7
Algo que es particular en nuestra región, es la asociación entre la altitud y la incidencia y mortalidad por CG en los países de la zona oeste de Latinoamérica alrededor de la cordillera de los Andes, que ha sido denominado el “Enigma de los Andes”.5 En el lado este, cercanas al Atlántico, algunas poblaciones han mostrado un mayor riesgo en comparación a otras. En la zona noroeste de Brasil, por ejemplo, se observa el mayor riesgo de CG.10 Las diferencias en el riesgo pueden ser atribuidas a diferencias genéticas, al consumo de sal, factores ambientales, la prevalencia de cepas de H. pylori positivas en CagA y otras coinfecciones a nivel gastrointestinal.11
Tabla 1. Incidencia y mortalidad de cáncer gástrico en Latinoamérica y el Caribe
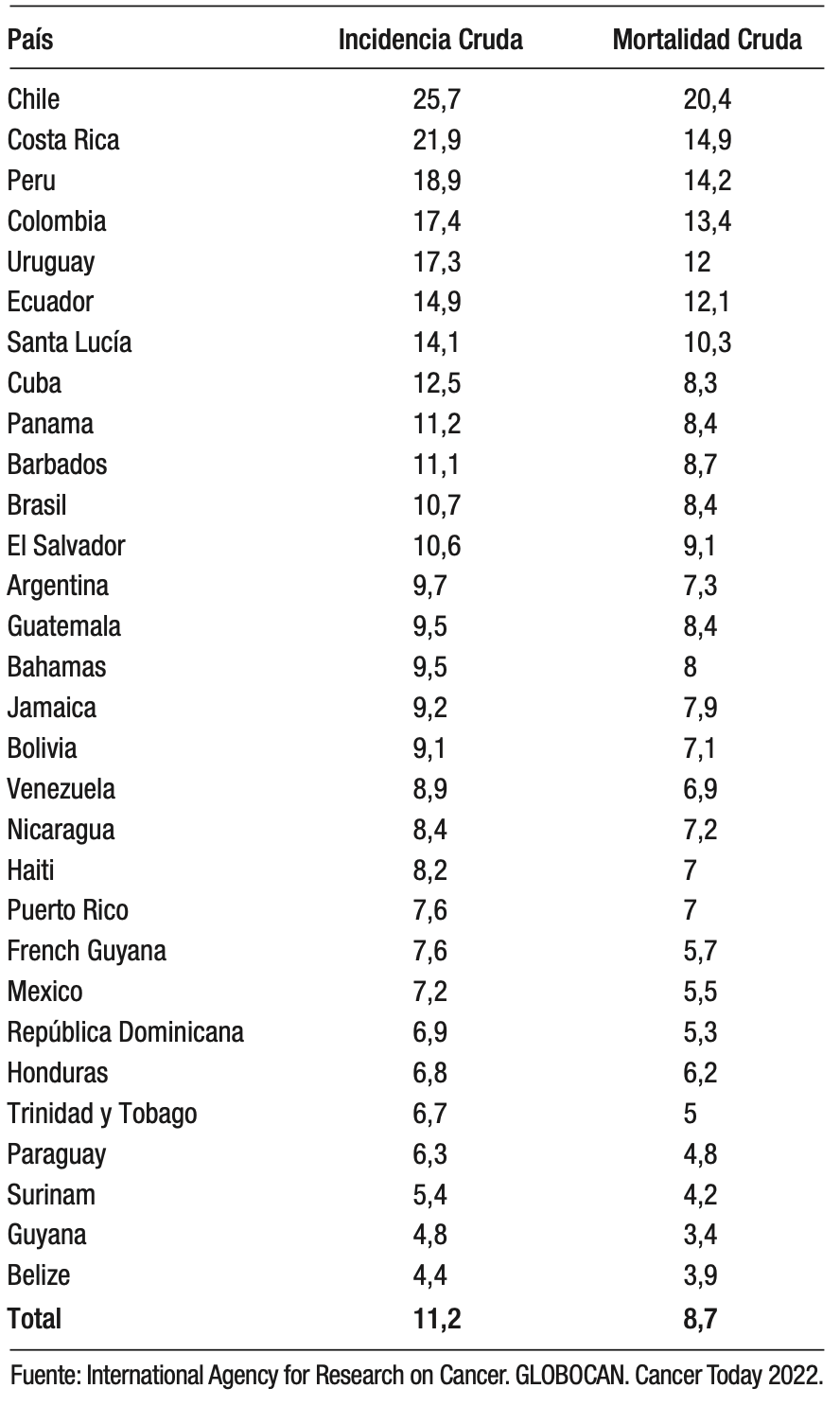
Es importante considerar que hay poblaciones que tienen un mayor riesgo de CG, como por ejemplo personas asiáticas y latinas, que tienen una incidencia 1,75 y 1,60 veces más que la población blanca en Estados Unidos.12 Un ejemplo de esto es el caso de Argentina, país considerado de bajo riesgo en el que, sin embargo, se ha observado que el sexo masculino presentaría un riesgo intermedio; además se debe considerar que cuenta con una población cosmopolita, especialmente en la región del AMBA (Ciudad y Provincia de Buenos Aires) con inmigrantes de áreas de riesgo alto e intermedio, como muchos países de Latinoamérica. La evidencia actual sugiere que, en estas poblaciones de riesgo alto, el riesgo se mantiene en la primera y la segunda generación. Por estos motivos es necesario plantear un mayor testeo para H. pylori en estas poblaciones.
Por último, es importante señalar que el patrón epidemiológico del CG está evolucionando en Latinoamérica. En primer lugar, se ha observado que en algunos lugares ha disminuido su prevalencia, con valores similares a los de los países de primer mundo. Este es el caso de Chile, donde la prevalencia histórica ha sido mayor al 70%,13 pero estudios recientes han reportado niveles menores, de hasta un 29% en adultos perteneciente a la población urbana; este hecho puede estar relacionado principalmente con la sanitización de las aguas.14;15 Por otro lado, en un análisis hecho entre 16 países en Latinoamérica y Puerto Rico se observa una tendencia de leve aumento en la mortalidad de personas menores de 50 años por esta causa, lo que es consistente con la evidencia encontrada en la población latina e hispánica de EE.UU.16,17
Prevención primaria y secundaria: definiciones
Prevención primaria: Erradicación del Helicobacter pylori
La prevención primaria del CG se basa en la modificación de los factores de riesgo para desarrollar la enfermedad. En este caso, donde el H. pylori es el principal factor de riesgo, y este a su vez es un agente infeccioso, una medida de prevención primaria fundamental es la vacunación de la población para disminuir la transmisión del germen. De acuerdo a la evidencia actual, no hay una vacuna que tenga un perfil de efectividad y seguridad que permita su uso a nivel poblacional,18 lo cual representa un problema, porque hasta este momento no se puede inmunizar a la población.
Frente a la inexistencia de una vacuna para disminuir la prevalencia de la infección del H. pylori, la erradicación de la infección se perfila como la principal forma de eliminar este factor de riesgo y es actualmente la principal medida de prevención.
El tratamiento de erradicación para el H. pylori consiste en la administración de fármacos que buscan eliminar a la bacteria del estómago. Las terapias de erradicación actuales tienen al menos dos componentes.
En primer lugar está el tratamiento antibiótico cuyo objetivo es eliminar a la bacteria. Se emplean variados fármacos; entre los más utilizados se encuentran amoxicilina, claritromicina, metronidazol, tetraciclina y levofloxacina.19
En segundo lugar, está la inhibición de la secreción de ácido por parte del estómago para alcanzar un pH gástrico igual o superior a 6, que induce al H. pylori a entrar en fase de replicación, en la cual es más susceptible al efecto del antibiótico. Los medicamentos que logran este efecto son los inhibidores de la bomba de protones (IBP), (omeprazol, pantoprazol, esomeprazol y lanzoprazol entre otros) y los bloqueadores de ácido competitivo con potasio (vonoprazán).20 También se utilizan las sales de bismuto para complementar algunos esquemas terapéuticos, especialmente las terapias cuádruples con bismuto.
El Registro Latinoamericano para el Manejo de la Infección por H. pylori (Hp-LATAM-Reg), creado en 2019 con el apoyo de Hp-EurReg y AEG, describe y evalúa las principales terapias de erradicación de H. pylori, sus tasas de erradicación, adherencia y efectos secundarios en países de Latinoamérica. Entre 2015 y 2023, seis países (Argentina, Chile, Colombia, Costa Rica, México y Perú) aportaron datos retrospectivos y prospectivos. Un análisis preliminar realizado en 2024 reportó 1378 individuos registrados, de los cuales 1218 (88%) no tenían tratamiento previo. Los resultados preliminares indican que: 1) la mayoría de los regímenes de tratamiento fueron de 14 días (n=1051, 96%) con inhibidores de la bomba de protones a dosis altas; 2) la terapia dual y la terapia cuádruple con bismuto fueron significativamente más efectivas que la terapia triple estándar; 3) la prueba diagnóstica más utilizada fue la histología (66%), y las pruebas más usadas para confirmar la erradicación fueron el antígeno monoclonal en heces (39%) y la prueba de aliento con 13C-urea (29%).21 Las tasas de erradicación de varios esquemas se asocian fuertemente con la resistencia a los antibióticos de H. pylori.
Los hallazgos del Hp-LATAM-Reg aportan información relevante para actualizar las guías nacionales y regionales de tratamiento de H. pylori; por ejemplo, en la región de Latinoamérica se deberían considerar las terapias cuádruples y duales como primera línea de tratamiento. Ya existe información sobre la efectividad de las terapias cuádruples en Latinoamérica. El estudio observacional que analizó datos del consorcio multicéntrico LEGACy comparó las terapias cuádruples con y sin bismuto contra la terapia triple estándar en población latinoamericana y europea. Las terapias cuádruples en Latinoamérica incluyeron población de Chile y Paraguay y en ambos casos se mantuvieron tasas de erradicación superiores al 90%.
La erradicación disminuye la incidencia de CG. Se ha calculado un RR de 0,6 (IC95% = 0,4-0,9) o, en otras palabras, una disminución del 40% del riesgo de incidencia de CG en pacientes erradicados comparados contra no erradicados.22,23 Se postula que esta medida tiene un mejor rendimiento cuando se realiza en pacientes que aún no tienen alteraciones histológicas preneoplásicas, ya que hasta ese momento la mucosa gástrica puede volver a la normalidad después de la erradicación del H. pylori.22 Ford y colaboradores en el año 2020 hicieron un metaanálisis para determinar el efecto de la terapia de erradicación del H. pylori, teniendo como resultado una disminución del 46% en la incidencia de CG en personas erradicadas y una reducción del 39% en la mortalidad por CG.24
Los resultados de la campaña de erradicación masiva en las islas Matsu, ubicadas en Taiwán, entre los años 2004 y 2018 apoyan estos conceptos. Hubo una disminución de la prevalencia del H. pylori desde un 64,2% a un 15%, lo cual provocó una disminución de la incidencia de CG del 53% (IC 95% = 30-69%) y de la mortalidad en un 25% (IC95% = 14-51%) en un periodo de aproximadamente 20 años, comparando estos indicadores entre el periodo 1995-2003 y 2016-2018.25
Otra población importante a tener en cuenta es la de aquellos pacientes con antecedentes de familiares de primer grado con cáncer gástrico. El antecedente familiar de cáncer gástrico duplica o triplica el riesgo. El testeo y erradicación del H. pylori de los infectados reduce la incidencia de cáncer gástrico. La evidencia más importante surge del estudio de Ju Choi y col.,26 quienes estudiaron el efecto de la erradicación de H. pylori en personas con antecedentes familiares de CG como prevención primaria, encontrando que en un seguimiento de 9,2 años, en el grupo que fue erradicado el Hazard Ratio fue de 0,45 (IC: 0,21-0,94; p = 0,03)
En términos poblacionales el consenso de Maastricht establece que el tratamiento de erradicación utilizado en cualquier población debería lograr erradicar la gran mayoría de casos, con una tasa de erradicación de al menos 90%. Esto requiere que el H. pylori sea susceptible al esquema de antibióticos usados en el tratamiento farmacológico.26
Esta medida es especialmente costo-efectiva en aquellos países con incidencia de CG mayor a 15-20 casos cada 100.000 habitantes,26 valor cercano al se encuentran varios países de América Latina.
Medidas complementarias para disminuir el riesgo de CG son el control del tabaquismo, controlar la ingesta de sal, abstenerse del consumo de alcohol, aumentar la ingesta de frutas, de vegetales y de fibra, aumentar la actividad física y mejorar la sanitización e higiene relacionada con los alimentos, porque son factores que se han relacionado con un aumento del riesgo de CG.27
Los riesgos teóricos asociados a la erradicación del H. pylori, se vinculan a la aparición de reflujo gastroesofágico (ERGE), resistencia a los antibióticos, cambios en la microbiota y enfermedades autoinmunes.
La resistencia a los antibióticos es una preocupación creciente en el manejo de las infecciones por H. pylori.
Las tasas de resistencia a antibióticos de uso común, como claritromicina, levofloxacina y metronidazol, han aumentado a nivel mundial. Por ejemplo, en la región de Asia-Pacífico se han reportado tasas de resistencia del 21% para claritromicina, 27% para levofloxacina y 45% para metronidazol.28 Esta resistencia afecta significativamente el éxito de los regímenes de erradicación, observándose que la resistencia a claritromicina y levofloxacina se asocia con un aumento de 7 y 8,2 veces en el fracaso del tratamiento, respectivamente.29
La elección de la terapia de erradicación debe considerar los patrones de resistencia locales y la exposición previa a antibióticos para optimizar los resultados del tratamiento.29
Una revisión sistemática y metaanálisis de estudios latinoamericanos publicados hasta octubre de 2013 reportaron prevalencias generales de resistencia primaria a antimicrobianos en adultos del 12% para claritromicina, 53% para metronidazol, 4% para amoxicilina, 6% para tetraciclina, 3% para furazolidona, 15% para fluoroquinolonas y 8% para la combinación de claritromicina y metronidazol.30 Si bien las prevalencias de resistencia variaron significativamente según el país, no hubo diferencias según el año de recolección de muestras. Un metaanálisis de 2019 sobre resistencia a claritromicina en residentes adultos de Santiago (Chile) mostró una prevalencia mayor (26%) y una tasa de erradicación de H. pylori subóptima (63%).31 Otro estudio realizado en Santiago reveló una mayor resistencia a levofloxacina en mujeres que en hombres (39% vs. 13%, p < 0,001),32 sugiriendo la necesidad de más estudios para explorar posibles diferencias según el sexo. Desde 2019, la OPGE apoya Hp-RESLA, un estudio multicéntrico sobre la resistencia a antibióticos moleculares de H. pylori en Latinoamérica, con el objetivo de crear una red de laboratorios regionales para PCR y secuenciación de próxima generación (NGS), utilizando biopsias gástricas recolectadas inicialmente para pruebas de ureasa rápida (RUT) y bloques de parafina incluidos en formalina.
La erradicación de H. pylori puede afectar significativamente el microbioma gastrointestinal, provocando alteraciones con posibles implicaciones clínicas. Se sabe que el uso de antibióticos en la terapia de erradicación causa disbiosis en el corto plazo, caracterizada por una disminución de la diversidad microbiana y cambios en la composición de la microbiota intestinal. A menudo esta disbiosis muestra un aumento de proteobacterias y una disminución de filos beneficiosos como Bacteroidetes y Actinobacterias.33-37
Estudios a largo plazo han demostrado que, si bien la microbiota intestinal puede experimentar inicialmente una alteración significativa, es frecuente que con el tiempo vuelva a sus niveles basales, generalmente en el plazo de un año.35,38 Sin embargo, la naturaleza transitoria de estos cambios no excluye las posibles consecuencias clínicas a corto plazo, como un aumento de la susceptibilidad a las infecciones o alteraciones metabólicas.36,38
La erradicación de H. pylori podría teóricamente provocar cambios en la secreción de ácido gástrico, especialmente en pacientes con gastritis predominantemente corporal. Esto podría dar lugar a un aumento de la secreción de ácido gástrico debido a la restitución de la masa de células parietales, lo que podría exacerbar los síntomas de la enfermedad por reflujo gastroesofágico (ERGE). Sin embargo, este escenario se considera relativamente poco frecuente.39
Un metaanálisis y varios estudios han investigado si la erradicación de H. pylori aumenta el riesgo de desarrollar ERGE. El metaanálisis no encontró ninguna asociación significativa entre la erradicación de H. pylori y el desarrollo de nuevos casos de ERGE en la población dispéptica general. Sin embargo, en estudios de cohortes se observó un mayor riesgo de ERGE erosiva en pacientes con enfermedad ulcerosa péptica (EUP), pero no en ensayos controlados aleatorizados (ECA).40
Diversos estudios clínicos han demostrado que la erradicación de H. pylori no aumenta significativamente la prevalencia de pirosis u otros síntomas de reflujo, ni empeora los síntomas en pacientes con ERGE establecida.39 Además, algunas investigaciones sugieren que la erradicación de H. pylori podría no afectar significativamente la exposición ácida esofágica o la motilidad, e incluso podría reducir el reflujo ácido hacia el esófago.41,42
La relación entre la erradicación de H. pylori y el desarrollo de enfermedades autoinmunes es compleja y ha sido explorada en diversos estudios. La evidencia sugiere que la infección por H. pylori puede desempeñar un papel en la modulación de las respuestas inmunitarias, influyendo potencialmente en el desarrollo de enfermedades autoinmunes. Un estudio analizó datos de la Base de Datos de Investigación del Seguro Nacional de Salud de Taiwán y encontró que el tratamiento de la infección por
H. pylori se asociaba con un aumento significativo del riesgo de enfermedades autoinmunes, incluida la enfermedad inflamatoria intestinal (EII).43 Este estudio destacó que el mayor riesgo no se debía únicamente a la terapia con antibióticos, ya que la razón de riesgo para desarrollar enfermedades autoinmunes fue mayor en pacientes tratados por H. pylori en comparación con aquellos tratados por infecciones del tracto urinario con antibióticos. Los posibles mecanismos que explican estas observaciones incluyen el papel de H. pylori en la inducción de la tolerancia inmunitaria. La infección por H. pylori se ha asociado con un menor riesgo de algunos trastornos inmunomediados, posiblemente debido a su capacidad para modular el sistema inmunitario del huésped.43 La erradicación de H. pylori podría alterar este equilibrio, lo que llevaría a un mayor riesgo de autoinmunidad.
Prevención secundaria: Endoscopía gastroduodenal para el tamizaje de lesiones preneoplásicas
La prevención secundaria del CG se centra en la detección temprana de lesiones precursoras mediante endoscopía digestiva alta y está fuertemente influenciada por el nivel de riesgo regional o nacional. Las lesiones precursoras incluyen atrofia gástrica, metaplasia intestinal gástrica (MIG) y displasia. A 1, 5 y 10 años de seguimiento luego del diagnóstico inicial, se diagnosticó CG en 0,3%, 0,6% y 0,8% de los pacientes con gastritis atrófica; 0,7%, 1,2% y 1,8% de los pacientes con metaplasia intestinal; 2,1%, 3,1% y 3,9% de los pacientes con displasia leve a moderada; y 24,9%, 29,5% y 32,7% de los pacientes con displasia severa (p < 0,001), según el estudio pivotal ejecutado por de Vries y col.44
Esta estrategia de prevención secundaria permite la aplicación de tratamientos curativos y mínimamente invasivos. Para una vigilancia efectiva, se recomienda categorizar a los pacientes según el sistema «Operative Link for Gastritis Assessment» (OLGA) para determinar la frecuencia de seguimiento, basado en el riesgo individual de progresión a CG.45
En Latinoamérica, se conformó una cohorte retrospectiva de 685 individuos que se sometieron a más de 2 endoscopías gastroduodenales (EGD) con biopsias con un intervalo de más de 6 meses entre 2015 y 2021, y que presentaron gastritis atrófica clasificada según el sistema OLGA y el Operative Link on Gastric Intestinal Metaplasia Assessment (OLGIM).46 Los estadios III-IV de OLGA y OLGIM se asociaron independientemente con un mayor riesgo de progresión a displasia de alto grado y CG. Un modelo de microsimulación basado en ECHOS y otros conjuntos de datos mostró que la vigilancia de la metaplasia intestinal detectada incidentalmente cada 5 años se asocia con una reducción de la incidencia y la mortalidad del CG, siendo rentable desde la perspectiva del sector sanitario.47 Estos resultados combinados respaldan el papel de la vigilancia endoscópica en pacientes latinoamericanos con estadios avanzados de OLGA/OLGIM.
Para asegurar una evaluación histológica precisa, se debe utilizar el protocolo de Sidney para la toma de biopsias gástricas (dos muestras de antro, una del ángulo y dos del cuerpo, en frascos separados) junto con la estadificación y gradación histológica OLGA y OLGIM. Los estadios III/IV de OLGA/OLGIM presentan el mayor riesgo, siendo la metaplasia intestinal incompleta un factor de alto riesgo. La alta concordancia inter e intraobservador para la MIG favorece la elección de OLGIM para la clasificación.
Para asegurar una endoscopía de calidad, se recomiendan:
• Utilizar equipos de alta definición con magnificación y cromo endoscopía.
• Limpiar adecuadamente la mucosa gástrica (la N-acetilcisteína y la simeticona pueden ser útiles).
• Documentar fotográficamente todas las áreas durante al menos 7 minutos.
La medida de prevención secundaria complementaria a la primera es el tamizaje con biomarcadores serológicos para identificar a aquellos pacientes con mayor probabilidad de presentar lesiones preneoplásicas. Se han estudiado de forma extensa en Japón, siendo los pepsinógenos I y la relación pepsinógeno I/II los que tienen más evidencia en favor de su uso.45 También se describen otros biomarcadores que hasta el momento tienen menos evidencia respecto a su utilidad y se encuentran en estudio, que podrían ser utilizados en el futuro, como el antígeno de cáncer 15-3 (CA15-3),48 el trefoil factor 3 (TFF3),49 la proteína reactiva C de alta sensibilidad (PCR),50 la poliposis adenomatosa coli (APC),51 los anticuerpos anti-factor intrínseco (IFAs)52 y la detección de MicroRNA.53
Por último, queremos mencionar la iniciativa HOPE-Hp-GC, liderado por CECAN desde 2023 en Molina (región del Maule, área de alto riesgo), donde se realiza un cribado inicial con pruebas de H. pylori pepsinógenos, considerando comorbilidades basales para evaluar el riesgo de CG (bajo o intermedio-alto). Si la prueba de H. pylori resulta positiva, se procede al tratamiento; posteriormente, los pacientes con riesgo intermedio-alto se someten a una VEDA con protocolo de biopsia de Sidney y evaluación OLGA (tras el tratamiento de H. pylori o directamente si es negativa).54 El seguimiento para pacientes de riesgo intermedio-alto es de cinco años para pacientes con OLGA 0 e infección persistente por H. pylori, y para pacientes con OLGA I-II; y de tres años para pacientes con OLGA III/IV. No se recomienda realizar seguimiento en pacientes con OLGA 0 y sin infección por H. pylori. Los resultados preliminares en Molina (1100 pruebas de aliento con urea, 49% positivos) activaron la cobertura universal para el tratamiento de erradicación y reembolso para más de 500 pacientes, reduciendo la lista de espera de VEDA en un 63% gracias a una nueva unidad de endoscopía. Se espera que otros centros de Chile y Latinoamérica se sumen a esta iniciativa, que incluye un cribado serológico no invasivo seguido de VEDA en 2025.
Experiencia latinoamericana en la prevención del cáncer gástrico en Latinoamérica
La mayoría de los sistemas de salud en Latinoamérica (LAC) presentan deficiencias significativas: protección financiera inadecuada contra los costos de la atención médica y una prestación de servicios fragmentada.55 La prevención, en particular, recibe poca atención. Por ello, urge la implementación de estrategias de prevención del CG para reducir los altos costos sociales y económicos asociados a esta enfermedad.56 Un marco estratégico basado en evidencia, recientemente propuesto, podría guiar las acciones inmediatas en toda la región para prevenir y controlar el CG en las Américas.56 Este marco se alinea con el Código LAC contra el Cáncer de 2023, que incluye, dentro del Código Mundial contra el Cáncer, la realización de pruebas y tratamiento para H. pylori como parte de programas de salud pública específicos.57 En los últimos años, la Organización Panamericana de Gastroenterología (OPGE), en colaboración con organizaciones europeas y norteamericanas (incluyendo el Instituto Nacional del Cáncer de EE. UU.), ha impulsado iniciativas regionales para la prevención primaria del CG.
Un consenso sobre el manejo de la infección por H. pylori en Latinoamérica, realizado en 2014 bajo el patrocinio de la Sociedad Chilena de Gastroenterología, contó con la participación de un grupo multidisciplinario de expertos y sentó las bases para diversas iniciativas en la región.23 Este consenso, junto con otro realizado por la Asociación Chilena de Endoscopía Digestiva (ACHED) sobre el diagnóstico endoscópico y seguimiento de las lesiones premalignas gástricas, recomendó la toma de biopsias sistemáticas, el uso del protocolo de Sidney y la estadificación OLGA/OLGIM.58 La OPGE también lidera el estudio GC-GAP para evaluar la preparación de políticas públicas contra el CG a través de un índice basado en políticas públicas utilizando el método Delphi, con la participación de expertos internacionales.
Chile ha implementado varias iniciativas y leyes relacionadas con la prevención del cáncer con posible impacto positivo en el CG. Esto incluye el programa «Elige vivir sano» (2015),59 la ley de etiquetado de alimentos (2016),60 la Ley del Cáncer (2022),61 y la creación del Centro de Excelencia para la Prevención y el Control del Cáncer (CECAN) en 2023 (https://cecan.cl/). La cobertura universal incluye acceso a terapia para CG y H. pylori.62 Sin embargo, la política de 2006 sobre EGD para mayores de 40 años ha generado largas listas de espera, lo que ha impulsado un estudio piloto con biomarcadores no invasivos para mejorar el acceso a la EGD.54 El consenso chileno de 2023 recomienda una estrategia de prueba y tratamiento para H. pylori (35-44 años) y una combinada (serología IgG H. pylori y EGD) para mayores de 45 años, alineada con el Consenso Maastricht/Florencia VI.26
La Sociedad Anticancerosa de Venezuela lanzó en 2023 un programa de cribado para lesiones premalignas en familiares de primer grado de pacientes con CG en el Hospital de Caracas.63
En Ecuador la estrategia nacional para la atención integral del cáncer (2017-2023) recomienda el cribado de CG en mayores de 50 años mediante pruebas serológicas para H. pylori y pepsinógenos, combinadas con endoscopía digestiva superior, utilizando el método ABC para determinar la frecuencia de los estudios endoscópicos.64
En Argentina disponemos de la Ley de etiquetado de alimentos (identifica a los alimentos con exceso de sal, azúcar) y el Instituto Nacional del Cáncer (INC) pero el CG no está dentro de sus líneas prioritarias. No disponemos de una estrategia de prevención nacional. Es necesario implementar estrategias de prevención primaria en los grupos de riesgo y estrategias de prevención individualizadas basadas en la presencia de lesiones precursoras de CG, en particular la MIG como prevención secundaria.
Conclusiones y puntos clave
El CG representa una carga significativa en Latinoamérica, siendo el más frecuente el tipo no cardial, asociado a la infección por H. pylori. El diagnóstico tardío es común, resultando en bajas tasas de supervivencia a 5 años. La alta prevalencia de H. pylori en la región junto con factores de riesgo como tabaquismo, consumo de alcohol, dieta rica en carnes procesadas y alta ingesta de sal, y la existencia de factores protectores como la educación y el consumo de frutas y verduras, hacen urgente la implementación de estrategias de prevención. La disparidad geográfica, con mayor incidencia en zonas andinas («Enigma de los Andes») y en el noroeste de Brasil, y el mayor riesgo en poblaciones asiáticas y latinas, requieren enfoques específicos. La disminución de la prevalencia en algunas zonas (Chile, por ejemplo), relacionada con mejoras en la higiene y el saneamiento, muestra la importancia de realizar intervenciones a nivel público. La erradicación de H. pylori es clave en la prevención primaria, reduciendo la incidencia y mortalidad del CG. La prevención secundaria, basada en la endoscopía para la detección temprana de lesiones precursoras (atrofia gástrica, metaplasia intestinal, displasia) es crucial para mejorar el pronóstico, y debe considerar el protocolo de Sidney y la estratificación de riesgo OLGA/OLGIM. Se deben considerar, además, la utilidad de biomarcadores serológicos.
Para abordar eficazmente la prevención del CG, Latinoamérica necesita un enfoque integral que combine varias estrategias. En primer lugar, es fundamental implementar programas de detección y erradicación de H. pylori, teniendo en cuenta los patrones de resistencia antibiótica específicos de cada región, evitando el uso de antibióticos donde la resistencia a antibióticos del H. pylori sea mayor al 15%, en alineamiento con la guía de Maastricht. Si se planteara la estrategia de testear y tratar en la población general, se deberían favorecer los tratamientos que sean de mejor adherencia y más fáciles de prescribir por profesionales no especialistas, como son las terapias duales con amoxicilina o tetraciclina junto a altas dosis de inhibidores de bomba de protones, de acuerdo a la resistencia local a la amoxicilina. En los otros contextos se deberían preferir terapias cuádruples para erradicar pacientes diagnosticados, ya que han demostrado consistentemente tasas de erradicación sobre el 90%.
Simultáneamente, se deben establecer programas de cribado endoscópico, particularmente en áreas de alto riesgo, utilizando metodologías estandarizadas como el protocolo de Sidney y la estadificación OLGA/OLGIM para una evaluación precisa. A su vez, es crucial desarrollar e implementar campañas de salud pública para promover estilos de vida saludables, enfocándose en la reducción de factores de riesgo modificables como el consumo de tabaco y alcohol, la dieta y la actividad física. Finalmente, se requiere una inversión significativa en infraestructura sanitaria para asegurar un acceso equitativo a las pruebas de diagnóstico y los tratamientos para todos. Por último, el apoyo a la investigación científica es fundamental para comprender mejor las causas del CG, especialmente las disparidades regionales y el “Enigma de los Andes”, lo que permitirá el desarrollo de estrategias de prevención más efectivas. Riquelme y col., compartieron 13 recomendaciones que sintetizan el enfoque para Latinoamérica:
Tabla 2. Recomendaciones para la prevención del cáncer gástrico en Latinoamérica, por Riquelme y col.

Fuentes de financiamiento. FONDECYT 1230504 (AR) “Role of the genomic and microbiome profile in gastric carcinogenesis: prospective endoscopic follow-up”; ANID FONDAP 152220002 (AR) “Center for Cancer Prevention and Control (CECAN)”.
Propiedad intelectual. Los autores declaran que los datos, las figuras y las tablas presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2024 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Laudanno O, Riquelme A y Medel-Jara P. Prevención del cáncer gástrico: Contexto y experiencia Latinoamericana. Acta Gastroenterol Latinoam. 2024;54(4):299-309. https://doi.org/10.52787/agl.v54i4.456
Referencias
- International Agency for Research on Cancer. GLOBOCAN. Cancer Today 2022 [Available from: https://gco.iarc.fr/today/en/dataviz/tablesmode=cancer&group_populations=1&multiple_populations=1
- CORREA P, PIAZUELO MB. The gastric precancerous cascade. Journal of digestive diseases. 2012;13:2-9.
- Ferlay J, Ervik M, Lam F, Laversanne M, Colombet M, Mery L, et al. Global Cancer Observatory: Cancer Today. 2024.
- Dominguez RL, Montalvan-Sanchez EE, Norwood DA, Rodriguez-Murillo A, Dominguez L, Estevez Ordoñez D, et al. Population-Based Study of Gastric Cancer Survival and Associations in Rural Western Honduras. Cancer Epidemiol Biomarkers Prev. 2024;33(12):1578-85.
- Torres J, Correa P, Ferreccio C, Hernandez-Suarez G, Herrero R, Cavazza-Porro M, et al. Gastric cancer incidence and mortality is associated with altitude in the mountainous regions of Pacific Latin America. Cancer Causes Control. 2013;24(2):249-56.
- Piñeros M, Frech S, Frazier L, Laversanne M, Barnoya J, Garrido C, et al. Advancing Reliable Data for Cancer Control in the Central America Four Region. J Glob Oncol. 2018;4:1-11.
- Bonequi P, Meneses-González F, Correa P, Rabkin CS, Camargo MC. Risk factors for gastric cancer in Latin America: a meta-analysis. Cancer Causes Control. 2013;24(2):217-31.
- Li Y, Choi H, Leung K, Jiang F, Graham DY, Leung WK. Global prevalence of Helicobacter pylori infection between 1980 and 2022: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2023;8:553-64.
- Curado MP, de Oliveira MM, de Araújo Fagundes M. Prevalence of Helicobacter pylori infection in Latin America and the Caribbean populations: A systematic review and meta-analysis. Cancer Epidemiol. 2019;60:141-8.
- Aguiar KEC, Oliveira IS, Cohen-Paes AN, Coelho RCC, Vinagre L, Rodrigues JCG, et al. Molecular Profile of Variants in CDH1, TP53, PSCA, PRKAA1, and TTN Genes Related to Gastric Cancer Susceptibility in Amazonian Indigenous Populations. J Pers Med. 2023;13(9).
- Correa P, Piazuelo MB. Helicobacter pylori Infection and Gastric Adenocarcinoma. US Gastroenterol Hepatol Rev. 2011;7(1):59-64.
- Sociedad Americana Contra El Cancer. Datos y Estadísticas sobre el Cáncer entre los Hispanos/Latinos 2018-2020. Atlanta: Sociedad Americana Contra El Cancer; 2018.
- Ferreccio C, Rollán A, Harris PR, Serrano C, Gederlini A, Margozzini P, et al. Gastric Cancer is Related to Early Helicobacter pylori Infection in a High-Prevalence Country. Cancer Epidemiol Biomarkers. 2007;16:662-7
- Da Costa D, Guidotti F, Cabello N, Trigo F, Contreras C, Vergara F, et al. Helicobacter pylori infection detected during upper gastrointestinal endoscopy. Rev Med Chil. 2018;146(5):555-61.
- Silva F, Latorre G, Medel P, Bustamante M, Montero I, Robles C, et al. Reduction in Helicobacter pylori infection among patients referred for upper gastrointestinal endoscopy in Santiago, Chile, between 2010-2020. Rev Gastroenterol Peru. 2024;44(1):14-20.
- Torres-Roman JS, Alvarez CS, Guerra-Canchari P, Valcarcel B, Martinez-Herrera JF, Dávila-Hernández CA, et al. Sex and age differences in mortality trends of gastric cancer among Hispanic/Latino populations in the United States, Latin America, and the Caribbean. Lancet Reg Health Am. 2022;16:100376.
- Anderson WF, Rabkin CS, Turner N, Fraumeni JF, Jr., Rosenberg PS, Camargo MC. The Changing Face of Noncardia Gastric Cancer Incidence Among US Non-Hispanic Whites. J Natl Cancer Inst. 2018;110(6):608-15.
- Santos ID, Cordeiro ML, Santos H, Souza VLd, Bittencourt B, França FA, et al. Vaccine development against Helicobacter pylori: from ideal antigens to the current landscape. EXPERT REVIEW OF VACCINES. 2021.
- MINSAL. Tratamiento de erradicación de Helicobacter pylori en el paciente con úlcera péptica. In: Enfermedades SdSPDdPyCd, editor. Santiago de Chile 2013.
- Muñoz JM, Regino WO, Zuleta MG. How can Helicobacter pylori eradication therapies be improved? Rev Colob Gastroenterol. 2018;33:427-37.
- Reyes-Placencia D, Remes-Troche JM, Laudanno O, Otero W, Piscoya A, Otoya G, et al. Sa1360 Helicobacter Pylori Diagnostic Tests and Indications of Treatment from the Latin American Registry on the Management of Helicobacter Pylori Infection (Hp-Latamreg). Gastroenterology. 2024;166(5):S-429.
- Malfertheiner P, Megraud F, O’Morain CA, Atherton J, Axon ATR, Bazzoli F, et al. Management of Helicobacter pylori infection – the Maastricht IV / Florence Consensus Report. Gut. 2012;61:646-64.
- Rollan A, Arab JP, Camargo MC, Candia R, Harris P, Ferreccio C, et al. Management of Helicobacter pylori infection in Latin America: A Delphi technique-based consensus. World J Gastroenterol. 2014;20:10969-89.
- Ford A, Yuan Y, Forman D, Hunt R, Moayyedi P. Helicobacter pylori eradication for the prevention of gastric neoplasia. Cochrane Database Syst Rev. 2020;6.
- Chiang T-H, Chang W-J, Chen SL-S, Yen AM-F, Fann JC-Y, Chiu SY-H, et al. Mass eradication of Helicobacter pylori to reduce gastric cancer incidence and mortality: a long-term cohort study on Matsu Islands. Gut. 2021;70:243-50.
- Choi, I. J., Kim, C. G., Lee, J. Y., Kim, Y. I., Kook, M. C., Park, B. et al. Family History of Gastric Cancer and Helicobacter pylori Treatment. The New England journal of medicine 2020 382(5), 427-436
- Malfertheiner P, Megraud F, Rokkas T, Gisbert JP, Liou J-M, Schulz C, et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut. 2022;0:1-39.
- Ilic M, Ilic I. Epidemiology of stomach cancer. World J Gastroenterol. 2022;28:1187-203.
- Liou JM, Lee YC, Wu MS. Treatment of Helicobacter pylori infection and its long-term impacts on gut microbiota. J Gastroenterol Hepatol. 2020;35(7):1107-16.
- Shah SC, Iyer PG, Moss SF. AGA Clinical Practice Update on the Management of Refractory Helicobacter pylori Infection: Expert Review. Gastroenterology. 2021;160(5):1831-41.
- Camargo MC, García A, Riquelme A, Otero W, Camargo CA, Hernandez-García T, et al. The problem of Helicobacter pylori Resistance to Antibiotics A Systematic Review in Latin America. Am J Gastroenterol. 2014;109:485-95.
- Arenas A, Serrano C, Quiñones L, Harris P, Sandoval M, Lavanderos M, et al. High prevalence of clarithromycin resistance and effect on Helicobacter pylori eradication in a population from Santiago, Chile: cohort study and meta-analysis. Scientific Reports. 2019;9.
- González-Hormazábal P, Arenas A, Serrano C, Pizarro M, Fuentes-López E, Arnold J, et al. Prevalence of Helicobacter pylori Antimicrobial Resistance Among Chilean Patients. Archives of Medical Research. 2021;12.
- Sitkin S, Lazebnik L, Avalueva E, Kononova S, Vakhitov T. Gastrointestinal microbiome and Helicobacter pylori: Eradicate, leave it as it is, or take a personalized benefit-risk approach? World J Gastroenterol. 2022;28(7):766-74.
- Li Y, He C, Lu N. Impacts of Helicobacter pylori infection and eradication on gastrointestinal microbiota: An up-to-date critical review and future perspectives. Chin Med J
(Engl). 2024. - Liou JM, Chen CC, Chang CM, Fang YJ, Bair MJ, Chen PY, et al. Long-term changes of gut microbiota, antibiotic resistance, and metabolic parameters after Helicobacter pylori eradication: a multicentre, open-label, randomised trial. Lancet Infect Dis. 2019;19(10):1109-20.
- Yap TW, Gan HM, Lee YP, Leow AH, Azmi AN, Francois F, et al. Helicobacter pylori Eradication Causes Perturbation of the Human Gut Microbiome in Young Adults. PLoS One. 2016;11(3):e0151893.
- Hsu PI, Pan CY, Kao JY, Tsay FW, Peng NJ, Kao SS, et al. Short-term and long-term impacts of Helicobacter pylori eradication with reverse hybrid therapy on the gut microbiota. J Gastroenterol Hepatol. 2019;34(11):1968-76.
- Du L, Chen B, Cheng F, Kim J, Kim JJ. Effects of Helicobacter pylori Therapy on Gut Microbiota: A Systematic Review and Meta-Analysis. Dig Dis. 2024;42(1):102-12.
- Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. (1572-0241 (Electronic).
- Yaghoobi M, Farrokhyar F, Yuan Y, Hunt RH. Is there an increased risk of GERD after Helicobacter pylori eradication?:
a meta-analysis. Am J Gastroenterol. 2010;105(5):1007-13; quiz 6, 14. - Zhao T, Liu F, Li Y. Effects of Helicobacter pylori eradication on esophageal motility, esophageal acid exposure, and gastroesophageal reflux disease symptoms. Front Cell Infect Microbiol. 2023;13:1082620.
- Zullo A, Hassan C, Repici A, Bruzzese V. Helicobacter pylori eradication and reflux disease onset: did gastric acid get «crazy»? World J Gastroenterol. 2013;19(6):786-9.
- Lin KD, Chiu GF, Waljee AK, Owyang SY, El-Zaatari M, Bishu S, et al. Effects of Anti-Helicobacter pylori Therapy on Incidence of Autoimmune Diseases, Including Inflammatory Bowel Diseases. Clin Gastroenterol Hepatol. 2019;17(10):1991-9.
- de Vries AC, van Grieken NC, Looman CW, Casparie MK, de Vries E, Meijer GA, et al. Gastric cancer risk in patients with premalignant gastric lesions: a nationwide cohort study in the Netherlands. Gastroenterology. 2008;134(4):945-52.
- Bornschein J, Bird-Lieberman EL, Malfertheiner P. The Rationale and Efficacy of Primary and Secondary Prevention in Adenocarcinomas of the Upper Gastrointestinal Tract. Dig Dis. 2019;37:381-93.
- Latorre G, Silva FA-O, Montero I, Bustamante M, Dukes E, Uribe J, et al. Comparison of OLGA and OLGIM as predictors of gastric cancer in a Latin American population: the ECHOS Study. (1468-3288 (Electronic).
- Thiruvengadam NR, Gupta S, Buller S, Awad I, Gandhi D, Ibarra A, et al. The Clinical Impact and Cost-Effectiveness of Surveillance of Incidentally Detected Gastric Intestinal Metaplasia: A Microsimulation Analysis. (1542-7714 (Electronic).
- National Cancer Institute. CA 15-3 [Available from: https://www.cancer.gov/espanol/publicaciones/diccionarios/diccionario-cancer/def/ca-15-3
- National Cancer Institute. TFF3: National Cancer Institute; [Available from: https://edrn.nci.nih.gov/data-and-resources/biomarkers/tff3/
- E A, A Y, C C, G T. The role of high sensitive C-reactive protein and histopathological evaluation in chronic gastritis patients with or without Helicobacter pylori infection. Acta Cir Bras. 2021;34.
- John Hopkins Medicine. APC I1370K and Colorectal Cancer
[12-02]. Available from: https://www.hopkinsmedicine.org/health/
conditions-and-diseases/colon-cancer/apc-i1307k-and-colorectal-cancer - Song M, Camargo MC, Katki HA, Weinstein SJ, Männistö S, Albanes D, et al. Association of Antiparietal Cell and Anti-Intrinsic Factor Antibodies With Risk of Gastric Cancer. JAMA Oncol. 2022;8:1-7.
- JBY S, R K, F Z, C K, L Z, R Z, et al. Development and validation of a serum microRNA biomarker panel for detecting gastric cancer in a high-risk population. Gut. 2021;70:829-37.
- Corsi Sotelo Ó, Pizarro Rojas M, Rollán Rodríguez A, Silva Figueroa V, Araya Jofré R, Bufadel Godoy ME, et al. Chilean consensus by expert panel using the Delphi technique for primary and secondary prevention of gastric cancer. (0210-5705 (Print).
- Roberti J, Leslie HH, Doubova SV, Ranilla JM, Mazzoni A, Espinoza L, et al. Inequalities in health system coverage and quality: a cross-sectional survey of four Latin American countries. Lancet Glob Health. 2024;12(1):e145-e55.
- Riquelme A, Abnet CC, Goodman KJ, Piazuelo MB, Ruiz-Garcia E, de Assumpção PP, et al. Recommendations for gastric cancer prevention and control in the Americas. Lancet Reg Health Am. 2023;27:100608.
- Herrero R, Carvajal LJ, Camargo MC, Riquelme A, Porras C, Ortiz AP, et al. Latin American and the Caribbean Code Against Cancer 1st edition: Infections and cancer. Cancer Epidemiol. 2023;86 Suppl 1:102435.
- Rollán A, Cortés P, Calvo A, Araya R, Bufadel ME, González R, et al. [Recommendations of the Chilean Association for Digestive Endoscopy for the management of gastric pre-malignant lesions]. Rev Med Chil. 2014;142(9):1181-92.
- Chile Atiende. Elige vivir sano 2024 [Available from: https://www.chileatiende.gob.cl/fichas/10435-elige-vivir-sano%5D%5D
- Taillie LS, Bercholz M, Popkin B, Reyes M, Colchero MA, Corvalán C. Changes in food purchases after the Chilean policies on food labelling, marketing, and sales in schools: a before and after study. Lancet Planet Health. 2021;5(8):e526-e33.
- Ministerio de Salud. Guía legal soble Ley del cáncer 2021 [Available from: https://www.bcn.cl/leychile/navegar?idNorma=1149004
- Ministerio de Salud. Problemas de Salud, 80. Tratamiento de erradicación del Helicobacter pylori [Available from: https://www.superdesalud.gob.cl/orientacion-en-salud/tratamiento-de-erradicacion-del-helicobacter-pylori/
- Venezuela SAd. Boletin General. 2023.
- Estrategia nacional para la atención integral del cáncer en el Ecua-
dor, (2017).
Correspondencia: Patricio Medel-Jara
Correo electrónico: pamedel@uc.cl
Acta Gastroenterol Latinoam 2024;54(4):299-309
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE


