Edison Javier Moreira Granda ID· Santiago Regnasco ID· Josefina Romero ID· Itatí Guerríeri ID
Susana Misino ID· Diego Gariglio ID· Bárbara Chiussi ID· Hernán Bracone ID· Emilia Saá ID
Hospital General de Agudos Dr. Ignacio Pirovano.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2024;54(4):318-326
Recibido: 18/10/2024 / Aceptado: 13/12/2024 / Publicado online el 30/12/2024 /
https://doi.org/10.52787/agl.v54i4.443
Resumen
Introducción. El cáncer colorrectal es una de las neoplasias más frecuentes y un grave problema de salud pública global. En Argentina, en 2020, se registraron 15.605 nuevos casos de cáncer colorrectal y, en 2022, 7.217 muertes que representaron el 12% de todas las muertes por tumores malignos. El Programa Nacional de Prevención y Detección Temprana del Cáncer Colorrectal recomienda la realización bienal del test inmunológico de sangre oculta en materia fecal en personas de 50 a 75 años que no presentan antecedentes personales o familiares de cáncer colorrectal, historia de enfermedad inflamatoria intestinal, síntomas ni factores de riesgo conocidos. Para los grupos de riesgo, se establecen evaluaciones específicas ajustadas a sus necesidades. El resultado positivo del test inmunológico de sangre oculta en materia fecal requiere practicar una videocolonoscopía, la prueba más sensible para la detección temprana de neoplasias colorrectales. Objetivos. Evaluar la tasa de TSOMF-I con resultado positivo. Describir el porcentaje de pacientes que se realizan una VCC tras un resultado de TSOMF-I positivo. Evaluar la tasa de detección de adenomas y la prevalencia de CCR en pacientes con TSOMF-I positivo. Materiales y métodos. Análisis retrospectivo mediante la revisión de los datos de individuos entre 50 y 75 años de edad con test inmunológico de sangre oculta en materia fecal positivo y de las videocolonoscopías realizadas en el Hospital Pirovano, Ciudad Autónoma de Buenos Aires, del 1° de enero de 2020 al 1° de enero de 2024. Resultados. Se evaluaron 717 pacientes. En el 21,6% (n=155) el resultado del test inmunológico de sangre oculta en materia fecal fue positivo, pero solo el 42,6% (n=66) se realizó la videocolonoscopía. Entre ellos, se encontraron hallazgos en el 80% de los casos, principalmente pólipos (36,4%), hemorroides internas (34,8%), diverticulosis (18,1%) y angiectasias (4,5%). La prevalencia de cáncer colorrectal fue del 3% y la tasa de detección de adenomas del 33,3%. Conclusión. El estudio evidenció una alta prevalencia de lesiones colorrectales, incluyendo adenomas y cáncer colorrectal, con cifras que se asemejan a las publicadas por otros trabajos internacionales. Los resultados obtenidos reflejan la eficacia del tamizaje mediante el test inmunológico de sangre oculta en materia fecal para identificar lesiones colorrectales relevantes. Un hallazgo clave fue que menos de la mitad de los pacientes con test inmunológico de sangre oculta en materia fecal positivo se realizaron una videocolonoscopía posterior, lo que indica la existencia de barreras importantes en el acceso a dicho estudio en nuestro medio y refuerza la necesidad de implementar estrategias para aumentarlo. Estos hallazgos son cruciales para optimizar los programas de tamizaje de cáncer colorrectal en Argentina, adaptándolos a las necesidades de la población local y mejorando los resultados en salud pública.
Palabras claves. Neoplasias colorrectales, prueba de sangre oculta en materia fecal, colonoscopía, tamizaje de cáncer colorrectal.
Colonoscopic Findings in Patients with a Positive Fecal Occult Blood Test: A Descriptive Study
Summary
Introduction. Colorectal cancer is one of the most frequent neoplasms and a serious public health concern worldwide. In 2020, in Argentina, 15,605 new cases of colorectal cancer were registered and, in 2022, 7,217 deaths representing 12% of all deaths from malignant tumors. The National Program for the Prevention and Early Detection of Colorectal Cancer recommends that people between 50 and 75 years of age with no personal or family history of colorectal cancer, no history of inflammatory bowel disease, no suggestive symptoms, and no known risk factors should undergo biennial immunological fecal occult blood test. For at-risk groups, specific evaluations are performed based on their specific needs. A positive result of the immunologic fecal occult blood test requires a colonoscopy, the most sensitive test for early detection. Aim. To assess the rate of TSOMF-I with a positive result. To describe the percentage of patients who undergo VCC after a positive TSOMF-I result. To assess the adenoma detection rate and prevalence of CRC in patients with TSOMF-I-positive. Materials and methods. A retrospective analysis was performed, in which data were collected from individuals between 50 and 75 years of age with positive immunologic fecal occult blood test and colonoscopies performed at Hospital Pirovano, Ciudad Autónoma de Buenos Aires, from January 1, 2020 to January 1, 2024. Results. A total of 717 patients were evaluated. A positive result on immunologic fecal occult blood test was observed in 21.6% (n=155) of the cohort, but only 42.6% (n=66) underwent colonoscopy. Findings were identified in 80% of cases, predominantly polyps (36.4%), internal hemorrhoids (34.8%), diverticulosis (18.1%) and angiectasis (4.5%). The prevalence of colorectal cancer was 3%, with an adenoma detection rate of 33.3%. Conclusion. This study showed a high prevalence of colorectal lesions, including adenomas and colorectal cancer, with figures that resemble those published by other international studies. The results obtained reflect the efficacy of immunological fecal occult blood test screening to identify relevant colorectal lesions. A key finding was that less than half of the patients with positive immunological fecal occult blood test underwent subsequent colonoscopy, which indicates the existence of important barriers to access to this study in our setting and reinforces the need to implement strategies to increase it. These findings are crucial to optimizing colorectal cancer screening programs in Argentina, adapting them to the needs of the local population and improving public health outcomes.
Keywords. Colorectal neoplasms, fecal occult blood test, colonoscopy, colorectal cancer screening.
Abreviaturas
CCR: Cáncer colorrectal.
PNCCR: Programa Nacional de Prevención y Detección Temprana del Cáncer Colorrectal.
TSOMF-I: Test de sangre oculta en materia fecal – Inmunológico.
EII: Enfermedad inflamatoria intestinal.
VCC: Videocolonoscopía.
TSOMF-Q: Test de sangre oculta en materia fecal – Químico.
Hb: Hemoglobina.
TDA: Tasa de detección de adenomas.
LNA: Lesión neoplásica avanzada.
VPP: Valor predictivo positivo.
VPN: Valor predictivo negativo.
SIGEHOS: Sistema Informático de Gestión Hospitalaria.
LST: Laterally spreading tumors (Lesiones de extensión lateral).
Introducción
El cáncer colorrectal (CCR) es uno de los tumores malignos más frecuentes y representa un problema de salud pública a nivel mundial. Para el año 2020 se estimó en Argentina una incidencia de 15.605 nuevos casos de CCR, siendo la segunda causa de cáncer para ambos sexos por debajo del cáncer de mama en mujeres y el cáncer de próstata en hombres. Durante el año 2022 se registraron en Argentina 7.217 defunciones por CCR, siendo la segunda causa de muerte por cáncer en nuestro país, lo que representó el 12,12% del total de muertes por tumores malignos.1
El Programa Nacional de Prevención y Detección Temprana del Cáncer Colorrectal (PNCCR) se dirige a dos grupos: por un lado, recomienda la realización del test inmunológico de sangre oculta en materia fecal (TSOMF-I) de forma bienal a hombres y mujeres entre 50 y 75 años que no presentan antecedentes personales o familiares de CCR, historia de enfermedad inflamatoria intestinal (EII), síntomas ni factores de riesgo conocidos. Por otro lado, aconseja a las personas con riesgo incrementado (con antecedentes familiares y/o personales) la evaluación con videocolonoscopía (VCC) a fin de determinar los pasos a seguir en cada caso.2
Existen dos tipos de test de sangre oculta en materia fecal: los químicos (TSOMF-Q) y los inmunológicos o inmunoquímicos (TSOMF-I).
Los TSOMF-Q (prueba de guayaco) son eficaces para reducir la mortalidad y la incidencia del CCR pero tienen numerosos inconvenientes, entre los que destacan su baja sensibilidad para la detección de CCR precoz y adenomas avanzados, por lo que no se recomienda su uso.3
Las pruebas inmunoquímicas se basan en una reacción antígeno-anticuerpo (ELISA, aglutinación de partículas de látex sensibilizadas, inmunocromatografía) que detecta solamente (Hb) fecal humana, sin requerir de restricciones dietéticas o farmacológicas, lo que facilita su aceptación. Como ventaja adicional, son poco sensibles a los sangrados de origen gastrointestinal alto, ya que la hemoglobina que proviene del tracto digestivo superior por lo general se encuentra desnaturalizada y los epítopos reconocibles por los anticuerpos son destruidos. A diferencia de las pruebas químicas, que necesitan múltiples muestras para aumentar la probabilidad de detectar sangrados intermitentes o mínimos, las inmunoquímicas son más precisas en cada medición individual. A su vez, pueden ser automatizadas, lo que mejora la eficiencia del análisis y minimiza la posibilidad de errores manuales. Para el tamizaje del CCR en la población general se establece como estrategia más apropiada el TSOMF-I. Este método de pesquisa ha demostrado una reducción de la incidencia y mortalidad por CCR en estudios controlados y randomizados, y es una de las estrategias de pesquisa considerada costo-efectiva para la población entre 50 y 75 años. En el caso de que el TSOMF-I sea positivo, el paciente debe ser derivado para una VCC complementaria, asegurando la accesibilidad y la calidad del estudio. Si en la VCC hay hallazgos patológicos, se hará tratamiento y seguimiento individualizado de acuerdo a las normativas vigentes.3
Estos tests pueden ser cualitativos o cuantitativos. En los primeros, la lectura se lleva a cabo en 5 minutos utilizando tiras reactivas impregnadas de anticuerpos contra la Hb. El gran avance en el desarrollo de los TSOMF-I ha llegado con el desarrollo de equipos que permiten cuantificar la cantidad de Hb fecal, el punto de corte puede variar dependiendo del fabricante o las guías clínicas locales. Generalmente, se establece en un rango que suele estar entre 50 y 100 ng/mL de buffer. El análisis automatizado es fiable, preciso y permite procesar hasta 50 muestras en una hora, lo que los hace ideales para el cribado de base poblacional. Además, los tests inmunológicos detectan cantidades de Hb fecal 7 a 15 veces inferiores a las detectadas por los tests químicos, lo que ha mejorado de forma significativa la sensibilidad para el diagnóstico de CCR y adenomas avanzados.3
La detección anual o cada dos años (según la guía utilizada en cada país) de sangre oculta en heces es la estrategia más extendida para el cribado poblacional del CCR. Esto se debe fundamentalmente a que es la única estrategia que ha demostrado su eficacia para reducir de forma significativa la mortalidad y la incidencia de esta enfermedad.4
En muchos pacientes con TSOMF positivo la VCC no detecta una causa probable de hemorragia gastrointestinal baja, por lo que la posibilidad de que se pase por alto una neoplasia es una preocupación común. Para reducir el riesgo de un futuro cáncer de intervalo, es importante comprender si la ausencia de neoplasia avanzada se debe a un TSOMF falso positivo o a una VCC falsa negativa. Si bien un TSOMF con un presunto falso positivo como resultado puede estar relacionado con la presencia de una afección hemorrágica benigna del colon, como las hemorroides, también puede reflejar una neoplasia no detectada en la VCC. Históricamente, la tasa de errores para la neoplasia de colon se ha estimado en un 15% para los adenomas mayores de 5 mm y en un 8% para los mayores de 10 mm. A pesar de las mejoras en la calidad de las imágenes de VCC en las últimas dos décadas, las tasas de pérdida de pólipos siguen siendo del 13% en general y del 1,6% para lesiones mayores de 10 mm.5
Un estudio evaluó los hallazgos de la VCC realizada después de un TSOMF positivo. Los autores incluyeron todos los tipos y tamaños de adenomas, así como el CCR como resultado positivo de la VCC. Encontraron una incidencia de CCR del 0,4% entre 3 y 6 años después de una VCC negativa. Varios ensayos controlados aleatorizados han investigado la eficacia del TSOMF versus la VCC para detectar neoplasia colorrectal, pero arrojaron resultados poco concluyentes y controvertidos. La VCC y el TSOMF-I son los dos métodos de detección de CCR más utilizados en todo el mundo.6
La VCC se considera la prueba más sensible para la detección temprana de neoplasias colorrectales. Sin embargo, este tipo de prueba invasiva conlleva un aumento significativo en los costos, así como varios desafíos adicionales. Entre estos se incluyen la reticencia de algunos pacientes a someterse al estudio, los riesgos de eventos adversos y la necesidad de una preparación intestinal adecuada. Estos factores combinados contribuyen a tasas de participación relativamente bajas en programas de detección basados en VCC. En comparación con la VCC, el TSOMF tiene un desempeño único más pobre para la detección de neoplasias, pero tasas de participación más altas.7
La tasa de detección de adenomas (TDA) debería utilizarse como una medida de calidad en las VCC de tamizaje o diagnósticas en pacientes de 50 años o más. Se recomienda alcanzar una tasa de detección de adenoma general de ≥ 25% (mujeres 20-25% y hombres 25-30%). No se establece un objetivo estándar. La TDA de pacientes que se realizan VCC luego de un TSOMF-I positivo tiene valores más elevados que la VCC como primer método de tamizaje. En el estudio COLONPREV, de análisis transversal post hoc, realizado en la primera ronda de TSOMF-I, de junio de 2009 a junio de 2011, este valor se estableció en 45% para un TSOMF-I con punto de corte de 15 mg/g en heces o 75 ng/ml en buffer. Este parámetro aún no ha sido evaluado para determinar CCR de intervalo y muerte por cáncer. Existen diferentes predictores de la TDA como son la edad, el tiempo de retirada empleado, la limpieza colónica y la historia personal de adenomas.8
Objetivos
− Evaluar la tasa de TSOMF-I con resultado positivo.
− Describir el porcentaje de pacientes que se realizan una VCC tras un resultado de TSOMF-I positivo.
– Evaluar la tasa de detección de adenomas y la prevalencia de CCR en pacientes con TSOMF-I positivo.
Material y métodos
Se realizó un estudio descriptivo, transversal, mediante la revisión retrospectiva de datos de pacientes con TSOMF-I y VCC realizados en el Hospital Pirovano, Ciudad Autónoma de Buenos Aires (CABA), del 1° de enero de 2020 al 1° de enero de 2024.
Se recolectaron datos de pacientes entre 50 y 75 años, de ambos sexos biológicos. Los TSOMF-I se realizaron mediante la prueba rápida MONTEBIO FOB en tira para detectar Hb en muestras de materia fecal. Las VCC se llevaron a cabo utilizando equipos Pentax epk-i7010 y Sonoscape HD-500. Fueron realizadas por médicos de planta del Servicio de Endoscopía y por residentes en formación supervisados por médicos de planta. Los datos recolectados provienen de informes del Servicio de Laboratorio Clínico, Servicio de Anatomía Patológica, Unidad de Gastroenterología y Sección de Endoscopía Digestiva del Hospital Pirovano, así como de los archivos del Sistema Informático de Gestión Hospitalaria (SIGEHOS) de CABA.
Criterios de inclusión
Pacientes entre 50 y 75 años de edad con TSOMF-I positivo realizado en el Hospital Pirovano del 1° de enero de 2020 al 1° de enero del año 2024, por screening de CCR.
Criterios de exclusión
Se consideraron criterios de exclusión las VCC incompletas o con preparación inadecuada, definidas por una puntuación en la Clasificación de Boston < 6 puntos o con segmentos individuales < 2 puntos. También se excluyeron pacientes con TSOMF-I o VCC realizados en otras instituciones, aquellos con antecedentes de VCC previa de menos de 10 años, signos o síntomas de hemorragia digestiva, EII, antecedentes personales o familiares de CCR o diagnóstico previo de neoplasias gastrointestinales.
Variables
Las variables del estudio incluyen datos demográficos (edad y sexo), número de TSOMF-I solicitados y sus resultados (positivos o negativos), realización de VCC en casos de TSOMF-I positivo y descripción de los hallazgos (ubicación anatómica, tipo, tamaño e histología de las lesiones observadas).
Aspectos éticos y regulatorios
El estudio fue aprobado por el CODEI (Comité de Docencia e Investigación) y el CEI (Comité de Ética e Investigación) del Hospital Pirovano. Además, fue cargado en la Plataforma de Registro Informatizado de Investigaciones en Salud de la Ciudad de Buenos Aires (PRIISA.BA). El estudio respetó la Declaración de Helsinki y se adhirió a las normativas éticas y regulatorias vigentes, incluyendo la Ley N.º 3301/2009 sobre Protección de Derechos de Sujetos en Investigaciones en Salud y las resoluciones relevantes (Resolución N.° 595/MSGC/2014, Resolución N.º 1480/2011, y Resolución N.º 1533/MSGC/2019).
La confidencialidad de los datos se aseguró según la Ley N.º 25326 y la Ley N.º 3301/09 para garantizar que la información obtenida se utilice únicamente para los fines establecidos y proteger la identidad de los participantes mediante técnicas de disociación.
Resultados
Se analizaron un total de 895 muestras de TSOMF-I, de las cuales 717 cumplieron con los criterios de elegibilidad. De estas, el 21,6% (n=155) resultaron positivas y el 78,4% (n=562) negativas (Figura 1).
Figura 1. Flujograma de participantes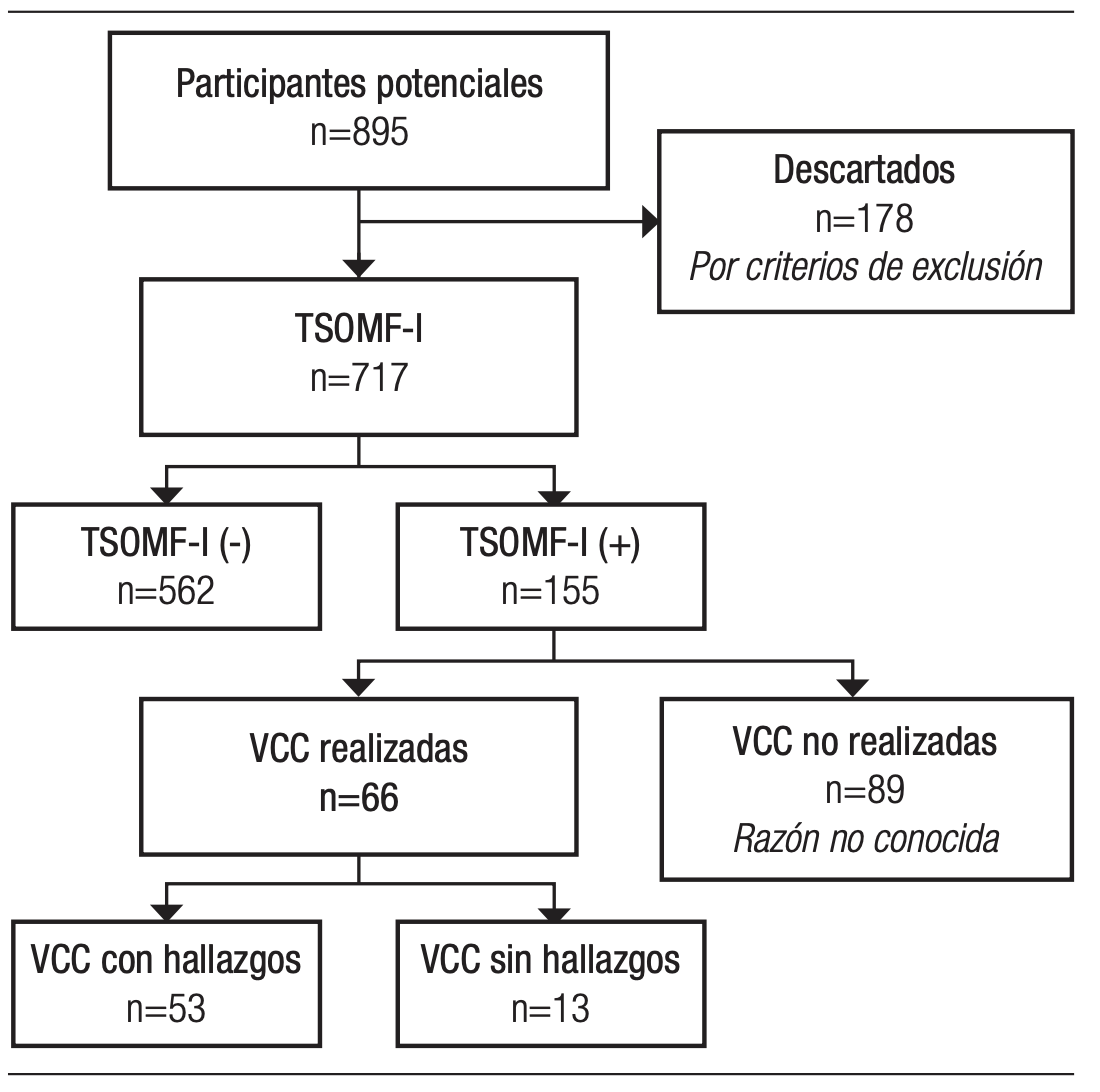
La población estudiada con TSOMF-I positivo durante este periodo incluyó 155 pacientes, de los cuales el 59% (n=92) fueron mujeres y el 41% (n=63) hombres. La edad mostró una mediana de 59 años (50 a 75). La distribución de la edad fue asimétrica a la derecha, lo que indica que hubo más pacientes con edades inferiores que mayores en relación al promedio (Figura 2).
Figura 2. Distribución de la edad de pacientes con TSOMF-I positivo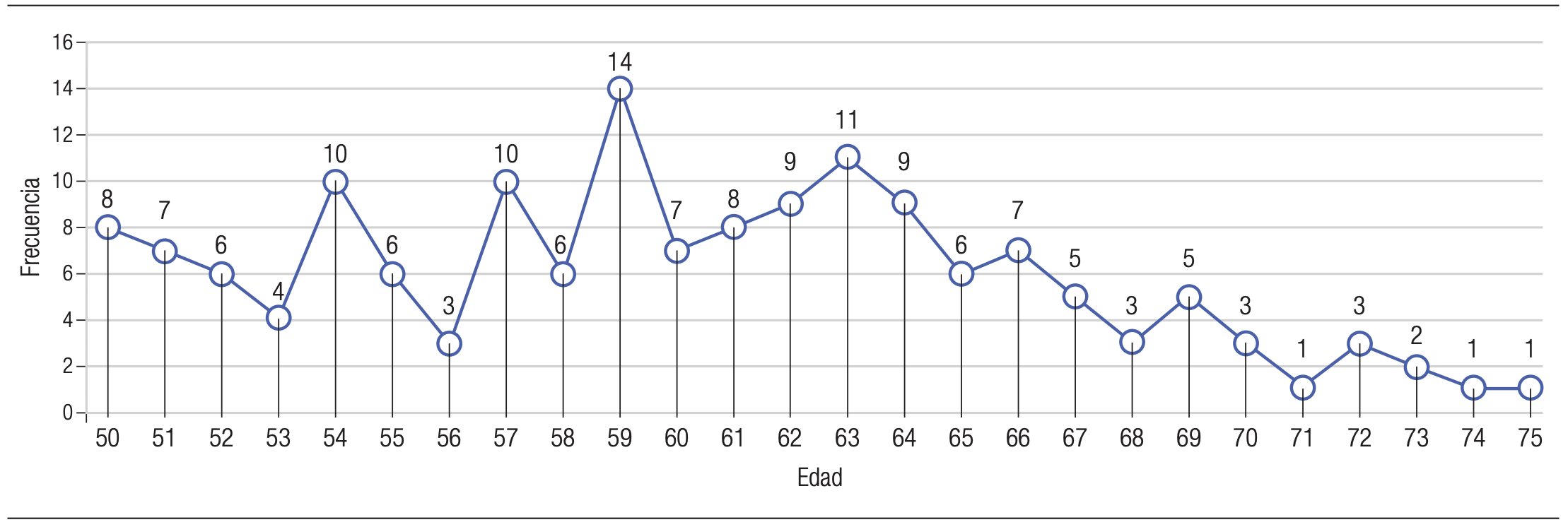
De los 155 pacientes con TSOMF-I positivo, solo el 42,6% (n=66) se realizaron a una VCC. En estos pacientes, la VCC reveló hallazgos en el 80% (n=53). Entre las lesiones identificadas se destacaron pólipos en el 36,4% (n=24), hemorroides internas en el 34,9% (n=23), diverticulosis en el 18,2% (n=12), angiectasias en el 4,6% (n=3), lesiones de extensión lateral (LST) en el 3% (n=2) y lesiones de aspecto neoproliferativo en el 3% (n=2). No se encontraron hallazgos en el 20% (n=13) de los pacientes (Tabla 1).
Tabla 1. Características de los pacientes con TSOMF-I positivo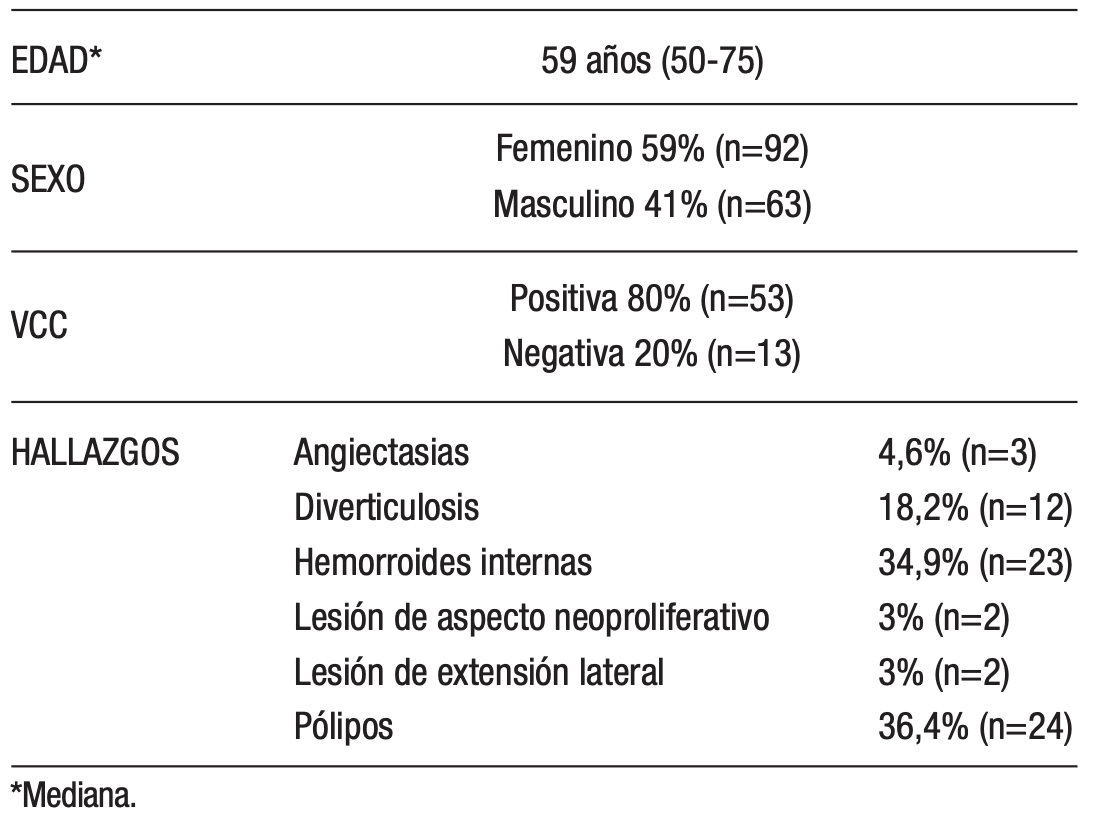
El total de hallazgos supera el número de pacientes, ya que algunos individuos presentaron múltiples tipos de lesiones.
Se identificaron 28 lesiones macroscópicas sugestivas de neoplasia. Se documentó detalladamente la morfología y el tamaño de cada lesión. Cuando fue posible realizar la resección, las muestras fueron enviadas para análisis anatomopatológico. En las lesiones neoplásicas avanzadas (LNA se optó por realizar biopsias y aplicar tatuaje endoscópico en lugar de proceder con resecciones completas. Esta estrategia permitió obtener un diagnóstico preciso y evaluar la extensión de la lesión antes de considerar una resección definitiva (Tabla 2).
Tabla 2. Distribución de lesiones sugestivas de neoplasia en VCC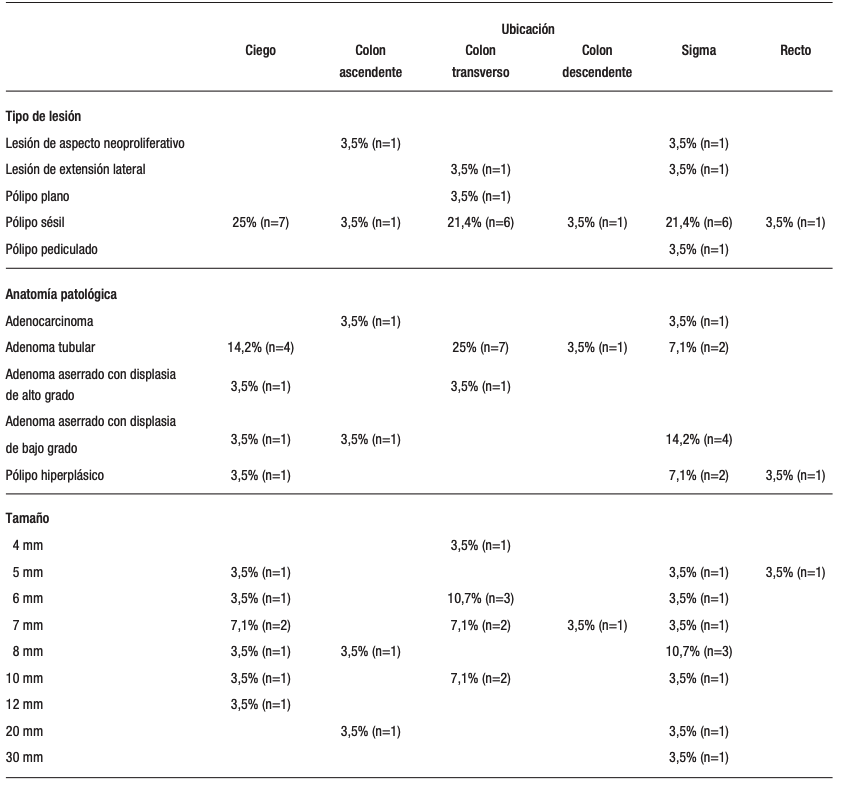
La distribución de las lesiones colorrectales observada en este estudio reveló predominio de pólipos sésiles, principalmente en el ciego 25% (n=7), colon transverso 21,4% (n=6) y sigma 21,4% (n=6), lo que representa el 78,6% del total de las lesiones identificadas. Las lesiones con características neoproliferativas y las LST se detectaron en el colon ascendente y sigma, respectivamente, cada una con un caso, lo que equivale al 7,1% del total para cada tipo. Los pólipos planos se localizaron exclusivamente en el colon transverso, con un caso (3,6%), mientras que un pólipo pediculado fue hallado en el sigma (3,6%).
El análisis anatomopatológico mostró que los adenomas tubulares fueron los más comunes y constituyeron el 50% del total de las lesiones, con mayor frecuencia en el colon transverso (n=7) y el ciego (n=4). Los adenocarcinomas representaron el 7,1% del total, distribuidos equitativamente entre el colon ascendente y el sigma. Los adenomas aserrados con displasia de alto y bajo grado sumaron 3 casos (10,7%) y 6 casos (21,4%) respectivamente, presentes en varios segmentos del colon. Los pólipos hiperplásicos constituyeron el 14,3% del total, con 4 casos identificados en el ciego, sigma y recto.
En cuanto al tamaño, las lesiones variaron entre 4 mm y 30 mm. Las más comunes fueron las de 7 mm, con 6 casos (21,4%), seguidas por las de 6 mm y 8 mm, ambas con 5 casos (17,9%). Las lesiones mayores, como las de 10 mm, se observaron en 4 casos (14,3%).
Entre los hallazgos adicionales se identificaron hemorroides internas, diverticulosis y angiectasias. Estas, junto con las VCC negativas, representaron el 60,6% (n=38) de las lesiones, sin relación con el tamizaje de CCR. Es importante destacar que no se reportaron eventos adversos durante la realización de las VCC.
Discusión
El presente estudio demuestra que la precisión diagnóstica del TSOMF-I en nuestro contexto es comparable a los estándares internacionales para la detección de CCR. La alta frecuencia de solicitudes del TSOMF-I en relación con la VCC de vigilancia indica que los métodos no invasivos son preferidos por los pacientes para el cribado. Sin embargo, el acceso a la VCC luego de un TSOMF-I positivo es bajo, lo que está influenciado por múltiples factores como barreras económicas, sociales y culturales, además de las demoras administrativas en la programación de las citas. Estos aspectos deben ser cuidadosamente considerados para optimizar la planificación y ejecución de los programas de tamizaje de CCR a fin de maximizar su eficacia y garantizar su accesibilidad.
En Argentina, los estudios sobre programas de rastreo poblacional de CCR son limitados. En 1999 Fernández y col. llevaron a cabo un estudio prospectivo en 332 pacientes con riesgo promedio de CCR a los que se le realizó un TSOMF-Q. Los tests fueron positivos en el 5,4% de los pacientes y el 77,8% accedieron a una VCC.9 Por su parte, Vietto y col., en un análisis de 5.816 pacientes de un plan de salud privado, encontraron una prevalencia de TSOMF-Q positivo del 25%, con una tasa del 53% de estudios colónicos realizados.10
Un estudio retrospectivo financiado por el Instituto Nacional del Cáncer, llevado a cabo entre 2015 y 2019 en barrios carenciados de Neuquén, incluyó 11.189 TSOMF-I, de los cuales el 23,1% resultaron positivos. La participación promedio de la población objetivo fue del 6,52%. De los pacientes con TSOMF-I positivo, solo el 24,1% se sometió a VCC; identificaron CCR en el 3,7% y pólipos en el 35%. Los resultados fueron normales en el 61,3%. La histología de los pólipos incluyó adenoma tubular (49%), hiperplásico (21,3%), tubulovelloso (20%), aserrado (7,2%) y otros (2,5%).11
En 2020, un estudio realizado en el Hospital Alemán de CABA incluyó 300 pacientes, de los cuales 273 (91%) completaron el TSOMF-I y la VCC. La edad promedio fue de 56,9 años (40-85 años) y el 54% eran hombres. Los hallazgos incluyeron adenomas de bajo riesgo en 53 pacientes (19%), adenomas aserrados sésiles en 18 (6,59%) y LNA en 21 (7,7%). Solo 4 pacientes (1,5%) fueron diagnosticados con CCR. Para LNA, la precisión diagnóstica del TSOMF-I en una única ronda mostró una sensibilidad del 30%, especificidad del 84%, VPP del 13% y VPN del 94%. En adenomas de bajo riesgo, la sensibilidad fue del 13%, especificidad del 84%, VPP del 17% y VPN del 79%. Para adenomas aserrados sésiles, se reportó una sensibilidad del 16,7%, especificidad del 87%, VPP del 11% y VPN del 91%. En cuanto al CCR, la sensibilidad fue del 75%, especificidad del 83%, VPP del 6% y VPN del 99%. No se registraron complicaciones posteriores a los procedimientos.12
En países limítrofes como Uruguay13 y Brasil,14 los estudios sobre TSOMF-I reportan resultados positivos en proporciones similares a las observadas en nuestra población.
La calidad de la VCC es crucial para detectar lesiones en pacientes con TSOMF-I positivo. La eficacia diagnóstica y terapéutica depende de factores como la experiencia del endoscopista, la calidad de la preparación colónica y la técnica utilizada. Aunque este estudio no incluyó variables específicas como el tiempo de VCC o la tasa de intubación cecal, los indicadores de calidad considerados, como la tasa de detección de pólipos (39,39%) y la TDA (33,33%), cumplen con el estándar mínimo recomendado
(≥ 25%) y se alinean con los valores del PNCCR (19-40%). Sin embargo, no se alcanzó la TDA del 45% reportada en el estudio COLONPREV para pacientes con TSOMF-I positivo.
La proporción de pacientes con CCR y TSOMF-I positivo fue del 3%, dentro del rango aceptable del PNCCR (2-9%). Esta diferencia con estudios de mayor rendimiento puede deberse al uso de equipos de última generación que incorporan inteligencia artificial, una tecnología aún no disponible en nuestra práctica. Adicionalmente, la experiencia del endoscopista es un factor determinante si se considera que muchos de los procedimientos fueron realizados por residentes en formación bajo la supervisión de médicos de planta, lo que podría influir en los resultados obtenidos.
Conclusiones
El estudio evaluó la relación entre el TSOMF-I positivo y los hallazgos en la VCC, y destacó una alta prevalencia de lesiones colorrectales, incluyendo, adenomas y CCR, con cifras que se alinean con las publicadas por otros trabajos internacionales. Los resultados obtenidos reflejan la eficacia del tamizaje mediante el TSOMF-I para identificar lesiones colorrectales relevantes, pero también ponen en evidencia la necesidad de mejora en la calidad de las VCC y en la incorporación de tecnologías más avanzadas.
Un hallazgo clave fue que menos de la mitad de los pacientes con TSOMF-I positivo realizaron una VCC posterior, lo que indica la existencia de barreras importantes en el acceso a dicho estudio en nuestro medio, como demoras administrativas, limitaciones económicas y una baja adherencia de los pacientes a estudios invasivos. Este dato refuerza la necesidad de implementar estrategias que aumenten el acceso a la VCC, incluyendo la educación de los pacientes y la optimización de los sistemas de salud. Estos hallazgos son cruciales para optimizar los programas de tamizaje de cáncer colorrectal en Argentina, adaptándolos a las necesidades de la población local y mejorando los resultados en salud pública. Los hallazgos destacan a su vez la importancia de generar estadísticas locales para diseñar programas de detección más efectivos, y garantizar un mayor impacto clínico en la prevención y manejo del CCR.
Consentimiento para la publicación. Para la confección de este manuscrito, se utilizaron datos anonimizados, que no han distorsionado su significado científico.
Propiedad intelectual. Los autores declaran que los datos y las figuras presentes en el manuscrito son originales y se realizaron en sus instituciones pertenecientes.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas.
Conflicto de interés. Los autores declaran no tener conflictos de interés en relación con este artículo.
Aviso de derechos de autor
© 2024 Acta Gastroenterológica Latinoamericana. Este es un artículo de acceso abierto publicado bajo los términos de la Licencia Creative Commons Attribution (CC BY-NC-SA 4.0), la cual permite el uso, la distribución y la reproducción de forma no comercial, siempre que se cite al autor y la fuente original.
Cite este artículo como: Moreira Granda EJ, Regnasco S, Romero J y col. Hallazgos colonoscópicos en pacientes con test de sangre oculta en materia fecal positivo: Estudio descriptivo. Acta Gastroenterol Latinoam. 2024;54(4):318-326. https://doi.org/10.52787/agl.v54i4.443
Referencias
- Yonamine K, Kirschbaum A. Recomendaciones para el tamizaje organizado de Cáncer Colorrectal en población de riesgo promedio en Argentina – 1a ed. – Ciudad Autónoma de Buenos Aires: Instituto Nacional del Cáncer; 2022.
- Sguiglia S. Nuevas recomendaciones para el tamizaje de cáncer colorrectal en Argentina. Evid actual pract ambul [Internet]. 2 de junio de 2023 [citado 21 de febrero de 2024];26(2):e007067. Disponible en: https://evidencia.org.ar/index.php/Evidencia/article/view/7067
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May 4;71.
- González N, et al. Hallazgos colonoscópicos en una población de pacientes con test de sangre oculta en heces positivos. Arch Med Int. 2011;33(2):21-23. ISSN 0250-3816.
- Ribbing Wilén H, Blom J, Höijer J, Hultcrantz R. Fecal immunochemical test in colorectal cancer screening: Colonoscopy findings by different cut-off levels. J Gastroenterol Hepatol. 2018. DOI:10.1111/jgh.14373
- Hunt JS, Cock C, Symonds EL. A True Positive and a False Negative? The Dilemma of Negative Colonoscopy After a Positive Fecal Occult Blood Test. Dig Dis Sci. 2022;67:1843-1849. DOI:10.1007/s10620-021-06986-4
- Zhong GC, Sun WP, Wan L, Hu JJ, Hao FB. Eficacia y rentabilidad de la prueba inmunoquímica fecal versus colonoscopia en la detección del cáncer colorrectal: una revisión sistemática y un metanálisis. Endoscopia gastrointestinal. 2019. DOI: https://doi.org/10.1016/j.gie.2019.11.035
- Agustín Kirschbaum; Karina Gisele Yonamine- Indicadores de calidad para videocolonoscopía en tamizaje de cáncer colorrectal. Recomendaciones basadas en evidencia /. 1a ed. – Ciudad Autónoma de Buenos Aires: Instituto Nacional del Cáncer, 2019.
- Fernandez JL, Gallegos M, Brochero A. Screening for colorectal cancer with an immunological fecal occult blood test. Acta Gastroenterol Latinoam. 1999 [citado 11 Abril 2024];29(2):73-78. Disponible en: https://pubmed.ncbi.nlm.nih.gov/10491719/
- Vietto V, Belardinelli S, Rubinstein F, Terrasa S. Cascada diagnóstica consecutiva al rastreo de cáncer colorrectal con sangre oculta en materia fecal: estudio de cohorte retrospectiva. Arch Med Fam Gen. 2017 [citado 15 Abril 2024];14(1):6-11. Disponible en: https://pesquisa.bvsalud.org/portal/resource/pt/biblio-907419
- Ruiz EF. Indicadores de desempeño de un programa de rastreo de cáncer colorrectal en la provincia del Neuquén, Argentina, 2015-2019. Rev Argent Salud Pública. 2022;14. Disponible en: https://rasp.msal.gov.ar/index.php/rasp/article/view/757/770
- Galvarini, M. (2020). Estudio prospectivo acerca de la precisión diagnóstica del test inmunológico de sangre oculta en materia fecal en una única ronda para la realización de pesquisa del cáncer colorrectal en pacientes de riesgo promedio en la Argentina. Revista Argentina de Coloproctología, 31(04). https://www.revistasacp.com/index.php/revista/article/view/64
- Fenocchi E, Martinez L, Tolve J, Montano D, Rondan M, Parra-Blanco A, et al. Screening for colorectal cancer in Uruguay with an immunochemical fecal occult blood test. Eur J Cancer Prev. 2006 [citado 16 Mayo 2024];15(5):384-390. Disponible en: https://pubmed.ncbi.nlm.nih.gov/16912566/
- Altemburg F, Biondo-Simoes M, Von Bahten L. A pesquisa de sangue oculto nas fezes associada a um questionário de sinais e sintomas na prevenção do câncer colo retal. Rev Brasileira de Coloproctologia. 2009 [citado 08 Junio 2024];29(1):57-64. Disponible en: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0101-98802009000100008
Correspondencia: Edison Javier Moreira Granda
Correo electrónico: drejmg@hotmail.es
Acta Gastroenterol Latinoam 2024;54(4):318-326
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE


