Sergio Pablo Huernos
Sección Enfermedades Inflamatorias. Departamento de Medicina. Hospital de Gastroenterolgía Dr Carlos Bonorino Udaondo. Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2016;46: 340-349
Recibido: 29/02/2016 / Aprobado: 17/08/2016 / Publicado en www.actagastro.org el 01/01/2017
Resumen
La enfermedad inflamatoria intestinal (EII) tiene un pico de incidencia entre los 15 y 35 años. Consecuentemente la enfermedad afecta a las mujeres durante sus años de vida reproductiva y por lo tanto el embarazo y la lactancia generan un tema de vital importancia médica. Según el estudio de Mountifield y col,1 las parejas de pacientes con EII tienen voluntariamente menos hijos que las parejas sin enfermedad. Las dos razones más importantes para evitar la concepción fueron el miedo a los efectos adversos de la medicación sobre los niños y los consejos ambiguos dados por los médicos. En este sentido esta revisión tiene la finalidad de aclarar algunos conceptos en relación a los efectos de la EII en el embarazo y los efectos potenciales de la medicación en los neonatos.
Palabras claves. Enfermedad inflamatoria intestinal, embarazo, lactancia, colitis ulcerosa, enfermedad de Crohn.
Pregnancy and breastfeeding in inflammatory bowel disease
Summary
The Inflammatory bowel disease has a peak incidence between 15 and 35 years. Consequently, the disease affects women during their reproductive years and therefore pregnancy and lactation generates an issue of vital medical importance. According to the study Mountifield et al,1 couples voluntarily IBD patients have fewer children than couples without disease. The two most important reasons to avoid conception were, fear of adverse effects of medication on children and the ambiguous advice given by doctors. In this sense this review is intended to clarify some concepts related to the effects of IBD on pregnancy and the potential effects of the medication in infants.
Key words. Inflammatory bowel disease, pregnancy, breastfeeding, ulcerative colitis, Crohn´s disease.
Abreviaturas
EII: enfermedad inflamatoria intestinal
CU: colitis ulcerosa
EC: enfermedad de Crohn
IFX: infliximab
ADA: adalimumab
CZP: certolizumab pegol
GOL: golimumab
NTZ: natalizumab
VDZ: vedolizumab
Fertilidad
Las pacientes con colitis ulcerosa (CU) y enfermedad de Crohn (EC) en remisión tienen un índice de infertilidad del 5-14%, similar a la población general.2
En hombres la calidad del esperma puede afectarse por la sulfasalzina que provoca oligospermia y alteración de la motilidad de los espermatozoides, generando más del 60% de infertilidad en el hombre. Este efecto es reversible al suspender la medicación.3 En mujeres la medicación no afecta la fertilidad.
La cirugía en la EC puede disminuir la fertilidad como consecuencia de adherencias, obstrucciones tubarias y alteraciones de la fimbrias. En la CU la cirugía del pouch ileoanal aumenta 3 veces el riesgo de infertilidad comparado con el tratamiento médico.4 En los últimos años, reportes del pouch laparoscópico podrían resultar en un menor índice de adherencias con respecto a la fertilidad comparado con la cirugía convencional.5 La fertilización in vitro en pacientes con pouch obtuvo similares resultados en cuanto a la gestación y a los nacidos vivos, comparados con pacientes con CU no operadas y controles.6
Herencia
Los hijos de alguno de los padres con EII tienen un riesgo de padecer la enfermedad de 0,5-1% en caso de una CU y de 2-3% si es una EC. El mayor riesgo aparece cuando ambos padres tienen una EII, con una probabilidad mayor del 30%.7 En mellizos la concordancia entre monocigotas y dicigotas es de 35% y 7% respectivamente en la EC y de 11% y 3% respectivamente en la CU.
Entre un 5% y 22% de los pacientes tienen algún familiar con EII. La tendencia familiar puede coincidir con el tipo y la localización de la enfermedad pero no con la severidad.8 Sin embargo, el modo de herencia de la EII es compleja y no puede ser explicada con un simple modelo mendeliano, por lo que sería prematuro y no se recomienda ningún screening genético en la actualidad.
Efecto de la EII en el embarazo y de éste sobre la EII
La actividad de la enfermedad en el momento de la concepción es el principal predictor del curso del embarazo. Las mujeres embarazadas con CU en remisión tienen un índice de recaída enfermedad/año de 34%, similar a pacientes no embarazadas con CU del 32%. Las pacientes con EC tienen índices similares.9, 10 Un meta-análisis de Miller JP y col con 1.300 pacientes con CU y 700 con EC objetivó embarazos normales en el 83% de las mujeres con EC (rango: 71-93%) y en el 85% de las pacientes con CU (rango: 76-93%).11
Si la enfermedad está en actividad al momento de la concepción, 2/3 de los pacientes continuarán en actividad y de éstos, el 60-70% podría empeorar. En esta situación hay mayor prevalencia de abortos, fetos muertos, bajo peso al nacer y malformaciones congénitas.12
Complicaciones durante el embarazo
Los estudios en pacientes embarazadas con EII muestran un riesgo aumentado de prematurez, bajo peso al nacer y mayor necesidad de partos por cesárea. Las pacientes tuvieron mayor probabilidad de tener abortos espontáneos (OR = 1,65; IC 95%: 1,09-2,48), prematurez, bajo peso y fetos muertos (OR = 1,54; IC 95%: 1,0-2,38) y complicaciones del parto (OR = 1,78; IC 95%: 1,13- 2,81).13, 14 En el meta-análisis de Cornish y col se evaluaron 12 estudios con un total de 3.907 pacientes y se demostró un incremento de prematurez (OR: 1,85; IC 95%: 1,52-2,31), bajo peso (OR = 2,1; IC 95%: 1,38-3,19) y cesárea (OR = 1,5; IC 95%: 1,26-1,79).15
Con respecto a la aparición de malformaciones congénitas, los estudios son controvertidos; se suma como factor “confundidor” el uso de la medicación, por lo cual es un tópico de continua discusión. Mientras que algunos estudios revelan un aumento en la incidencia de malformaciones congénitas,15, 16 otros no encontraron aumentado dicho riesgo.13, 17, 18
Las pacientes con CU podrían tener un riesgo aumentado, comparadas con pacientes con EC, particularmente anomalías específicas como deficiencias del sistema límbico (OR = 6,2; IC 95%: 2,9-13,1) y malformaciones del sistema urinario excretor (OR = 3,3; IC 95%: 1,1-9,5).19 Sin embargo, en la mayoría de las series de pacientes con CU, no se encontraron dichas alteraciones. Se necesitarán nuevos estudios para definir este tema con mayor claridad.
Con respecto a los neonatos nacidos a término, el score APGAR, el índice de mortalidad y la internación en cuidados intensivos tuvieron resultados similares a los niños nacidos de madres sin EII.
Medicación
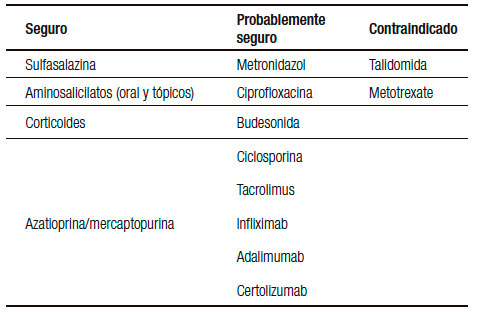
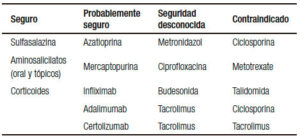
La mayoría de los fármacos utilizados para el tratamiento de la EII no están asociados con importantes efectos adversos y el mantenimiento de la remisión de las mujeres embarazadas es una prioridad en estas pacientes (Tabla 1). La Administración de Drogas y Alimentos de EE.UU. (FDA) publicó una guía para el uso de los medicamentos durante el embarazo (Tabla 2).20
Tabla 1. Seguridad de fármacos en el embarazo.
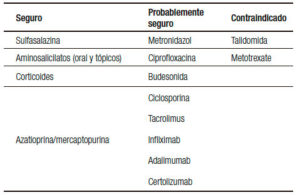
Tabla 2. FDA. Categorías para el uso de fármacos en embarazo.

Aminosalicilatos
Todos los aminosalicilatos (sulfasalazina, mesalazina, balsalazide) son fármacos categoría B y han demostrado su seguridad en el tratamiento oral como tópico durante el embarazo.21-23 Estudios en animales y en humanos como en un meta-análisis no demostraron efectos teratogénicos.24
Con la sulfasalazina se deben adicionar 2 mg/día de ácido fólico durante todo el embarazo, por su interferencia con el metabolismo de los folatos.
Corticoides
Son fármacos categoría C. Todos los corticoides atraviesan la placenta y son convertidos a metabolitos menos activos por la enzima 11-hidroxigenasa, por lo que genera una baja concentración en la sangre fetal. Los efectos adversos documentados en animales no se han confirmado en humanos. Sin embargo, un estudio caso-control de corticoides durante el primer trimestre de embarazo mostró un riesgo aumentado de paladar hendido y labio leporino.25 Esto fue confirmado por otro estudio26 y un meta análisis (OR = 3,35; IC 95%: 1,97-5,69).27 Este riesgo no fue confirmado por otros autores. Un estudio prospectivo de 311 mujeres expuestas a corticoides durante el primer trimestre no presentó anormalidades ni casos de malformaciones orofaciales.28
Se han descripto casos de diabetes gestacional, ruptura prematura de membranas e insuficiencia adrenal en el neonato en madres que requirieron corticoides a lo largo del embarazo.28
Con respecto a la budesonida, hay muy pocos casos documentados en embarazadas. En una serie de 8 pacientes con EC medicadas con budesonida no se observaron complicaciones en las madres ni en los neonatos.29
Antibióticos
Los antibióticos utilizados habitualmente en la EII son el metronidazol y las quinolonas (ciprofloxacina, norfloxacina, levofloxacina) en cursos cortos para el tratamiento de la EC, en especial con compromiso perianal y en la pouchitis.
Metronidazol
Es una droga categoría B. No se asoció a mayor riesgo de abortos espontáneos ni malformaciones congénitas. Esto se demostró en estudios retrospectivos, en dos meta-análisis y en un estudio prospectivo30-33 aunque en un estudio mujeres expuestas al metronidazol durante el segundo y tercer mes de embarazo tuvieron mayor índice de labio leporino con o sin paladar hendido.34
Quinolonas
Son fármacos categoría C. Tienen alta afinidad por el tejido óseo y cartilaginoso. Estudios en animales (ratas y perros), observaron afección de estos tejidos. En estudios de mujeres embarazadas medicadas con quinolonas no se encontró aumento del riesgo de malformaciones congénitas ni abortos espontáneos.35, 36 Dada la limitada evidencia con estos antibióticos se recomienda evitar su uso durante el primer trimestre del embarazo.
Inmunomoduladores
Azatioprina/ 6-mercaptopurina
Son fármacos categoría D según la FDA. Por este motivo son las drogas que generaron mayor controversia en el tratamiento de las pacientes embarazadas con EII. Los estudios en animales han demostrado efecto teratógeno con aumento de la frecuencia de paladar hendido, anormalidades esqueléticas y urogenitales. En los humanos, el hígado fetal carece de la enzima necesaria para convertir la azatioprina a mercaptopurina. Por este motivo el feto está protegido de la toxicidad de la droga durante el crucial periodo de organogénesis.
Sin embargo, los estudios son controvertidos. Varios de ellos mostraron mayor índice de prematurez, abortos espontáneos, bajo peso al nacer y malformaciones congénitas.37-39 Por el contrario, otros estudios no hallaron diferencias en pacientes tratadas y controles. En un estudio de 189 embarazadas en tratamiento con azatioprina comparado con controles no hubo diferencias en el riesgo de malformaciones entre las tratadas (3,5%) vs controles (3%).40
En otro estudio retrospectivo, con un número significativo de pacientes embarazadas con EII tampoco se encontró diferencias en la prevalencia de abortos espontáneos, fetos muertos, malformaciones congénitas y aumento en el riesgo de infecciones, comparados con los controles.41 El único estudio prospectivo en pacientes tratadas con tiopurinas encontró un riesgo similar de complicaciones que la población general. Los autores concluyen que el uso de inmunomoduladores antes o en el momento de la concepción es seguro y no recomiendan la suspensión de la droga.42
En una cohorte del registro CESAME43 se documentaron 215 mujeres embarazadas con EII entre el año 2004 y 2007. Se compararon tres grupos. Uno (86 pacientes) en tratamiento con tiopurinas sola o asociada a otros fármacos como aminosalicilatos, corticoides, etc.; otro grupo (84 pacientes) tratados con otra droga distinta de los inmunomoduladores y el tercer grupo (45 pacientes) sin tratamiento. Las tiopurinas no se
asociaron a mayor riesgo de malformaciones congénitas. La mayor prevalencia de prematurez y bajo peso al nacer no fue significativa y podría relacionarse con la actividad de la enfermedad de base.
El grupo francés de EII realizó un estudio basado en una encuesta on-line a los médicos gastroenterólogos especialistas en EII. En 175 cuestionarios completados, el 89% de los profesionales continuaban el tratamiento con azatioprina/mercaptopurina hasta el parto y ellos recomendaban su uso durante el embarazo.44
Por todo lo expuesto, el efecto de las tiopurinas en el embarazo continúa debatido en la actualidad, sin embargo, en la mayoría de los centros aconsejan mantener dicha terapia.
Ciclosporina
Es una droga categoría C. En un meta-análisis45 de 15 estudios con 410 pacientes embarazadas el índice de malformaciones congénitas fue de 4%, lo cual no difería de la prevalencia de la población general. Hay reportes del tratamiento efectivo con ciclosporina en la CU severa, cortico refractaria, y ésta sería una mejor opción que la colectomía dado los riesgos para la madre y el feto en esta circunstancia.46, 47
Tacrolimus
Es un fármaco categoría C. Hay reportes escasos de su uso en pacientes embarazadas con EII. En un “case-report” de una paciente con CU en tratamiento de mantenimiento, no presentó complicaciones.48 En un centro de transplante se siguieron prospectivamente 49 embarazos en 37 mujeres durante 13 años. Treinta y seis mujeres no tuvieron complicaciones. En cuanto a los neonatos, dos fueron prematuros, uno falleció de síndrome de Alagille, y el 78% tuvieron adecuado peso al nacer y no se observaron malformaciones congénitas.49
Metrotexate y talidomida
Son drogas categoría X. Ambos fármacos son teratogénicos y están contraindicados durante el embarazo. En caso que una paciente en edad fértil reciba esta medicación, debe usar métodos anticonceptivos adecuados. Para evitar la exposición a estas drogas tanto hombres como mujeres que busquen un embarazo deben suspender la medicación 3 a 6 meses previos a la concepción.
Terapia biológica
Infliximab (IFX)
Es una droga categoría B. La evidencia clínica acumulada indica que el IFX es seguro en el período de la concepción y durante los dos primeros trimestres del embarazo. El registro TREAT es un registro prospectivo con más de 6.000 pacientes con EC y describe 36 pacientes embarazadas en tratamiento con IFX.50 No se documentaron malformaciones congénitas y el índice de abortos (11,1 vs 7,1%) y las complicaciones perinatales (8,3 vs 7,1%) fueron comparables entre pacientes tratadas con IFX y pacientes sin terapia biológica respectivamente.
El IFX safety data base es un registro retrospectivo voluntario de efectos adversos de la droga, en pacientes con EC y artritis reumatoidea, realizado por el laboratorio que manufactura el IFX. Se documentaron 96 embarazadas en tratamiento con IFX, expuestas entre los 3 meses previos a la concepción y al final del primer trimestre, con índices de abortos espontáneos y complicaciones fetales similares a la población general.51
El grupo francés GETAID realizó un estudio prospectivo de pacientes embarazadas durante 2 años (2009- 2010). Registró 127 embarazos en 120 pacientes. De éstas, 54 recibieron terapia biológica. No hubo diferencias en el resultado del embarazo entre las pacientes tratadas y las que no eran medicadas con anti-TNF.52
En un estudio observacional de Schnitzler y col evaluaron 42 pacientes con terapia biológica, 35 pacientes con IFX y 7 con adalimumab, y el resultado del embarazono fue diferente de las pacientes sin terapia biológica y también de pacientes tratadas con anti-TNF previamente al embarazo.53
Adalimumab (ADA)
Es un fármaco categoría B. Los datos disponibles con ADA son más limitados en relación al IFX. La Organización de Especialistas en información sobre Teratología (OTIS) reportó un estudio prospectivo de 38 pacientes embarazadas en tratamiento con ADA y otro adicional de 133 pacientes. El índice de abortos espontáneos (5 de 38: 13%) feto muerto (0 de 38) prematurez y malformaciones congénitas (2 de 33: 6%) fue similar a las pacientes-control y a la población general.54
Certolizumab pegol (CZP)
Es una droga categoría B. Es un fragmento Fab pegilado de un anticuerpo monoclonal anti-TNF humanizado. Comparado con los otros anti-TNF, los datos con este fármaco son más limitados. Este anticuerpo carece de la fracción Fc, que es crucial para el pasaje a través de la placenta, y el fragmento Fab atraviesa la placenta por difusión pasiva, por lo que los niveles séricos hallados en el neonato son muy bajos. En un estudio de 4 pacientes que recibieron CZP durante el embarazo, con las últimas dosis administradas entre 1 y 4 semanas previas al parto, los niveles de CZP en el cordón umbilical variaron de 0,4 a 1 ug/ml, siendo los de las madres entre 4,9 y 59 ug/ml.55
En una serie de casos de 16 pacientes tratadas con CZP, todos los neonatos fueron sanos.56 En un estudio de 139 pacientes embarazadas, hubo 103 nacidos vivos, 2 con malformaciones congénitas, 21 abortos espontáneos y 15 electivos, resultados similares a la población general.57
De acuerdo a todos los estudios actuales, el CZP sería una droga segura durante todo el embarazo.
Golimumab (GOL)
Este anticuerpo anti-TNF ha sido aprobado recientemente para tratamiento en CU, por lo que no hay datos en relación a su uso en el embarazo.
En síntesis, en los últimos años, 2013,58 201459 y en este año60 se han publicado revisiones y meta-análisis, los cuales documentaron que no había mayor riesgo de abortos, prematurez, bajo peso y malformaciones congénitas en las pacientes embarazadas en tratamiento con anti- TNF comparadas con las pacientes sin dicha terapia.
Anti-integrinas
Natalizumab (NTZ)
Es una droga categoría C. Es un anticuerpo monoclonal inhibidor de la α-4-integrina aprobado para el tratamiento de la EC en EE.U., pero no así en Europa. Es un anticuerpo IgG4, transportado activamente a través de la placenta en el segundo y tercer trimestre del embarazo pero en menor medida que los anticuerpos IgG1 (IFX, ADA, GOL). Su uso en la EII es limitado, por la aparición, en algunas series, de un efecto adverso consistente en una leucoencefalopatía multifocal progresiva.
El NTZ es ampliamente utilizado en la esclerosis múltiple. En un estudio de 164 pacientes, con EII y esclerosis múltiple, durante el 1° trimestre del embarazo no evidenció efectos adversos.61
Otro estudio de 35 pacientes con esclerosis múltiple, en tratamiento con NTZ, no encontró diferencias en el resultado del embarazo comparado con pacientes sin terapia biológica.62
Vedolizumab (VDZ)
Es un anticuerpo monoclonal humanizado IgG1 contra α4B7-integrina que modula el transporte de linfocitos en el tracto gastrointestinal. No ha sido aún aprobado para su uso en la EII. En los estudios experimentales en ratas y monos, con dosis 20 veces superiores a las dosis en humanos, no se demostró daño fetal ni efectos adversos perinatales.63
En los estudios clínicos preliminares, en pacientes embarazadas y parejas de embarazadas, se comparó VDZ con placebo. De 24 pacientes embarazadas expuestas al VDZ, hubo un caso de prematurez y una malformación congénita (esta paciente había tenido un aborto espontáneo previamente). Hubo 16 parejas en tratamiento con VDZ, de las cuales hubo 9 nacidos vivos, 2 abortos espontáneos, 2 electivos y 3 resultados no documentados.64 Este es el primer estudio de VDZ en pacientes embarazadas, por lo que los datos son muy limitados para sacar conclusiones y se deberá esperar los resultados de los futuros estudios clínicos.
Tratamiento combinado
Un porcentaje de pacientes con EII severa requerirá, para el control de la enfermedad, tratamiento combinado con inmunosupresores (azatioprina, 6-mercaptopurina) y terapia biológica (IFX, ADA, CZP, GOL, NTZ). El estudio más significativo que evaluó esta situación es el estudio PIANO (Pregnancy IBD and Neonatal Outcomes),65 un registro prospectivo realizado en 30 centros de EE.UU que evaluaron a las pacientes durante todo el embarazo y continuará la observación hasta la edad de 4 años de todos los niños.
Se seleccionaron 4 grupos de pacientes: 1) pacientes no expuestas a tratamiento inmunosupresor ni a terapia biológica; 2) pacientes con tratamiento inmunosupresor (azatioprina/6-MP); 3) pacientes con terapia biológica (IFX, ADA, CZM, NTZ); y 4) pacientes con tratamiento combinado.
Los datos preliminares hasta abril de 2013 registraron 1.232 pacientes, de las cuales 357 recibían terapia biológica, incluido el 3° trimestre de embarazo, y 109 pacientes recibían tratamiento combinado con tiopurinas y biológicos.66 Se evaluaron los abortos espontáneos, actividad de la enfermedad, prematurez, bajo peso al nacer y malformaciones congénitas. Se observó un leve aumento del riesgo relativo (RR) para la prematurez en el grupo de tratamiento combinado (RR = 2,4; IC 95%: 1,3-4,3) que no se presentó en el grupo de terapia biológica sola (RR = 0,8; IC95%: 0,5-1,3). No se evidenció aumento del riesgo de abortos espontáneos, bajo peso al nacer o malformaciones congénitas en pacientes con terapia biológica sola o en el tratamiento combinado.
El reporte previo (mayo 2012 DDW)65 mostraba mayor índice de infecciones en los neonatos, pero el RR a los 12 meses, cuando se ajustó por partos prematuros y excluido el CZP, fue para el grupo de terapia biológica sola de 0,9 (IC 95%: 0,7-1,2) y 1 (IC95%: 0,7-1,3) para el grupo con tratamiento combinado. Asimismo, la lactancia no se asoció con riesgo de infecciones ni alteración del desarrollo pondo-estatural.
Efecto de la terapia biológica en los neonatos
Para evaluar la seguridad de los anticuerpos anti-TNF durante el embarazo, una consideración importante es conocer cuándo el feto estará expuesto a dicha medicación. El IFX y el ADA son anticuerpos IgG, que son los únicos que atraviesan activamente la placenta. Este pasaje es mediado por el receptor neonatal Fc que se expresa en las células del sinciciotrofoblasto de la placenta.67
Esta transferencia comienza en el segundo trimestre del embarazo y se hace significativa en el tercer trimestre. Se ha puesto especial atención en este tópico después de que Cheent K y col publicaron el caso fatal de un neonato, secundario a una infección diseminada de BCG, después de 6 semanas de la aplicación de la vacuna BCG, cuya madre recibió tratamiento con IFX durante todo el embarazo.68 A partir de este caso comenzó a investigarse los niveles séricos de la medicación en las madres y los neonatos.
En un estudio de Zelinkova Z y col de cuatro pacientes, se dosaron los niveles de IFX en el cordón umbilical y en sangre materna en el momento del parto.69 Estas pacientes recibieron IFX hasta las semanas 21 y 30 de gestación. Tres neonatos tenían niveles de IFX en el cordón umbilical que eran 2-3 veces superiores al nivel en la sangre materna, cuyas madres recibieron el IFX hasta las semanas 26 en dos y semana 30 en la otra. En la paciente que fue medicada hasta la semana 21, no se detectó IFX en el cordón umbilical.
Mahadevan U y col estudiaron los niveles séricos en sangre materna, en el cordón umbilical y en el neonato de 11 pacientes tratadas con IFX y 10 pacientes con ADA. La última dosis de IFX fue 35 días promedio previa al parto (rango: 2-91).70 En todos los casos el nivel de IFX en el cordón y en la sangre del neonato fue mayor que el de la madre al momento del parto, y el nivel medio del cordón umbilical fue 160% del nivel en sangre materna (rango: 87-400). El neonato necesitó de 2 a 7 meses para que el nivel sérico sea indetectable.
La última dosis promedio de ADA previa al parto fue 5,5 semanas (rango: 0,14-8). De la misma manera, en todos los casos el nivel sérico de ADA en el cordón fue mayor que el de la madre en el parto y el nivel medio del cordón fue 179% del nivel materno (rango: 98-293). Estos niveles permanecieron detectables después de 11 semanas del parto. No hubo complicaciones perinatales durante el periodo de seguimiento en ambos grupos.
De acuerdo a los estudios mencionados, surge la pregunta sobre cuánto tiempo se debería continuar la terapia durante el embarazo. Este tópico está siendo discutido actualmente en todos los centros especializados.
En el caso que la paciente evolucione con la enfermedad activa, el tratamiento se continúa porque, como se mencionó anteriormente, la actividad de la enfermedad es el factor pronóstico más importante tanto para la madre como para el feto. La decisión más difícil se plantea cuando la paciente evoluciona con remisión de la enfermedad porque no hay una opinión generalizada al respecto. En algunos estudios sugieren suspender la terapia biológica alrededor de las semanas 20-22,71 otros postulan entre las semanas 24 y 2672, 69 y en otros centros plantean mantener la terapia con IFX hasta la semana 32 y con ADA hasta la semana 34.73, 74
Será fundamental que la decisión de la suspensión de la terapia sea consensuada y compartida entre el equipo médico y las pacientes.
En relación al CZM, como no tiene un pasaje activo a través de la placenta, se podría continuar con la medicación hasta el final del embarazo.
En base a los estudios actuales, los neonatos expuestos a la medicación intra útero tendrían una respuesta inmune adecuada a las vacunas inactivas y se recomienda mantener el esquema habitual de vacunación. Las vacunas a virus vivos (rotavirus, BCG, polio oral) deberán evitarse durante los primeros 6 meses de vida.75
Parto. Cirugía
El modo del parto debe ser comandado por el equipo obstétrico según la indicación y la necesidad de la especialidad, y debe abordarse un trabajo interdisciplinario con el gastroenterólogo, proctólogo y neonatólogo.
La indicación de una cesárea programada se recomienda en pacientes con EC con compromiso perianal. En un estudio retrospectivo76 con un número significativo de pacientes con afección perianal, se documentó que el parto vaginal predisponía a mayores lesiones perianales.
El pouch ileoanal es una indicación relativa para una cesárea. Las pacientes con pouch necesitan conservar indemne el aparato esfinteriano y la función del piso pelviano para mantener una adecuada continencia fecal. No hay una opinión unánime al respecto, mientras algunos estudios77 reportan deterioro de las funciones fisiológicas de estas estructuras, otros no documentaron alteraciones en ese sentido.78 Se requieren nuevos estudios prospectivos para fundamentar una decisión clara en este sentido.
Las indicaciones quirúrgicas en las pacientes embarazadas con EII son similares a las pacientes no embarazadas. En las pacientes con CU la principal indicación es la refractariedad al tratamiento médico, teniendo en cuenta que la actividad severa de la enfermedad tiene mayor morbi-mortalidad para el feto y la madre y que una cirugía en esta situación será beneficiosa para ambos para evitar cualquier tipo de anastomosis primaria, la técnica aconsejada es una colectomía subtotal con ileostomía.
En la EC las indicaciones quirúrgicas comprenden la obstrucción, perforación, hemorragia o absceso intraabdominal, que no difieren de las pacientes no embarazadas. La cirugía es relativamente segura en todos los trimestres del embarazo, pero hay un ligero aumento de abortos espontáneos en el 1° trimestre y de parto prematuro en el 3° trimestre.79
Lactancia
La lactancia no está asociada a mayor índice de recaída de la EII y de hecho ejercería un efecto protector durante el primer año del posparto.80 Los datos son limitados y estas consideraciones deberán ser corroboradas con estudios prospectivos.
Medicación durante la lactancia (Tabla 3)
Aminosalicilatos
Los aminosalicilatos son excretados en la leche materna en ínfima cantidad. En varios estudios no se evidenciaron efectos perjudiciales para el neonato.81 Se pueden utilizar durante la lactancia.
Antibióticos
Los datos son limitados. El metronidazol y las quinolonas se excretan en la leche materna, por lo que no se aconseja su uso en la lactancia.82, 83
Corticoides
Los corticoides alcanzan baja concentración en la leche materna. Para minimizar este efecto se aconseja amamantar 4 horas después de una dosis oral de corticoide.84
Tiopurinas
La exposición de los lactantes a las tiopurinas es baja. Hay una gran variabilidad interindividual en la absorción y metabolismo de la azatioprina y mercaptopurina que influye en la exposición a los neonatos. De acuerdo a los estudios de biodisponibilidad de la droga, al igual que los corticoides, se sugiere esperar 4 horas desde la ingestión de la medicación para amamantar.85
Ciclosporina
Se excreta en la leche materna y se documentaron concentraciones terapéuticas en la sangre de los infantes, por lo que no se aconseja su uso.86
Tacrolimus
Los datos son limitados.
Infliximab
En contraposición con estudios previos,87 que no habían documentado IFX en la leche materna ni en el suero de los neonatos, en estudios recientes se encontraron en la leche materna niveles de IFX en concentraciones 200 veces menores que los niveles séricos.75, 88 Fisiológicamente la principal inmunoglobulina excretada en la leche materna es la Ig A, no así la IgG. Asimismo, después de la ingesta oral, los anticuerpos anti-TNF no son absorbidos por acción de las enzimas digestivas de los infantes. En el seguimiento de los lactantes no se evidenciaron complicaciones infecciosas. En base a los datos actuales, el IFX se puede usar en la lactancia.
Adalimumab
Se encontraron en mínimas concentraciones en la leche materna, pero no hay datos sobre las concentraciones séricas en los infantes.89
Certolizumab
Al igual que los otros anticuerpos anti-TNF, también se encontró en niveles bajos en leche materna.56
Metotrexate
Es excretado en la leche materna en baja proporción. Aunque el significado de esto se desconoce, dado el potencial daño por la acumulación de la droga en los tejidos de los infantes, no se recomienda su uso en la lactancia.90
Talidomida
No fue estudiada durante la lactancia, sin embargo, basado en sus propiedades químicas, podría excretarse en la leche materna. Los infantes expuestos a la droga pueden presentar somnolencia. Dada la ausencia de datos, se desaconseja su uso.90
Tabla 3. Seguridad de fármacos en la lactancia.
Recomendaciones finales
Un adecuado control de la EII, manteniendo la enfermedad en remisión clínica desde el momento de la concepción, aumenta la probabilidad de cursar el embarazo sin actividad de la EII. Si se produce una recaída de la enfermedad, deberá tratarse con todo el arsenal terapéutico disponible, como en las pacientes no embarazadas, con el objetivo de lograr la remisión, porque la actividad de la EII es el factor principal que determinará la evolución de la madre y el feto. Las pacientes con tratamiento inmunsupresor y terapia biológica deberán realizarse control de laboratorio cada 2 meses. Para aquellas pacientes que requieran tratamiento antibiótico, la mejor opción es amoxicilina-clavulánico.
Se suspenderá la terapia biológica al final del 2° trimestre. Se discutirá con la paciente el momento de reiniciar la terapia durante el puerperio. Se evaluará con el equipo obstétrico el modo de parto, especialmente las pacientes con EC con compromiso perianal y las pacientes con pouch ileoanal, pasibles de una cesárea programada.
Evitar las vacunas a virus vivos en los neonatos cuyas madres recibían terapia biológica durante el embarazo. Los pediatras deberán monitorear el estado inmunológico, y las potenciales infecciones de los infantes. La mayoría de la medicación puede continuarse durante la lactancia.71, 74
Referencias
- Mountifield R, Bampton P, Prosser R, Muller K, Andrews JM. Fear and fertility in inflammatory bowel disease; a mismatch of perception and reality affects family planning decisions. Inflamm Bowel Dis 2009; 15: 720-725.
- Andres PG, Friedman LS. Epidemiology and the natural course of inflammatory bowel disease. Gastroenterol Clin North Am 1999; 28: 255-281.
- O´Morain C, Smethurst P, Dore CJ, Levi AJ. Reversible male infertility due to sulphasalazine: studies in man and tat. Gut 1984; 25: 1078-1084.
- Waljee A, waljee J, Morris AM, Higgins PD. Threefold increased risk of infertility: a meta-analysis of infertility after ileal pouch anal anastomosis in ulcerative colitis. Gut 2006; 55: 1575-1580.
- Indaar AA, Efron JE, Young-Fadok TM. Laparoscopic ileal pouch-anal anastomosis reduces abdominal and pelvic adhesions. Sur Endosc 2009; 23: 174-177.
- Pabby V, Shah Oza S, Dodge L, Hacker MR, Moragianni VA, Correia K, Missmer SA, Fox JH, Ibrahim Y, Penzias A, Burakoff R, Cheifetz A, Friedman S. Am J Gastroenterol 2015; 110: 792- 797.
- Shivananda S, Lennard-Jones J, Logan R, Fear N, Price A, Carpenter L, M van Blankenstein. Incidence of inflammatory bowel disease across Europe: is there a difference between north and south? Results of the EC-IBD. Gut 1996; 39: 690-697.
- Orholm M, Munkholm P, Langholz E, Nielsen OH, Sorensen TI, Binder V. Familial occurrence of inflammatory bowel disease. NEJM 1991; 324: 84-88.
- Nielsen OH, Andreasson B, Bondesen S, Jarnum S. Pregnancy in ulcerative colitis. Scand J Gastroenterol 1983; 18: 735-742.
- Nielsen OH, Andreasson B, Bondesen S, Jarnum S. Pregnancy in Crohn´s disease. Scand J Gastroenterol 1984; 19: 724-732.
- Miller JP. Inflammatory bowel disease in pregnancy: a review. J R Soc Med 1986; 79: 221-225.
- Alstead EM. IBD and pregnancy. Postgrad Med J 2002; 78: 23- 26.
- Mahadevan U, Sandborn WJ, Li DK, Hakimian S , Kane S, Corley D. Pregnanacy outcomes in women with inflammatory bowel disease: a large community-based study from Northern California. Gastroenterology 2007; 133: 1106-1112.
- Bengston MB, Solvberg IC, Aamodt G, Jahnsen J, Moum B, IBSEN study group. Relationships between inflammatory bowel disease and perinatal factors: both maternal and paternal disease are related to preterm birth of offspring. Inflammatory Bowel Dis 2010; 16: 847-855.
- Cornish J, Tan E, Teare J, Teoh TG, Rai R, Clark SK, Tekkis P. A meta-analysis on the influence of inflammatory bowel disease on pregnancy. Gut 2007; 56: 830-837.
- Dominitz JA, Young JC, Boyko EJ. Outcomes of infants born to mothers with inflammatory bowel disease: a population-based cohort study. Am J Gastroenterol 2002; 97: 641-648.
- Stephansson O, Larsson H, Pedersen L, Kieler H, Granath F, Ludvigsson J, Falconer H, Ekbom A, Sørensen HT, Nørgaard M. Congenital abnormalities and other birth outcomes in children born to women with ulcerative colitis in Denmark and Sweden. Inflammatory Bowel Dis 2011; 17: 795-801.
- Broms G, Granath F, Ekbom A, Hellgren K, Pedersen L, Sørensen HT, Stephansson O, Kieler H. Low risk of birth defects for infants whose mothers are treated with Anti-Tumor necrosis factor agents during pregnancy. Clin Gastroenterol Hepatol 2016; 14: 234-241.
- Norgard B, Puho E, Pedersen L, Czeizel AE, Sorensen HT. Risk of congenital abnormalities in children born to women with ulcerative colitis: a population-based, case-control study. Am J Gastroenterol 2003; 98: 2006-2010.
- Wylie AM. Part 71, Designation of Class A, Class B, Class C, Class D, and agency action. Fed Regist 2008; 73: 18-55.
- Norgard B, Fonager K, Pedersen L, Jacobsen BA, Sorensen HT. Birth outcome in women exposed to 5-aminosalicylic acid during pregnancy: a Danish cohort study. Gut 2003; 52: 243-245.
- Mahadevan U, Corley D. Aminosalicylate (ASA) use during pregnancy is not associated with increased adverse events or congenital malformations in women with inflammatory bowel disease. Gastroenterology 2006; 130: A40.
- Norgard B, Czeizel AE, Rockenbauer M, Olsen J, Sorensen HT. Population-based case control study of the safety of sulfasalazin during pregnancy. Aliment Pharmacol Ther 2001; 15: 483-486.
- Rahimi R, Nikfar S, Rezale A, Abdollahi M. Pregnancy outcome in women with inflammatory bowel disease following exposure to 5-aminosalicylic acid drugs: a meta-analysis. Reprod Toxicol 2008; 25: 271-275.
- Rodríguez-Pinilla E, Martinez-Frías ML. Corticosteroids during pregnancy and oral cleft: a case-control study. Teratology 1998; 58: 2-5.
- Carmichael SL, Shaw GM. Maternal corticosteroid use and risk of selected congenital anomalies. Am J Med Genet 1999; 86: 242-244.
- Park-Wyllie L, Mazzotta P, Pastuszak A, Moretti ME, Beique L, Hunnisett L, Friesen MH, Jacobson S, Kasapinovic S, Chang D, Diav-Citrin O, Chitayat D,Nulman I, Einarson TR, Koren G. Birth defects after maternal exposure to corticosteroids: prospective cohort study and and meta-analysis of epidemiological studies. Teratology 2000; 62: 385-392.
- Gur C, Diav-Citrin O, Schechtman S, Arnon J, Ornoy A. Pregnancy outcome after first trimester exposure to corticosteroids: a prospective controlled study. Reprod Toxicol 2004; 18: 93-101.
- Beaulieu DB, Ananthakrishnan AN, Issa M, Rosenbaum L, Skaros S, Newcorner JR, Kuhlmann RS, Otterson MF, Emmons J, Knox J PA, Binion DG. Budesonide induction and maintenance therapy for Crohn´s diseaseduring pregnancy. Inflamm Bowel Dis 2009; 15: 25-28.
- Sorensen HT, Larsen H, Jensen ES, Thulstrup AM, Schønheyder HC, Nielsen GL, Czeizel A. Safety of metronidazole during pregnanacy: a cohort study of risk of congenital abnormalities, preterm delivery and low birth weight in 124 women. J Antimicrob Chemother 1999; 44: 854-856.
- Burtin P, Taddio A, Ariburnu O. Safety of metronidazole in pregnanacy: a meta-analysis. Am J Obstet Gynecol 1995; 172: 529-529.
- Caro-Paton T, Carvajal A, Martin de Diego I, Álvarez Requejo A, Rodríguez Pinilla E. Is metronidazole teratogenic? A meta-analysis. Br J Clin Pharmacol 1997; 44: 179-182.
- Diav-Citrin O, Shechtman S, Gotteiner T, Arnon J, Ornoy A. Pregnanacy outcome after gestational exposure to metronidazole: a prospective controlled cohort study. Teratology 2001; 63: 186-192.
- Czeizel AE, Rockenbauer M. A population based case-control teratologic study of oral metronidazole treatment during pregnanacy. Br J Obstet Gynecol 1998; 105: 322-327.
- Loebstein R, Addis A, Ho E, Andreou R, Sage S, Donnenfeld AE, Schick B, Bonati M, Moretti M, Lalkin A, Pastuszak A, Koren G. Pregnancy outcome following gestational exposure fluoroquinolones: a multicenter prospective controlled study. Anti-microbial Agents Chemother 1998; 42: 1336-1339.
- Larsen H, Nielsen GL, Schonheyder HC, Olesen C, Sorensen HT. Birth outcome following maternal use of fluoroquinolones. Int J Antimicrob Agents 2001; 18: 259-262.
- Alstead EM, Ritchie JK, Lennard-Jones JE, Farthing MJ, Clark ML. Safety of azathioprine in pregnancy in IBD. Gastroenterology 1990; 99: 443-446.
- Zlatanic J, Korelitz BI, Rajapakse R, Kim PS, Rubin SD, Baiocco PJ, Panagopoulos G. Complications of pregnancy and child development after cessation of treatment with 6-mercaptopurine for Inflammatory bowel disease. J Clin Gastroenterol 2003; 36: 303-309.
- Moskovitz DN, Bodian C, Chapman ML, Marion JF, Rubin PH, Scherl E, Present DH. The effect on the fetus of medications used to treat pregnant Inflammatory bowel disease-patients. Am J Gastroenterol 2004; 99: 656-661.
- Goldstein LH, Dolinsky G, Greenberg R, Schaefer C, Cohen- Kerem R, Diav-Citrin O, Malm H, Reuvers-Lodewijks ME, Rost van Tonningen-van Driel MM, Arnon J, Ornoy A, Clementi M, Di Gianantonio E, Koren G, Braunstein R, Berkovitch M. Pregnancy outcome of women exposed to azathioprine during pregnancy. Birth Defects Res Teratol 2007; 79: 696-701.
- Francella A, Dyan A, Bodian C, Rubin P, Chapman M, Present DH. The safety of 6-mercaptopurine for childbearing patients with inflammatory bowie disease: a retrospective cohort study. Gastroenterology 2003; 124: 9-17.
- Dejaco C. Pregnancy and birth outcome under thiopurine therapy for inflammatory bowel disease. Gastroenterology 2005; 128: A12.
- Coelho J, Beaugerie L, Colombel JF, Hebuterne X, Lerebours E, Lemman M, Baurner P, Cosnes J, Bourreille A, Gendre JP, Seksik P, Blain A, Metman EH, Nisard A , Cadiot G, Veyrac M, Coffin B, Dray X, Carrat F, Marteau P. Pregnancy outcome in patients with inflammatory bowel disease treated with thiopurines: cohort from the CESAME study. Gut 2011; 60: 198-203.
- Peyrin-Biroulet L. Oussalah A, Roblin X, Sparrow MP. The use of azathioprine in Crohn´s disease during pregnancy and in the post-operative setting: a worldwide survey of experts. Aliment Pharmacol Ther 2011; 33: 707-713.
- Bar Oz B, Hackman R, Einarson T, Koren G. Pregnancy outcome after cyclosporine therapy during pregnancy: a meta-analysis. Transplantation 2001; 71: 1051-1055.
- Angelberger S, Reinisch W, Dejaco C. Prevention of abortion by cyclosporine treatment of fulminant ulcerative colitis during pregnanacy. Gut 2006; 55: 1364-1365.
- Reindl W, Schmid RM, Huber W. Cyclosporin A treatment of steroid-refractory ulcerative colitis during pregnanacy: report of two cases. Gut 2007; 56: 1019.
- Baumgart DC, Sturm A, Wiedenmann B, Dignass AU. Uneventful pregnancy and neonatal outcome with tacrolimus in refractory ulcerative colitis. Gut 2005; 54: 1822-1823.
- Ashokkumar B, Jain AB, Reyes J, Marcos A, Mazariegos G, Eghtesad B, Fontes PA, Cacciarelli TV, Marsh W, De Vera M, Rafail A, Starzl TE, Fung J. Pregnancy after liver transplantation with tacrolimus immunosuppression: a single center´s experience update at 13 years. Transplantation 2003; 76: 827-832.
- Lichtenstein GR, Feagan BG, Cohen RD, Salzberg BA, Diamond RH, Chen DM, Pritchard ML, Sandborn WJ. Serious infections and mortality in association with therapies for Crohn´s disease. TREAT registry. Clin Gastroenterol Hepatol 2006; 4: 621-630.
- Katz JA, Antoni C, Keenan GF, Smith DE, Jacobs SJ, Lichtenstein GR. Outcome of pregnancy in women receiving infliximab for the treatment of Crohn’s disease and rheumatoid arthritis. Am J Gastroenterol 2004; 99: 2385-2392.
- Seirafi M, Treton X, de Vroey B, Cosnes J, Roblin X, Allez M, Marteau P, Biroulet LP, Bouhnik Y. Anti-TNF therapy and pregnancy in inflammatory bowel disease: a prospective cohort study from the GETAID. Gastroenterology 2011; 140: S-175.
- Schnitzler F, Fidder H, Ferrante M, Ballet V, Noman M, Van Assche G, Spitz B, Hoffman II, Van Steen K, Vermeire S, Rutgeerts P. Outcome of pregnancy in women with inflammatory bowel disease treated with antitumor necrosis factor therapy. Inflamm Bowel Dis 2011; 17: 1846-1854.
- Johnson DL, Jones KL, Chambers CD. Pregnancy outcomes in women exposed to adalimumab: the OTIS autoimmune diseases in pregnancy project. Gastroenterology 2009; 136: A-27.
- Mahadevan U. Certolizumab use in pregnancy: low levels detected in cord blood. Gastroenterology 2009; 136: A960.
- Kane SV, Acquah LA. Placental transport of immunoglobulins: a clinical review for gastroenterologists who prescribe therapeutic monoclonal antibodies to women during conception and pregnancy. Am J Gastroenterol 2009; 104: 228–233.
- Mahadevan U, Wolf DC, Stach C, Kosutic G, Williams S, Terpstra I, Clowse M. Outcomes of pregnancy in subjects exposed to certolizumab pegol. Am J Gastroenterol 2012; 107: S621.
- Nielsen OH, Loftus E Jr, Jess T. Safety of TNF-α inhibitors during IBD pregnancy: a systematic review. BMC Med 2013; 11: 174.
- Narula N, Al-Dabbagh R, Dhillon A, Sands B, Marshall J. Anti- TNFa Therapies Are Safe During Pregnancy in Women with Inflammatory Bowel Disease: A Systematic Review and Meta- Analysis. Inflamm Bowel Dis 2014; 20: 1862-1869.
- Shihab Z, Yeomans ND, De Cruz P. Anti-Tumour Necrosis Factor α Therapies and Inflammatory Bowel Disease Pregnancy Outcomes: A Meta-analysis. J Crohn´s Colitis 2016 (en prensa).
- Nazareth M, Mahadevan U, Cristiano L KM. Natalizumab use during pregnancy. Am J Gastroenterol 2008; 103: S449-S450.
- Hellwig K, Haghikia A, Gold R. Pregnancy and natalizumab: results of an observational study in 35 accidental pregnancies during natalizumab treatment. Mult Scler 2011; 17: 958-963.
- Deerfield, IL: Takeda Pharmaceuticals America, Inc. 2014.
- Dubinsky M, Mahadevan U, Vermeire S, Abhyankar B, Lasch K. Vedolizumab exposure in pregnancy: Outcomes from clinical studies in inflammatory bowel disease. J Crohn’s Colitis 2015; 9: S361-S362.
- Mahadevan U, Martin CF, Sandler RS, Kane S, Dubinsky MC, Lewis JD, Sandborn WJ, Sands BE. PIANO: a 1,000 patient prospective registry of pregnancy outcomes in women with IBD exposed to immunomodulators and biologic therapy. Gastroenterology 2012; 142: S-149.
- Mahadevan U. Management of your pregnant IBD patients. AGA spring Postgraduate Course 2013; 18-19: 367-379.
- Firan M, Bawdon R, Radu C. The MHC class I-related receptor, FcRn, plays an essential role in the maternofetal transfer of gamma-globulin in humans. Int Immunol 2001; 13: 993-1002.
- Cheenat K, Nolan J, Shariq S. Case report fatal case of disseminated BCG infection in an infant born to a mother taking infliximab for Crohn´disease. J. Crohns Colitis 2010; 4: 603-605.
- Zelinkova Z, de Haar C, de Ridder L, Pierik MJ, Kuipers EJ, Peppelenbosch MP, van der Woude CJ. High intra-uterine exposure to infliximab following maternal anti-TNF treatment during pregnancy. Aliment Pharmacol Ther 2011; 33: 1053-1058.
- Mahadevan U, Wolf DC, Dubinsky M, Cortot A, Lee SD, Siegel CA, Ullman T, Glover S, Valentine JF, Rubin DT, Miller J, Abreu MT. Placental transfer of anti-tumor necrosis factor agents in pregnant patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2013; 11: 286-292.
- Vermeire S, Carbonnel F, Coulie P, Geenen V, Hazes JM, Masson PL, De Keyser F, Louis E. Management of inflammatory bowel disease in pregnancy. J Crohn´s Colitis 2012; 6: 811-823.
- van der Woude CJ, Ardizzone S, Bengtson MB, Fiorino G, Fraser G, Katsanos K, Kolacek S, Juillerat P, Mulders AGMGJ, Pedersen N, Selinger C, Sebastian S, Sturm S, Zelinkova Z, Magro F. The Second European Evidenced-Based Consensus on Reproduction and Pregnancy in Inflammatory Bowel Disease. J Crohn´s Colitis 2015; 9: 107-124.
- Leung Y, Panaccione R, Ghosh S, Seow C. Management of the pregnant inflammatory bowel disease patient on antitumour necrosis factor therapy: State of the art and future directions. Can J Gastroenterol Hepatol 2014; 28: 505-509.
- Ng SW, Mahadevan U. My Treatment Approach to Management of the Pregnant Patient With Inflammatory Bowel Disease. Mayo Clin Proc 2014; 89: 355-360.
- Gisbert JP, Chaparro M. Safety of anti-TNF agents during pregnancy and breastfeeding in women with inflammatory bowel disease. Am J Gastroenterol 2013; 108: 1426-1438.
- Hatch Q, Champagne BJ, Maykel JA, Davis BR. Crohn´s disease and pregnancy: the impact of perianal disease on delivery methods and complications. Dis Colon Rectum 2014; 57: 174-178.
- Remzi FH, Gorgun C, Bast J. Vaginal delivery after ileal-pouch anal anastomosis: a word of caution. Dis Colon Rectum 2001; 48: 1691-1699.
- Cornish JA, Tan E, Teare J, Teoh TG. The effect of restorative proctocolectomy on sexual function, urinary function, fertility, pregnancy and delivery:a systematic review. Dis Colon Rectum 2007; 50: 1128-1138.
- Visser BC, Glasgow RE, Mulvihill KK, Mulvihill S. Safety and timing of nonobstetric abdominal surgery in pregnancy. Dig Surg 2001; 18: 409-417.
- Moffatt DC, Ilnyckyj A, Bernstein CN. A population based study of breatfeeding in inflammatory bowel disease: initiation, duration and effect on disease in the postpartum period. Am J Gastroenterol 2009; 104: 2517-2523.
- Diav-Citrin O, Park HY, Veerasunthaam G, et al. The safety of mesalamine in human pregnanacy: a prospective controlled cohort study. Gastroenterology 1998; 114: 23-28.
- Heisterberg I, Branebjerg PE. Blood and milk concentrations of metronidazole in mothers and infants. J Perinat Med 1983; 11: 114-120.
- Gardner DK, Gabbe SG, Harter C. Simultaneous concentrations of ciprofloxacin in breast milk and in serum in mother and breastfed infants. Clin Pharm 1992; 11: 352-354.
- Ost L, Wettrell G, Bjorkhem I, Rane A. Prednisolone excretion in human milk. J Pediatr 1985; 106: 1008-1011.
- Moretti ME, Verjee Z, Ito S, KorenG. Breast feeding during maternal use of azathioprine. Ann Pharmacother 2006; 40: 2269-2272.
- Moretti ME, Sgro M, Johnson DW, Sauve RS, Woolgar MS, Taddio A, Verjee Z, Giesbrecht E, Koren G, Ito S. Ciclosporine excretion into breast milk. Transplantation 2003; 75: 2144-2146.
- Kane S, Ford J, Cohen R, Wagner G. Abscence of infliximab in infants and breast milk from nursing mothers receiving therapy for Crohn´s disease before and after delivery. J Clin Gastroenterol 2009; 43: 613-616.
- Ben Horin S, Yavzori M, Kopylov U, Picard O, Fudim E, Eliakim R, Chowers Y, Lang A. Detection of infliximab in breast milk of nursing mothers with inflammatory bowel disease. J Crohn´s Colitis 2011; 5: 555-558.
- Ben Horin S, Yavzori M, Katz L, Picard O, Fudim E, Chowers Y, Lang A. Adalimumab level in breast milk of a nursing mother. Clin Gastroenterol Hepatol 2010; 8: 475-476.
- Nielsen OH, Maxwell C, Hendel J. IBD medications during pregnancy and lactation. Nat Rev Gastroenterol Hepatol 2014; 11: 116-127.
Correspondencia: Sergio Pablo Huernos
Av Caseros 2061. Ciudad Autónoma de Buenos Aires. Argentina.
Tel: 4304-1606
Correo electrónico: shuernos@arnet.com.ar
Acta Gastroenterol Latinoam 2016;46(3): 184-191
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE