Alicia María Sambuelli, Silvia Negreira, Aníbal Gil, Silvina Goncalves, Paula Chavero, Pablo Tirado, Maricel Bellicoso, Sergio Huernos
Enfermedades Inflamatorias Intestinales. Hospital de Gastroenterología “Dr. Carlos Bonorino Udaondo”.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2019;49(S2)
Publicado en www.actagastro.org el 30/12/2019
Resumen
La colitis ulcerosa (CU) y la enfermedad de Crohn (EC), formas principales de las Enfermedades Inflamatorias Intestinales (EII), presentan un amplio espectro de heterogeneidad clínica. Para el tratamiento de la EII son condiciones clave la información sobre la correcta categorización de la actividad y los patrones de la enfermedad, los objetivos adecuados, los factores predictivos usados actualmente, los criterios de eficacia y la seguridad de las terapias tradicionales y modernas.
Se realizó una búsqueda bibliográfica exhaustiva sobre los aspectos mencionados para la toma de decisiones en el tratamiento de la EII. Consideramos también positivo ampliar las fronteras del pensamiento delineando las opciones más relevantes en investigación.
Describimos las clasificaciones actuales de los patrones de la enfermedad: extensión en la CU, localización y comportamiento en la EC, aportando datos sobre la progresión frecuente de la enfermedad.
Incluimos los índices de actividad y las definiciones de remisión utilizadas a través del tiempo, pero destacando que estudios recientes hacen foco en objetivos terapéuticos que van más allá de los síntomas. Por lo tanto, enfatizamos que, según la evolución de los objetivos de tratamiento, los «end points» para evaluar la eficacia de fármacos se han movido desde los índices clínicos a las mediciones objetivas de la enfermedad (endoscopía, imágenes, marcadores serológicos y fecales) y los resultados informados por los pacientes (PRO).
Delineamos las modalidades de respuesta al tratamiento y el conocimiento actual sobre los factores de riesgo, útiles para la práctica clínica, de una evolución complicada de la EII. Además, resumimos las evidencias de eficacia y seguridad de la mayoría de las opciones terapéuticas: corticoesteroides, tiopurinas, inmunomoduladores y agentes biológicos.
Diseñamos algoritmos de tratamiento basados en la categorización de la enfermedad, tratamientos previos, respuesta, factores de riesgo, comorbilidades y metodología de optimización.
A pesar de que consideramos en los algoritmos los tratamientos y la sistemática para las optimizaciones disponibles en nuestro país, también hemos sumarizado las más importantes de las opciones nuevas que se comercializan o están en investigación en el concierto mundial.
Palabras claves. Colitis ulcerosa, enfermedad de Crohn, enfermedades inflamatorias intestinales, manejo, algoritmos.
Management of inflammatory bowel disease, revision and treatment algorithms
Summary
Ulcerative colitis (UC) and Crohn’s disease (CD), the main forms of Inflammatory Bowel Disease (IBD), present a wide spectrum of clinical heterogeneity.
Information about right categorization of activity and disease patterns, proper objectives, current predictive factors, criteria of efficacy and safety of traditional and modern therapies are key conditions for IBD management.
A comprehensive literature search was performed regarding mentioned aspects for decision making in IBD management. We consider also positive to expand the frontiers of thought with the knowledge of most relevant options in research.
We describe the current classifications of disease patterns: extent in UC, location and behavior in CD, underscoring data about frequent disease progression.
We include the activity scores and remission definitions used through time, but highlighting that recent studies focused on therapeutic targets beyond symptoms. So, we emphasize that, according evolve of treatment objectives, the endpoints to evaluate drug efficacy are moving from clinical indexes toward objective measures of disease (endoscopy, images, serologic and fecal markers) and patient-reported outcomes.
We delineate the modalities of treatment response and current knowledge about risk factors for complicated CD outcomes useful for clinical practice. Also, we summarized the evidences of efficacy and safety of most options for IBD treatment, corticosteroid, thiopurines, immunomodulators and biologic agents.
We design treatment algorithms, based on disease categorization, previous treatments, response, risk factors, comorbidities, and methodology of optimization.
Despite we considered in the algorithms the treatments and tools for optimization available in our country, we summarized most important commercialized or in research new options, around the world.
Key words. Ulcerative colitis, Crohn’s Disease, Inflammatory Bowel Diseases, treatment, algorithms.
Abreviaturas
CI: Colitis indeterminada.
CU: Colitis ulcerosa.
EC: Enfermedad de Crohn.
EII: Enfermedades inflamatorias intestinales.
IBD-U: Inflammatory Bowel Disease Unclassified.
Ver la lista completa de abreviaturas en la página 237
Introducción
Fundamento para el desarrollo de esta revisión y los algoritmos de manejo
Las Enfermedades Inflamatorias Intestinales (EII) son entidades potencialmente severas, de difícil manejo, con considerable heterogeneidad clínica. La vulnerabilidad y potencial discapacidad de los enfermos ha sido internacionalmente reconocida por la Organización Mundial de la Salud en la Clasificación Internacional del Funcionamiento, de la Discapacidad y de la Salud (por su nomenclatura en Inglés WHO, ICF Research Branch: The International Classification of Functioning, Disability and Health). Esto se debe a que estas enfermedades 1) presentan alta morbilidad por complicaciones que impactan marcadamente en la calidad de vida de los pacientes y sus familias, 2) son potencialmente graves, 3) pueden ser mortales y 4) debutan en edades cruciales del desarrollo, lo que afecta el período de capacitación y productividad.
Debido a estas razones, junto con la heterogeneidad en los patrones de presentación, la complejidad del manejo de la EII en la práctica clínica y el vertiginoso progreso de la medicina en esta área, es necesaria una revisión extensa sobre los diversos aspectos de la terapéutica en este tema que aporte una visión global y que además incluya el fundamento clínico de las estrategias de tratamiento, algoritmos de manejo y una introducción respecto de las expectativas futuras.
El equipo de Enfermedades Inflamatorias del Hospital “Dr. Carlos Bonorino Udaondo” fue el primero en desarrollar una estructura específica para la asistencia de la EII, convirtiéndose en el centro de referencia para su manejo en la Argentina. Considerando la heterogeneidad y la complejidad de la EII, decidimos realizar esta publicación resumiendo la evidencia publicada, los criterios de manejo para la práctica clínica con la experiencia acumulada durante 29 años, intentando desarrollar una herramienta útil en muestro medio.
Este protocolo terapéutico se enfocará esencialmente en el tratamiento de la EII fundamentado en la actividad, la localización y el comportamiento de la enfermedad. Incorporamos la información de guías y publicaciones basadas en la evidencia de diversas instituciones (Consensos Europeos Basados en Evidencia [ECCO], Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa [GETECCU], Colegio de Gastroenterológos de USA [ACG], Guías de la Sociedad Británica Gastroenterología [BSG], metaanálisis Cochrane, otras revisiones sistemáticas y bibliografía de autores relevantes. Asimismo, incluimos un sumario de nuevos desarrollos farmacológicos, con la finalidad de abrir nuestro trabajo a nuevas perspectivas, que podrían revolucionar la terapéutica en los años futuros.
Grupo de EII del Hospital Dr. Carlos Bonorino Udaondo: 29 años en el manejo de la EII
El equipo, que desde 1990 está integrado por seis gastroenterólogos, ha creado una base de datos, que cuenta con un registro de más de 4000 pacientes. En promedio, se hospitalizan alrededor de 140 pacientes por año y realizamos más de 4000 consultas ambulatorias, lo cual lo convierte en un centro apropiado para capacitación. Desde hace más de 15 años se decidió incluir rotaciones y visitas de médicos de otros centros para capacitarse en el manejo de estos pacientes.
El abordaje del paciente se realiza mediante un equipo multidisciplinario. El área de emergencia cuenta con una guardia de 24 horas con gastroenterólogos y cirujanos entrenados en el manejo de estas enfermedades. El servicio de Proctología incluye una planta de numerosos coloproctólogos altamente especializados. Además, trabajamos con patólogos especializados, endoscopistas avezados en diagnóstico y terapéutica, infectólogos, servicio de nutrición y servicio de imágenes con disponibilidad de enterotomografía en el hospital y enterorresonancia a través de la red municipal. El equipo incluye actualmente una enfermera para el soporte de los pacientes y la administración de medicamentos biológicos. El manejo de los pacientes internados se realiza de forma multidisciplinaria entre nuestro equipo, los coordinadores de sala, el staff del hospital y los médicos residentes, quienes reciben una sólida formación teórico-práctica en estas enfermedades, discutiendo los pacientes en el ámbito general del hospital y en recorridas específicas para pacientes con EII.
Registro de las EII
Las bases de datos electrónicas son reconocidas internacionalmente como una herramienta valiosa para evaluar las características clínicas y la evolución de la enfermedad. Conscientes de que las EII son enfermedades crónicas con posibles reactivaciones impredecibles que requirieren frecuentes reevaluaciones de la clínica y la terapéutica, el manejo de una gran casuística utilizando solamente extensas historias manuscritas solicitadas programadamente es inviable. En consecuencia, creamos tempranamente un registro computarizado. El registro de EII se creó en el año 1996 y recolecta la información a partir de una base de datos generada localmente que resume las características clínicas de estos pacientes; funciona en red en el área de nuestro consultorio especializado y permite la captura regular y sistemática de las características sociodemográficas y clínicas de estos pacientes a través del tiempo. El programa consta de datos codificados que se ordenan cronológicamente, lo que permite el análisis en software estadísticos, incluyendo además información descriptiva, que posibilita la codificación retrospectiva. El registro captura eventos clínico-quirúrgicos-terapéuticos relevantes, usando definiciones internacionalmente aceptadas, lo que permite el estudio de la evolución, de los factores de pronósticos y de los resultados de la terapéutica.
Los datos históricos se migraron recientemente a un sistema más moderno, con el objetivo de automatizar la categorización de los pacientes según las clasificaciones internacionales, cálculos de índices clínicos, tiempo de sobrevida hasta diversos eventos, como la cirugía, y diferentes complicaciones y tratamientos. Hasta el año 2018, el registro incluye a más de 4000 pacientes con diagnóstico de EII.
Fundamento clínico y definiciones para una estrategia adecuada del tratamiento
1. Aspectos generales e impacto de la enfermedad
Las EII son afecciones crónicas y potencialmente discapacitantes que representan un importante problema en la salud pública, tienden a afectar a presonas jóvenes, presentan una curso clínico recidivante que impactan en la vida, la capacidad laboral, la vida social y la calidad de vida de los pacientes.1 La colitis ulcerosa (CU) y la enfermedad de Crohn (EC) son los dos tipos principales de EII.
⇨ Epidemiología: datos relevantes
Se han reportado mundialmente diferencias considerables en la epidemiología de la EII: en la prevalencia y la incidencia con variaciones en la relación CU/EC.2 Globalmente, la incidencia de la EII aumentó marcadamente en los últimos años. Se ha descripto dentro de una determinada región que este incremento se presenta inicialmente en la CU y luego se estabiliza, para dar lugar a un aumento de la EC, habiéndose reportado en diversas regiones del mundo un cambio en la relación CU/EC, con una disminución proporcional del predomino de la CU registrado históricamente. Las mayores tasas de incidencia y prevalencia de EII se han observado en el norte de Europa, el Reino Unido y América del Norte.2, 3 En áreas de menor prevalencia como el sur y el este de Europa, Asia, África y América del Sur, las tasas de incidencia también demostraron un aumento progresivo.4 Lo descripto sugiere que estas características pueden depender de factores de riesgo ambientales.2 Se reportó históricamente un gradiente norte-sur en la prevalencia de la EII.4 Sin embargo, tal variante geográfica se ha descripto menos relevante en los últimos años, observándose altas tasas de incidencia en el sur de Australia y Nueva Zelandia. Una revisión sistemática reciente que incluyó las publicaciones basadas en población analizó 167 estudios realizados en Europa, 52 en Asia y países del Medio Oriente y 27 de América del Norte.2 Los registros más altos de incidencia y prevalencia de la EII se observaron en naciones occidentalizadas. Los registros de prevalencia más elevados de Europa para la CU fueron 505 por 100.000 personas en Noruega y 322 por 100.000 personas para la EC en Italia. En Canadá se reportaron tasas de 248 por 100.000 personas para la CU y 319 por 100.000 personas para la EC. El mencionado estudio informó como incidencias más altas (por 100.000 habitantes-año) para CU áreas del norte de Europa (Islandia: 24,3), América del Norte (Canadá: 19,2) y Australia (17,4). En Asia y Medio Oriente la incidencia se estimó en 6,3 por 100.000 personas-año. Para la EC las mayores tasas de incidencia anuales por 100.000 personas-año se observaron en Australia (29,3), América del Norte (Canadá: 20,2) y Europa (12,7 por 100.000 personas-año, reportándose 10,6 en UK), mientras que en Asia y Medio Oriente se registraron 5,0 por 100.000 personas-año. Estudios realizados en Cardiff (UK) y en el Condado de Olmsted en los Estados Unidos mostraron una incidencia creciente y consistente de EII desde la década de 1930, reportada hasta final del siglo XX en la CU. La mayoría de los estudios incluidos en la mencionada revisión sistemática demostraron una incidencia creciente estadísticamente significativa tanto para la EC como para la CU en diferentes regiones a través del tiempo, demostrando un incremento global de esta en relación con la industrialización.2 También el estudio ECCO-Epicom describe que la incidencia y la prevalencia de EII aumentaron en las últimas décadas en toda Europa.5 La prevalencia estimada actual de EII es aproximadamente del 0,3% de la población europea, con una incidencia en incremento de 176.000 casos nuevos-año, estimándose que 2,5-3 millones de personas en Europa son afectadas por EII, lo que implica un costo total anual en salud muy elevado. En base a un promedio costos de los pacientes diagnosticados en el año 2010 (n 1.367) en 28 centros europeos, durante en su primer año luego del diagnóstico, se calculó un costo total de 5942 Euros para EC, 2753 para CU, y 2898 para las EII no clasificables. En cuanto a la edad de debut, las tasas de incidencia son mayores entre la segunda y la cuarta década de la vida. Dado que las EII afectan principalmente a individuos jóvenes en su adultez temprana e impactan en todos los aspectos de la vida de la persona afectada, representan importantes costos directos e indirectos tanto para el sistema de salud como para la sociedad. Aproximadamente la mitad de los pacientes tienen recaídas frecuentes o enfermedad activa continua y pueden desarrollar manifestaciones extraintestinales.5 Además, hasta 2/3 de los pacientes con EC todavía desarrollan complicaciones que requieren hospitalización y/o cirugía, aunque algunos estudios recientes sugieren una disminución en las tasas de cirugía. Las tasas quirúrgicas también disminuyeron en la CU, reportándose generalmente un 10-15% de pacientes que finalmente requieren una colectomía, aunque existe una variación geográfica inexplicada en las tasas de colectomía.2 Este estudio Epi-com reveló que la tasa de discapacidad a largo plazo y el impacto económico y social de las EII en Europa es enorme. El 20% de los pacientes en Europa requieren una pensión de invalidez y entre un 10% y 25% adicional enfrentan problemas de desempleo o trabajan a tiempo parcial.5
Los datos epidemiológicos sugieren que la EII se distribuye en igual forma entre ambos sexos. Desde el punto de vista de la etnicidad en las poblaciones de raza blanca, se han demostrado las incidencias más elevadas y se ha descripto una particular predisposición en los judíos; sin embargo, actualmente estas enfermedades están aumentando globalmente, como se ejemplifica en descripciones de tal incremento en hispánicos y asiáticos.6
Kaplan G., en una apasionante publicación sobre la carga que representará la EII entre el 2015 y el 2025 con base en el evidente aumento progresivo de la misma, la describe como una enfermedad global. Ejemplifica el impacto del continuo crecimiento de la EII con la población de Alberta, Canadá, en donde a los pacientes ya existentes en el 2015 (prevalencia 660 por 100.000) se sumará un número creciente de casos incidentes, calculándose una prevalencia de 790 por 100.000 para el 2025, con lo que el número absoluto de pacientes con EII en 2025 en Alberta será casi 70% más alto que en 2015. Del mismo modo, este autor analiza datos de incidencia y prevalencia de diversas áreas del mundo, avalando fervientemente la información sugerida por autores previos sobre un cambio en la epidemiología de la EII caracterizado por constante incremento. Kaplan señala que la EII fue considerada tradicionalmente como una enfermedad de los blancos europeos que viven en regiones industrializadas del mundo occidental, pero estudios epidemiológicos han desafiado esta creencia, al demostrar una gran influencia del medioambiente, afectando a individuos de todos los grupos étnicos (por ejemplo, hispanos y afroamericanos) cuyas familias han vivido en el mundo occidental por muchas generaciones.
Así, la primera generación de descendientes de individuos que migraron de países en desarrollo con baja prevalencia de EII (como el sudeste Asia) al mundo occidental (por ejemplo, el Reino Unido) tiene el mismo riesgo de desarrollar EII que la población del Reino Unido. En las últimas décadas, en países recientemente industrializados en Asia, los estudios (como el Asia-Pacific Crohn’s and Colitis Epidemiology Study: ACCES) demostraron que la EII es una enfermedad ya establecida; similarmente, en el estado de Punjab del norte de India la incidencia demostrada en CU fue de 6 por 100.000 en 1999 a 2000; un estudio nacional de Turquía demostró tasas de 4,4 y 2,2 por 100.000 desde 2002 a 2003 para la CU y la EC, también en aumento; según datos de Brasil, la incidencia de la EII se incrementó de 1,0 por 100.000 entre 1986-1990 a 4,5 a 3,5 por 100.000 entre 2001 a 2005. Si bien los datos son aún más bajos que en países industrializados, todos informan un progresivo aumento, y en varios se ha demostrado un incremento proporcional de la EC, como ocurrió en el mundo occidentalizado.
Kaplan señala que los países recientemente industrializados han experimentado una transformación de la sociedad, con migración de áreas rurales a urbanas, un cambio de la agricultura a la industrialización, y que centros urbanos densamente poblados han dado lugar a una evolución de comportamientos de estilo de vida (por ejemplo, tabaquismo), dietas (como una reducción en ingesta de fibra y disminución de la lactancia), exposiciones (aumento de la contaminación) y actividades diarias (un cambio a ocupaciones sedentarias). Este autor postula que los países recientemente industrializados, como la India y la China tienen cada uno una población que excede mil millones de personas, y que ello, en conjunción con la expansión de la urbanización y la occidentalización podría significar que el número de casos de EII en países recientemente industrializados podría en algún momento superar el número de casos en el mundo occidental. Por lo tanto, el mencionado autor, define a la EII como una enfermedad global y reflexiona respecto de la implicancia sobre los sistemas de salud del aumento exponencial en el número de pacientes con EII en los países de occidente durante la próxima década, en los que el debut temprano y una incidencia en aumento darían una inversión de la pirámide poblacional, con una cantidad de pacientes con EII que sobrepase los recursos, el personal y la infraestructura necesarios para atenderlos. Señala también que los países recientemente industrializados deben prepararse para el rápido aumento de la incidencia y la prevalencia de EII.5-7
No se dispone de datos poblacionales para estimar la incidencia y prevalencia en la Argentina. En el Hospital de Gastroenterología donde la sección de Enfermedades Inflamatorias Intestinales constituye de alguna manera un centro de derivación de estas enfermedades en el país, de los 4000 pacientes registrados con datos confiables para categorizar la enfermedad, globalmente los dos tercios son portadores de CU, pero la relación CU/EC fue disminuyendo progresivamente a partir del siglo presente por el incremento relativo de la EC, siendo en los últimos años tal relación menor a 2:1.
⇨ Aspectos básicos de la patogenia
La etiología de la EII es aún desconocida. Se considera que varios factores desempeñan un papel en el desarrollo de la EII, entre ellos la susceptibilidad genética, las condiciones ambientales, la flora intestinal y una deficiencia del sistema inmune.2 Adicionalmente, una función anormal de la barrera epitelial brinda una exposición inapropiada de los linfocitos de la lámina propia a estímulos antigénicos de la luz intestina.8
En los últimos años se han logrado progresos importantes en las investigaciones sobre la patogenia. Actualmente se acepta que la desregulación de la respuesta inmune se desencadena por diferentes antígenos intraluminales, como la flora bacteriana, y probablemente otros antígenos (alimentarios, microbianos y otros medio ambientales). La influencia de factores genéticos se evidencia por reportes de agrupamiento familiar y de mayor incidencia en gemelos monocigotos.9 Por lo tanto, se reconoce que la interacción de factores genéticos y ambientales tiene un papel en la patogénesis de estos trastornos. Estos factores producirían una respuesta inflamatoria descontrolada que desencadenaría el daño tisular.10
Las modificaciones de la dieta, el uso de antibióticos, la colonización intestinal, el estilo de vida y la industrialización, son los factores que probablemente más contribuyeron al aumento de la prevalencia de la enfermedad inflamatoria intestinal en el último siglo. Se postula que los factores ambientales y/o infecciones que ellos desencadenan inducen cambios en la función de barrera del epitelio, con la consiguiente pérdida de tolerancia inmune a los antígenos intestinales.
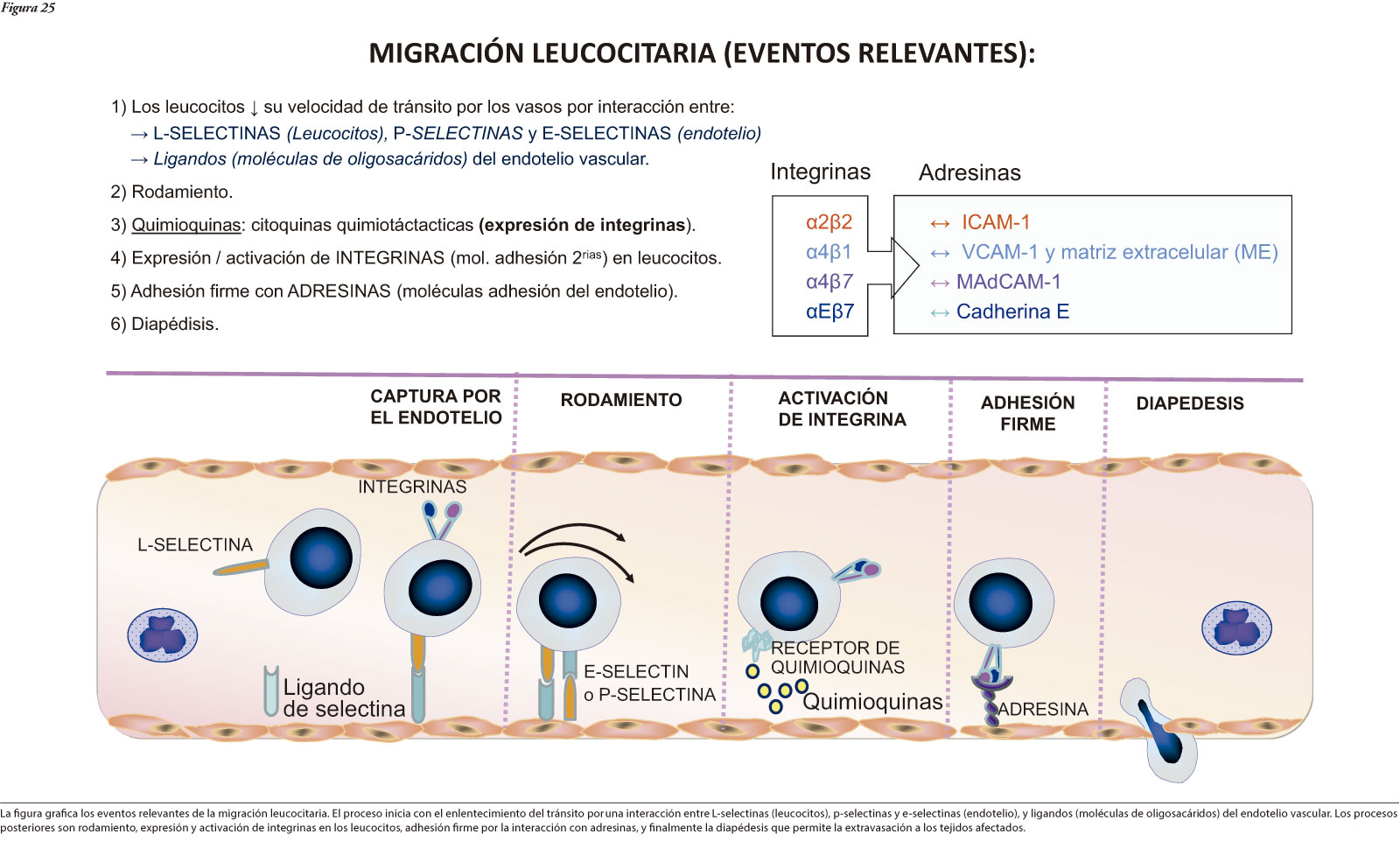
Esto lleva a la activación de las células dendríticas (funcionando como presentadoras de antígenos) que median el transporte de los mismos a los ganglios linfáticos mesentéricos, donde promueven la diferenciación de linfocitos T naïve a células TH-1, TH-2, TH-17 o linfocitos T reguladores que a su vez producen citoquinas proinflamatorias y quemoquinas. Seguidamente, ingresan al intestino células circulantes efectoras y reguladoras a través de mecanismos altamente selectivos para la migración de tales células que involucran diversas interacciones con el endotelio vascular mediante moléculas de adhesión, proceso que concluye en la diapédesis de tales células a través de la pared vascular y migración hasta la lámina propia de los segmentos gastrointestinales afectados por el proceso inflamatorio. Diversas mutaciones genéticas específicas pueden causar una desregulación de la respuesta inmunitaria innata.
Varias anomalías genéticas se asociaron con alteraciones en la función de barrera de la mucosa, con deficiente inmunorregulación o depuración bacteriana, observándose híper-reactividad de linfocitos T a las bacterias entéricas comensales. Estas alteraciones involucran tanto el sistema inmunitario innato como el adquirido. Adicionalmente, factores ambientales parecen desencadenar modificaciones epigenéticas que probablemente contribuyan a la herencia. Además de afectar la función inmunológica y la barrera intestinal, los factores del medioambiente parecen influir en la composición del microbioma intestinal y su interacción con el sistema inmune mucoso. Bajo la influencia de todos los factores mencionados, la interacción del microbioma intestinal, los mecanismos de defensa innatos, la susceptibilidad genética, los factores medioambientales y la función de barrera, según el equilibrio de los diversos factores, configuran un estado de “inflamación fisiológica” manteniendo la homeostasis y una adecuada defensa contra patógenos, o bien una situación patológica desencadenando y perpetuando las lesiones inflamatorias crónicas y el cortejo sintomático de las EII.9, 11
⇨ Principales factores de riesgo
Los factores ambientales desempeñan una función importante en la etiología de las EII.4, 12, 13 El tabaquismo activo tiene un efecto protector sobre la presentación de la CU y su severidad. El riesgo de desarrollar una CU en fumadores es aproximadamente la mitad que en los no fumadores.
Contrariamente, los fumadores tienen un riesgo aumentado de desarrollar EC, cercana al doble que los no fumadores. También hay mayor concordancia entre gemelos en relación con el tabaco.14
Los metaanálisis de Calkins (1989) y Logan (1990) demostraron para la CU un RR de 0,41 (IC95%: 0,3-0,5) y 0,47 (IC95%: 0,4-0,6) y para la EC un RR de 2,0 (IC95%: 1,7-2,5) y 2,4 (IC95%: 2,0-2,9) respectivamente. El riesgo para EC en relación con el tabaquismo se reportó mayor en las mujeres (OR = 4,1; IC95%: 2,0-4,2) que en hombres (OR = 1,5; IC95%: 0,8-6,0).15
Por otro lado, Calkins también reportó que los exfumadores presentan un mayor riesgo versus los no fumadores de desarrollar CU (OR = 1,7; IC95%: 1,4-2,0). El intervalo hasta la presentación de la CU predomina en el 1er año, luego de dejar de fumar, siendo todavía común hasta 2-3 años de la interrupción del hábito, aunque se describió que el aumento del riesgo puede prolongarse hasta los 6 años.16 Las tasas de admisión hospitalaria y de colectomía también son mayores en exfumadores que en individuos que nunca fumaron.17, 18 En EC los exfumadores presentan un aumento del riesgo versus los no fumadores (OR = 1,8; IC95%: 1,3-2,5), aunque el mismo es menor que en los que continúan con el hábito.19
El tiempo de “pérdida” del riesgo en EC es un aspecto poco documentado; según algunos autores podría ser de 5 a 10 años.13-20 Respecto del efecto en el fumador pasivo, aunque el tema es controvertido, se ha descripto un aumento de menor magnitud que en el fumador activo, tanto en exposición prenatal como en la niñez.1-13 Se corroboró asimismo un riesgo relevante de recurrencia postoperatoria en el fumador.21 El estudio TABACROHN demostró que hasta casi un tercio (31%) de los pacientes con EC son capaces de lograr abstinencia completa del hábito de fumar dentro de los 18 meses de una estrategia de abandono del tabaco basada en la educación y consejos, con solo 8% de recaída del hábito dentro del lapso del estudio.22 Ello señala la importancia de la función educativa del médico, ya que en otro estudio se demostró que la cesación del tabaco se asoció con una reducción de las recaídas durante un seguimiento medio de 29 meses, con tasas similares a los no fumadores, y con menor necesidad de esteroides o terapia inmunosupresora en los que dejaron el hábito y en los no fumadores, en comparación con los que continuaban fumando.15 El mecanismo patogénico de este efecto discordante del tabaquismo en ambas enfermedades no es claro, pero puede deberse en parte a diferencias en la patogénesis de las respetivas enfermedades relacionadas con el estrés oxidativo en las células mononucleares en respuesta a los constituyentes del humo del cigarrillo. Se hipotetizaron otros factores, entre ellos cambios en la permeabilidad, en la microcirculación, en la motilidad (modulada por óxido nítrico), en la peroxidación lipídica, en niveles diferentes de citoquinas proinflamatorias de la mucosa, en la síntesis de mucina (la mucosa es delgada en la CU versus EC), o en el clearance de bacterias por los macrófagos.1-13
Se demostró que la apendicectomía con histología comprobada de apendicitis es un factor protector para el desarrollo de la CU y se reportó una reducción de la severidad cuando la apendicetomía se realiza previamente el debut de la enfermedad.4 Se ha sugerido que este efecto se relacionaría con una alteración del microbioma intestinal que influye en la prevalencia de apendicectomía y resulta protector para el desarrollo de la CU.13 Cuando la apendicectomía se efectúa después del inicio de la CU, el efecto sobre la evolución de la enfermedad es menos evidente.12 En cambio, en la EC el efecto no es protector, siendo controvertido un leve efecto contrario.23, 24
En la EC, los antecedentes familiares de EII son factores de riesgo bien probados para el desarrollo de la enfermedad.25, 26 Los antecedentes familiares de EC o CU aumentan levemente el riesgo de desarrollar CU en otro miembro de la familia,12 aunque la concordancia en gemelos homocigotos es más frecuente en la EC.
Respecto de la teoría de la higiene, se postuló que en la EII una disminución de la exposición a antígenos en la infancia podría afectar la diversidad de la microbiota entérica, produciendo disbiosis, y podría ser la causa de una hiperreacción inmunológica en el momento de un siguiente contacto microbiano, pero esto es discutido y parece no ser homogéneo en distintas regiones del mundo.27 Los anticonceptivos han sido reportados como factor de riesgo ambiental involucrado en el desarrollo de CU y EC (RR: 1,28 y 1,46 respectivamente), y también se describió que el riesgo sería mayor en las fumadoras. Los estrógenos usados como terapia de reemplazo hormonal parecen aumentar el riesgo de CU pero no de la EC. Sin embargo, no hay suficiente evidencia para aseverar una relación con alguna forma específica de anticoncepción y la ocurrencia de recaída. Por lo tanto, los hallazgos reportados y el riesgo-beneficio de usar o restringir los anticonceptivos son controvertidos.27, 28
Los medicamentos antiinflamatorios no esteroides (AINEs) no selectivos se han considerado portadores de un riesgo significativo de agravar la CU; sin embargo, tal factor de riesgo y su verdadera magnitud se discuten.
La evidencia con respecto a los antiinflamatorios no esteroides como factor de riesgo para el desencadenamiento de una EC es menos robusta.29 Sin embargo, debido a observaciones realizadas en la vida real, nuestra política es aconsejar a los pacientes evitar su uso en las dos enfermedades.
La gastroenteritis infecciosa es sucedida por un riesgo de 2,4 (IC95%: 1,7-3,3) de desarrollar EII, en relación a controles sin EII, especialmente durante el primer año posterior al evento (hazard ratio = 4,1; IC95%: 2,2-7,4), aunque el riesgo absoluto es bajo.30 El mencionado riesgo de desarrollar EC en relación con gastroenteritis se reportó mayor que en la CU (hazard ratio = 6,6; IC95%: 1,9-22,4) durante el mencionado período.
El aumento de la prevalencia de la EII con la industrialización es mundialmente reportado y aceptado. El material particulado de alta densidad produce aumento TNF-α (mediador clave de EII) y otras citoquinas. Se reportó en un estudio que la densidad de las emisiones de componentes seleccionados de la polución del aire correlacionó significativamente con hospitalizaciones por EII en adultos en los hospitales de Wisconsin en el año 2002 (p = 0,02).13
Además, la exposición residencial a altas concentraciones de dióxido de nitrógeno se asoció con un elevado riesgo de desarrollar EC en adultos jóvenes y en chicos, y la exposición residencial a altas concentraciones de dióxido de sulfuro se relacionó con un elevado riesgo de desarrollar CU, también en este caso en las mencionadas edades tempranas.31
Además, se investigó para ambas enfermedades inflamatorias intestinales la implicancia de una dieta pobre en fibras y alta en azúcares refinados, la ingesta de ácidos grasos totales, monoinsaturados y poliinsaturados, las comidas rápidas, el consumo de bebidas cola, etc., con resultados discordantes entre estudios; varias publicaciones de las dos últimas décadas no avalan la hipótesis de una patogénesis alimentaria. Sin embargo, modificaciones en la dieta podrían resultar en cambios tempranos en el microbioma intestinal, y desencadenar brotes de estas enfermedades. Es dificultoso arribar a conclusiones valederas por diversos factores confundidores como la restricción de la ingesta por los síntomas, presentes ya en las fases precoces de la enfermedad.
Adicionalmente diversos hallazgos clínicos y bioquímicos que podrían sugerir el rol de algún alimento pueden ser inespecíficos y secundarios a la lesión intestinal.28, 32
También se han sugerido implicadas en la patogenia la toma de antibióticos en edades tempranas de la vida, la deficiencia de vitamina D y el estrés. Se han realizado intentos para aislar microorganismos que podrían explicar la inflamación, pero no se ha podido sustentar adecuadamente la hipótesis de un microorganismo específico que gatille la inflamación crónica.
La enfermedad de Johne es una enteritis granulomatosa crónica de ganado vacuno y ovino causado por Mycobacterium avium, una subespecie paratuberculosis (MAP), muestra algunas analogías con EC. Varios estudios han tratado de aclarar si MAP tiene un papel en la etiología de esta enfermedad.
La presencia de MAP se investigó mediante múltiples métodos de detección en diferentes muestras de tejidos de pacientes afectados por EC o CU y en controles sanos. Sobre la base de diversos reportes, algunos autores apoyan una estrecha relación entre MAP y EC, pero la opinión general es que todavía necesita ser probada la existencia de un vínculo causal claro.4, 33
2. Diagnóstico y subtipos de EII
Para establecer el diagnóstico deben descartarse otras entidades que pueden presentar signos o síntomas parecidos, las que deben seleccionarse para ser evaluadas como diagnóstico diferencial según la localización y características de las lesiones, síntomas y estudios complementarios. Algunos diagnósticos diferenciales presentan hallazgos parecidos en la endoscopía, las imágenes o la histopatología, y otros solo se pueden confundir por los síntomas (Tabla 1).34
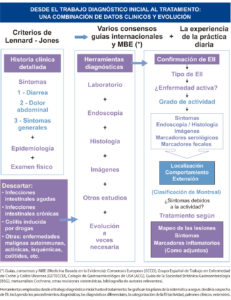
Las EII se clasifican en: CU, EC (constituyendo estas dos la mayoría de las formas clínicas), EII no clasificable y colitis indeterminada. Los criterios tradicionales de Lennard-Jones para diagnosticar EC y CU involucran 4 grupos de datos: clínicos, radiológicos, endoscópicos y anatomopatológicos (categorizados en mayores y menores), confirmando el diagnóstico de EC o CU en base a la suma de criterios, definidos según su relevancia (Tablas 2 y 3).35
Tabla 1. Principales entidades a descartar en el diagnóstico diferencial de la EII.

Tabla 2. Criterios diagnósticos tradicionales para definir la colitis ulcerosa (Lennard-Jones, 1980).35
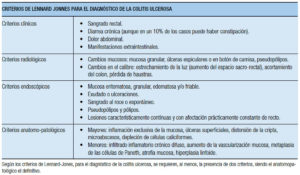
Tabla 3. Criterios diagnósticos tradicionales para definir la enfermedad de Crohn (Lennard-Jones, 1980).35
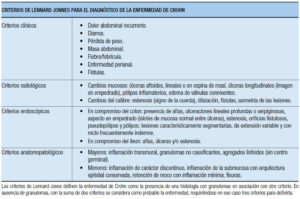
Si bien ellos han sido considerados de gran relevancia a través del tiempo y estandarizan conceptos importantes, Angelberger y col. estudiaron la sensibilidad y especificidad para el diagnóstico de EC de los criterios de Lennard-Jones en pacientes de Nancy, Barcelona y Viena y determinaron que cerca de la mitad de los pacientes con diagnóstico de larga data hubieran sido considerados como “no EC” al momento del diagnóstico.26, 36
En la actualidad se considera que el diagnóstico surge de una combinación de datos clínicos y estudios que no es estricta.
Además un porcentaje de pacientes con EII cambia de subtipo diagnóstico con el tiempo. En la actualidad ha surgido una necesidad (que se está satisfaciendo progresivamente) de evaluar e incorporar nuevos criterios, con base en la evolución de las metodologías aplicables a los pacientes, incluyendo los diversos progresos en técnicas de diagnóstico por imágenes, como la videocápsula.
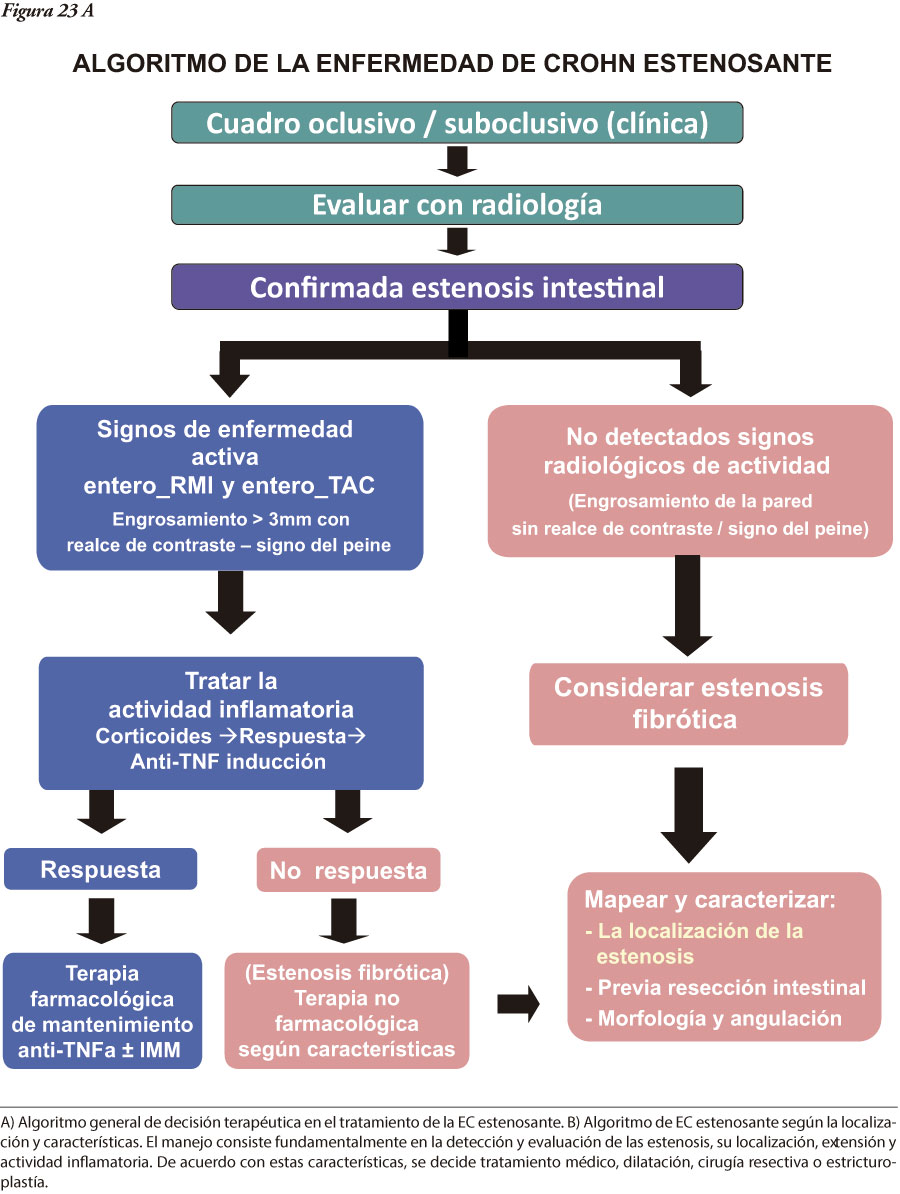
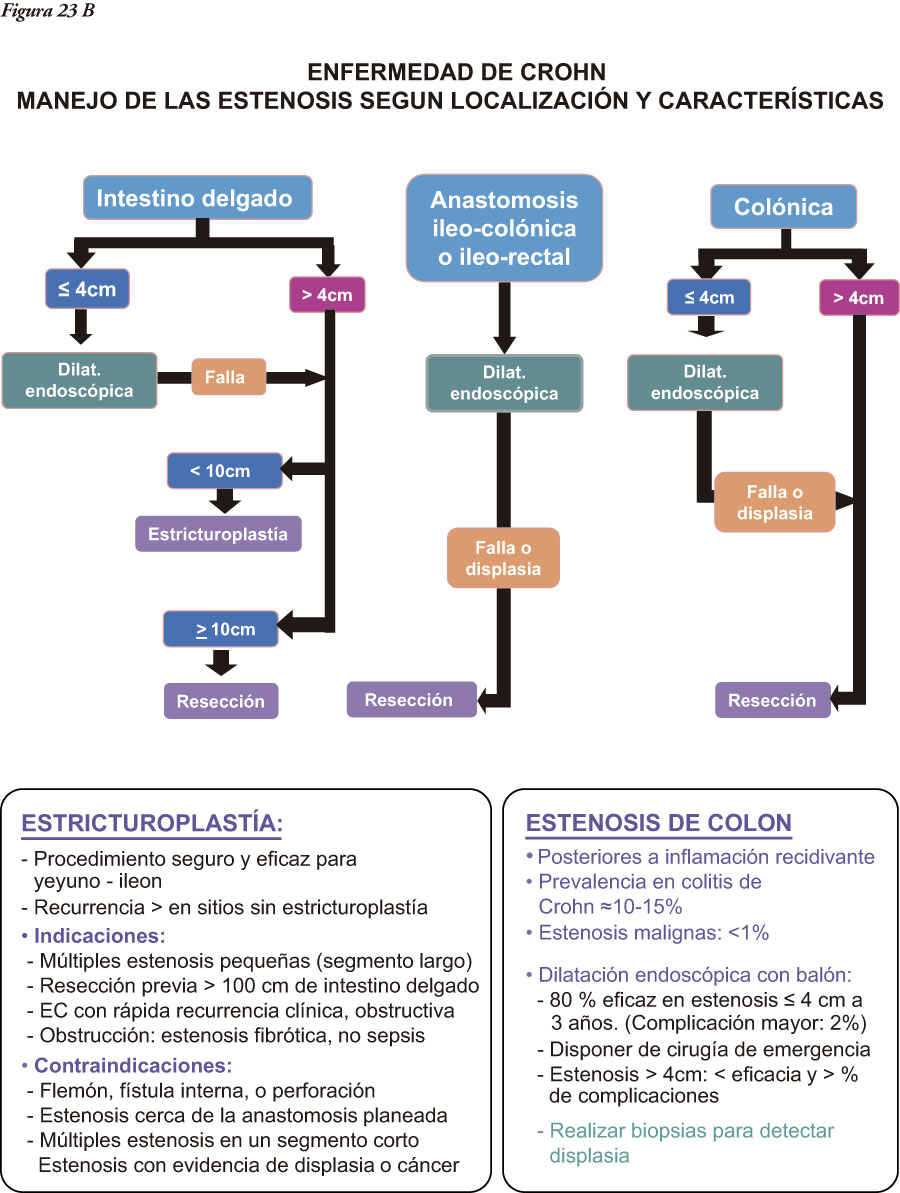
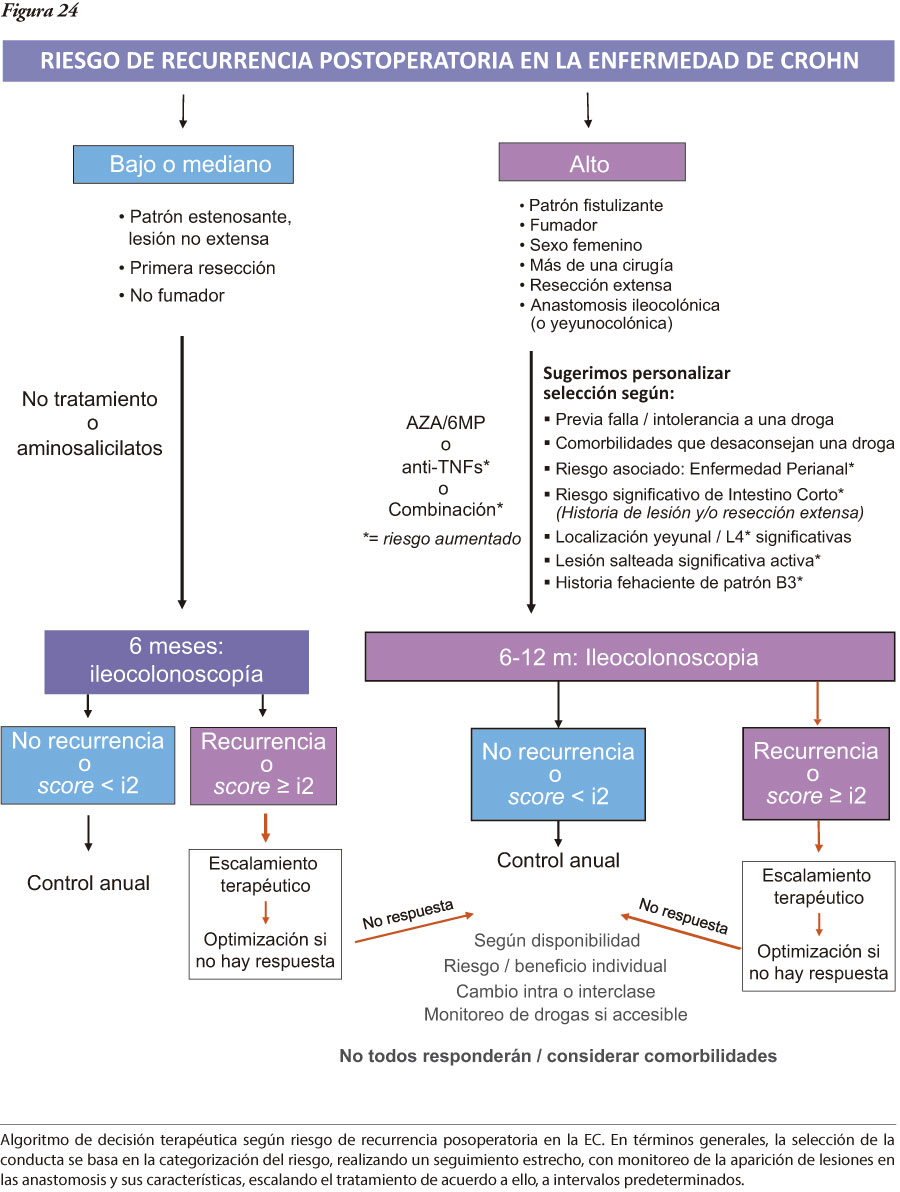
En la caracterización de los pacientes son de utilidad la serología y los nuevos marcadores de actividad. Se torna cada vez más relevante el requerimiento de criterios más tempranos de diagnóstico y tratamiento, con base un un mayor conocimiento de la heterogeneidad de las EII, de los factores predictivos y de la observación de los cambios evolutivos del comportamiento. Intentamos esquematizar, desde una visión global, las principales herramientas empleadas desde la sospecha diagnóstica hasta el tratamiento (Figura 1).
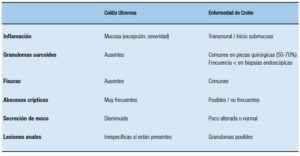
Cuando la enfermedad compromete el íleon u otra porción del intestino delgado es claro que el subtipo de EII es una EC, pero cuando el compromiso se limita al colon, es importante tener presentes diversos aspectos diferenciales clínicos, macroscópicos (observables por endoscopía, métodos radiológicos tradicionales baritados o TAC, RMI, o especímenes quirúrgicos) e histológicos entre ambas enfermedades (Tablas 4, 5 y 6).
Tabla 4. Diferencias clínicas entre la colitis ulcerosa y la enfermedad de Crohn del colon.
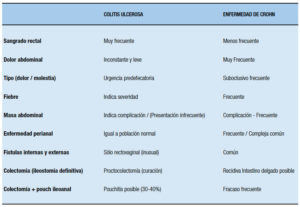
Tabla 5. Diferencias macroscópicas entre la colitis ulcerosa y la enfermedad de Crohn del colon.
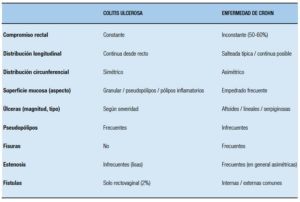
Tabla 6. Diferencias histológicas entre la colitis ulcerosa y la enfermedad de Crohn del colon.
a. Diagnóstico y clasificación de la colitis ulcerosa
La CU es una afección inflamatoria crónica de la mucosa del colon, el cual se presenta afectado en extensión variable (en forma continua y simétrica) involucrando al recto desde el margen anal, y que se caracteriza habitualmente por un curso recidivante/remitente y en menor proporción por actividad crónica continua.37
Los síntomas de la CU habitualmente (aunque no indefectiblemente) reflejan el grado de severidad de la enfermedad y consisten en diarrea habitualmente mezclada con sangre (más del 90% de los pacientes) y/o urgencia rectal. En general hay eliminación frecuente de pequeñas cantidades de moco, sangre y exudado (pseudodiarrea, con pujo y tenesmo), aunque puede presentarse con sangrado sin alteración del ritmo evacuatorio, y en raros casos con estreñimiento. Puede observarse defecación nocturna, que sugiere organicidad. La persistencia de los síntomas durante más de cuatro a seis semanas ayuda a diferenciar la CU de la mayoría de las diarreas infecciosas. Los síntomas sistémicos de malestar, anorexia o fiebre se observan menos frecuentemente que en la EC, y en general se presentan durante un ataque severo.12 En general, es más común la urgencia defecatoria que el dolor. Cuando hay dolor abdominal suele ser de tipo cólico, más frecuentemente en hipogastrio y flanco izquierdo, y se ve más frecuentemente en las rectosigmoiditis. Si el dolor abdominal se torna relevante, suele reflejar complicaciones (estenosis, perforación) o algunas veces una EC no diagnosticada, ya que esta enfermedad cursa más habitualmente con dolor de estas características.
⇨ Extensión (Clasificación de Montreal)
El parámetro usado convencionalmente para definir la extensión es el endoscópico (la máxima extensión alcanzada), como se señala en la publicación original de la clasificación de Montreal (Tabla 7).39 La extensión del compromiso colónico es un parámetro que afecta el pronóstico y, por lo tanto, el manejo del paciente, incluyendo la elección del tratamiento, e impacta en el momento en que debe iniciarse la vigilancia para displasia o cáncer colorrectal y en la frecuencia de los estudios, por ser las CU extensas las que presentan mayor índice de complicaciones y colectomía. Esto se evidencia en la publicación de la clasificación original de la clasificación de Montreal, en la que se muestran las tasas de colectomía a los 5 años de evolución del Hospital St Mark’s, (UK), la Clínica Cleveland (USA), Copenaghen (Dinamarca), pudiendo apreciarse que la enfermedad extensa estas tasas superan entre 3 a 5 veces a las proctitis y proctosigmoiditis, y ocurre lo mismo con el riesgo de cáncer objetivándose que también entre 25 y 30 años de evolución es 3 a 5 veces mayor que las proctitis y proctosigmoiditis en las poblaciones de la Mayo Clinic (USA), Clínica Cleveland (USA), Uppsla (Suecia) y Estocolmo (Suecia).37
Tabla 7. Clasificación de Montreal de la extensión de la CU (Silverberg y col., 2005).37

Los síntomas y signos de enfermedad severa son menos frecuentes en la proctitis y colitis izquierdas.38 Las proctitis tienen menor compromiso sistémico que las otras extensiones, pero debe considerarse que la extensión es un proceso dinámico y la enfermedad puede progresar proximalmente, lo cual es un indicador de severidad.37
⇨ Histología
En la Tabla 6 se listaron sucintamente los rasgos histológicos relevantes que hacen al diagnóstico diferencial de la CU con la EC. Describiendo más extensamente los hallazgos histológicos, la CU se caracteriza por los siguientes parámetros:40-42
• Distorsión difusa de la arquitectura críptica, presentado frecuentemente en criptas ramificadas.
• Infiltrado inflamatorio típicamente limitado a la mucosa (aunque en la colitis fulminante puede penetrar la muscular propia), también difuso y continuo, que aumenta en sentido proximal hacia distal comprometiendo el recto.
• Criptitis (neutrófilos dentro del epitelio de las criptas) y abscesos crípticos (neutrófilos dentro del lumen de las criptas), generados ambos por neutrófilos, que componen el infiltrado inflamatorio junto con los linfocitos y células plasmáticas. El número de eosinófilos es variable.
• Plasmocitosis basal (células plasmáticas detectadas predominantemente entre la base de las criptas y la muscular de la mucosa), la cual es el rasgo temprano con mayor valor predictivo para el diagnóstico de la CU versus otras opciones diagnósticas que no corresponden a EII, presente en el 38% de los pacientes dentro de las dos primeras semanas. Puede ocurrir que en una CU en una fase temprana, la arquitectura de las criptas esté conservada y no se observe infiltrado inflamatorio mucoso, detectándose estos rasgos de cronicidad más tardíamente.
• Depleción de mucina del epitelio, causada por la inflamación, rasgo que, aunque puede ayudar al diagnóstico, también se puede observar en la colitis infecciosa y en la EC.
• Erosiones del epitelio superficial: su presencia puede depender del grado de la actividad inflamatoria, y también pueden presentarse ulceraciones profundas.
• Metaplasia de células de Paneth: se observa asociada con la cronicidad (mayormente en el colon izquierdo).
• Otros cambios asociados con la cronicidad: pseudopólipos inflamatorios, hipertrofia de la muscular de la mucosa y submucosa, e infrecuentemente fibrosis.
• Ausencia de granulomas en biopsias de pacientes con CU, excepto aquellos granulomas de cuerpo extraño, y los ocasionados por rotura de criptas y extravasación de mucina.
• Por lo tanto, las características microscópicas más comunes en la CU son la distorsión y atrofia críptica (disminución de mucina), erosiones superficiales e infiltración del epitelio superficial (criptitis) con neutrófilos, mientras que granulomas epitelioides son diagnósticos de EC.
• No todas estas características microscópicas están presentes en la enfermedad en estadio temprano, lo que dificulta el diagnóstico ya que la colitis infecciona se caracteriza por la arquitectura críptica conservada y la inflamación. Las características morfológicas son variables según la duración de la enfermedad, la edad del paciente y el tratamiento.
• Hallazgos histológicos predictivos de subsiguiente recaída clínica en pacientes con CU quiescente: plasmocitosis basal, aumento de la celularidad a través de la mucosa, alto número de neutrófilos y eosinófilos, abscesos crípticos, depleción de mucina y daño del epitelio superficial en el área respectiva.39, 40 Como ya se ha mencionado, las principales características histológicas diferenciales con la EC se muestran en la Tabla 6. Debe tenerse en cuenta que el tratamiento puede inducir la restauración completa de la distorsión de la arquitectura con disminución de la intensidad de inflamación; el patrón de distribución clásica de la inflamación puede cambiar de difuso o continuo a parcheado o discontinuo por efecto del tratamiento.
• Una esquematización muy útil para el manejo diario requerido para el diagnóstico en la práctica clínica de los rasgos histológicos de la CU fue realizada por Karen Geboes en un capítulo de histopatología de la EC y CU del libro Inflammatory Bowel Disease publicado en Londres (Tabla 8).40
Tabla 8. Resumen de los principales criterios histológicos que contribuyen al diagnóstico de CU.40

Scores histológicos: fueron diseñados con la intención de evaluar el pronóstico a largo plazo, predecir las tasas de remisión, el requerimiento futuro de cirugía y el riesgo de malignidad.
Los índices más usados tradicionalmente fueron los diseñados por el patólogo inglés S.A. Riley y por la patóloga belga K. Geboes, de los cuales se realizó al menos una modificación posterior para mejorar su utilidad.41-42 Como primer antecedente, en 1988 Riley publicó un score (rango 0-4, donde 0 era normal) que solo consideraba el infiltrado inflamatorio (leve-moderado-marcado representando scores 1-3, todos ellos sin destrucción tisular), cuando la destrucción tisular se asociaba al infiltrado marcado se adjudicaba el máximo score, igual a 4.
Pero el score ampliamente difundido del mismo autor fue el publicado en 1991, en el que consideró 6 ítems independientes (neutrófilos en la lámina propia, abscesos crípticos, depleción de mucina, integridad del epitelio, células redondas en la lámina propia, distorsión de criptas) categorizando a cada uno en leve, moderado o severo (Tabla 9).
Tabla 9. Score de Riley (rediseñado en 1991).41

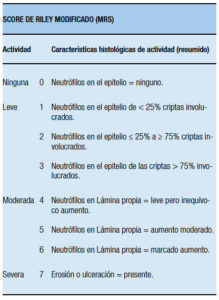
Este último fue usado en varios ensayos clínicos randomizados para predecir la recaída (pese a no determinarse el acuerdo interobservador). Luego de ello BG Feagan, en el año 2005, introdujo una modificación (Modified Riley Score: MRS), excluyendo ítems que consideró probablemente no relevantes en la inflamación, y las anomalías estructurales (por ej., irregularidades de la arquitectura de las criptas) (Tabla 10).43
Tabla 10. Score de Riley Modificado por Feagan y col. (2005) (Modified Riley Scoring System: MRS).43
El otro score muy reconocido es el de Geboes que mostró buena reproducibilidad, una correlación modesta con la actividad endoscópica, y categoriza los hallazgos histológicos en 7 grados con subitems.42
Si bien se diseñó en el año 2000, su inclusión en una publicación sobre cicatrización mucosa sugiere la intención, aún como perspectiva futura, de constituir eventuales nuevas herramientas para utilizar en el tratamiento hacia un blanco (también llamado hacia un objetivo y conocido en la literatura inglesa como treat-to-target) con la idea de cambiar la evolución natural de la enfermedad (Tabla 11).42
Cabe señalar que en la concepción de focalizar en la actividad, elaboró una simplificación recientemente publicada del score de Geobes, que correlaciona con el score endoscópico de Mayo y el previo score original de Geboes, de interés porque solo se incluyen variables ligadas con la actividad de la inflamación, las que se distribuyen en 3 subcategorías (0-3) (Tabla 12).
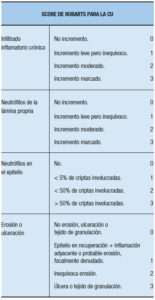
Más recientemente, intentando lograr una mayor reproducibilidad y una detección específica de la actividad de la enfermedad, se diseñaron dos nuevos scores. Uno es el score de Robarts (basado en infiltrado inflamatorio crónico, neutrófilos de la lámina propia, neutrófilos en el epitelio y erosión o ulceración (Tabla 13).44
Tabla 13. Score de Robarts para la CU (Mosli MH, Feagan BG, 2015).44
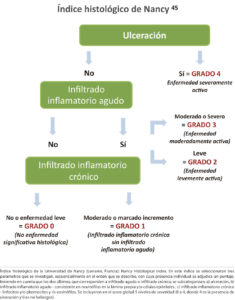
El otro score de los dos creados con los objetivos mencionados, es el índice de Nancy, en el que se seleccionaron tres parámetros que se buscan secuencialmente en el orden que se describe, con cuya presencia individual se adjudica un puntaje teniendo en cuenta que los dos últimos, que corresponden a infiltrado agudo o infiltrado crónico se subcategorizan: a) ulceración, b) infiltrado inflamatorio agudo – consistente en neutrófilos en la lámina propia y/o células epiteliales, c) infiltrado inflamatorio crónico – linfocitos y/o plasmocitos y /o eosinófilos. Se incluyeron en el score global 5 niveles o grados de severidad (0 a 4, en el que 4 es la presencia de ulceración representando enfermedad severamente activa y 0 es no hallazgos). El infiltrado inflamatorio solamente crónico incluye niveles de severidad grado 0 y grado 1. Respecto al infiltrado, el que refleja actividad es solamente el infiltrado inflamatorio agudo, incluyendo niveles de severidad grado 2 (enfermedad levemente activa) y grado 3 (enfermedad moderadamente activa). (Para su mejor comprensión, las anormalidades a evaluar, subscores y su interpretación en términos de actividad de la enfermedad se muestran en un esquema tal como fue utilizado en la publicación de desarrollo y validación del mismo) (Figura 2).45
Una revisión sistemática Cochrane reciente reporta que los dos últimos scores mencionados (Robarts y Nancy) son los que lograron mayor nivel de validación (confiabilidad, validez del contenido, testeo de hipótesis y validez de criterio).46
⇨ Relevancia de la edad de debut
Algunas evidencias sugieren que la evolución de los pacientes con CU varía en base a una estratificación por grupo etario (< 16; 16-40 y > 40 años). Usando esta categorización algunos autores postularon que los pacientes diagnosticados antes de los 16 años de edad presentan un curso inicial más agresivo, mientras que el diagnóstico a una edad mayor se asocia con un menor riesgo de colectomía.47 Un estudio del grupo Inflammatory Bowel South-Eastern Norway (IBSEN), en concordancia con previos estudios de los mismos autores, reportó que el debut antes de los 40 años es un factor independiente de riesgo, asociado con colectomía dentro de los primeros 10 años del diagnóstico, lo que fue combinado con otros factores independientes de riesgo (la extensión, la necesidad de esteroides sistémicos y la elevación de la VSG o la PCR en una matriz de predicción de colectomia.48
⇨ Evaluación de la actividad clínico-endoscópica
En la CU, la actividad clínica de la enfermedad se categoriza en remisión, leve, moderada y severa.12 Es muy importante distinguir a los pacientes con exacerbación grave (que requieren hospitalización), de los ambulatorios. La categorización endoscópica puede consistir en un subcore de un índice compuesto o evaluarse separadamente.
◊ Índices y criterios clínicos de actividad
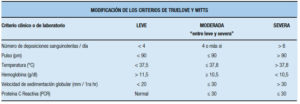
Criterios de Truelove y Witts: constituyen un herramienta de gran utilidad, ampliamente usada en la práctica clínica para reconocer una CU severa.49 Se deben descartar los diagnósticos diferenciales de otras afecciones (tal como CMV y otras etiologías diversas de diarrea y sangrado) con sigmoideoscopía y biopsia.12-49 Según esta clasificación, seis o más deposiciones, con sangrado rectal, fiebre (presentando temperatura media nocturna >37,5°C o ≥37,8°C al menos 2 días de cuatro), frecuencia cardíaca >90 latidos por minuto, anemia (hemoglobina (≤75%, homologable a <10,5 g/dl), o velocidad de sedimentación globular (VSG)>30 mm/h indican colitis severa. (Tabla 14). La definición de ataque severo del American College of Gastroenterology (ACG)51 requiere la presencia de heces sanguinolentas ≥ 6/día y evidencia de toxicidad (fiebre, taquicardia, anemia o VSG elevada). Esta categorización clínica tradicional es fácil de aplicar en pacientes ambulatorios. La presencia de criterios de severidad requiere hospitalización para tratamiento intensivo por vía parenteral y es el inicio de toma de decisiones terapéuticas relevantes para el paciente (solamente el 70% responde a este tratamiento intensivo tradicional). Varias sociedades médicas, como la Association of Coloproctology of Great Britain and Ireland (ACPGBI, por sus siglas en inglés)50 la European Crohn´s and Colitis Organization (ECCO)12 además del ya mencionada ACG51, recomiendan los criterios de Truelove and Witts. Estos han sido modificados, agregando el valor de la PCR (o VSG) y categorizando las variables por severidad como lo ha publicado la ECCO en su consenso (Tabla 15).12 Se han usado también otros criterios para definir actividad severa de la enfermedad o predecir la respuesta al tratamiento. En la mayoría de los estudios se encontró que la albúmina es un marcador de severidad, siendo utilizada en 1986 por Chapman, Selby y Jewell en una publicación que compara corticoides intravenosos con y sin metronidazol como criterio de severidad (Criterios Revisados de Oxford defiendo actividad severa como: la presencia de al menos seis deposiciones sanguinolentas diarias y uno o más signos de gravedad de los criterios de Truelove y Witts o albúmina sérica baja [< 3,5 g/dl]).
Tabla 14. Actividad de la enfermedad en colitis ulcerosa, criterios originales de Truelove y Witts (1955).49

Tabla 15. Actividad de la enfermedad en colitis ulcerosa, modificación de los criterios de Truelove y Witts (adaptado de Dignass y col.).12
También se diseñó como modificación un índice semicuantitativo que se ha usado mayormente en publicaciones españolas, que categoriza las variables por severidad y agrega los valores de albúmina, recuento de leucocitos y niveles de potasio sérico (Tabla 16).52 La clasificación de Montreal, además de la extensión previamente mencionada, categoriza la actividad basándose en los criterios mencionados de Truelove y Witts, scoreándolos como “S” (severidad) de 0 a 3 (Tabla 17). La colitis fulminante según el ACG requiere ≥10 deposiciones con sangre, sangrado continuo, toxicidad, sensibilidad abdominal, distensión, requerimiento de transfusión de sangre, dilatación colónica en la Rx directa de abdomen).51
Tabla 16. Índice semicuantitativo diseñado a partir de los criterios de Truelove y Witts.52
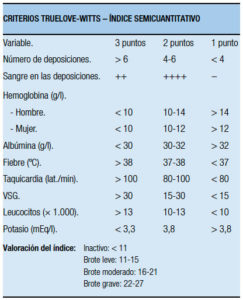
Tabla 17. Clasificación de Montreal de severidad de la colitis ulcerosa.37
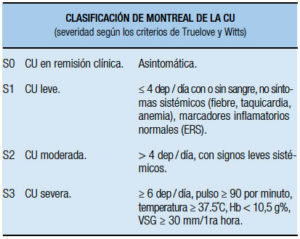
Índice de Mayo de actividad: llamando así por haber sido diseñado en Clínica Mayo (USA), es uno de los índices de actividad que se usan con más frecuencia en estudios clínicos para la CU. Aunque la definición de curación mucosa es controvertida, este índice constituye una herramienta adecuada debido a la facilidad de su implementación. El índice de Mayo (Mayo score total) está compuesto de cuatro ítems (sangrado, frecuencia de las deposiciones, evaluación global del médico y aspecto endoscópico scoreados) categorizados de 0 a 3, que se suman para obtener un puntaje total que varía entre 0 y 12 (Tabla 18).53 Algunos estudios usan los componentes no endoscópicos, definiendo índices como índice parcial. Ellos consisten en el Mayo score parcial de 9 puntos (sin endoscopía) o bien de 6 puntos (considerando solo la frecuencia de las deposiciones y el sangrado, de 3 puntos cada uno). Los índices parciales son de especial valor en los estudios clínicos para evaluar la actividad en las visitas realizadas en tiempos intermedios entre la cuantificación de los scores totales, resultando también de utilidad para detectar el tiempo de inicio de la respuesta. En un estudio de Lewis y col., evaluaron en qué magnitud el cambio del Mayo score parcial refleja un cambio significativo en la percepción del paciente. Para ello se usó un cuestionario, en el cual como “gold standard”, el paciente ranqueaba su percepción de la actividad de la enfermedad en una escala de 1 a 6 puntos, donde la definición de respuesta requería el descenso de al menos 2 de los 6 puntos). La remisión se definió por las dos primeras categorías en la escala (“perfecto” y “muy bueno”), correspondiendo a “severo” el mayor puntaje. Además el estudio tuvo en cuenta la percepción por el paciente de un cambio en la actividad ranqueado de 1 a 7 puntos (desde “mucho mejor” a “mucho peor” correspondiendo “no cambios” a un score de 4). Se compararon los componentes del score de Mayo con la percepción de actividad y de mejoría por el paciente. Se determinó la concordancia (kappa estadistica) entre los ranqueos del paciente y el score parcial de Mayo. Se calcularon los cut-off óptimos (puntos de corte) de los diferentes índices indicando la máxima sensibilidad y especificidad para detectar una respuesta definida por el reporte de percepción del paciente mediante Receiving Operating Characteristics (ROC) Curva. El máximo producto de sensibilidad y especificidad para identificar la respuesta clínica percibida por el paciente se alcanzó con una reducción en el Mayo Score Total ≥ 3 puntos; usando el score de Mayo parcial de 9 puntos, la respuesta se identificótanto con un descenso ≥ 2 como ≥ 3 puntos y con el Mayo score parcial de 6 puntos, con una reducción del score ≥ 2 puntos. Para la identificación de remisión (con percepción: perfecto o muy bien) el óptimo cut-off de sensibilidad y especificidad fue 2,5 para el score de Mayo parcial de 9 puntos (sensibilidad de 71%, especificidad de 84%), y para el score de Mayo parcial de 6 puntos el óptimo cut-off fue 1,5 (sensibilidad 65% especificidad 81%). Los cambios del score de Mayo parcial y total correlacionaron estadísticamente (Coeficiente de Spearman) con los cambios de la percepción del paciente, y con el índice más reconocido de calidad de vida de la Enfermedad Inflamatoria Intestinal, Inflammatory Bowel Disease Questionnary (IBDQ).
Tabla 18. Índice de la Clínica Mayo (Schoeder y col., 1987).53
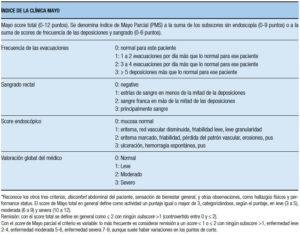
La óptima definición de remisión ha sido controvertida (entre scores 0 a 2). Cuando se usan scores parciales, el criterio de actividad se define según los autores con un puntaje similar al usado a tal fin en el Mayo total (puntaje ≥ 3) o ≥ 2. Por lo tanto, las definiciones de los criterios de actividad, remisión, y respuesta presentan diferencias relacionadas con las poblaciones de pacientes (algunas provenientes de trials, otras de la práctica clínica y estudios de vida real), los tratamientos utilizados, los índices elegidos o criterios seleccionados seleccionados que pueden depender de los objetivos en los distintos estudios, aspectos que se tratarán al describir como categorizar a los pacientes en sub-grupos.54
– Otros índices clínicos
Los criterios de Truelove y Witts y el Índice de Mayo han sido tradicionalmente los más usados en la práctica clínica, pero se desarrollaron numerosos índices de actividad, y se estudiaron factores predictivos, la mayoría no validados. Describiremos el índice de Seo llamado también Activity Index (AI),55 el de Lichtiger,56 el de HO,57 el CAI (Clinical Activity Index) de Rachmilewitz,58 el Índice de Powell-Tuck,59 y fórmulas para calcular factores pronósticos, algunas incluidas en los índices mencionados, y otras adicionales.60, 61
Índice de Seo: para su diseño se analizaron 18 variables clínicas, endoscópicas y de laboratorio por regresión logística, calculando el score con cinco variables clínicas (Tabla 19).55
Se reportó un valor predictivo de este índice, y se publicó un estudio en el cual con tratamiento corticoide IV la mejoría se asoció con disminución de 30 puntos, y la remisión con un score < 180 a 2 semanas de corticoides IV. Adicionalmente, requirieron colectomía el 65% de las CU con scores > 180, y todos los pacientes con puntajes > 200.55
Tabla 19. Índice de actividad (AI) de Seo.55

Índice de Lichtiger: fue diseñado inicialmente para evaluar la respuesta al tratamiento con ciclosporina en el brote grave de CU refractario a corticoides, y desempeñó, por lo tanto, un papel importante en la historia del tratamiento de la CU.56 El score tiene un rango de 0 a 21 puntos. La respuesta clínica fue definida con un valor < 10 en 2 días consecutivos y la remisión con un score de ≤ 3. No está validado (Tabla 20).
Tabla 20. Índice de Lichtiger de la CU (Lichtiger y col., 1994).56

Índice de Ho: diseñado en base a 167 pacientes consecutivos con CU severa, empleando regresión logística múltiple para analizar los parámetros de probabilidad de fracaso del tratamiento médico dentro de los primeros 3 días del mismo, y los predictores independientes (Tabla 21).57 El estudio reportó que el 40% de los pacientes no respondieron, por lo que requirieron colectomía dentro del período de admisión, más un 5% adicional dentro de los 60 dias.57 Las tasas de fracaso de la terapia médica de los pacientes con scores adjudicados a los riesgos leve (0-1), moderado (2-3) y alto (≥ 4) fueron 11% 43% y 85% respectivamente. Un análisis ROC demostró un área bajo la curva de 0,88 con una sensibilidad del 85% y una especificidad del 75% para un score ≥ 4 en la predicción de la falta de respuesta. El análisis de regresión logística múltiple identificó como predictores independientes del resultado la frecuencia media de las deposiciones, la dilatación del colon en los primeros 3 días y la hipoalbuminemia (p < 0,001, 0,001 y 0,002 respectivamente). Todos los pacientes con scores ≥ 6 fallaron en este estudio. Se considera que este índice permitiría una identificación precoz de los pacientes con CU severa que requerirá tratamiento médico de segunda línea o cirugía.57 Usando este índice, Aceituno y col. reportaron con scores < 6 al día 5° de esteroides IV un 95% de éxito y un 58% con scores > 6.62
Tabla 21. Índice de Ho de la CU.57

Índice de Rachmilewitz (Índice de Actividad Clínica: Clínical activity index – CAI): cuantifica 7 variables clínicas enumeradas en la tabla, adjudicando un score a cada una, el puntaje total varía desde 0 a 29 puntos. Actividad: score > 4. Un score ≤ 4 puntos fue definido como remisión, pero deja una zona gris que permite un nivel de síntomas (deposiciones número 36-60/semana) (Tabla 22).58
Tabla 22. Índice de Actividad Clínica (CAI) de Rachmilewitz de la CU.58
Índice de Powell-Tuck: incluye una combinación de variables de síntomas y signos intestinales, extracolónicos y sistémicos, de bienestar general y adicionalmente un score endoscópico basado mayormente en el de Baron, que luego describiremos (Tabla 23).59
Los puntos de corte de los scores son: remisión: 3; actividad leve: 3–10; actividad moderada: 11–14; actividad severa > 14.
Tabla 23. Índice de Powell-Tuck (Powell-Tuck y Col., 1978).59

Índice de Walmsley (Simple Activity Index): como su nombre lo indica es un índice simplificado que combina parámetros de otros índices.63 Se comparó con el de Powelll y Tuck que se detalla a continuación (diseñado para trials de corticoides) y con el de Ho, presentando muy buena correlación (Tabla 24).
Un score < 2 puntos se considera remisión y una disminución de ≥ 2 puntos (o controvertido ≥ 3) sobre el score basal se considera respuesta (Walmsley y col., 1998).63
Tabla 24. Índice de Walmsley.63

Estimación de riesgos: diversos autores, algunos ya mencionados, elaboraron fórmulas con combinaciones de parámetros clínicos y de laboratorio60 (como Ho, Seo, Rachmilewitz, y las modificaciones de los criterios de Truelove y Witts que scorearon los grados de severidad). Entre los no mencionados se destacan:
– Travis y col., en 1996: reportaron que 85% de los pacientes con una frecuencia de deposiciones de > 8/día o 3-8/día con PCR de 45 mg/dl después de 3 días de tratamiento médico intensivo requirieron colectomía.60
– Lindgren y col., en 1998: desarrollaron la siguiente fórmula de regresión para predecir la probabilidad de fracaso médico: número de evacuaciones + 0,14 × PCR (mg/L) siendo > 8,0 el óptimo cut-off teórico para predecir la falla de la terapia médica.61 Este autor observó que la elevación sostenida de la temperatura, la diarrea con sangre persistente y la PCR elevada al tercer día de corticoides intravenosos son importantes predictores de resistencia en ataques agudos de CU. Además reportó que una PCR ≥ 25 y más de 4 deposiciones diarias al tercer día de hospitalización se asociaron con alto riesgo de colectomía dentro de los 30 días.
◊ Cuantificación de la actividad endoscópica
Subscore endoscópico del score total de Mayo: es el criterio más usado para la cuantificación de actividad endoscópica; ha sido previamente listado dentro del mencionado Score de Mayo (Tabla 18).
Score de Baron: es un score endoscópico diseñado tempranamente en la historia de los índices de actividad. Un cuestionamiento frecuente respecto de eficacia es que no describe úlceras (Baron y col., 1964) (Tabla 25).
Tabla 25. Score endoscópico de Baron.64

Índice de Sutherland: se tomó el subscore endoscópico del índice de Sutherland (0-3 puntos) que tiene 12 puntos con 4 componentes (UCDAI); a efectos prácticos globalmente es similar al de Mayo (Tabla 25).64
Tabla 26. Índice de Sutherland.64

Otros índices endoscópicos más recientemente elaborados para la CU:
Se propusieron nuevos y promisorios índices endoscópicos para la CU
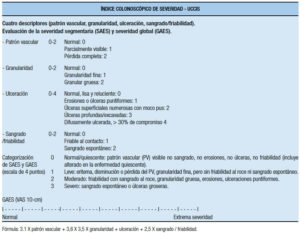
– El índice de severidad endoscópica de CU (UCEIS, por sus siglas en inglés) demostró ser un instrumento confiable para la medición de la actividad endoscópica en la CU (Tabla 27).
Tabla 27. Índice endoscópico de severidad de colitis ulcerosa.65, 66
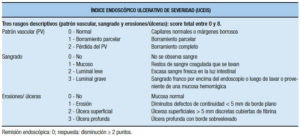
Este índice en su modelo final comprende tres rasgos descriptivos cada uno con niveles de severidad que en total suman 11 (patrón vascular: 3 niveles, sangrado: 4 niveles y erosiones / úlceras: 4 niveles). Como se puede apreciar en la tabla, el score total del ínidice, considerando un rango que comprende desde el mínimo al máximo score individual de cada descriptor, puede variar entre 0 y 8, ya que el primer nivel de los tres descriptores es 0.65, 66 Este índice se desarrolló en 2012 a partir de una biblioteca de videos, y su elaboración se llevó a cabo en 2 fases. En una primera fase se evaluó entre especialistas en EII la variabilidad en la interpretación endoscópica y se establecieron definiciones de los componentes endoscópicos a utilizar en el índice. Se usaron 670 videos (de pacientes con CU con Mayo scores 0-11), 10 videos de 5 pacientes sin CU y de 5 hospitalizados con CU aguda severa. Para definir descripciones confiables fueron elegidos 16 videos que presentaban el rango completo de severidad, entre 24 preseleccionados. Los videos seleccionados fueron evaluados por 10 investigadores que determinaron el acuerdo con el score de Baron (se compararon con la lectura central de los trials de donde procedían los videos) y se acordaron definiciones precisas de los descriptores endoscópicos. En una segunda fase, 30 nuevos investigadores scorearon los descriptores según la severidad usando una escala visual análoga (VAS) de 0-100. Se agregaron nuevos videos y se analizaron combinaciones de descriptores. Se evaluaron estadísticamente tanto la variabilidad intraobservador como la interobservador por cada descriptor. En síntesis, se determinó que los tres descriptores, cada uno de los cuales incluye tres o cuatro niveles con definiciones precisas, configuran un total de 11 niveles, que predicen la evaluación global de la severidad (en un rango de 0 a 8), y se calculó estadísticamente que con la categorización que surgió de estos procedimientos, el índice captura el 90% de la varianza del espectro completo de la severidad endoscópica. La friabilidad que puede ser descripta como “friabilidad al contacto” (en general reconocida por la presión con la pinza cerrada), o como la más reproducible “friabilidad incidental” (en general definida como sangrado al retiro del endoscopio), se evaluó como posible integrante del índice por considerarse reflejo de fragilidad mucosa por la inflamación que precede a la ulceración, pero finalmente fue excluída sin pérdida de la predictibilidad; se demostró que es muy variable, pobremente entendida y necesita una explicación adicional del procedimiento para su documentación. En teoría podría haber 48 combinaciones posibles entre las subcategorías (4x4x3) de los tres descriptores, aunque algunas de ellas no se ven en la práctica clínica. Hay definiciones aún no consensuadas, pero esta publicación ejemplifica combinaciones de niveles, describiendo que la remisión sólo puede ser definida como un nivel 1 (score 0) de los tres descriptores (incluyendo arborización vascular con capilares normales claramente definidos, o reconocibles visualizándose con pérdida parcelar de sus márgenes o borrosos, no sangrado, no erosiones o úlceras) y la definición la enfermedad de enfermedad severa implica la combinación de un niveles de al menos 3 para patrón vascular y sangrado, y al menos nivel 2 para erosiones y úlceras.65 Posteriormente se realizó una validación del índice a partir de una nueva biblioteca de videos de sigmoidesocopia flexible estratificados por severidad. Intervinieron en este análisis 25 investigadores (con videos duplicados) que determinaron la variabilidad interobservador e intraobservador, tanto en forma ciega, como no ciega. Los tres descriptores mencionados del UCEIS (patrón vascular, sangrado, erosiones/úlceras) fueron scoreados mediante VAS de 0-100, analizando el acuerdo intra e interinvestigador por análisis de concordancia (coeficiente κappa), mostrando un buen radio de confiabilidad que no cambió con el conocimiento de los detalles clínicos, además de buena consistencia interna y un alto nivel de correlación entre UCEIS y evaluación de severidad. El UCEIS capturó el 86% de la variabilidad en la evaluación total de la severidad endoscópica realizada mediante VAS de 0-100 por los investigadores.66 Un consenso internacional ha definido que usando este índice, la remisión endoscópica se define como un UCEIS de 0, y la respuesta como una disminución del UCEIS ≥ 2 puntos.67 Un estudio de CU severa sugirió una fuerte probabilidad de requerir terapia de rescate con ciclosporina o infliximab en el 79% de los casos para scores ≥ 7 y una asociación con colectomía (≥ 5,33% vs. 9% con UCEIS ≤ 4; p = 0,037). Este score evalúa la mucosa más afectada al sigmoideoscopio flexible.68
– Índice colonoscópico de severidad (UC Colonoscopic Index of Severity: UCCIS, por sus siglas en inglés): demostró una alta correlación con los índices clínicos y parámetros de laboratorio de actividad de la enfermedad.69 Este índice fue desarrollado a partir de una biblioteca de videos de colonoscopía (con 5 segmentos scoreados) utilizando diferentes combinaciones de descriptores para predecir la evaluación global de la severidad endoscópica (GAES por sus siglas en inglés) o la evaluación segmentaria de la severidad endoscópica (SAES). Se usó la escala visual análoga (VAS) con escala de 4 puntos y una escala de 10 cm. Se evaluaron 4 lesiones colonoscópicas (patrón vascular, granularidad, ulceración, sangrado/friabilidad) y las mencionadas GAES y SAES (Tabla 28).69
El acuerdo interobservador fue bueno a excelente para las 4 lesiones evaluadas por endoscopia y el GAES.
Tabla 28. Índice colonoscópico de severidad de colitis ulcerosa.69
– El valor de las úlceras profundas, como marcador de colitis endoscópica severa: las ulceraciones profundas, despegamiento mucoso en el borde de las ulceraciones, ulceraciones en forma de pozo y abrasión mucosa extensa se consideran criterios relevantes de enfermedad severa. Carbonnel describió la evolución de 85 pacientes con ataques de CU severa en relación con los hallazgos endoscópicos descriptos.70 En el estudio citado, ente 46 pacientes con colitis endoscópica severa 43 requirieron cirugía (38 refractarios a corticoides IV, de los cuales cinco tenían un megacolon tóxico).
Se observaron ulceraciones extensas hasta al menos la capa muscular en 42/43 piezas de colectomía. Por el contrario, 30/39 con colitis endoscópica moderada respondieron al tratamiento.
Solo nueve pacientes necesitaron cirugía adicional posterior, pero seis de esos nueve pacientes fueron sometidos a otra colonoscopía antes de la colectomía, y todos mostraron colitis endoscópica severa.
– Cuantificación de la actividad endoscópica incluyendo la extensión
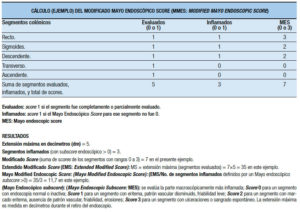
Los scores actuales para la CU no tienen en cuenta la extensión y la distribución de la inflamación de la mucosa. Para ello se desarrolló el Modificado Mayo Endoscópico Score (MMES: The Modified Mayo Endoscopic Score) que divide el colon en cinco segmentos, cada uno de ellos scoreados (0-3) y sumados, para obtener el Modificado Score (MS) en una escala de 15 puntos. Los pasos para el cálculo se ejemplifican (Tabla 29).
Luego se obtiene el Extendido Modificado Score (EMS: Extended Modified Score) multiplicando el MS por la extensión máxima evaluada en decímetros (evaluados). Finalmente, se obtiene el score buscado Modificado Mayo Endoscópico Score dividiendo el Extendido Mayo Score por el número de segmentos con inflamación activa (inflamados).
La presencia de un parche cecal y pseudopólipos se consideran en los cálculos (no representativos de inflamación activa). Este score correlaciona con la clínica, biológica, y la actividad histológica, pero aún no se ha validado.71
Tabla 29. Cálculo del score endoscópico modificado de Mayo.71
b. Diagnóstico y clasificación de la enfermedad de Crohn
La EC es una enfermedad inflamatoria transmural, recidivante, que puede afectar uno o más segmentos del tracto gastrointestinal, desde la boca al ano, siendo el compromiso ileocecal el que se reportó como más frecuente mundialmente. El recto está involucrado en aproximadamente la mitad de los casos. Las presentaciones más típicas incluyen el compromiso discontinuo de varias partes del aparato gastrointestinal (en general intestino delgado colon) y el desarrollo progresivo de complicaciones que incluyen una modalidad estenosante y una modalidad perforante que presenta fístulas y abscesos.38
Sin embargo, en nuestra región, donde es muy común la localización aislada del colon, frecuentemente se observa una lesión continua con patrón asimétrico y alta prevalencia de compromiso perianal. Los granulomas sarcoides no caseosos no asociados con injuria críptica constituyen una característica diagnóstica importante en términos de especificidad en el diagnóstico diferencial con la CU, pero en el análisis de las piezas quirúrgicas el hallazgo más frecuente es la inflamación transmural, observándose mayor grado de engrosamiento submucoso (por fibrosis, obliteración fibromuscular e inflamación), siendo también importante la presencia de fisuras que se pueden presentar en áreas que presentan un engrosamiento de la pared intestinal, y adicionalmente se suele observar hiperplasia de los plexos nerviosos y ganglionitis. Otros rasgos, como la irregularidad en la arquitectura críptica, la presencia de células de Paneth y las úlceras, pueden estar en las dos enfermedades. La EC es una entidad heterogénea que involucra diferentes fenotipos en términos de edad de inicio, localización de la enfermedad y comportamiento de la misma.37
Síntomas: el más frecuente de la EC es la diarrea, definida como una disminución en la consistencia fecal durante más de 6 semanas, de características variables, generalmente influenciadas por la localización, la actividad y los antecedentes quirúrgicos de la enfermedad. Otros síntomas incluyen dolor abdominal (que puede ser un marcador clínico de obstrucción intestinal), pérdida de peso, fiebre, como también la presencia de sangre o moco o ambos en las deposiciones, especialmente en la EC del colon.26, 38 Sin embargo, debe considerarse que los síntomas (como dolor-diarrea) pueden deberse a causas diferentes de la enfermedad activa. Estas incluyen secuelas de una cirugía realizada previamente por una lesión activa o sus complicaciones, hiperproliferación bacteriana, malabsorción de sales biliares o ácidos grasos, estenosis, adherencias, litiasis vesicular, efectos colaterales de tratamientos y también debe considerarse la posibilidad de que el paciente presente síntomas por las mismas entidades que se observan en la población sin EII, como discinesia (SII – síndrome de intestino irritable) o por cursar una infección intestinal agregada. Para seleccionar el tratamiento, se deben descartar los diagnósticos diferenciales y evaluar las enfermedades concomitantes.
⇨ Histología 39, 40
Las características microscópicas generalmente consideradas para el diagnóstico de EC del colon (en biopsias endoscópicas) son la inflamación crónica focal (discontinua), la distorsión críptica focal (discontinua) y granulomas (no relacionadas con la lesión de las criptas). Para el análisis de biopsias endoscópicas del íleon se pueden considerar de valor para el diagnóstico los mencionados aspectos y, además una arquitectura irregular de las vellosidades.
Descriptos más detalladamente, los rasgos histológicos que acercan al diagnóstico de EC reúnen las siguientes características:
• Incremento variable en la celularidad de la lámina propia (células redondas: linfocitos y células plasmáticas) en las muestras de biopsias.
• La celularidad de la lámina propia no está limitada a la mucosa, pudiendo observarse extensión de la inflamación en la submucosa en una biopsia, con o sin infiltración granulocítica, confinado a uno o más focos, lo cual determina diferencias entre múltiples muestras de biopsia.
• Irregularidad críptica (distorsión: criptas no paralelas, de diámetro variable o dilatadas, ramificación y acortamiento) con o sin inflamación del área.
• Características de los granulomas en EC: son definidos como una colección de histiocitos epitelioides (monocitos/macrófagos), con contornos a menudo vagamente definidos. Las células gigantes multinucleadas pueden presentarse en esta enfermedad, como así también en otras patologías, la necrosis no es característica de esta enfermedad, sino que habitualmente es una alerta para pensar en otros diagnósticos. Solo tienen valor los granulomas en la lámina propia no relacionados con la lesión de las criptas para ser considerados como demostrativos de EC (granulomas no caseificantes). Los granulomas de las criptas son de menor confiabilidad para el diagnóstico.
• Otras entidades pueden presentar rasgos parecidos, observándose pequeños acúmulos de histiocitos, células epitelioides y células gigantes, o células gigantes aisladas, hallazgos que no deben ser considerados como patognomónicos de EC. Ello se debe a que los granulomas pueden presentarse en: Mycobacterium spp., Chlamydia spp., Yersinia pseudotuberculosis y Treponema spp.: los microgranulomas: se presentan también en Salmonella spp., Campylobacter y Yersinia enterocolitica spp.; las células gigantes pueden verse en la Chlamydia spp.).
• Asimismo, es de extrema importancia considerar que en los pacientes con sospecha de EC se debe excluir esta enfermedad sistemáticamente, espacialmente cuando proceden de zonas con una alta prevalencia de tuberculosis. En este diagnóstico puede aparecen granulomas con necrosis caseosa (o sin ella), y la misma no necesariamente es observada en la pared intestinal, ya que sus hallazgos pueden limitarse a los ganglios. El mencionado puede ser ya sea un diagnóstico diferencial primario o evolutivo, consecuencia del tratamiento inmunosupresor y/o anti-TNF. Lo mismo ocurre con diversas infecciones micóticas, que pueden ser diferenciales primarias o presentarse como infecciones oportunistas en inmunosuprimidos.39, 40
• Hiperplasia linfoide transmural en piezas de resección intestinal: los agregados linfoides transmurales, sobre todo lejos de las áreas de ulceración y granulomas no relacionados con las lesiones de las criptas, son características discriminantes típicas para un diagnóstico de la EC, diferente de otras condiciones, en particular de la CU.
• Metaplasia de glándulas pilóricas: característica indicativa de la inflamación crónica de la mucosa, comúnmente relacionadas con reparación de ulceraciones, y pudiendo observarse en 2-27% de las biopsias ileales de pacientes con EC, siendo común en las resecciones ileales. Hasta ahora no se han observado asociadas a las biopsias ileales de pacientes con CU, con o sin backwash ileitis (ileítis por reflujo). Sin embargo, se observan en 40% de los reservorios ileales (pouch) con anastomosis ileo-anal, donde parece ser un marcador específico de pouchitis crónica refractaria a los antibióticos o EC del pouch.
• Inflamación crónica de las criptas de distribución focal o irregular: es característica en pacientes adultos no tratados con EC.
Se ha descripto que los mencionados rasgos histológicos caracterizan a la EC.39, 40 Sin embargo, no son patognomónicas si no acompañan de manera completa o incompleta a otros rasgos clínicos, endoscópicos, imagenológicos, serológicos y evolutivos de la enfermedad, requiriendo diagnósticos diferenciales.
La naturaleza irregular de la inflamación solo es diagnóstica en pacientes adultos no tratados ya que la inflamación puede volverse parcheada en la resolución de la CU activa, y los niños pequeños (edad < 10 años) con CU pueden presentar una inflamación discontinua. La presencia de una sola característica no se considera suficiente para un diagnóstico confiable de EC. Para el material quirúrgico, se ha sugerido que se debe hacer un diagnóstico de EC cuando están presentes tres características en ausencia de granulomas, o cuando se presenta un granuloma epitelioide con otra característica, siempre que se excluyan las infecciones específicas. Para muestras endoscópicas simples o múltiples, no hay datos disponibles sobre cuántas características deben estar presentes para un diagnóstico firme de EC. Pueden identificarse en muestras de biopsia: granulomas y anomalías arquitectónicas de criptas focales (segmentarias o discontinuas), junto con inflamación crónica focal o preservación de mucina en sitios activos. Hay acuerdo general en que la presencia de un granuloma y al menos otra característica establecen un diagnóstico de EC. Esta segunda característica puede ser la inflamación (focal) o, preferiblemente, anomalías de la arquitectura. Las anomalías focales de la arquitectura favorecen un diagnóstico de EC, mientras que el aspecto pseudovelloso superficial colorrectal inclina a un diagnóstico de CU. Sin embargo, la presencia de un granuloma no es un pre requisito para el diagnóstico de EC, siendo características adicionales útiles la presencia de: inflamación crónica focal sin atrofia críptica, criptitis focal (aunque poco reproducible), úlceras aftoides, inflamación submucosa desproporcionada, hipertrofia neural (hiperplasia de la fibra nerviosa), linfocitos intraepiteliales incrementados, especialmente cuando son proximales. Así, cuando se dispone de múltiples biopsias, también pueden ser útiles para inclinar el diagnóstico hacia EC la afectación ileal, una distribución de la inflamación que muestre un gradiente proximal a distal y la ausencia de características que sean altamente sugestivas o diagnósticas de CU, como la irregularidad difusa críptica, el número reducido de criptas y los polimorfos epiteliales generales de la cripta. Un grupo de patólogos no expertos y expertos que participó en un taller de identificación de casos y evaluación de resultados por consenso reconoció el valor de estas características para hacer diagnóstico de EC, logrando al menos el 50% de acuerdo, aunque se reconoce que, aun entre expertos, la discriminación entre EC y CU en biopsias colonoscópicas no es exacta. Los casos difíciles, las biopsias esofágicas, gástricas y duodenales pueden ayudar a establecer el diagnóstico de EC por la presencia de granulomas o inflamación focalizada. En las biopsias gástricas, la ausencia de Helicobacter pylori y la presencia de un infiltrado celular perifoveolar o periglandular compuesto de células mononucleares (células T CD3 + e histiocitos CD68 +) y granulocitos son características importantes. Por otro lado, la gastritis focal no es exclusiva de EC.40
Es importante tomar biopsias múltiples, discutir los casos y tener en cuenta que varias características diagnósticas útiles para el diagnóstico de EC en muestras quirúrgicas, como la inflamación transmural, la fibrosis y las fístulas, solo están presentes en las capas profundas de la pared intestinal. Por ello, al no estar disponibles para la biopsia endoscópica, el diagnóstico de CU es más confiable que el de EC ya que las lesiones son más limitadas a la mucosa y submucosa. La EC en los niños, al debut, se asocia con más colitis y menos ileítis. La frecuencia de los granulomas es mayor en niños que en adultos y la inflamación focal en el tracto gastrointestinal superior es útil para diferenciar EC de CU en este grupo de pacientes.40
Al igual que en la CU se diseñaron scores con expectativas pronósticas, aplicables también en la selección terapéutica, hasta ahora no totalmente validados. El más conocido es el de Geboes que agrupa las lesiones en 8 categorías (scoreadas de la absoluta normalidad a la máxima alteración). Las categorías son: daño epitelial, cambios en la arquitectura, infiltración de células mononucleares en la lámina propia, infiltración de células polimorfonucleares en la lámina propia, células polimorfonucleares en el epitelio, presencia de erosiones y/o úlceras, presencia de granulomas (Tabla 30).42
Realizado el diagnóstico de EII, también debe considerarse que los síntomas sistémicos y la alteración de los reactantes de fase aguda pueden provenir de manifestaciones extraintestinales, abscesos por comportamiento perforante y efectos colaterales de medicamentos.
Las manifestaciones extraintestinales (MEI) deben ser un llamado de atención hacia la posibilidad de una EII, y tal como lo expresa el Consenso Europeo ECCO de manejo de la EC del año 2010, y el de manifestaciones extraintestinales de la misma institución del año 2016, habitualmente no pasan desapercibidas, ya que suelen afectar profundamente la calidad de vida.
Las más comunes son las alteraciones del sistema musculoesquelético, que involucran las articulaciones periféricas y/o axiales,26 presentándose también en otros órganos como es el caso de las manifestaciones orales, dermatológicas, oftalmológicas, hepáticas. Ellas pueden presentarse antes de la aparición de síntomas intestinales floridos e incluso del diagnóstico de EII.
Tabla 30. Score histológico de Geboes de la enfermedad de Crohn.42

En la EC son más frecuentes que en la CU y dentro de la EC predominan en la localización colónica.26, 72 Hasta el 50% de los pacientes con enfermedad intestinal inflamatoria experimentan al menos una MEI que puede presentarse antes de que se diagnostique la EII. Las MEI tienen un impacto adverso en la calidad de vida de los pacientes y algunas como la colangitis esclerosante primaria (CEP) o el tromboembolismo venoso pueden ser potencialmente mortales. La probabilidad de desarrollar MEI aumenta con la duración de la enfermedad y en los pacientes que ya tienen una MEI. Algunas de las MEI, como la iritis/uveítis, son más comunes en las mujeres, mientras que la CEP y la espondilitis anquilosante son más comunes en los hombres. En general corren con la actividad de la enfermedad, con excepciones, como la CEP, la espondilitis anquilosante, el pioderma gangrenoso y la uveítis. El manejo de las MEI complejas se debe discutir en equipo multidisciplinario.72
Pese a todas estas descripciones, debe quedar claro que NO existe todavía un método diagnóstico patognomónico para la EC, por lo que se acepta que el diagnóstico se realiza mediante la evaluación clínica y una combinación de exámenes endoscópicos, histológicos, radiológicos y/o bioquímicos. Actualmente, los consensos internacionales no consideran que las determinaciones genéticas sean una herramienta útil para el diagnóstico de rutina o para el manejo habitual de la EC.26
⇨ Fenotipos (clasificación de Montreal)
Globalmente, la comunidad médica acepta y usa ampliamente la clasificación de Montreal para la EC, que categoriza la enfermedad en fenotipos según: 1) edad de diagnóstico (tres categorías: menor de 17, entre 17 y 40 años y mayor de 40 años), 2) localización de las lesiones L1 (solo íleon), L2 (solo colon), L3 (íleon + colon), y L4 (tracto gastrointestinal superior) como un comportamiento en el caso de ser la única localización, y si se asocia a las otras localizaciones se agrega a cualquiera de las mencionadas como modificador L4, asociación que se toma como comportamiento de la enfermedad.37 3) Comportamiento (Behavior = B por su inicial en inglés B1 (inflamatorio o no fistulizante/no estenosante), B2 (estenosante), B3 (fistulizante intestinal). En el caso de tener lesión perianal se clasifica como modificador “p”, asociado o no a los mencionados comportamientos (Tabla 31).
Tabla 31. Clasificación de Montreal de la enfermedad de Crohn (adaptado de Silverberg y col., 2006).37
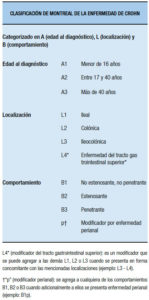
⇨ Evaluación de la actividad clínico-endoscópica
Debido a la heterogeneidad de la enfermedad y las cirugías y las condiciones concomitantes, el grado de actividad de la enfermedad, tanto clínica como endoscópica son difíciles de categorizar con exactitud, habiéndose utilizado a través del tiempo varias herramientas para este propósito.
La actividad clínica de la enfermedad en EC se categoriza generalmente en leve, moderada y severa, aunque desde el punto de vista objetivo hay subitems en diversos sistemas de clasificación difíciles de definir con precisión.26
◊ Índices y criterios clínicos de actividad
Índice de actividad de la EC (CDAI, por sus siglas en inglés Crohn’s Disease Activity Index) se ha adoptado ampliamente en estudios clínicos para la evaluación de la actividad de esta enfermedad.73 El cálculo del CDAI consiste en ocho componentes clínicos (algunos de los cuales involucran síntomas y signos relacionados con la enfermedad que se registran diariamente durante 7 días), todos ellos sumados, después del ajuste de algunos de ellos por un factor de ponderación (Tabla 32). Sin embargo, no debe olvidarse que la EC es una afección compleja que puede modificarse por secuelas de las complicaciones de la enfermedad, factores influenciados por la subjetividad y síntomas funcionales y que la mencionada heterogeneidad de la enfermedad dificulta la precisión de la cuantificación de los índices de actividad, cuando estos se comparan con la presencia y magnitud de las lesiones estructurales.
Se define como enfermedad activa a la presencia de un valor de CDAI igual o mayor a 150. La enfermedad severa se define por un puntaje mayor a 450.73 Se considera actividad moderada a severa un CDAI de 220 a 450.74
En la práctica clínica, este índice es difícil de incorporar en el manejo rutinario de los pacientes, utilizándose habitualmente para ensayos terapéuticos o para categorizar a los pacientes con fines de investigación.
Tabla 32. Índice de actividad de la enfermedad de Crohn.73

Índice Harvey-Bradshaw (HBI) (“Harvey-Bradshaw Index o Simplex Index o The Modified CDAI” ):75 es una alternativa más simple. Este índice se correlaciona con el CDAI pero es menos complejo. Por lo tanto, el HBI es considerado adecuado para el seguimiento a largo plazo y para ser utilizado en la práctica clínica por ser más sencillo de implementar.75-77 Consta de cinco parámetros clínicos (Tabla 33). El rango es 0 a 19 + el número de deposiciones. En general un score ≥ 5 se considera representativo de actividad clínica (equivalente a un CDAI ≥ 150), y usualmente se considera enfermedad moderada a severa a un score ≥ 7 (equivalente a un CDAI ≥ 220) aunque otros autores consideran moderada ≥ 8), y criterio de respuesta a un descenso del HBI ≥ 3.76-77
Tabla 33. Índice de Harvey-Bradshaw (HBI) de la EC.75
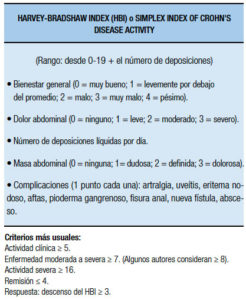
Índice de Van Hees: este índice se basa en 8 variables (clínicas y de laboratorio) que se listan en la Tabla 34 y el antecedente de resección intestinal. Fue diseñado mediante un estudio retrospectivo que realizaron tres médicos a 63 pacientes (lo que representa una muestra baja) que habían sido referidos para un total de 85 evaluaciones clínicas (Tabla 34). Se considera actividad leve, moderada y severa a índices mayores de 100, 150 y 110 respectivamente.78
Sin embargo, estos índices, en realidad no miden la “cantidad de inflamación”, sino “cuán enfermo se siente el paciente”, o “cuán enfermo lo ve el médico”. Son cuestionables por la subjetividad y variabilidad del interobservador. Como los síntomas son el pilar fundamental para la cuantificación, el número de deposiciones, la consistencia fecal y otros datos pueden depender de causas diferentes de la actividad inflamatoria, como una previa resección intestinal (diarrea por ácidos grasos, ácidos biliares, contaminación bacteriana), un síndrome de intestino irritable asociado la dieta. El dolor puede estar asociado a un síndrome de intestino irritable o una fibroestenosis secuelar, médicamente intratable.
Grados de actividad clínica de la EC para la práctica de rutina: el consenso ECCO describe una categorización de la actividad de la EC26, 78 como leve, moderada y severa fundamentada en síntomas y signos digestivos, indicadores del estado general de los pacientes, marcadores inflamatorios (PCR) y respuesta al tratamiento previo (Tabla 35).26
Tabla 34. Índice de actividad de Van Hees de la EC.78

Tabla 35. Grados de actividad clínica de la EC para el manejo de rutina (Van Assche 2010, modificado).26

◊ Cuantificación de la actividad endoscópica
La cicatrización de la mucosa confirmada endoscópicamente se convirtió en un objetivo terapéutico relevante en el tratamiento de la EC. Los sistemas de clasificación endoscópica se propusieron para evaluar la actividad de la EC, aunque son engorrosos para la práctica clínica habitual y generalmente se usan en estudios clínicos.26 Los índices más usados son:
Índice endoscópico de severidad de la EC (CDEIS: Crohn’s Disease Endoscopic Index of Severity): fue el primer método de cuantificación validado de la actividad endoscópica. Fue desarrollado hace 20 años y se usa aún en investigación como método de referencia para catalogar actividad de lesiones endoscópicas, pero es inadecuado por la complejidad para la práctica clínica habitual.79 Este índice se compone de subscores que categorizan: la presencia de úlceras en la superficie mucosa, la presencia de úlceras profundas, la extensión de la superficie involucrada por la enfermedad, la extensión de la superficie ulcerada y además la presencia de estenosis ulcerada y no ulcerada para cada segmento del colon (Tabla 36).79 El rango de este índice es 0 a 44. Aunque un score of < 3 indica remisión endoscópica completa, también se ha considerado remisión a un score < 6. Un score ≥ 3 indica enfermedad endoscópica activa y una disminución > 5 se considera respuesta.80
Tabla 36. Índice endoscópico de severidad de la enfermedad de Crohn (CDEIS).80
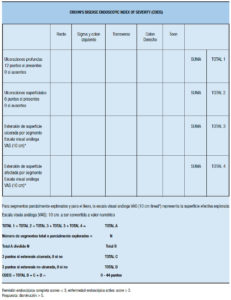
Índice endoscópico simple para la EC (SES-CD: Simple Endoscopic Score for Crohn´s Disease): este método de cuantificación fue validado posteriormente al CDEIS. Es más simple y comprende cuatro variables: tamaño de las úlceras, extensión de la superficie ulcerada, extensión de la superficie afectada y estenosis, cuantificando cada variable de 0 a 3 en cada uno de los cinco segmentos del intestino (Tabla 37).81
Ambos índices muestran una buena correlación, pero algunos autores sugieren el uso del SES-EC como alternativa al CDEIS, debido a su más fácil manejo para la clasificación endoscópica de la actividad en la rutina clínica.82 Los puntos de corte no están totalmente estandarizados. El rango es de 0 a 56. Un score < 3 se ha sugerido como enfermedad inactiva, aunque algunos estudios establecieron score 0, y se ha interpretado un descenso del 50% como respuesta, pero esto no está perfectamente definido.80, 81
Tabla 37. Score endoscópico simple de enfermedad de Crohn.82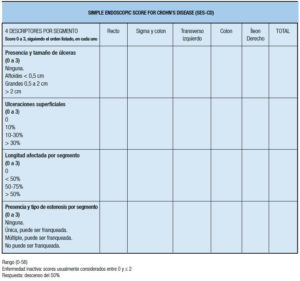
– Cicatrización mucosa
Independientemente de los scores de remisión mencionados para el CDEIS y el SES-CD, en la práctica clínica y en algunos estudios clínicos en EC, se definieron:
√ Cicatrización mucosa completa como la ausencia de ulceraciones en el seguimiento endoscópico de pacientes que presentaban ulceraciones al inicio.80-83
√ Cicatrización parcial de la mucosa como una clara mejoría endoscópica pero aún con ulceraciones.84
Una escala de actividad endoscópica diferente que se puede usar tanto para la EC y CU es la utilizada en el estudio IBSEN (Inflammatory Bowel Disease in Southeastern Norway study). El score tiene un rango entre 0 y 2 puntos (0 = normal, 1 = eritema ligero o granularidad; 2 = granularidad, friabilidad, y el sangrado, con o sin la adición de ulceraciones).
El score 0 o 1 fue considerado como curación de la mucosa, mientras que todos los tipos de ulceración (o de inflamación activa) se relacionaron con un puntaje de 2 (“no cicatrizado”), tanto en la CU o EC.85
◊ Cuantificación de la actividad en la EC fistulizante
Los pacientes que tienen como síntoma más relevante el drenaje de fístulas enterocutáneas o perianales pueden presentar un CDAI no representativo bajo ya que de esta complicación solo le corresponden 20 puntos en la cuantificación global del puntaje. Ellos son:
Índice de Present y Rutgeerst para la EC (Present y col., 1999): se basa en la evaluación de la respuesta del drenaje fistuloso (Tabla 38).85
Tabla 38. Cuantificación tradicional de la actividad en EC fistulizante.86

Índice de actividad de la enfermedad perianal (Perianal Disease Activity Index – PDAI): es un score de la Universidad de McMaster que evalúa ítems relacionados la calidad de vida. Evalúa 5 categorías (categorizadas desde no síntomas y severos de 0 al 5) que pueden verse afectadas por la presencia de fístulas: drenaje, dolor, restricción de la vida sexual, tipo de enfermedad perianal y grado de induración. A mayor puntuación, mayor gravedad.
Un punto de corte del PDAI score > 4 resultó en 87% de exactitud usando la evaluación clínica (drenaje activo y/o signos de inflamación local) (Irvine y col., 1995; Present y col., 1999) (Tabla 39).86
Tabla 39. Índice de actividad de la enfermedad perianal.87

c. EII no clasificable
Este término (IBD-U, Inflammatory Bowel Disease Unclassified por sus siglas en inglés) aplica a pacientes que presentan evidencia clínica y endoscópica de enfermedad inflamatoria intestinal crónica que afecta el colon (cuando no se efectuó colectomía), sin compromiso del intestino delgado y sin evidencia histológica definitiva ni otra evidencia que defina entre EC o CU, descartándose además etiología infecciosa. Por lo tanto, se aplica a pacientes en los cuales por rasgos clínicos, endoscópicos y hallazgos histopatológicos de las biopsias mucosas (no de una pieza quirúrgica) se puede diagnosticar EII, pero se requiere información adicional para caracterizarla. Esta información adicional podrá provenir de la clínica, las imágenes, la serología o la genética, intentándose predecir si presentarán en el futuro rasgos claros para discriminar entre CU o EC, o seguirán siendo no clasificables. Debe tenerse en cuenta que hay pacientes seronegativos y que los datos de serología y genética actuales no son suficientemente robustos para ser usados con esta finalidad de manera masiva en la práctica clínica, requiriéndose progresos de las herramientas diagnósticas y mayor conocimiento de la inmunogenética para lograrlo.87
d. Colitis indeterminada
La utilización de esta denominación (CI: colitis indeterminada) se ha restringido por definición únicamente a aquellos casos en que se efectuó una colectomía y los patólogos aún con la pieza quirúrgica no pueden efectuar un diagnóstico definitivo de EC o CU después de completar el examen.87
3. Otras herramientas para la evaluación de la EII
⇨ Biomarcadores
Dada la naturaleza invasiva de la endoscopía, la implementación de un método sencillo y no invasivo es esencial para avalar la selección prediagnóstica y el control de la actividad de la enfermedad.
En forma ideal, un biomarcador debería poder usarse para detectar la actividad, evaluar el efecto del tratamiento, exhibir valor pronóstico sobre la recidiva de la enfermedad e identificar individuos con alto riesgo de desarrollar la enfermedad.88, 89 Los principales marcadores postulados para detectar la actividad y predecir recaída son la proteína C reactiva (PCR) sérica, la eritrosedimentación y los marcadores fecales (calprotectina y lactoferrina). Sin embargo, varios de estos marcadores presentan una baja sensibilidad y/o especificidad, y pueden no reflejar el daño intestinal real.90
La proteína C reactiva (PCR): y la velocidad de sedimentación globular (VSG) son sustitutos habituales de la respuesta de fase aguda a la inflamación. La PCR se correlaciona ampliamente con la actividad de la enfermedad en la EC, evaluada por índices estándar, y refleja cambios seriados en la actividad inflamatoria.91 Los niveles de PCR son mayores en la EC que en la CU.91 Sin embargo, estudios tempranos reportaron que aproximadamente un tercio de los pacientes con enfermedad clínicamente activa presentaban niveles normales de PCR (Boirivant y col., 1988).92 La utilidad en la variabilidad entre análisis, la relevancia a través de subtipos de EII y la capacidad de predecir resultados a largo plazo deben ser explorados más.
La VSG: mide la inflamación intestinal en la EC con menor precisión reflejando los cambios en la concentración de proteínas plasmáticas y el hematocrito. La VSG aumenta con la actividad de la enfermedad, pero se ha descripto, aunque no universalmente, que correlaciona mejor con la enfermedad colónica que con la ileal.92, 93
La calprotectina fecal: es una proteína unida al calcio que constituye hasta más del 60% de la proteína citosólica de neutrófilos. Es muy resistente a la degradación bacteriana, por lo que su estabilidad en las heces, la convierte en un marcador muy atractivo. Es muy aceptada por los pacientes por ser un estudio no invasivo, y por la facilidad de la recolección de la muestra, que no requiere preparación. Tiene un valor predictivo positivo de 85-90% para distinguir la EII del síndrome de intestino irritable. La calprotectina fecal ha demostrado ser útil en el diagnóstico de la EII, correlacionando con la actividad de la enfermedad mucosa, y también demostró ser un marcador alternativo confiable de respuesta al tratamiento o recidiva de la lesión.94 En la EII, la presencia de inflamación intestinal activa está asociada con migración leucocitaria preferentemente de neutrófilos a la mucosa intestinal.95 Como resultado, en la materia fecal se detectan niveles aumentados de proteínas inflamatorias entre las cuales están la calprotectina y la lactoferrina (esta última también es reconocida de valor para detectar actividad de la EII). Se ha reportado en múltiples estudios que los valores de calprotectina fecal se diferencian estadísticamente entre grupos de pacientes con enfermedad activa y enfermedad inactiva tanto en EC como CU.96-99 En un estudio destacado por la casuística CP < 250 μg predijo cicatrización (CDEIS < 3) con sensibilidad 94%, especificidad 62%.100
Basándonos en la información internacional y nuestra experiencia, sugerimos el uso de calprotectina fecal realizando la primera determinación inmediatamente previa a una evaluación endoscópica y efectuando luego periódicamente otras mediciones de calprotectina para predecir el riesgo de recidiva o evaluar la eficacia del tratamiento, correlacionando con los índices endoscópicos, aunque más apropiadamente su elevación constituiría un signo de alerta para indicar una endoscopía y definir la conducta terapética una vez corroborada la lesión activa. Sin embargo, se discute si es igualmente efectiva o menos efectiva en la EC que en la CU y en el Crohn intestino delgado que en el Crohn de colon.96-101
En la cohorte del estudio STORI (ensayo clínico de retiro del infliximab), el cut-off combinado de calprotectina con PCR ultrasensible (PCRus) para la predicción de curación mucosa fue de CF 250 μg/g + PCRus 5 mg/l para una especificidad > 70%, sensibilidad > 70%.102
Debe notarse que el uso de medicamentos antiinflamatorios no esteroides (AINEs), la aparición de infección intestinal intercurrente y la presencia de enfermedad maligna pueden causar una elevación de los niveles de calprotectina en ausencia de EII.
Los anticuerpos como marcadores serológicos: se detectan en la EC diversos anticuerpos, los más importantes son los antimicrobianos: ASCA (Anti-Saccharomyces cerevisiae IgA e IgG), Anti-OmpC (Anti-outer-membrana porina C de la Escherichia coli), Anti-Cbir (anti-flagellina), Anti-I2 (Anti-Pseudomonas fluorescens componente I2), Antiglicanos: ALCA (IgG Anti-laminaribioside), ACCA (IgA Anti-chitobioside), AMCA (IgG anti-mannobioside).
Además, se encuentran otros que son autoanticuerpos, los más importantes son el ANCA (anticuerpo anticitoplama de los neutrófilos) en el Crohn de colon, y PAB (anticuerpo anti-pancreático).
Se ha reportado que la presencia (sobre el valor de referencia) o la magnitud de los niveles séricos de algunos de ellos se relacionan con el diagnóstico y/o el pronóstico a largo plazo. Existe controversia con respecto a su utilidad en la práctica clínica.26 Sin embargo, los mencionados anticuerpos y sus combinaciones (suma de anticuerpos, suma de cuartiles) demostraron estar estadísticamente asociados con el comportamiento de la enfermedad, la probabilidad de desarrollar complicaciones (estenosis, fístulas perinales y no perianales) y el riesgo de cirugía.103-105
Con respecto a su respectiva utilidad en la práctica clínica, cada uno de los marcadores presenta ventajas y desventajas. Idealmente, un marcador simple, rápido, sensible, específico, no costoso, no invasivo para monitorear la inflamación intestinal sería muy útil en la EII. Sin embargo, aún no se dispone de un biomarcador que combine todas estas cualidades.
⇨ Nuevos criterios de evaluación: patient-reported -outcomes (PROs)
En el contexto de seleccionar blancos eficaces para el tratamiento se realizó el consenso STRIDE (Selecting Therapeutic Targets in Inflammatory in Bowel Disease) de la IOIBD (International Organization for the Study of Inflammatory Bowel Diseases), en el que entre los blancos del tratamiento se reconoció la relevancia de los resultados informados por los pacientes: Patient-reported outcomes (PROs).80
Tal consenso aporta una discusión enriquecedora sobre los fundamentos de incorporarlos como herramientas importantes de evaluación de los pacientes, que se resume a continuación. Se discutieron estas herramientas que recientemente han adquirido relevancia, debido a la necesidad de medir con precisión la experiencia del paciente con EII y sus manifestaciones biológicas. Reconociendo este requerimiento, la Administración de Drogas y Alimentos (FDA) de EE.UU., está planteando modificar los puntos finales de los ensayos clínicos, desde el CDAI y los índices de actividad de la CU hacia los PRO y medidas objetivas de la enfermedad, como los hallazgos endoscópicos, en forma combinada.
Los PROs pueden ser diversos. El PRO final deseable sería la normalización de la calidad de vida (en comparación con la previa a la aparición de la enfermedad), lograda a través de la resolución de los síntomas y la inflamación. Actualmente se considera además que reconociendo la gran variabilidad en la expresión de síntomas, en las EII (mayor en EC) se deben abordar otros síntomas individuales que están afectando la calidad de vida del paciente.
√ El PRO primario postulado para la CU por el consenso STRIDE es la resolución del sangrado rectal y la normalización del hábito intestinal.
√ El PRO primario postulado en el consenso denominado STRIDE fue la resolución de dolor abdominal y diarrea/hábito intestinal alterado.
Los PROs relacionados con los índices clínicos o clínico-endoscópicos se elaboraron extrayendo de los índices convencionales para CU (como el score de Mayo) o EC (como el CDAI) algunos componentes informados por los pacientes en cartas diarias que se seleccionaron por interpretar que se asocian con la perspectiva de los pacientes, lo cual se supone que podría aumentar las diferencias entre una droga activa que se está evaluando y un placebo. Luego se suman los valores de los componentes seleccionados y se evalúa estadísticamente la capacidad de detectar el efecto de un tratamiento.
Dado que los PROs son variados, y se ha realizado un consenso que los incluye, se volverá sobre este tema cuando hablemos del consenso STRIDE, incorporando tablas explicativas.
⇨ Índices de calidad de vida
Las mediciones de cuantificación de la enfermedad con índices clínicos y endoscópicos pueden no detectar el impacto de la enfermedad sobre la calidad de vida de los pacientes.
Se dispone de índices utilizados en otras enfermedades como el SF-36 (que permite comparaciones con controles sanos) y específicos de EII de los cuales el IBDQ (Inflammatory Bowel Disease Questionnaire) es el más comúnmente usado para medir la calidad de vida relacionada con la salud (CVRS).
IBDQ: fue diseñado y publicado por el grupo de la Universidad McMaster de Ontario como un cuestionario autoadministrado específico de EII y es el más frecuentemente validado en EII. Se ha utilizado también para cuantificar la respuesta terapéutica en mesalazina, budesonida, ciclosporina, biológicos, cirugía, y otros eventos en la vida del paciente.106
IBDQ-32: consta de 32 ítems distribuidos en 4 dimensiones (síntomas digestivos, síntomas sistémicos, afectación emocional y social). El IBDQ-32 no contiene la dimensión de la afectación funcional de la enfermedad. Las respuestas de cada ítem se expresan en una escala de 7 puntos, donde 7 corresponde a la mejor percepción y 1 a la peor. El instrumento produce un score global para la totalidad de los ítems (y para cada una de las 4 dimensiones); el rango de la puntuación global del IBDQ abarca de 32 a 224. Se ha propuesto un score de 168 puntos para considerar al paciente en remisión y una diferencia en el IBDQ mínima de 27 puntos para respuesta.106
IBDQ-36: se desarrolló para pacientes ambulatorios, contiene 36 ítems distribuidos en 5 dimensiones (síntomas digestivos, síntomas sistémicos, afectación emocional, social y afectación funcional). La quinta dimensión (afectación funcional) es la que no se incluye en el IBDQ-32. Las respuestas de cada ítem están divididas en 7 puntos, donde el número 7 es el nivel más alto y el número 1 el más bajo. Este instrumento produce una puntuación o valoración global para la totalidad de los ítems y 5 puntuaciones para cada una de las dimensiones. El IBDQ-36 e IBDQ 32 correlacionan significativamente y existen versiones españolas validadas de ambos.106
IBDQ-9: es una versión simplificada del IBDQ, con 9 ítems, desarrollada más recientemente, la cual tiene excelente correlación con IBDQ-36 y correlaciona con los índices clínicos de actividad.107
⇨ Definiciones de interés para la evaluación
Es importante establecer los criterios con los se evalúan las modalidades de respuesta al tratamiento y la probabilidad de recaída. Las definiciones que aquí se describen se identifican en su mayoría con los criterios de la serie de publicaciones del Segundo Consenso Europeo Basado en Evidencia (ECCO, por sus siglas en inglés). Es de destacar que, con leves variaciones, nosotros usábamos tradicionalmente criterios de tratamiento y evaluación muy similares en la práctica clínica a las publicaciones de consensos ECCO, y adherimos ampliamente a la generalidad de los postulados. Nuestros criterios fueron adoptados a partir de la evidencia internacional publicada y a partir de la experiencia acumulada en la evaluación de los resultados y la observación de una numerosa casuística de pacientes con EII.
◊ Definiciones de interés en la CU
Criterio de respuesta al tratamiento
Se define respuesta como la mejoría clínica y endoscópica, dependiendo (para el propósito de estudios clínicos) del índice de actividad usado. En general, en el score de Mayo esto significa una disminución en el índice de actividad ≥ 30% y ≥ 3 puntos, más una disminución del sangrado rectal (≥ 1 punto o un score absoluto de 0 o 1) y del subscore endoscópico ≥ 1. Sin embargo, estos criterios no son universales.12, 108 La última referencia agregada corresponde a una revisión de D’Haens G y col. de los índices clínicos y end-points en los ensayos clínicos, la cual es extensa y de excelente calidad, por lo que recomendamos su lectura.
Como ya se había mencionado, cuando no se dispone de endoscopía, o en tiempos intermedios del seguimiento, se usa el score parcial de Mayo (sin endoscopía) y se define respuesta como una disminución ≥ 3 puntos. Según ya se comentó previamente el score parcial de Mayo puede ser de 6 o 9 puntos según incluya o no los 3 puntos de la valoración global del médico (PGA, Physician Global Assessment, por sus siglas en inglés). Cuando se usa el score parcial de 9 puntos se ha definido respuesta tanto con un descenso ≥ 2 como ≥ 3 puntos, y con el Mayo score parcial de 6 puntos respuesta se define con una reducción del score ≥ 2 puntos (Tabla 18).
Criterio de remisión
La remisión clínica es considerada por algunos autores similar (≤ 2) en los scores total y parcial de la Clínica Mayo, pero otros postulan ≤ 1.54 El cut-off del score total recomendado (≤ 2 puntos), en general requiere que ningún subscore individual sea > 1.
Criterio de Recaída
El término recaída se usa para definir un empeoramiento de los síntomas en un paciente con CU establecida que se encuentra en remisión clínica, ya sea de forma espontánea o después del tratamiento médico. El sangrado rectal es considerado el componente esencial de la recaída por la mayoría de los profesionales (más de 2/3 en el consenso ECCO), sin embargo, es frecuente (más de la mitad en el consenso ECCO) que se considere que es necesaria la combinación del sangrado rectal con un aumento en la frecuencia de las deposiciones y mucosa alterada en la sigmoideoscopia para definir recaída.12, 108
Respecto de la definición de recaída en estudios clínicos o en investigación de diversa índole, ello se define en cada protocolo de estudio, siendo el índice más usado para investigación el de Mayo, que es bastante parecido al de Sutherland. En el de Sutherland, score total, puede definirse recaída como un score > 3, incluyendo un puntaje endoscópico de al menos 1 (friabilidad de la mucosa). Cuando solo se evalúa el componente clínico, se considera recaída el equivalente a un score parcial ≥ 3. Respecto de factores predictivos de recaída, Bessisson T y col. reportaron como tales a la plasmocitosis basal y la cicatrización mucosa.108, 109
Patrón de recaída según su frecuencia
La recaída puede ser infrecuente (≤ 1/año), frecuente (≥ 2 recidivas/año) o continua (síntomas persistentes de CU activa sin período de remisión). Aunque los términos son subjetivos, su presencia se considera clínicamente relevante.12, 110
Se postuló la denominación de recaída precoz cuando ocurre dentro de los 3 meses después de haberse logrado la remisión con el tratamiento previo. Si bien aún debe validarse su importancia en la terapéutica, es crucial en el caso de los corticoides y en la definición de corticoideodependencia.12
Refractariedad y dependencia a los corticoides
Son conceptos de gran importancia ya que definen cambios de estrategia terapéutica. Se llama resistencia a corticoides a la presencia de enfermedad activa a pesar del tratamiento con prednisolona oral (de hasta 0,75 mg/kg/día durante un período de 4 semanas)12 o la falta de respuesta clínica tras la administración de corticoides a dosis plena por vía intravenosa durante 7 a 10 días (Tabla 40).111, 112 Debe tenerse en cuenta que actualmente en la CU se aconseja acortar este tiempo donde se aplica como monoterapia a la mitad, para agregar un tratamiento más potente en el momento oportuno.52 Obviamente, según la evolución de la actividad de la enfermedad, el antes mencionado tratamiento oral puede cambiarse a corticoides intravenosos.
Tabla 40. Definición de corticoideo-resistencia.12, 26, 52

Los criterios de corticoideodependendencia han sido variables y fueron cambiando a través del tiempo. Definiciones tradicionales fueron: la imposibilidad de disminuir los corticoides por debajo de 15-25 mg/día en un período de 6 meses, y la necesidad de restituirlos a dosis de 10-30 mg para controlar los síntomas a corto plazo de haberlos bajado o suspendido en pacientes inicialmente respondedores.49, 111 Actualmente la definición consensuada involucra la imposibilidad de disminuir los corticoides por debajo de 10 mg en un margen de tiempo de 3 meses, o la recaída dentro de los 3 meses de suspenderlos (Tabla 41).12, 52
Tabla 41. Definición de corticodeo-dependencia.12, 26

CU refractaria a inmunomoduladores
Se consideran refractarios los pacientes que presentan enfermedad activa a pesar de recibir tiopurinas a una dosis adecuada durante al menos 3 meses (azatioprina 2-2,5 mg/kg/día o mercaptopurina 1-1,5 mg/kg/día o máximo tolerada. El control de que la dosis es la apropiada implica una de las 2 metodologías de optimización según disponibilidad:
1) dosis ajustada por TPMT, inicialmente por genotipeo y luego por medición de actividad de la enzima tiopurin-metiltransferasa [TPMT];
2) cuando no contamos con estos análisis, como es generalizado en nuestro país, nos manejamos con el laboratorio de rutina, optimizando la dosis en base al mismo, como se describirá en el tópico de inmunosupresores.
A pesar de que las mencionadas definiciones de resistencia y dependencia son arbitrarias, presentan relevancia clínica para decidir el momento del tratamiento biológico o la cirugía.12 Puede tratarse de no respuesta primaria o recaída, pero teniendo en cuenta que hay que descartar que una aparente pérdida de respuesta se deba a otras causas, por ejemplo, a una enfermedad concomitante o una estenosis fibrótica.
◊ Definiciones de interés en la EC
Criterio de respuesta al tratamiento
La respuesta habitualmente se define por una reducción en CDAI ≥ 100 puntos desde la evaluación inicial (aunque en algunos estudios se usó una reducción en CDAI ≥ 70 puntos para biológicos, algunos considerando además una disminución del 25% en el score total).26, 113, 114
Si la actividad se cuantifica con el HBI, un cambio de 3 puntos corresponde a un cambio de 100 puntos en el CDAI, por lo que se interpreta como respuesta a un descenso ≥ 3 puntos (Tablas 32 y 33).76, 77
Criterio de remisión
Habiendo definido previamente que es enfermedad activa en EC, se estableció que el criterio usado en la mayoría de estudios clínicos para remisión clínica en EC es un CDAI < 150 (Sandborn y col., 2002).74 Ello se convirtió en la definición habitual y está adoptado ampliamente para la evaluación en estudios clínicos y de investigación de diversa índole.
Alternativamente al CDAI, el HBI podría permitir una evaluación más sencilla de la actividad de la EC en estudios clínicos a largo plazo y aún más en estudios en la vida real, por facilitar la posibilidad más frecuente de una medición estandarizada de la actividad de la enfermedad. Usando este método de cuantificación, remisión clínica se define por un score HBI ≤ 4 puntos, que corresponde a un CDAI < 150 puntos (Tablas 32 y 33).76, 77 Los estudios que evalúan el mantenimiento de la remisión en EC deben tener una duración de al menos 12 meses.26
Criterio de recaída
El término recaída se aplica a una exacerbación de los síntomas en pacientes con EC confirmada que están en remisión clínica, ya sea espontánea o posterior a del tratamiento médico. En la práctica clínica, la recaída clínica debería corroborarse preferentemente mediante parámetros de laboratorio, imágenes o endoscopía. En estudios de investigación se propuso un CDAI > 150 con un aumento de más de 70 puntos, aunque este criterio no está validado universalmente.26, 74
La recaída precoz se define por recaída dentro de un período de menos de 3 meses después de haber alcanzado la remisión con el tratamiento previo, lo cual, al igual que en la CU, es clínicamente relevante en la definición de respuesta a los corticoides.
En cambio, la reaparición de lesiones después de una resección quirúrgica «curativa» se denomina recurrencia.26
Patrón de recaída segun su frecuencia
AI igual que en la CU, el patrón de recaída según su frecuencia puede ser clasificado en infrecuente (≤ 1/año), frecuente (≥ 2 episodios/año) o continua (síntomas persistentes de EC activa sin período de remisión). Esta categorización es arbitraria y aunque parece clínicamente relevante, debe determinarse la importancia pronóstica.26
Recurrencia morfológica
La recurrencia morfológica se define como la aparición de lesiones nuevas de EC después de la resección completa de la lesión observada macroscópicamente, habitualmente localizada en el íleon neoterminal y/o en la anastomosis, pudiendo ser detectada por endoscopía, radiología o cirugía.26 El patrón de oro es la endoscopía, predictor de recaída clínica, según el score de Rutgeerst, siempre que la anastomosis sea accesible. Son predictivos de recaída clínica los scores ≥ 2 (Tabla 42).115
Tabla 42. Índice de Rutgeerst (recaída posquirúrgica de la EC).115
Algunas características visualizadas por ecografía o TC/IRM pueden no ser específicamente indicativas de recurrencia de la enfermedad.26
La enterotomografía y la enterorresonancia magnética por enteroclisis o enterografía son las técnicas estándar para establecer la extensión y la actividad de la EC del intestino delgado, observándose el engrosamiento anormal de la pared en imágenes contrastadas y el signo del peine (opacificación de los vasos rectos) que indica congestión vascular mesentérica y el realce del contraste. Permiten ver edema de la pared, ulceraciones y la presencia de complicaciones extraluminales. El score MaRIA brinda una cuantificación de la actividad en los estudios de Entero-RMI (Rimola y col., 2011). Los predictores que en la enterorresonacia se asocian con actividad endoscópica son engrosamiento de la pared, realce del contraste, edema y úlceras.116
La radiación ionizante limita el uso de la TC en el monitoreo rutinario. La radiología por fluoroscopía contrastada tiene una considerable menor sensibilidad que la TC o RM para la detección de lesiones extraluminales.
Los hallazgos fuertemente sugestivos en la ultrasonografía con doppler son el espesor de pared con engrosamiento significativo de la capa de submucosa y el patrón de vascularización, pero la evaluación de los segmentos intestinales profundos y la interposición de gas constituyen dificultades diagnósticas para este método, que además tiene alta variabilidad interobservador.
La video cápsula del intestino delgado se indica cuando hay alta sospecha clínica de EC y las demás evaluaciones son negativas. La enteroscopía de doble balón debe ser reservada para situaciones en que la biopsia es importante para el diagnóstico o cuando se requiere dilatación de estenosis.26 Este tema se tratará más extensamente en el ítem “Prevención de la recaída postoperatoria en la EC”.
Refractariedad y dependencia a los corticoides
La definición de refractariedad a esteroides mencionada para la CU es global para la EII, implicando enfermedad activa a pesar del tratamiento con prednisolona (de hasta 0,75 mg/kg/día durante un período de 4 semanas) (Van Assche y col., 2010), y también, al igual que en la CU, a la falta de respuesta clínica tras la administración de corticoides a dosis plena por vía intravenosa durante 7 a 10 días.26, 111, 112 Es igualmente aconsejable si no hay respuesta acortar el tiempo para indicar un tratamiento más potente en el momento oportuno. En nuestro centro vemos frecuentemente pacientes con cuadros severos por EC Crohn extensa del colon, y el hecho de considerar la indicación de biológicos precozmente en caso de no respuesta es relevante en el pronóstico, ya que requieren cirugía de emergencia con el agravante del mal pronóstico de un posterior pouch ileoanal. Las imágenes y el examen clínico nos ayudarán a excluir complicaciones que requieran cirugía de emergencia. La definición de corticoideodependencia también es similar a la de la CU (Tablas 40 y 41). Las definiciones de esteroidependencia y resistencia tienen como objetivo el retiro completo de los esteroides.26 Hay que recordar que la refractariedad a esteroides o la dependencia a estos únicamente debe evaluarse después de una cuidadosa exclusión de las complicaciones específicas de la enfermedad.
Enfermedad de Crohn localizada
La EC intestinal que afecta < 30 cm de extensión se define como enfermedad localizada. Esta definición se utiliza más habitualmente en la localización ileocecal (< 30 cm íleon ± colon derecho), pero puede también aplicarse a la enfermedad colónica aislada o a la enfermedad intestinal proximal del intestino delgado.26
Enfermedad de Crohn extensa
Se categoriza como extensa a la EC intestinal que afecta > 100 cm de extensión, independientemente de la localización (también aplica a la suma de los segmentos inflamados afectados separadamente). No existen definiciones claras para extensiones intermedias (por ejemplo, entre 30 y 100 cm) ya que los criterios podrían ser subjetivos. Pero debe señalarse que la mencionada definición de EC extensa refleja una mayor carga inflamatoria e implicancia para la toma de decisiones clínicas y quirúrgicas.26
Enfermedad de Crohn temprana
Una serie de evidencias basadas en la historia natural de la EC, los hallazgos inmunológicos y los estudios clínicos sugieren la conveniencia de usar drogas modificadoras de la EC en un período de la enfermedad precoz, para que tal intervención pueda mejorar el pronóstico.117
Los fundamentos para consensuar la definición y dar relevancia a la enfermedad temprana son:
a) La naturaleza progresiva de la EC: la mayoría de los pacientes con EC presentan inicialmente patología predominantemente inflamatoria.
Con el tiempo, una proporción relevante de los mismos experimentan progresión de la enfermedad a complicaciones como estenosis y fístulas. Categorizando a los pacientes según la clasificación de Viena, Louis E y col. reportaron que entre 125 pacientes seguidos por al menos 10 años, el 77% tenía enfermedad con patrón inflamatorio (no complicada con estenosis o fístulas) al tiempo del diagnóstico, mientras que el 11% ya tenían estenosis y el 16%, fístulas. A 10 años el 46% había cambiado el comportamiento, de modo que las proporciones en la mencionada cohort para los patrones inflamatorio, estenosante y fistulizante fueron 30,6%, 32,6% y 37,6% respectivamente, observándose un cambio desde inflamatorio a estenosante en el 27,1% y a fistulizante en el 29,4% de los enfermos (p < 0,0001, en ambos casos).118
Cosnes y col., en una cohorte de 2002 pacientes (1974-2000), reportaron que en la EC no complicada el riesgo de desarrollar progresión del comportamiento a los cinco años es del 52% (12% estenosis, 40% fístulas) y a los 20 años, 18% de los casos presentan estenosis y 70% fístulas.119 En la casuística del Hospital Udaondo (1990-2002) ente 333 pacientes con EC, 144 habían sido seguidos por 10 años, observándose una progresión del comportamiento del 20% a 5 años p < 0,01 y del 40% a 10 años p < 0,001 (según la clasificación de Viena, usada en esa fecha). De los pacientes que debutaron como estenosantes el 52% cambiaron a fistulizantes. Cabe señalar que la clasificación de Viena incluía la complicación perianal como fistulizante, que en la EC colónica fue significativamene más prevalente (50%) p < 0,001 que en la enfermedad ileocolónica (8%), diferente de lo ocurrido con las fístulas abdominales, ya que en las localizaciones que comprometen de algún modo el intestino delgado L1, L3, L4 (con o sin colon) se equilibra la prevalencia de ambas modalidades de fístulas.120
Las complicaciones difieren según la localización; es más frecuente la complicación estenosante en la EC que compromete el intestino delgado exclusivamente, y la fistulizante en la enfermedad que compromete intestino delgado y el colon, tal como lo habían descripto previamente Louis y col.118 Sumando diversas cohortes poblacionales de la literatura, 19-36% de los pacientes con diagnóstico reciente de EC presentan complicaciones, en un rango informado como del 48% a 52% a los 5 años y 69 a 70% a los 10 años después del diagnóstico.121
En la casuística de Olmsted County (1990-2004) se detectaron cambios del comportamiento de manera más precoz probablemente debido a que había una alta proporción de residentes involucrados en la atención de la salud: un 18,6% de pacientes cambiaron el comportamiento a 90 días, 22,0% a 1 año, 33,7% a 5 años, 38,7% a 10 años y 50,8% a 20 años.122
Las estenosis, fístulas y abscesos son las principales indicaciones de cirugía en la EC, y los estudios de cohorte poblacionales describen un riesgo acumulado de la cirugía entre el 40% y el 71% en el plazo de 10 años después del diagnóstico. Así, el requerimiento quirúrgico en un tiempo medio de 13,2 años en Omstem County entre 1940-2001 (n = 314) fue del 58%, la mitad con 2 resecciones. Munkholm y col. reportaron en una casuística regional (Copenhague, Dinamarca) de 373 pacientes un 70% de operados a 15 años. En la misma, cabe señalar que más de un tercio de los casos (36%) requirieron dos o más cirugías, incluyendo un 22% de los pacientes que fueron sometidos a tres o más operaciones.121, 123, 124
b) El patrón inmunológico cambiante de la EC
– Los hallazgos inmunológicos difieren según el estadio de la EC.117
– En modelos murinos de colitis y en humanos se observó que los perfiles de citoquinas cambian durante el curso clínico de la EC.117 En los modelos murinos experimentales (IL-10 Knockout Mice) la enfermedad intestinal temprana se caracteriza por respuestas Th1 con incremento de INFγ e IL12, pero no la fase crónica, en la cual la IL-4 y la IL-13 aumentan progresivamente desde la fase temprana a la tardía. En la colitis por TNBS se producen en una fase inicial IL-12 e INFγ, luego IL23, Il17 e Il-25 y posteriormente IL-13 y TGβ.117
– La IL-12 induce la producción de INF-γ en clonas de Células T aisladas del intestino de pacientes con EC temprana (no así en la tardía).125
– En la mucosa del íleon neoterminal, precediendo a la lesión endoscópica, se acumulan células CD3 y CD68 positivas. En la fase muy temprana son hiperreguladas la IL-12 y el IFN-γ, pero no las IL-17A ni la IL-4, fenómeno que va seguido de una fase temprana donde IL-12 y TNFα se producen en exceso; por otra parte, en las áreas de mucosa dañada son hiperreguladas las interleuquinas IL-23p19 e IL-6, según se detecta por métodos moleculares.126
– También se describieron variaciones en las moléculas de adhesión y sus ligandos como en el receptor de quemokinas 9 (CCR9).117
Las evidencias de los ensayos clínicos: se tomaron como modelo las evidencias publicadas en los estudios de artritis reumatoidea, en los que el uso temprano previene la discapacidad.117 Los análisis de subgrupos en ensayos controlados con placebo en la EC demostraron que los Anti-TNFs indicados tempranamente son más eficaces en lograr la remisión y/o cicatrización mucosa: ejemplos son adalimumab (estudios CHARM, EXTEND), certolizumab (estudio PRECISE2), infliximab (estudios SONIC y SUTD), detectándose mayor eficacia en pacientes con EC temprana, aunque no todos estos estudios históricos se ajustan a la definición actual, ni todos los anti-TNFs tienen estudios específicos al respecto.117, 127-131 Un estudio pediátrico demostró que en esa población de pacientes el uso precoz se asoció con mayor eficacia versus placebo y menor requerimiento de corticoides.132
Sin embargo, los dos estudios de inmunosupresión temprana en adultos (AZTEC y RAPID) son controvertidos y no lograron significancia estadística, aunque se describen factores en el diseño que pueden haber disminuido la eficacia en el primero y hubo una terminación temprana en el AZTEC, aunque se un estudio estudio post hoc del último mencionado, que detecta diferencia significativa favorable en la recaída a 12 meses.133, 134
Ante las mencionadas evidencias, se propusieron definiciones preliminares de EC temprana, a fin de ser usadas en los ensayos clínicos de drogas modificadoras de la enfermedad. Hubo definiciones preliminares, considerándose en la primera de ellas EC temprana (a diferencia de la EC establecida) a un paciente adulto o pediátrico con diagnóstico establecido de EC, con una duración de la enfermedad menor de 2 años, y adicionalmente algunas de las condiciones listadas en la tabla adjunta que sumariza las características de los diferentes estadios evolutivos de la EC.117
La Tabla 43 sumariza los principales aspectos de la definición preliminar mencionada de enfermedad temprana.117
Luego, diecinueve expertos que realizaron un consenso en una reunión internacional de EII en París, establecieron la actual definición de EC temprana, que podría ser usada en los ensayos clínicos modificadores de la enfermedad.135
Tabla 43. Características de los Diferentes Estadios Evolutivos de la Enfermedad de CROHN.117
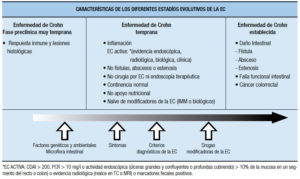
√ Definición actual consensuada de EC temprana: EC de duración ≤ 18 meses y sin previo uso de agentes modificadores de la enfermedad, los cuales comprenden inmunomoduladores y/o biológicos (definición de París), estando permitidos el uso de mesalazina y/o corticoides.135 Respecto del uso de los corticoides, opinaron que debería ser considerado como una covariable en los ensayos clínicos.
• Asimismo, en esa reunión se consensuaron los factores que deberían considerarse para estratificar de los pacientes en el caso de los ensayos clínicos con drogas modificadoras de la enfermedad, y elaboraron definiciones para los mismos:
a) Enfermedad activa
Evidencia endoscópica de actividad. Definida por al
menos una úlcera > 5 mm en al menos un segmento y SES-CD o CDEIS ≥ 4 (corte aún no validado), sin biopsia requerida.
Evidencia radiológica de actividad. Definida como previamente descripto por realce del contraste, ulceraciones, edema, espesor de la pared, o en entero-RMI score MARIA > 7 en cualquier segmento o equivalente en otro índice validado.
b) Presencia de síntomas clínicos definidos como CDAI > 150.
c) Presencia de daño intestinal, definido como uno o más por los siguientes hallazgos:
– Fístulas abdominales.
– Abscesos: acumulación de líquido extraluminal ≥ 1 cm de diámetro (TC, US, RMI) purulento al drenaje percutáneo o quirúrgico.
– Estenosis: 1) duodenal: no franqueable con gastros
copio, 2) yeyunal o ileal: engrosamiento de la pared, y disminución de la luz con dilatación preestenótica (diámetro > que normal para el intestino delgado en TC o RMI, 3) colónica: estenosis infranqueable con un colonoscopio o engrosamiento de la pared y estrechamiento luminal con dilatación preestenótica. (Si no fueran evaluables mediante endoscopía, se acordó definirlas como un diámetro mayor que el diámetro normal del colon en la TC o RMI).
– Historial de cirugías para estenosis, abscesos, o fístulas.
– Historia de dilatación endoscópica con balón de estenosis.
– Fístulas perianales al diagnóstico o posteriores o estenosis rectal.
Score de Lémann o “damage score” (índice de daño intestinal):
Es una herramienta de cuantificación que fue desarrollada con el objetivo de medir el daño acumulativo en los pacientes con EC, a fin de evaluar la progresión de la enfermedad en el tiempo y el impacto de las diversas estrategias de tratamiento en la evolución. Se compone de subscores de severidad (0-3) de lesión inflamatoria, lesión penetrante, lesión estenosante y cirugías, por cada una de 4 localizaciones: 1) tracto GI superior, 2) intestino delgado, 3) colon y o recto, 4) anal/perianal), con los que se calcula la severidad global para cada localización. Los diversos scores de los distintos segmentos sumados dan la severidad del daño global total (TGI completo). Se consideran los scores en relación con la duración de la enfermedad (> 2 y 2-10 años) (Tabla 44).136
Tabla 44. Score de Lémann o índice de daño (damage score) para las lesiones del intestino delgado según la lesión o historia de cirugía o cualquier otro procedimiento intervencionista (Pariente y col., 2011).136, 137
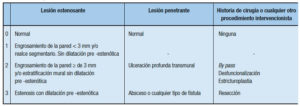
Luego de este diseño se realizó un estudio prospectivo multicéntrico, internacional, con los criterios mencionados para las imágenes incluidas en el score de daño de pacientes con EC evaluados en 24 centros de 15 países. Se estratificaron según localización y duración.
Los pacientes fueron sometidos a un examen clínico y se analizaron las imágenes de resonancia magnética abdominal, endoscopía alta, colonoscopía, según los sitios sospechosos de la enfermedad.
Se consideraron los 4 órganos divididos en segmentos, cuantificando los daños segmentarios desde 0,0 (sin lesión) a 10,0 (resección completa), según estenosis, fístulas y resecciones. Del promedio de los scores de los segmentos resultó un daño global (0 a 10), que fue evaluado en su capacidad para medir el daño intestinal estructural acumulado en 138 pacientes con EC. Se observó eficacia en la evaluación de la lesión y buena sensibilidad a los cambios de severidad. Este índice debe ser utilizado para evaluar la progresión de la EC y la eficacia del tratamiento.137
◊ Discapacidad en EII: el primer índice
El impacto de la enfermedad inflamatoria intestinal (EII) sobre la discapacidad fue evaluado mediante la Clasificación Internacional del Funcionamiento, de la Discapacidad y la Salud (ICF) desarrollada por la rama de investigación (Research Branch) en el tema de discapacidad de la Organización Mundial de la Salud.
El ICF es un sistema de codificación jerárquica con cuatro niveles de datos que incluye más de 1400 categorías. Se desarrolló el primer índice de discapacidad para la EII mediante la selección de las categorías más relevantes de la ICF que se ven afectadas por la EII. Las categorías relevantes se identificaron a través de cuatro estudios preparatorios (revisión sistemática de la literatura, estudio cualitativo, encuesta de expertos y un estudio transversal), que fueron presentados en una conferencia de consenso.
Sobre la base de las categorías del ECF identificadas de valor para la EII del ICF, se realizó un cuestionario a médicos dedicados a EII. La conferencia de consenso (20 expertos, 17 países) condujo a la selección de 36 categorías (“core set”: conjunto básico extendido) relevantes para EII, de las cuales se seleccionaron 19 categorías ICF (“core set”: conjunto básico abreviado) que se utilizaron para desarrollar el índice de discapacidad: siete categorías sobre funciones del cuerpo, dos sobre estructuras del cuerpo, cinco sobre actividades y participación y cinco sobre factores ambientales.
El índice de discapacidad puede utilizarse en estudios para evaluar el efecto a largo plazo de la EII sobre el estado funcional del paciente y como un nuevo end point en los ensayos de modificación de la enfermedad.138
Arsenal terapéutico utilizado en la EII y recientes estrategias de manejo
Selección con base en los objetivos del tratamiento
Según la evidencia actual, el objetivo terapéutico en la EII debería ser la inducción de la remisión clínica y la cicatrización de la mucosa (remisión profunda) en todos los pacientes en los cuales esta estrategia sea posible. Aun al momento del diagnóstico, es esencial considerar cómo se mantendrá la remisión después de lograr la inducción clínica (Figura 3). Los aspectos relevantes son prevenir las complicaciones y mejorar la calidad de vida de los pacientes.
Según la evidencia actual, el objetivo terapéutico en la EII debería ser la inducción de la remisión clínica y la cicatrización de la mucosa (remisión profunda) en todos los pacientes en los cuales esta estrategia sea posible. Aun al momento del diagnóstico, es esencial considerar cómo se mantendrá la remisión después de lograr la inducción clínica (Figura 3).
Los aspectos relevantes son prevenir las complicaciones y mejorar la calidad de vida de los pacientes.
En la práctica clínica, tradicionalmente, se ha usado una estrategia de tratamiento escalonado (step-up) que consiste en la indicación progresiva de tratamientos más potentes, cuando las drogas de primera línea o menos tóxicas no logran el éxito dentro de un período, que varía con el estado del paciente y la droga elegida.
Sin embargo, el médico puede decidir tratar con un agente farmacológico potente (estrategia top-down) en un estadio precoz, según la situación actual y la presencia de factores de mal pronóstico, o si así lo prefiere el paciente que cursa con síntomas de enfermedad activa, o si en ese corto período ha tenido factores predictivos significativos o intolerancia a otras drogas.
La elección de un agente para inducción de la remisión depende de la eficacia publicada de cada fármaco, el perfil de seguridad, las condiciones concomitantes, la familiaridad del médico con su uso, la preferencia del paciente y el estado clínico de la enfermedad (actividad, localización, extensión y comportamiento) (Figura 4).131, 139
El objetivo moderno del tratamiento de mantenimiento es mantener la remisión clínica y endoscópica libre de corticoides. Se seleccionarán en base a ello las evidencias de eficacia, los posibles efectos adversos y las comorbilidades individuales.
1. Aminosalicilatos
a. Conceptos generales
Los aminosalicilatos están disponibles en diferentes formulaciones para administración en forma oral (comprimidos, gránulos) y tópica (enema, espumas o supositorios). La selección de la formulación más adecuada depende de la vía de administración requerida, el costo y la disponibilidad.
Los aminosalicilatos actúan sobre las células epiteliales por medio de diferentes mecanismos que modulan la liberación de mediadores lipídicos, citoquinas y especies reactivas de oxígeno.
Recientemente se describió para el 5-ASA un efecto agonista del peroxisome proliferator-activated receptor-γ (PPAR-γ), que resulta en un incremento de la expresión de este factor de transcripción, el cual mantiene la integridad de la mucosa gastrointestinal, regulando la inflamación.140
El primer aminosalicilato empleado en la EII fue la sulfasalazina o salicilatosulfapiridina (SASP), una droga sintetizada por Nanna Svartz en 1938 (Hospital Karolinska, Estocolmo), originalmente propuesta para el tratamiento de la artritis reumatoidea.141
Posteriormente se diseñaron formulaciones orales con sistemas de liberación que difieren en cuanto al sitio y la forma en que se libera el componente activo 5-asa, mejorando además la seguridad con respecto a la SASP. Estas formulaciones se seleccionan según la vía de administración requerida, evaluación de costo, disponibilidad y seguridad en comparación con SASP.
La SASP consta de una molécula de sulfapiridina (SP) y una molécula de ácido 5-aminosalicílico (5-asa) unidas mediante un enlace diazoico, requiriendo las enzimas azo-reductasas de las bacterias colónicas, para desdoblarse en los mencionados componentes entre, el íleon terminal y el colon.
Entre un 10 y 30% de la SASP ingerida se absorbe en el intestino delgado se excreta una parte por la vía biliar, retorna al intestino (circuito enterohepático) y se liga la fracción restante a las proteínas plasmáticas para excretarse por la vía urinaria.
La sulfasalazina que llega intacta al colon se desdobla en SP y 5-ASA.
Los efectos terapéuticos de la SASP se deben a la molécula de 5-asa, el componente activo, que permanece en la luz del colon, de acción predominantemente tópica, interactuando con el epitelio dañado del sitio donde está el proceso inflamatorio, mientras la SP se absorbe y produce la mayoría de los efectos adversos. La mayor parte de la SP es absorbida por el colon, se distribuye por el organismo y es transportada al hígado, donde, entre otros pasos metabólicos, se acetila.
Los individuos acetiladores lentos, condición genéticamente determinada, tienen en relación con los acetiladores rápidos mayor nivel sérico de SASP libre y son más propensos a experimentar efectos adversos.
El 70% del 5-ASA es excretado en las heces, mientras que el resto es absorbido por el colon y metabolizado a formas acetiladas inactivas (N-Ac-5-ASA), ya sea en el hígado o localmente en las células epiteliales (volviendo al lumen para excretarse por las heces o absorberse excretándose por orina). También se excreta por orina una pequeña proporción de 5-asa libre.142
Posteriormente se desarrollaron formulaciones que liberan altas concentraciones de 5-ASA prescindiendo de la molécula de SP, en lugares específicos del intestino, variables según el tipo de fármaco.
Hay que tener en cuenta que el 5-ASA debe estar provisto de sistemas de liberación confiables para lograr eficacia, ya que si fuera administrado libre se absorbería rápidamente en el intestino delgado proximal y no se lograría la biodisponibilidad tópica requerida sobre la mucosa inflamada.
Los compuestos se denominan genéricamente mesalazina en Europa, y mesalamina en los Estados Unidos.
Para que el 5-ASA actúe en un sitio determinado del intestino, se diseñaron diferentes sistemas de liberación, ya sea con diversas cubiertas entéricas o con enlaces azoicos, pero con combinación diferente a la SP para que el mencionado componente activo pueda ser transportado al colon, actuando mediante mecanismos similares a sulfasalazina, pero sin los efectos adversos de la droga transportadora.143
Algunas formulaciones tienen resinas acrílicas que liberan la droga a pH 6 (eudragit-L) determinado que sea posible una acción tópica desde el yeyuno medio hacia el colon distal (Salofalk®, Claversal®) mientras que otras requieren para ello pH 7 (eudragit-S) que se libera a partir del íleon terminal o colon (Asacol®).
Otro sistema de liberación consiste en microgránulos con una membrana de etil celulosa semipermeable que al humedecerse (por ser sensible al agua) permite que la mesalazina salga de adentro de los microgránulos, constituyéndose en un mecanismo de liberación lenta (tiempo dependiente), que comienza en el intestino proximal, e involucra el duodeno, el yeyuno, el íleon y el colon, con escasa influencia del pH (Pentasa®).
Se diseñó luego otra forma de presentación en microgránulos (Salofalk®), que requiere que en un primer paso se remueva por efecto del pH una cubierta acrílica del tipo Eudragit L (disolución a pH 6), accediendo así al núcleo de los microgránulos que consta de un polímero adicional que provee liberación prolongada de 5-ASA aun en el colon distal.
También se elaboraron, como se mencionó, compuestos diferentes a la SASP con enlaces azoicos, uno que consiste en dos moléculas de 5-asa unidas por enlaces azoicos: olsalazina (Dipentum®) o transportadores inertes: balsalazide (Colazide®). Estas formulaciones comparten con la sulfasalazina el requerimiento de la acción de las bacterias colónicas para liberar la molécula de 5-asa, por lo que son solo activas en el colon.
Más recientemente se ha desarrollado un sistema de liberación multimatriz – MMX (Lialda® o Mazavant®) que libera el 5-ASA homogéneamente en todo el colon con el objetivo de mejorar el acceso a áreas más distales que las otras fórmulas, mediante un núcleo con micropartículas de 5-ASA que contiene (sistema multimatriz) una matriz lipofílica, que se dispersa a través de una matriz hidrófila (que se erosiona) cuando la cubierta del núcleo (una película polimérica gastro-resistente) se desintegra a pH 7 (desde íleon).
La mesalazina MMX y las presentaciones en gránulos aumentan la adherencia al tratamiento con mesalazina oral al proveer formulaciones que permiten ingerir fácilmente altas dosis mediante una toma diaria (Figura 5).144
b. Resumen de aspectos relevantes sobre Aminosalicilatos en EII (Tabla 45).
Tabla 45. Conceptos relevantes sobre aminosalicilatos en la EII.

c. Eficacia de los aminosalicilatos en la CU
Las revisiones sistemáticas y metaanálisis demostraron que los aminosalicilatos son altamente efectivos para inducir remisión y prevenir la recurrencia de la CU. A fin de optimizar los resultados, se realizaron estudios para definir cuáles son las dosis diarias totales más efectivas según la situación clínica y la frecuencia de administración más beneficiosa (en términos de problemas de adherencia).
Las dosis ≥ 2,0 g/día de mesalazina son más efectivas que las dosis menores para inducir remisión y reducir el riesgo de recurrencia de la CU quiescente145, confirmando reportes previos en términos de respuesta clínica y endoscópica.146 Además, se reportó que los pacientes con CU moderadamente activa (comparados con los que cursan enfermedad leve) tratados con altas dosis de mesalazina (4,8 g) presentan porcentajes de respuesta significativamente mayores en la inducción de la remisión, en comparación con los pacientes tratados con 2,4 g/día (71,8% vs. 59,2%; p = 0,036).147 Adicionalmente, se observaron tasas significativamente mayores de curación de la mucosa con dosis altas a las seis y tres semanas, en un análisis combinado de ASCEND I y II.148 En el estudio ASCEND III, también con dosis altas, se reportó beneficio en la inducción de remisión a las seis semanas (43% vs. 35%; p = 0,04), y se describió que dosis altas se asociaron con una ventaja terapéutica en aquellos enfermos que habían requerido esteroides y tratamiento rectal.149 También se describió una mejoría significativa en la calidad de vida en relación con la dosis.150 Sin embargo, este efecto dosis-respuesta no ha sido universalmente consistente en otros estudios, dado que no se observó con la formulación con sistema de liberación multi-matriz (MMX) ni se replicó.151-153
Nosotros compartimos la visión de GETECCU en cuanto a que estos hallazgos controvertidos de la relación dosis-respuesta con mesalazina en la CU se deben interpretar con precaución debido a: 1) el pequeño subgrupo analizado cuando se compararon las dosis de mesalazina; 2) las limitaciones inherentes a la extrapolación de los datos entre formulaciones; 3) en algunos estudios, con mayores dosis se observó respuesta clínica más precoz y cicatrización mucosa, 4) es importante considerar que el uso de dosis de 3 g/día o mayores no se asocian significativamente con mayor toxicidad. Nuestro centro concuerda con esta opinión, y tradicionalmente también nosotros, como se sugiere en las guías españolas, hemos usado al menos 3 g por día para inducción de remisión en la CU.52
Con respecto a la frecuencia de administración de la mesalazina, el estudio PODIUM demostró que los pacientes con CU que recibían 2 g/día en gránulos orales de liberación prolongada (Pentasa®) en una sola toma presentaron tasas de remisión significativamente mayores que los pacientes que recibieron 1 g dos veces por día, debido a la menor adherencia resultante de una administración más frecuente (6% versus 44% a 8 meses). A 1 año, el 70,9% de los pacientes que recibieron 2 g/día en una sola toma de mesalazina permanecían en remisión, en comparación con el 58,9% de los pacientes del grupo de mesalazina 1 g dos veces por día, p = 0,024.154 Adicionalmente a esta evidencia, la administración una vez por día de los gránulos con perfil de liberación prolongada (Salofalk®) demostró ser tan efectiva en la inducción de remisión como la administración de la misma dosis en tomas divididas de mesalazina con cubierta Eudragit-L.155
Con la formulación de mesalazina que usa tecnología MMX para demorar y extender el suministro del principio activo a través del colon, se logró remisión clínica y endoscópica en la semana 8 en el 34,1% y 29,2% de los pacientes que recibieron mesalazina MMX 2,4 g/día administrada dos veces por día y mesalazina MMX 4,8 g/día administrada una vez por día respectivamente, en comparación con el 12,9% de los que recibieron placebo (p < 0,01). Además, la remisión de la enfermedad en pacientes tratados con mesalazina MMX se mantuvo de forma efectiva en la mayoría de los casos durante al menos 12 meses, y se reportó que la prevalencia de pacientes en los que se logró inducir y mantener la remisión fue del 56,6% (196/346), con buena tolerancia.156, 157
La eficacia de la mesalazina está íntimamente influenciada por la adherencia del paciente. Kane S. y col. realizaron un estudio en el que demostraron que los pacientes con CU quiescente en mantenimiento con mesalazina que no adherían al tratamiento, presentaron un aumento del riesgo de recurrencia clínica (87% vs. 26%, p = 0,0001).158
Para la vía rectal se pueden usar supositorios en el caso de las proctitis, y espumas o enemas para la colitis izquierda (las espumas llegan habitualmente a 40 cm y las enemas pueden alcanzar el ángulo esplénico).159 Si bien los supositorios son insuficientes en extensiones superiores a proctitis, su administración simultánea con el tratamiento oral aporta el beneficio de mejorar el pujo y el tenesmo, que resultan tan molestos para el enfermo.
La mesalazina rectal es también una opción de gran valor para el manejo de la CU. Un estudio aleatorizado tres ramas de tratamiento comparó la eficacia de 1) enemas con una suspensión de mesalazina (Rowasa) como agente único de tratamiento, 2) comprimidos orales de mesalazina (Asacol) como agente único, 3) y la combinación de enemas y comprimidos de mesalazina en pacientes con CU distal activa leve a moderada, a las 3 y 6 semanas. De manera similar al mencionado estudio, la mayor eficacia del tratamiento combinado se demostró también con Pentasa en pacientes con CU leve a moderada extensa. Se administraron por vía oral 4 gramos 2 veces por día durante 1 mes, y el mes siguiente se continuó este tratamiento combinado con una enema de 1 gramo de mesalazina o bien una enema de placebo). El grupo de tratamiento combinado presentó un incremento significativo de la mejoría de los síntomas clínicos en comparación con la monoterapia (a 8 semanas se observó remisión en 64% vs. 43%, p<0,003 y se evidenció mejoría a 4 semanas en 89% vs. 62%, p<0,0008 y a 8 semanas en 86% vs. 68% (p<0,026).160, 161
Con respecto a la dosis rectal óptima de los supositorios, el tratamiento administrado 1 vez al día mediante supositorios de 1 g es igualmente efectivo que 500 mg en dosis divididas.162 Se pueden usar enemas y espumas y no hay evidencia de mayor dosis respuesta usando enemas de 1 g en comparación a 4 g.163
Deben usarse formulaciones de mesalazina con tecnologías de sistemas de liberación que hayan sido validadas en ensayos clínicos como efectivos y confiables, y recordar que la adherencia es un tema relevante.
La sulfasalazina tiene eficacia al menos similar a diferentes aminosalicilatos aprobados para la CU y, más aún, una revisión Cochrane reportó a la primera mencionada como más efectiva, pero es indiscutible que en todas las publicaciones los efectos colaterales son más más frecuentes y de mayor relevancia.164, 165 La dosis recomendada es de 2 g para la enfermedad en remisión y de 3-4 g en la enfermedad activa, dosis que también conlleva un mayor perfil de efectos colaterales descriptos a continuación como dosis dependientes. Debe tenerse en cuenta que la sulfasalazina es significativamente menos efectiva que los corticoides en la enfermedad leve a moderada (77% vs. 48%, p < 0,01).166
d. Eficacia de los aminosalicilatos en la EC
En las últimas décadas, la mesalazina se consideró el tratamiento más popular en la EC leve, siendo de interés su bajo nivel de toxicidad. Sin embargo, la utilidad de mesalazina en sus diferentes formulaciones para el tratamiento de la EC presenta una gran controversia en la bibliografía. Las variaciones que se observaron en la respuesta a este agente se han adjudicado en diversas publicaciones a la forma la presentación de la EC y la estadificación clínica (localización de la enfermedad, actividad, necesidad de mantenimiento de la remisión ya sea inducida clínica o quirúrgicamente) y a las diferentes presentaciones farmacológicas (el lugar de liberación de la mesalazina y al sistema de liberación). Inicialmente se probaron varias formulaciones de mesalazina: liberación controlada pH dependiente (pH6/pH 7) y tiempo dependiente.
Los primeros estudios con aminosalicilatos orales reportaron eficacia para el tratamiento de la EC ileal, ileocólica o colónica.167-168 Con base en tales estudios, y considerando que la mesalazina es una droga deseable por el bajo potencial de toxicidad, diversas guías institucionales y algoritmos incluyeron la mesalazina, en general a altas dosis, en las opciones de tratamiento de la EC ya sea leve o moderadamente activa, aunque con frecuencia se aclara que la evidencia es controvertida, los tamaños de las muestras de los estudios fueron limitadas, y no queda claro el beneficio según la localización.169, 170
Un metaanálisis de tres estudios controlados con placebo con mesalazina (4 g diarios) para inducción de remisión en EC activa durante 16 semanas que incluyó un total de 615 pacientes demostró una reducción media estadísticamente significativa del CDAI, pero la magnitud de la diferencia es escasa y sugiere que la significancia clínica debería considerarse marginal y controvertida, no logrando además discriminar si un subgrupo específico de pacientes podría beneficiarse con este agente.171 Respecto del beneficio de la mesalazina para el mantenimiento de la remisión en EC, también los estudios que investigaron este aspecto demostraron resultados inconsistentes. Además, algunos de ellos no analizaron en forma separada si la inducción de la remisión fue clínica (lograda por un tratamiento farmacológico) o posquirúrgica.
Se efectuaron cinco metaanálisis para evaluar el papel de la mesalazina en el mantenimiento de la remisión de la EC, que mostraron resultados conflictivos.172-176
El metaanálisis de Camma y col. reportó que la mesalazina reduce en forma significativa el riesgo de recurrencia sintomática (diferencia combinada de riesgo, -6,3%; IC95%: -10,4% a -2,1%) con un NTT de 16 para prevención de una recurrencia. Aun así, a diferencia de otras revisiones sistemáticas, se analizó el mantenimiento de la remisión inducida en forma clínica o quirúrgica en forma separada, demostrando una disminución de la tasa de recaída, estadísticamente significativa pero modesta, en el escenario de remisión inducida quirúrgicamente (-13,1%; IC95%: -21,8- -4,5). Se observó que este efecto fue predominantemente en la enfermedad ileal. No se detectó significancia estadística en pacientes con remisión clínicamente inducida (-4,7%; IC95%: -9,6- -2,8).173 Otro metaanálisis de Cochrane, realizado por Akobeng y Gardner, focalizado en el mantenimiento de la remisión clínicamente inducida, no encontró evidencia que indique que las preparaciones de 5-ASA son superiores al placebo en pacientes con EC a los 12 o 24 meses.172
También se investigaron diferencias en la eficacia entre las formulaciones de mesalazina. Steinhart y col. reportaron una potencial mayor eficacia en la prevención de la recaída médicamente y posquirúrgicamente inducida con las formulaciones pH 7 dependientes.177 Sin embargo, los consensos y guías de tratamiento actuales no recomiendan la indicación de 5-ASA para el mantenimiento de la remisión inducida clínicamente en la EC; los estudios incluyen una mayoría de pacientes con enfermedad ileal o ileocecal.
Con respecto al uso tópico, la mesalazina vía rectal se propuso como tratamiento adyuvante en la EC izquierda o colónica distal activa. Aunque esta recomendación no está aceptada universalmente, en nuestro centro la incluimos en el arsenal terapéutico estándar. La sulfasalazina en dosis igual o mayor a 3 g/día se demostró efectiva en pacientes en actividad con compromiso colónico, en menor grado que los corticoesteroides, pero Malchow y col., en 1984, y Summers y col., en 1979, reportaron que la sulfasalazina no es efectiva para el tratamiento de aquellos pacientes con EC activa limitada al intestino delgado ni demostró eficacia para el mantenimiento de la remisión.178, 179 La sulfasalazina se asocia con un menor perfil de seguridad en comparación con las formulaciones de mesalazina, incrementando los efectos adversos a las dosis mencionadas (véase perfil de seguridad).
e. Perfil de seguridad de los aminosalicilatos
Seguridad de la mesalazina: esta droga tiene efecto tópico sobre las células epiteliales colónicas, donde también se metaboliza. Esto implica que la eficacia del medicamento no se puede determinar por comparaciones farmacocinéticas basadas en niveles circulantes, aunque su absorción podría afectar el perfil de seguridad.
• Es una droga habitualmente muy bien tolerada. Las reacciones adversas más comunes, observadas globalmente en un 15% de los pacientes, son diarrea (3%), cefalea (2%), náuseas (2%), erupción en la piel (1%) y discracias sanguíneas (trombocitopenia < 1%). Una revisión sistemática que incluyó 46 estudios clínicos randomizados de pacientes tratados con mesalazina, olsalazina o balsalazida confirmó que todos los derivados 5-ASA investigados utilizados en la EII tienen buen perfil de seguridad.180 En este estudio, se demostró que las mesalazinas usadas en la CU activa tuvieron un porcentaje de efectos adversos numéricamente menor (22%) que el placebo (34%), con discontinuación similar por efectos adversos 6% versus 7% respectivamente).
• Además, mesalazina y balsalazina tuvieron menor número de efectos secundarios (30%) que la sulfasalazina (43%) y fue menor el número de discontinuaciones (5%) con mesalazina/balsalazina que con sulfasalazina (16%).
• Comparando olsalazina con placebo en 2 estudios, los efectos adversos fueron númericamente más frecuentes con olsalazina (23-83%) que con placebo (5-80%), pero no significativamente, y no hubo diferencia en las discontinuaciones, pero la mitad de las ocurridas por olsalazina fueron por diarrea secretora, que es dosis dependiente. Los efectos adversos ocurrieron en un rango de 10-39% en pacientes con olsalazina, siendo numéricamente pero no estadísticamente mayores con sulfasalazina (23-60%), al igual que las discontinuaciones.
• En la CU en remisión entre los pacientes tratados con 5-ASA, 20-41% presentaron efectos adversos versus 39-44% con placebo. Los tratados con mesalazina presentaron efectos adversos en el 31% de los casos versus 42% en el grupo placebo y discontinuaron 7% versus 16% respectivamente. En un ensayo clínico de olsalazina controlada con placebo discontinuaron por diarrea severa 16% con droga activa versus 2% con placebo. La diarrea por olsalazina representó el 50% de los eventos adversos en casi todos los estudios con esta droga, y ocasionó el 60% de las discontinuaciones del tratamiento, pero aun en este caso el número de pacientes que discontinuaron el tratamiento en los ensayos clínicos no fue estadísticamente mayor que en el placebo, tampoco en el caso de la comparación entre olsalazina (discontinuados en un rango de 3-19%) versus sulfasalazina (discontinuados del 2-11%).180
• En síntesis, puede concluirse que los efectos adversos de mesalazina y balsalazina y la necesidad de discontinuar son comparables con el placebo y menores que con sulfasalazina. En el caso de la olsalazina, en general se observaron más efectos adversos y discontinuaciones que con placebo y mesalazina, aunque no alcanzaron significancia.
• Los eventos adversos serios que ocurren con mesalazina (hepatitis, discrasias sanguíneas, pancreatitis, pleuropericarditis, nefritis intersticial) por lo general han sido reportados como casos aislados.
• Se realizó un análisis de posibles serios eventos adversos notificados a la Comisión de Seguridad de las Medicamentos del Reino Unido en los años 1991-1998 con el objetivo de comparar mesalazina y sulfasalazina.181
• El mencionado estudio informó que el riesgo relativo varía por evento adverso individual, de modo que la nefritis intersticial y la pancreatitis son significativamente más reportadas con mesalazina, mientras que las discrasias sanguíneas se describen con mayor frecuencia con sulfasalazina. Hubo 11 reportes de nefritis intersticial con mesalazina, por millón de prescripciones, no describiéndose con sulfasalazina. La insuficiencia renal es un evento adverso muy infrecuente (habiéndose reportado la nefritis intersticial y el síndrome nefrótico) y constituye un efecto idiosincrático. Es reconocida como una complicación del tratamiento con mesalazina, y raramente fue descripta hipersensibilidad en relación con el uso de sulfasalazina. Al respecto cabe señalar que las concentraciones de 5-ASA urinarias son más altas con mesalazina que con preparaciones con ligadura azoica y, además, que esta droga se asemeja estructuralmente a la fenacetina, causa bien conocida de nefritis intersticial. Se reportó nefritis intersticial con insuficiencia renal y creatinina elevada asociada con mesalazina en 0,2% de una cohorte de 2940 pacientes, y en 1/3 de pacientes con dosis > 3 g de 5-ASA se observó proteinuria tubular.181 Se ha reportado que la suspensión temprana de la droga (menos de 10 meses) restaura la función renal en el 85% de los casos. Contrariamente, un estudio poblacional sugiere que el mencionado riesgo se asocia con la enfermedad (como una manifestación extraintestinal infrecuente), más que con la dosis o el tipo de mesalazina.182 Durante el tratamiento con 5-ASA se debe monitorear la función renal de los pacientes con antecedentes de insuficiencia renal, comorbilidades significativas o aquellos que reciben en forma concomitante medicamentos potencialmente nefrotóxicos. Se ha postulado que la creatinina y el hemograma completo se deberían controlar cada 3-6 meses durante el tratamiento con aminosalicilatos, pero no existe evidencia que permita establecer un régimen definido de monitoreo.139
• Otro evento adverso descripto en diversas publicaciones por 5-ASA es la pancreatitis, que fue reportada en el estudio de Ransford y col. casi siete veces más frecuentemente para mesalazina (7,5 por millón) comparado con SASP (1,1 por millón de prescripciones) (odds ratio [OR] = 7,0; IC95%: 2,6-18,6; p < 0,001) y descripta en un estudio francés como asociado con mesalazina.181
• Las discrasias sanguíneas observadas son depresión de la médula, anemia aplásica, agranulocitosis, neutropenia y trombocitopenia; son más frecuentes con sulfasalazina que con mesalazina (OR = 1,5; IC95%: 1,1-2,1). Asimismo, con la sulfasalazina son estadísticamente más comunes en la artritis reumatoidea por las dosis y la susceptibilidad de la patología (p < 0,001), como así también la hepatotoxicidad.181 Cabe señalar que la hepatotoxicidad se ha reportado con mesalazina en algunos pacientes que presentaron previamente anafilaxia a sulfasalazina.181
• Un evento adverso infrecuente, pero importante de tener en cuenta en los pacientes con CU, es una forma de intolerancia aguda a 5-ASA, que semeja una exacerbación de la enfermedad (diarrea en 1,0-4,6% de los pacientes, en algunos casos con sangre; dolor adominal hasta el 5% y fiebre hasta en el 1,5% de los pacientes respectivamente, observado en el 3% de los casos). Ello afecta profundamente el pronóstico del paciente individual, porque ante las escasas descripciones del mismo, se suele interpretar que el abandono de la medicación es un problema de adherencia y se reindica el mismo tratamiento, lo que perpetúa la sintomatología.183
• D´Haens y Van Bodegraven, en una publicación que evalúa los datos disponibles de sulfasalazina y mesalazina sobre mortalidad, serios eventos adversos irreversibles y tolerabilidad de ambas drogas, concluyen que la mesalazina debería ser preferida a la sulfasalazina en el tratamiento de la EII, señalando que el 80% de los pacientes intolerantes a sulfasalazina tolerarán mesalazina sin problemas.184
Seguridad de la sulfasalazina: refiriéndonos ahora a este fármaco más específicamente, el mismo presenta efectos colaterales dosis dependientes en el 10-45% de los pacientes:
• Los más frecuentes son cefalea, náuseas, dolor epigástrico, diarrea y también se presenta anemia por déficit de ácido fólico, rash cutáneo, los cuales correlacionan con los niveles séricos de sulfapiridina. Estas reacciones son más comunes si se administran dosis que superen los 2 gramos diarios, no debiéndose sobrepasar los 4 gramos diarios ya que no mejora la eficacia terapéutica y se incrementan los efectos colaterales.185
• Pueden presentarse reacciones idiosincráticas de piel (Stevens-Johnson y necrolisis epidérmica tóxica), extremadamente raras y serias, que pueden ser fatales, descriptas sobre todo con sulfasalazina (muy raramente con mesalazina). Se presentan con un cuadro similar a una gripe, lesiones erosivas de piel que surgen de ampollas en las que hay despegamiento de las capas superficiales (signo de Nikolsky), llagas orales o vaginales, anemia hemolítica, disfagia, adenopatías, fiebre.181
• Otras lesiones de hipersensibilidad (infrecuentes) son alveolitis, neumonitis, pericardititis, anemia hemolítica (Randsford y Langman, 2002), hepatitis, y pancreatitis, ya mencionada previamente para los aminosalicilatos en general, y menos frecuentemente que con mesalazina. Raramente se ha descripto un síndrome de sensibilidad a drogas con eosinofília y síntomas sistémicos: DRESS (Drug Rash Eosinophilia Systemic Symptoms), que puede acompañarse de otras alteraciones hematológicas.
• Toxicidad hematológica: las discrasias sanguíneas registradas en EII incluyen depleción medular, anemia aplástica, agranulocitosis y neutropenia y trombocitopenia. La agranulocitosis observada en 0,6/1000 pacientes con EII tratados con sulfasalazina es un cuadro particularmente severo que en general ocurre dentro de los tres primeros meses. También se puede observar anemia por cuerpos de Heinz en pacientes deficientes en glucosa-6-fosfato que presentan una hemoglobina anormal y hemólisis. Debemos recordar que la sulfasalazina produce déficit de folatos, por lo que debe administrarse simultáneamente ácido fólico para evitar la anemia megaloblástica.
• Puede también observarse infertilidad masculina reversible por hipospermia con disminución de la motilidad de los espermatozoides (situación que revierte rápidamente con la suspensión de la droga).186
• Su utilización dependerá de varios factores, preferencias del paciente (costo), y a veces puede ser de utilidad en patología articular asociada.
2. Corticoides
a. Conceptos generales
Los corticosteroides son agentes antiinflamatorios potentes para el tratamiento de los pacientes con actividad moderada, tanto de la CU como de la EC y la leve no respondedora. No tienen ningún papel en el tratamiento de mantenimiento de la remisión de ninguna de las dos enfermedades. Respecto de su modo de acción, mediante diversos mecanismos fisiopatológicos producen: inhibición de varias vías inflamatorias suprimiendo la transcripción de interleuquinas, inducción de IκB que estabiliza el complejo NFκB, supresión del metabolismo del ácido araquidónico y estimulación de la apoptosis de linfocitos dentro de la lámina propia del intestino.187 El arsenal de corticosteroides en EII incluye fármacos orales (prednisolona, prednisona, budesonida de formulación de liberación apropiada para CU, intravenosos [hidrocortisona y metilprednisolona] y rectales [los supositorios de corticoides no están disponibles para EII], espumas y enemas [incluyendo hidrocortisona, budesonida, prednisolona, metasulfobenzoato de betametasona, se usan o han usado en nuestro medio las tres primeras en preparaciones comerciales o caseras]. Mediante modificaciones químicas en la molécula y el sistema de liberación de algunas de ellas, se intenta maximizar los efectos tópicos mientras se limitan los efectos colaterales sistémicos de los esteroides.
b. Resumen de los aspectos relevantes de los corticoides en EII (Tabla 46).
Tabla 46. Conceptos relevantes sobre corticoesteroides en EII.

c. Eficacia de los corticoides en la CU
◊ Corticoides orales de acción sistémica
El primer estudio clínico randomizado que investigó la eficacia clínica y endoscópica de los corticoides (cortisona 100 mg/día) en la CU de actividad moderada en comparación con placebo data de 1954, cuando Truelove y Witts reportaron los resultados preliminares, publicando al año los resultados finales. El estudio incluyó 109 pacientes, observando: remisión en el 41% comparado con 16% para placebo y mejoría en el 69% versus 41% respectivamente (todos significativos: p < 0,01). También se observó diferencia significativa en el logro de remisión endoscópica (30% vs. 11%) y mejoría endoscópica (68% vs. 39%).49, 188
Dos estudios controlados con placebo confirmaron la eficacia de los esteroides orales convencionales para pacientes ambulatorios con CU activa, mostrando un NNT NNT “Number-Needed-to-Treat” de 2 (IC95%: 1,4-5,0).189, 190 Al igual que el estudio mencionado de Truelove y Watkinson (1962), el estudio de Lennard-Jones realizado en pacientes ambulatorios con enfermedad moderada demostró tasas mayores de respuesta y efecto más rápido clínico y endoscópico en los pacientes tratados con prednisona 60 mg (55%) en comparación con SASP 2 a 4 g (40%, p < 0,01) y con enemas de hidrocortisona (15%).166, 190
Adicionalmente, un metaanálisis relativamente re-
ciente ratificó el beneficio clínico de glucocorticosteroides estándar sobre placebo para la inducción de la remisión de la CU (RR de no remisión = 0,65; IC95%: 0,45-0,93).191
Sin embargo, pese al éxito a corto plazo, un estudio de cohorte del condado de Olmsted, Minnesota (1970-1993) describió el pronóstico a más largo plazo, evaluando la evolución de185 pacientes con CU después del primer curso de corticoesteroides. Al primer mes, el 54% de los pacientes habían logrado la remisión completa, el 30% la remisión parcial y el 16% no tuvieron respuesta. Pero al completar un año de seguimiento, se observó respuesta prolongada en el 49% de los pacientes, dependencia de esteroides en el 22%, mientras que el 29% requirió colectomía.110 Esto significa que más de la mitad de los pacientes necesitan escalar a un tratamiento médico diferente o una intervención quirúrgica.
Respecto del régimen apropiado de corticoesteroides orales, el recomendado por el consenso ECCO para la enfermedad moderadamente activa es de 40 mg/día de prednisolona durante 1 semana, 30 mg/día durante 1 semana, luego 20 mg/día durante 1 mes antes de disminuir a 5 mg/día/semana.
Es relevante para cualquier centro disponer de una estrategia estándar para identificar la dependencia a esteroides en un estadio precoz a fin de considerar tempranamente otras opciones terapéuticas tal como inmunomoduladores o biológicos.92
El régimen mencionado es muy similar al que tradicionalmente hemos usado como estándar de tratamiento de rutina en nuestro Centro. En nuestra práctica indicamos 40 mg durante 1 semana, seguido de 30 mg durante 1 semana, 20 mg durante 3 semanas y luego 10 mg hasta un período total de 8 semanas. Este período podría extenderse hasta 12 semanas en caso de utilizarlos como puente hasta la acción de las tiopurinas, en cuyo caso solemos extender los 20 mg a 4 semanas en lugar de 3 semanas. En los casos en que por los antecedentes de largo tratamiento (teniendo en cuenta una diferente susceptibilidad entre pacientes) es posible presumir una insuficiencia adrenal, se debe actuar multidisciplinariamente con un endocrinólogo para indicar tratamiento sustitutivo al momento de la suspensión de la prednisona, teniendo en cuenta pautas de stress, mayormente en caso de infecciones o cirugía.
◊ Corticoides orales de acción tópica
Recientemente, la budesonida MMX, una formulación oral que se administra una vez por día y extiende la liberación de budesonida gradualmente en todo el colon usando tecnología MMX, demostró ser segura y más efectiva que el placebo para la inducción de remisión en pacientes con CU activa, leve a moderada. Después de 8 semanas, los porcentajes de remisión entre los sujetos que recibieron 9 mg de budesonida MMX, 6 mg de budesonida MMX o mesalazina fueron del 17,9%, 13,2% y 12,1% respectivamente, demostrándose beneficio significativo con 9 mg de budesonida en comparación con placebo (remisión: 7,4%) (p = 0,0143), pero no con 6 mg de budesonida ni con mesalazina. Los porcentajes de mejoría clínica observados (reducción ≥ 3 puntos en el UCDAI) se observaron en 33,3% (budesonida 9 mg), 30,6% (budesonida 6 mg), 33,9% (mesalazina) y 24,8% (placebo).
– Los porcentajes de mejoría endoscópica en la semana 8 fueron: 41,5% (budesonida MMX 9 mg), 35,5% (budesonida MMX 6 mg), 33,1% (mesalazina) y 33,1% (placebo). Las tasas de resolución de los síntomas (no sangrado ni diarrea) en la semana 8 entre los sujetos que recibieron 9 mg o 6 mg de budesonida MMX o mesalazina fueron del 28,5%, 28,9% y 25,0% respectivamente en comparación con el 16,5% para placebo (p = 0,0258, p = 0,0214 y p = 0,1025).193
◊ Corticosteroides intravenosos
Permanecen como pilar del tratamiento convencional en la CU activa grave.111 Debe recordarse que previamente al estudio descripto de corticoides en la CU, la mortalidad en la enfermedad severa superaba el tercio de los pacientes, bajando al 8% con la administración de corticoides intravenosos, que disminuyó al ajustar los plazos tolerados para considerar no respuesta.
Una auditoría de EII realizada en el 2008 en el Reino Unido informó una mortalidad del 2,9% en pacientes internados con colitis aguda grave, aunque en ambientes especializados puede ser < 1%.194 También se reportó mortalidad del 1% con un índice de colectomía del 29% (IC95%: 28-31%) en una revisión sistemática de 32 estudios (1.991 pacientes), y un porcentaje de eficacia del 67% (IC95%: 65-69%) (no discriminándose entre respuesta completa y parcial).195 Estos hallazgos convalidan la respuesta a los corticoides observada en el estudio emblemático de Truelove y Witts.
Tradicionalmente (aunque actualmente con evaluación más precoz) se han administrado esteroides sistémicos intravenosos a dosis de 1 mg por kilo de peso 5 a 7 días (metil prednisolona 60 mg o la modalidad de indicación que es más habitual en nuestro centro, hidrocortisona 400 mg (que pueden dispensarse indistintamente en infusión continúa o fraccionada).111 La extensión del tratamiento después de los 7 a 10 días sin una decisión alternativa no solo no reporta beneficio, sino que no ofrece una alternativa diferente de la falta de respuesta, afectando la seguridad del paciente.
Debe recordarse que la enfermedad severa sin respuesta al tratamiento puede ser mortal. Según un conocido estudio de Järnerot publicado en 1974, los porcentajes acumulados de colectomía del plan tradicional de corticoides intravenosos fueron: en la primera semana 21% con predominio en la enfermedad extensa, a 3 semanas 41%, a 3 meses 47%, a 3 años del 56%. Los índices de recurrencia en el 1er año fueron del 48%, decreciendo en el 2do y 3er año subsiguientes a un 14% por año.196
Actualmente, se considera relevante evaluar los parámetros de severidad del paciente (síntomas, laboratorio, marcadores de inflamación predictivos) precozmente (a los tres días), y evaluar la condición para otras medidas terapéuticas de rescate, a fin de llevar a cabo tal indicación dentro de los primeros 5 días.197
El uso de esteroides intravenosos en el megacolon tóxico (definido como dilatación no obstructiva total o segmentaria del colon ≥ 5,5 cm asociada con toxicidad sistémica) es imperativo siempre que las heces se confirmen negativas para Clostridium difficile y no se sospeche una perforación. Se deben implementar medidas necesarias para apuntalar el estado clínico y considerar otras (estabilización de hidroelectrolitos, antibióticos, evaluación por un cirujano) y, sobre todo, seguir estrictamente al paciente tomando decisiones ágiles, sin que se pierda el momento de la oportunidad, e intentar salvar el colon mientras no se arriesgue la vida.198
◊ Corticoides por vía rectal
Desde hace décadas se disponía de preparaciones rectales de corticoides con alta biodisponibilidad sistémica (hidrocortisona 100 mg en enema, y menos comúnmente en espuma). Los estudios de comparación de eficacia en revisiones sistemáticas con enemas de mesalazina en general fueron favorables a esta última droga, pero en algunos pacientes se describió la situación inversa.199
La formulación rectal más difundida de los corticoides no sistémicos consiste en 2 mg de budesonida en 100 ml de solución salina isotónica o en espuma. Se demostró mejoría en la CU leve moderada distal o izquierda en 40-55% de los casos tratados con enemas (la mitad en remisión completa), y con espumas también se observó eficacia clínica y endoscópica en un estudio de más de 500 pacientes, en ambos casos con muy buen perfil de seguridad.163, 200
d. Eficacia de los corticoides en la EC
◊ Corticoides orales de acción sistémica
La eficacia de los esteroides para la inducción de remisión en la EC se estableció por primera vez en dos grandes estudios. El estudio de la Nacional Cooperativo para la EC (NCCDS) “National cooperative Crohn’s disease study” (n = 162) utilizando 0,5 a 0,75 mg/kg/día de prednisona (dosis proporcional a la severidad) con disminución paulatina durante 17 semanas, que demostró una remisión del 60% en comparación con una remisión del 30% con placebo y reportó un NNT = 3.179 El Estudio Cooperativo Europeo para la EC – ECCDS European Cooperative Crohn’s Disease Study, (n = 105) informó una remisión del 83% con 6-metilprednisolona (1 mg/kg/día) en comparación con 38% para el placebo (NNT = 2).178
Además de documentar la buena respuesta obtenida a corto plazo, para evaluar a más largo plazo la historia natural del tratamiento con corticosteroides en la EC, al igual que en la CU, se realizó en el Condado de Olmsted, Minnesota, durante los mismos años (1970-1993), un estudio de cohorte de 173 pacientes que investigó la evolución a 1 mes y a 1 año posterior al curso de corticosteroides. Después de un mes, el 58% de los pacientes presentaron remisión completa, 26% presentaron remisión parcial y 16% no respondieron. Luego de un año de tratamiento, se observó respuesta prolongada en el 32% de los pacientes, esteroide dependencia en el 28% y el 38% debieron ser operados.110 Estos hallazgos revelaron que más de 2/3 de los pacientes requerirán intervenciones diferentes escalando la terapia (médica o quirúrgica) después de recibir corticosteroides.
◊ Corticoides orales de acción tópica
La budesonida con cubierta entérica de liberación ileocecal a dosis de 9 mg demostró beneficios consistentes para la EC activa ileal o ileoolónica, pero es menos efectiva que la prednisolona.201 Actualmente se prefiere budesonida a prednisolona si la distribución de la enfermedad es la requerida para esta formulación (enfermedad ileal terminal o ileocecal). A pesar de la eficacia de los esteroides en la inducción de remisión, se debe planificar precozmente una estrategia de control y tratamiento a largo plazo para mantener la remisión.187
◊ Corticoides intravenosos
Deben indicarse en el caso de actividad severa de la enfermedad, en las mismas dosis que se emplean en la CU.
c. Perfil de seguridad de los corticoides
Los efectos adversos de los corticosteroides en pacientes con EII están bien descriptos en el Estudio Nacional Cooperativo para el Estudio de la EC (NCCDS), observándose efectos adversos evidentes en más del 50% de los pacientes que recibieron tratamiento de inducción supresor con dosis altas (según el CDAI 0,5-0,75 mg/kg) y en aproximadamente un tercio de los pacientes que habían respondido y fueron seguidos con dosis bajas (0,25 mg/kg), que denominaron profilácticas. Requirieron reducción de dosis o discontinuación el 32% de los pacientes con altas dosis y el 26% de los pacientes con dosis bajas.202
Varios autores publicaron que la budesonida de liberación ileocecal en la EC se asocia con efectos colaterales con una frecuencia menor que con los esteroides sistémicos.201, 203 La prevalencia reportada por Rutgeerst fue del 33% contra el 55% para los corticoides sistémicos (p = 0,003) y se observó menor reducción de la densidad mineral ósea a 2 años.204 Otros autores observaron con budesonida una frecuencia similar de efectos adversos, pero menos severos que con prednisolona.205
El uso de corticosteroides en la EC puede asociarse con tres categorías principales de eventos adversos:
1) Los efectos precoces debido a dosis suprafisiológicas usadas para la inducción de remisión en EC activa incluyen: algunos de índole cosmético (acné, cara de luna llena, edema y estrías cutáneas), alteración del sueño y del humor, dispepsia o intolerancia a la glucosa.201
2) Los efectos asociados con el uso prolongado (habitualmente > 12 semanas, a veces menos) incluyen cataratas de localización subcapsular posterior, osteoporosis, osteonecrosis de cabeza del fémur, miopatía y susceptibilidad a infecciones. Respecto de las infecciones, se estudió el riesgo de infecciones postoperatorias en 159 pacientes con EII sometidos a cirugía electiva, reportándose un aumento del riesgo en los tratados con corticoides: odds ratio para cualquier y mayor infección 3,69 (IC 95%: 1,24-10,97) y 5,54 (IC 95%: 1,12-27,26), pero no en pacientes del mismo estudio tratados con tiopurinas.206
Estudios de cohorte que investigaron parámetros de seguridad demostraron que los esteroides por si solos, según fue observado por Lichtenstein y col. en el registro TREAT (The Crohn’s Therapy, Resource, Evaluation, and Assessment Tool), o la combinación de corticoides otros agentes inmunosupresores, aumentan el riesgo de infecciones graves.207-209
3) Los efectos durante el retiro de los corticoides incluyen insuficiencia suprarrenal aguda (por la suspensión brusca), un síndrome de seudorreumatismo (con mialgia, malestar y artralgia, similar a una recrudescencia de la EC) o aumento de la presión intracraneal.201
El retiro completo de los esteroides en los pacientes esteroide-dependientes es posible mediante la introducción oportuna de azatioprina y/o anti-TNF, tratamiento nutricional adyuvante (particularmente en pediatría) o cirugía cuando no ha habido adecuada respuesta a los algoritmos de tratamiento.
Se recomienda indicar tratamiento osteoprotector si la duración del tratamiento corticoide es mayor a 12 semanas, aunque algunos autores proponen suplementos de calcio y vitamina D en todos los pacientes, según algunos resultados de estudios prospectivos.210
3. Inmunomoduladores
a. Conceptos generales
Los inmunomoduladores usados en EII incluyen las tiopurinas (azatioprina [AZA] y mercaptopurina [6-MP]), metotrexato [MTX] e inhibidores de calcineurina (ciclosporina [CsA] y tacrolimus).
◊ Conceptos generales sobre tiopurinas
La azatioprina y mercaptopurina son análogos de las bases purínicas de los ácidos nucleicos, que funcionan como antimetabolitos alterando la síntesis de novo de purinas e inhibiendo la reproducción celular.211-218 La tioguanina (6-TG) es el metabolito final de ambas drogas, que tiene el principal efecto inmunosupresor terapéutico por incorporarse a las cadenas de ADN y producir apoptosis.218
◊ Metabolismo de las tiopurinas
Se adjunta un gráfico del metabolismo de las tiopurinas (Figura 6, Panel A).
La azatioprina es convertida por un mecanismo no enzimático (clivaje del anillo imidazol) a 6-MP en el hígado y en los hematíes.
La 6-MP sufre un proceso catabólico intracelular en los enterocitos y hepatocitos, pero no en el tejido hematopoyético (biodisponibilidad sistémica baja) donde la enzima xantino oxidasa (XO) la transforma en ácido 6-tioúrico y la enzima tiopurin metiltransferasa (TPMT) en el metabolito inactivo 6-metilmercaptopurina (6MMP).
El efecto terapéutico (mediado por la TG) resulta de una secuencia de procesos, donde por una vía anabólica competitiva la 6-MP es transformada por una enzima (hipoxantina-fosforibosiltransferasa: HPRT) en ácido 6-tioinosínico 5’monofosfato (6-TIMP), la que por dos vías que compiten da lugar a diferentes metabolitos activos:
1) el terapéutico 6-tioguanina nucleótidos (6-TGs) por la enzima inosin-monofosfato dehidrogenasa (IMPDH),
2) el potencialmente tóxico 6-metilmercaptopurina ribonucleótido (6-MMPR).
La TPMT es la enzima que cataliza la metilación de 6-MP y 6-TIMP. Como resultado de los efectos de la incorporación de 6-TG en las cadenas de ADN hay bloqueo de la activación de las células T, inhibición de la producción de linfoquinas y proliferación de clonas de linfocitos.211-218
Desencadenan una vía muy específica de apoptosis mitocondrial en el subgrupo de células T CD4+, que han sido enfrentadas repetidamente con antígenos específicos coestimuladas por un receptor (CD28). Tal apoptosis sería mediada por inhibición de una proteína: Rac1.218 La síntesis de novo de purinas se inhibe, ya que los ribonucleótidos metilados tienen efecto antimetabólico, contribuyendo también a la acción inmunosupresora.
De este balance entre 6-TG y 6-MMPR resultante de la competencia entre TPMT y otras vías enzimáticas depende la potencialidad mielotóxica de la TG, y ello detemina que la medición de estos metabolitos pueda utilizarse para monitoreo terapéutico.
Lo mencionado se debe a que en la TPMT hay diferencias genéticas que influyen en la eficacia y toxicidad de las tiopurinas. El gen de la TPMT, localizado en el cromosoma 6, tiene al menos 9 variantes alélicas (con diferencias étnicas), y las variaciones de su actividad funcional determinan la relación 6-TG y 6-MMPR, que debería estar en equilibrio. Según las características genéticas, los individuos pueden presentar (o no) alelos de baja actividad (TPMT*A, TMPT*2, TPMT *3B, TMPT *3C), que se combinan entre sí (formando fenotipos) ya sea dos de baja actividad, o uno de baja actividad con un alelo de alta actividad (salvaje o normal).
La presencia en un individuo de un fenotipo con uno o dos alelos de baja actividad resulta en conversión preferencial a 6-TG alterando el mencionado balance, con riesgo variable de mielosupresión.
En la población caucásica hay 89% de homocigotos para la forma salvaje (normales), el 11% son heterocigotos para un alelo de baja actividad y el 0,3% presentan dos alelos de baja actividad (homocigotos recesivos o heterocigotos compuestos según sean iguales o diferentes los alelos de baja actividad).211, 212, 214, 216
Se investigó que tres fenotipos condicionan las dosis del tratamiento y tempranamente se aconsejó:
1) actividad TPMT normal: manejarse con dosis normales,
2) actividad intermedia (manejable con la mitad de las dosis habituales),
3) actividad baja o ausente: se desaconseja el tratamiento con tiopurinas por alto riesgo de mielosupresión. Por lo tanto, la determinación de los polimorfismos de TPMT y de los niveles de metabolitos 6-TG y 6-MMPR se utilizan para determinar la dosis a indicar, y monitorear si la droga se encuentra en rangos de eficacia, riesgo de toxicidad de la médula ósea y/o hepatotoxicidad, o si la dosis es insuficiente (no adherencia).214- 216
Se adjunta una figura que sumariza la influencia de los genotipos de la TPMT en las dosis requeridas de tiopurinas (Figura 7).
La probabilidad de respuesta se incrementa signifivativamente cuando los niveles de tioguanina (6-TGN) están 235-450 pmol/8 × 108 eritrocitos.
Se identificó así a un grupo de pacientes con niveles elevados de 6-MMPN (> 5700) y bajos de 6-TG < 230 (considerando las unidades ya referidas para la determinación) asociados a resistencia al tratamiento y potencial hepatotoxicidad, y a un grupo de pacientes refractarios que a pesar de altos niveles de 6-TG no responden y requieren cambio de tratamiento. Se adjunta un gráfico que ilustra la interpretación de los valores de los metabolitos de 6-tioguanina y 6 mercaptopurina (Figura 6, Panel B).
En síntesis, las aplicaciones prácticas son:
1) el genotipeo puede identificar los pacientes en alto riesgo de mielotoxicidad en los que el tratamiento con azatioprina o 6-mercaptopurina está contraindicado (homocigotos de baja actividad o heterocigotos compuestos), y 2) los heterocigotos con un alelo de baja actividad requieren dosis más bajas. Este tipo de toxicidad TPMT dependiente suele evidenciarse tempranamente, en el primer trimestre de la administración de las tiopurinas.
Sin embargo, debe tenerse en cuenta que en los pacientes tratados con estas drogas existen otras causas de mielotoxicidad diferentes de la TPMT (generalmente de más tardía presentación que las dependientes de la TPMT) y que el monitoreo de los recuentos de glóbulos rojos y leucocitos no debe obviarse.211-217
La tiopurinas son drogas ampliamente indicadas, y muy útiles, pero deben utilizarse bajo estricto control por sus potenciales efectos adversos, siendo el más destacable la depresión medular, en general dosis dependiente (2%), que puede condicionar infecciones.
El peso molecular de la azatioprina es 55% del 6-MP y el 88% de la AZA es convertida a 6-MP, por lo que la dosis se indica en relación con el peso. Por lo tanto, las dosis terapéuticas, de no mediar las anomalías genéticas descriptas son 2 a 2,5 mg /kg de peso para la azatioprina y 1 a 1,5 mg/kg de peso para 6-MP, lo que contribuye al empleo de un factor de conversión de dosis desde azatioprina a 6-MP de aproximadamente 2,08 si se asume 100% de biodisponibilidad oral. En términos de practicidad, la dosis de AZA es aproximadamente igual al doble de la dosis de 6-MP.
Es relevante considerar que su efecto terapéutico recién se observa generalmente a los 3 meses (tiempo medio), por lo tanto, estos fármacos no tienen indicación en ataques severos o en pacientes intolerantes a corticoides.215
Se recomienda el uso por un tiempo medio a prolongado; sin embargo, no existe actualmente consenso universal sobre la duración óptima del tratamiento de mantenimiento con tiopurinas en EII.219
Adicionalmente es relevante conocer que el ácido tioinosínico se inactiva por la xantino-oxidasa, a su vez inhibida por el halopurinol, concepto de gran importancia porque su coadministración puede potenciar la mielotoxicidad.219
El último aspecto mencionado puede ser también utilizado para optimizar el tratamiento con tiopurinas en aquellos pacientes que no responden por tener una derivación preferencial a los metabolitos de 6-metilmercaptopurina; en dichos pacientes el halopurinol puede constituir una herramienta eficaz para desplazar el metabolismo hacia la vía metabólica de eficacia terapéutica 6-tioguanina, pero para utilizar este mecanismo es importante contar con el dosaje de los metabolitos, ya que se requiere disminuir las dosis de tiopurinas adecuadamente, porque el riesgo de mielotoxicidad se potencia por el halopurinol.220
Cabe señalar que en nuestro país no está disponible la determinación de los metabolitos de las tiopurinas para ajustar las dosis del tratamiento, y respecto de los genotipos de TPMT que se utilizan al inicio del tratamiento, la determinación de los alelos de baja actividad solo está disponible en escasas instituciones, con acceso de alto costo y no cubiertos por el sistema de salud, a excepción del Hospital Garraham, destinada solo a pediatría.
◊ Conceptos generales sobre metotrexato
Se utiliza generalmente en escenarios similares a las tiopurinas en la EC, habitualmente por vía parenteral. Los metabolitos poliglutamatos del metotrexato inhiben la dihidrofolato reductasa, pero este efecto citotóxico no explica su efecto antiinflamatorio.
Probablemente la inhibición de la síntesis de citoquinas y eicosanoides con modificación de los niveles de adenosina contribuya en gran parte a este efecto.
El uso de este fármaco se tratará más extensamente al referirnos a su uso en ambas enfermedades.221
◊ Conceptos generales sobre inhibidores de la calcineurina (ciclosporina, tacrólimus):
Se cree que el mecanismo de acción de los inhibidores de la calcineurina es el resultado de la inhibición de la traslocación nuclear del factor de transcripción del factor nuclear de células T activadas NFAT (Nuclear factor of activated T-cells), impidiendo así el inicio de la transcripción de la cascada de las citoquinas por las células T.
La ciclosporina presenta un rápido inicio de acción y es efectiva para el manejo de la CU severa.222
b. Resumen de aspectos relevantes de tiopurinas, metotrexato e inhibidores de calcineurinas en EII (Tablas 47, 48 y 49).
Tabla 47. Aspectos y conceptos relevantes sobre tiopurinas en EII.
c. Eficacia de los inmunomoduladores en la colitis ulcerosa.
◊ Eficacia de las tiopurinas en la CU
Pese a una amplia utilización de estas drogas en la EC, la posibilidad de tratar a los pacientes no respondedores mediante colectomía y reconstituir el tránsito con pouch ileal y anastomosis ileoanal (IPAA: Ileal Pouch Anal Anastomosis) demoró la realización de estudios relacionados con la eficacia de estas drogas. Ello se debe a que esta técnica en principio fue considerada una buena alternativa curativa para la CU. Sin embargo, se describieron progresivamente complicaciones a corto y largo plazo asociadas con el IPAA, cuyo tipo y magnitud demostraron la necesidad de buscar alternativas no quirúrgicas.
El metaanálisis de Gisbert y col. incluyó 30 estudios no controlados en CU con pacientes que recibieron AZA/6-MP (n 1632), demostrando una eficacia media del 65% para inducción y del 76% para el mantenimiento de la remisión. Esta revisión sistemática también analizó 7 estudios controlados. De ellos, en la prevención de la recurrencia, se incluyeron 6 estudios (124 pacientes tratados con tiopurinas con una eficacia media del 60%, que comparado con el 37% en controles placebo o 5-ASA fue significativamente superior (OR = 2,56; IC95%: 1,51-4,34). El análisis de los estudios que solo usaron placebo versus AZA/6-MP resultó en un OR de 2,59 (IC95%: 1,26-5,3), con un NNT de 5 y una reducción del riesgo absoluto del 23%. En la inducción de remisión estudiada en cuatro estudios controlados (89 pacientes tratados con tiopurinas) no se detectó diferencia con los controles (73% versus 64%, respectivamente OR = 1,59; IC95%: 0,59-4,29).223
También se observó una ventaja de las tiopurinas en comparación con placebo para el mantenimiento de la remisión (OR = 0,41; IC95%: 0,24-0,70) en una revisión sistemática Cochrane realizada con 4 estudios (286 pacientes).224 Asimismo, Ohno K y col. demostraron resultados significativos en el mantenimiento en otra revisión sistemática, informando para placebo OR 2,31 (IC95%: 1,57-4,56) y para 5- ASA o placebo 2,26 (IC95%: 1,27-4,01), NNT: 6 pacientes, para la prevención de recurrencia. No se demostraron beneficios en la inducción de remisión comparando AZA versus placebo, OR 1,45 (IC95%: 0,68-3,08). (Revisados desde 1966 a marzo 2003 MEDLINE database, Cochrane Library, 2003 issue 1, y desde 1981 a marzo de 2003, Japana Centra Revuo Medicina database).225
Un estudio aleatorizado en CU dependiente de esteroides demostró que la AZA (2 mg/kg/día) fue significativamente más efectiva que la mesalazina oral (3,2 g/día) en lograr la remisión clínica y endoscópica.226 Entre los pacientes que recibieron AZA, el 53% logró remisión clínica y endoscópica libre de esteroides después de 6 meses, en comparación con el 21% con mesalazina (IP = 4,78; IC95%: 1,57-14,5).226
Un análisis de 83 sujetos con CU dependiente de esteroides del registro de EII del hospital Udaondo (2006-2010) mostró que el riesgo de colectomía después de cinco años de seguimiento fue del 27%, lo que consideramos una tasa de eficacia interesante para este subgrupo de pacientes, dado que, en su mayoría, de no mediar este tratamiento, hubieran sido sometidos a cirugía. Después de 5 años, el 29% de los pacientes con mejoría clínica requirió ≤ 2 cursos estándar de esteroides no prolongados mientras que el 5% requirió cursos intermitentes (≥ 3). El 30% de los pacientes pudo suspender los esteroides, recibiendo ocasionalmente tratamiento tópico con enemas o supositorios. En este grupo de pacientes incluidos en la era prebiológica para la CU, que usaron el corticoide como puente, por su dependencia, el tiempo medio hasta la suspensión de los esteroides fue de 4,7 (SEM 0,8) meses.227
Los datos de un prestigioso Centro de EII (Hospital John Radcliffe, Oxford) en la descripción de la experiencia de 30 años de seguimiento en 622 pacientes con EII (1968 – 1999) revelaron que los predictores de remisión más comunes fueron el recuento de glóbulos blancos (RGB) o de neutrófilos (p = 0,0001), un incremento del volumen corpuscular medio (p = 0,0001) y la edad avanzada (p = 0,05).228 Tales factores pronósticos hematológicos fueron significativos en nuestro estudio de seguimiento.
◊ Eficacia del metotrexato en la CU
Los estudios prospectivos sobre metotrexato para la CU se realizaron en muestras pequeñas de pacientes, y se usaron dosis o vías de administración diferentes, presentando resultados inconsistentes. Las revisiones Cochrane concluyeron que la evidencia existente no es suficiente. Los resultados de las comparaciones entre metotrexato y placebo, metotrexato y sulfasalazina, metotrexato y 6-mercaptopurina y metotrexato y ácido 5-aminosalicílico no avalan su uso en el mantenimiento de la remisión; los estudios resultaron de baja calidad para sacar conclusiones (previamente se había comparado la inducción de remisión versus placebo o comparadores activos con los mismos resultados).229
Se realizó un ensayo controlado randomizado multicéntrico (METEOR) comparando metotrexato vs. placebo en CU esteroide dependiente en 26 centros médicos de seis países que incluyeron el GETAID (Groupe d’Étude Thérapeutiques des Affections Inflammatoires Digestives) y la ECCO (European Crohn’s and Colitis Organisation) entre 2007 y 2013. El metotrexato parenteral (25 mg/semana IM o subcutáneo) por 24 semanas no fue superior al placebo para la inducción de la remisión libre de esteroides en pacientes con CU (31,7% vs. 19,6, p = 0,15) y no se demostró diferencia en la cicatrización mucosa. Sin embargo, se observó remisión clínica (no involucra la endoscopía) sin esteroides en un porcentaje significativamente mayor de pacientes con metotrexato que con placebo (a semana 16: 41,7% vs. 23,5% respectivamente, p = 0,04). El número de retiros del tratamiento debido a la CU activa fue menor, pero más pacientes con metrotrexato tenían náuseas y vómitos (21,7%) que en el grupo placebo (3,9%; p = 0,006).230
Otro estudio controlado con placebo para inducción y mantenimiento es el MERIT-UC se encuentra aún en curso.
◊ Eficacia de los inhibidores de la calcineurina en la CU
– Ciclosporina: Lichtiger y col., en 1990 (Mount Sinai Medical Center), trataron con esta droga por infusión endovenosa continua a dosis de 4 mg/kg durante 10 a 14 días a pacientes con colitis ulcerosa severa refractaria a 10 días de corticoides intravenosos, seguidos por ciclosporina oral 6 a 8 mg/kg/día durante 6 meses en los respondedores. La ciclosporinemia fue mantenida entre 400 y 600mg/l. Durante la fase precoz la respuesta fue del 80% con tiempo medio hasta la respuesta menor a una semana, mantenida en el 69% de los pacientes que continuaron con ciclosporina oral. El porcentaje de éxito global a 6 meses fue del 56%.56
Un estudio posterior randomizado de Lichtiger y col. se realizó también en pacientes que fracasaron con corticosteroides intravenosos luego de 7 o más días.231 Nueve de once pacientes tratados durante 14 días con 4 mg/kg/día de ciclosporina respondieron mientras que los 9 pacientes con placebo no lograron la mejoría (IR = 0,18; IC95%: 0,05-0,64). Al final del estudio la disminución media del score clínico en la actividad en el grupo de ciclosporina fue significativamente mayor que en el grupo placebo. El 27% de los pacientes en el grupo de ciclosporina requirieron colectomía en comparación con 44,4% en el grupo placebo. Algunos pacientes en el grupo placebo (n = 5) que no tenían respuesta y no requerían cirugía urgente cursaron posteriormente a administración abierta de ciclosporina durante un máximo de 14 días, demostrando respuesta. A pesar de estos hallazgos exitosos a corto plazo, el 55% de los pacientes (6 de los 11 randomizados a ciclosporina) requirieron cirugía dentro de los 6 meses.232
Por lo antedicho, la ciclosporina es un medicamento que se usa de puente como droga de rescate de la cirugía en la CU severa refractaria, pero se deben agregar tiopurinas para disminuir la tasa de colectomía a largo plazo. Ello fue demostrado, entre otros estudios, por los de la universidad de Chicago, reportando para pacientes rescatados con ciclosporina tasas de colectomía de 20% versus 45% según tuvieran o no seguimiento con tiopurinas respectivamente, en tiempo medio de 8,5 años.233 En el grupo de EII de Bélgica, 63% evitó la colectomía al año, pero en ese término, entre los pacientes que ya recibían azatioprina al momento de la ciclosporina fueron colectomizados el 88%, comparado con el 52% que inició la azatioprina al mismo tiempo que la ciclosporina.234 En un estudio retrospectivo del hospital San Giovanni Battista de Torino, respondieron 63% de 61 pacientes, de los que 61% permanecían libres de colectomía al año y 35% a 7 años respectivamente, pero comparando los que fueron y no fueron tratados con azatioprina los porcentajes fueron el 80% versus 47% al año y 60% versus 15% en los tratados con azatioprina (p = 0,0007 a 7 años).235
Otro estudio randomizado controlado con placebo fue realizado por D’Heans G y col. en 30 pacientes con monoterapia (infusión contínua de ciclosporina 4 mg/kg/día o metilprednisolona 40 mg/día). Después de ocho días en una segunda fase del estudio, respondieron 9/14 pacientes (64%) con ciclosporina versus con 8/15 (53%) con metilprednisolona. Los respondedores continuaron la misma medicación oral en combinación con azatioprina, y al año el 78% de los inicialmente controlados con ciclosporina mantuvieron la remisión versus el 37% de los tratados con metilprednisolona.236 El análisis combinado a partir de estudios controlados y no controlados demostró tasas de respuesta a ciclosporina endovenosa entre 76% y 85%.
Todo ello nos demuestra que la ciclosporina debe administrarse a los naïve de tiopurinas, para cambiar el pronóstico con tiopurinas en el largo plazo, a menos que se utilice como inducción de rescate y entre a un mantenimiento con una droga nueva que logre cumplir para el largo plazo, habiendo casos aislados de vedolizumab. Los hallazgos descriptos sugieren una mediana de tiempo hasta la respuesta de 4 días, lo que permite una colectomía oportuna en los pacientes sin respuesta. Respecto de las dosis, en otro estudio se aleatorizaron 73 pacientes a 2 mg/kg o 4 mg/kg de ciclosporina endovenosa.237 Las tasas de respuesta a 8 días fueron similares en ambos grupos (83% y 82% respectivamente), con necesidad de colectomía en el 9% en el grupo de 2 mg/kg y en el 13% en el grupo de 4 mg/kg. El grupo que recibió la menor dosis presentó un mejor perfil de seguridad.236
Aunque no todos los pacientes habían fracasado con corticosteroides endovenosos al ingreso, la dosis de 2 mg/kg/día se convirtió en la estándar usada en la práctica clínica actual con un bajo riesgo de colectomía en el corto plazo.237 Desde que los efectos adversos son influenciados por la dosis, cabe señalar que las concentraciones medias de ciclosporina al día 4 son menores que con 4 mg/kg. En respondedores que están bajo tratamiento oral se consideran satisfactorios niveles d150-250 ng/ml usando un radioinmunoensayo monoclonal.222, 237 La mejor estimación parecería corresponder a niveles máximos de 2 horas post-dosis (probablemente 700 ng/ml).238
– Tacrolimus: Este inhibidor de la calcineurina de acción similar a la ciclosporina fue investigado en la CU en un estudio randomizado versus placebo de 2 dosis de tacrolimus en 27/60 pacientes con colitis severa, sin observarse remisión, pero reportando respuesta parcial en 67% (4/6) de pacientes con niveles de 10-15 ng/mL, 50% (5/10) con niveles de 5-10 ng/mL y 18% (2/11) (p = NS). El consenso europeo considera este ensayo terapéutico deficiente en poder estadístico, pero señala que hay series que reportan resultados parecidos a la ciclosporina después de admininistrarlo intravenosamente (0,01 a 0,02 mg/kg) u oralmente (0,1 a 0,2 mg/kg), aunque también se discute que las poblaciones eran heterogéneas.238, 239 Nuestro grupo no ha usado tacrolimus. Opinamos que los reportes son de escasa muestra y aconsejamos que dado las posibles características pronosticas de la CU severa, y disponiendo en nuestro país de otras drogas, no se la use fuera del contexto de una investigación aprobada por las autoridades regulatorias, especialmente en centros sin experiencia en el manejo de este fármaco y de la CU severa.
b. Eficacia de los inmunomoduladores en la enfermedad de Crohn
◊ Eficacia de las tiopurinas en la EC
Al igual que en la CU, en la EC se usan la azatioprina o la 6-MP. Debe notarse que debido al lento inicio de acción, habitualmente se hace necesario el uso de tratamientos concomitantes como puente, durante aproximadamente tres meses, para el control de la enfermedad. Una revisión de Cochrane de la eficacia de azatioprina y 6-MP para la inducción de remisión en EC activa demostró beneficio para las tiopurinas en comparación con placebo, reportando un OR de 2,36 (IC95%: 1,57-3,53), con un NNT de 5.240 Respecto de la evaluación efectos adversos, el NNH (por sus siglas en inglés, number needed to harm) reportado en el mencionado estudio fue de 14. Debido a la demora en el inicio de acción, la tasa de respuesta fue mayor en estudios que duraron más de 16 semanas (NNT = 4).
Un metaanálisis realizado tempranamente por Pearson y col. evaluó el impacto de azatioprina y 6-MP en la inducción y mantenimiento de remisión. En 367 pacientes con EC activa se observó beneficio estadísticamente significativo con un OR de 3,09 (IC95%: 2,45-3,91). En 319 pacientes con EC quiescente se observó eficacia en el mantenimiento de la remisión, reportándose un OR de 2,27 (IC95%: 1,76-2,93), como también en el cierre de fístulas, que result¬ó en un OR 4,44 [IC 1,50 a 13,20).241 Present y col. reportaron cicatrización de fístulas en el 31% de los pacientes con EC tratados con 6-MP versus 6% en el placebo.242
También con respecto al mantenimiento de la remisión, otra revisión sistemática que incluyó siete estudios con azatioprina y uno con 6-MP reportó beneficio: OR = 2,32 (IC95%: 1,55-3,49) para azatioprina y 3,32 (IC95%: 1,40-7,87) para 6-MP.243 Cabe señalar que un número importante de pacientes que recibieron azatioprina para el mantenimiento de la remisión suspendieron la medicación debido a intolerancia, en comparación con placebo (OR = 3,74; IC95%: 1,48-9,45).
Sandborn y col. evaluaron el efecto de administración de dosis intravenosas de impregnación de azatioprina (50 mg/h por 36 horas: 1800 mg) en seis pacientes con EC activa tanto clínica como endoscópicamente. Cuatro pacientes que lograron remisión clínica en la semana 16 presentaron mejoría endoscópica; tres presentaron curación endoscópica completa otro paciente mejoró clínicamente. En otros 6 pacientes con Crohn fistulizante (13 fístulas), con el mismo tratamiento, observaron remisión (7/13 a semana 4) o mejoría transitoria o definitiva en otras 4 a diferentes tiempos.244 Sin embargo, posteriormente, en un similar intento de acelerar el inicio de acción, la eficacia de dosis altas se evaluó en un estudio randomizado administrando azatioprina (40 mg/kg) por infusión de 36 horas (n = 51) seguidas de azatioprina oral por 16 semanas versus placebo (n = 45), suspendiendo la prednisona en 5 semanas. En la semana 8, 25% de los pacientes lograron la remisión (objetivo primario) con azatioprina versus 24% en el grupo placebo, lo que no fue más efectivo que la estrategia oral tradicional.245
Peiryn-Biloulet y col. evaluaron en un metaanálisis la azatioprina y 6-MP en la recurrencia posquirúrgica clínica y endoscópica a 1 y 2 semanas en comparación con placebo con y sin tratamiento de inducción antibiótica y mesalazina. El resultado del estudio fue que los pacientes tratados con tiopurinas mostraron mayor eficacia en la prevención de la recaída clínica posoperatoria que los controles a 1 año (diferencia 8%, IC95%: 1-15%; p = 0,021; NNT = 13) y a 2 años (diferencia = 13%, IC95%: 2-24%; p = 0,018; NNT = 8). La eficacia fue mayor a la del placebo al año (diferencias en recurrencia clínica IC95%: 13, 1.8-25%, = 0,025, NNT = 7, y endoscópica 23%, 9-37%, p = 0,0016, NNT = 4 respectivamente, la última fue en la recurrencia endoscópica severa (i2-4): diferencia media 15, IC95%: 1.8-29, p = 0,026, NNT = 7, pero no en la muy severa (i3-4). Los efectos adversos condujeron al abandono en el 17,2% con tiopurinas vs. 9,8% en controles p = 0,021).246
Las tiopurinas también se han asociado con curación mucosa en EC (De Cruz y col., 2013).247 En un escenario postoperatorio, D’Haens y col. siguieron a 19 pacientes con recurrencia postoperatoria de enfermedad ileal refractaria a esteroides con lesiones severas, tratados con azatioprina como mantenimiento después del retiro de esteroides durante al menos 6 meses. De los pacientes que lograron remisión clínica y fueron reevaluados con endoscopía o radiología (n 15) se observó cicatrización completa de las lesiones microscópicas en el 40%, casi completa en el 33% y parcial en el 20%.248
◊ Eficacia del metotrexato en la EC
Se adjunta un sumario de conceptos relevantes sobre metotrexato (Tabla 48). Las indicaciones son similares al tratamiento con tiopurinas, pero actualmente el metotrexato es menos usado, reservándose generalmente para el tratamiento de la EC activa o recurrente en aquellos pacientes refractarios o con intolerancia a las tiopurinas o agentes anti-TNF.249
Un estudio controlado con placebo demostró que el 39% de los pacientes dependientes de esteroides con EC activa que recibieron 25 mg/semana de metotrexato intramuscular (dosis indicada para la inducción de la remisión) en adición a prednisolona (20 mg diarios al inicio) pudieron suspender los esteroides y presentaron remisión en comparación con el 19% en la rama placebo p = 0,0025, a las 16 semanas, disminuyendo el CDAI a la 4ta semana.250 Hubo un 17% de pacientes que suspendieron el tratamiento por efectos adversos versus 2% de los que recibieron placebo.
Este beneficio de la droga se confirmó en una revisión sistemática.251 Por tanto, la dosis mencionada de metotrexato (25 mg/semana) es la estándar avalada por la evidencia para inducción de remisión.
Se demostró una reducción significativa de los niveles del medicamento y variabilidad en la absorción oral de metotrexato en comparación con la administración subcutánea.252 Este es el motivo por el cual la administración parenteral parece ser más efectiva.253 A pesar de que por motivos prácticos la administración oral es más conveniente y preferida por los pacientes, no existe evidencia que avale esta estrategia. Aun así, si se intenta, se debe monitorear cuidadosamente la respuesta clínica.
La utilidad en el mantenimiento de la remisión fue estudiada por Feagan en 76 pacientes tratados con 15 mg por semana por vía IM por 10 meses observando eficacia en el 65% con metotrexato versus 39% tratados con placebo p = 0,0015, pero no pudo ser avalado en metaanalisis por ser el único estudio estadísticamente significativo.254
Mahadevan y col. en un estudio retrospectivo reportó respuesta en 62% de 37 cursos de tratamiento con metotrexato en 33 pacientes con Crohn luminal y/o fistulizante. En el Crohn fistulizante observó cierre completo en un 25% fístulas y cierre parcial en el 31%. Tuvieron efectos adversos significativos 6% de los pacientes.255
Lémann y col. en el año 2000 evaluaron el tiempo durante el cual se mantuvo la remisión en una población de los pacientes con alto porcentaje (85%) de falla o intolerancia a azatioprina, inducidos con metotrexato 25 mg IM semanalmente 6 meses o más, y seguidos durante 18 meses adicionales. El 71% de la población de estudio se mantuvo en remisión durante 1 año y un 52% 3 años, aunque algunos cambiaron a tratamiento oral.256
Con la intención de comparar si la combinación de metotrexato con infliximab potencia la eficacia del infliximab, se realizó en 126 pacientes un estudio doble ciego, controlado con placebo en pacientes con EC inducidos simultáneamente con prednisona dentro de las 6 semanas previas, en progresivo descenso. En la semana 50, un 30,6% presentó falla en el grupo de tratamiento combinado, en comparación con 29,8% en el grupo de monoterapia con infliximab, no demostrándose beneficio de combinar metotrexato con infliximab.257
Es recomendable tener en cuenta la administración concomitante suplementaria de folatos.258
◊ Eficacia de los inhibidores de la calcineurina en la EC
Se incluye un sumario de los conceptos relevantes de inhibidores de la calcineurina (Tabla 49). Los inhibidores de la calcineurina son de valor limitado para la EC.139 Un solo estudio reportó que la Ciclosporina A oral es eficaz para el tratamiento de la EC resistente o con intolerancia a esteroides. Después de dos meses, el 59% de los pacientes tratados con ciclosporina A mejoraron, en comparación con el 32% en el grupo placebo (p = 0,032).259 Otros tres estudios no confirmaron este hallazgo.260-262
Respecto a tacrolimus en la EC, en una revisión sistemática lograron criterios de inclusión 11 estudios con un total de 163 pacientes, de los cuales 127 pacientes fueron tratados con tacrolimus. Se investigó la eficacia de la administración sistémica (oral o intravenosa: dosis empleadas 0,1 a 0,2 mg/kg/peso) en Crohn luminal y en Crohn perianal, y de la administración tópica en Crohn perianal (ungüento 0,5 a 1 mg/g a dosis diaria de 2 g o no registrada). Las tasas de remisión y de respuesta (pool crudo) en Crohn luminal (70 pacientes en seis estudios) fueron 44,3% (rango: 7-69%) y 37,1% (rango 14–57%) respectivamente. En pacientes con Crohn perianal (49 pacientes procedentes de 8 estudios de los cuales 4 incluyeron solo Crohn perianal) los porcentajes de remisión y respuesta fueron 28,6% (rango: 0-64%) y 38,8% (rango: 0-57%) respectivamente.263 Los estudios que utilizaron tacrolimus tópico consistieron en subgrupos de pacientes (n total = 14) provenientes de 2 estudios de los 4 mencionados focalizados en Crohn perianal (ulceraciones y fístulas). Los porcentajes de remisión promediados alcanzan 35,7%, los de respuesta parcial 28,6% de respuesta parcial, reportándose mayor eficacia en las ulceraciones perianales que en las fístulas. Los efectos adversos no serios fueron comunes (temblor, parestesia y cefaleas) y se observó nefrotoxicidad reversible en el 16% de los pacientes.
Cabe señalar que en los estudios de tacrolimus en Crohn las muestras fueron pequeñas, con criterios de inclusión no homogéneos, duración variable del tratamiento (entre menor a 10 semanas con escasa respuesta a varios años), diferencias en la medicacicón concomitante, como así también se reportó variabilidad en los niveles séricos de droga. Si bien estos datos aislados sugieren alguna eficacia, se necesitan mejores estudios. La limitada experiencia con tacrólimus es insuficiente como para recomendar su indicación sistematizada para el tratamiento de la EC.139, 263 Nuestro grupo no tiene experiencia en el uso de tacrólimus.
C. Perfil de seguridad de los inmunomoduladores
◊ Seguridad de las tiopurinas
Como previamente se expresó, la azatioprina es una prodroga que se convierte en 6-MP, y luego se metaboliza al metabolito activo 6-tioguanina. Se deben monitorear cuidadosamente las dosis de azatioprina y 6-MP, por lo general en relación con los efectos potenciales de supresión de la médula ósea y hepatotoxicidad. Si bien la dosis blanco de azatioprina, como ya fue mencionado, es habitualmente entre 2 y 2,5 mg/kg/día y la de 6-MP es aproximadamente la mitad (1 a 1,5 mg/kg/día), la dosis “máxima tolerada” será diferente entre individuos, según el nivel en el cual se desarrolla la leucopenia (más frecuentemente observada) o la hepatotoxicidad. La leucopenia es un efecto colateral mielotóxico de las tiopurinas.
Según se expresó previamente al referirnos al mecanismo de acción, el fenotipo metabólico del individuo se puede definir por la medición de la actividad de la tiopurin-metiltransferasa (TPMT) o por el genotipo de la TPMT. En términos de seguridad debe recalcarse lo ya mencionado respecto de que las variantes genéticas de baja actividad de la TPMT pueden causar supresión medular potencialmente fatal en el caso de individuos homocigotos para estas mutaciones (0,35%) por presentar metabolismo de la tiopurina groseramente anormal, con exceso de metabolitos citotóxicos, alcanzando niveles muy elevados de 6-TG. Por otro lado, los heterocigotos para una mutación de baja actividad codominante (se recuerda que son alrededor del 11% de los individuos) requieren dosis intermedias.216, 264, 265
Mientras que la mencionada disminución de la actividad de la TPMT puede producir leucopenia, su aumento puede producir hepatotoxicidad, ambos dependientes de la dosis. Si bien los pacientes con baja actividad de la TPMT tienen ventaja estadísticamente significativa en el mantenimiento de la remisión, los efectos adversos (mielotoxicidad, alergias, intolerancia gastrointestinal) son más frecuentes cuando la actividad de la TPMT es baja.266
La evaluación de laboratorio de la TPMT se determinó obligatoria en el Reino Unido antes de indicar tiopurinas en niños y adultos jóvenes en un ensayo clínico de tratamiento con leucemia linfoblástica aguda y linfoma. La actividad fenotípica puede ser medida por métodos cromatográficos o radioquímicos.264 Por métodos cromatográficos los rangos reportados son: actividad normal > 21,0 EU/mL; actividad intermedia: 6,0-21,0 EU/mL; actividad baja < 6,0 EU/mL. (https://www.prometheuslabs.com/Resources/PTM/TPMT_Enzyme_Product). En un estudio que utilizó método radioquímico, los pacientes heterocigotos para un alelo de baja actividad expresaban niveles de actividad de la TPMT en hematíes < 16 U/mL de sangre.266 Los que tenían actividad más alta que el promedio (≥ 12 U/mL) fueron los más refractarios, por lo que habitualmente respondían con niveles más altos de 6-tioguanina nucleótido).266 Los puntos de corte entre homocigotos dominantes y heterocigotos (actividad intermedia) pueden variar con la metodología usada para determinarlos.
Dado que la actividad enzimática o el genotipeo se realizan con igual objetivo (seguridad y mayor rapidez de alcanzar dosis efectivas), algunos autores recomiendan elegir el genotipeo como test primario (si bien la garantía no es absoluta por la posibilidad de un raro alelo), sugiriendo que con la sola determinación fenotípica de la actividad, el riesgo de no detectar un paciente TPMT deficiente es mayor (11%).264 Sin embargo, otros autores sugieren que la actividad es mejor predictor que el genotipeo, siempre que no exista como factor de error una transfusión reciente, ya que la medición se expresa en mL de sangre.267-268
Respecto de ello, Deshpande y Abreu proponen chequear la actividad de la TPMT considerando a) si es baja, iniciar una terapia alternativa, b) si es intermedia, iniciar a 1mg/kg para 6-MP y 2 mg/kg para azatioprina monitoreando los valores de recuento celular del hemograma en semanas 3, 6, 9 ya que la frecuencia de la severa inmunosupresión decrece más allá de las 8 semanas y, si no hay problemas, luego menos frecuentemente, c) si es alta, sugieren iniciar 6-MP/AZA a más alta dosis, con similar monitoreo hematológico.268
Según lo previamente comentado, los valores apropiados para 6-TGN están entre 230 y 400 pmol/8×108 eritrocitos y para 6-MMPN son los > 5700 pmol/8 × 108 eritrocitos (detectable desde 273), combinación que demuestra estar en rango terapéutico y además en bajo riesgo de mielotoxicidad y hepatotoxicidad respectivamente.
Un metaanálisis de 43 estudios demostró una fuerte correlación entre niveles de 6-TGN > 230–260 pmol/8 × 108 eritocitos y remisión clínica (OR = 3,27).269 Otra forma de interpretación 6-MMPN/6-TGN es usar la relación (radio) para interpretar la vía predomínate en un paciente en particular.270
Deshpande y Abreu, basándose en estos conocimientos, proponen un algoritmo de chequeo de tales metabolitos a tres semanas (una vez establecido el tratamiento con tiopurinas), estableciendo además la relación entre ambos (6-MMPN/6-TGN) como indicadores de riesgo y tipo de efectos adversos, dosis insuficiente/adherencia, refractariedad. En el curso del tratamiento son reconocidos útiles los mismos parámetros.
Estos autores se basaron en que los pacientes con una relación muy alta 6-MMPN/6-TGNN (alta actividad enzimática TPMT) presentan más probabilidades de alcanzar niveles tóxicos de 6-MMPN antes de lograr niveles terapéuticos de 6-TGN y en ellos se deben considerar las terapias alternativas (por ejemplo, agentes anti-TNF o metotrexato) cuando no responden a AZA/6-MP.
En pacientes que tienen relación más baja (< 10-20), se podría escalar la dosis permitiendo el aumento de los niveles de 6-TGN y, por lo tanto, una mayor probabilidad de remisión clínica sin mayor riesgo de hepatotoxicidad.268, 270
Otro tema a considerar es que la hepatotoxicidad no depende exclusivamente de los niveles de 6-MMPR, ya que cerca del 90% de los pacientes con MMPR > 5300 pmol/8×108 eritrocitos no presentaban hepatotoxicidad, por lo que la reducción de la dosis debe reservarse para los que tienen enzimas hepáticas altas.268
Entonces, dosando los metabolitos el algoritmo aconsejado sería:268
I. 6-TG en rango, 6-MMP en rango: no mover las dosis de AZA/6-MP.
II. 6-TG baja, 6-MMP en rango o relación 6-MMP/6-TG < 10-15 “ aumentar dosis de AZA/6-MP.
III. 6-TG baja, 6-MMP alta o relación 6-MMP/6-TG ratio > 15 “ considerar cambio a metotrexato o anti-TNF.
IV. 6-TG en rango, 6-MMP alta “ igual dosis de AZA/6-MP a menos que las transaminasas estén elevadas, en ese caso considerar cambio a anti-TNF.
V. 6-TG baja, 6-MMP baja “ no adherencia, reeducar al paciente, no variar dosis de AZA/6-MP.
Estos autores también avalan la conducta de que, como previamente se comentó, el agregado de un inhibidor de la XO como alopurinol podría optimizar la 6-TGN y reducir la 6-MMPN en aquellos con metabolismo preferencial a 6-MMP, mejorando la respuesta, siempre que se dosen los metabolitos en términos de seguridad, y se baje la dosis.268
Sparrow reportó 20 pacientes no respondedores con altos niveles de 6-MMP en quienes indicando 100mg de alopurinol con dosis de azatioprina del 25 al 50% se produjeron cambios significativos: aumento de la 6-TGN y disminución de la 6-MMP, de corticoides, disminución del índice de Harvey Brashaw y normalización de enzimas hepáticas.220
Smith y col. reportan que con 100 mg de alopurinol y dosis de tiopurinas del 25–33% de la habitual, 20/25 pacientes con hepatotoxicidad toleraron la combinación normalizando las enzimas hepáticas, y que habiendo administrado la combinación en pacientes con subóptima respuesta con alta actividad (> 35) o efectos adversos que impedían aumentar la dosis, con hipermetilación predominante y alto radio 6-MMPN/6-TGN (> 11), lograron remisión en un total de 62% de 63 pacientes que completaron 1 año de tratamiento.271
Se adjunta un esquema de manejo para guiar la optimización de los no respondedores a las tiopurinas (Figura 8).
– Efectos adversos más comunes a corto plazo
Aproximadamente el 28% de los pacientes con azatioprina experimentan efectos colaterales.240 Los efectos secundarios más frecuentes son náuseas, vómitos, y malestar general (hasta en un 15%) para los que se recomienda administrar la droga de noche, y al inicio aumentar lentamente la dosis. Otros efectos secundarios comunes son cefalea, fatiga, anorexia, pérdida de peso, estomatitis, alopecia, artralgia, debilidad muscular y erupción cutánea (en más de 10% de los pacientes).272 Si hay artralgias/mialgias con AZA, se puede probar con mercaptopurina.272
El efecto secundario dependiente de la dosis importante de tiopurinas es la mielosupresión (2%-5%), que se observó en la cuarta parte de los casos después de un año.212, 272
La determinación de la actividad de la TPMT antes de comenzar tiopurinas puede prevenir mielosupresión temprana, pero la mielosupresión no es privativa de las fases iniciales del tratamiento sino que puede ocurrir en cualquier momento. Puede desarrollarse una leucopenia profunda en forma súbita e impredecible por los análisis hematológicos previos, aunque es infrecuente (asintomática 3%, severa con < 2000 leucocitos mm3 en el 1%).212 La leucopenia predispone a complicaciones. Sin embargo, las infecciones no necesariamente se asocian a leucopenia. La combinación con corticoides favorece las infecciones; las infecciones representan efectos adversos que pueden presentarse dentro de las primeras semanas o meses o durante la evolución a largo plazo, debiendo evitarse una linfopenia menor de 600/microlitro, ya que en particular < 250 CD4+ cel T /microlitro, y > 10 mg prednisolona son predictivos de infecciones.272, 273
La hepatotoxicidad (al rededor del 3%) puede consistir en una hepatitis precoz inducida por drogas, hiperplasia nodular regenerativa, dilatación sinusoidal o fibrosis (tardías, infrecuentes); la más frecuente no es idiosincrática sino dosis dependiente y responde al reducir la dosis, pudiendo reintroducirse o no según la evolución.212, 272
La pancreatitis es idiosincrática, también poco frecuente (0,5% a 4%), pero es importante porque tiene la característica de que recidiva con el tratamiento, impidiendo habitualmente la reintroducción de ambas formas de tiopurinas, como también ocurre en la hepatotoxicidad idiosincrática inducida por estas drogas.212, 272
Cómo controlar en nuestro medio los efectos adversos más frecuentes al introducir las tiopurinas
En condiciones de no disponibilidad de los métodos de estudio de polimorfismos o actividad de la TPMT, tanto la AZA como la 6-MP se deben introducir en una dosis baja con monitoreo hematológico (es decir, hemoglobina, recuento leucocitario, plaquetas, fosfatasa alcalina y enzimas hepáticas) semanal y aumento de dosis quincenal al inicio, hasta alcanzar la dosis de mantenimiento, espaciando los controles progresivamente. El mencionado es el protocolo que seguimos en nuestro centro, iniciando 6-mp a 25 mg/día y azatioprina a 50 mg/día.
Luego se debe continuar el monitoreo en forma mensual y posteriormente cada 2 meses durante todo el tratamiento. La necesidad de controlar la amilasa en pacientes asintomáticos no parece ser necesaria.212
No hay consenso universal respecto de los valores del laboratorio de rutina que deben ser tomados para reducir la dosis o suspender transitoriamente la medicación. Nielsen considera 3000 leucocitos/mm3, 120.000 plaquetas/3 y 50% de aumento de enzimas hepáticas para bajar la dosis o suspender transitoriamente. Present y col. reportaron en un estudio de toxicidad a corto y largo término de 396 pacientes con enfermedad inflamatoria intestinal que por encima de 3500 leucocitos es improbable la sobreimposición de infecciones.274 La Fundación Aragonesa para el Estudio y Apoyo a la EII publicó una guía de uso práctico de azatioprina (http://docplayer.es/43221292-Guia-de-uso-practico-de-azatioprina-en-la-enfermedad-inflamatoria-intestinal.html / info@arainf.es [www.arainf.es [Gomollón F y García Santiago, 2 de marzo, 2017]); ellos consideran que con 4000 leucocitos/mm3 (y neutrófilos > 1500) y las plaquetas por encima de 150.000 debe continuarse con iguales dosis. Además, si los leucocitos totales están por debajo de 3000 (o los neutrófilos < 1500), o las plaquetas por debajo de 100.000 mm3 se puede considerar una reducción de la dosis, al 50%. En valores entre esos dos extremos aconsejan adelantar el nuevo control analítico.
Coincidimos en que habría una zona gris donde se pueden toman conductas según el paciente y la evolución, aunque, en términos generales, en nuestro centro, por debajo de 3500 o 3800 mm3, optamos por confirmar el laboratorio y suspender por muy breve tiempo (pocos días) hasta que el paciente tenga 4500 leucocitos mm3, realizando luego pequeños ajustes de la dosis. Si está por debajo de 3000 leucocitos mm3 luego de suspender, interrogar y alertar al paciente por la posibilidad de infecciones, monitoreamos la evolución de los leucocitos, y al llegar a 4500/mm3, reinstauramos las tiopurinas bajando la dosis un 50% o más según la magnitud de la leucopenia y seguimos controlando. Intentamos mantener el paciente siempre con al menos 1500 neutrófilos.
En nuestra experiencia, es de frecuente observación que el paciente que baja los leucocitos refiera náuseas y un cansancio extremo, por lo que ante estos síntomas, si el laboratorio no es reciente, debería repetirse. También debe tenerse en cuenta que ante la suspensión de los corticoides puede desencadenarse la leucopenia.
Con esta política hemos tenido buena respuesta y seguridad, y debemos recordar que actualmente hay otras alternativas terapéuticas, por lo que si el paciente presenta una manifiesta intolerancia, no es adecuado empecinarse en que reciba estas drogas. Es importante recordar también lo ya mencionado respeto de la relación de la linfopenia con las infecciones, en especial en pacientes tratados con corticoides.272, 273
Respecto de las enzimas hepáticas, luego de corroborarlas, suspendemos transitoriamente cuando han aumentado a 2 o 2,5 veces lo normal, rápidamente descartamos otras causas, y si no las hubiera, restablecemos la droga a un 50% de la dosis inicial cuando han bajado aceptablemente. Como comentan los autores de aranif (los que toman conducta cuando las enzimas persisten elevadas a más de 2 a 3 veces lo normal o aumentan) observamos que es frecuente que luego se pueda subir la dosis. Si se encuentra colestasis (x 2) o ictericia o el aumento de las enzimas es considerable, se suspende el tratamiento. Se ha reportado que la mayoría de los pacientes que presentan hepatotoxicidad con azatioprima toleran mercaptopurina.275
No debemos olvidar de preguntar, ante mielosupresión, hepatotoxicidad o pérdida de respuesta, si el paciente ha experimentado cambios en el peso (recordando que la dosis es por kilogramo de peso, adaptada al genotipo del paciente) y si recibe medicaciones concomitantes.
Debe recordarse además que el tiempo medio de demora de la respuesta es alrededor de 3 meses, pero si fuera un paciente heterocigoto para TPMT incluyendo un alelo de baja actividad, es altamente probable que responda antes, requiriendo solo la mitad de la dosis, pudiendo presentar mielosupresión si no se controla. La disponibilidad de genotipeo, determinación de actividad de la TMPT y metabolitos aceleran el tiempo de introducción de la droga y permiten optimizar el tratamiento por mejor monitoreo de las dosis, la respuesta y la eventual toxicidad.
En caso de pancreatitis o reacciones anafilácticas idiosincráticas, en nuestro centro, no reintroducimos ni la misma droga ni la tiopurina alternativa.
– Efectos adversos a largo plazo
Si bien también pueden presentarse en las primeras semanas, las infecciones son un riesgo teórico de tratamiento a largo plazo como resultado de la inmunosupresión general, incluyendo infecciones virales tales como citomegalovirus, herpes zoster, hepatitis A y B, así como infecciones bacterianas, abscesos hepáticos, neumonía. Es importante destacar el riesgo de infecciones oportunistas potencialmente letales con corticoides, que es al menos tan alta y tal vez mayor que el de AZA o 6MP (ver prevención de infecciones en inmunosuprimidos).212
Se han observado bajo azatioprina formas mortales de varicela (por lo que está indicado vacunarse) y Epstein-Barr (EBV) con severo compromiso. En pacientes expuestos a tiopurinas, han sido reportadas infecciones primarias asociadas con linfohistiocitosis hemofagocítica.276, 277
Respecto de efectos adversos hematológicos diferentes de los descriptos, se reportaron la leucemia mieloide aguda y la mielodisplasia por tiopurinas muy raramente, con mayor frecuencia en pacientes con CU.276 En los últimos años se ha incrementado el estado de alerta sobre el riesgo de diversos tipos de malignidad en relación con las tiopurinas, algunas caracterizadas recientemente.
Se ha descripto que el riesgo de linfoma puede aumentar aproximadamente al cuádruple en términos de riesgo relativo en pacientes con EII tratados con tiopurinas. Tradicionalmente esto se ha atribuido a los medicamentos, a la gravedad de la enfermedad subyacente o a una combinación de ambos.278 El estudio CESAME (Cancers et Surrisque Associés aux Maladies Inflammatoires Intestinales en France) en 19.486 pacientes (60,3% EC y 39,7% CU o EII indeterminadas) de una cohorte nacional francesa de 680 gastroenterólogos mostró un riesgo aumentado para enfermedades linfoproliferativas entre los pacientes que recibieron tiopurinas en comparación con aquellos que nunca recibieron el medicamento HR de 5,28 (IC95%: 2,01-13,9; p = 0,0007).279 En un metaanálisis que incluyó 26 estudios, los investigadores estimaron que si bien el riesgo relativo es el mencionado, hay un bajo riesgo absoluto de linfoma asociado con tiopurinas (4 por 10.000 años-paciente).280
Se describen en la actualidad fundamentalmente tres tipos de linfomas asociados al tratamiento con tiopurinas, algunos de ellos asociados con infecciones por Epstein-Barr.276, 281, 282
1 – Linfomas “postrasplante like”: Se reportaron linfomas no Hodgkin en pacientes adultos expuestos a tiopurinas, relacionados con infección crónica latente por EBV. Dicho cuadro se produce debido a que el sistema inmune pierde el control de la proliferación de linfocitos B infectados por el EBV (linfomas responsables del aumento de cinco veces en el riesgo de los linfomas atribuibles a tiopurinas). Durante un período de 10 años de tratamiento, puede estimarse a partir de los datos CESAME que el riesgo acumulado de linfoma inducido por tiopurinas es de 0,4% por debajo de la edad de 50 años, 2% entre las edades de 50 y 65 años, y 4% después de 65 años de edad. El exceso de riesgo de estos linfomas atribuible a tiopurinas es reversible con la suspensión del tratamiento.276, 277, 279
2 – Linfomas posmononucleosis: este cuadro se produce en jóvenes menores de 35 años, con serología negativa para EBV. La prevalencia es de 3 en 1000 pacientes año. Se ha sugerido en lugar de tiopurinas el uso de anti-TNF y/o metotrexato en seronegativos para EBV.276, 277
3 – Linfoma hepatoesplénico de células T: es una forma agresiva de linfoma que se reportó en un pequeño número de pacientes jóvenes varones menores de 35 años (prevalencia 0,3 en 1000 pacientes año), que en general han recibido la combinación de tiopurinas y agentes anti-TNF durante más de 2 años,281-283 por lo que, adaptando los criterios al paciente individual, se aconseja tener en cuenta este riesgo al indicar tratamiento combinado en esta población.276
Sin embargo, debe considerarse que las complicaciones de la EII secundarias a una enfermedad no controlada (infecciones graves secundarias a lesiones intestinales, desnutrición, cánceres relacionados con la inflamación crónica sostenida, eventos tromboembólicos) están asociados con un exceso de mortalidad, riesgo que eventualmente puede ser mayor que el riesgo de la azatioprina.
Además es importante tener en cuenta que si se generan elevadas concentraciones de tioguanina la mielosupresión es mayor, con posibles mayores efectos adversos como infección y linfoma, y ello debe ser considerado en especial si el paciente es un buen respondedor tempranamente, al que podría llevarse a menores dosis sin afectar la respuesta (se describe esto en los centros que pueden dosarse para concentraciones mayores de 550 pmol/8×108 eritrocitos, cuando 230 a 400 es adecuado).276 Trasladado a nuestras posibilidades (carencia de esas determinaciones), no deberíamos descuidar el control del grado de inmunosupresión, realizando los chequeos rutinarios del hemograma, para detectar la presencia de leucopenia excesiva e innecesaria.
Pero en el contexto de la enfermedad crónica, progresiva y discapacitante puede considerarse, sin embargo, lo que se ha publicado al respecto de que los beneficios superan el riesgo de linfoma en los primeros años de uso de tiopurinas.284
Louis y col. señalan que la mejor indicación de las tiopurinas sería monoterapia en EII no severa corticoideodependiente.276
En los pacientes que debutan más allá de los 65 años, la enfermedad suele ser más benigna, pudiendo considerarse la suspensión, pero recordando que si no es más benigna, los esteroides y los biológicos en esta población también implican un riesgo considerable.
Pese a que se sugiere considerar una suspensión electiva luego de la remisión sostenida por 5 años más allá de los 50 años, también debe considerarse el riesgo de recaída, y la necesidad de seguir al paciente con marcadores, endoscopía e imágenes. En general se aconseja que la medicación debería adaptarse a cada paciente según criterios clínicos, demográficos, biomarcadores, y que si no se pueden suspender los esteroides en el plazo de 3-6 meses, la terapia debe escalarse.276
El aumento de riesgo de malignidad relacionado con tiopurinas se describió recientemente. Con respecto a la asociación de la exposición a tiopurinas y tumores cutáneos, un estudio prospectivo del grupo de estudio CESAME que comprendió 14.986 pacientes con EII demostró que la exposición a este tratamiento (en curso o posterior al mismo) aumentó el riesgo de cáncer de piel no melanoma, aun después de los 50 años de edad.286 Por ello se aconseja control dermatológico y protección solar, aunque también se describió un exceso de riesgo en la población general de EII.
El riesgo del cáncer cervical está aumentado en la EII (entre otros factores se incluyen promiscuidad, tabaco, anticonceptivos) y aunque no está fehacientemente demostrado si se relacionan con las tiopurinas, se aconsejan controles. Se postuló relación con el HPV, al igual que ocurre en inmunosuprimidos por otras causas, por lo que se aconsejan exámenes ginecológicos anuales para detectar anomalías cervicales y respetar normas de prevención con vacuna para HPV previa a la inmunosupresión en mujeres jóvenes.277, 287-289 También se han relacionado con el HPV los cánceres localizados en región anal crónicamente inflamados por enfermedad de EC.277
El tratamiento de los pacientes con EII y un tumor maligno pasado o actual se ha vuelto más frecuente en la práctica diaria a medida que los inmunomoduladores se administran precozmente y prolongadamente en la EII.
Algunos autores sugieren extrapolar las guías de transplantados. Estas guías consideran tres grupos de cánceres divididos de acuerdo con la probabilidad de recurrencia, según una categorización en:290
1) Bajo riesgo (0%): tumor renal asintomático de hallazgo accidental, linfomas, testículo, cáncer de cuello uterino, tiroides.
2) Riesgo intermedio (11 al 25%): cuerpo uterino, colon, mama, próstata.
3) Riesgo alto (> 25%): vejiga, melanoma, cáncer de piel no melanoma, mieloma, cáncer de riñón sintomático.
En realidad, son pocos los autores que han publicado acerca de la conducta terapéutica en pacientes con cáncer previo y EII.
Lahaire D. aborda este tema, comentando que si bien las guías de tratamiento no recomiendan el uso de inmunomoduladores en pacientes que han tenido un tumor maligno en los últimos 5 años, y los médicos son reacios a utilizarlos por el riesgo de reactivar micrometástasis en estado latente, esto no tiene un adecuado sustento.
Este autor considera que la evidencia científica para evitar inmunomoduladores en pacientes con EII con cáncer previo es débil y debe decidirse en conjunto con el oncólogo con base en el riesgo-beneficio del tipo de cáncer del paciente individual y el tratamiento de la EII refractaria.291
Un reciente metaanálisis no demostró un aumento de la recurrencia con tratamiento inmunosupresor o anti-TNF, pero se necesitan estudios prospectivos para determinar los intervalos óptimos para el reinicio de las terapias con inmunosupresores para las personas con cánceres específicos, lo cual no está aún definido.292
Deben utilizarse normas de prevención, la mayoría de las cuales son similares que para los Anti-TNF. Antes de la introducción de inmunosupresores y biológicos deben cumplimentarse medidas de prevención aconsejadas por la ECCO y normas nacionales.
◊ Seguridad de metotrexato: la toxicidad precoz del metotrexato es principalmente gastrointestinal (náuseas, vómitos, diarrea y estomatitis) y puede limitarse mediante el uso concomitante de 5 mg de ácido fólico cada 2 o 3 días. La discontinuación del tratamiento por efectos adversos ocurre en un 10-18% de los pacientes tratados con esta droga.249
El uso de metotrexato está contraindicado durante el embarazo y es mejor demorar la concepción durante varios meses después de la suspensión del tratamiento.276
La hepatotoxicidad y la neumonitis son las principales preocupaciones a largo plazo. Un estudio de biopsias hepáticas en pacientes con EII que recibieron metotrexato demostró alteraciones solamente histológicas, a pesar de dosis acumulativas de hasta 5410 mg.293
El monitoreo con biopsia hepática no se justifica, pero si la TGO se duplica, es recomendable suspender el metotrexato hasta su normalización y recién después reintroducirlo. La prevalencia de neumonitis se estimó en 2-3 casos por 100 años-paciente de exposición, pero en series importantes no se reportaron casos.249
◊ Seguridad de inhibidores de la calcineurina en la EC: los efectos tóxicos más frecuentes que se asocian al uso de ciclosporina endovenosa son parestesias, hipertensión, hipomagnesemia, hipertricosis y cefaleas.294 Las toxicidades importantes son insuficiencia renal, infecciones, convulsiones, anafilaxia, y se ha descripto mortalidad (del 0 al 3,5%). Tanto la hipocolesterolemia (colesterol sérico menor a 120 mg/dl) como la hipomagnesemia (magnesio sérico menor a 1,5 mg/dl) aumentan significativamente el riesgo de convulsiones en pacientes tratados con ciclosporina endovenosa.295
Como se mencionó previamente, las dosis endovenosas bajas de ciclosporina (2 mg/kg/día) pueden asociarse con menores tasas de toxicidad.237
Los aspectos relevantes de los inmunosupresores en EII se presentan en las Tablas 47, 48 y 49.
4. Agentes biológicos
a. Anti-factor de necrosis tumoral. Conceptos generales
El factor de necrosis tumoral (TNF-a) es una citoquina proinflamatoria que presenta un papel relevante en la patogénesis de la EII. La producción de TNF-a en la mucosa intestinal, heces y suero se encuentra aumentada en pacientes con EII.296-298 Además, demostró efectividad en la colitis del cotton top tamarin, una especie de mono tití que desarrolla CU espontánea.299 Ello sustentó la hipótesis de bloquear esta citoquina con anticuerpos monoclonales dirigidos específicamente.300
En la Figura 9 se esquematiza la estructura de los diferentes Anti-TNF aprobados en EII.
El infliximab (Remicade®), adalimumab (Humira®) y golimumab (Simponi®) son anticuerpos monoclonales IgG1 contra el TNF, con potentes efectos antiinflamatorios. Se unen al TNF-a con gran afinidad y neutralizan la actividad biológica del TNF soluble y/o unido a la membrana, ejercen toxicidad celular directa a través de la lisis mediada por el complemento y/o citotoxicidad dependiente de anticuerpos, e inducen apoptosis.301-305
El infliximab y adalimumab están aprobados para el tratamiento de la CU y la EC y el golimumab hasta el momento solo para la CU. El infliximab es un anticuerpo monoclonal quimérico humano (75%) murino (25%) que se administra mediante infusión endovenosa. El adalimumab y golimumab son anticuerpos monoclonales recombinantes completamente humanos que se administran en forma subcutánea.301, 305
El certolizumab pegol (Cimzia®) es un fragmento de anticuerpo Fab humanizado pegilado dirigido contra el TNF (95% humano). Es humanizado recombinante IgG4. No contiene fracción Fc, por lo tanto no activa el complemento ni inicia la citotoxicidad dependiente del complemento, no tiene efecto proapoptótico. Este último agente está aprobado solamente para la EC, y se administra subcutáneamente.301, 305
Diversos estudios controlados demostraron la eficacia de estos agentes contra el TNF en la EII. En la EC, la evidencia actual avala el uso de infliximab y adalimumab en la enfermedad activa moderada a severa, en la EC refractaria a esteroides, EC dependiente de esteroides, EC con fístulas (fístulas internas o complicaciones perianales) y en la prevención de la recurrencia posquirúrgica.301-305
En la CU, la evidencia avala el uso de infliximab, adalimumab y golimumab en la actividad moderada a severa (refractaria y dependiente de esteroides). En la CU activa severa refractaria a esteroides intravenosos, el infliximab es efectivo como tratamiento de rescate.306, 307 Estos agentes también probaron su eficacia en varias manifestaciones extraintestinales de la EII.308, 309
Además, el infliximab y el adalimumab se han utilizado en la inflamación crónica del reservorio (pouchitis) y en las complicaciones de la EC de la anastomosis ileoanal con reservorio-ileal (IPAA) ya sea por una EC previamente conocida (aunque indicada infrecuentemente en EC por conocerse a priori una alta probabilidad de fracaso), o por una EC inadvertida prequirúrgicamente o por la aparición posquirúrgica de una EC de novo.310-313
En la Tabla 50 se sumarizan las indicaciones de los distintos anti-TNF en EII.
Los anti-TNF Etanercept y Onercept se investigaron en grandes estudios aleatorizados controlados con placebo en pacientes con EC. Los resultados publicados demuestran que no se observaron diferencias significativas entre estos medicamentos y el placebo para el manejo de la enfermedad e inducción de remisión.314, 315
b. Resúmenes de aspectos relevantes de los Anti-TNFs
Se sumarizan las indicaciones, forma de administración, optimización, y eficacia (Tablas 50, 51 y 52)
Se incluyen resúmenes de los resultados de estudios en CU y EC (Tablas 53 a 65).
Tabla 50. Indicaciones de los anti-TNF en EII.

Tabla 51. Forma de administración y optimización de los anti-TNF en EII.
c. Eficacia de los anti-TNFs en la CU
◊ Infliximab (Remicade®)
Se adjunta tabla que sumariza los ensayos clínicos controlados randomizados con infliximab (Tabla 52).
· La primera evidencia robusta de eficacia en la CU activa fueron los estudios pivotales controlados con placebo ACT1 y ACT2 (Active Ulcerative Colitis Trials 1 y 2) que demostraron el beneficio del infliximab sobre placebo en pacientes ambulatorios con CU activa moderada a severa después de presentar refractariedad o intolerancia a uno o más de los siguientes tratamientos convencionales: corticosteroides (incluyendo también dependencia), azatioprina o mercaptopurina.316 Se consideró adicionalmente solo en el ACT2 la refractariedad al 5-ASA como criterio de inclusión (Rutgeerts y col., 2005).316
Tabla 52. Eficacia del IFX en la Colitis ulcerosa. Evidencia en ensayos controlados randomizados.

El estudio ACT1 comparó infliximab 5 mg/kg, 10 mg/kg o placebo a las semanas 0, 2 y 6, y luego cada 8 semanas durante un año. Se logró respuesta clínica a las 8 semanas en el 69,4% (5 mg/kg) y 61,5% (10 mg/kg) de los pacientes y en el 37,2% en el grupo placebo (p < 0,001). Se logró remisión en el 38,8%, 32,0% y 14,9%, y curación mucosa en el 62,0%, 59,0% y 33,9% de los respectivos grupos de tratamiento antes mencionados. El ACT 2 fue un ensayo de diseño parecido, aunque según se comentó previamente el 26% de la población del estudio se incluyó por refractariedad al 5-ASA como agente único y el período de mantenimiento fue más corto. Las tasas de respuesta a la semana 8 para 5 mg/kg, 10 mg/kg y placebo fueron del 64,5%, 69,2% y 29,3%, observándose remisión en el 33,9%, 27,5% y 5,7% (p < 0,001) y curación mucosa en el 60,3%, 61,7% y 30,9% (p < 0,001) para los grupos de infliximab en comparación con placebo respectivamente.316
Una revisión sistemática de la eficacia de infliximab en la CU moderada a severa refractaria a corticosteroides y/o inmunomoduladores que incluyó siete estudios clínicos randomizados concluyó que este agente es efectivo en la inducción de remisión clínica, respuesta clínica, cicatrización mucosa y que una sola infusión de infliximab redujo la necesidad de colectomía evaluada a corto plazo (definido como 90 días).317 Previamente, a partir del año 2001, se habían realizado estudios abiertos generalmente de muestras pequeñas y resultados variables, que no fueron incluidos en revisiones sistemáticas.304
· Los estudios ACT1 y ACT2 también evidenciaron el beneficio del infliximab para el mantenimiento de la remisión en la CU. En el estudio ACT1, las tasas de remisión clínica en la semana 54 fueron del 34,7% (5 mg/kg), 34,4% (10 mg/kg) y 16,5% (placebo). En ACT 2, las tasas de remisión a las 30 semanas fueron del 25,6% (5 mg/kg), 35,8% (10 mg/kg) y 10,6% (placebo). Las proporciones de pacientes con remisión clínica sostenida en todos los plazos fueron del 19,8% (5 mg/kg) y 6,6% (placebo) a las 54 semanas en el ACT 1, y en el ACT2 a las 30 semanas 14,9% (5 mg/kg) y 2,4% (placebo). Las tasas de respuesta clínica y remisión fueron similares entre las subpoblaciones de pacientes que eran “refractarios a corticosteroides” y aquellos “no refractarios a corticosteroides”.316
Una revisión sistemática de Gisbert y col. evaluó no solo la inducción sino un más largo término (aproximadamente 9 meses), incluyendo en la revisión 34 estudios previos a enero del 2006 (n = 896). La tasa de respuesta global a corto término fue 68% (IC95%: 65-71) y de remisión 40% (IC95%: 36-44) y a largo término la respuesta fue 53% (IC95%: 49-56) y la remisión 39% (IC95%: 35-42) respectivamente.318 Los estudios controlados de infliximab versus placebo fueron 5 (separando ACT1 Y ACT2), observando para infliximab a corto término un beneficio para el infliximab en la respuesta (OR = 3,6; IC95%: 2,67-4,95; p < 0,001) y remisión (OR = 4,56; IC95%: 1,98-10,5; p < 0,001), NTT 3 y 4 respectivamente. Estos resultados se reprodujeron en el largo término: respuesta (OR = 3,4; IC95%: 2,52-4,59; p < 0,001) y remisión (OR = 2,72; IC95%: 1,92-3,83; p < 0,001), con NNT 3 y 5 (IC95%: 4-7) respectivamente.316, 318-321 Respecto de la comparación con esteroides el bajo número de estudios (2 abiertos randomizados de infliximab versus esteroides, uno de ellos de baja calidad) y el bajo número de pacientes no hicieron factible su inclusión formal en el metaanálisis.318
La incidencia acumulada de colectomía a las 54 semanas en los estudios ACT1, ACT2, y fuentes de datos asociados (provenientes de la extensión del estudio y uso de infliximab comercial) fue del 10% para infliximab y del 17% para placebo (p = 0,02; reducción absoluta del riesgo 7%).322
En el ACT1 se demostró que la cicatrización mucosa completa (subscores endoscópicos 0 y 1) se asoció en forma independiente con una menor tasa de colectomía (95% libres de colectomía a la semana 54, en comparación con el 87% y el 80% de los que tenían subscores endoscópicos de Mayo de 2 y 3, p = 0,0004 respectivamente) no observándose tal asociación en los pacientes que recibieron placebo (p = 0,47). Los recién mencionados son datos observados en un estudio post hoc de los ACT que reporta 6% de operados con infliximab y 11% de los pacientes con placebo.323
· Infliximab como rescate en CU severa refractaria: se demostró que el infliximab es un tratamiento de rescate efectivo y seguro en pacientes que experimentan un ataque agudo severo de CU que no responde al tratamiento convencional con corticosteroides endovenosos. Järnerot y col. diseñaron un estudio en el que fueron incluídos 45 pacientes con CU severa refractaria, randomizados para recibir infliximab (n 24) o placebo (n = 21) al día 4to del inicio del tratamiento con corticosteroides si cumplían los criterios de CU fulminante el 3er día, o en los días 6-8 si durante los días 5-7 cumplían los criterios de ataque agudo severo a moderado. El resultado fue que 7 pacientes (29%) en el grupo de infliximab y 14 pacientes (67%) en el grupo placebo requirieron colectomía dentro de los 3 meses después de la randomización OR = 4,9 (IC95%: 1,4-17; p = 0,017).321 Después de 3 años, requirieron colectomía el 50% (12/24) de los pacientes que recibieron infliximab y el 76% (16/21) de los pacientes que recibieron placebo (p = 0,012). De los ocho pacientes con remisión endoscópica al tercer mes, ninguno fue colectomizado, en comparación con el 50% (7/14) de los que no habían logrado remisión endoscópica (p = 0,02).324
– Infusiones de inducción aceleradas: se investigó en muestras pequeñas de pacientes con CU el efecto de infusiones aceleradas de infliximab sobre la evolución de los pacientes, en cuanto al requerimiento de colectomía:
· Gibson y col. analizaron retrospectivamente la eficacia del infliximab en 15 pacientes que recibieron las tres infusiones de inducción de infliximab (5 mg/kg) en 24, días seguidas de mantenimiento cada 8 semanas, en comparación con un grupo de 35 pacientes que recibieron inducción con infliximab estándar (0, 2, 6 semanas), seguidas de mantenimiento cada 8 semanas. A 3 meses del inicio del tratamiento con infliximab, significativamente menos pacientes necesitaron colectomía en la estrategia acelerada: 1/15 (6,7%) en comparación con el grupo de dosificación convencional: 14/35 (40%), pero no hubo diferencias en la tasa de colectomía a los 6 y 12 meses. Los mayores niveles de albúmina y el uso de la inducción acelerada se asociaron con la no necesidad de colectomía en un análisis multivariado. Los pacientes que lograron CRP ≤ 5 mg/L tuvieron una tasa de colectomía del 3,2%, frente a una tasa del 68,4% en los que no alcanzaron este nivel de control de la inflamación. Obviamente, se debe evaluar que la situación clínica no represente un riesgo de vida.325
· Govani y col. reportaron la evolución de 57 pacientes con CU severa tratados con IFX, de los cuales 17 recibieron una dosificación acelerada, consistiendo en una segunda dosis de infliximab 3 días después de la 1rª si la proteína C-reactiva (CRP) no había disminuido < 0,7 mg/dl. La tasa de colectomía de 90 días para la dosificación típica fue de 12,5% en comparación con el 47,1% entre los que recibieron la dosis acelerada (p = 0,01). Para aquellos pacientes que fueron sometidos a colectomía, la tasa de reingreso posoperatoria a 30 días fue mayor entre los que recibieron la dosis acelerada (57,1% vs. 20%, p = 0,29), pero las complicaciones posoperatorias fueron similares.326
· Hindryckx y col. realizaron una búsqueda sistemática sobre el posible beneficio de optimizar la inducción, incluyendo 76 estudios, y concluyeron que existe una tasa de depuración aumentada de infliximab en pacientes con CU aguda severa, sugiriendo que un régimen intensificado de dosis de infliximab con 1-2 infusiones adicionales en las primeras 3 semanas de tratamiento podría reducir la tasa de colectomía temprana (3 meses) hasta en un 80%, por lo que señalan la necesidad de un ensayo clínico comparando una optimización personalizada con el régimen convencional de inducción.327
– Ensayo clínico: terapia combinada con azatioprina
· Similar al conocido estudio SONIC en EC, el estudio UC-SUCCESS investigó en pacientes con CU moderada a severa la eficacia de monoterapia con infliximab, versus monoterapia con azatioprina versus infliximab + azatioprina combinados después de 16 semanas de tratamiento, en pacientes naïve para biológicos. Una proporción significativamente mayor de pacientes logró la remisión libre de esteroides a la semana 16 en la rama de la combinación infliximab + azatioprina (39,7%) versus infliximab monoterapia (22,1%, p = 0,017) y los que recibieron monoterapia con azatioprina (23,7%, p = 0,032). Se observó curación de la mucosa en la semana 16 en el 62,8% de los pacientes que recibieron infliximab + azatioprina, en comparación con el 54,6% que recibieron infliximab solamente (p = 0,295) y 36,8% con azatioprina (p < 0,05). En conclusión, la respuesta clínica y la cicatrización mucosa fueron mayores en ambos grupos con infliximab en comparación con azatioprina como agente único, observándose la mejor respuesta clínica en la terapia combinada.328
– Estudios comparativos entre Infliximab y Ciclosporina intravenosa como terapia de rescate
· El estudio CYSIF CYcloSporine versus InFliximab fue un estudio abierto, aleatorizado, controlado de 115 pacientes con CU severa (score de Lichtiger mayor a 10 puntos) que habían fracasado a 5 días de corticoides intravenosos, que comparó infliximab (5 mg/kg a semanas 0, 2 y 6) con ciclosporina intravenosa (2 mg/kg por día durante 1 semana seguida de ciclosporina oral hasta el día 98). En los respondedores se indicó azatioprina en el día 7.307 El parámetro principal de eficacia fue el fracaso del tratamiento, definido por la falta de respuesta clínica al día 7, recurrencia entre el día 7 y el 98, ausencia de remisión libre de esteroides al día 98, evento adverso grave que llevaba a la interrupción del tratamiento, colectomía o muerte. Al día 7, tuvieron respuesta el 86% de los tratados con ciclosporina y el 84% de los tratados con infliximab, no observándose diferencia significativa (riesgo absoluto de la diferencia 2% [IC95%: -11-15; OR = 1,1; IC95%: 0,4-3,3; p = 0,76]). El score de actividad (Lichtiger), en la primera semana disminuyó más rápido en los pacientes que recibieron infliximab que en los tratados con cicloporina. El tiempo medio de la respuesta clínica fue 5 días (IQR 4-7) en el grupo de ciclosporina y 4 días (3-6) en el grupo de infliximab (p = 0,12). Al día 98 se observó el fracaso del tratamiento en 35 pacientes (60%) en la rama de ciclosporina y en 31 pacientes (54%) en la rama de infliximab (diferencia absoluta del riesgo de 6% [IC95%: -7 a 19)]; p = 0,52). Fueron operados 17% del grupo tratado con ciclosporina y 21% de los tratados con infliximab. El tiempo hasta la colectomía fue similar (p = 0,60). Se observó curación de la mucosa al día 98 en el 47% de los randomizados a ciclosporina y el 45% de randomizados a infliximab, no diferenciándose significativamente ambos grupos. Tampoco hubo diferencia significativa en la tasa de eventos adversos serios, observados en 9 pacientes (16%) en la rama de ciclosporina y en 14 pacientes (25%) en la rama de infliximab. Los autores concluyeron que la ciclosporina no fue más efectiva que el infliximab en pacientes con CU aguda grave refractaria a corticoides endovenosos.307
– Se investigó posteriormente la evolución al seguimiento a largo plazo (mediana 5,0 años, IQR: 4,2-5,9) en los mencionados grupos. Las tasas de sobrevida libre de colectomía ± SD a 1, 2 y 5 años fueron 70 ± 6%, 65 ± 6% y 61 ± 7% respectivamente en los pacientes asignados al azar a ciclosporina y 70 ± 6%, 68 ± 6% y 65 ± 7% en los asignados a infliximab (p = 0,86). La mayoría de las colectomías fueron realizadas en el primer año después de la randomización (Laharie y col., 2015). Respecto de la sobrevida libre de colectomía, no hubo diferencia significativa según los tratamientos iniciales de ciclosporina o infliximab (61,5% vs. 64,7%; hazard ratio [HR]: 0,99). Se observó una tendencia a favor de infliximab en la variable sobrevida sin recaída o colectomía (HR = 0,65; p = 0,062). Como conclusión, en esta cohorte multicéntrica a largo plazo de seguimiento de los pacientes refractarios a esteroides, randomizados a ciclosporina o infliximab, se reportó que la sobrevida libre de colectomía no depende de tratamiento inicial y que ambas drogas tienen la misma eficacia y seguridad a largo plazo.329
– Una investigación más reciente fue el ensayo clínico CONSTRUCT, Randomised controlled trial. Comparison Of iNfliximab and ciclosporin in STeroid Resistant Ulcerative Colitis.330 Este estudio fue planeado considerando que si bien el infliximab y la ciclosporina fueron reconocidos de eficacia similar en el tratamiento de la CU aguda severa, no se disponía de una evaluación comparativa de su eficacia clínica relativa y de costo-efectividad. El ensayo, realizado en más en 52 hospitales de Inglaterra, Escocia y Gales, fue abierto, randomizado, pragmático, comparando ciclosporina con infliximab en pacientes con CU severa aguda resistente a aproximadamente 5 días de hidrocortisona intravenosa. Los pacientes fueron asignados aleatoriamente (1:1) para recibir ya sea infliximab (5 mg/kg infusión intravenosa a semanas 0, 2, 6) o ciclosporina (2 mg/kg por día mediante una infusión continua durante 7 días), seguido de ciclosporina oral (5,5 mg/kg/día) por 12 semanas. El estudio fue ciego para el jefe de la investigación y encargados del análisis, pero no para los investigadores locales y pacientes. El resultado primario fue la sobrevida ajustada a la calidad durante 12 a 42 meses, documentando el área bajo la curva (AUC) de los scores Crohn’s and Ulcerative Colitis Questionnaire (CUCQ) completado por los participantes al inicio del estudio, 3 meses y 6 meses, y luego cada 6 meses. Se reclutaron 270 pacientes, 135 se asignaron al grupo de infliximab y 135 a ciclosporina, incluyendo en el análisis del objetivo primario a 121 (90%) de los pacientes en cada grupo. No hubo diferencias significativas entre los grupos en la sobrevida ajustada a la calidad, ni entre los scores CUCQ, EQ-5D, o SF-6D. La prevalencia de colectomía fue similar (41% para infliximab vs. 48% para ciclosporina; p = 0,223; los tiempos medios hasta la colectomía fueron: 811 [IC95%: 707-912] días en el grupo de infliximab vs. 744 [638-850] días en el grupo de ciclosporina; p = 0,251). No hubo diferencias con respecto a serias reacciones adversas (16 reacciones en 14 participantes que recibieron infliximab vs. 10 reacciones en 9 pacientes que recibieron ciclosporina), serios eventos adversos o muertes. Los días de hospitalización fueron 10,33 (DS: 13,55) días para infliximab y 12,56 (DS: 10,72) días para ciclosporina.331
– Una revisión sistemática reciente (2016) realizada por Narula N y col. incluyó 16 estudios con 1473 participantes. Entre 3 estudios controlados incluidos no se observó diferencia significativa entre infliximab y ciclosporina en los porcentajes de respuesta al tratamiento y la prevalencia de colectomía a 3 o 12 meses. En los 13 estudios no controlados, el infliximab en comparación con la ciclosporina se asoció con tasas significativamente más altas de respuesta al tratamiento: OR = 2,96 (IC95%: 2,12-4,14) y menor requerimiento de colectomía a 12 meses OR = 0,42 (IC95%: 0,22-0,83), aunque las tasas de colectomía a 3 meses no demostraron diferencias significativas OR = 0,53 (IC95%: 0,22-1,28). No hubo diferencias significativas entre IFX y ciclosporina en eventos adversos relacionados con fármacos, complicaciones postoperatorias y mortalidad. Hasta el momento no se puede concluir que existan diferencias, pero se necesitan más estudios prospectivos.332
– En conclusión, hasta lo que se conoce, en la práctica clínica, la elección del tratamiento (ciclosporina o infliximab) debe seleccionarse según la experiencia del médico y del centro.308
– Uso secuencial de ambos tratamientos (infliximab y ciclosporina, o viceversa)
– En el caso de estos dos agentes, el uso secuencial de la droga alternativa cuando una fracasa es controvertido. Chaparro M y col. evaluaron el perfil de eficacia y seguridad del tratamiento con infliximab después del fracaso del tratamiento con ciclosporina en pacientes con CU refractaria a corticosteroides.333 Se realizó una revisión retrospectiva de las historias clínicas. Se utilizó el índice de Lichtiger.
Las tasas acumulativas de colectomía se calcularon mediante el método de Kaplan-Meier y se realizó un análisis de regresión de Cox para identificar los factores predictivos de colectomía. Para evaluar el perfil de seguridad de esta estrategia de tratamiento, se consideró cualquier evento adverso ocurrido después de la primera infusión de infliximab. La población del estudio comprendió 47 pacientes con CU corticoesteroide refractaria tratados con infliximab después del fracaso del tratamiento con ciclosporina. El índice de Lichtiger basal medio fue de 13. El tiempo medio hasta el infliximab, de 6 días. Después de la primera infusión de infliximab, 13% de los pacientes lograron remisión y 74% respuesta parcial. De los 35 pacientes que recibieron la tercera infusión de infliximab, 60% logró remisión y 37% respuesta parcial. Un 30% requirió colectomía. Hubo un 23% de efectos adversos, incluyendo una muerte por neumonía nosocomial (40 años de edad), operado a 10 días de la primera infusión de infliximab. Por estos resultados, los autores concluyen que el tratamiento con infliximab posibilita evitar la colectomía en dos tercios de los pacientes con CU corticoide-refractaria en los que falló la ciclosporina. Sin embargo, las tasas de eventos adversos y la mortalidad indican que la decisión de administrar la terapia secuencial (ciclosporina-infliximab) debe considerarse de forma individual.333
◊ Adalimumab (Humira®)
Se presenta una tabla que resume los aspectos relevantes de la evidencia sobre la eficacia del adalimumab en CU en los estudios pivotales (Tabla 53).
Tabla 53. Eficacia del adalimumab en la colitis ulcerosa. Evidencia existente en RCT.

El adalimumab en la CU se probó precozmente para la inducción y/o el mantenimiento de la respuesta clínica o remisión en una pequeña muestra de pacientes adultos que habían recibido infliximab por actividad moderada a severa, que perdieron la respuesta o eran intolerantes al infliximab. El adalimumab mostró un efecto beneficioso previniendo la colectomía en aproximadamente el 40 al 50% de los pacientes.334-336
· Los estudios controlados con placebo que evaluaron la eficacia de adalimumab en pacientes que presentaban CU moderada a severa activa a pesar del tratamiento convencional fueron el ULTRA1 y el ULTRA2, (Ulcerative Colitis Long-Term Remission and Maintenance with Adalimumab Treatment of Moderate to Severe Ulcerative Colitis), ambos en pacientes ambulatorios.337, 338
· El ULTRA1 incluyó 390 pacientes con scores de enfermedad moderada a severa y scores endoscópicos ≥ 2, sin tratamiento previo con anti-TNF, con inadecuada respuesta o intolerancia a corticoesteroides y/o inmunosupresores, con el objetivo primario de evaluar inducción de remisión en la semana 8, comparando tres brazos: 1) adalimumab 160 mg en la semana 0 (inicial), 80 mg en la 2da semana, 40 mg en las semanas 4ta y 6ta; 2) adalimumab 80 mg en la semana 0 y 40 mg en 2da, 4ta, 6ta semanas; 3) placebo cada 2 semanas. Respecto del objetivo primario, los resultados observados fueron los siguientes: en la 8va semana, presentaron remisión el 18,5% de los pacientes en el grupo de adalimumab 160/80 (observándose un beneficio estadísticamente significativo p = 0,031) y el 10,0% en el grupo de adalimumab 80/40 (p = 0,833; NS), en comparación con el 9,2% en el grupo placebo. En cuanto a los parámetros de eficacia secundarios, 46,9% de los pacientes presentaron curación mucosa y 54,6% tuvieron respuesta clínica en la rama de adalimumab 160/80 (51,5% con inducción 80/40). Se observó elevada respuesta placebo (44,6%). Se lograron diferencias estadísticamente significativas en el subscore de sangrado rectal (p = 0,038) y en la evaluación global del médico (p = 0,035). En este estudio se han reconocido algunos aspectos metodológicos que pudieron influenciar algunos resultados. Al respecto cabe señalar que la rama de inducción 80/40 que no demostró diferencia estadística (actualmente reconocida como una dosis de inducción no óptima y no aconsejada en EII) surgió de una enmienda incorporada al estudio por una recomendación de las autoridades regulatorias europeas (Reinisch y col., 2011).337 Adicionalmente, para cuantificar la actividad se computó el día con más alto score de síntomas del índice de Mayo (entre los tres días previos a la visita), parámetro que difiere del promedio de los tres días usado en otros ensayos clínicos de biológicos. Las variables clínicas de respuesta en los tratados con adalimumab fueron similares en diferentes regiones del mundo, pero hubo notables diferencias regionales en la respuesta placebo.337
· El estudio ULTRA2 incluyó 594 pacientes refractarios a corticoides y/o azatioprina/mercaptopurina, de los cuales el 40,3% presentaron exposición previa a anti-TNF (versus naïve), y fueron estratificados en base a ello. Los pacientes fueron randomizados para recibir adalimumab 160 mg iniciales, 80 mg a la 2da semana, y luego 40 mg cada 2 semanas, o bien placebo cada 2 semanas (Sandborn y col., 2012), comparándose como objetivo primario adalimumab versus placebo en la inducción de remisión en la semana 8, y también evaluándose el mantenimiento de la remisión a 52 semanas. Los pacientes que presentaban respuesta inadecuada, a partir de las 12 semanas podían recibir adalimumab en forma abierta 40 mg cada 2 semanas, con opción de optimizar a semanal si no respondían a la administración cada 2 semanas. En los pacientes que ingresaron recibiendo esteroides basalmente se programaba el descenso de los mismos a partir de las 8 semanas a discreción del investigador. Lograron remisión un número significativamente mayor de los pacientes que recibieron adalimumab en comparación con placebo en la semana 8 (16,5% y 9,3%; p = 0,02) y en la semana 52 (17,3% y 8,5%; p = 0,01).338
Respecto de los end-points secundarios, las tasas de respuesta clínica en la semana 8 fueron del 50,4% para adalimumab y del 34,6% para placebo (p < 0,001), y en la semana 52, del 30,2% y 18,3% respectivamente (p = 0,002). La cicatrización mucosa fue significativamente más alta con adalimumab que con placebo a la semana 8 (41% vs. 32%; p = 0,032) y a la semana 52 (25% vs. 15%; p = 0,009), observándose lo mismo al evaluar la suspensión de esteroides, el IBDQ, y la proporción de pacientes que mantuvieron en forma sostenida los mencionados end-points en ambos tiempos (8 y 52 semanas).338 Los pacientes que no recibieron previamente tratamiento anti-TNF (naïve) presentaron tasas de remisión más altas que aquellos que presentaban exposición previa, tanto en la semana 8 (21,3% vs. 9,2%) como en la semana 52 (22% vs. 10,2%) respectivamente, y en esta condición naïve se observaron también mayores tasas de curación mucosa (en la semana 8: 49,3% y en la 52: 31,3%) en los subscores clínicos, remisión clínica sostenida con suspensión de esteroides y en el IBDQ, de modo que en la mayoría de los end-points hubo diferencias con el placebo.338
· Para los pacientes del estudio ULTRA1 (Reinisch y col., 2013, inducción de remisión después de 8 semanas) se diseñó una extensión abierta de 52 semanas, en la que los pacientes recibieron mantenimiento con adalimumab 40 mg (cada 2 semanas) o continuaron con el mismo tratamiento (con la opción de optimizar a 40 mg semanalmente, si era necesario). Iniciaron adalimumab en forma abierta cada 2 semanas 360 de los 390 pacientes en la población de análisis principal, presentando tasas de remisión a la semana 52 del 29,5% (tasa que incluía optimizados y no optimizados con diferentes dosis de inducción de la enmienda), que lo incrementó al 33,8% cuando se incluyeron solo los inducidos con 160/80). Se observó respuesta clínica en el 53,6% y el porcentaje de curación mucosa fue del 46,7%. La tasa de pacientes que requirió optimización de la dosis (27,7%) fue menor en la rama de inducción con 160/80 que en las de inducción con 80/40 (30%) y placebo (37,7%).337
Entre los pacientes que recibieron corticoesteroides al inicio, más de la mitad (56% de incluidos con la enmienda descripta) logró suspenderlos antes de la semana 52, estando 26,1% en remisión clínica. Los respondedores a la semana 8 presentaron remisión clínica a la semana 52 en el 38,8% de los casos.337
· El mantenimiento a más largo plazo se evaluó en el estudio ULTRA 3, concluyendo que una prolongación de tratamiento administrado en forma abierta con el esquema que venían recibiendo en los previos estudios (cada 2 semanas con opción de optimizar u optimizados) fue eficaz para lograr el mantenimiento de la remisión, la curación mucosa y una mejoría en la calidad de vida. De los pacientes del ULTRA 1 o 2 que fueron randomizados para adalimumab (n = 600) y analizados, 199 mantenían el tratamiento con adalimumab después de 4 años, con 24,7% de remisión (por score parcial de Mayo) y 27,7% de cicatrización mucosa (evaluando – imputando – como no respondedores a los pacientes de los que no se conoce el dato por abandonar el estudio, NRI no responder imputation). Suspendieron los esteroides (NRI) el 59,2%. Considerando los pacientes que estaban en remisión según el score total de Mayo (n = 242) a la inclusión en el ULTRA3, se mantuvieron en remisión hasta el tercer año (por Mayo score parcial) el 63,6% y con curación mucosa el 59,9% (evaluados como NRI) respectivamente.339
· Debe recordarse que no hay evidencia que sustente el adalimumab como tratamiento de rescate de la CU severa refractaria a corticoides IV.
· Los estudios de vida real tuvieron objetivos variables, al igual que tasas de respuesta diversas, y varios de ellos tuvieron muestras pequeñas. Se incluye un sumario de algunos estudios de vida real (Tabla 54). Uno de los mayores es del Grupo Italiano para el Estudio de la Enfermedad Inflamatoria Intestinal, cuyos miembros estudiaron la eficacia de adalimumab en una cohorte de pacientes con CU tratados en 22 centros italianos. Los criterios de valoración principales fueron la remisión clínica en las semanas 4, 12, 24 y 54. Los objetivos secundarios fueron el retiro sostenido de esteroides, la remisión endoscópica y la necesidad de colectomía. Se incluyeron 88 pacientes, la mayoría de los cuales habían recibido anteriormente. Las tasas de remisión clínica fueron del 17%, 28,4%, 36,4% y 43,2% a las 4, 12, 24 y 54 semanas respectivamente. Requirieron colectomía 22 pacientes. La presencia de remisión clínica y de valores bajos de PCR en la semana 12 fueron parámetros predictores de remisión clínica en la semana 54 (OR = 4,17; IC95%: 2,36-19,44 y OR = 2,63; IC95%: 2,32-14,94 respectivamente para los mencionados factores predictores). El uso previo de inmunosupresores se asoció con una menor probabilidad de remisión clínica en la semana 54 (OR = 0,67; IC95%: 0,08-0,66) y con una mayor tasa de colectomía (HR = 9,7; IC95%: 1,46-9,07).
· Los autores en esta experiencia de ”vida real” concluyen que el adalimumab parece ser eficaz en pacientes con CU médicamente refractaria. Los pacientes que alcanzan la remisión temprana pueden esperar un mejor resultado a largo plazo.340
Tabla 54. Eficacia del adalimumab en la colitis ulcerosa. Evidencia existente en la vida real.

· Otro estudio de vida real fue retrospectivo basado en los datos obtenidos del registro ENEIDA. Fueron incluidos todos los pacientes diagnosticados con CU tratados con adalimumab. La respuesta a adalimumab se evaluó en las semanas 12, 28 y 54 con el score parcial de Mayo, y el requerimiento de colectomía se evaluó hasta el final del seguimiento. Se incluyeron 48 pacientes con CU tratados con adalimumab; 39 (81,3%) habían recibido previamente infliximab. Las tasas de respuesta en las semanas 12, 28 y 54 fueron 70,8%, 43,2% y 35% respectivamente. La respuesta al tratamiento previo con infliximab fue el único factor predictivo de respuesta a adalimumab en la semana 12, lograda en el 90% de los que habían presentado remisión con infliximab, el 53,8% de los que presentaron respuesta y el 33,3% de los no respondedores primarios (p = 0,01). Se requirió colectomía en 11 pacientes (22,9%), en un tiempo medio de 205 días. El único predictor independiente clínico de colectomía fue la falta de respuesta a adalimumab a la semana 12. La tasas de colectomía fueron significativamente mayores en los no respondedores (42,9%) en comparación con los respondedores (14,7%) (p = 0,035). El tiempo de sobrevida libre de colectomía fue significativamente significativamente menor (p = 0,01) en los no respondedores versus los respondedores 341.341
· Otros reportes de vida real mostraron un beneficio del adalimumab en pacientes con CU activa que previamente habían recibido infliximab, logrando remisión clínica hasta el 27% a corto plazo.342-344
· El estudio InspirAda, un ensayo clínico internacional fase 3 desarrollado en 20 países que incluyó a 463 pacientes con CU activa y fallo a tratamiento convencional que recibieron adalimumab por 26 semanas, investigó respuesta clínica, costo del tratamiento, satisfacción con el tratamiento, calidad de vida (Short IBDQ y EQ-5D-5) y productibidad laboral. Los resultados de este estudio demostraron tasas de respuesta y remisión en los pacientes de CU moderada-severa clínicamente significativas (67% respuesta, 71% remisión usando el Simple Clinical Colitis Activity Index). Según los datos que se desprenden del estudio InspirAda, el tratamiento con adalimumab mejora la calidad de vida y la satisfacción en aquellos pacientes que reciben este tratamiento biológico. La productividad laboral, actividades diarias, disminución del ausentismo y el ahorro en costos médicos relacionados con la CU fueron altamente significativos, determinándose que permite el ahorro de recursos.345 Un estudio restrospectivo en EE.UU. de 170 médicos que contribuyeron con 380 pacientes con adalimumab y 424 con infliximab no encontraron diferencias en la evolución (tiempo hasta la remisión, sangrado, evacuaciones y PGA normal, ni interrupción, optimización y cambio de droga.346
◊ Golimumab (Simponi®)
Se adjunta un sumario de la evidencia existente en golimumab en los estudios pivotales (Tabla 55). Es otro anticuerpo monoclonal humano dirigido contra el TNF-alfa, subcutáneo. En la Argentina, el golimumab fue primeramente aprobado para tratar la artritis reumatoidea, artritis psoriásica y espondilitis anquilosante. En 2013 fue aprobado para tratar adultos con CU moderada a severa, resistente o refractaria a tratamientos previos o que requiere terapia continua con esteroides. Los ensayos clínicos pivotales investigaron la eficacia y seguridad del golimumab en la inducción y mantenimiento de la remisión en la CU moderada a severa.
Tabla 55. Eficacia del golimumab en la colitis ulcerosa. Evidencia existente.

Terapia de inducción
· El golimumab subcutáneo se evaluó en el estudio de inducción PURSUIT-SC (Program of Ulcerative Colitis Research Studies Utilizing an Investigational Treatment) en pacientes naïve a otro anti-TNF que presentaban CU moderada a severa (score de Mayo 6-12 con subscore endoscópico igual o mayor a 2), a pesar del tratamiento convencional.347 Este estudio de 1064 adultos resultó de la integración de pacientes de:
· Dos ensayos doble ciego de fase II de los que se derivaron los pacientes (sumados 290 pacientes) de búsqueda de rango de dosis (con los siguientes esquemas de administración, expresados en mg, de golimumab o placebo y tiempos: 100/50, 200/100 y 400/200 o placebo, a semanas 0 y 2).347
· Un estudio de fase III de confirmación de dosis (774 pacientes), randomizados para inducción con los esquemas 200/100 y 400/200 (las 2 dosis selecionadas para análisis en el estudio integrado de inducción) o placebo.347
Resultados
· En los estudios fase II se demostró una tendencia hacia una dosis-respuesta. A semana 6, una proporción numéricamente mayor de pacientes con golimumab 400/200 mg tuvo respuesta clínica o remisión, curación de la mucosa o puntajes IBDQ superiores a los de los pacientes asignados a placebo. Con base en la eficacia, concentraciones séricas y seguridad en la fase II, se seleccionaron las dosis de inducción de golimumab de 400/200 mg y 200/100 mg para desarrollo continuo en la fase III.
· En el estudio de fase III, las tasas de respuesta clínica en la semana 6 (objetivo primario) fueron 51,0% y 54,9% entre los pacientes inducidos con 200/100 mg y 400/200 mg de golimumab respectivamente, frente al 30,3% entre los que recibieron placebo (ambos p < 0,0001).
· También fueron significativos los resultados para los objetivos secundarios: las tasas de remisión clínica de los respectivos rangos de dosis de golimumba fueron 17,8%, 17,9% versus 6,5% el placebo (ambos p < 0,0001), de curación de la mucosa fueron 42,3%, 45,1% para golimumab con las dosis mencionadas versus placebo 28,7% 0,0014 y p < 0,0001 respectivamente) como los cambios del IBDQ (p < 0,0001).347
Terapia de mantenimiento (a 54 semanas)
· Se investigó en el estudio (PURSUIT-M) que incluyó 1228 pacientes, a los cuales se les administró golimumab o placebo cada 4 semanas, posteriormente a una inducción de 6 semanas (2 aplicaciones), distribuidos en dos grandes grupos de 464 y 764 pacientes (cada uno subagrupado).348
· Un grupo (n = 464) de respondedores al tratamiento de inducción con golimumab, provenientes de dos estudios con golimumab subcutáneo y uno con golimumab intravenoso (PURSUIT-IV), fueron randomizados para recibir: golimumab 50, golimumab 100 mg o placebo cada 4 semanas hasta la semana 52, con evaluación en las semanas 30 y 54 (el 75% completó el estudio).347-349
· Un grupo (n = 764) de pacientes incluidos sin randomizar, diseñado también para 54 semanas. Este último incluía los siguientes subgrupos: a) 129 pacientes respondedores a una inducción con placebo, b) 405 pacientes no respondedores a una inducción con golimumab, c) 230 pacientes no respondedores a una inducción con placebo (el 55% completó el estudio).
– Los subgrupos no respondedores a la inducción (ya sea con golimumab o con placebo) recibieron 100 mg de golimumab hasta la semana 12, y luego a la semana 16, y si no respondían eran discontinuados.
– Los respondedores a placebo continuaban con placebo.
Ante la pérdida de respuesta
– Los tratados con placebo recibían golimumab 100 mg.
– Los tratados con golimumab 50 mg se re-randomizaban a golimumab 50 mg o 100 mg. Los que recibían 100 mg continuaron con esa dosis, a excepción de un subgrupo que pasó transitoriamente a 200 mg.
Resultados
· La respuesta clínica se mantuvo en los pacientes que recibieron 50 mg y 100 mg de golimumab hasta la semana 54 en el 47,0% y 49,7% versus el 31,2% de los pacientes que recibieron placebo (p = 0,010 y p < 0,001, respectivamente). En las semanas 30 y 54, los pacientes que recibieron 100 mg de golimumab se diferenciaron significativamente en las tasas de remisión clínica (27,8% a 54 semanas) y curación de la mucosa (42,4%) vs. placebo (15,6% y 26,6%; p = 0,004 y p = 0,002 respectivamente, en similar punto de tiempo). Los pacientes del grupo que recibió 50 mg presentaron tasas de remisión del 23,2% (NS) y curación de la mucosa del 41,7% (p = 0,011) versus placebo.348
· Los porcentajes de eventos adversos serios fueron acordes con los conocidos para los anti-TNF: 8,4%, y el 14,3% entre los pacientes que recibieron golimumab 50 mg y 100 mg respectivamente, y 7,7% para el placebo; las infecciones graves eran 3,2% y 3,2% y 1,9% en el orden previamente descripto.348
· Golimumab intravenoso (PURSUIT-IV): el estudio incluyó entre fase I y Fase II a 291 pacientes, a los que se les administró 1 infusión de 2 mg/kg o 4 mg/kg o placebo, con evaluación a 6 semanas, pero la respuesta fue menor que con la administración subcutánea, por lo que se discontinuaron los ensayos clínicos, pese a que los respondedores continuaron con el estudio de mantenimiento de 1 año con golimumab subcutáneo para estudio de eficacia y seguridad.349
d. Eficacia de los Anti-TNFs en la EC
◊ Ínfliximab (Remicade®)
Se adjunta tabla de ensayos clínicos pivotales con evidencia de eficacia en la EC (Tabla 56). En el año 1997 Targan y col. publicaron en el New England Journal of Medicine el primer estudio con infliximab en EC. Fue un ensayo de 13 semanas de duración controlado con placebo en EC moderada a severa que incluyó a 108 pacientes refractarios a 5-ASA, corticoesteroides y/o inmunomoduladores, reportando una tasa de respuesta del 81% a las 4 semanas de administrar una única infusión de 5 mg/kg de infliximab en comparación con el 17% del grupo que recibió placebo (p < 0,001, NNT = 1,6), y 33% vs. 4% del placebo logrando remisión (p = 0,005). En la semana 12, el 48% de los pacientes aún presentaba respuesta.301
Tabla 56. Eficacia del infliximab en la enfermedad de Crohn en los estudios pivotales. EC luminal. Evidencia existente.

· Posteriormente, en 1999, Present y col. demostraron que también el infliximab es una droga eficaz para el tratamiento de las fístulas abdominales o perianales, en un estudio randomizado controlado con placebo de 94 pacientes con EC. Se observó respuesta clínica (definida como la reducción ≥ 50% en el número de fístulas con drenaje observadas al tiempo basal) en el 62% de los pacientes aleatorizados a realizar tres infusiones a semanas 0, 2 y 6, de una dosis de 5 mg o 10 mg por kilogramo de peso, en comparación con el 26% de los que recibieron placebo (p = 0,002). Se reportó remisión (definida como la ausencia de fístulas con drenaje) en el 46% de los pacientes que recibieron infliximab, en comparación con el 13% en el grupo placebo (p = 0,001). El tiempo medio durante el que las fístulas permanecieron cerradas fue de 3 meses.86 Sin embargo, la experiencia clínica demostró que la actividad de la enfermedad recae al administrar el infliximab solo como inducción.
· El primer estudio randomizado con placebo que evaluó la eficacia y seguridad del infliximab para el mantenimiento de la remisión en EC en 73 pacientes demostró que el retratamiento con 4 infusiones en los respondedores a una infusión inicial mantuvo el beneficio clínico, extendiéndose a 8 semanas de la última infusión; cabe señalar que el estudio se realizó en pacientes con inmunosupresión concomitante. La tasa de remisión aumentó durante el tratamiento, de 37,8% a 60% desde la semana 12, alcanzando el 52,9% en los tratados con infliximab 8 semanas luego de la infusión final (semana 44). En cambio, en el grupo retratado con placebo disminuyó de 44% a 35% con solo 20% de remisión a la semana 44 (p < 0,013). El tiempo de pérdida de la respuesta fue mayor con infliximab (48 semanas versus 37 semanas) que con retratamiento con placebo (p < 0,057). Debe considerarse que la inducción fue con una sola infusión.114
· Estudio ACCENT (A Crohn´s Disease Clinical Trial Evaluating Infliximab in a New Long Treatment Regimen): Fue investigado en este estudio el mantenimiento a más largo término con infliximab, respecto de los estudios antes mencionados, en pacientes con EC moderada a severa, a los cuales se les realizó una infusión inicial de infliximab (semana 0), evaluando la respuesta a semana 2 (respondedores: 335 de 573 incluidos). Los respondedores a la segunda semana (58%) fueron randomizados hasta la semana 46 en tres grupos de tratamiento: 1) repetidas infusiones de placebo a semanas 2 y 6 y luego cada 8 semanas, 2) repetidas infusiones IFX 5mg/ kg a los mismos puntos de tiempo, 3) IFX 5 mg/kg a semanas 2 y 6, seguidas por IFX 10 mg cada 8 semanas. Se los siguió y evaluó hasta la semana 54, comparando la proporción de pacientes que mantenían la eficacia a la semana 30 entre los grupos mencionados, y además el tiempo medio en que los pacientes perdían la respuesta.
· En este estudio se observó que los grupos tratados con IFX 5 mg/kg y 10 mg/kg cada 8 semanas, en comparación con el grupo placebo, presentaron tasas significativamente más altas de remisión en las semanas 30, del 39% y 45%, versus 21% con placebo (p = 0,003 y 0,002 y en la semana 54 (30% y 39% versus 15%, p = 0,007 y p < 0,0001 respectivamente. Los pacientes respondedores a la primera infusión que continuaron recibiendo IFX cada 8 semanas tuvieron mayor probabilidad de permanecer en remisión, y de suspender los corticoides por un período más largo en las ramas de IFX (OR para las dos dosis combinadas 2,7; IC95%: 2,6-4,6).
También se observaron diferencias significativas entre las tasas de respuesta de las ramas con infliximab 5 y 10 mg/kg en la semana 30 (50%, 58%) versus el grupo placebo (27%), (p = 0,0002 y p = 0,0001 para las respectivas dosis de infliximab), las que además tuvieron el mismo comportamiento en la semana 54: (39%, 49%) y 17% (p = 0,0001 para ambas dosis del biológico vs. placebo).
A lo largo de las 54 semanas, el tiempo medio hasta la pérdida de respuesta al infliximab fue de 19 semanas (10-45) para el grupo placebo, diferenciándose significativamente de los grupos mantenidos con infliximab cada 8 semanas en dosis de 5 mg/kg y 10 mg/kg que perdieron la respuesta en 38 semanas (IQR 15 a 54) y más de 54 semanas (21 a > 54), p = 0,002 y p = 0,0002, respectivamente).
· Los pacientes con infusiones de infliximab cada 8 semanas presentaron una ventaja significativa en la capacidad de suspender los corticoides a ambos tiempos manteniendo la remisión 29% vs. 5% p = 0,004 (OR = 4,2; IC 95%: 1,5-11,5 en la semana 54) y también en la rapidez de la disminución de la dosis.
· Tratamiento reglado vs. episódico como objetivo del ACCENT: un análisis relevante que se describe en otra publicación del mismo ACCENT consistió en evaluar una estrategia de tratamiento reglada o programada (en cuanto a sus intervalos fijos) en comparación con una estrategia episódica (tratamiento activo con infliximab según necesidad) cuando los pacientes empeoraban.350
Para ello, partiendo de los mencionados respondedores a la segunda semana (58%) aleatorizados en los tres grupos arriba citados, a partir de la semana 14, si recaían, se los cruzaba a una estrategia de tratamiento activo (consistente en infliximab 5, 10 o 15 mg/kg) para los grupos inicialmente randomizados como placebo (que era el asignado a tratamiento episódico), infliximab 5 mg/kg, infliximab 10 mg/kg respectivamente (o sea los pacientes que estaban con infliximab recibían una dosis 5 mg más alta).113, 350
La eficacia del tratamiento programado de infliximab fue superior a la del tratamiento episódico. El CDAI demostró una diferencia consistentemente significativa en la estrategia programada (10 mg/kg) a semanas 10 a 54, y el IBDQ para IFX 10 mg/kg.
Las tasas de respuesta y en algunos puntos la remisión (combinadas en la estrategia programada) fueron significativamente mayores desde las semanas 10 a la 30. En la semana 30, la respuesta fue 52% para la estrategia programada y 62% para la episódica (p = 0,024). A las 54 semanas no se observó significancia, lo que se adjudicó a que cerca de la mitad los pacientes en el grupo de estrategia episódica habían cruzado a tratamiento activo y el 22% de los pacientes de estrategia programada había suspendido el tratamiento activo.350
· Combinando las 2 dosis del tratamiento reglado, a la semana 30, 40% de los pacientes versus 32% estaban en remisión p=0,07). Entre los pacientes tratados regladamente con 5mg/kg y presentaron pérdida de respuesta, 90% restablecieron la respuesta luego de optimizar a 10 mg/kg, y el 80% de los que recibían 10 mg, también la recuperaron luego de recibir 15 mg/kg.
· Tenían úlceras al tiempo basal 81 pacientes (82%) de 99 pacientes evaluables que ingresaron al estudio. De estos, fueron reexaminados por endoscopia 74 pacientes a la semana 10, y 58 pacientes a la semana 54. A 10 semanas (con 3 infusiones realizadas) el 29% de los tratados con 5mg/kg de infliximab y el 3% de los que recibían infusiones episódicas (sólo una en ese momento) mostraron cicatrización mucosa (p = 0,006).
· Se observó a 54 semanas cicatrización mucosa en el 44% de los pacientes tratados con la combinación de las dosis de infliximab programadas y en el 18% en la estrategia episódica (p = 0,041). A 10 semanas con 3 infusiones el 22% y el 29% de de los que recibieron tratamiento reglado con 5 mg/kg y 10 mg/kg respectivamente, presentaron cicatrización en los dos tiempos versus el 0% que recibieron tratamiento episódico.
· Se demostró curación de la mucosa en la semana 54 en una proporción significativamente mayor de pacientes en la estrategia de tratamiento programado, en comparación con el tratamiento episódico (44% vs. 18%, p = 0,041).113, 350
· Respecto del retiro de corticoides a la semana 30, para IFX 5 mg/kg y 10 mg/kg se observaron tasas de 44% y 47% vs. 29% para estrategia episódica (p = 0,03 y p = 0,01). Los pacientes de estrategia programada tuvieron significativamente menos hospitalizaciones relacionadas con la EC (p = 0,014) y menos cirugías (p = 0,01) que los pacientes de estrategia episódica.350 Se demostró curación de la mucosa en la semana 54 en una proporción significativamente mayor de pacientes en la estrategia de tratamiento programado en comparación con el tratamiento episódico (44% vs. 18%, p = 0,041).
Entre los pacientes con endoscopía en semanas 10 y 54, se observó curación de la mucosa en 22% y 29% de los pacientes con IFX programado a 5 mg/kg y 10 mg/kg versus 0% (p = 0,006) en la estrategia episódica respectivamente.113, 350
· Adicionalmente, un gran estudio de una cohorte de 614 pacientes en un solo centro mostró que la necesidad de internaciones y cirugías era significativamente menor en los pacientes con infliximab programado.84 Además, se observó menor inmunogenicidad (anticuerpos anti-infliximab y reacciones de infusión) en la estrategia de infliximab programada.350
· El estudio ACCENT II (EC fistulizante) evaluó la eficacia y seguridad de infliximab como tratamiento de mantenimiento en pacientes con EC fistulizante.351 Se adjunta tabla de sumario de los ensayos clínicos que aportaron la evidencia de la eficacia del infliximab en la EC fistulizante (Tabla 57).
Tabla 57. Eficacia del infliximab en la enfermedad de Crohn fistulizante en ensayos clínicos. Evidencia existente.

· Fueron enrolados 306 pacientes, con una o más fístulas drenantes de al menos 3 meses de evolución. Los pacientes recibieron infliximab endovenoso (5 mg/kg) en las semanas 0, 2 y 6, siendo el objetivo primario comparar el tiempo de pérdida de respuesta entre un mantenimiento (recibido aleatoriamente) con infliximab 5mg/kg cada 8 semanas y con placebo desde la semana 14 hasta la semana 46, con la última visita de evaluación en la semana 54. Cuando los pacientes perdían la respuesta, si estaban con placebo podían cruzar a infliximab 5 mg/kg, y los que estaban con 5 mk/g cruzaban a infliximab 10 mg /kg; estos datos fueron censurados para el análisis de sobrevida. Se consideró respuesta a la reducción de al menos el 50% en el número de fístulas drenantes en visitas consecutivas con intervalo de 4 semanas, y respuesta completa a la ausencia de fístulas drenantes. Antes de la randomización, se observó respuesta inicial completa en el 48% a la semana 14 (en 31% de los pacientes ya se había detectado a la segunda semana). De los 306, 282 pacientes recibieron las 3 infusiones y estuvieron disponibles para la randomización, de los cuales 195 (69%) habían tenido una respuesta inicial a la inducción (no drenaje de al menos el 50% de las de las fístulas iniciales en las semanas 10 y 14), y los restantes 87 no habían respondido La randomización fue a la semana 14. Se demostró una diferencia significativa en el logro del objetivo primario (tiempo hasta la pérdida de respuesta); los respondedores a la inducción presentaron una respuesta mayor en el grupo tratado con infliximab que en el tratado con placebo (más de 40 semanas contra 14 semanas respectivamente; p < 0,001). Adicionalmente, dentro del mismo grupo de iniciales respondedores, el 36% de los que recibieron infliximab de mantenimiento y el 19% de los pacientes en el grupo placebo presentaron cierre de todas las fístulas con drenaje (respuesta completa) (p = 0,009). Si consideramos el criterio de respuesta el cierre de al menos 50% de las fístulas, los porcentajes fueron 46% vs. 23% (p = 0,001), y entre los que tenían CDAI ≥ 220, el 36% vs. el 6% (p = 0,004). Entre los no respondedores a la inducción, 16% de los que luego recibieron placebo tuvieron respuesta versus 21% de los que recibieron infliximab, (p = 0,6). El 46% de los pacientes del grupo mantenido con infliximab lograron al menos un 50% de cierre de las fístulas con drenaje versus el 23% con placebo, (p = 0,001). Entre los que perdieron la respuesta y cruzaron de placebo a infliximab 5 mg/kg (n = 41), o bien de 5 mg/kg a 10 mg/kg (n = 21), restablecieron la respuesta el 61% y 57% respectivamente, pero el tratamiento discontinuo implicó un aumento temporario de la actividad de la enfermedad y una alteración de la calidad de vida. Los autores concluyeron que cerca del doble de los que recibieron infliximab a 54 semanas que es aproximadamente un año, tuvieron cierre de fístulas completo y durable.351
· Un análisis post hoc del ACCENT II demostró eficacia del infliximab en las fístulas rectovaginales (el sub-estudio siguió el mismo diseño que el global, con similar randomización para mantenimiento con infliximab o placebo a semana 14 y seguimiento hasta 54 semanas). El 18% (n = 25) de las mujeres tenían fístulas rectovaginales (total 27 fístulas drenantes basalmente). El porcentaje de respondedores (cierre de al menos el 50% de las fístulas) a ambas semanas (10 y 14) fue del 64%. Luego de las 3 dosis de inducción estaban cerradas el 60,7% a la semana 10 y el 44,8% a la semana 14. El porcentaje de fístulas cerradas a las 14 semanas fue 72,2% entre los que respondieron al régimen de las 3 dosis vs. 0% (ningún cierre) entre los no respondedores a las 3 dosis iniciales. A lo largo de las semanas restantes hasta la semana 54 la proporción de fístulas cerradas fue de aproximadamente el doble en los respondedores a la inducción. El cierre de todas las fístulas en algún punto del estudio fue mayor en el grupo de mantenimiento con infliximab (71,4%) que en los mantenidos con placebo (54,5%). La duración del cierre de las fistulas rectovaginales fue más prolongada en el grupo de mantenimiento con infliximab 5-mg/kg (mediana: 46 semanas) que en el grupo placebo (33 semanas). Los pacientes que cruzaron de placebo a infliximab o que optimizaron la dosis fueron considerados falla. El CDAI cayó casi 100 puntos en la semana 54 en los mantenidos con infliximab y volvió a los valores basales en los mantenidos con placebo. La mediana del IBDQ bajó en el grupo mantenido con placebo y subió en los pacientes mantenidos con infliximab.352
· Un análisis posterior de los estudios ACCENT II reveló que 5 mg/kg de infliximab cada 8 semanas redujo las internaciones, cirugías y procedimientos de forma significativa, en comparación con placebo.353
Se adjunta tabla con un sumario de los resultados del ensayo clínico de la estrategia top down en EC (Tabla 58).
Tabla 58. Estrategia top down. Ensayo clínico.

· Estudio SUTD (step up vs. Top down trial): resultados del ensayo clínico que postula esta estrategia: bajo la hipótesis de que la indicación precoz de drogas potentes puede cambiar la evolución natural de la enfermedad y prevenir complicaciones, se llevó a cabo un estudio randomizado, abierto, en Alemania, Holanda y Bélgica, en 133 pacientes con EC naïve para infliximab, inmunosupresores y corticoides con CDAI > 200, de menos de 4 años de evolución. Se les administró en el estudio SUTD un plan de tratamiento precoz (n = 67) de una combinación de infliximab (0, 2 y 6 semanas) e inmunosupresores, seguido (ante requerimiento clínico) de infliximab episódico, reservando el corticoide si era requerido como la última opción del plan (estrategia conocida como top down por su denominación en inglés). Esta fue comparada (n = 66) con la estrategia convencional, conocida como step-up (intensificación progresiva del tratamiento a medida que progresa la severidad de la enfermedad) consistente en: corticoides 2 cursos, seguidos de inmunosupresores, e infliximab en último término si era requerido por la situación clínica).131 Los end points primarios fueron la remisión sin corticoesteroides y sin resección intestinal en las semanas 26 y 52.
· En la semana 26, un 60,0% de los pacientes en el grupo que recibió tratamiento combinado con inmunosupresión e infliximab (top down) estaban en remisión sin corticoesteroides y sin resección quirúrgica, en comparación con el 35,9% de los tratados con la estrategia convencional (step up), para una diferencia absoluta de 24,1% (IC95%: 7,3-40,8; p = 0,0062). En la semana 52 alcanzaron estos objetivos el 61,5% y el 42,2% (diferencia absoluta: 19,3%; IC95%: 2,4-36,3; p = 0,0278) de las estrategias top down y step up respectivamente. Pese a que las tasas de remisión (inicialmente significativamente mayores con la estrategia top down) disminuyeron después de un año de tratamiento, el 19% de los pacientes con tratamiento step-up aún recibían esteroides, en comparación con el 0% de los pacientes con tratamiento top-down.
· Los autores concluyen que un tratamiento intensivo temprano en el curso de la enfermedad podría relacionarse con mejor evolución.
· Se realizó un subestudio endoscópico en un grupo representativo del estudio SUTD a 2 años del inicio (49 pacientes, 26 de aquellos con estrategia top down y 23 con step up), utilizando el SES-CD score para la evaluación. Los tratados con la estrategia top down presentaron tasas significativamente mayores de curación de la mucosa a los dos años (73,1% versus 30,4%, p = 0,0028). En un estudio posterior, se reportaron los resultados de la evolución de esos pacientes del SUTD estudiados endoscópicamente (disponible en 46 pacientes) y seguidos a 2 años de la endoscopía, haciendo foco en la comparación entre aquellos que lograron cicatrización de la mucosa y los que tuvieron actividad endoscópica. Se correlacionaron además parámetros clínicos y de laboratorio, así como de tratamiento. Una proporción significativamente más alta de pacientes inicialmente tratados con la estrategia top down en comparación a los tratados con step up (estudio univariado) estaban en remisión sin esteroides (p = 0,017) y además sin anti-TNF (p = 0,0071). El análisis de regresión logística múltiple demostró que la cicatrización de la mucosa evaluada por el SES-CD score (0 vs. 1 a 9) fue el único factor significativo que predijo remisión a 3 a 4 años. Las comparaciones entre cicatrización de la mucosa y actividad endoscópica son: para remisión sostenida libre de esteroides 70,8% vs. 27,3%, (OR = 4,352; IC95%: 1,10-17,22, p = 0,036) y considerando que adicionalmente la misma se mantenga también sin anti-TNF: 62,5% vs. 18,2% respectivamente (OR = 4,883; IC95%: 1,14-20,84; p = 0,032).354
· Tratamiento combinado (inmunosupresión y anti-TNF): fue investigado en un estudio randomizado, doble ciego, realizado en 508 pacientes naïve de tratamiento biológico e inmunomodulador en EC moderada a severa de corta evolución denominado SONIC (The Study of Biologic and Immunomodulator Naive Patients in Crohn’s Disease). Este, reveló que la terapia con 5 mg/kg de infliximab a las 0, 2 y 6 semanas y luego cada 8 semanas, administrada de forma combinada con azatioprina (2,5 mg/kg) fue superior a cada uno de los mencionados tratamientos administrados como monoterapia.130
· Se adjunta tabla que sumariza los resultados de la eficacia del tratamiento combinado con infliximab y tiopurinas (Tabla 59).
Tabla 59. Terapia combinada versus monoterapia. Estudio “SONIC”.
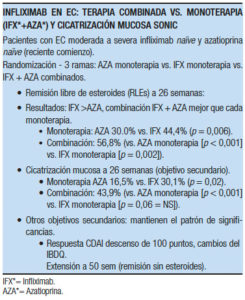
· Un total de 318 pacientes completaron 30 semanas, de los cuales 280 entraron en una extensión a 50 semanas (20 semanas adicionales de estudio exploratorio), con mantenimiento del ciego. Las tasas de inducción de remisión libre de esteroides (objetivo primario) de la terapia combinada versus el infliximab como agente único después de 26 semanas fueron de 56,8% vs. 44,4% (p = 0,02). La azatioprina como agente único fue menos efectiva (30%), comparado con ambos: con la combinación (p < 0,001) y con el infliximab (p = 0,006). La curación de la mucosa (objetivo secundario, definida como desaparición de las úlceras) demostró tasas significativamente mayores en el grupo de infliximab + azatioprina (43,9%) versus azatioprina como monoterapia (16,3%, p < 0,001), mostrando una tendencia cercana al límite de la significancia cuando la combinación se comparó con infliximab como monoterapia (30,1%, p = 0,06), en tanto que con infliximab se observó una proporción significativamente mayor de pacientes con cicatrización que con azatioprina (p = 0,02). Otros objetivos secundarios fueron la respuesta (descenso de CDAI de 100 puntos) a 26 semanas, manteniéndose la diferencia entre azatioprina e infliximab y entre la combinación y azatioprina, siendo los valores: azatioprina 37,6% vs. infliximab 54,4% (p = 0,002), combinación AZA + IFX 62,1% vs. azatioprina (p < 0,001), la combinación vs. infliximab fue solo numéricamente mayor (p = 0,16; NS). Después de la semana 30 el análisis preespecificado se basó en datos de los pacientes que entraron a la extensión. En la semana 50 las comparaciones de infliximab con azatioprina y la terapia combinada con infliximab mostraron igual tendencia. En los pacientes que entraron al estudio de extensión, la combinación AZA + IFX mantuvo la significancia estadística constante en comparación con azatioprina para la remisión libre de esteroides, la respuesta y también para los cambios del IBDQ en los diversos tiempos. Dado que hubo pacientes que no entraron a la extensión, al evaluar la población total, se obtuvo significancia en los objetivos clínicos, considerando el estatus de la última observación de la semana 26 trasladada a la semana 50 para estos pacientes.
· Este estudio demostró la relación entre la cicatrización de la mucosa y la remisión libre de esteroides. Además, debe tenerse en cuenta que los grupos de pacientes tenían una mediana de tiempo de evolución de la enfermedad de entre 2,2 y 2,4 años, lo que demuestra la importancia del uso temprano de biológicos en la cicatrización de la mucosa, en relación con la eficacia.130
· En el consenso europeo del manejo de la EC Dignass y colaboradores describen un estudio de Van Assche y col. en el que se reportó que la la continuación de la terapia inmunosupresora combinada con infliximab más de 6 meses no tiene mayor beneficio del que tiene la monoterapia con infliximab, aunque cabe señalar que está asociada con más altos niveles de infliximab.139
◊ Adalimumab (Humira®)
Es un anti-TNF efectivo para la inducción y el mantenimiento de la remisión clínica en pacientes con EC activa moderada a severa, avalado por la evidencia de varios estudios:
Se adjunta tabla con los primeros estudios de evidencia de inducción y mantenimiento (Tabla 60).
Tabla 60. Adalimumab en la EC moderada a severa. Estudios CLASSIC.

· El estudio CLASSIC I (Clinical Assessment of Adalimumab Safety and Efficacy Studied as Induction Therapy in Crohn’s Disease): es un ensayo randomizado, controlado versus placebo, doble ciego, en pacientes con EC activa moderada a severa, sin tratamiento previo con infliximab (naïve), con exploración de rango de dosis (expresadas en mg y administradas a 0 y 2 semanas: 160/80, 80/40, 40/20 respectivamente). El objetivo primario fue investigar la eficacia del adalimumab en comparación con placebo en la inducción de remisión a las 4 semanas del tratamiento. Ello se logró en el 36% de 299 pacientes tratados con la dosis de inducción de adalimumab más alta usada en el estudio (160 mg, seguidos de 80 mg a las 2 semanas) en comparación con el 12% con placebo (p = 0,001). Se obtuvo para la misma dosis significancia estadística, considerando respuesta una disminución del CDAI de 100 puntos (50% vs. 25%, p = 0,002). Con las otras dosis (40/20 y 80/40), que lograron remisión del 18% y 24% respectivamente, no hubo diferencia significativa con el placebo a 4 semanas. A pesar de que, de acuerdo con el criterio de una disminución de 70 puntos, se observó significancia al inducir con 80/40 (significativa en la primera semana en un subgrupo) o con 40/20, está hoy ampliamente aceptado que la dosis de inducción debe ser 160/80. Además de la remisión, en los grupos de inducción 160/80, se constataron cambios significativos en otros objetivos secundarios: descenso de los valores medios del CDAI (p < 0,001), aumento del IBDQ (p < 0,05) y un descenso de la PCR que se observó con todas las dosis usadas: 160/80, 80/40, 40/20 (p = 0,032, p = 0,0002 y p = 0,0001 respectivamente).355
· El estudio CLASSIC II: es una extensión a 56 semanas respecto del CLASSIC I, para investigar el mantenimiento a largo término versus placebo en la población de pacientes del CLASSIC I. Un total de 276 pacientes del CLASSIC I se enrolaron en el CLASSIC II y recibieron en forma abierta adalimumab 40 mg a semanas 0 (correspondiente a la semana 4ta del CLASSIC II) y semana 2.356 Luego del mencionado tratamiento, se seleccionaron los pacientes que habían logrado remisión a la 4ta semana del CLASSIC I (semana 0 del CLASSIC II) y a las 4 semanas del ingreso al CLASSIC II (n = 55). Estos pacientes fueron aleatorizados en tres grupos: 40 mg de adalimumab subcutáneo semana por medio (n = 19), 40 mg cada semana (n = 18) y placebo (n = 18).
· Los pacientes no elegibles para randomización (n = 204) por no presentar remisión en la semana 4 del CLASSIC I, o en la semana 4 del CLASSIC II, entraron en un estudio en el que recibieron adalimumab en forma abierta.
· Los 55 pacientes randomizados en los tres grupos de mantenimiento, semana por medio, adalimumab 40 mg semanal y placebo demostraron en la semana 56 tasas de remisión del 79%, 83% y 44% respectivamente (p < 0,05 vs. placebo). En este subgrupo de pacientes randomizados, además, se observaron diferencias significativas respecto del placebo en las tasas de respuesta clínica (caída de 100 puntos del CDAI) en varios tiempos desde la semana 12, tanto en la rama de adalimumab cada 2 semanas como en la de administración semanal. Las tasas de respuesta a semana 56 fueron 89%, 79% y 56% respectivamente para las 3 ramas mencionadas. Se observó caída del CDAI significativamente mayor en los grupos de adalimumab versus placebo, y el IBDQ con adalimumab se mantuvo ≥ 170 (valor que se correlaciona con remisión), pero cayó rápida y significativamente en el grupo placebo. Los parámetros mencionados de eficacia se presentaron más precozmente y persistentemente en los pacientes que recibían 40 mg por semana. En los análisis estadísticos se consideró LOCF (Last Observation Carried Forward) para cada grupo versus placebo.
· De esos 55 pacientes randomizados, 49% habían recibido esteroides basalmente y se indicó intentar retiralos a las 8 semanas. A las 65 semanas habían discontinuado el 67% de los tratados con adalimumab cada 2 semanas versus el 88% con adalimumab semanal y el 56% de pacientes con placebo (LOCF).
· Los pacientes aleatorizados que no respondían o que recaían podían entrar al estudio abierto para recibir 40 mg de adalimumab cada 2 semanas y si no respondían, también en forma abierta, podían optimizar las dosis por frecuencia de aplicación a adalimumab 40 mg semanales (consideraron falla al analizar de eficacia primaria).
· El estudio abierto fue conformado inicialmente con 204 pacientes que no habían logrado remisión a la semana 0 o 4, completando 56 semanas el 64%. Los pacientes de esta rama fueron tratados con 40 mg de adalimumab cada 2 semanas, pudiendo optimizar a adalimumab semanal, que ocurrió en el 45,8% (60/131), observándose globalmente en la semana 56 tasas de remisión del 46%. Las tasas de eficacia en optimizados y no optimizados a tratamiento semanal, considerando el criterio de remisión, fueron del 49% y 42%, y considerando respuesta (disminución del CDAI de 100 puntos) fueron del 66% y 64%. A la semana 56, los pacientes del estudio abierto tenían un descenso medio del CDAI de 158,4 puntos, y de los que recibían esteroides basalmente habían discontinuado el 58%.356
Se adjunta tabla con un sumario del estudio CHARM de mantenimiento de remisión con adalimumab (Tabla 61).
Tabla 61. Adalimumab en la EC moderada a severa. Estudio CHARM.

· El estudio CHARM (Crohn’s Trial of the Fully Human Antibody Adalimumab for Remission Maintenance) evaluó la eficacia y seguridad de adalimumab en el mantenimiento de la respuesta y la remisión en pacientes con EC moderada a severa.127 (Tabla 61) Se enrolaron 854 pacientes, que a las 4 semanas de una inducción abierta de 80/40 mg a semanas 0 y 2 se estratificaron por respuesta considerando como criterio una disminución en CDAI ≥ 70 puntos desde el score basal. Fueron respondedores el 58% (n = 499, 76 excluidos), los que se aleatorizaron a un tratamiento doble ciego con 40 mg de adalimumab cada 2 semanas), o 40 mg de adalimumab cada semana, o placebo, hasta la semana 56. El objetivo primario fue evaluar la remisión a 26 y 56 semanas de estos pacientes respondedores a la 4ta semana, comparando los tres grupos de tratamiento.
· Las tasas de remisión observadas a la semana 26 fueron significativamente mayores en los grupos de 40 mg de adalimumab cada 2 semanas y cada semana en comparación con placebo (40%, 47% vs. 17% respectivamente; p < 0,001), observándose también beneficio, con diferencias significativas, a la semana 56 (36%, 41% versus placebo 12%, p < 0,001). La significancia estadística comenzó a observarse a las 6 semanas. Los porcentajes de respuesta (objetivo secundario: descenso de 100 puntos del CDAI) a 56 semanas para los tres grupos fueron del 41%, 48% y 16% respectivamente (p < 0,001). El CDAI medio mostró un descenso significativamente mayor (p < 0,001) en los grupos de adalimumab versus placebo, así como también tuvieron una mejora significativa del IBDQ a través del tiempo.
· Respecto de otros objetivos secundarios, en la semana 56 se observó remisión sostenida libre de esteroides con adalimumab cada 2 semanas y cada 1 semana, en el 29% y el 20% (p < 0,001 y p = 0,006 respectivamente) vs. el 5% con placebo.
· Los pacientes que presentaban recaída o no respuesta sostenida, a partir de la semana 12, entraron a un plan de administración en forma abierta de adalimumab cada 2 semanas, con posibilidad de escalar a dosis de 40 mg semanal si era requerido, siendo computados como falla en lograr la remisión.127
· Un total de 505 enrolados (59%) completaron las 56 semanas. Aproximadamente la mitad de los enrolados (n = 251) permaneció en el grupo de tratamiento doble ciego randomizado, y la otra mitad (n= 263) lo completó en la fase abierta (123 con adalimumab cada 2 semanas y 140 semanal).127
· Entre los pacientes randomizados a adalimumab cada 2 semanas (n 260), requirieron escalar a adalimumab semanal el 27,3% el primer año y el 13,1% el segundo año; debe notarse que luego de las 56 semanas ya estaban incluidos dentro de un estudio abierto de extensión.127
· Los no respondedores randomizados a la 4ta semana (n = 279) de cualquiera de las tres ramas fueron estudiados para evaluar los objetivos secundarios y la seguridad, y el 21% de ellos completó el estudio doble ciego de 56 semanas, el 26% de los pacientes con adalimumab y el 12% con placebo.127
· Al respecto se reitera que debe tenerse en cuenta que la mejor dosis de inducción es 160 mg inicialmente y 80 mg a las 2 semanas, según lo demostrado en el estudio CLASSIC, esquema recomendado actualmente, diferentes de las otras dosis de inducción utilizadas en el CHARM.
· Además de los resultados mencionados, el porcentaje de pacientes respondedores randomizados que lograron discontinuar el uso de corticoides al menos por 90 días manteniendo la remisión fue mayor con adalimumab. La remisión sostenida libre de corticoides se observó a 26 semanas en solamente el 3% de pacientes con placebo, siendo significativamente mayor en los grupos con adalimumab cada 2 semanas (19%, p = 0,006), y cada semana (15%, p = 0,019). De manera similar a 56 semanas se observó remisión sostenida libre de esteroides solo en el 5% de los tratados con placebo, siendo significativamente mayor en los respectivos esquemas de adalimumab cada 2 semanas (29%, p < 0,001) y semanal (20%, p = 0,006).
· La respuesta de la enfermedad fistulizante se tratará en un apartado especial, con seguimiento a más largo plazo (Adalimumab en enfermedad de Crohn fistulizante).
· Discontinuaron el tratamiento por efectos adversos un mayor porcentaje de los tratados con placebo (13,4%) que con adalimumab cada 2 semanas y semanal (6,9% y 4,7% respectivamente, ambos p < 0,05) y que con adalimumab inducción abierta (6,3%).127
Se adjunta tabla de los ensayos de extensión a largo término del estudio CHARM (ADHERE y EXTEND) (Tabla 62).
Tabla 62. Adalimumab y remisión profunda. Estudios EXTEND y ADHERE.

· El estudio EXTEND (EXTend the Safety and Efficacy of Adalimumab through ENDoscopic Healing): fue un estudio aleatorizado, doble ciego, controlado que comparó la eficacia del adalimumab (inducción + mantenimiento versus inducción + placebo) para inducir y mantener la curación de la mucosa (objetivo primario), en 135 adultos con EC moderada ileocolónica severa.
· Se documentó el grado de ulceración de la mucosa basal por ileocolonoscopía.128 La inducción fue realizada con adalimumab 160/80 mg en las semanas 0/2. En la semana 4, los pacientes fueron aleatoriamente asignados a mantenimiento con 40 mg de adalimumab (adalimumab continuo) o bien con placebo cada dos semanas hasta la semana 52 (inducción + placebo).
· Los no respondedores o en recaída entraron en una fase abierta a partir de la semana 8. La evaluación de la curación de la mucosa fue por ileocolonoscopía en las semanas 12 y 52.
· En la semana 12, el resultado por intention to treat (usando SES-CD, Simple Endoscopic Score for CD < 2) observó curación de la mucosa en el 27% de los pacientes con adalimumab continuo y en el 12% con inducción + placebo, al límite de la significancia (p = 0,056), y un preespecificado análisis preprotocolo (exclusiones por desviaciones) alcanzó diferencia (p = 0,046).
· En la semana 52 la cicatrización fue significativamente mayor (28% versus 0%) para adalimumab continuo comprado con inducción + placebo (p < 0,001).
· Mantuvo la cicatrización desde las 12 semanas hasta las 52 semanas el 47% del grupo de adalimumab continuo (n = 17) en comparación con ninguno (0 de 8) en el grupo de inducción + placebo (p = 0,009).
· Analizando por el criterio de remisión endoscópica del CDEIS (Crohn´s Disease Endoscopic Index of activity) ≤ 4 las tasas en la semana 12 fueron del 52% y el 28% (p = 0,006) y a la semana 52 del 28% y 3% (p < 0,001), ambas en los dos puntos de tiempo significativamente mayores para adalimumab continuo comparado con inducción + placebo.
· Fueron también mayores las tasas de remisión clínica (CDAI) con adalimumab continuo versus inducción + placebo, tanto en la semana 12 (47% vs. 28%, p = 0,021) como en la 52 (33% vs. 9%; p = 0,001).
· Los pacientes que desde la semana 8 presentaban no respuesta o recaída pasaban a un estudio abierto con administración de adalimumab cada 2 semanas, con la opción desde la semana 10 de optimizar a adalimumab semanal si era requerido. En los pacientes que pasaban al estudio abierto se realizaba una endoscopía adicional al momento del cambio a esta rama.
· El resultado general del estudio fue que los pacientes con actividad moderada a severa que siguieron recibiendo adalimumab fueron más propensos a lograr cicatrización que los que continuaron con placebo.128
· En otra publicación, Colombel y colaboradores compararon ambas ramas del estudio EXTEND en el logro de la remisión profunda (definida como la ausencia de ulceración mucosa y remisión clínica cuantificada por el CDAI) y además establecieron relaciones con otros parámetros evolutivos.339 Los porcentajes de remisión profunda fueron del 16% en los pacientes tratados con adalimumab frente al 10% en los que recibieron placebo (p = 0,34) a la semana 12, y 19% vs. 0% (p < 0,001) a la semana 52. Las tasas de remisión profunda fueron mayores en los pacientes que recibieron adalimumab y una evolución de la EC ≤ 2 años (33% a semanas 12 y 52), indicio de que el tratamiento precoz es más efectivo. En la semana 52, los pacientes que lograron una remisión profunda a la semana 12 requirieron significativamente menos ajustes de tratamiento con adalimumab y tuvieron menos hospitalizaciones y cirugías relacionadas con la EC, menor déficit en la actividad diaria no laboral, menores costos totales de la enfermedad y mayor calidad de vida (manifestada por más altos IBDQ y SF36/mejor función física). 339
· El ensayo ADHERE (Additional Long Term Dosing with Humira to Evaluate Sustained Remission and Efficacy in Crohn‘s Disease), se realizó como extensión abierta del recién mencionado estudio CHARM luego de las 56 semanas de duración, en el que se incluyeron 467 pacientes, que fueron seguidos por 212 semanas para evaluar la eficacia y la seguridad del adalimumab durante ese lapso, que corresponde a 4 años de tratamiento, entre los respondedores del CHARM que durante el estudio doble ciego habían recibido randomizadamente adalimumab ya sea semanal o quincenal (n 329). Además se evaluó remisión y respuesta, y remisión libre de corticoesteroides; se subagrupó a los que recibieron corticoides al tiempo basal (n 206). Adicionalmente se investigó la cicatrización de las fístulas en los que al tiempo basal presentaban esta complicación (n 70). Se incorporaron también 139 de los pacientes randomizados a placebo en el CHARM (42 habían permanecido en el doble ciego y 97 habían sido movidos al estudio abierto del CHARM)357 Los respondedores del CHARM, aún en doble ciego, y los que habían cruzado a la administración abierta de adalimumab, se mantenían con adalimumab cada 2 semanas si no estaban previamente optimizados, pero con opción de escalar a semanal si era requerido. Se realizó una evaluación intermedia a 2 años, observando que la mayoría de los pacientes que entraron con adalimumab cada 2 semanas permanecieron con esa dosis (76,5%).358 Como previamente mencionado, de 260 pacientes que en el CHARM habían sido randomizados a adalimumab 40 mg cada 2 semanas, el 27,3% cambiaron a semanal durante el primer año y un 13,1% adicional cambiaron durante el segundo año. Los pacientes que recibían corticoides podían continuarlos, con disminución o suspención si mejoraban, o reinstaurarlos si tenían una recaída; los que no los recibían debían esperar 3 meses para iniciarlos.
· Después de 2 años de tratamiento (116 semanas del CHARM, que equivale a la 60 del ADHERE), presentaron remisión clínica el 41,9%, 49,8% y 37,6% de los pacientes que se aleatorizaron originalmente a adalimumab cada 2 semanas, cada semana y placebo respectivamente (análisis LOCF).
· Para todos los grupos, las tasas de remisión fueron sostenidas; al final de CHARM, y en el ADHERE, 122 (84,1%) de los pacientes mantuvieron la remisión a 2 años. De los que venían optimizados a adalimumab40 mg semanal en forma ciega y pasaron optimizar cada 2 semanas, 85% mantuvieron la dosis en el ADHERE, el 76% hasta las 116 semanas. Los pocos que requirieron volver a semanal recuperaron respuesta en más del 90% de los casos.358
· Todos los grupos experimentaron mejoría del IBDQ. Se observó reducción de las tasas de hospitalizaciones por la misma EC y las relacionadas con otras causas. En un período de 2 años, las tasas de efectos adversos graves y neoplasias malignas (33,3 y 1,1 eventos/100-paciente-años, respectivamente) fueron similares a los observados durante el programa general de adalimumab.358
· Los resultados a 4 años mostraron que de los 329 respondedores iniciales del CHARM, 30% lograron remisión o respuesta. La mayoría de los pacientes (54%) con remisión en el primer estudio descripto, la mantuvo a 4 años, la mayoría mantuvo la respuesta clínica. A los 4 años el 16% de los pacientes que tomaban corticosteroides al tiempo basal estaban en la remisión libre de corticosteroides y las fístulas habían cicatrizado en el 24% de los pacientes que presentaban fístulas al momento basal. Las tasas de incidencia de eventos adversos se mantuvieron estables con el tiempo.357
· El estudio GAIN (Gauging Adalimumab Efficacy in Infliximab Nonresponders) evaluó en 325 pacientes la eficacia de adalimumab como tratamiento anti-TNF de segunda línea en pacientes con EC moderada a severa que perdieron respuesta o presentaron intolerancia a infliximab.
Se adjunta un sumario de la eficacia del adalimumab en los no respondedores a infliximab (Tabla 63).
Tabla 63. Ensayo clínico GAIN sobre la eficacia del adalimumab en la pérdida de respuesta o la intolerancia al infliximab.

· La proporción de pacientes con adalimumab que logró remisión clínica (21%) fue significativamente mayor en comparación con placebo (7%, p < 0,001); las tasa de respuesta (considerando una disminución de 70 puntos del CDAI) fueron del 52% vs. 34% respectivamente (p = 0,001). Este hallazgo demostró que el adalimumab podría ser una alternativa en los previos no respondedores a infliximab, aunque con menor eficacia que en los pacientes naïve.359
Se adjunta tabla que sumariza la eficacia del adalimumab en la EC fistulizante (Tabla 64).
Tabla 64. Adalimumab en la enfermedad de Crohn fistulizante. Estudios pivotales.

Adalimumab en enfermedad de Crohn fistulizante: con respecto a la eficacia del adalimumab en el Crohn fistulizante, en 117 de los pacientes incluidos en el CHARM que presentaban fístulas con drenaje (70 randomizados a adalimumab y 47 a placebo), se observó con adalimumab versus placebo un beneficio con diferencia estadística en el cierre a 26 semanas (30% vs. 13%; p = 0,043).
· A 56 semanas (1 año) se mantuvieron cerradas el 100% y se cerraron nuevas fístulas (llevando el porcentaje a 33% vs. 13%, p = 0,016).
· De los tratados con adalimumab con fístulas al tiempo basal (n = 70), aproximadamente un 60% (22/37), luego de 2 años de tratamiento, habían cicatrizado. Luego de un año del estudio ADHERE en el que se administró adalimumab en forma abierta, el 90% de las fístulas que habían cicatrizado en el CHARM (con adalimumab o placebo) se mantenían cicatrizadas.
· Además, estos pacientes presentaron una mejor calidad de vida y mejor función física en comparación con los pacientes que no lograron remisión profunda.360
◊ Certolizumab pegol (Cimzia®)
Se adjunta tabla que resume los resultados de los ensayos clínicos de certolizumab en la EC (Tabla 65). Para investigar la eficacia del certolizumab (CZP) en la EC se realizó un estudio de búsqueda de dosis que incluyó a 292 adultos con EC activa moderada a severa.361
Tabla 65. Eficacia del certolizumab pegol en la enfermedad de Crohn.

Ellos recibieron 100, 200, o 400 mg de CZP o placebo en las semanas 0, 4 y 8, siendo evaluados a la semana 12 por el CDAI según respuesta (descenso ≥ 100 puntos) o remisión (score ≤ 150).
Presentaron respuesta el 33% de los pacientes que recibieron 400 mg de CZP en semana 0 y semana 2 en comparación con el 15% en el grupo placebo, con tasas respuesta clínica más alta que el placebo en todos los puntos, la mejor en la semana 10 (52,8% vs. placebo 30,1%; p = 0,006), pero no fue significativa en la semana 12.
· Las tasas de remisión clínica con 400 mg a la semana 4 fueron del 21% para CZP en comparación con el 8% para placebo. Con las otras dosis el beneficio fue menor. Las tasas de respuesta fueron superiores en pacientes que presentaron una PCR inicial ≥ 10 mg/L, observándose tasas de respuesta al placebo en subgrupos de pacientes con bajos niveles de proteína C reactiva, que según comentario de los autores pueden haber influido negativamente en los resultados.361
· En el estudio PRECISE 1 (Pegylated Antibody Fragment Evaluation in Crohn’s Disease: Safety and Efficacy 1), 662 pacientes con EC activa moderada a severa se aleatorizaron para recibir 400 mg de CZP o placebo en las semanas 0, 2 y 4 y luego cada 4 semanas hasta la semana 24, investigó la inducción de respuesta en la semana 6, y la respuesta en ambas semanas 6 y 26. Las tasas de remisióna clínica en los pacientes, con PCR basal ≥ 10 mg/L, fueron en la semana 6 del 37% para CZP y 26% para el placebo (p = 0,04, en las semanas 6 y 26 las tasas para CZP y placebo fueron del 22% y 12% respectivamente (p = 0,05).
· En la población total los porcentajes de respuesta fueron en CZP 35% y en el placebo 27% (p = 0,02), a las semanas 6 y 26 las tasas para CZP y placebo fueron del 23% y 16% respectivamente (p = 0,02).
· El certolizumab fue superior al placebo para la inducción de remisión clínica en la semana 4 y en la semana 26, aunque, en este estudio, no se detectó diferencia estadística en otros tiempos (p = 0,17 a ambas semanas 6 y 26). 362
· Los estudios PRECISE 2 y PRECISE 3 reportaron que el CZP fue bien tolerado en el tratamiento prolongado de la EC, con remisión sostenida en algunos pacientes que continuaron en el estudio, durante, 7 años. 129, 363 Según análisis: “Last observation carried forward” y “Nonresponder Imputation”: 58% y 45% a 1 año, 56% y 26% a 3 años, 55 y 13% a 7 años Respectivamente.362
· El estudio WELCOME (26-Week open-label trial Evaluating the clinical benefit and tolerability of certoLizumab pegol induCtiOn and Maintenance in patients suffering from CD with prior loss of response or intolErance to infliximab) sugiere que el CZP es efectivo en pacientes que recibieron infliximab y perdieron la respuesta, o bien se volvieron intolerantes a este medicamento.364
· Esta investigación incluyó a 539 pacientes y consistió en un período de inducción abierto inicial de seis semanas, en el que los pacientes recibieron 400 mg de CZP en las semanas 0, 2 y 4. Después del período de inducción, el 61% de los pacientes había logrado respuesta (disminución del CDAI de al menos 100 puntos). Los respondedores en la semana 6 fueron asignados al azar a cualquiera de los dos grupos de mantenimiento de 400 mg CZP, para comparar la administración cada 2 o cada 4 semanas.
· En la semana 26, el 40% de los pacientes que recibieron tratamiento con CZP cada 4 semanas y el 37% de los que recibieron tratamiento cada 2 semanas tuvieron respuesta clínica (p = 0,55), y estaban en remisión el 29% y 30% para CZP cada 4 semanas y cada 2 semanas respectivamente (p = 0,81).364
· El estudio abierto MUSIC (Endoscopic MUcoSal Improvement in Patients with Active Crohn’s Disease Treated with CZP) de pacientes con EC ileocolónica activa demostró que el CZP mejora las lesiones endoscópicas (evaluadas por CDEIS) después de 54 semanas de tratamiento. Las tasas de respuesta endoscópica (disminución en el CDEIS > 5 puntos), remisión endoscópica (CDEIS < 6), remisión endoscópica completa (CDEIS < 3) y curación de la mucosa (sin úlceras) en la semana 10 fueron del 54%, 37%, 10% y 4%, respectivamente. A 54 semanas las tasas correspondientes fueron del 49%, 27%, 14% y 8%, respectivamente.365
· En conclusión, y con fundamento en la evidencia, infliximab, adalimumab y certolizumab pegol demostraron eficacia clínica similar en pacientes con EC activa moderada a grave. El perfil de eventos adversos informado en varios estudios también es similar entre los anti-TNF.
e. Optimización mediante TDM (therapeutic drug monitoring)
· Si se cuenta con las determinaciones de niveles séricos de anti-Tnf y anticuerpos antidroga, es preferible manejarse con esta herramienta que optimizar a ciegas, porque podemos estar aumentando las dosis de una droga inefectiva.
· Las concentraciones de anti-TNF bajas o indetectables están asociadas con una deficiente respuesta clínica. Se demostró que los anticuerpos anti-infliximab (ATI) aumentan la eliminación del fármaco y son una causa de bajos niveles séricos de IFX.366
· Se conoce que el clearance de IFX, que influencia los niveles, puede estar afectado por el peso corporal elevado, bajos niveles de albúmina y los ATI. Se ha postulado que el monitoreo terapéutico con intensificación de la dosis debe evaluarse como estrategia para prevenir el desarrollo de ATI en pacientes con concentraciones indetectables o bajas de IFX. Pero debido a resultados de las determinaciones los niveles séricos de IFX, que pueden o no estar bajas en presencia de ATI, se reportó que los ATI pueden perjudicar la actividad del fármaco, no sólo afectando el clearance de IFX, sino que al menos en algunos pacientes el efecto de los ATI está mediado por un mecanismo alternativo, que es la unión de los ATI al idiotipo, el cual es el epítopo propio de una molécula o sea el determinante antigénico (porción de una macromolécula que es reconocida por el sistema inmunitario, específicamente la secuencia a la que se unen los anticuerpos) que está situado en el IFX en la fracción F(ab’)2 “Fragment antigen bingding” que en este caso incluye la región bisagra (ver figura 9) e incluye tanto un dominio constante como los dominios variables de las cadenas pesadas y livianas. De esta manera bloquea la unión de IFX al TNF, neutralizando directamente la actividad del fármaco.
· Vande Castelle y col. reportaron en un estudio que los anticuerpos anti-IFX fueron transitorios en el 28% de los pacientes.367 Solo el 13% de estos pacientes con anticuerpos transitorios a IFX tuvieron que interrumpir el infliximab, en comparación con el 68% de los pacientes con anticuerpos persistentemente positivos (RR 5,1).367
· Al igual que una experiencia previa de Ben-Horin, una reciente publicación del Academic Medical Centre Amsterdam demostró que la adición de inmunomoduladores puede aumentar las concentraciones séricas anti-TNF y recuperar la respuesta clínica, logrando lo mencionado en el 77% de los casos que habían perdido la respuesta por inmunogenicidad. Los autores encontraron anticuerpos anti-IFX en el 26% de los pacientes y anti-adalimumab en el 27%, y administraron inmunomoduladores (tiopurinas o metotrexato) en 17/159 pacientes.368
· Los niveles se determinan en µg/mL. Se recomienda medirlos por primera vez a las 12-14 semanas del inicio del biológico.369
· Sin embargo, la American Gastroenterology Association en una revisión técnica sugiere que los cambios de tratamiento se guíen con monitoreo REACTIVO.
· Se sugieren niveles adecuados como referencia durante el mantenimiento. Pero debe notarse que un pequeño subgrupo de pacientes responderá con concentraciones más elevadas. Las concentraciones óptimas para la inducción son inciertas.
· El estudio TATXIT (Trough level Adapted InfliXImab Treatment), que comparó pacientes asignados aleatoriamente al manejo estándar con optimización de la dosis prospectivamente basada en medición de niveles, demostró que, durante la terapia de mantenimiento con IFX, se lograron mejores resultados clínicos cuando se fijó un umbral de concentración IFX de ≥ 3 µg/mL. Además, sugirió que los pacientes con una concentración de IFX de > 7 µg/ml pueden ser desescalados, lo que resulta en costos de medicamentos significativamente menores, sin afectar la proporción de pacientes en remisión. La concentración preferida sería > 5 µg/ml.370, 371
· La AGA realiza recomendaciones en base a 6 estudios que suman casi mil pacientes, señalando que cuando se usan umbrales de ≥ 1 µg/mL, el 25% de los pacientes no están en remisión, porcentaje que disminuye al 15% con niveles ≥ 3 µg/mL, y aproximadamente al 4% con concentraciones de ≥ 7 µg/mL o ≥ 10 µg/mL.372, 373
· Respecto del adalimumab, cuatro estudios proveyeron datos del porcentaje de pacientes que no están en remisión con concentraciones > 5 ± 1 µg/ml o 7,5 ± 1 µg/ml. La proporción de pacientes que no están en remisión con concentraciones en umbrales ≥ 5 µg/ml disminuye desde el 17% al 10% cuando los umbrales de concentraciones son ≥ 7,5 ± 1 µg/ml.
· Debe tenerse en cuenta que hay diferentes reactivos, con escasos ensayos de comparabilidad. Se desconoce la proporción de pacientes que con dosis estándar (40 mg cada 2 semanas) u optimizada (40 mg semanal) podrían lograr estos niveles.372, 373
· Respecto del certolizumab, se analizaron los datos de 9 trials. Los pacientes que no están en remisión decrecen del 42% al 26% cuando se usan niveles ≥ 20 µg.372, 373
· Se reportó recientemente, con respecto a los niveles séricos de adalimumab, que un punto de corte de 8,14 µg/ml discrimina pacientes con cicatrización de la mucosa con una sensibilidad y especificidad de 91,4% y 76,0%, respectivamente (valores predictivos positivo y negativo del 84,2% y 86,4%).374
· Respecto del golimumab hay pocos datos. El estudio PURSUIT identificó niveles de 2,5 µg/ml a semana 6 en la inducción y 1,4 µg/ml a 44 semanas (mantenimiento), y otro estudio de Detrez mencionado por Vande Castelle reporta que presentar 2,6 µg/ml en la semana 6 predice mejoría a la semana 14.372, 373
· En resumen, cuando se usan determinaciones de niveles reactivos durante la terapia de mantenimiento, un umbral de concentración mínima de ≥ 5 µg/ml para infliximab, ≥ 7,5 µg/ml para adalimumab y ≥ 20 µg/ml para certolizumab pegol, es posible identificar una mayoría de los pacientes en los cuales es improbable que ocurra una respuesta al escalamiento de la terapia.
· Solo unos pocos pacientes podrán responder al elevar las concentraciones desde estos niveles, más frecuentemente en la CU que en el Crohn, y tomando como blanco la remisión endoscópica más que la clínica.
· Con respecto a anticuerpos, un umbral > 9 para infliximab y > 4 µg/mL para adalimumab identifican niveles altos que no responden al escalamiento de la dosis con 90% de especificidad. Esto es porque algunos estudios han demostrado que pacientes con bajos niveles de anticuerpos y niveles subterapéuticos de droga pueden responder al escalamiento de la terapia, en comparación con los que tienen altos niveles de anticuerpos.373
· En general, para las conductas terapéuticas partimos de conocer si los niveles son terapéuticos o subterapéuticos y cruzamos esta información con la de si los anticuerpos son detectables o indetectables. Si las concentraciones son subterapéuticas y los anticuerpos no detectables, implica que la falla no es inmunomediada, lo que ocurre en el 51% de los casos.
· Si los anticuerpos son detectables, ello significa que la falla es inmunomediada, lo que ocurre en el 19% de los casos. Si los niveles son terapéuticos y los anticuerpos no son detectables, lo cual se observa en el 25% de los casos, entonces no sería adecuado para ese paciente el mecanismo de acción de la droga.
· La otra posibilidad es que la concentración de droga sea terapéutica, con anticuerpos detectables, lo que ocurre en el 5% de los casos.
· En un paciente clínicamente sintomático, se recomienda:
- Aumentar la dosis o la frecuencia (la frecuencia en caso de adalimumab; en el infliximab es opcional, se puede aumentar la frecuencia o la dosis)) cuando los niveles de droga son subterapéuticos y los niveles de anticuerpos son absolutamente negativos.
- Si los niveles de droga son subterapéuticos y los anticuerpos son detectables, pero bajos, se puede intentar aumentar la dosis, antes de realizar otros cambios. Si los anticuerpos son altos, es preferible cambiar de anti-TNF y considerar agregar un inmunosupresor.
- Cuando los niveles de droga son terapéuticos y el paciente es un no respondedor y no es obviamente quirúrgico (por ej. estenosis fibrótica), se debe cambiar la clase de droga, ya que la inflamación puede ser mediada por un mecanismo no dependiente del TNF.
· Recordar que los pacientes no naïve a biológicos tienen menor respuesta. Si además hay anticuerpos, al cambiar a otro biológico de otra clase se puede considerar agregar un inmunomodulador.369, 371, 373-375
· Hay distintas técnicas para la determinación. La más común es ELISA (enzyme-linked immunosorbent assay), y se observó una correlación entre tres reactivos disponibles ELISA, aunque uno de ellos detectó un 18% de falsos positivos. El más común (double antigen assay) no puede medir los anticuerpos anti-droga en presencia de niveles de droga.
· Actualmente hay un ELISA alternativo, que utiliza el anticuerpo antihumano de cadena lambda (AHLC), por sus siglas en inglês Anti-Human Lambda Chain para la detección de anticuerpos, que puede superar la interferencia de infliximab con la medición de ADA.
· Otros son: Fluid-phase Radioimmunoassay (RIA): la deteccción se basa en la formación de complejos de infliximab con antígeno radiomarcado, estimándose la concentración de infliximab por medir la radioactividad del complejo; demostró buena correlación con los parámetros clínicos, aunque las altas concentraciones pueden interferir con la detección de anticuerpos.; LC-MS/MS (liquid chromatography, tandem mass spectrometry), ECLIA (electrochemiluminescence immunoassay) mide niveles y anticuerpos; HMSA (homogenous mobility shift assay) es la más sensible, mide infliximab y adalimumab con los anticuerpos simultáneamente, identifica resultados falsos positivos de anticuerpos del ELISA, pero es costosa.369, 371-374
· Los umbrales pueden depender de la técnica usada.
· Se sumariza en una tabla la conducta habitualmente aconsejada para optimización de anti-TNF por niveles séricos y anticuerpos antidroga.
Algoritmo reactivo (Figura 10).
f. Perfil de seguridad de los anti-TNFs
La mayoría de los efectos colaterales asociados con el tratamiento anti-TNF en EC pueden considerar como efecto de clase. El tratamiento con agentes anti-TNF es relativamente seguro si se usa para indicaciones adecuadas.
Uno de los primeros reportes numérica y científicamente relevantes de vida real fue un estudio de 500 pacientes consecutivos tratados en la clínica Mayo que mostró una tasa de eventos adversos serios (SAE) por sus siglas en inglés Serious Adverse Events, asociados con infliximab del 8,2% e infecciones graves del 4%. Las infecciones son la principal preocupación con el uso de agentes anti-TNF en la EII. Los pacientes tratados con anti-TNF y/o otros inmunomoduladores tienen mayor riesgo de infecciones oportunistas.376 Eventos adversos serios menos frecuentes incluyen enfermedad similar a reacción por suero (3,8%), y alteraciones autoinmunes como lupus inducido por medicamentos (0,6%) y desmielinización (0,2%). La sepsis activa (como un absceso) es una contraindicación absoluta dado el riesgo de septicemia.376, 377 La reactivación o desarrollo de tuberculosis se ha reportado en 24/100.000 pacientes con artritis reumatoidea que recibieron tratamiento anti-TNF, en comparación con 6/100.000 que no recibieron dicho tratamiento.378
Son también importantes los datos del mencionado registro TREAT (The Crohn’s Therapy, Resource, Evaluation and Assessment Tool), publicado en 2006, de 6290 pacientes con Crohn enrolados, de los que el 87% habían recibido infliximab 3179 (5519 pacientes año), y 3111 habían recibido otras terapias con una evaluación media de 1,9 años. Si bien en el análisis univariado se observó un mayor riesgo de infección con el uso de infliximab, el resultado del análisis multivariado de regresión logística reportó que el infliximab no fue un predictor de infecciones graves (OR = 0,99; IC95%: 0,64-1,54). Los factores independientes asociados con las infecciones incluyeron el uso de prednisona (OR = 2,21; IC95%: 1,46-3,34; p < 0,001), el uso de narcóticos/analgésicos (OR = 2,38; IC95%: 1,56-3,63; p < 0,001), y la actividad de la enfermedad moderada-severa (OR = 2,11; IC95%: 1,10-4,05; p = 0,024). En la regresión logística análisis multivariable, solo la prednisona se asoció con un aumento del riesgo de mortalidad (OR = 2,10; IC95%: 1,15-3,83; p = 0,016).209
Turoner señaló que cuando se combinan tratamientos inmunosupresores (esteroides, tiopurinas y agentes anti-TNF) aumenta el riesgo de infecciones oportunistas.208
La mayoría de los efectos deberían considerarse de clase, y son trasladables entre anti-TNF. Estudios altamente relevantes sobre adalimumab son los de Burmester y col., que en 2013 que publicó datos de seguridad de 12 años de experiencia clínica (71 ensayos clínicos) que incluyó 23.458 pacientes, que resultan en 36.730 pacientes-año (PA) de exposición, abarcando estudios randomizados, controlados, fase abierta y extensiones a largo plazo hasta noviembre de 2010 de pacientes tratados con adalimumab con diferentes patologías y globalmente.379 Los grupos fueron EC (EC), incluyendo este diagnóstico 11 estudios, artritis reumatoidea (AR), espondilitis anquilosante (EA), artritis idiopática juvenil (AIJ), psoriasis (Ps). Los SAE (Serio Evento Adverso) más frecuentes fueron los Eventos Infecciosos Serios, (SIEs, por sus siglas en inglés Serious Infectiuos Events) que mostraron las tasas más altas para AR y Crohn, generalmente estables a través del tiempo para todas las indicaciones. Los más frecuentes (tasas > 0,2 eventos/100 PA) en EC fueron: absceso del tracto gastrointestinal (1,6/100 PA), gastroenteritis (0,3/100 PA) y neumonía (0,4/100 PA). La frecuencia difirió de acuerdo con la patología, ya que en otras enfermedades las más comunes fueron: en artritis reumatoidea (AR): celulitis y neumonía, en artritis idiopática juvenil: apendicitis y herpes zoster, en espondilitis anquilosante: infección del tracto urinario, en psoriasis: celulitis. La mayoría de los pacientes con eventos infecciosos serios (70%) continuaron con el tratamiento con adalimumab. Aproximadamente el 28% de los pacientes con EC (32% en el caso de la artritis reumatoidea) suspendieron permanentemente el tratamiento, por un evento infeccioso serio, en comparación con el 18-24% de otras indicaciones. Las infecciones más frecuentes (> 1%) que provocaron la suspensión en la suma de diagnósticos fueron neumonía (6,6%), artritis bacteriana (2,8%), absceso del tracto gastrointestinal (2,6%) y celulitis (1,7%). El índice de TBC activa en los ensayos clínicos fue de 0,2/100 pacientes año (PA). Las infecciones oportunistas en los ensayos clínicos más comunes fueron: candidiasis esofágica y aspergillosis, sepsis por cándida, coccidioidomicosis, infección por CMV, herpes zoster y nocardiosis. En total (excluyendo TBC y candidiasis) se describieron 20 casos, de los cuales 4 fueron en EC (< 0,1 eventos/100 PA). Las tasas de incidencia de trastornos desmielinizantes graves, síndrome lupus-like e insuficiencia cardíaca congestiva (ICC) en todas las indicaciones fueron ≤ 0,1 eventos/100 PA, con la excepción de ICC en pacientes con AR, que fue de 0,2/100 PA. Inicio o agravamiento de psoriasis pustular, ≤ 0,1 evento/100 pacientes año. La incidencia de malignidades en la mayoría de los diagnósticos fue similar a la población general (0,7 eventos/100 PA), excluyendo el cáncer de piel no melanoma (NMSC, por sus siglas en inglés Nonmelanoma Skin Cancer); observado en 0,1/100 PA y el linfoma (0,2/100 PA). Los cálculos de SIR (Standardised Incidence Rates) para linfomas se realizaron en base a 33 eventos, de los cuales 2 ocurrieron en EC), siendo solo en AR mayor que lo esperado (SIR = 2,74; IC95%: 1,83-3,93). El reporte de incremento de NMSC se basó en 184 eventos (22 para EC) presentando la EC junto con AR, un SIR (95% CIs) > 1, mayor al esperado en la población general. El SIR para melanomas (15 eventos, ninguno en EC) fue elevado en la psoriasis. La mortalidad no fue superior a la de la población general. Al respecto del inicio o agravamiento de la psoriasis pustular, se reportó que los anti-TNF pueden inducir inflamación paradójica de la piel, que puede presentar lesiones psoriasiformes u otras, lo cual, aunque suelen ser secundarias a este tratamiento, se comentará en la sección de manfestaciones extraintestinales, dentro de las dermatológicas.
Otro estudio más reciente de AR del mismo autor (Burmester), post-marketing, con exposición a adalimumab por 5 años, demostró resultados que no fueron diferentes a los de los ensayos clínicos.380 Las incidencias de SAE y SEI fueron 13,8 y 2,8 eventos) /100 PA respectivamente. Ellos ocurrieron más frecuentemente en los primeros meses del tratamiento. No se detectaron diferencias en mortalidad ni malignidad respecto de la población general.380
También Colombel y col. evaluaron los eventos adversos de interés por 100 años-paciente de exposición a adalimumab en los ensayos clínicos.381 Las tasas se calcularon mediante datos ajustados por población a partir de estudios clínicos (3160 pacientes con EC), que representan 3401,9 PA de exposición a adalimumab. Las infecciones graves (eventos 100-PA: 6,6) se reportaron como SAE (serio evento adverso) más frecuentes, y entre ellas las más comunes fueron los abscesos (intraabdominales y relacionados con el tubo gastrointestinal). El total de SAE fue: 34,4 eventos 100-PA y aquellos eventos que llevaron a discontinuación fueron del 16,3. En este estudio los principales efectos adversos fueron: malignidad (ocurrió en baja incidencia: 1,3 eventos 100-PA, sumando linfoma y cáncer de piel no melanoma [NMSC] -por sus siglas en inglés- observándose linfomas en < 0,1), infecciones oportunistas (2, incluyendo tuberculosis), enfermedad desmielinizante (0,2), desórdenes tipo lupus-like (0,2), insuficiencia cardíaca congestiva (< 0,1).381 La frecuencia de reacciones en el sitio de inyección fue de 4,1 eventos 100 PA.381 La ocurrencia de cualquier evento adverso fatal (eventos 100-PA) fue de 0,1. La tasa estandarizada de mortalidad (TEM) en este estudio para pacientes con EC tratados con adalimumab fue de 0,44 (IC95%: 0,12-1,12), menor que la tasa de 1,52 (IC95%: 1,32-1,74) que se informó en un metaanálisis de pacientes con EC (una TEM < 1,0 indica que la tasa es menor a la prevista y TEM > 1,0 indica que la tasa es mayor a la prevista) (Canavan y col., 2007).
Las infecciones oportunistas (1,8%) fueron: candidiasis (1,7%), de las cuales más de la mitad fueron de localización oral. Además, se observaron: tuberculosis, CMV, nocardiosis, coccidiodiomicosis (cada una < 0,1%).381
Ljung y col., en un estudio de 217 pacientes tratados con infliximab en Estocolmo, reportó que los riesgos pueden aumentar en personas mayores, ya que en total fallecieron 7 pacientes, siendo el promedio de edad de los mismos de 62,7 años (rango 25-79).377 Para explorar el efecto de la edad, en el registro TREAT publicado en el 2016 (6273 pacientes con EC enrolados) se estudiaron 3440 tratados con infliximab y 2833 con otros tratamientos.383 Los pacientes fueron estratificados en 4 cuartiles según la edad en: ≤ 30 (Grupo 1) n = 1480, 31 a ≤ 41, (Grupo 2), n = 1669, 42 a ≤ 52 (Grupo 3), n = 1535 y > 52 (Grupo 4) n = 1552, con edades medias de 25, 36, 47, y 60 respectivamente, a fin de investigar si la edad es predictor de serias infecciones. Se observó un aumento significativo del riesgo de serias infecciones para los pacientes tratados con infliximab en el Grupo 4 (edad media 60 años) versus el Grupo 1 (edad media 25 años), HR = 1,60 (IC95%: 1,15-2,22; p = 0,005), la cual no se observó en una comparación similar de edades de pacientes no tratados con IFX. HR = 0,774 (IC95%: 0,39-1,532; p = 0,462). Esto puede extenderse a todos los anti-TNF.383
El riesgo teórico de alteraciones linfoproliferativas o enfermedades malignas (especulado debido al papel del TNF endógeno en la supresión de tumores) es controvertido. No se observó incremento de malignidad en el estudio de Fidder ni en el registro TREAT.206, 384 En el avance del registro TREAT publicado en el 2014, los factores asociados independientemente con un mayor riesgo de malignidad fueron la edad del paciente, la duración de la enfermedad y el tabaquismo. No se observó una asociación significativa entre malignidad e infliximab (HR = 0,59; p = 0,16). En un análisis basado en la exposición, el uso de inmunosupresores como monoterapia (OR = 4,19; IC95%: 0,58-30,37; p = 0,16) o en combinación con infliximab (OR = 3,33; IC95%: 0,46-24,06; p = 0,23) parecían asociarse con un riesgo numérico mayor de malignidad que en el tratamiento con infliximab como única droga (OR = 1,96; IC95%: 0,23-17,02; p = 0,54) cuando se compararon ambos con el tratamiento con ninguna de las dos drogas, pero estos resultados no fueron estadísticamente significativos.
Un metaanálisis de 26 estudios con 8905 pacientes y 21.178 pacientes-año de seguimiento en estudios clínicos con agentes anti-TNF en EII sugiere un aumento del riesgo de linfoma.280 Entre los sujetos tratados con anti-TNF, se informaron 13 casos de NHL (6,1 por 10.000 pacientes-año); debe tenerse en cuenta que la mayoría de estos pacientes tenían exposición previa a inmunomoduladores. Los sujetos tratados con anti-TNF + inmunomodulador presentaron un riesgo significativamente elevado (SIR = 3,23; IC95%: 1,5-6,9) en comparación con la tasa esperada de linfomas no Hodgkin’s en la base de datos Surveillance Epidemiology & End Results de la población de EE. UU. (SEER: 1,9 por 10.000 pacientes/año). Asimismo, comparando los tratados con anti-TNF + inmunomoduladores con la tasa de NHL en pacientes con EC tratados solo con inmunomoduladores (4 por 10.000 pacientes-año: 3,6, según Kandiel)276, el SIR fue de 1,7 (IC95%: 0,5-7,1). Aunque 1,7 es más alto que los tratados con immunomoduladores, no fue estadísticamente significativo (IC95%: 0,5-7,1).278. 280, 385 Este riesgo predomina en hombres, y al excluir 2 estudios de los cuales el 15% de los pacientes se retiraron, aumenta el riesgo absoluto de NHL a 9,4 por 10.000 pacientes año con un SIR de 9,4 (IC95%: 1,8-12,3). El riesgo es sensible a edad y sexo (masculino). El riesgo de NHL aumenta con la edad, pero la única categoría en que alcanzó diferencia estadística fue en hombres de entre 55-64 años, con un SIR de 16,8. El concepto actual (según los datos de la Cohorte francesa CESAME) es que los linfomas están más frecuentemente relacionados con las tiopurinas y/o con el tratamiento combinado.277, 279, 385 Además, debe recordarse que en niños y jóvenes que recibieron concomitantemente tiopurinas, aumenta la probabilidad de linfoma hepatoesplénico de células T, aunque el riesgo es muy bajo.
El registro Pyramid se presentó en ECCO 2017, con el objetivo de evaluar el riesgo de linfoma y otras neoplasias en los pacientes tratados ya sea con adalimumab monoterapia, con tiopurinas, con corticoides o con ambos.386 La duración media de tratamiento con ADA fue de 1212,4 (835,4) días. La exposición acumulada a adalimumab excluyendo la exposición durante estudios previos de EC, fue de 16680,4/pacientes/año con un seguimiento individual máximo de alrededor de 6 años. Un 12% (n = 601) de los pacientes ya habían sido enrolados en estudios previos con adalimumab. Se reportaron 10 linfomas: 9/10 pacientes habían tenido exposición previa y/o actual a inmunomoduladores. Este registro concluye que la tasa de exposición ajustada de linfoma fue 0,060 eventos/100 PA, menor a la esperada de 0,084 eventos/100 pacientes/año. Los pacientes en terapia combinada de ADA + IMM reportaron más neoplasias, 3,0% (n = 54), que los que solo recibieron ADA: 1,9% (n = 62), p = 0,018.386
Los previamente mencionados son efectos de clase, pero las reacciones en el sitio de inyección constituyen un efecto adverso de las medicaciones subcutáneas y las reacciones de infusión son efectos de los anti-TNF administrados de forma intravenosa. Los demás anti-TNF tienen porcentajes equiparables de reacciones adversas.
Conceptos a resaltar como conclusión
– Los pacientes tratados con agentes modificadores de la inmunidad tienen un riesgo aumentado de presentar infecciones bacterianas, virales, micóticas y parasitarias. Los anti-TNF se asocian más frecuentemente con micosis y mycobacterias, los corticoides con micosis, y las tiopurinas con infecciones virales; es importante considerar la superposición entre inmunomoduladores.387
– Los abscesos intraabdominales se describen como una de las infecciones serias más frecuentes en enfermedades inflamatorias intestinales.
– Una cuidadosa selección de los pacientes y un seguimiento meticuloso pueden disminuir la carga de efectos colaterales asociados con el tratamiento anti-TNF y con el uso de inmunosupresores en general.
– Dado que los riesgos de infecciones pueden ser comunes a otras drogas, con los anti-TNF deben utilizarse normas de prevención, en este aspecto, bastante similares a las utilizadas para las tiopurinas. Es relevante adherir a las medidas preventivas establecidas universalmente y adaptadas a las situaciones locales antes de la introducción de inmunosupresores y biológicos donde se especifican las medidas de prevención de la ECCO y normas nacionales. Ver: medidas de prevención de efectos adversos en pacientes inmunocomprometidos.
– Ver Estrategias para mejorar la seguridad del tratamiento.
Reacciones de infusión
Se definen como reacciones de infusión a ciertos efectos indeseables que aparecen durante o después de realizar la infusión. La administración de infliximab, al ser un anticuerpo quimérico, determina la formación de anticuerpos anti-infliximab, dando lugar a las reacciones de infusión y una disminución o pérdida de la respuesta al tratamiento.
Los porcentajes varían según las distintas series. En pacientes con EC, se estima que ocurren reacciones de infusión en un 5-10% de las infusiones.388, 389
Estas pueden ser: reacciones agudas, o bien, reacciones retardadas.388-390
– Reacciones agudas: son las que aparecen durante la infusión o en las primeras 24 h. Las manifestaciones clínicas son: exantemas maculares, urticaria, opresión torácica, sensación de mareos o disnea, cefalea, hipotensión o hipertensión, náuseas, sudoración. Las que se producen dentro de las 2 horas, durante o poco después de la infusión, generalmente responden favorablemente a la disminución de la velocidad de infusión o al tratamiento con antihistamínicos, paracetamol, o, en algunos casos requieren corticosteroides.350 La prevalencia reportada en el estudio de Mayo Clinic es del 3,8%, (19 de 500 pacientes) reportando que debieron discontinuar la infusión en el 9 de estos 19 pacientes. La mayoría ocurren después de la segunda infusión.376
– Reacciones retardadas: se presentan entre las 24 h y 14 días después de la infusión. Los síntomas característicos son: artralgias, mialgias, síntomas tipo influenza, cefalea, cansancio, fiebre y urticaria. Estas reacciones fueron reportadas en el estudio de la Mayo Clinic en el 2,8%, y en series no controladas en el 9%.376 Ocurren especialmente si se producen intervalos prolongados desde la última infusión, lo que avala el tratamiento reglado, comparado con el tratamiento a demanda. Además se reportó como relevante la falta de inducción inicial, cuando existe un período de 20 semanas o más entre la primera y la segunda infusión.398, 390 En estas circunstancias se recomienda la administración previa de hidrocortisona, que algunos centros realizan rutinariamente, pero es frecuente la pérdida de respuesta a través del tiempo.207, 376, 391
Según la gravedad se pueden categorizar en:388-391
– Leves: se autolimitan o ceden espontáneamente cuando se disminuye la velocidad de infusión o cuando esta se suspende temporariamente.
– Moderadas: por lo general requieren de la interrupción de la infusión, hasta que cedan los síntomas.
– Severas: se determina la suspensión de la infusión y en ocasiones la hospitalización del paciente.
La mayoría de las reacciones de infusión son leves o moderadas.
· Mecanismos involucrados en las reacciones de infusión388-390
a) Reacciones anafilácticas: son reacciones sistémicas agudas causadas por la liberación masiva de histamina y otras citoquinas de los mastocitos, mediadas por IgE (hipersensibilidad tipo I). Sin embargo, la mayoría no se deben a este mecanismo. Los síntomas más comunes son: prurito, urticaria, broncoespasmo. Se tratan con antihistamínicos, corticoides y/o antialérgicos según la magnitud del cuadro. Las reacciones severas pueden requerir epinefrina.376, 388-391
b) Reacciones no anafilácticas: no son mediadas por IgE. Son el resultado de la degranulación directa y la activación de mastocitos causada por la droga en sí, debido a la formación de inmunocomplejos.
Los síntomas son inespecíficos: náusea, cefalea, sudoración o mareos. A menudo se relacionan con la velocidad de infusión, y se tratan disminuyendo la velocidad o deteniendo la infusión, administrando paracetamol y/o difenhidramina.388-390
– Enfermedad del suero like, llamada así porque en realidad se parece a la enfermedad del suero. Cheifetz sugiere que el mecanismo podría ser una forma leve de eventos de verdadera hipersensibilidad tipo III, debido a que se observa el síndrome clínico característico, pero habitualmente no se detecta la evidencia de laboratorio (disminución del complemento y presencia de inmunocomplejos Antígeno-Anticuerpo circulantes), para lo cual proponen el nombre de reacción retardada inmunomediada. Frecuentemente hay anticuerpos anti-infliximab.
– Hay otros síndromes a considerar bajo esta definición clínica: reacciones lupus-like (asociadas con anticuerpos anti-doble cadena de DNA), y otras que se presentan con síntomas conocidos como flu-like (temblores, escalofríos, malestar general, tos seca, pérdida de apetito, dolores corporals, náuseas), manifestaciones extraintestinales, e incluso con síntomas gastrointestinales, lo que simula una reactivación de EII.
– Los síntomas típicos son erupción, fiebre y poliartralgias. El cuadro resuelve a las semanas de interrupción del tratamiento.392
El tratamiento varía según la presentación (comúnmente, antihistamínicos y paracetamol, y si hay artralgias/artritis puede usarse analgesia con tramadol y, eventualmente, corticoides).
· ¿Cómo se puede intentar prevenir las reacciones de infusión?
Se adjunta un esquema del manejo de las reacciones de infusión según sus características (Figura 11).
– Premedicación: no hay pruebas sólidas sobre el efecto protector de la premedicación antes de realizar las infusiones con antihistamínicos y corticoides, por lo que este tema es controvertido.388-391 Si bien conocemos las controversias, en nuestro centro premedicamos.
– Infusiones regladas: se ha demostrado que realizar una inducción (0-2-6 semanas) es menos inmunogénico que una dosis única de inicio. Además, el tratamiento de mantenimiento cada 8 semanas es mejor que el episódico para prevenir la formación de anticuerpos.350, 388
– Uso de inmunosupresión: el uso combinado con inmunosupresores reduce la antigenicidad.350
· Se adjunta una tabla con un sumario de las contraindicaciones de los anti-TNF (Tabla 66).
Tabla 66. Contraindicaciones de los biológicos anti-TNF.
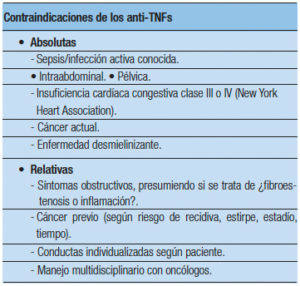
g. Otros biológicos (ver en: nuevos tratamientos (pág. 191 a 215)
Se discutirán en el apartado sobre nuevos agentes farmacológicos, ya que los biológicos no anti-TNFs disponibles (vedolizumab y ustekinumab) son de reciente aprobación y comercialización en Argentina.
5. Antibióticos en EII
El uso de antibióticos como tratamiento primario de la CU no está avalado por la evidencia. Se utilizan solo en las complicaciones, o patologías cexistentes, como en el agregado de una colitis infecciosa concomitante; en complicaciones que pueden implicar translocación bacteriana, como el megacolon tóxico, y en los colectomizados con pouch ileoanal anastomosis (cuando en realidad el diagnóstico es una pouchitis: inflamación del reservorio ileal).
En la EC, la eficacia de los antibióticos fue investigada en estudios realizados con escaso número de pacientes en la EC luminal y perianal y en la prevención de la recurrencia posquirúrgica. En la EC luminal actualmente son poco usados.139
Los antibióticos que se han ensayado en la EII incluyen metronidazol y ciprofloxacina. El metronidazol fue evaluado en la EC en un estudio de 16 semanas de 105 pacientes, no resultando estadísticamente superior al placebo cuando se compararon los porcentajes de inducción de remisión entre grupos, pero se observó una disminución en CDAI entre 67 y 97 puntos en el grupo de metronidazol (10 y 20 mg/kg respectivamente), en comparación con un disminución de sólo 1 punto con placebo (p = 0,002), así como descenso de la α-1-glucoproteína ácida (marcador de actividad) y de la PCR (consideradas juntas las dos ramas de dosis). El beneficio se limitó a los casos con compromiso colónico. El porcentaje de pacientes que se retiraron del estudio es remarcable (53%), 17 de ellos por efectos adversos.393
En un estudio cruzado de 78 pacientes de 8 meses (dos períodos de 4 meses), la respuesta al metronidazol fue similar a la respuesta a la sulfasalazina (tasas de remisión en cada rama, sin placebo), pero una cantidad mayor de pacientes que fracasaron con sulfasalazina respondieron al metronidazol al cruzar a los pacientes según diseño, mientras que no ocurrió lo mismo a la inversa.394 Los eventos adversos en los pacientes tratados con metronidazol pueden incluir náuseas, sabor metálico, reacción tipo disulfiram y neuropatía periférica (pacientes con 15-20 mg/kg/d con una dosis acumulativa de > 30 g).395
Si bien la ciprofloxacina en un estudio se comparó con mesalazina en la EC activa, reportándose buena respuesta a 6 semanas, no es actualmente una opción reconocida para el tratamiento de la actividad de la EC.396
Se estudió el uso precoz de metronidazol durante 3 meses para la prevención de la recurrencia posquirúrgica en el neoterminal luego de resección ileal y anastomosis, en comparación con placebo. El 75% de los pacientes en el grupo placebo presentó lesiones recurrentes en el íleon neoterminal en comparación con el 52% en el grupo de metronidazol (p = 0,09). La recurrencia endoscópica severa se redujo de forma significativa en el grupo deen el grupo de metronidazol (13%) en comparación con el de placebo (43%; p = 0,02), demo-rando la tasa de recurrencia clínica a 1 año (4% contra 25%). Los efectos adversos son más frecuentes que con placebo.397
· Con excepción de la última mencionada aplicabilidad del metronidazol, actualmente, los antibióticos se consideran adecuados sólo para complicaciones sépticas, los síntomas atribuibles a la contaminación bacteriana, pouchitis o enfermedad perineal. Se postuló el tratamiento anti-mycobacteria, no avalado por la evidencia.139
6. Recientes conceptos estratégicos para el manejo de la EII
Como se describió previamente, el tratamiento de la EII consiste en la inducción de la remisión y en su mantenimiento. Por ello es fundamental acentuar que se deben descartar otras causas de los síntomas (además de la actividad de la enfermedad), como causas funcionales, infecciones intestinales o síntomas secundarios a cirugías previas (sobrecrecimiento bacteriano, diarrea colerética, intestino corto, bridas, fibroestenosis).
Los pacientes deben estar adecuadamente informados y se los debe alentar a participar activamente en las decisiones terapéuticas. También deben tenerse en cuenta diversas situaciones especiales tales como el embarazo y la lactancia. Al decidir la estrategia adecuada de tratamiento para la EII, deben considerarse:
- Diversos aspectos específicos relacionados con el impacto intestinal y sistémico de la enfermedad. Algunos de los que hemos mencionado se postularon como predictores de pronóstico y fueron avalados con evidencia. Según estudios observacionales de casuísticas numerosas basados en la evolución natural de la enfermedad, deben considerarse factores adicionales como la edad al inicio, la duración de la enfermedad y, adicionalmente, características objetivables en los estudios, como la severidad de las lesiones endoscópicas, y algunos parámetros de laboratorio, aspectos que más adelante abordaremos más extensamente.
- Diversos aspectos relacionados con la medicación. Ellos dependen del perfil de efectos colaterales, la historia de la respuesta y la tolerancia individual, como así también de las comorbilidades y de los fármacos concomitantes no relacionados con la EII. Adicionalmente, deben tenerse en cuenta si determinaciones como caracterización genotípica o fenotípica de TPMT están disponibles o si el paciente ya está tratado, y los dosajes de los metabolitos de la TPMT o de niveles de biológicos o anticuerpos, según corresponda.
- Intentar lograr más allá de la remisión clínica es un tema relevante, que se se basa en evidencias de que ello podría disminuir las recurrencias y prevenir complicaciones, hospitalizaciones y cirugías. De esta propuesta surge el llamado: tratamiento hacia un objetivo.
a. Tratamiento hacia un blanco (consenso reciente)
Es una estrategia de manejo del tratamiento orientada al logro de un blanco, entendido como un objetivo (treat to target). Consiste en la evaluación regular de la actividad de la enfermedad usando parámetros objetivos clínicos y biológicos, que representan los blancos a lograr mediante el subsecuente ajuste del tratamiento (optimización). Para ello se propuso estratificar a los pacientes por riesgo de progresión (evaluando además comorbilidades del paciente individual) y elegir los blancos de la terapéutica.
Respecto de los blancos, se propuso: la asociación de síntomas clínicos, la cicatrización mucosa y la normalización de marcadores serológicos y fecales sustitutos de la endoscopía. Entre los últimos se destacan la PCR y la calprotectina fecal.
Respecto de los tiempos para la repetición de los estudios endoscópicos en las primeras publicaciones, se propuso: 6 meses hasta lograr la cicatrización mucosa y cada 1-2 años posteriormente.398
Respecto del monitoreo de los síntomas clínicos y marcadores, se sugirió inicialmente el control mensual en la enfermedad severa/moderada y cada 3-6 meses en los demás casos.398
Consenso STRIDE sobre tratamiento hacia un blanco: el mencionado consenso de la International Organization for the Study of Inflammatory Bowel Diseases (IOIBD) de 28 especialistas elaboró recomendaciones sobre la base de una revisión sistemática de la literatura y la opinión de expertos para definir los blancos a utilizar en el tratamiento hacia un objetivo avalados por la evidencia. Recordamos que el documento resultante del consenso se llamó STRIDE (Selecting Therapeutic Targets in Inflammatory in Bowel Disease). Los blancos potenciales que se investigaron fueron: clínicos, endoscópicos, histológicos, imágenes, biomarcadores, Patient Report Outcome (PRO).80
Luego del análisis, este consenso ratificó la utilidad de la endoscopía y recomendó los parámetros a lograr:
Cicatrización de la mucosa: definida como ausencia de úlceras en EC y scores de Mayo 0-1 en la CU, para la cual el blanco óptimo es 0 y el mínimo requerido 1.
Imágenes: consideradas blanco en la EC solamente, en el caso de que la endoscopía no pueda evaluar adecuadamente la inflamación. Los estudios por imágenes para evaluar las lesiones estructurales son de gran utilidad. El score MaRIA (magnetic resonance index of activity) demostró correlación entre las lesiones endoscópicas y la entero-RMI.115
El tiempo para los controles: se sugirió 6-9 meses en la EC y 3-6 meses en la CU.80
Los biomarcadores de actividad séricos y fecales: entran en el escenario de herramientas para el manejo del paciente por ser no invasivos y/o de menor costo que los endoscópicos y las imágenes. Sin embargo, los biomarcadores no han sido consensuados debidamente como blancos adecuados para llevar a cabo la optimización de la terapia por sí mismos. Se aconseja, hasta el momento, considerarlos mediciones adjuntas que facilitan el monitoreo, por sugerir la necesidad de endoscopía o imágenes que avalen la conveniencia de optimizar, ya que pueden reflejar inflamación intestinal residual.80
PROs (patient reported outcomes; en español: evolución reportada por el paciente): para describir la clínica se decidió incorporar este ítem, que involucra (pudiendo ser variable) lo que el paciente reporta en relación con su condición de salud.
· Fueron considerados objetivos primarios en la CU
PROs clínicos: la normalización del hábito intestinal y el sangrado, que deberían controlarse al menos cada 3 meses cuando existan síntomas.
Según lo previamente mencionado, en la CU se debería evaluar endoscópicamente dentro de 3-6 meses después del inicio de la terapia.
· Fueron considerados objetivos primarios en la EC
El dolor y la normalización del hábito intestinal, que deberían controlarse al menos cada 3 meses cuando existan síntomas.
Según lo previamente referido, en la EC se aconseja evaluar endoscópicamente a los 6-9 meses y cada 6-12 meses cuando se controlaron los síntomas.
· Otros objetivos clínicos posibles: es relevante la normalización de la calidad de vida.80
Se presenta en una tabla un sumario de los resultados del consenso STRIDE (Tabla 67).
Tabla 67. Sumario de los resultados del consenso STRIDE Selecting Therapeutic Targets in Inflammatory Bowel Disease (normatizando el tratamiento hacia un objetivo).

Si bien estas estrategias son promisorias, aún debe corroborarse si la implementación de algoritmos no totalmente estandarizados, persiguiendo estos blancos, cambiará el curso clínico y la calidad de vida de los pacientes. Por lo tanto, las indicaciones y los cronogramas de estas estrategias aún no están totalmente estandarizados.
Más allá de todos las evidencias y proyectos estratégicos para mejorar el futuro curso de la enfermedad, nunca debe olvidarse tomar en cuenta el riesgo beneficio (con la consideración de las comorbilidades) de cada paciente individual.
En ensayos clínicos se ha intentado utilizar diversos PRO que emergen de escalas de distinta índole que se han diseñado a lo largo del tiempo, que incluyen calidad de vida, ansiedad, depresión, fatiga, productividad laboral y discapacidad. Sin embargo, los datos de resultados con estos PRO en pacientes con EII son limitados y no se miden de manera consistente. Los instrumentos de calidad de vida se han utilizado en general como puntos finales secundarios en ensayos clínicos en EII. También deberían tenerse en cuenta objetivos a acordarse con el paciente individual.80
A fin de ejemplificar como se desarrollaron algunos de los PROs, se presentan tablas que resumen algunos de los diseñados para la CU o la EC (Tablas 68 y 69).
Tabla 68. Patient Report Outcomes (PROs) en la colitis ulcerosa.

Tabla 69. Patient Report Outcomes (PROs) en la enfermedad de Crohn.
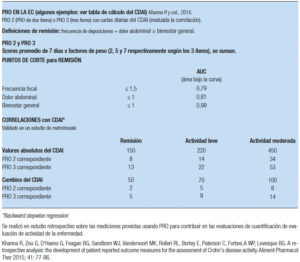
b. Significado evolutivo del damage score (índice de daño) de Lémann
El score de Lémann fue planeado, como ya señalamos, como una estrategia para cuantificar el daño acumulativo por la enfermedad (Tabla 44). Los métodos de estudio por imágenes enterorresonancia y enterotomografía (la primera es preferida debido a la seguridad en relación con el no empleo de radiación ionizante) se han incluido en este score internacional ya mencionado. Su utilidad práctica se describe a continuación:
– Se publicaron los resultados de un estudio realizado en Francia en el que se controlaron los cambios en el score del índice de Lémann136, 137, 399 en una cohorte de 221 pacientes (2004-2011), en quienes los scores se evaluaron durante los 2 primeros años y de 2 a 10 años de EC, buscando factores asociados con el daño digestivo. Se realizaron 2 o 3 evaluaciones morfológicas seriadas de los pacientes durante un período de 2 a 10 años, mediante imágenes examinadas por un gastroenterólogo y un radiólogo, y se calcularon los scores del índice. El punto de corte elegido para la definición de daño transparietal sustancial fue un valor de 2. Los factores asociados con un score superior a 2 en la última evaluación y la progresión de los scores del índice se evaluaron mediante análisis univariado y regresión logística. La mediana del score (2,3; rango intercuartil [RIC]: 1,2-3,9) inicial incrementó con el tiempo, llegando casi a cuadruplicarse en 5-10 años y los scores aumentaron significativamente en cada etapa en comparación con la inicial.
– Después de 73 meses (RIC: 51-96) de evaluación de seguimiento, 138 pacientes tenían un valor del índice de Lémann superior a 2,0. El score de Lémann inicial predijo el daño tardío. Los factores asociados con la progresión del daño fueron la resección intestinal, el tiempo y el porcentaje de tiempo, dentro de una enfermedad clínicamente activa.
– Por lo tanto, con base en un análisis de los pacientes con EC mediante el índice de Lémann, casi dos tercios de los pacientes tienen un daño considerable en la mucosa de 2 a 10 años después del diagnóstico.137, 399
c. Estrategias para mejorar la seguridad del tratamiento
– Medidas de prevención de efectos adversos en pacientes inmunocomprometidos
Es un tema de preocupación debido al uso de drogas que modifican la respuesta inmune; en este sentido, la EII presenta desafíos particulares para el médico. Las infecciones oportunistas son con frecuencia difíciles de identificar y se asocian a morbilidad y mortalidad importantes. Aunque los mecanismos de acción no son iguales en los distintos tipos de inmunomoduladores usados en la EII, todos comprometen en algún grado la respuesta inmunitaria del paciente.
Se consideran inmunocomprometidos a los tratados con corticoides en dosis equivalente a prednisona ≥ 20 mg/día durante ≥ 2 semanas, tiopurinas, metotrexato, ciclosporina, tacrolimus o anti-TNF.
Diversas infecciones virales, bacterianas, parasitarias y micóticas se asociaron con el uso de tratamiento inmunomodulador en la EII. Además del uso de inmunomoduladores, otros factores de riesgo de infecciones oportunistas incluyen desnutrición, enfermedades concomitantes y antecedentes de infecciones graves. La edad es otro factor de riesgo independiente para infecciones oportunistas.387 Cabe destacar que las combinaciones de tratamientos inmunomoduladores en EII se asocian con un aumento del triple en el riesgo de infecciones oportunistas si se usa un inmunomodulador OR 2,9 (1,5-5,3), y un aumento sustancial (OR = 14,5; IC95%: 4,9-43) si se usan dos o más drogas inmunomoduladoras de forma concomitante.208
Actualmente no existen métodos precisos para evaluar cuantitativamente el nivel de inmunosupresión en pacientes con EII.
Las medidas para reducir o prevenir la aparición de infecciones oportunistas son esenciales para decidir la introducción de inmunosupresores o biológicos, pero deben practicarse apenas se lo recibe al paciente, ya que cualquier individuo afectado por EII es un potencial candidato (Tabla 70).
Tabla 70. Evaluaciones antes de la introducción de inmunomoduladores y/o biológicos. Extendidos a todas las EII como potenciales candidatos.

· Recomendaciones ECCO:387 esta entidad propuso una lista de verificación estandarizada (checklist) para evaluar y prevenir riesgos de infecciones oportunistas en la atención clínica habitual de pacientes con EII. Este, que es de extraordinaria utilidad, debe sin embargo adaptarse a las condiciones y prácticas clínicas regionales. ECCO (OI) Consensus Checklist (Edition 2014) (Disponible en línea: https://www.eccoibd.eu/images/6_Publication/6_3_ECCO%20Guidelines/MASTER_OI_Consensus_UpdateCheckList_OI_guidelines_2014.pdf).400
· Recomendaciones nacionales: se dispone de un consenso de la Sociedad Argentina de Infectología, con normas nacionales que incluye recomendaciones de prevención de infecciones en pacientes que reciben modificadores de la respuesta biológica.401 Asimismo, se disponen de recomendaciones nacionales de vacunación argentina en el Programa Nacional de Control de Enfermedades Inmunoprevenibles (ProNaCEI). http://www.msal.gob.ar/images/stories/bes/graficos/0000000451cnt-2013-06_recomendaciones-vacunacion-argentina-2012.pdf 401, 402
Debe realizarse un extensivo interrogatorio, examen físico, historial de vacunas y exámenes de laboratorio. Es sumamente importante que el equipo multidisciplinario incluya a infectología.
Serologías a solicitar en los pacientes con EII
HIV IgG (ELISA), VDRL (si es positiva confirmar y tratar), chagas (IFI, ELISA, IHA, se requieren 3 testeos con 2 resultados positivos), toxoplamosis IgG, VZV IgG, sarampión IgG, HBV (HBsAg, AcAnti-HBs, AcAnti-HBc, HBeAg a criterio del médico para chequear infectividad), HVC IgG, la serología de hepatitis A (HAV IgG, HAV IgM) se realizará según criterio médico. Además, se solicita serología para virus Eipsten Baar (VEB), y en inmunosuprimidos, serología CMV IgG.52, 377, 401-404
Conducta a seguir con las serologías positivas por virus de la hepatitis B previas al tratamiento:
- Si es AcAnti-HBs (+), AcAnti-HBc (core) positivo y HBsAg (-) puede tratarse de un vacunado o tener una HBV oculta (por ello corresponde seguir con carga viral para detectar reactivación).
- Si es HbsAg positivo asintomático, se realiza profilaxis antiviral 2 a 4 semanas antes de iniciar el anti-TNF, y se continúa 6 meses.
- Si es HBsAg positivo con enfermedad, se indica tratamiento y control antes de iniciar anti-TNF (lamivudina con inmunosupresión menor de seis meses, entecavir o adefovir con inmunosupresión mayor de seis meses).
Virus de la hepatitis C positivo: se realiza tratamiento y seguimiento con carga viral durante el tratamiento.400-402
Estas conductas, propuestas en la literatura, se consensuan con los hepatólogos en equipo multidisciplinario, para cada paciente individual.
Prueba de detección de tuberculosis: PPD (2UT: positiva en inmunocomprometidos PPD ≥ 5 mm y PPD ≥ 10 en inmunocompetente). Repetir cada 12 meses.
La técnica de IGRA (ensayo de liberación de IFNγ, luego de la exposición al antígeno de la TBC) con la que no contamos aún en el país, al no presentar reacción cruzada con el bacilo de Calmette-Guérin presente en la BCG, descarta falsos positivos.
Puede realizarse Booster (repetir PPD en 2 semanas en caso de anergia), pero no está normatizado en nuestro país.52, 387, 400, 401
La TBC latente se trata con isoniazida durante 9 meses, y se extiende a 12 meses en caso de inmunsupresión severa. Si bien las guías del CDC aconsejan no administrar terapias anti-TNF hasta completar el tratamiento de TBC latente o activa, si es urgente, las guías europeas acortan el tiempo de tratamiento de la TBC latente a 2 semanas (pero no en TBC activa, en cuyo caso el tiempo se extiende).400, 401
Determinaciones en materia fecal
– Toxinas A y B para Clostridium difficile.387
– Coprocultivo y parasitológico (este último según epidemiología y antecedentes).
Otros estudios
– Radiografía de tórax.
– En caso de sospecha de absceso o fibroestenosis: tomografía computada/RMI, enterografía, exámenes para descartar abscesos perianales y, si los mismos se detectan, se realiza drenaje (sedales si está indicado).
– Descartar otros focos de infección (por ej.: dental).
– Virus Epstein-Barr (VEB): EBNA antígeno temprano, monotest. Se aconseja conocer el estatus inmunológico para este virus antes de iniciar tratamiento inmunosupresor. El desarrollo de algunos tipos de linfoma está claramente relacionado con el virus de Epstein-Barr (EBV). Se puede usar aciclovir en infecciones graves durante el tratamiento inmunosupresor, el cual debe suspenderse, al menos temporariamente.387, 400, 401, 403, 404
– CMV en biopsias con inmunohistoquímica en pacientes sintomáticos inmunocomprometidos (puede ser precedido por IgG CMV: positiva en gran porcentaje de la población). Si es negativa no es necesario la búsqueda de CMV en biopsias.403, 404
– Virus del papiloma humano (HPV): control ginecológico y PAP. No contraindica la inmunosupresión.
– Virus herpes simple: ante antecedentes de herpes simple recurrente, considerar la profilaxis mientras dure la inmunosupresión con aciclovir 400 mg cada 12 horas, valaciclovir o fanciclovir.
Vacunas recomendadas: pueden ser usadas intra, pre o post-tratamiento, idealmente al conocer al paciente porque toda EII es un potencial candidato para inmunosupresión.387, 400-402 (Las vacunas inactivadas no representan riesgo en inmunosuprimidos).
– Hepatitis B: 3 dosis (0, 1 y 6 meses). Controlar Anti-HBs cuantitativo un mes después de la última dosis (≥ 10 UI).
Estudiar IgG VHA antes de vacunar. Vacunación: 2 dosis separadas por 6 meses. Si el resultado es positivo, no vacunar (los valores de corte dependen de la vacuna administrada y de la edad mayor o menor de 18 años).
– Influenza inactivada trivalente estacional: 1 dosis anual en otoño.
– Vacuna antineumocóccica: vacuna antineumocóccica 13 valente conjugada (PCV 13) y polisacárida 23 valente (PPSV). Inicial 1 dosis de PCV 13 (antineumocóccica conjugada), y luego PPSV 23 (antineumocóccica polisacárida) a los 2 meses, refuerzo a los 5 años, y otra luego de los 65 años.
– Vacuna antimeningococo: conjugada ACWY (a criterio médico, requerida en aesplenia funcional) refuerzo a 5 años, con distancia de 1 mes de la antineumocócica.
– Difteria/tétano acelular (DTa) Doble adultos (revacunación cada 10 años), si recibieron el esquema completo a 0, 30, 360 días. Si no lo recuerdan o no lo recibieron, realizar este esquema. Una de las dosis debe contener Pertussis acelular (DPTa) HPV cuadrivalente: 3 dosis a 0, 1 o 2 y 6 meses entre los 11 y 26 años. Puede administrarse la mencionada Gardasil (4 serotipos) o Cervanix (2 serotipos).
Las vacunas contraindicadas cuando el paciente ya está inmunosuprimido, por cual es importante realizar las determinaciones de laboratorio y las vacunas preventivas al conocer un paciente con EII, para evitar oporunidades perdidas de prevención.387, 400-402
No se deben administrar vacunas activas (microorganismos vivos) en pacientes que están cursando tratamiento inmunosupresor.
– Tuberculosis (BCG).
– Fiebre amarilla.
– Sarampión: vacunar según serología (en seronegativos) previo a la inmunosupresión. Se dispone en el país de:
– Doble viral (MR: sarampión, rubeola).
– Triple Viral (MMR): sarampión, rubeola, parotiditis.
– Polimelitis oral (OPV/Sabin): debe suministrase en su reemplazo la vacuna parenteral inactivada (IPV/Salk), Inactivated Polio Vaccine tanto al paciente como a sus contactos.
– Rotavirus (se indica en menores de 1 año, delegando el cambio de pañal por 2 semanas a los contactos no inmunosuprimidos).
Varicela: se indica en inmunocompetentes, 2 dosis en un mes en seronegativos mayores de 13 años y una dosis en menores de 13 años. Colocar no menos de 3 semanas antes y para vacunar suspender al menos 3-6 meses la inmunosupresión.
– Zoster: a mayores de 60 años seropositivos o mayores de 50 años pre inmunosupresión.
– Salmonella typhi oral.
– Influenza inhalatoria: no disponible en la Argentina.
Vacunar a los convivientes (influenza, triple viral MMR), VZV (2 dosis en un mes), si hay exantema indicar aislamiento de contacto, polio inactivada (Salk), rotavirus en niños.
Manejo de las infecciones más frecuentes en pacientes inmunocomprometidos con EII
Las infecciones se detectan específicamente ante sospecha clínica, con métodos específicos de diagnóstico según el microorganismo: citología, cultivo, serología, o detección molecular. Pueden utilizarse diversos métodos (imágenes, endoscopías, etc., para evaluar la localización). Realizar tratamiento específico en el contexto de un equipo multidisciplinario.387, 400, 401
Tuberculosis y otras mycobacterias
TBC latente: ver el ítem de prevención de efectos adversos en pacientes inmunocomprometidos.
TBC activa: cuando se diagnostica una TBC activa, debe ser instaurada la terapia antituberculosa. Los inmunosupresores y anti-TNFs deben suspenderse, y si es necesario pueden reinstaurarse después de 2 meses de iniciado el tratamiento, pero las decisiones deben realizarse multidisciplinariamente, evaluando riesgos y beneficios.
Tener en cuenta que la enfermedad tuberculosa puede presentarse en las siguientes localizaciones:387, 400, 401
– Pulmonar
– Extrapulmonar: ganglionar, peritoneal, pleural, meníngea, gastrointestinal, afectación paravertebral, ósea, genital, urinaria, miliar y otras localizaciones.
Es importante tener en cuenta que un examen directo de biopsia intestinal positivo no significa TBC hasta completar la tipificación y hallazgo del bacilo, ya que puede tratarse de otra mycobacteria.
Otras infecciones oportunistas bacterianas diferentes de la tuberculosis
Debido a los agentes anti-TNFs, la presentación clínica de las infecciones puede ser atípica, con ausencia de fiebre. Las infecciones más comunes son: neumonía, artritis séptica y meningitis.387, 400, 401
Pueden presentarse infecciones por Streptococcus pneumoniae, Legionella pneumophila, Salmonella, Listeria monocytogenes, Nocardia, Clostridium difficile. S. pyogenes, S. aureus, entre otras.387, 400, 401
Micosis
Las infecciones más destacables a considerar son las ocasionadas por:387, 400, 401
– Pneumocystis jiroveci: se realiza profilaxis en pacientes con al menos 2 inmunosupresores (especialmente si incluyen derivados de la ciclofilina) o triple inmunosupresión o con linfopenia < 600 o con CD4 < 300 ml. De elección TMS (160/800 mg 3 veces por semana u 80/40 mg diarios)
– Antecedente de criptococosis: profilaxis combinando el anti-TNF con fluconazol.
– Aspergillus.
– Micosis profundas entre las cuales es relevante el Histoplasma capsulatum.
– Cándida spp.
Parásitos
Las infecciones destacables a considerar son:387, 400, 401
– Strongyloides stercoralis, especial alerta ante eosinofilia, realizando coproparasitológico y sondeo duodenal.
– Toxoplasma gondii
Si el paciente viaja a zonas endémicas de riesgo para diferentes patologías se aconseja realizar consulta previa con infectólogos especialistas en medicina del viajero (el centro público de referencia es el Hospital Muñiz).
Guías de tratamiento de la EII para la práctica clínica
1. Anamnesis para un tratamiento correcto
Preguntas básicas que modifican la conducta terapéutica en el paciente individual:
1. ¿Presenta síntomas o signos de actividad de la enfermedad?
2. ¿Requiere internación?
3. ¿Los síntomas son por la EII o existen otras causas (funcionales, cirugías, fibroestenosis, brida)?
4. ¿Cuál es la localización/extensión de la enfermedad?
5. ¿Es primera presentación o recaída (patrón de recaída: frecuencia, duración y respuesta)?
6. ¿Es virgen de todo tratamiento para EII?
7. ¿Hay discordancias entre los síntomas, el laboratorio (anemia, albúmina, VSG, PCR), las imágenes (radiografía simple de abdomen, RMI, TC, US) y los hallazgos endoscópicos?
8. ¿Es dependiente de esteroides, presentó intolerancia o refractariedad previa a algún medicamento? (Se requiere información detallada: dosis, adherencia, duración).
9. ¿Cuál es la duración del brote actual?
10. ¿Está bajo tratamiento farmacológico para la EII? (Una respuesta afirmativa implica revisar: vía, dosis, adherencia, duración del tratamiento y del inicio de acción, tolerancia, seguridad).
11. ¿Presenta o presentó manifestaciones extraintestinales o complicaciones? (EC = comportamiento estenosante o penetrante, o complicación perianal, o absceso – CU o EC megacolon tóxico o enfermedad maligna).
12. ¿Presenta patologías concomitantes (actuales o antecedentes)? (En ese caso, registrarlas).
13. ¿Recibió recientemente medicamentos para otras afecciones o para síntomas como dolor, fiebre, diarrea? (Antibióticos, AINE, opiáceos, inhibidores de la motilidad intestinal).
14. ¿Presenta algún hábito de abuso de sustancias tóxicas o un estilo de vida que potencialmente podría influir en el curso de la enfermedad?
15. ¿Presenta factores predictivos de mal pronóstico adicionales a la categorización estándar de la enfermedad (por ej., ulceraciones profundas)?
16. ¿Viajó en forma reciente?
17. ¿Cuál es la edad actual y la edad de inicio de la enfermedad?
18. ¿Cuál es la duración de la enfermedad?
19. ¿Cursa un episodio apto para tratamiento médico o una complicación que requiere cirugía?
20. ¿Cuál es el nivel de información del paciente sobre la enfermedad?
A continuación, con base en las evidencias hasta ahora presentadas y la experiencia clínica, delinearemos los principales algoritmos de tratamiento de las EII.
2. Tratamiento de la colitis ulcerosa
a. Factores determinantes de las decisiones terapéuticas en la CU
La forma de presentación es heterogénea entre pacientes, y los síntomas pueden ser mimetizados por otras enfermedades. Se presenta un esquema de la metodología utilizada desde el diagnóstico hasta el tratamiento (Figura 1). Antes de seleccionar el tratamiento se requiere la confirmación de la enfermedad y de su actividad. La sigmoideoscopía flexible y la biopsia, agregando el examen de patología orificial, pueden ayudar a realizar diagnósticos diferenciales que pueden causar síntomas que simulan actividad de la EII (como colitis por citomegalovirus sobreimpuesta a una CU) Debe descartarse el diagnóstico o la complicación con una enfermedad maligna, un sangrado hemorroidal o de otra etiología, tener presente que un síndrome de intestino irritable concomitante puede llevar a sobreinterpretar la presencia de actividad de la CU, asimismo deben investigarse posibles evidencias que orienten a considerar un diagnóstico de EC; más allá de la utlilidad de la rectosigmoideoscopía flexible para el seguimiento, los pacientes deben tener una colonoscopia total y si es posible evaluar el ileon terminal.
Cuando se decide la estrategia adecuada de tratamiento para la CU, se debe considerar la actividad, la extensión (proctitis, compromiso izquierdo, enfermedad extensa) y el patrón de la enfermedad. Debe tenerse en cuenta el patrón de la enfermedad que vamos a tratar, investigando las características mencionadas anteriormente, como la frecuencia de las recaídas, el curso de la enfermedad, la respuesta a la medicación previa, el perfil de efectos colaterales de la medicación y las manifestaciones extraintestinales. Además deben considerarse situaciones especiales, tales como el embarazo y la lactancia. La edad al inicio y la duración de la enfermedad también se reconocen como factores importantes de pronóstico.47 Se ha discutido si la CU es realmente una enfermedad progresiva. Varios autores señalaron que la CU es una enfermedad dinámica, con más de un 50% de los casos que progresan de formas limitadas de la enfermedad (proctitis, colitis izquierda), a formas más extensas de colitis, lo cual agrava el pronóstico. Además se ha documentado por los métodos por imágenes que estructuralmente tiene rasgos de cronicidad (aumento de espesor del espacio presacro, del depósito de grasa, engrosamiento de la pared rectal) en correlación con la duración de la enfermedad).405, 406 Los factores pronósticos de la EII fueron recopilados y publicados por Torres Joana y colaboradores. El procedimiento incluyó extensas revisiones bibliográficas, discusiones y votaciones de expertos en EII sobre la relevancia de los distintos factores predictivos en 32 países, que culminaron con una reunión internacional, en la que se llegó a un consenso global. Por lo tanto, en la CU se han reconocido predictores de mal pronóstico, que han sido postulados para realizar un control más estricto y la consideración temprana de terapias modificadoras de la inmunidad, con el fin de intentar modificar el curso de la enfermedad.407 Se listan en una tabla los factores predictivos de mal pronóstico en la CU (Tabla 71).
Tabla 71. Factores predictivos de mal pronóstico en la colitis ulcerosa.

Algunos factores ambientales, como el tabaquismo, tienen un impacto diferente en ambas enfermedades, así como la inmunogenética y la farmacogenética. Es importante diferenciar los pacientes con CU activa que necesitan hospitalización de aquellos con enfermedad activa leve o moderada, que en general se pueden manejar en forma ambulatoria. El índice más simple, mejor validado y más ampliamente utilizado para identificar la CU grave sigue siendo el de Truelove y Witts. En nuestra práctica hospitalaria, la endoscopía ocupa un papel importante en la evaluación de la actividad de la enfermedad y el diagnóstico diferencial de causas concomitantes de síntomas.
En síntesis, la elección adecuada del medicamento está influenciada por:
• La clasificación de la enfermedad (actividad y extensión según Montreal).
• Respuesta previa y actual al tratamiento (recurrencia, dependencia o refractariedad a esteroides).
• Manifestaciones extraintestinales y sus complicaciones.
• Los demás factores pronósticos (como la edad y las úlceras profundas).
• Un balance entre la potencia del fármaco y sus posibles efectos colaterales (factores individuales, comorbilidades).
b. Algoritmos de tratamiento en la CU
◊ CU de actividad leve a moderada (Figura 12)
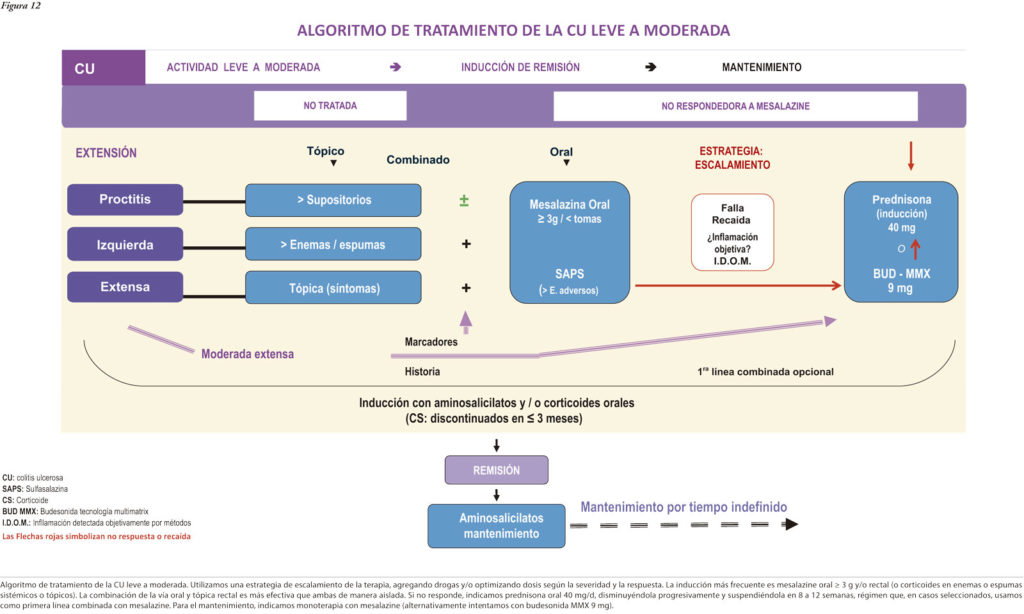
Conceptos generales
El tratamiento es ambulatorio y el desempeño de las tareas laborales debe adecuarse según el grado de compromiso del paciente.
A grandes rasgos, utilizamos una estrategia de escalamiento de la terapia, incrementando drogas y/o optimizando las dosis según la severidad y la respuesta.
I. Medicación de primera línea
– Estrategia de inducción con mesalazina
– La inducción usada más frecuentemente es mesalazina oral y/o rectal (supositorios y espumas o enemas, pudiendo también elegirse preparaciones de corticoides sistémicos o tópicos). El tipo seleccionado depende de la extensión, y de la previa respuesta a alguna de las formulaciones. Si bien se describe una mayor efectividad de la mesalazina, no conocemos comparaciones con la budesonida en espuma. La combinación de la vía oral y tópica rectal es más efectiva que la oral y que la rectal administradas aisladamente.
– Para la inducción con mesalazina oral utilizamos (si bien es controvertido) dosis iguales o mayores a 3 g y procuramos usar presentaciones farmacológicas de alta concentración de droga por unidad (para evitar tomas frecuentes), ya sea en tabletas o en sobres con granulado para aumentar la adherencia.
– Si el paciente está clínicamente activo y ya recibía mesalazina, debemos descartar que la no respuesta se deba a que la dosis indicada es inadecuada, o a que falla en la adherencia al tratamiento. Aconsejamos indicar formulaciones de baja frecuencia de tomas y utilizar (dependiendo de la extensión) el beneficio de la terapéutica oral/rectal combinada.
– Debemos considerar la calidad del fármaco que recibe, ya que las preparaciones comerciales no sometidas a ensayos clínicos pueden presentar problemas en el sistema de liberación de la droga.
– Pese a las bondades de las nuevas formulaciones, cuando los pacientes tienen el antecedente de haber recibido sulfasalazina durante largo tiempo sin presentar efectos adversos, y luego de ser informados sobre otras opciones, si ellos prefieren el menor costo y se concientizan sobre la importancia de la adherencia, puede continuarse con sulfasalazina en lugar de mesalazina ya que la eficacia es al menos comparable, pero aportando simultáneamente ácido fólico. Con la dosis de inducción de remisión (3 g) pueden observarse efectos adversos dosis dependiente, en especial cefaleas. La sulfasalazina puede ser de utilidad adicional en los pacientes con manifestaciones extraintestinales articulares, efecto que no fue observado en la mesalazina y que representaría una ventaja de la sulfasalazina en estos casos, ya que la primera utilización de la misma fue en las artritis.
II. No respuesta a la inducción con mesalazina
• Estrategia de escalamiento de la terapia: manejo de los corticoides orales:
– Indicamos prednisona oral usualmente en dosis diaria de 40 mg (ocasionalmente optimizamos a 60 mg si no responde, en especial si tiene antecedentes similares y con más frecuencia si además tiene alto peso, por lo general ≥ 80 kg), disminuyendo progresivamente hasta suspender en 8 a 12 semanas, continuando solo con mesalazina en régimen similar al descripto cuando abordamos el manejo de las drogas para la CU específicamente. Se debe tener en cuenta que las disminuciones de dosis no deben ser bruscas (según nuestra experiencia), no mayores de 10 mg, y que al llegar a la dosis de 20 mg, en general es aconsejable mantener una meseta un poco más prolongada (3 a 4 semanas) que con las dosis más elevadas, antes de seguir disminuyendo. Es muy importante no prolongar la duración total del curso los corticoides, pero tampoco se deben indicar dosis subterapéuticas ni cursos más cortos que lo convencional, porque está documentado y consensuado que disminuye la eficacia de la inducción de remisión.
– Cabe señalar que ya está disponible la budesonida oral con sistema de liberación MMX, que por ser de baja biodisponibilidad tiene un perfil de seguridad más favorable, pudiendo ser utilizada a dosis de 9 mg durante 8 semanas: esta droga tiene mayor seguridad, aunque menos eficacia que los corticoides de acción sistémica.
– En casos seleccionados, en general, según la historia de la enfermedad, la duración del brote, la extensión (CU extensa), las alteraciones del laboratorio y la calidad de vida, podemos usar como primera línea corticoides orales, que combinamos con mesalazina, manteniendo solo esta última en el largo plazo.
III. Mantenimiento en la CU leve a moderada
• Estrategia de mantenimiento con aminosalicilatos (como optimizar):
– El tiempo de tratamiento de mantenimiento con mesalazina es prolongado y actualmente puede considerarse indefinido.
– Nuestra conducta más frecuente es mantener las dosis de inducción de mesalazina ≥ 3 g hasta constatar que exista remisión endoscópica. Le sugerimos al paciente que no baje la dosis hasta realizar un estudio, aunque sea una videorecto-rectosigmoideoscopía. Evaluamos la calprotectina fecal, si está disponible. La calprotectina puede mostrar valores intermedios de inflamación residual y consideramos que tiene valor sugestivo de remisión cuando, estando elevada antes de la intervención terapéutica, se normalizó o hubo un descenso sustancial que alcanza cifras que se reportaron aceptables en las EII inactivas (menores a 250 mg/1000g, Calprotectina Bühlmann ELISA). Más frecuentemente la consideramos como una alerta (valiosa) y preferimos certificar la remisión endoscópicamente, si el paciente lo acepta. Recién entonces, por lo general, consideramos bajar la dosis a 2 gramos de mesalazina, aunque en algunos pacientes, por comportarse con algún grado de inestabilidad, aconsejamos continuar con dosis más elevadas.
– La dosis de mantenimiento de sulfasazina es 2 g. También tratamos de corroborar objetivamente la remisión antes de bajar la dosis de inducción (si se tolera), en forma similar a lo mencionado para mesalazina.
IV. Recaída leve a moderada durante el mantenimiento de la remisión
· Estrategia según el tratamiento que logró la inducción de remisión:
a) Recaída en los respondedores a la inducción con mesalazina (sin corticoides): Se escala a corticoides orales en esquema similar al descripto, eligiendo el fármaco subsiguiente según si presenta respuesta, dependencia o refractariedad a corticoides.408
b) Recaída en quienes requirieron inducción con corticoides, la cual ocurre en un tiempo ≤ 3 meses de la suspensión (condición que se define como corticoideo-dependencia, al igual que la imposibilidad de reducirlos en 3 meses por debajo de los 10 mg de prednisona).
Según lo expresado previamente, los pacientes corticoideodependientes tienen efectos adversos indeseables secundarios a los esteroides a corto y largo plazo que deben evitarse, y un requerimiento elevado de colectomía. Ver el manejo en el subtítulo V (modalidades de respuesta al corticoide oral en la CU moderada).
V. Modalidades de respuesta al corticoide
(respuesta / dependencia / resistencia)**
• Estrategia según la respuesta:
a) Buena respuesta a corticoides: en este caso se indica mesalazina como mantenimiento.
b) Dependencia a corticoides: corresponde seleccionar entre inmunosupresores, biológicos o la combinación de ambos según los siguientes parámetros: Se grafica el algoritmo de decisión terapéutica en la recaída de CU leve a moderada, y cortico-dependencia/resistencia (Figura 13).
· Inmunosupresores: (tiopurinas) se pueden indicar si hay tolerancia a un puente con prednisona (requerido por la demora de acción de los mismos cercana a 3 meses, que infrecuentemente puede extenderse a 6 meses si la introducción es lenta por intercurrencias). Se utiliza la mercaptopurina 1 a 1,5 mg/kg de peso o azatioprina 2 a 2,5 mg /kg de peso. En ausencia de determinación de genotipos o fenotipos de TPMT, se aconseja comenzar el tratamiento con dosis bajas (no más de 50 mg en el caso de azatioprina o 25 mg en el caso de mercaptopurina) y aumentar la dosis progresivamente con controles de laboratorio de rutina. La imposibilidad de medir la TPMT en nuestro medio determina que seamos más cautos y en algunos casos esperemos algo más de 3 meses antes de considerar que estas drogas no son eficaces en un paciente individual, en especial cuando los leucocitos descienden muy lentamente. En alrededor de un 20% de pacientes las tiopurinas deben suspenderse por efectos adversos. Deben tenerse en cuenta las comorbilidades y factores individuales (por ej.: edad avanzada, hombres jóvenes EBV negativo, antecedente de intolerancia, presencia de efectos adversos actuales, antecedente de malignidades, que se tratan en los ítems de seguridad).
· Biológicos anti-TNF aprobados para CU (infliximab, adalimumab, golimumab) indicados en:
- Falla o intolerancia a los IS (AZA-6MP).
- Intolerancia a un puente con prednisona requerido por los IS.
- Factores de mal pronóstico de la EII.
- Decisión médico-paciente basada en conceptos recientes (por ej.: hombres jóvenes EBV negativo).
- Comorbilidades, como contraindicaciones para anti-TNF o inmunosupresores.
- Preferencia del paciente (ver el manejo de anti-TNF).
· Tratamiento combinado: indicados los anti-TNF conjuntamente con inmunosupresores, como opción en caso de factores de mal pronóstico y/o para intentar mejorar la respuesta (disminuyendo los anticuerpos anti-droga dirigidos contra anti-TNF; en este caso la evidencia es con infliximab y azatioprina, aunque en el mundo real suelen combinarse también los otros anti-TNF).
· Los biológicos de otra clase diferente de anti-TNF (anti-integrinas: vedolizumab, está recientemente aprobado y comercializado en la Argentina) pueden ser indicados, tanto en caso de comorbilidades y refractariedad anti-TNF o inmunosupresores, o alternativamente a ellos en esta categorización de severidad, según lo declara el Consenso Europeo.409 Dado que se incluye entre las anti-integrinas y está recientemente aprobado en la Argentina, se describirá más extensamente en el ítem “Nuevos tratamientos: aprobados y en experimentación”.
c) Refractariedad a corticoides orales
En la enfermedad moderada refractaria a corticoides orales se pueden indicar:
· Biológicos o tratamiento combinado con AZA o 6-MP: según los factores pronósticos, y/o para intentar optimizar la respuesta, teniendo en cuenta también comorbilidades y factores individuales. La combinación a indicar incluye los mencionados anti-TNF disponibles aprobados en CU para este grado de severidad, moderada (infliximab, adalimumab, golimumab). Se incluyen las consideraciones previas con respecto a vedolizumab, pudiendo indicarse alternativamente a los anti-TNF o ante refractariedad o comorbilidades.409
· Corticoides intravenosos: utilizados como puente hacia biológicos con o sin inmunosupresores (mayormente en combinación con infliximab). Indicados en la CU clínicamente moderada, más frecuentemente en algunos pacientes con marcadores de laboratorio y/o endoscopía que denoten una mayor severidad que la sugerida por los síntomas. Cabe señalar que casi la mitad de los pacientes respondedores desarrollarán corticoideodependencia temprana.409, 410 Por ello, deben considerarse precozmente para la toma de decisiones para el manejo a corto y largo plazo los factores predictivos, como úlceras profundas en una CU extensa, la hipoalbuminemia, PCR en niveles altos y los demás mencionados.
(**) La llamada del título de esta sección tiene como objetivo recordar que se deben tener en cuenta factores individuales del paciente: en la selección del tratamiento de dependencia y refractariedad a corticoides deben considerarse también comorbilidades, medicaciones concomitantes y antecedente de intolerancia, edad, acceso al tratamiento, actividad laboral, preferencias, etc., lo que implica que la decisión final debe tomarse según las características del paciente individual.
VI. Modalidades de respuesta a IS (intolerancia / optimización / resistencia)
• Estrategias según respuesta o tolerancia a IS:
a) Buena respuesta/tolerancia: continuar con inmunosupresores, controlando el laboratorio cada 3 meses. El tiempo de tratamiento con inmunosupresores debe ser un balance entre los factores de riesgo individuales y una elevada probabilidad de recaída.
b) No respuesta o pérdida de respuesta a IS: ante todo evaluar si se requiere ajustar la dosis.
- Ante falta de eficacia no resuelta: la conducta es cambiarlos por anti-TNF o vedolizumab.
- Intolerancia idiosincrática: cambiar por anti-TNF o vedolizumab.
- Evento adverso dosis dependiente (por ej.: leucopenia): reajustar dosis si es posible.
- Ante evento adverso no resuelto: cambiar por anti-TNF o vedolizumab.
- Las mismas consideraciones de disponibilidad, historia del paciente, comorbilidades, edad, deben tenerse en cuenta para usar biológicos anti-TNF o vedolizumab.
- VII. La extensión de la CU en las decisiones terapéuticas:
a) Proctitis ulcerosa: estos pacientes tienen habitualmente mejor pronóstico que aquellos con enfermedad más extensa en cuanto al grado de repercusión clínica, la magnitud y el tipo de complicaciones y manifestaciones extraintestinales. Sin embargo, aunque raramente se indica cirugía en una enfermedad distal, hay casos muy sintomáticos que pueden ser particularmente resistentes a diversos tratamientos y alterar la calidad de vida.
La terapéutica de primera línea avalada por la literatura consiste en mesalazina tópica 1 gramo diario en supositorios. En esta extensión, el tratamiento rectal tiene mayor eficacia que el oral,160 pero también está demostrado que la combinación de ambas vías de administración es la opción más eficaz.
La mayoría de los centros tratan en primera instancia las proctitis solo por vía rectal. Nosotros, frecuentemente, ante una enfermedad cuyo diagnóstico está corroborado, tenemos una conducta diferente, ya que hemos asistido a pacientes con proctitis que extendieron bruscamente la lesión, y algunos casos requirieron cirugía de emergencia, en especial los pacientes jóvenes.
En la publicación del Congreso Mundial del 2005, en la que se describió la clasificación de Montreal, se reportaron en una tabla las proporciones de pacientes de varias casuísticas que en un período de 10 años cambiaron su extensión de proctitis a CU izquierda (entre 11 y 54%) y de proctitis a CU extensa (entre 7 y 34%), y además se describió para las proctitis un riesgo de colectomía del 2 al 9% a 5 años.37
Nuestra conducta más frecuente en los pacientes no tratados, con base en nuestras experiencias, que coinciden con estas descripciones, es aconsejar tratar la actividad con mesalazina rectal y oral combinados. Esta indicación de tratamiento oral/rectal combinado de inicio en las proctitis nos parece relevante cuando la histología es bien característica y/o el anticuerpo ANCA es positivo (con lo que mejora el diagnóstico diferencial con otras entidades, como lesiones por AINE, u otros cuadros inespecíficos). Luego de mantener el tratamiento combinado, repetimos la endoscopía (en 3-6 meses) y si se observa cicatrización mucosa, intentamos mantener ininterrumpido solo el tratamiento oral, agregando el rectal episódicamente, según necesidad. La mayoría de los pacientes en nuestro medio prefieren esta estrategia de tratamiento. También debe notarse que en nuestro medio hay una mejor adherencia a la medicación oral que a la rectal (en especial en los tratados con las fórmulas de altas dosis por unidad).
¿Qué hacer si un paciente con proctitis no responde al tratamiento en 1 a 4 semanas con mesalazina oral/rectal?: si no muestra rasgos clínicos y de laboratorio de agravamiento y deterioro de la calidad de vida, antes de introducir corticoides orales en esta localización, se puede intentar con corticoides tópicos para optimizar el tratamiento por vía rectal, siendo especialmente bien toleradas las espumas de budesonida, que administramos en un horario diferente a los supositorios (generalmente las enemas o espumas de noche antes de dormir). Recién entonces, si el paciente continúa sin responder agregamos, prednisona oral en dosis diaria de 40 mg (optimizando muy ocasionalmente a 60 mg), según el esquema descripto previamente (es independiente de la extensión), disminuyendo progresivamente hasta suspender en 8 a 12 semanas. Como alternativa para el futuro se incorporó en el algoritmo la budesonida MMX 9 mg, también continuando al suspenderla solo con mesalazina.
Si, manteniéndose la CU en esta localización, se presenta recaída no frecuente y moderada, podemos intentar insistir con la intensificación del tratamiento tópico antes de instaurar los corticoides sistémicos. Pero en caso de que no observemos buena evolución, por la frecuencia de las recaídas, la dependencia al corticoide o el incremento de los síntomas, actuamos de manera similar que en los pacientes con enfermedad más extensa, usando estrategias de escalamiento según lo previamente descripto en los conceptos generales, optando incluso por inmunosupresores y biológicos (escenarios de enfermedad severa, corticoideo dependencia, corticoideo resistencia).
La necesidad quirúrgica en la proctits es muy infrecuente mientras no se extienda, pero puede ser necesaria. En nuestra casuística, de una cohorte de 1907 pacientes, se operaron menos del 1% de los pacientes con proctitis.
b) CU izquierda: si el paciente no está tratado, también iniciamos la terapéutica asociando mesalazina oral a dosis de actividad y tratamiento tópico, pero en esta extensión en general son más útiles las enemas de mesalazina o budesonida que los supositorios (alcanzan en el 80% de los casos el ángulo esplénico) o las espumas (muy bien toleradas, con una distribución que alcanza aproximadamente 40 cm). En general adaptamos las administraciones tópicas a la actividad laboral de los pacientes, indicando una aplicación cada 24 h (nocturna). En algunos casos, indicamos un supositorio en otro horario, aunque no sea óptima la distribución sobre el área comprometida, para aliviar los síntomas rectales, y mejorar la calidad de vida. Si la enfermedad está limitada al rectosigma, las mencionadas formulaciones, aplicables por vía rectal, le dan a la medicación tópica más posibilidades de lograr evadir el escalamiento a tratamiento sistémico que en la enfermedad extensa, aunque menor posibilidad que en las proctitis.
Si no hay respuesta al tratamiento oral/rectal en 1 a 4 semanas debe indicarse el tratamiento con corticoides orales según la evolución de los signos de actividad, sin permitir que se agrave, debiendo considerarse como opción la budesonida MMX, más aun en esta localización (10 a 15 días de espera con síntomas leves a moderados si no empeora y no hay compromiso de laboratorio, es un tiempo razonable y suele ser tolerado). Con más razón que en las proctitis, si finalmente corresponde usar corticoides, es muy importante no indicarlos en las dosis o tiempos subterapéuticos, bajo la suposición errónea de que una enfermedad no tan extensa requiere menos dosis. Tampoco deben prolongarse más allá de 8-12 semanas, intentando usarlos para mantener la remisión.
Si los pacientes con proctitis activa no responden a corticoides orales y tratamiento tópico, o tienen recaídas frecuentes, se escala la terapia a inmunosupresores y biológicos, según lo delineado en los conceptos generales para corticoideo dependencia, corticoideo resistencia, o bien, en caso de incremento de la actividad, de enfermedad severa. Los corticoides parenterales pueden ser una opción para inducir remisión en refractarios a corticoides orales, aunque no tengan enfermedad severa, en plan de pasarlo a mantenimiento de remisión, inmunosupresores o biológicos para el largo plazo. El porcentaje de operados con esta extensión en nuestra casuística en la misma cohorte mencionada, fue del 16,1%.
c) CU extensa: en el concepto de estrategia de escalamiento de terapias en la CU leve-moderada, si el paciente no estaba tratado, se indica mesalazina, y si estaba tratado con mesalazina, se indica prednisona vía oral, respetando las dosis según un curso convencional previamente descripto y considerando la alternativa de la budesonida MMX 9 mg.
Sin embargo, en esta extensión, en algunos pacientes con enfermedad sintomáticamente moderada, tomamos la decisión de usar prednisona como primera línea de tratamiento, combinada con mesalazina.
Decidimos esta conducta con base en la duración del episodio, el impacto de los síntomas en su actividad laboral o personal, la historia de reactivaciones previas, la presencia de marcadores de inflamación, o hallazgos de la endoscopía que resulten borderline con enfermedad severa. Obviamente, en esta extensión, la medicación tópica se indica para aliviar los síntomas, pero no resuelve la actividad de las lesiones proximales al ángulo esplénico (o al rectosigma, según el alcance de los preparados usados).
Con más razón, en la enfermedad izquierda y la proctitis, si no responde a corticoides orales, o incrementa rápidamente la severidad, debe escalarse rápidamente el tratamiento, proporcionalmente al grado de actividad, y realizar lo que delinearemos para enfermedad severa, corticoideo dependencia o corticoideo resistencia. Debemos recordar que la enfermedad extensa es la que presenta el mayor riesgo de complicaciones y tasa de colectomía, por lo que el escalamiento oportuno a inmunosupresores o biológicos es relevante. En la cohorte descripta de nuestro centro se operaron el 29,8% de las CU extensas, lo que representó el 82,9% de todos los que requirieron cirugía.
◊ CU de actividad severa de cualquier extensión
Se grafica el algoritmo de decisión terapéutica de rescate en la CU severa refractaria a corticoides IV, y el seguimiento a corto plazo (Figura 14).
I. Conceptos generales
– La CU de actividad severa es una emergencia médica, ya que es un cuadro potencialmente fatal.
· Los pacientes que cumplan los criterios de esta definición descriptos por Truelove y Witts se deben hospitalizar para el tratamiento intensivo bajo el cuidado de un equipo multidisciplinario que incluya como mínimo gastroenterólogos y cirujanos colorrectales, aunque también son importantes un buen equipo de nutrición, imagenólogos e infectólogos, y es necesario procurar que el soporte emocional sea el adecuado.
· Debe realizarse un buen interrogatorio y examen físico, descartando otros factores como la ingesta de antibióticos, la presencia de colitis infecciosas simultáneas, o temporalmente cercanas en el entorno del paciente, y viajes recientes a países donde las diarreas bacterianas o parasitarias son frecuentes. Además, se debe investigar: la no adherencia al tratamiento, errores en las dosis de las medicaciones que recibía (corticoides, inmunosupresores, etc.), la ingesta de AINE y de opiáceos, radioterapia previa abdomino pelviana o causas predisponentes para sospechar lesiones isquémicas.
· Se requieren controles de laboratorio de rutina, marcadores de inflamación predictivos de evolución (como PCR), y de aquellos cuya alteración predispone a complicaciones (por ej.: descartar hipokalemia que condiciona megacolon tóxico).
· La hipoalbuminemia ≤ 3 g, una PCR ≥ 45 mg/l, la presencia de fiebre, taquicardia, islotes mucosos en la Rx simple de abdomen, ≥ 3 asas dilatadas de intestino delgado, y las úlceras profundas (colitis anatómica severa) son algunos de los factores predictivos de mal pronóstico.12, 49, 51, 55, 57, 60
· Deben realizarse con celeridad preguntas dirigidas a evaluar la seguridad de los posibles planes estratégicos de tratamiento (infecciones pasadas o recientes, entre ellas antecedentes de tuberculosis, HIV, hepatitis) y comorbilidades que condicionen un eventual tratamiento, como insuficiencia cardíaca, cáncer, enfermedades neurológicas desmielinizantes, EPOC, insuficiencia renal, drogadicción, etc.376-380, 387, 400, 401
II. Determinaciones a realizar desde el primer día
– Búsqueda de patógenos en materia fecal, que puedan asociarse con la clínica, condicionar una reactivación o complicarse con el tratamiento. Coprocultivo para detección de una colitis infecciosa aguda, parasitológico (huevos, quistes y parásitos) según la epidemiología -viajes, procedencia-, y deben determinarse las toxinas A y B de Clostridium difficile. Si bien estas indicaciones son generales para las EII, en la CU severa representan una situación de emergencia.12, 52, 376, 387, 400, 401
Otras determinaciones relevantes (véase lo mencionado en medidas preventivas en los inmunocomprometidos, antes de la introducción de inmunosupresores y biológicos) para evaluar la modalidad y seguridad del tratamiento y algunas para diagnóstico diferencial son Rx de tórax, la prueba de la tuberculina (PPD: derivado proteico purificado 2 UT por dosis) para detectar TBC latente (pápula > 5mm), ante el cual debe hacerse profilaxis, serologías virales para hepatitis B y C, HIV, IgG anti-CMV. (véase prevención de riesgos y manejo de infecciones en pacientes inmunosuprimidos). Determinaciones adicionales aconsejadas en el checklist ECCO previamente descripto para prevención de infecciones en imunosuprimidos.
Otros estudios deberán evaluarse a discreción del médico, según los antecedentes del paciente.52, 387, 383, 400-402
– Es necesario el control con Rx directa de abdomen, para descartar una dilatación, o asas de intestino delgado dilatadas, que son predictivas de mal pronóstico. Debe realizarse rectosigmoideoscopía con evaluación de actividad, controlando la insuflación debido al riesgo que implica la severidad, efectuando biopsia para descartar CMV por técnicas habituales e inmunohistoquímica.
– Si las biopsias son positivas para CMV en pacientes con actividad severa o enfermedad refractaria, el tratamiento es ganciclovir intravenoso o valganciclovir, y si se detecta Clostridium difficile, el tratamiento es metronidazol o vancomicina orales. Estas pueden ser patologías concomitantes con la actividad de la enfermedad, y debe realizarse el tratamiento específico, lo que puede o no modificar el curso de la CU. En caso de continuar con síntomas, debe administrarse tratamiento para la enfermedad inflamatoria intestinal severa de base, en equipo multidisciplinario con proctólogos, y estar alerta porque puede requerirse cirugía.238, 387, 403, 404
III. Tratamiento de primera línea
• Estrategia de inducción
– La administración de corticosteroides intravenosos a dosis plena (hidrocortisona 400 mg por día o equivalente a 1 mg/kg día de prednisona) es la primera estrategia farmacológica a implementar.
– Mayores dosis no son más efectivas, pero dosis menores son menos efectivas.
– Es esencial realizar evaluaciones precoces y tomar decisiones rápidas sobre alternativas terapéuticas de rescate (ciclosporina o infliximab) en refractarios a esteroides intravenosos. Se recomienda realizar esta evaluación tempranamente, seguida de la consecuente decisión sobre un rescate, entre el tercer y el quinto día, tendiendo en cuenta que la mayoría de los autores recomiendan una evaluación inicial a las 72 horas del plan intravenoso de esteroides.52, 238
– La identificación en estadio precoz de aquellos pacientes que requieren tratamiento médico de rescate ante no respuesta y el momento apropiado para iniciarlo, o la necesidad y momento de realizar una colectomía, son aspectos relevantes en la decisión clínica.
– Es imperativo administrar heparina a dosis profiláctica.
– Deben indicarse antibióticos ante una probable gastroenteritis aguda como causa de los síntomas o como disparador en caso de colitis tóxica, y mientras se evalúa una perforación bloqueada (que si se confirma o persiste la sospecha, es indicativa de cirugía, al igual que lo es una hemorragia masiva).
– El megacolon tóxico se trata con corticoides intravenosos con reposo intestinal absoluto. Debe controlarse estrictamente el equilibrio hidrolectrolítico (estabilizando el potasio y el magnesio fundamentalmente). Se aconsejan cambios de posición del paciente (rotación) para favorecer la eliminación del aire. Están contraindicados los opiáceos y los anticolinérgicos. Se agregan antibióticos intravenosos porque esta complicación se considera un cuadro preperforativo. Si no mejora en 2 o 3 días o se agrava, debe realizarse colectomía por la alta probabilidad de perforación y mortalidad.
IV. CU severa refractaria a corticoides intravenosos
– Luego de evaluar los factores predictivos ya mencionados (PCR, albúmina, número de deposiciones, examen abdominal, radiología simple, etc.) y los controles de seguridad, si es refractario a las dosis antes mencionadas de corticoides intravenosos, y reúne condiciones para el rescate, debe elegirse entre infliximab y ciclosporina.307
– Cuando se sospecha perforación, o si el paciente presenta hemorragia masiva, megacolon tóxico que no responde, o contraindicaciones para el tratamiento de rescate, es imperativo realizar colectomía.
– Si con las mencionadas estrategias de rescate no se observa mejoría dentro de los 4-7 días, se recomienda la colectomía. En nuestro centro tenemos experiencia cuantiosa con infliximab, pero no con ciclosporina. Nosotros por el momento no realizamos tratamiento clínico de tercera línea (secuencialmente infliximab – ciclosporina o viceversa en el contexto de un cuadro severo), que podría implicar un aumento del riesgo.
Ⓐ Rescate de la CU severa con infliximab
– Se administra infliximab en infusiones a dosis de 5 mg/kg de peso, en las semanas 0, 2 y 6, y se continúa cada 8 semanas con infusiones regladas a la misma dosis. Puede agregarse una tiopurina, lo que aumenta la eficacia. Nuestro grupo comenzó a utilizar terapia de rescate con esta droga en el 2006. Entre los primeros 70 pacientes que recibieron inducción con infliximab, el 83% de los casos permanecían sin cirugía a los 6 meses. Los naïve a tiopurinas continuaron con mercaptopurina (luego del “puente” con infliximab) en el 79% de los casos, y el porcentaje restante, con infusiones regladas. Esta estrategia “puente” fue diseñada debido al limitado acceso que brindaba el sistema de salud en ese período de tiempo al mantenimiento con anti-TNF a largo plazo, pero aun con este diseño, solo el 35% requirió cirugía a los 2 años, con una tasa de “no respuesta primaria” (hasta 12 semanas) del 16%. Datos preliminares de una cohorte actualizada del más del doble de pacientes dieron por resultado un 22% de no respuesta primaria. Actualmente, habiendo mejorado las condiciones de acceso por resolución de la entidad reguladora, indicamos tratamiento reglado sistemáticamente. En un estudio retrospectivo corroboramos que la estrategia de tratamiento reglado, al igual que en la EC (en nuestro caso versus estrategia puente hacia tiopurinas), se asocia con un mejor pronóstico en términos de disminución de colectomías, indicación de corticoides y prevalencia de recaídas.227
– Si no se realiza colectomía, en los pacientes severos no respondedores al rescate, la evolución puede ser fatal, por lo cual la decisión tomada de manera multidisciplinaria con el cirujano no debe demorarse en esos casos.
– El tratamiento combinado con tiopurinas mejora los resultados a largo plazo, pero la decisión debe tomarse en el contexto del paciente individual, porque la asociación tiene más riesgo de complicaciones, especialmente en algunas poblaciones de pacientes.277, 208
– Los resultados internacionales del rescate con infliximab son similares que con ciclosporina, y se ha observado en el primer estudio randomizado internacional que la respuesta a los 7 días fue equiparable (84 y 83%) para ciclosporina (n = 58) e infliximab (n = 57). Al día 7 se agregó azatioprina a los respondedores, siendo similar el porcentaje de colectomizados al día 98 (18% y 21% respectivamente).307
– El rescate de refractarios al corticoide intravenoso: el infliximab es el biológico que demostró efectividad para terapia de rescate en esta situación, por lo que es el indicado para este escenario clínico. Convencionalmente, se administra mediante infusiones de 5 mg/kg de peso en etapa inicial de inducción 0, 2 y 6 semanas, seguido por mantenimiento realizado con la misma dosis cada 8 semanas. No se ha demostrado evidencia de rescate de enfermedad severa refractaria a corticoides intravenosos con otros biológicos.
· Recaída durante el mantenimiento con anti-TNFs
Se muestra el algoritmo de decisión terapéutica a largo plazo en pacientes en mantenimiento que recaen, luego de ser rescatados de una CU severa refractaria a corticoides intravenosos (Figura 15).
Algoritmo de anti-TNFs en pacientes en mantenimiento con pérdida secundaria de respuesta (reactivo).
· Optimización de anti-TNFs: una vez que el paciente ha respondido a anti-TNF y está en mantenimiento, si pierde la respuesta se optimiza ya sea por frecuencia o por dosis, pudiendo elegir entre las dos opciones en el caso del infliximab, y en el caso del adalimumab es por frecuencia de aplicación. El infliximab a 5mg/kg se optimiza por frecuencia a 6 semanas y secuencialmente a 4 semanas, y por dosis a 10 mg/kg cada 8 semanas. El adalimumab 40 mg cada 2 semanas se optimiza, si es requerido, a 40 mg dosis semanal. El otro biológico anti-TNF aprobado para CU es el golimumab, que se optimiza a 100 mg cada 4 semanas. Puede realizarse tratamiento combinado con inmunosupresores según riesgo-beneficio (factores de mal pronóstico y comorbilidades del paciente).328
– Si no responde a la optimización del 1er anti-TNF, debemos realizar un cambio a otro de los biológicos alternativos, ya sea un anti-TNF, u otro según disponibilidad del fármaco (el vedolizumab está recientemente comercializado y puede utilizarse en este caso de pérdida de la respuesta a anti-TNF en mantenimiento, aunque con menor respuesta que en un paciente naïve de biológicos) y de las determinaciones de anticuerpos y niveles de drogas, a uno de otra clase. Recordar que mientras se cursa un escenario de colitis severa refractaria al corticoide intravenoso, solo el infliximab ha demostrado evidencia de eficacia.
– Si se cuenta con determinaciones de niveles de droga y anticuerpos es aconsejable decidir si optimizar y cómo, según los siguientes parámetros: 1) optimizar cuando los niveles de droga son subterapéuticos y los niveles de anticuerpos son absolutamente negativos; 2) cuando los anticuerpos son bajos, aumentar la dosis es una opción, pero no la única, ya que puede intentarse combinación con inmunosupresores, y también es viable cambiar de anti-TNF; 3) cuando los anticuerpos son altos se requiere cambio de droga (puede ser o no a otro anti-TNF disponible en nuestro medio, o cambiar de clase de droga, según lo previamente comentado); 4) cuando los niveles de droga son terapéuticos y el paciente no es respondedor y no es obviamente quirúrgico, se debe cambiar de clase de droga, recordando en cuanto a las expectativas lo ya mencionado: que habitualmente los pacientes naïve a biológicos tienen mayores niveles de respuesta, pero vale la pena el intento si la enfermedad no quemó etapas poniendo en peligro la vida, ya que el pouch ileal tiene complicaciones a corto y largo plazo.366-374
– Una pequeña casuística de vida real (n = 30) con adalimumab observó un 27% de remisión y un 60% de respuesta a la semana 12 en pacientes en los que había fallado el infliximab, reportándose que, a 8 meses, la mitad continuaba en tratamiento con solo un 20% de casos con requerimiento de colectomia.344 Recordemos que no hay datos diferentes al infliximab sobre rescate de CU severa refractaria a corticoides intravenoso, por lo que esta estrategia se indica en la CU moderada.
– Las decisiones deben tomarse teniendo en cuenta la severidad. Si la condición del paciente es severa habiendo estado en mantenimiento con infliximab, por ejemplo, puede ser necesario hospitalizar, reinstaurar los corticoides intravenosos y optimizar el infliximab de emergencia. Si no hay opción por el estado del paciente, está indicada la cirugía pese a que es difícil predecir adecuadamente el pronóstico.
· No respuesta a la optimización
Al no estar disponible el dosage de droga y anticuerpos, podemos indicar:
– Cambio intraclase (otro anti-TNF), cambio interclase (vedolizumab está recientemente en la Argentina).
– Tratamiento combinado (tiopurinas asociadas a anti-TNF) considerando la posibilidad de anticuerpos antidroga.
“ Como se comentó, cabe enfatizar que la determinación de niveles de anti-TNF y anticuerpos antidroga, no disponibles en la Argentina, mejoran el manejo.
Ⓑ Rescate con ciclosporina
– Si se considera indicar esta droga, los principales recaudos son solicitar y corregir los valores de magnesio, colesterol y chequear la función renal y la TA.
– La ciclosporina se administra de forma intravenosa a dosis de 2-4 mg/kg de peso/día, entre 7 y 14 días, obteniéndose con 2 mg/kg igual resultado y mayor seguridad.
– Monitoreos requeridos: niveles de ciclosporinemia (ajustados a 300 o 400 ng/ml), función renal (la creatinina no debe superar el 30%), TGO, TGP (< 2 veces el valor de referencia). Por la posibilidad de convulsiones es necesario controlar y corregir el magnesio con administración IV (respetando valores límite no menores 1,5 mg/dl). Se requieren valores límite de colesterol no menores de 120 mg/dl, control de la TA por la posibilidad de hipertensión y la indicación de cotrimoxazol como profilaxis del Pneumocystis jiroveci.52
– La ciclosporina constituye un puente hacia los inmunosupresores, ya que al pasar a la vía oral disminuye la respuesta; su uso no se recomienda por más de 6 meses. Dado que los resultados a largo plazo mejoran asociando tiopurinas, con lo cual se logra una disminución significativa el índice de colectomía a largo plazo, se recomienda que la ciclosporina se use solo en pacientes naïve a estas drogas, y que no se indique por lo tanto en aquellos en los que ya fracasaron al tratamiento.
– Por ello, en caso de que el paciente en mantenimiento a largo plazo con tiopurinas (post ciclosporina alejado) pierda la respuesta, es posible indicar un anti-TNF, o uno de otra clase aprobado para CU, como el vedolizumab, que se elegirá según la severidad, realizando inducción – mantenimiento y el algoritmo correspondiente al biológico seleccionado, con posibilidad de optimizar y/o cambiar de biológico ante la pérdida de respuesta secundaria según se expresa en VII (algoritmo de anti-TNF).
Ⓒ No respuesta al rescate con infliximab o ciclosporina
– Como ya se expresó, la conducta consensuada mundialmente es la colectomía, cuya indicación tardía, si el paciente no responde, cursa con incremento de la mortalidad.
– Como previamente se mencionó, se ha reportado en pequeños grupos de pacientes con un régimen acelerado de infusiones de infliximab una disminución significativa del requerimiento de colectomía, pero aún faltan más evidencias en la literatura.325, 326
– También se ha mencionado el uso secuencial de ambas drogas (infliximab y ciclosporina), pero dado los efectos adversos, hay que considerar la conducta para cada caso individual, recordando que es más importante salvar la vida que salvar el colon.333
V. Mantenimiento luego de cursar CU de actividad severa
Se muestra un algoritmo global de las modalidades de respuesta en la CU severa, tanto en la inducción como en el mantenimiento (Figura 16).
Ⓐ Mantenimiento luego de respuesta clara/rápida a corticoides IV (con predilección en no tratados), implica:
– Disminución y suspensión de corticoides según esquema convencional
– Mantenimiento: mesalazina.408
• Estrategia ante una recaída (durante el mantenimiento en respondedores a corticoide IV):
Se realizan evaluaciones de severidad, comorbilidades y factores pronósticos:
· Recaída no severa durante el mantenimiento en respondedores a corticoides IV: puede elegirse en este caso entre inmunosupresores y biológicos de acuerdo con el siguiente criterio:
– Si tolera un puente con corticoides, puede tratarse con inmunosupresores.
– Si no tolera el puente con corticoides, no responde a inmunosupresores o tiene factores de mal pronóstico se lo puede tratar con uno de los tres anti-TNF validados para CU (infliximab, adalimumab y golimumab), aplicando el algoritmo de biológicos para inducción, mantenimiento y eventual pérdida de respuesta, intraclase e interclase según características del paciente y disponibilidad.
El adalimumab se usa a dosis de 160 mg y 80 mg a semanas 0 y 2 respectivamente, y luego de 2 semanas se indican 40 mg cada 2 semanas.
Con respecto a golimumab, en pacientes con peso corporal inferior a 80 kg se indica inducción con 200 mg y 100 mg a semanas 0 y 2 respectivamente, y se mantiene con 50 mg cada 4 semanas. En pacientes con peso corporal ≥ 80 kg la inducción es igual, pero el mantenimiento es de 100 mg cada 4 semanas, si bien en una experiencia del Hospital Guy´s and St Thomas se demostró beneficio indicando 100 cada 4 semanas en los pacientes que perdían respuesta, independientemente del peso.
– Son significativamente más eficaces a largo plazo utilizados como inducción seguida por mantenimiento (versus episódicamente).
– La combinación con tiopurinas fue reportada más eficaz (evidencia en el caso del infliximab) por disminuir anticuerpos antidroga.
– Los pacientes con CU naïve de otros biológicos tienen mejor respuesta que los no naïve, aun cuando se cambien a otros biológicos intraclase e interclase.
– Alternativa o secuencialmente puede utilizarse vedolizumab, en infusiones de 300 mg (dosis estándar que no se modifica) administrada como inducción inicialmente, repetirlas a la semana 2, nuevamente a la 6ta semana del inicio, y posteriormente como manteniento a las 8 semanas, administrándose en lo sucesivo cada 8 semanas, siendo posible optimizar cada 4 semanas.
Ⓐ Recaída severa durante el mantenimiento en respondedores rápidos a corticoides IV:
– Si durante el mantenimiento ocurre una recaída severa, se realizan nuevamente corticoides intravenosos y rescate, eligiendo preferentemente infliximab sobre ciclosporina, por la necesidad de un mejor mantenimiento debido al evidente curso grave de la CU, con o sin inmunosupresores, como los criterios y conductas descriptas para enfermedad severa (incluyendo cirugía si no responde).
Si se observa respuesta, se pasa al algoritmo de anti-TNF, con optimización y eventual cambio de biológico si hay pérdida de respuesta, incluyendo una posible combinación con inmunosupresores (especialmente en el caso del infliximab), o cambio de clase.
Ⓑ Mantenimiento en respondedores a corticoides IV que cursaron con inestabilidad (altibajos de síntomas y/o marcadores)
– En este caso no es apropiada la opción de mantenerse solo con mesalazina.
– Se eligen inmunosupresores, biológicos o tratamiento combinado.
– Los mismos se seleccionan según los factores ya mencionados: comorbilidades, riegos y demás factores personales según cada paciente.
◊ Actividad inflamatoria en pacientes asintomáticos detectada por métodos de estudio
Un tema controvertido es qué debemos hacer en un paciente asintomático con actividad inflamatoria detectada por los estudios de control.
Haciendo un pool con la endoscopía, los marcadores serológicos y fecales y la rutina de laboratorio, y eventualmente imágenes, podríamos denominar a esta herramienta “inflamación detectada objetivamente por métodos de estudio” (I.D.O.M.) nombre adjudicado con el fin de identificarla en los gráficos del algoritmo).
Si bien este tópico es discutido, según los hallazgos se pueden sugerir algunas conductas que deben adaptarse a factores dependientes del paciente individual:
a) Úlceras profundas en cualquier extensión: es un factor predictivo de mal pronóstico, siendo válido intervenir en este caso con biológicos con o sin combinación con inmunosupresores, aun sin síntomas. Aunque la gravedad suele ser proporcional a la extensión, una proctitis endoscópicamente muy severa también amerita un tratamiento agresivo, aunque podemos apuntalar el tratamiento sistémico con el tratamiento local.
b) Proctitis o proctosigmoiditis: debido a la biodisponibilidad del tratamiento tópico en la zona afectada, la intensificación y repetición del mismo pueden al menos mejorar parcialmente el problema.
– En la vida real, dentro del espectro de las EII, nos encontramos con situaciones intermedias, por ejemplo, lesiones endoscópicas leves asintomáticas. Las lesiones que generan más duda son las difíciles de encuadrar en las clasificaciones. Los scores 0 y 1 del Mayo score y UCEIS son reconocidos como cicatrización de la mucosa, siendo el 0 el óptimo.81 Hay hallazgos que están cercanos a los “umbrales” de las categorizaciones. Un ejemplo son las lesiones que demuestran tener algo más de actividad que un score endoscópico 1 de Mayo para ser definidas como cicatrización, entendida como quiescencia (principalmente respecto del grado de friabilidad), pero que difieren de los rasgos más típicos y frecuentes de una enfermedad moderada. Respecto al UCEIS, los scores por categorías de actividad no están bien definidos. Los autores de un estudio reciente categorizaron la enfermedad leve con un score UCEIS 2 (discutiendo con base en sus hallazgos endoscópicos si el score 4 del UCEIS corresponde a una enfermedad leve o a una moderada), y definieron el score 1 con una modificación que aplica solo el descriptor patrón vascular.81, 397
– Sin que ello esté estandarizado, nuestra conducta en proctitis o proctosigmoiditis con lesión endoscópica leve asintomática (que implica además no anemia, o marcadores serológicos de inflamación) es mantener al paciente con tratamiento tópico y mesalazina oral a dosis de actividad, haciendo controles de laboratorio, y siguiendo si es posible una curva de calprotectina fecal, pero en general no escalamos a otra droga.
– Si la lesión endoscópica es moderada y no hay expresión de marcadores de inflamación, otras alteraciones de laboratorio ni síntomas: 1) primero optimizamos el tratamiento convencional tópico y oral (mesalazina, y si no responde se indica un curso de corticoides orales, 2) si no cicatriza (lo cual es posible) debido a que la extensión es corta, podríamos contemporizar en lugar de seguir escalando, realizando una estrategia de seguimiento con marcadores. Si detectamos un agravamiento de la lesión estructural asintomática (por ej.: por calprotectina corroborada por endoscopía), escalamos progresivamente. Si además se agregan marcadores de inflamación serológicos y anemia, escalamos rápidamente.
c) CU izquierda o extensa: si la lesión endoscópica es leve, sin alteraciones de laboratorio (marcadores de actividad o anemia), primero optimizamos el tratamiento convencional. Indicamos enemas con mesalazina o budesonida en caso de que la lesión (izquierda) sea accesible o predomine distalmente. Posteriormente, se puede monitorear secuencialmente con calprotectina y otros marcadores, y repetir la endoscopía cuando los mismos se eleven o cuando aparezcan síntomas (realizando tratamiento en consecuencia), o al año si todo se mantiene sin cambios. Cabe señalar la compliance de las formas de tratamiento tópico en espumas, especialmente útiles para la enfermedad izquierda rectosigmoidea.
– Si es moderada sin síntomas intestinales, en la que luego de optimizar y escalar el tratamiento de primera y segunda línea (incluyendo aminosalicilatos y corticoides) la lesión no mejora, consideramos (balance comorbilidades/riesgo de la enfermedad) escalar el tratamiento a inmunosupresores o biológicos. Si adicionalmente se detecta anemia, hipoalbuminemia, o marcadores de inflamación persistentemente elevados o en ascenso, tal estrategia de escalamiento debería realizarse sin demora, en especial en los jóvenes.
– Si detectamos actividad endoscópica severa, en una endoscopía de rutina sin síntomas intestinales, aconsejamos tratar con corticoides intravenosos si ya venían recibiendo tratamiento, y podrán ser orales con estricto control si es por falta de tratamiento. Si tiene úlceras profundas con o sin tratamiento previo, indicamos de inmediato corticoides intravenosos, recordando que se describen pacientes que debutan con un megacolon tóxico. Si la lesión no mejora, se escala el tratamiento. Si ya estaba adecuadamente tratado, la conducta de escalamiento es más imperiosa y la recomendamos para el mantenimiento, aunque el paciente mejore, de manera similar a lo que hacemos con los pacientes con úlceras profundas. El seguimiento con marcadores fecales puede indicar la necesidad de nuevas endoscopías para decidir cambios de tratamiento. La coexistencia de anemia, hipoalbuminemia y/o PCR aumentada justifican una mayor celeridad en las decisiones.
◊ Monitorear, optimizar y escalar el tratamiento ¿Cuándo cómo y por qué ?
– La acción de escalar el tratamiento implica: el riesgo de las drogas a utilizar.
– Sin embargo, la inacción implica: la exposición al riesgo de las complicaciones de la enfermedad.
– Es importante chequear la adherencia y ajustar las dosis de todo tratamiento.
– En la elección y modificación de las estrategias, entre los factores a considerar son relevantes la cicatrización mucosa (parámetro objetivo de pronóstico reconocido por la evidencia) y las úlceras profundas, factor predictivo de mala evolución.
– La calprotectina fecal, la PCR y otros marcadores no invasivos son alertas para indicar métodos de detección que corroboren la lesión activa estructural.
– Otros, como la edad de debut y la extensión, podrían no tener un impacto inmediato, sino en el largo plazo, pero tenerlos en cuenta podría mejorar el pronóstico.
– Un mantenimiento adecuado implica una remisión sostenida. En el mantenimiento, por lo general, se suele emplear el fármaco con el que se logró remisión, salvo en el caso de los corticoides y la ciclosporina.
– Si el paciente recae, los tratamientos se van escalando, para reinducir la remisión, ya sea intensificando la dosis o la frecuencia, cambiando o combinando los tratamientos, según la gravedad del cuadro, la rapidez de acción requerida (implicando la tolerancia a drogas puente que sean necesarias) y la eficacia y seguridad de los fármacos a elegir.
– Intentar mantenimiento con corticoides o sobreindicarlos es un error universalmente reconocido.
– Finalmente, debe recordarse que el paciente puede no responder a diversos tratamientos, o presentar una colitis fulminante sin respuesta, y en ese caso, más importante que salvar el colon es salvar la vida, indicando cirugía.
3. Tratamiento de la enfermedad de Crohn
a. Factores determinantes de decisiones terapéuticas en la EC
– La heterogeneidad de la EC determina diversas modalidades de manejo terapéutico según las diferentes formas de presentación clínica.
– El primer paso del plan de tratamiento para un paciente con EC consiste en evaluar el grado de actividad y la localización de la enfermedad (L1, L2, L3 y L4, esta última aislada o asociada como modificador de otra localización) y el comportamiento (B1, B2, B3, complicación perianal presente o no en cada comportamiento como modificador), otras manifestaciones sistémicas y complicaciones agudas (obstrucción, colecciones presentes en la evaluación) y las comorbilidades del paciente individual. Al igual que en la CU, se decide el tratamiento luego de descartar que los síntomas sean secundarios a infecciones, a medicamentos o desencadenados por enfermedades concomitantes.
– Por ello se debe obtener evidencia objetiva de la actividad de la enfermedad (marcadores inflamatorios, colonoscopía o imágenes) antes de comenzar o modificar el tratamiento clínico.
– Los síntomas secundarios a resecciones intestinales pueden no relacionarse con la actividad, como es el caso de la diarrea colerética por resección ileal, que puede tratarse con colestiramina.
– Habitualmente la EC es una enfermedad progresiva, que cambia de comportamiento no complicado a estenosante y/o fistulizante.
– Por lo tanto, se presenta con localización, extensión, grados de actividad y respuesta variable entre pacientes y también en distintos momentos del mismo paciente, lo que requiere un proceso dinámico de evaluación y eventuales reevaluaciones de las conductas terapéuticas.
– Consideramos que la frecuencia de las recaídas también puede tenerse en cuenta en las decisiones. Se han clasificado como infrecuentes cuando se presentan en intervalos menores de una por año, según la definición del Consenso Europeo.411
– En determinadas localizaciones, y si la enfermedad se presenta con una extensión limitada de las lesiones, puede seguirse una estrategia de escalamiento progresivo de las terapias, según la respuesta a los diversos fármacos. Se ha reportado que un porcentaje bajo de pacientes con enfermedad leve (18% de los casos) podrían logran la remisión de forma espontánea sin tratamiento activo, según lo reportado por Su y col. en una revisión sistemática de estudios clínicos. En el Consenso Europeo, se describen cohortes con una proporción variable de casos de buen pronóstico. Sin embargo, puntualizan que la mayoría de los pacientes con EC activa tienen síntomas que requieren tratamiento.411, 412
– En términos generales, cuando no hay respuesta a la inducción, según la situación clínica y los fármacos empleados, se ajusta la dosis, se cambia la vía de administración, se ensaya otra clase de droga de similar potencia, o se escala a una estrategia reportada como superior, ya sea usando monoterapia o terapias combinadas. Adicionalmente, la ausencia de cicatrización de la mucosa puede ser usarse como predictor de un curso complicado.411
– Es de suma importancia analizar el paciente en su situación actual y pensar en su futuro.
– Como ejemplo, la presencia de determinados criterios al debut (requerimiento de corticoides, lesión perianal y edad menor de 40 años) son factores predictivos de discapacidad a 5 años, que fueron validados por otros autores.413, 414
– En la publicación de Joana Torres y col. se consensuaron múltiples factores predictivos de mal pronóstico en la enfermedad en relación con la extensión, la localización, la edad y el comportamiento.407 Además, las úlceras profundas, extensas, se asocian con un curso agresivo con requerimiento quirúrgico.415 Los marcadores serológicos positivos antimicrobianos, la suma de ellos o altos títulos, se asocian también con riesgo de cirugía y un comportamiento estenosante o fistulizante, y las mutaciones de susceptibilidad del gen NOD2 se asocian con enfermedad ileal y riesgo de cirugía.103, 407, 415 El tabaquismo, que es el mayor factor ambiental, se asocia con un curso severo, requerimiento de cirugía y recaídas, como se mencionó antes.407 Se listan los factores predictivos de mal pronóstico en la EC (Tabla 72). Bis sandiciur ad essitatectem late.
Tabla 72. Factores predictivos con mayor recomendación de tratamiento agresivo en la EC.
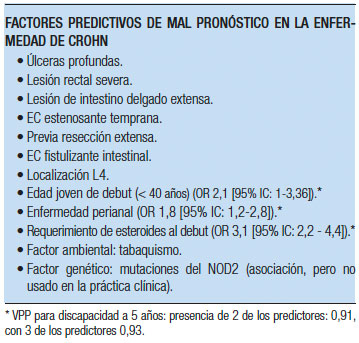
– Las estrategias pueden variar según las mencionadas características de los pacientes individuales, la edad, factores ambientales (tabaquismo), el tiempo de evolución de la enfermedad, la severidad anatómica de las lesiones y su repercusión sistémica en un momento dado, las comorbilidades, la farmacogenética y otros factores personales.
– También, al igual que en la CU, debe tenerse en cuenta la tolerancia a los fármacos, como en el caso de las tiopurinas, el puente de corticoides que puede necesitarse por la demora de acción de estas últimas, o las reacciones de infusión o el sitio de inyección de los biológicos.
– Pueden ser necesarios procedimientos quirúrgicos resectivos, conservadores, de drenaje, o endoscopía terapéutica. Puede requerirse cirugía de emergencia o programada.
En síntesis, la elección adecuada del medicamento está influenciada por:
• La clasificación de la enfermedad (actividad y patrones clínicos según la Clasificación de Montreal, incluyendo comportamiento/tipo de complicaciones, localización y edad al diagnóstico)
• Igual que en la CU, debe considerarse la modalidad de la respuesta previa y actual y los factores individuales y comorbilidades del paciente (recurrencia, dependencia o refractariedad a esteroides), manifestaciones extraintestinales y sus complicaciones, y balance riesgo-beneficio del tratamiento.
• Hay diversos factores pronósticos que difieren de los de la CU.
b. Algoritmos de tratamiento en la EC
Más allá de variaciones individuales, para el manejo de la EC se reconocen subgrupos de pacientes que requieren algoritmos especiales: 1) la enfermedad luminal, 2) la enfermedad fistulizante, 3) la enfermedad estenosante (un subtipo de la EC luminal), que por sus características y pronóstico requiere un manejo diferencial.
– Estas sistemáticas varían según la actividad, la localización de las lesiones y el grado de complejidad de las lesiones.
– En base a lo descripto, podemos considerar los siguientes escenarios clínicos:
◊ Tratamiento de la EC luminal
I. Actividad leve y moderada: en general el tratamiento es ambulatorio
Ⓐ Localización ileal o ileocecal
– Globalmente, en esta localización en la primera presentación de la enfermedad, para inducir remisión se usan corticoides, dependiendo la vía y la formulación del grado de actividad y de la extensión.
– Pueden usarse esteroides orales preferentemente de acción tópica (budesonida) o de acción sistémica en la enfermedad leve o moderada, o por vía intravenosa en los casos severos. Según la presentación se eligen las mencionadas formulaciones como primera opción o como escalamiento si el paciente se fue agravando. Los corticoides no deben indicarse para el mantenimiento de la remisión.
– Hay un espectro variable de escenarios clínicos entre una lesión localizada (arbitrariamente llamadas así las lesiones ≤ 30 cm) y una extensa (≥ 100 cm), pero debe recordarse que los pacientes con este patrón de distribución de las lesiones, aun en el caso de una enfermedad de corta extensión, presentan una tasa de cirugía alta porque esta localización implica riesgo aumentado de estenosis o enfermedad penetrante. En una cohorte de 309 pacientes con esta localización, en Inglaterra, al año del primer tratamiento un 24% era corticoideo dependientes y un 35% requirió cirugía.416
– Por ello es importante que, además de los marcadores de inflamación y los síntomas, se controle el estatus de las lesiones estructurales, evaluando la posibilidad de implementar, según los hallazgos, una estrategia de mantenimiento con tratamientos que puedan modificar el curso de la enfermedad.
– Si la recaída es temprana (< a tres meses de la remisión) estaremos ante una corticoideo dependencia y elegiremos inmunosupresores o biológicos, según se tolere la demora de un puente con corticoides y según factores predictivos individuales (edad, comorbilidades), considerando biológicos o tratamiento combinado ante refractariedad.
– Si las recaídas son infrecuentes (menores de una vez por año) puede ser apropiado, si hubo previa buena respuesta de la lesión estructural subyacente, repetir corticoides y considerar agregar un inmunomodulador cuando recae.
Inducción de remisión en lesión ileocecal o ileal localizada (≤ 30 cm de ileon).
Se grafica el algoritmo de tratamiento de inducción de remisión en la EC leve a moderada localizada, ileal o ileocecal, y la de colon izquierdo (Figura 17). También se grafica para la EC localizada un algoritmo para la transición desde la inducción al mantenimiento (Figura 18).
• Leve o moderada sin tratamiento actual o bajo mesalazina
– El tratamiento preferido en caso de lesión localizada y actividad leve es la budesonida oral (9 mg diarios). A pesar de que la misma es menos efectiva que la prednisona, se prefiere como estrategia de primera línea, dado que se asocia con un mejor perfil de seguridad.
– El beneficio clínico de la mesalazina demostró ser marginal, limitado a subgrupos de pacientes, por lo que en la actualidad su uso es cuestionado.171-175 Sin embargo, un estudio reciente no encontró diferencias entre budesonida 9 mg y 4,5 g de mesalazina con cubierta.417
– Siguiendo una estrategia de escalamiento, si no hay respuesta en 4 a 8 semanas a budesonida, se indican corticoides sistémicos orales: habitualmente prednisona oral (más frecuentemente 40 mg día, o 60 mg según antecedentes/peso), en descenso paulatino (suspendiéndolos en 8 semanas o en 12 semanas dependiendo de la respuesta, el grado de actividad, y la estrategia para el largo plazo). Dosis más bajas o una menor duración son menos efectivas y predisponen a una recaída precoz.
– En algunos pacientes, según los antecedentes, y preferentemente en los que presentan actividad moderada, puede considerase tratarlos directamente con prednisona por su mayor eficacia.
– Si no existe respuesta a corticoides orales, el paciente recae, o presenta un cuadro severo, la conducta es la hospitalización y el tratamiento con corticoides intravenosos.
– Con base en el pronóstico de esta localización, aunque la respuesta a corticoides intravenosos sea buena, cuando existan antecedentes de severidad y refractariedad o persistencia de lesión activa intestinal, debería considerarse, al menos, inmunosupresión con tiopurinas o metotrexato (según tolerancia y tiempo requerido de acción del tratamiento) versus biológicos. Pueden utilizarse anti-TNFs o vedolizumab, como lo establece el Consenso Europeo o alternativamente ustekinumab, de reciente aprobación en nuestro país.411 Para los pacientes que han demostrado presentar una enfermedad con recaídas infrecuentes (menos de una vez por año) puede ser apropiado esperar la recaída y repetir corticoides con un inmunomodulador, según las comorbilidades y la edad. Las imágenes son importantes para excluir complicaciones (por ej.: colecciones o estenosis).
– Adicionalmente, es válido que la presencia de lesiones activas significativas, detectadas objetivamente por ileocolonoscopía y en áreas inaccesibles por imágenes (preferentemente entero-RMI), sean un factor de decisión para escalar el tratamiento, aunque los síntomas hayan mejorado. Los marcadores bioquímicos serológicos y fecales según el consenso STRIDE pueden usarse como adjuntos para sugerir la necesidad del estudio confirmatorio. Ello se basa en el concepto actual del valor pronóstico de cicatrización de la mucosa, intentando disminuir la mencionada predisposición a la cirugía.
– Los corticoides son francamente inferiores a los inmunosupresores y biológicos para lograr y mantener la cicatrización y no deben usarse para el mantenimiento de la remisión, por lo que se deberían aplicar estos conceptos según la tolerancia, la urgencia y los factores individuales del paciente.
– Ante la persistencia de los síntomas, debe también considerarse que puede tratarse de una complicación fibroestenótica irreversible, especialmente cuando hay normalidad de marcadores de inflamación (PCR, eritrosedimentación, calprotectina fecal) en el laboratorio o en las imágenes (cuando no se observa signo del peine ni realce con gadolinio, y no hay estratificación de la pared en la entero-resonancia), por lo que puede requerirse un procedimiento quirúrgico o dilatación endoscópica en lugar de tratamiento médico, aunque suelen coexistir frecuentemente la actividad inflamatoria y la fibrosis. Ello se tratará en el algoritmo del Crohn estenosante.
Ⓑ EC de localización colónica
· EC de colon izquierdo de actividad leve sin tratamiento actual
– Aunque controvertido, en este caso pueden usarse aminosalicilatos. La sulfasalazina demostró un efecto beneficioso de magnitud modesta en dosis cercana a 4 g, pero como la utilidad está limitada por los efectos adversos, en la práctica clínica se lo suele remplazar con altas dosis de mesalazina, no avalada por la evidencia.
– La budesonida de liberación ileocecal no es efectiva en la mayoría de los pacientes con enfermedad colónica, excepto cuando la enfermedad está totalmente o casi exclusivamente circunscripta al colon proximal.
– Cuando está involucrado el rectosigma se puede indicar adicionalmente tratamiento tópico por vía rectal (enemas o espumas de mesalazina, eventualmente budesónida, aunque ello no está consensuado en la EC).
– El metronidazol también se reportó estadísticamente eficaz en el compromiso del colon en período de actividad, pero su uso en las dosis demostradas como más efectivas (20 mg kg/peso) está limitado (por efectos adversos) y la administración prolongada puede asociarse a neuropatía periférica.
– Debe señalarse que si bien los aminosalicilatos orales y tópicos se incluyen en los algoritmos de EC del colon de actividad leve, la evidencia es descripta por los mismos autores como inconsistente.169, 411
– Nosotros utilizamos esta opción de tratamiento con aminosalicilatos orales (en general mesalazina) y simultáneamente tópicos como adyuvante en la enfermedad leve del colon izquierdo localizada distalmente, pero reconocemos que la evidencia sobre su beneficio es limitada y que los factores que impactan en su uso expandido son la falta de otras opciones para casos leves y el buen perfil de seguridad de la droga.
– Opinamos que si el tratamiento se limita a mesalazina, sin escalar a drogas más eficaces, el recto solo debería tener compromiso leve o estar inactivo, ya que la lesión rectal es un reconocido factor de mal pronóstico.
– Si fracasa el tratamiento con aminosalicilatos (falta de remisión clínica a la semana 8) y/o detectamos por métodos objetivos actividad inflamatoria (falta de curación de la mucosa endoscópica o alternativamente una entero-RMI con signos de actividad) la terapia de elección para inducir remisión son los esteroides sistémicos, similar a lo aconsejado en la actividad moderada.
– Respecto del mantenimiento, en los pacientes con compromiso limitado a colon izquierdo (con lesión rectal poco significativa o ausente) que logren remisión con corticoides, y que inicialmente hayan respondido a aminosalicilatos, presentando recaídas infrecuentes, puede reintentarse un mantenimiento a dosis altas con el mismo tipo de aminosalicilatos, escalando la terapia a inmunomoduladores, anti-TNFs, o los recientemente aprobados en la Argentina Vedolizumab o ustekinumab, si se presenta a corto plazo una nueva recaída o una lesión endoscópica persistente.411
– Los marcadores fecales y serológicos tienen utilidad en el monitoreo también en esta localización, lo que indica la necesidad de la endoscopía.
· EC de colon izquierdo de actividad moderada
– Estos pacientes deben recibir prednisona oral como inducción de remisión y debe decidirse el mantenimiento con base en la extensión, la distribución específica de las lesiones y la respuesta. El esquema de corticoides sistémicos es similar al descripto para la enfermedad ileocecal (habitualmente 40 mg, ocasionalmente 60 mg por día, en general dependiendo del peso, la clínica y los antecendentes, en descenso progresivo hasta la suspensión a 8 a 12 semanas). También en este caso se debe hacer un esfuerzo por no prolongar la exposición a corticosteroides, pero tampoco se debe inducir con dosis subterapéuticas o disminuir los corticoides demasiado rápido (Ho y col., 2006).412
· EC de colon extensa
– En este caso, aunque la actividad sea leve a moderada es adecuado que los esteroides orales se implementen como puente hacia un mantenimiento con tiopurinas y/o anti-TNF, siendo preferible considerar los anti-TNF en la enfermedad extensa moderada, ya que la extensión es un factor de riesgo.
· EC con compromiso rectal significativo
– En caso de daño estructural significativo del recto (según endoscopía o imágenes) o actividad endoscópica persistente, aun con enfermedad clínicamente leve clasificada según síntomas, independientemente del estatus y la localización de otras lesiones, nosotros creemos conveniente usar esteroides como puente y realizar mantenimiento con tiopurinas, anti-TNF o tratamiento combinado, según la magnitud de la lesión, tolerancia del paciente, comorbilidades y preferencias.
Ⓒ EC con compromiso extenso del intestino delgado (> 100 cm)
– Estos pacientes, aun con síntomas leves (y con solo la lesión estructural activa) deben recibir un tratamiento más agresivo, con prednisona para inducción, y mantenimiento con azatioprina/6-MP o anti-TNF.139, 418 El tratamiento precoz con anti-TNF es aconsejable, ya que este patrón es un factor de mal pronóstico.
– En los pacientes con estenosis, al plantearse la cirugía debe intentarse ser lo más conservador posible, procurando limitar la magnitud de potenciales resecciones que se requieran y evaluar el empleo de técnicas de estricturoplastía o dilatación endoscópica.139
– Se debe evaluar y apuntar si el estado nutricional del paciente lo requiere.
Ⓓ EC de localización gastrointestinal superior (L4)
1) Esofágica y gastroduodenal:
· Habitualmente se usan inicialmente esteroides al inicio y se introduce conjuntamente un inhibidor de la bomba de protones.139
– El pronóstico de esta localización fundamenta evaluar de manera precoz inmunomoduladores y/o anti-TNF precozmente. Dado que son localizaciones de pobre pronóstico, la primera elección para inducción y mantenimiento segun severidad y factores individuales de selección son los biológicos aprobados para EC, anti-TNF, vedolizumab, y tambien es adecuado el ustekinumab. Las complicaciones estenosantes, que son altamente frecuentes, se resolverán con dilatación endoscópica o cirugía si son irreversibles con tratamiento médico.
· Yeyunal
– Recientemente se ha reportado que la localización yeyunal tiene peor pronóstico que la esofágica y la gastroduodenal, y que la limitada al íleon, mostrando un riesgo aumentado de cirugías múltiples, enfermedad estenosante y debut en jóvenes.419 Se adjunta un algoritmo de tratamiento de la EC teniendo en consideración los factores de mal pronóstico (Figura 19).
◊ EC luminal, actividad severa de cualquier localización
– Los pacientes con enfermedad activa severa deben tratarse con esteroides intravenosos 300 a 400 mg/día, en plan similar a la CU severa, y además deben ser precozmente evaluados (3 a 5 días) en cuanto a indicación de anti-TNF.169
– Debido a que el comportamiento no estenosante no penetrante puede progresar a estenosante o penetrante, deben considerarse y descartarse complicaciones que podrían requerir procedimientos quirúrgicos de diversa índole: enfermedad fibroestenosante obstructiva intratable medicamente, perforación libre o bloqueada, abscesos intrabdominales o perianales secundarios a trayectos fistulosos. En la EC colónica es posible, aunque infrecuente, la complicación con un megacolon tóxico, lo cual representa una emergencia, similar a lo que ocurre en la CU. Ello requiere estudios de laboratorio e imágenes, y trabajo multidisciplinario con el equipo quirúrgico. Descartadas tales complicaciones, se pueden usar anti-TNF precozmente (incluso desde el día de internación si el paciente realizó previamente los tests para detectar TB latente o activa y cumple los demás criterios de seguridad para introducción de un tratamiento biológico).
◊ EC con inadecuada respuesta a los tratamientos tradicionales
I. EC corticoideodependiente de cualquier localización
– Estos pacientes pueden tratarse con inmunosupresores: tiopurinas o metotrexato, si la situación clínica puede esperar hasta la acción de un puente con corticoides, 12 a 16 semanas en el caso de las tiopurinas (debiendo ajustar la dosis progresivamente) y 8 a 12 semanas en el caso del metotrexato, indicado en dosis de 25 mg semanales IM.169
– En el caso de no responder o presentar factores de mal pronóstico, se indican anti-TNF (infliximab, adalimumab, certolizumab) como monoterapia, o una estrategia combinada con inmunosupresores, o bien vedolizumab o ustekinumab segun las características del paciente.
II. EC resistente a corticoides orales de cualquier localización
– En esta situación, la actividad clínica del paciente suele no permitir el tiempo de espera para la eficacia de los inmunosupresores. En la práctica clínica, aunque no sean evidenciables criterios clínicos de severidad, en los pacientes resistentes a corticoides orales se suelen indicar frecuentemente corticoides intravenosos y biológicos aprobados para Crohn (como monoterapia o en combinación con inmunosupresores), siendo en caso de emergencia elegible el infliximab.
– Como alternativa, monitoreando la situación clínica, puede indicarse directamente anti-TNF sin corticoides intravenosos, prolongando los corticoides orales.
III. EC severa refractaria a corticoides IV (rescate)
– Se realiza rescate con infliximab combinado o no con inmunosupresores para el mantenimiento, siguiendo un algoritmo de biológicos en caso de pérdida de respuesta, con optimización o cambio intraclase (infliximab, adalimumab, certolizumab) o interclase si están disponibles (vedolizumab y ustekinumab hasta el momento).
IV. Mantenimiento de la EC luminal que requirió corticoides intravenosos
– Consideramos que en la EC que llegó a una situación de severidad, en especial si se detecta persistencia de la inflamación mediante los estudios, a pesar de una respuesta clínica, debería evaluarse el mantenimiento con inmunosupresores o biológicos (siendo relevante en las decisiones la ausencia de cicatrización de la mucosa). En el caso de recibir biológicos entran a un algoritmo de mantenimiento, con eventual optimización si recaen, cambio de clase y cambio interclases, teniendo en cuenta que se selecciona entre infliximab, adalimumab y certolizumab en el caso de los anti-TNF. Con respecto al cambio interclases, las opciones que se comercializa es el vedolizumab en nuestro país, al igual que el ustekinumab.
– Una razón adicional para esta indicación es que el requerimiento de corticoides al debut (no necesariamente intravenosos) es un factor independiente para discapacidad a los 5 años de enfermedad, en especial en jóvenes (menores de 40 años) y más aún si presentan fístulas perianales asociadas, criterios que deberían también tenerse en cuenta.413, 414
V. Recaída moderada a severa bajo tratamiento inmunomodulador de cualquier localización
– En el caso de actividad moderada, luego de chequear si la dosis del inmunosupresor está ajustada, la conducta mas apropiada es asociarlo con un anti-TNF, o vedolizumab (en casos severos considerar asociar un curso de esteroides). Según los factores predictivos (Tabla 72) y comorbilidades (en especial en el caso de infliximab) podría mantenerse una combinación con inmunosupresores y anti-TNF en un tiempo en general no menor de 6 meses, e intentar luego monoterapia con anti-TNF o bien vedolizumab o ustekinumab.
Pueden requerirse medidas terapéuticas adicionales según las complicaciones, que se listan en una tabla (Tabla 73).
Tabla 73. Posibles medidas terapéuticas adicionales en la enfermedad de Crohn.

◊ Tratamiento de la EC fistulizante
Se grafica un algoritmo de decisión terapéutica compatible con los conceptos actualizados de manejo en la EC fistulizante perianal (Figura 20).
I. Enfermedad perianal
La frecuencia de la enfermedad perianal (EPA) varía según la localización. En el reporte de Hellers y col. del año 1980, se informó la menor prevalencia de complicación perianal en la enfermedad ileal aislada (L1), localización en la que se reportó en el 12%, incrementando al 15% en la enfermedad ileocolónica (L3), mientras que en la enfermedad colónica (L2) se describió en el 41% cuando no hay compromiso rectal, y de presentación casi constante (92%) cuando el recto estaba comprometido.420 Además, así como los demás cambios de comportamiento se incrementan con la duración de la enfermedad, la prevalencia acumulada de complicaciones perianales también aumenta con el tiempo, como se describió en una casuística de Olmsted County Minesota: 12% a 1 año, 15% a 5 años, 21% a 10 años y 26% a 20 años.421
“ Los pacientes con enfermedad perianal deben evaluarse bajo anestesia, RMI o ecoendoscopía para definir la anatomía y localización de la fístula, asas y órganos involucrados, y para excluir abscesos. Se debe tratar la enfermedad activa subyacente.
Parks y col., en 1976, elaboraron una clasificación descriptiva, que influye en las decisiones quirúrgicas, pero es compleja de utilizar en la práctica clínica. Usando el esfínter externo como punto de referencia, y teniendo en cuenta su anatomía quirúrgica, categoriza a las fístulas en superficial, interesfinteriana, transesfinteriana, supraesfinteriana y extraesfinteriana (Figura 21).422
– Se ha propuesto una clasificación empírica de la enfermedad perianal en fístulas simples y complejas que es más sencilla:423-425
a) Fístulas simples: son bajas, por debajo de la línea dentada, transcurren por el tercio inferior del esfínter anal externo (tipos: superficiales, interesfinterianas, transesfinterianas bajas), y se caracterizan por la ausencia de complicaciones perianales. Tienen un solo orificio externo, es decir, no duelen ni presentan fluctuación.
b) Fístulas complejas: son altas, localizadas por encima de la línea dentada (tipos: interesfinterina o transesfinteriana alta, supraesfinteriana y extraesfinteriana), tienen múltiples orificios externos, dolor, fluctuación, y pueden estar asociadas con abscesos perianal, estenosis rectoanal, proctitis o fístulas a la vagina o vejiga.
EC fistulizante perianal simple
– Se debe descartar la presencia de un absceso perianal; si se encuentra, debe drenarse con urgencia.
– En la fístula perianal simple, es importante evaluar si es sintomática, en las que se recomienda el uso de sedal no cortante si el recto está activo, y si está inactivo podría considerarse la fistulotomía: sin embargo, la estrategia preferida es la colocación de un sedal en combinación con antibióticos (metronidazol y/o ciprofloxacina). Cuando se torna recurrente puede tratarse con anti-TNF y/o tiopurinas.
– Se utilizan antibióticos: metronidazol (750 a 1500 mg diarios) y ciprofloxacina (1000 mg diarios), que deben mantenerse al menos un mes, y luego se revalúa el paciente. Este esquema alivia los síntomas por mejoría transitoria de la enfermedad, pero la cicatrización suele no ser completa, y la recaída es frecuente cuando se suspenden estos medicamentos.426-428
– Cuando los pacientes no evolucionan adecuadamente se debe iniciar y mantener anti-TNF con o sin inmunomoduladores.
EC fistulizante perianal compleja
– Las drogas usadas son anti-TNF y/o tiopurinas, siendo el tratamiento combinado más efectivo.
– Los inmunosupresores y biológicos deben indicarse una vez que se descarten abscesos, se traten los que puedan existir y se tomen medidas preventivas para evitar la formación de los mismos en el futuro. Por ello, además del tratamiento antibiótico, debe reasegurarse que no hay sepsis pélvica.424, 425, 429 Se debe indicar el drenaje quirúrgico si se detectan abscesos y, si corresponde, deben colocarse sedales flojos para prevenirlos.424, 425, 429
Tratamientos disponibles
• Tiopurinas. Resumen de las evidencias
– Un análisis de un subgrupo de un estudio doble ciego aleatorizado a tiopurinas o placebo en EC reportó que el 31% de los pacientes tratados con 6-mercaptopurina experimentó un cierre completo de las fístulas en comparación con el 6% en el grupo placebo.242
– En un metaanálisis de cinco estudios aleatorizados controlados, se evaluó el uso de azatioprina/6-MP para el cierre de fístulas perianales como end point secundario, resultando significativa la diferencia versus placebo a favor de las tiopurinas en 70 pacientes, mostrando que se cerraron en el 54% de los tratados con tiopurinas frente a un 21% de los pacientes tratados con placebo (OR = 4,44; IC95%: 1,5-13,2).241
– Un metaanálisis más reciente que excluyó el primer estudio mencionado fue negativo, dando un OR de respuesta para tres estudios controlados que pudieron aportar los datos originales azatioprina 55% vs. placebo 29% (OR = 4,68; IC95%: 0,60-36,69).430
– Se evaluó una combinación de antibióticos y azatioprina en un estudio prospectivo abierto, el cual mostró la superioridad de tal combinación. Estudiaron 49 pacientes con antibióticos, de los cuales 29 recibieron azatioprina. A los 5 meses respondieron el 49% con la combinación vs. el 15% con antibióticos solamente (p = 0,03).431
• Anti-TNFs. Resumen de las evidencias
a) Infliximab
– Como se describió antes, fue el primer agente biológico que demostró efectividad en estudios controlados aleatorizados para la inducción del cierre de fístulas perianales.
– En el tratamiento de Crohn fistulizante, en un estudio controlado randomizado doble ciego de 94 pacientes con fístulas (90% eran perianales), la administración de infusiones de 5 mg/kg en las semanas 0, 2 y 6 indujeron cierre completo (eliminación de todo drenaje en 2 visitas, separadas por 1 mes) en 17/31 casos (55%), y 38% con 10 mg/kg en comparación con 13% en el placebo (p = 0,001 y p = 0,04 respectivamente). La respuesta, definida como el cierre de al menos el 50% de las fístulas se observó en el 68% y 56% con 5 mg/kg y 10 mg/kg respectivamenre (p = 0,002 y p = 0,02), manteniéndose por un tiempo medio de tres meses. También se observó una diferencia significativa en los escores del Perianal Disease Activity Index en la mayoría de los controles.86
– El estudio ACCENT II confirmó esta respuesta inicial.351-352 En el ACCENT II, se incluyeron 306 pacientes con fístulas perianales o enterocutáneas (coexistente rectovaginal en 25 mujeres), que fueron tratados con infliximab a semanas 0, 2 y 6, resultando un 69% (n 195, de los cuales el 82% tenía fístulas perianales) de respondedores a 10 y 14 semanas. Los respondedores fueron aleatorizados a infliximab o placebo a 54 semanas. El 36% de los que se mantuvieron con infliximab tenían cierre completo de las fístulas versus el 19% con placebo (p = 0,009) y el tiempo de pérdida de la respuesta fue 40 semanas versus 14 semanas respectivamente (p < 0,001). Si perdían la respuesta existía la posibilidad de cruzar a IFX 5 mg/kg si estaban con placebo y los que estaban en mantenimiento con 5 mg podían cruzar a 10 mg/kg, con lo cual restablecieron la respuesta el 60% y el 57% respectivamente.351
b) Adalimumab
• En el estudio CHARM (enrolados 854 pacientes, de los cuales 117 tenían fístulas, 96,6% perianales) que estudió la eficacia del adalimumab en el mantenimiento a 56 semanas entre los respondedores a la inducción, se observó cierre de las fístulas con mayor frecuencia en los pacientes tratados con adalimumab en la semana 26 (30% versus placebo 13%, p = 0,04) y en la semana 56 (33% versus 13%, p = 0,016). Una extensión demostró cicatrización sostenida en el 90% de los pacientes a 2 años en el estudio ADHERE.357, 360
• En posteriores estudios abiertos se describen respuestas de pacientes que habían presentado falla o intolerancia al infliximab, en algunos casos empleando adicionalmente diversas estrategias (sedales, terapia combinada).432-434
• Tacrolimus
– Estudios no controlados sugirieron que el tacrolimus puede ser efectivo para enfermedad perianal.435-438 Sandborn y col. realizaron un estudio randomizado doble ciego en 48 pacientes con EC con fístulas tratados con tacrólimus oral 0,2 mg/kg o placebo durante 10 semanas drenantes (casi el 90% perianales; más de la mitad continuaron con tiopurinas). Se observó mejoría (cierre de ≥ 50% de las fístulas) durante por lo menos 4 semanas en el 43% en el tratamiento activo, frente al 8% en el grupo placebo (p = 0,004), pero no hubo diferencia en la remisión (el cierre de todas las fístulas). Los efectos adversos fueron estadísticamente significativos (2 abandonaron el tratamiento) con tacrólimus, en especial por aumento de creatinina, parestesias, insomnio e inestabilidad, por lo que requirieron disminución de dosis.439 Cuando en la ya referida revisión sistemática de McSharry K y col. se analizó específicamente Crohn perianal, se reportó remisión en el 28,6% y respuesta en el 38,8% de 49 pacientes.263 Con los datos disponibles se evidencia que se requieren más estudios, aunque podría ser usado en no respondedores a anti-TNF.
• Antibióticos
a) Metronidazol
– Tal como se mencionó en la sección correspondiente a antibióticos, se los ha usado en la enfermedad perianal. Berstein y col. trataron con metronidazol a 21 pacientes con enfermedad perianal refractaria durante 8 semanas, presentando mejoría el 83% de los casos y cicatrización el 38%, pero 1/3 tuvieron efectos adversos. Brandt y col. trataron 26 pacientes por 12 meses con 50% de mejoría y 25% de remisión; solo el 28% de los que discontinuaron permanecieron sin recaída. Las parestesias dosis relacionadas fueron del 50% en tratados por más de 6,5 meses. Jakobovits J y col. trataron 8 pacientes, de los cuales la mitad resolvieron los síntomas hasta los 6 meses, pero todos tuvieron efectos adversos.426-428
– El tratamiento tópico con metronidazol no demostró resultado significativo.440
b) Ciprofloxacina
– Thia KT y col. no observaron diferencia al comparar metronidazol, ciprofloxacina y placebo en 25 pacientes por 10 semanas (muestra de bajo poder).441 Solomon M y col., en un estudio no controlado, encontraron que esta combinación de antibióticos ciprofloxacina-metronidazol logró mejoría clínica en 9 de 14 pacientes, con cierre de la fístula en 3 de 14 pacientes.
– La ciprofloxacina asociada con adalimumab demostró tener mayor respuesta clínica que adalimumab más placebo (p = 0,047) y también remisión (p = 0,009) en 76 pacientes con EC con enfermedad fistulizante perianal activa a 12 semanas, pero no al discontinuar a 24 semanas.443
– West RL y col. administraron ciprofloxacina combinada con infliximab en 24 pacientes, demostrando respuesta a la semana 18 en el 73% de los pacientes, frente al 39% con infliximab monoterapia (p = 0,12; NS).444
Anti-TNF en EC fistulizante: ¿cuándo, cómo y porqué?
– Existe controversia sobre si indicar anti-TNF o tiopurinas como primera línea, o tratamiento combinado.
– Peyrin Biroulete, en una publicación donde discute sobre los anti-TNF como primera línea de terapia, menciona que el Colegio Americano de Gastroenterología recomienda anti-TNFs como tratamiento de primera línea en lesiones perianales no supurativas y enfermedad crónica fistulizante, independientemente de que sean fístulas simples o complejas; ello se fundamenta en que las fístulas perianales son un claro factor de mal pronóstico, reconocido de manera unánime en la literatura.
– Existe evidencia de que los anti-TNFs constituyen un tratamiento más potente, y se consideran potenciales modificadores de la enfermedad.418
– El consenso mundial con autores de la Organización Mundial de Gastroenterología (WGO), la Organización International para la Enfermedad Inflamatoria Intestinal (IOIBD), la Sociedad Europea de Gastroenterología y Robarts Clinical Trial es sumamente claro en recomendar este tratamiento como primera línea para las complicaciones perinales.425 También lo hacen D´Haens y col. en una declaración sobre biológicos (año 2011) realizada por la UEG y la posición de Londres en el Congreso Mundial de Gastroenterología.445
Modo de administración
Infliximab: infusiones IV 5 mg/kg. Inducción a tiempo 0, semana 2, semana 6 y mantenimiento cada 8 semanas.
Adalimumab: inducción 160 mg, 80 mg a 0, 2 semanas, y luego 40 mg cada 2 semanas.
Si el paciente no responde se optimiza, y si continúa sin responder se cambia de biológico.
– El mantenimiento reduce las tasas de internación y cirugía.
– Los pacientes responden mejor si los anti-TNF se administran precozmente.
– Los agentes anti-TNF deben usarse en forma prolongada.
Tiopurinas en EC fistulizante. Modo de administración
6-MP y azatioprina:
– Administradas según las dosis convencionales: 6 Mp 1 a 1,5 mg kg y azatioprina 1 a 2,5 mg/kg, teniendo en cuenta los mismos criterios y controles que para la enfermedad luminal.
– Recordar que el tiempo de demora promedio para el comienzo de acción es de 3 meses.
– El tratamiento combinado es más efectivo (corresponde evaluar beneficios versus riesgos en el paciente individual).
Conclusiones del consenso mundial de expertos. Manejo de EPA (WCOG 2013)
El antes mencionado consenso mundial de expertos que se llevó a cabo en el Congreso Mundial de Gastroenterología 2013 consensuó diversos aspectos del manejo de la enfermedad perianal (Gecse y col., 2014) y creemos que es de gran valor resumir varias de las definiciones y conclusiones en este capítulo:425 se incluye un resumen de las conclusiones relevantes en una tabla (Tabla 74).
Tabla 74. Resumen de las conclusiones de un consenso de expertos sobre enfermedad perianal (EPA), desarrollado en sesiones del WCOG 2013.

• Definiciones evaluadas
a) Perianal disease activity index (PDAI) (Tabla 39).
– Fue testeado y validado: en la evaluación de actividad clínica.
– Basado en la evaluación de la calidad de vida con varios componentes (dolor/restricción de las actividades y la restricción de las actividades sexuales) y la gravedad de la enfermedad perianal (secreción de una fístula, el tipo de enfermedad perianal y el grado de induración).87 Un score > 4 fue reportado como de 87% de exactitud para la evaluación. El método de evaluación mediante la magnitud del drenaje (cierre: definido por no drenaje de todas las fístulas que drenaban y respuesta por reducción de ≥ 50% de fístulas drenantes a la compresión digital suave)86 fue considerada investigador dependiente y no se ha validado.425
b) Clasificación de las fístulas en bajas y altas
– Avalada por el consenso mencionado.
c) Clasificación anatómica de Parks
– El consenso concluye que impacta en el tratamiento quirúrgico y el riesgo asociado de la incontinencia posquirúrgica.
d) Absceso perianal
– Definido clínicamente como fluctuación y radiológicamente como una colección de fluido.
– Detección por imágenes: 1) RMI: lesión hiperintensa en T2 con un anillo inflamatorio que realza pos-contraste en T1 ponderado o 2) una zona hipo o anecoica con ecografía endoanal (a menudo mal demarcada).
– Se destacó la necesidad de la detección oportuna y el tratamiento de los abscesos para minimizar el riesgo de complicaciones sépticas.
e) Proctitis
– Definición: cualquier ulceración y/o estenosis en el recto o la inflamación y/o estenosis del ano.
– Relevancia: la presencia de inflamación rectal: 1) debe ser informada al evaluar la fístula; 2) debe ser tenida en cuenta al tratar la fístula (buscando cicatrizar la mucosa y cuidando no operar con proctitis). La proctitis es predictiva de no cicatrización de la fístula, de falla de reparación quirúrgica y de riesgo de proctectomía.
• Métodos de estudio evaluados y manejo de las complicaciones:
a) Endoscopía
– Permite la evaluación de la extensión y gravedad de la inflamación luminal, y la presencia de orificios y otras complicaciones como la estenosis y cáncer.
b) Examen bajo anestesia
– Tiene un papel importante en el diagnóstico y clasificación, permitiendo el drenaje de abscesos y/o colocación de sedales. Si se sospecha de un absceso perianal, es el procedimiento de elección para drenarlo.
c) RMI
– Puede detectar colecciones adicionales que no detectó al examen bajo anestesia, visualiza con precisión el esfínter anal y los músculos del suelo pélvico, así como los trayectos de fístulas y abscesos con una precisión que varía desde 76 hasta 100%. Además, puede identificar clínicamente abscesos “silenciosos” e inflamación luminal.
– La secuencia ponderada T2 con supresión de grasa es la técnica óptima para formación de imágenes, y la secuencia ponderada T1 con gadolinio es útil para la diferenciación entre fluido/pus y tejido de granulación.
d) Ecografía endorrectal (con o sin peróxido de hidrógeno)
– Es una alternativa útil a la resonancia magnética en el diagnóstico de las fístulas, permitiendo una visualización detallada del complejo del esfínter anal, con exactitud de entre 86-95% para la clasificación correcta y de 62-94% para la identificación de orificios internos.
– Sin embargo, no puede identificar con precisión abscesos isquioanales o del supraelevador, porque la penetración es limitada. En casos seleccionados, la infusión local de peróxido de hidrógeno o EUS Doppler color con inyección de solución salina mejora la visualización.
– La ecografía muestra la fístula de Crohn y puede diferenciar entre la fístula anal relacionada con esta enfermedad o la criptogénica, con un valor predictivo positivo y negativo del 87% y 93% respectivamente.
e) Comparación de ecografía y RMI
– Ambos métodos tienen una sensibilidad comparable en la detección de fístulas perianales. En un metaanálisis la especificidad para MRI fue mayor que la de la ecografía endorectal y ambos son superiores al examen clínico a la hora de evaluar y monitorear las fístulas perianales.
– El ultrasonido transperineal puede ofrecer una ventaja en la detección de fístulas anovulvares (88,9% frente a 44,4% en comparación con la RMI).
f) Fistulografía y la TC
– Son modalidades antiguas de evaluación diagnóstica de la EPA debido a la exposición de la radiación y la mala visualización de la relación anatómica de las fístulas con los músculos del suelo pélvico. Solo en casos muy seleccionados puede mejorar la información para el manejo quirúrgico
• Conductas terapéuticas recomendadas por el consenso en diversos aspectos (EPA- GOG 2013).
a) Drenaje y sedal combinado con anti-TNF:
– Las tasas más altas de éxito y las más bajas de recurrencia fueron de pacientes que se sometieron a exámenes bajo anestesia con drenaje y colocación de sedal antes de comenzar el tratamiento con anti-TNF.
b) Estenosis anal
– Requiere dilatación única o repetida. Se realiza dilatación suave digital o con bujías, y tratando medicamente si es posible.
c) Tratamiento farmacológico
– Anti-TNF: fuertemente recomendados. El infliximab es el mejor documentado, pero el adalimumab y el certolizumab son moderadamente eficaces.
– Tiopurinas y antibióticos: considerados como adyuvantes.
– Tacrolimus: puede ser usado en no respondedores a anti-TNF.
Procedimientos quirúrgicos en la EPA
(Técnicas/resultados y recomendaciones)
Incluyen drenaje con sedal, colgajo de avance rectal, fistulotomía u otros procedimientos. Cuando se compara la cirugía con el tratamiento combinado, los datos son:
– Respuesta: con cirugía solamente 35,9%.
– Tratamiento combinado 71,3%.
– Diferencia p = 0,001 (se recomienda tratamiento combinado).
• Sedal flojo para drenaje
– Es un método eficiente y seguro en el tratamiento de fístulas perianales de Crohn, pues previene los abscesos. No está establecido el tiempo que debe dejarse. La fístula puede cerrarse totalmente solo cuando se retira, pero su remoción precoz puede asociarse con recurrencia de abscesos (15% en el ACCENT con retiro a semana 2).
– Los sedales cortantes producen frecuente incontinencia (no deben usarse).
• Fistulotomía y puesta a plano:
– Este procedimiento, en términos de seguridad, es aplicable en fístulas sintomáticas superficiales bajas interesfinterianas en ausencia de proctitis.
– En las bajas transesfintéricas que se presentan en la mujer, hay riesgo de incontinencia, por tener el esfínter externo más corto en su parte anterior.
– Las fístulas altas se asocian con lenta cicatrización y mayor tasa de incontinencia.
Procedimientos de reparación quirúrgica definitiva:
– Incluyen fistulotomía, colgajos de avance mucoso, tapones biológicos (colágeno, mucosa intestinal porcina), trasposición del músculo Gracilis, ligadura del tracto de la fístula interesfinteriana (LIFT), adhesivo de fibrina y la inyección de células madre del tejido adiposo o médula ósea. Estos procedimientos tienen porcentajes variables de eficacia, algunos en experimentación, y varios de ellos implican un porcentaje de incontinencia.
– La reparación quirúrgica definitiva solo se considera en ausencia de proctitis.
Procedimientos quirúrgicos paliativos
• Ostoma desfuncionalizante: opción para la enfermedad severa no respondedora.
• Protectomía: transperineal intersfintérica con ostoma permanente es el último paso de una enfermedad refractaria, fistulizante, severa.
Se resumen las conclusiones relevantes del consenso de expertos: manejo de EPA (WCOG 2013) (Tabla 74).
Otras opciones terapéuticas, reportadas aisladamente
– Oxígeno hiperbárico: en nuestra experiencia, en coincidencia con los resultados de ocasionales descripciones de la literatura, algunos pacientes que no responden adecuadamente, o con contraindicaciones para inmunosupresión, mejoran con una opción no farmacológica, en algunos casos administrando simultáneamente con el tratamiento inmunosupresor o biológico cursos repetidos de forma intermitente.446
– Talidomida: también en pacientes altamente refractarios, hemos usado esporádicamente la talidomida 100 mg a 200 mg día, luego de recomendaciones por el importante riesgo teratogénico y los demás efectos adversos posibles (como polineuropatía y cuadros depresivos), observándose casos aislados de mejoría.
– La experiencia inicial con células madre inyectadas localmente, tanto con células madre mesenquimales alogénicas derivadas de tejido adiposo expandido como con células estromales mesenquimales derivadas de médula ósea autóloga, han mostrado efectos beneficiosos.447-449 Se inyectaron en un ensayo de investigación (ADMIRE Study Group) células madre mesenquimales derivadas de tejido adiposo alogénico (Cx601) en fístulas perianales complejas en la EC, en un estudio controlado aleatorizado, doble ciego, consistente en una sola inyección intralesional de Cx601 (n 107) versus placebo (n 105), con estratificación según el tratamiento concomitante de referencia. Evaluado por intención de tratamiento, una proporción significativamente mayor de pacientes tratados con Cx601 versus placebo alcanzó una remisión combinada (clínica más cierre de fístulas) 50% vs. 34%, respectivamente; p = 0,02. Experimentaron eventos adversos relacionados con el tratamiento (los más frecuentes el absceso anal y proctalgia). Los autores concluyen que Cx601 es un tratamiento eficaz y seguro para las fístulas perianales complejas en pacientes con EC que no respondieron a tratamientos convencionales o biológicos, o ambos.449
II. Enfermedad fistulizante no perianal
El manejo de las fístulas no perianales también requiere caracterizar su anatomía, evaluar cuáles son los órganos comprometidos, descartar complicaciones (estenosis, abscesos), y determinar la situación de la enfermedad y los parámetros nuticionales.27, 429, 450, 451
Requiere un manejo multidisciplinario (gastroenterólogo, cirujano, imagenólogo, nutricionista, y en ocasiones infectólogos y terapistas).
– En las fístulas internas, después de descartar abscesos y estenosis irreversibles, el tratamiento ideal son los anti-TNF con o sin inmunosupresión.
– La indicación precoz de anti-TNF antes de complicaciones irreversibles es un factor importante para el tratamiento exitoso de la EC fistulizante.
En los estudios clínicos mencionados previamente, incluyendo los pivotales de infliximab que reportan tratamiento de EC fistulizante, más del 80% de los pacientes presentaban solo fístulas perianales, por lo tanto, la mayoría de los resultados corresponden a fístulas perianales. Con adalimumab el porcentaje el muy similar (menor aún). Lo mismo ocurre en los estudios de inmunosupresores.86, 351, 352
El resultado a largo plazo del tratamiento con anti-TNF de las fístulas enterocutáneas en pacientes con EC fue estudiada por el grupo francés Groupe d’Etude des Thérapeutique Affections Inflammatoires du digestive (GETAID) entre enero de 2008 y diciembre de 2009, que realizó una revisión retrospectiva de los resultados de todos los pacientes con EC fistulizante (con exclusión de fístula perianal) tratados con estas drogas, evaluando el cierre de las fístulas y la tolerancia de la terapia, mediante análisis univariado y multivariado. Fueron incluidos en este estudio 48 pacientes con seguimiento medio de 3,0 años (rango: 2,0-6,6). La localización de las fístulas fue intestino delgado (n = 38), duodeno (n = 1), colon (n = 9), anastomosis ileocolónica 17 (35%) casos. Tenían fístulas complejas 16 (33%) con múltiples tractos y 11 pacientes (23%) alto flujo (con ostoma). El cierre completo de las fístulas se logró en 16 (33%) pacientes, de los cuales 8 sufrieron una recaída durante el período de seguimiento. En el análisis multivariado, el cierre completo de las fístulas se asoció con la ausencia de múltiples tractos y estenosis agregadas. Se complicaron con un absceso abdominal 15 (31%) de los pacientes. Requirieron resección intestinal con el trayecto fistuloso 26 (54%) de los pacientes. Un paciente murió después de la cirugía debido a la sepsis abdominal. Los autores de este estudio concluyen que la terapia anti-TNF puede ser eficaz en hasta un tercio de los pacientes, especialmente en ausencia de estenosis y fístulas complejas. Ello indica que es necesaria una cuidadosa selección de los pacientes para prevenir el fracaso del tratamiento y mejorar la seguridad.452
Este reporte certifica una vez más que las fístulas proximales a una complicación fibroestenosante irreversible requieren habitualmente cirugía para descomprimir la obstrucción que evita el cierre de la fístula, con posterior indicación posquirúrgica de anti-TNF para prevenir la recurrencia.351-452
Diagnóstico y tratamiento de las fístulas no perianales
Se grafican los conceptos generales para el manejo de fístulas no perianales (Figura 22 A), y el manejo específico según las características de las fístulas (Figura 22 B).
Las fístulas intraabdominales puden ser internas y externas
a) Internas: enteroentéricas, enterocolónicas, gastrocolónicas, duodenocolónicas, enterovesicales.
b) Externas: enterocutáneas espontáneas o pos-quirúrgicas.
a) Fístulas internas: el método diagnóstico de elección es la entero-RMI.450
Enteroentéricas entre íleon y colon derecho: según lo anteriormente expuesto, requieren descartar estenosis que impida el cierre de la fístula, evaluar la presencia de abscesos, y en caso positivo drenarlos y controlar el estado nutricional. La mayoría son asintomáticas. Si no hay infección intraabdominal ni estenosis, se tratan preferentemente con anti-TNF con tiopurinas (mayor eficacia) o sin ellas, adaptando el tratamiento según comorbilidades y casos individuales; eventualmente puede indicarse cirugía por las complicaciones.
Gastrocolónicas, duodenocolónicas e ileocolónicas: generalmente cursan con síntomas de diarrea, pérdida de peso y deterioro nutricional, debido al by-pass intestinal y sobrecrecimiento bacteriano del intestino delgado. La mayoría requiere cirugía. Puede intentarse tratamiento médico, según la situación clínica y si no existen estenosis o abscesos.
Enterovesicales: la mayoría de las publicaciones de fístulas enterovesicales reportaron tratamiento quirúrgico, con resección del asa afectada, resolución de la eventual estenosis y eventual colección intraabdominal, control y tratamiento de potenciales infecciones urinarias. Monitoreando las infecciones, y asociando antibióticos, podrían tratarse medicamente con inmunomoduladores y biológicos. La cirugía es necesaria en caso de infección urinaria recurrente o abscesos.
Un estudio reciente realizado en España, retrospectivo multicéntrico, incluyó pacientes con EC con fístulas enterourinarias diagnosticadas por la presencia de síntomas clínicos y confirmados por cirugía o técnicas radiológicas o endoscópicas. Se reportaron los resultados del tratamiento médico y quirúrgico. Se evaluaron los factores predictivos para alcanzar la remisión sin necesidad de cirugía; se usó regresión de Cox. Se definió la remisión como la ausencia de síntomas clínicos con una confirmación radiológica de cierre de la fístula. De 6081 pacientes con EC examinados, 97 tenían fístulas enterourinarias (frecuencia 1,6%), el 65% en hombres. Después de una mediana de seguimiento de 91 meses, el 96% de los pacientes estaban en remisión sostenida. 33 pacientes (35%) recibieron terapia con anti-TNF. De estos, el 45% alcanzó una remisión sostenida (mediana de seguimiento de 35 meses) sin necesidad de cirugía. Más del 80% de los pacientes requirieron cirugía, lo que indujo la remisión (mediana de seguimiento de 101 meses) en el 99% de ellos. Los pacientes que se excluyeron del análisis de los predictores de remisión sin necesidad de cirugía fueron aquellos donde el tiempo entre el diagnóstico de la fístula y la cirugía enterourinaria fue menor a 8 semanas y el tratamiento médico de la fístula no se intentó. En este estudio se reportó que solo el uso de agentes anti-TNF se asoció con una mayor tasa de remisión sin necesidad de cirugía (hazard ratio: 0,23, IC95%: 0,12-0,44; p < 0,001). Sin embargo, 15 pacientes (45,4%), en los que los anti-TNF no fueron eficaces, lograron remisión sostenida luego de la cirugía. Tres pacientes que no se operaron mejoraron, pero no lograron remisión (mediana de seguimiento 59 meses, IQR: 26-74).
En esta gran cohorte de pacientes con EC, la frecuencia de fístulas enterourinarias fue baja. Más del 80% de los pacientes requirieron cirugía, y en todos menos uno de ellos la cirugía indujo una remisión sostenida. Los autores concluyen que, en un subgrupo seleccionado de pacientes, los anti-TNF pueden inducir remisión a largo plazo de la fístula y su cierre, lo cual fue documentado radiológicamente, por lo que es posible evitar la cirugía en un grupo de pacientes.453
b) Fístulas externas26, 450
Enterocutáneas
– El equipo multidisciplinario es sumamente relevante, ya que se trata de pacientes complejos. Fístulas espontáneas o primarias450
– Típicamente secundarias a la actividad de la enfermedad. Si tienen alto débito cursan con deterioro nutricional. Se requiere mapear los trayectos, descartar estenosis que impidan su cierre, mantener los parámetros nutricionales, descartar abscesos.450
– Se pueden tratar con anti-TNF y tiopurinas y, si no se cierran, se intenta la cirugía.450
– En general, las fístulas de bajo débito, no complicadas con absceso, pueden tratarse con inmunomoduladores y biológicos, aunque la respuesta es menor que en las fístulas perianales. Las fístulas de alto débito generalmente tienen que ser tratadas quirúrgicamente, más aún si están complicadas con absceso o estenosis intestinal distal.429
Fístulas posquirúrgicas tempranas (entre 7 a 14 días) y tardías (en un período ≥ 3 meses).429, 454
– Las tempranas suelen ser secundarias a una complicación de la técnica, como dehiscencia de sutura.
– Pueden ser de alto débito, requerir soporte nutricional, reposición hidroelectrolítica, y eventualmente octeótrido.450
– Suelen requerir bolsas de ileostomía y el tratamiento de la piel es un aspecto relevante y complejo.450
– Si no responden, lo cual es frecuente en las posquirúrgicas, especialmente si tienen alto débito, y habitual si tienen estenosis distal, requieren cirugía con resección del asa afectada. Hvas aconseja en caso de una fístula temprana, si se dan las condiciones clínicas, bolsa de ileostomía, terapia nutricional, esperando cicatrización, y si no ocurre operar después de los 3 meses.450 Si hay estenosis distal a la fístula, la conducta quirúrgica se recomienda como inicial, al igual que el drenaje si hay abscesos.450
c) Fístulas enteroginecológicas26, 429, 450, 451,455
La selección del tratamiento debe ajustarse al paciente individual.450
Un estudio español que incluyó 47 pacientes, 75% con fístulas rectovaginales, 21% con fístulas anovaginales/anovulvares y 4% con fístulas enterovaginales reportó con infliximab respuesta completa en el 17% de los pacientes y respuesta parcial en el 30%. Las tiopurinas lograron una remisión del 13% y una respuesta parcial del 24%, mientras que no se observó respuesta duradera con los antibióticos. La cirugía se indicó en el 38,3% de los pacientes, con un 22% de respuesta completa después de una primera operación, y un 38,8% lo logró luego de una reintervención. En total, el cierre definitivo después de una o más de estas terapias se logró en solo el 31,9% de los casos.455
Fístulas rectovaginales
– El infliximab demostró eficacia en un análisis post-hoc del ACCENT II. Entre 25 pacientes de ACCENT II con fístulas rectovaginales, esta droga fue efectiva luego de una inducción con infliximab a 0, 2, 6 semanas, logrando el cierre de la fístula en el 44,8% de los casos a la semana 14. Entre los pacientes respondedores, el 72% no drenaron más allá de la semana 14. Comparando entre un grupo que siguió un mantenimiento con infliximab 5-mg/kg cada 8 semanas y otro que siguió con placebo, la duración del cierre de la fístula rectovaginal fue más prolongada en el grupo de mantenimiento con infliximab (media, 46 semanas) que en el grupo placebo (33 semanas).350
– Además de los esquemas convencionales de anti-TNF y/o tiopurinas se suele agregar antibióticos, aunque no deberían usarse como único tratamiento, ya que como demostró el estudio español mencionado previamente, la eficacia a largo plazo requiere otras drogas o procedimientos.
– En rectovaginales no respondedoras puede intentarse: flap de avance mucoso, adhesivo de fibrina, tapón (plug), con resultados muy variables (mejores al 30% hasta mayores la 80%) según la técnica y las características de la paciente: en general se espera respuesta en aproximadamente la mitad de las pacientes.425, 429
– Eventualmente pueden requerir ostomía de derivación si se asocian con síntomas inaceptables, que en pacientes con gran compromiso puede evolucionar a protectomía.
Fístulas enterovaginales y sigmoideovaginales
– Habitualmente requieren resección del segmento intestinal afectado (intestino delgado, sigma) y pueden necesitar desfuncionalización.
Fístulas ano-introitales bajas
– Si son asintomáticas, pueden no requerir tratamiento quirúrgico, contrariamente a las fístulas sintomáticas, donde la cirugía es frecuente (incluyendo ostomía de derivación).26, 429
◊ Manejo de la EC estenosante
La aparición de estenosis como complicación de la EC es un problema relevante. Recordemos que según lo reportado por Louis y col., el 11% de los pacientes con Crohn presentaba estenosis de inicio, y el 32,6% de los mismos a 10 años de evolución.118
De los registros médicos de Olmsted County (Minnesota) 306 pacientes diagnosticados con EC entre 1970 y 2004, seguidos con una media de 8,4 años y evaluados para su fenotipo clínico inicial, con base en la Clasificación de Montreal, surge que las probabilidades acumuladas de desarrollar enfermedad estenosante en diferentes tiempos fueron las siguientes: al debut 2,9%; a 90 días 4,8%; al año 7,2%; a 5 años 12,4%; a 15 años 15,2%; a 20 años 21,6%; permaneciendo en 21,6% a 30 años.122
La localización más frecuente de las estenosis de novo es el íleon y la región ileocolónica. Sin embargo, las estenosis pueden aparecer en cualquier lugar afectado por la EC, incluyendo el tracto gastrointestinal superior, el colon y el recto. La frecuencia y la localización de las estenosis primarias de la EC es de 40-55% en el íleon terminal y colon, 15-25% en el colon solamente, 25-40% exclusivamente íleon y hasta el 10% en el tracto gastrointestinal superior.121
En un estudio de 615 nuevos pacientes con EC consecutivamente diagnosticados en la Clínica Cleveland entre 1966 y 1969, se siguió a 592 pacientes (media 13 años, y un mínimo de 7 años). La primera cirugía por obstrucción fue más frecuente en la EC del intestino delgado (61,1%), y en la enfermedad ileocolónica (48,2%) que en la EC localizada solo en colon (22,3%).456
Después de la resección intestinal de una estenosis, la recurrencia postoperatoria de la EC en la anastomosis se produce habitualmente, en especial en pacientes con anastomosis ileocolónica.121
Se muestra un algoritmo general para EC estenosante (Figura 23 A) y un sumario del manejo específico en cuanto a localización y características (Figura 23 B).
Ante síntomas clínicos de obstrucción intestinal, luego de las medidas convencionales para tratar una obstrucción y tratamiento corticoide intravenoso se realizan estudios para demostrar y evaluar las características de la estenosis. Es relevante determinar si hay actividad inflamatoria.121
Diagnóstico: la entero-MRI con contraste IV con gadolinio es el estudio de 1ra línea, con una sensibilidad para detectar estenosis del 95% y para detectar actividad del 80 al 90%. Permite observar engrosamiento de la pared, realce del contraste, edema, ulceración. La enterotomografía tiene un valor diagnóstico similar, pudiendo también usarse la ultrasonografía con Doppler (esta última es operador dependiente y tiene la dificultad de la interposición de gas).121
Habitualmente hay marcadores de serológicos y fecales de enfermedad activa. Los marcadores fecales son útiles si el paciente no cursa un cuadro de obstrucción aguda.
Tratamiento: si se detecta actividad, luego del corticoide se indican anti-TNF con o sin inmunosupresores. Previamente se excluyen complicaciones.121
Si no hay respuesta al tratamiento médico se presume estenosis fibrótica irreversible. Si es accesible a la endoscopía y menor de 4 cm se intenta dilatación con balón; si es mayor de 4 cm se puede realizar estricturoplastía, y si es mayor de 10 cm suele optarse por resección quirúrgica del segmento. Para la decisión son importantes la localización, la angulación y la presencia de una resección intestinal previa.121
Dilatación en la EC, solo debe intentarse la dilatación de una estenosis en instituciones con servicio de cirugía las 24 horas. Respecto de los resultados, una revisión sistemática, que incluyó 13 estudios con 347 pacientes con EC tratados con dilatación endoscópica para estenosis posquirúrgicas, demostró una tasa de éxito técnico superior al 80%, aunque ocurren complicaciones importantes, entre las que se destaca la perforación en un 2%. Una longitud de la estenosis ≤ 4 cm se asocia en forma significativa con no requerimiento de cirugía. Los autores concluyeron que la dilatación endoscópica es efectiva y segura, especialmente para la recurrencia después de resecciones ileocolónicas, lo que demora la cirugía en un promedio de 3 años.139, 457, 458 Para estudiar la seguridad y la eficacia a largo plazo de la dilatación, en una cohorte seguida entre 1995 y 2006 en Leuven, se realizaron 237 dilataciones en 138 pacientes para estenosis clínicamente obstructivas (< 5 cm, 84% anastomótica), con 97% de éxito inmediato (5% de complicaciones graves). A 5,8 (IQR: 3,0-8,4) años de seguimiento requirieron nueva dilatación el 46% o cirugía el 24%, no detectándose que el resultado a largo plazo de la dilatación endoscópica este influenciado por la actividad de la enfermedad o la terapia médica.
Estricturoplastía: se realiza en el intestino delgado (no en colon) en múltiples estenosis pequeñas en un segmento largo (contraindicada en múltiples en segmento corto), cuando el paciente tiene el antecedente de una resección previa > de 100 cm de intestino delgado, rápida recurrencia clínica obstructiva, estenosis fibrótica (aunque se puede hacer en enfermedad activa). Las contraindicaciones son: flemón, fístula interna, o perforación, evidencia de displasia o cáncer. La más frecuente es la de Heineke-Mikulicz realizable en estenosis menores de 10 cm (la indicación más frecuente), aunque hay otras técnicas para estenosis mayores de 10 cm. El promedio de complicaciones es 13% (0 a 57%). La recurrencia es del 28%.121, 139, 459-461
Resección intestinal
Si se realizan resecciones de intestino delgado, deben ser lo más conservadoras posible. En el colon, los tipos de cirugía a indicar en las estenosis según los segmentos comprometidos son: una resección segmentaria cuando la lesión involucra menos de 1/3 del colon; si es salteado en ambos extremos se realizan 2 resecciones, y si hay una estenosis larga y se evidencia actividad, se realiza colectomía.139
◊ Prevención de la recurrencia postperatoria
Se muestra un algoritmo de decisión terapéutica en función del riesgo de recurrencia postoperatoria en la EC (Figura 24).
Si bien las probabilidades de cirugía en la EC varían entre distintas casuísticas, es universalmente reportado que por falta de respuesta al tratamiento o por complicaciones tiene alto requerimiento quirúrgico. Cuando el período de observación se extiende a 20 años, algunos estudios publicaron una probabilidad de cirugía cercana al 80% a 20 años. Tal es el caso de Munkholm y col., en una cohorte de 373 pacientes de Copenhagen (1962-1987), y la National Cooperative Crohn’s Disease Study (NCCDS) en 569 pacientes, publicado en 1979, reportaron el 82% y el 78% respectivamente.
Mekhjian462-463, en la mencionada cohorte danesa solo el 34% habían requerido una sola operación y el 36% dos o más operaciones.
En el condado de Olmsted County, entre los pacientes diagnosticados entre 1974 y 2004, 152 (49%) requirieron cirugía con un riesgo acumulado de 38, 48, 58 y 61% a 5, 10, 20 y 30 años respectivamente.464 Más recientemente en una cohorte noruega, población basado, la probabilidad acumulada durante los primeros 10 años fue del 37,9%. Dentro de los 5 años del diagnóstico la tasa de cirugía es del 17 al 35%.465 Bougen G y col. revisaron el riesgo de cirugía previa y posterior a la era de los biológicos, con foco en adultos con EC luminal, observando que antes de la era de los biológicos, la cirugía en los datos de centros de referencia osciló entre el 17% y el 35% dentro de los 5 años del diagnóstico inicial, y del 18% al 33% en el mismo caso en la era de los biológicos. Sin embargo, estos datos pueden estar influenciados por el sesgo de referencia. Los estudios poblacionales pueden reflejar mejor el espectro verdadero de una enfermedad. Con base en siete cohortes basadas en población, Bougen reportó una necesidad de cirugía dentro de los 5 años del diagnóstico del 27% al 61% antes de la era de los anti-TNF, y del 25% al 33% posteriormente.466
La resección intestinal en la EC no es curativa, lo cual es un dogma fuera de discusión y la recurrencia postoperatoria es un grave problema. La proporción de pacientes que requieren cirugía por complicaciones o refractariedad en algún momento de su enfermedad es del 80% (Bouguen y col., 2011).466
La recaída endoscópica es el mayor predictor de recurrencia clínica, y los pacientes que recaen clínicamente están en riesgo de reoperación. La recurrencia clínica, documentada en los centros de referencia, presenta rangos del 20% al 37% al año del debut y del 34% al 47% a 5 años, figura similar a la de las cohortes poblaciones. La prevalencia de recaída endoscópica reportada por Rutgeerst y col. fue del 73% al año de enfermedad y del 85% a 3 años.115 Esta tasa de recaída endoscópica es similar a otros centros de referencia, donde se reciben pacientes complejos, mientras que en los estudios basados en población las tasas de recaída endoscópica son 1/3 menores. La recurrencia normalmente se localiza en el segmento inmediatamente proximal a la anastomosis quirúrgica. Si hay una ileostomía de derivación proximalmente, mientras no se reconstituya el tránsito, en general la lesión no se produce.
El CDAI y el HBI no están validados para cuantificar la recaída postoperatoria, porque los síntomas secundarios a la cirugía afectan los resultados. La recidiva morfológica se cuantifica con el score de Rutgeerst. El riesgo de recurrencia se correlaciona con la endoscopía, siendo menor al 10% cuando se presentan scores 0-1, del 20% para scores ≥ 2 y del 50-100% cuando los scores son i3-i4, estos últimos fuertemente asociados con el riesgo de reoperación.115 En general, en pacientes que han sido sometidos a resección quirúrgica para EC, el 70% requiere una nueva cirugía dentro de los 20 años.467
Las decisiones terapéuticas para prevenir la recaída se toman con base en la presencia de factores que predicen el riesgo de recaída. Los establecidos en la literatura son: el tabaco (fumador activo), el fenotipo fistulizante, la enfermedad perianal, la presencia de una resección intestinal previa y una previa resección extensa ID.21 El predictor más potente es el fumar activamente, especialmente en mujeres, con una relación dosis respuesta. La condición de fumador activo duplica el riesgo de recaída.21, 468, 469 A pesar de algunos datos controvertidos, un fenotipo penetrante parece aumentar el riesgo de recaída postoperatoria (avalado por varios reportes e incluso un metaanálisis de 3044 pacientes, OR: = 1,5; p = 0,0002), lo que fue considerado evidencia por el consenso ECCO.21, 139, 470 Los estudios realizados en enfermedad perianal definieron a esta variable también como factor riesgo, aunque la magnitud del riesgo presenta variabilidad en diversas investigaciones.21, 471 Además en los pacientes que tienen una resección intestinal previa se determinó un aumento del riesgo de recaída comparado con los que nunca fueron operados, según lo demuestran los datos de una cohorte suiza en la que se reoperaron más del 80% de 244 pacientes con este antecedente, y además tuvieron una tasa de recaída clínica significativamente mayor que luego de la primera operación.21, 472 Asimismo, Buisson y col., en su revisión de los factores predisponentes de recaída postoperatoria, reportan la controversia existente en cuanto al papel de la extensión de la resección; describen un estudio suizo poblacional de 476 pacientes en el que una mayor extensión del segmento resecado parece aumentar el riesgo de recaída (RR = 1,4), y otros estudios, de centros de referencia, aunque no con unanimidad, reportan relación con la extensión, pero difieren con respecto a la definición de la extensión de la resección (reportando como extensas las mayores de 20 a 50 cm).21, 473
Se postularon además otros factores, asociados con el pronóstico en estudios aislados, sin demostrarse unanimidad consistente en los resultados: el tipo de anastomosis de (lado a lado), el procedimiento quirúrgico (laparoscopía), la indemnidad o no de los márgenes de resección, el sexo, la edad al inicio de la enfermedad, la localización, la duración hasta la cirugía, las complicaciones quirúrgicas y la historia familiar de EC. También se han reportado otros posibles predictores con datos histológicos (plexitis mientérica en el margen de resección proximal fue postulada como factor de riesgo por el grupo de Leuven y un grupo de París, pero en una investigación del St. Marks no resultó estadísticamente significativo, y la presencia de granulomas), como así también no fueron unánimemente significativos los marcadores genéticos y biológicos (mutaciones del CARD 15, TGFb, un bajo nivel de ARNm de IL10, el valor de PCR).21, 474-478 De todos los mencionados, el único modificable, y además fuerte predictor, es el tabaco.
Dado que no todos los pacientes tendrán recurrencia, y el tiempo en que se esta desarrollará posteriormente a la cirugía difiere entre individuos, se considera una conducta racional estratificar por riesgo, según los factores predictivos mencionados y monitorear endoscópicamente la anastomosis, en busca de lesiones predictivas de recaída clínica (i2b) según el score de Rutgeerst. La endoscopía es el patrón de oro para diagnosticar recurrencia.115 La cápsula endoscópica es la preferida por los pacientes por el confort, no requiere anestesia, pero hasta el momento es controvertida su utilización en remplazo de la ileocolonoscopía, ya que su sensibilidad en las lesiones de la anastomosis ha sido reportada más baja que en la endoscopía. Si bien puede detectar lesiones proximales a las que no accede el colonoscopio, la relevancia clínica de tales lesiones en el pronóstico es incierta.468
Respecto de las imágenes, la ultrasonografía es una técnica de buena sensibilidad y especificidad para evaluar la recaída, pero es operador dependiente y la presencia de gas en las asas intestinales dificulta la evaluación. La enterotomografía está limitada, dado el propósito de evitar la exposición a la radiación ionizante. La enteroresonacia es el método de imágenes preferido para la EC, aunque el costo es elevado, y puede no detectar lesiones superficiales que detecta la endoscopía.468 Recientemente, los marcadores fecales (calprotectina y lactoferrina) han demostrado ser superiores al CDAI y la PCR en la predicción de actividad de la enfermedad endoscópica, y varios autores los avalan en la predicción de la recidiva después de la resección endoscópica en EC.468, 479
En el estudio POCER (postoperative Crohn’s endoscopic recurrence) prospectivo, aleatorizado y controlado, realizado en 17 hospitales en Australia y en un hospital en Nueva Zelanda, que luego se comentará, se analizaron datos de 135 pacientes con EC para evaluar la eficacia de las evaluaciones endoscópicas y el tratamiento intensivo para prevenir la recurrencia de la EC después de la cirugía. Se midieron los niveles de calprotectina fecal (319 muestras) PCR y CDAI antes de la cirugía y luego a los 6, 12 y 18 meses después de la resección. Se realizaron ileocolonoscopías a los 6 meses después de la cirugía en 90 pacientes, y a los 18 meses después de la cirugía en todos los pacientes. El nivel medio de FC disminuyó de 1347 µg/g antes de la cirugía a 166 µg/g a los 6 meses de la cirugía, pero fue más alto en pacientes con recurrencia (score endoscópico de Rutgeerts, ≥ i2) que en pacientes en remisión (275 frente a 72 µg/g, respectivamente, p < 0,001). Los niveles combinados de FC a los 6 y 18 meses se correlacionaron con la presencia (r = 0,42; p < 0,001) y la gravedad (r = 0,44; p < 0,001) de recurrencia de CD, pero no el nivel de PCR y el puntaje CDAI. Los niveles de FC superiores a 100 µg/g indicaron recidiva endoscópica con un 89% de sensibilidad y un 58% de especificidad, y un valor predictivo negativo (VPN) del 91%, lo que significa que la colonoscopia podría haberse evitado en el 47% de los pacientes. Seis meses después de la cirugía, los niveles de FC menores de 51 µg/g en pacientes en remisión endoscópica predijeron el mantenimiento de la remisión (VPN, 79%). En pacientes con recurrencia endoscópica a los 6 meses, que optimizaron el tratamiento, los niveles de CF disminuyeron de 324 µg/g a los 6 meses a 180 µg/g a los 12 meses y 109 µg/g a los 18 meses. El valor predictivo calprotectina podría usarse para identificar a los pacientes con mayor probabilidad de recaída con más precisión que el nivel de PCR o el CDAI.479
Los estudios realizados para prevenir la recurrencia de la EC después de la cirugía demuestran en algunos estudios un beneficio limitado de los aminosalicilatos, y en otros estudios, resultado negativo. El meta-análisis de Camma C y col. reportó una reducción de la recaída estadísticamente significativa en el escenario de remisión inducida quirúrgicamente (-13,1%; IC95%: -21,8- -4,5).137 En el metaanálisis de Doherty G y col., la mesalazina se asoció con una reducción significativa del riesgo de recurrencia clínica (RR = 0,76; IC95%: 0,62-0,94; NNT = 12), y la recurrencia endoscópica grave (RR = 0,50; IC95%: 0,29-0,84; NNT = 8) cuando se compara con el placebo (Doherty y col., 2009).480 Debe ser notarse que el número reportado de pacientes a tratar para lograr un beneficio fue de 12, lo cual es modesto, y lo es también el de Ford AC y col. del 2011 (con un NNT de 10) en 834 pacientes, comparando mesalazina con placebo (RR = 0,80; IC del 95% = 0,70 a 0,92).481 La sulfasalazina no mostró ningún beneficio en la prevención de la recaída, en el mencionado metaanálisis en el que se estudiaron 448 pacientes.481
Los antibióticos del grupo imidazol han demostrado una moderada eficacia en la prevención temprana de la recurrencia endoscópica y en demorar la recurrencia clínica. Su uso a largo plazo no ha sido evaluado, en parte debido al riesgo de toxicidad. Un metaanálisis de dos ensayos clínicos aleatorizados controlados indican que los antibióticos del grupo imidazol, metronidazol y ornidazol reducen el riesgo de recaída endoscópica [(RR) 0,44; 95% CI, 26-0,74] y de recurrencia clínica (RR = 0,23; IC95%: 0,09-0,57) con respecto al placebo.482
En un primer estudio realizado en 60 pacientes, el metronidazol (20 mg/kg) a partir de la primera semana posterior a la resección ileal administrado durante 3 meses redujo estadísticamente las tasas de recurrencia clínica al año (4% frente al 25%, p = 0,044) y la recurrencia endoscópica severa a 12 meses (MTZ 56,3% vs. PBO 79% = 0,037), pero no fue significativo en la prevención de todas las lesiones, independientemente de la severidad (75% vs. 52%, p = 0,09).397 En un estudio posterior, de ornidazol, se redujo significativamente la tasa de recurrencia clínica (37,5% vs. placebo 7,9%, p = 0,046) en 80 pacientes a un año. El grupo tratado activamente también tenía una reducción significativa en la lesión endoscópica a los 12 meses (79% vs. 53,6%, 0,037).483 Sin embargo, significativamente más pacientes suspendieron el estudio por los efectos adversos. No ha sido evaluado si confieren un beneficio adicional sobre una tiopurina o agente anti-TNF solo. La budesonida no demostró beneficios en la prevención de la recaída postoperatoria, a 3 o 12 meses en un ensayo clínico, y en otro no se observaron tasas de prevención de recaída endoscópica y clínica significativas, pero sí tendencias positivas.484, 485
Con respecto a las tiopurinas, ya fue mencionado un metaanalisis de Peyrin Biroulet en el que se reportó que los pacientes tratados con análogos de las purinas con y sin inducción con antibióticos mostraron mayor eficacia que el placebo en la prevención de la recaída clínica postoperatoria que los controles a 1 año (diferencia 8%, IC95%: 1-15%; p = 0,021; NNT = 13) y a 2 años (diferencia = 13%, IC95%: 2-24%; p = 0,018; NNT = 8). La eficacia fue superior a la del placebo para la prevención de la recurrencia endoscópica severa (diferencia media 23%, IC95%: 9-37%; p = 0,0016; NNT = 4) según el score de Rutgeerst (i2-4), pero no en la muy severa (i3-4). Los tratamientos se asociaron con una mayor incidencia de eventos adversos que con placebo, conduciendo al abandono de 17,2% de los pacientes con tiopurinas vs. El 9,8% en controles, p = 0,021).246
Un estudio prospectivo observacional investigó en un estudio de 57 pacientes la probabilidad de mantenerse libre de recurrencia con azatioprina, reportando porcentajes de 57, 32 y 18% a 12, 36 y 60 meses respectivamente, concluyendo que reduce la recurrencia temprana, pero progresa en el tiempo.486
Hanahuer y col., en una comparación de 6MP, mesalazina y placebo en la prevención de recurrencia postoperatoria, reportaron que las tasas de recaída endoscópica fueron del 43% entre los tratados con 6 MP, 63% entre los tratados con mesalazina, y 64% entre los que recibieron placebo (p < 0,05 a favor de la mercaptopurina). Este estudio, sin embargo, tiene el problema de una alta tasa de abandono: se retiró (por el alto número de pastillas del diseño) el 69% de la población evaluable.487
En un ensayo aleatorio controlado realizado en 81 pacientes con EC, la combinación de metronidazol y azatioprina fue superior a la monoterapia con metronidazol en la prevención de la recurrencia postoperatoria endoscópica a 12 meses. Al mes 12, 7/22 pacientes permanecían sin lesiones en el grupo de tratamiento combinado vs. 1/29 metronidazol (p = 0,037).488 La recurrencia endoscópica mostró una disminución significativa a 12 meses: 43,7% con azatioprina combinada con metronidazol y 69,0% con metronidazol (p = 0,048). Mediante un análisis por intención de tratamiento la recurrencia endoscópica fue 55% con la combinación y 78% con monoterapia con metronidazol (p = 0,035).488
En un estudio prospectivo, aleatorizado, abierto, se comparó la azatioprina (2 mg/kg/día) con mesalazina (3 g/d) y el riesgo de recaída clínica a 2 años fue igual entre ambos grupos.489
Regueiro M y col., en un estudio de 24 pacientes, asignaron al azar infliximab (5 mg/kg) o placebo dentro de 4 semanas de la cirugía y continuaron cada 8 semanas durante 1 año. Los corticosteroides y antibióticos se suspendieron a las 12 semanas de la cirugía, y se permitió tratamiento concomitante con 5-ASA y azatioprina o 6-MP a dosis estable. La recurrencia endoscópica fue significativamente menor con infliximab (9,1%) comparado con placebo (84,6%, p = 0,0006), presentando lesiones más severas los tratados con placebo (grado 2: 30,8%; grado 3: 23,1%; grado 4: 30, 8%). Regueiro reporta que, entre los 12 pacientes con más de 1 año de seguimiento, los que recibieron infliximab luego de la recurrencia no experimentaron los mismos beneficios que los que lo habían recibido profilácticamente.490
Los pacientes del estudio antes mencionado randomizados a infliximab o placebo fueron seguidos por al menos 5 años después de la cirugía, en un estudio abierto, dándoles la opción de continuar, parar, o comenzar infliximab. En los pacientes asignados al grupo de infliximab en el primer año se demostró un mayor tiempo medio de sobrevida hasta la primera recurrencia endoscópica (1.231 ± 747 días) que en los pacientes originalmente asignados al grupo placebo (460 ± 121 días, p = 0,003). Se identificó recurrencia endoscópica en el 22,2% de los pacientes que recibieron infliximab a largo plazo y en el 93,9% de los no tratados con infliximab (p < 0,0001). La tasa de recurrencia quirúrgica (resección quirúrgica requerida adicionalmente) fue significativamente menor en los pacientes que recibieron infliximab durante casi todo el período de seguimiento que en los que lo recibieron durante períodos de tiempo más cortos (20,0% vs. 64,3%; p = 0,047). Los pacientes asignados originalmente al grupo de infliximab presentaron un tiempo significativamente mayor para la cirugía (1798 ± 359 días) que los pacientes originalmente asignados al grupo placebo (1058 ± 529 días, p = 0,04).491
La eficacia del adalimumab en la prevención de la recidiva posquirúrgica se comparó con tiopurinas y mesalazina en un ensayo que incluyó a 51 pacientes. A los 2 años de la cirugía la tasa de recurrencia endoscópica fue significativamente menor en los pacientes tratados con adalimumab (6,3%) en comparación con azatioprina (64,7%) y con mesalazina (83,3%). Se observó una proporción significativamente menor de pacientes con recidiva clínica en el grupo de adalimumab (12,5%) que con azatioprina (64,7%) y mesalazina (50%).492
Arnuzzi y col. compararon infliximab con azatioprina en un estudio abierto prospectivo aleatorizado con el objetivo de evaluar la incidencia de recurrencia endoscópica al año, que no difirió significativamente entre los 11 pacientes que recibieron infliximab y los 11 pacientes de azatioprina.493
El estudio de mayor seguimiento y número de pacientes con anti-TNF es el llamado POCER (Post Operative Crohn’s Endoscopic Recurrence) Los pacientes fueron asignados al azar en una relación 2:1 con dos tipos de seguimiento: 1) asistencia activa (endoscopía de la anastomosis a los 6 meses), o 2) asistencia estándar (no se realizaba evaluación endoscópica programada hasta los 18 meses en que finalizó el protocolo).494
El tratamiento farmacológico inicial se basó en el riesgo de recurrencia. Se definió como alto riesgo a la presencia de uno o más de los siguientes factores: tabaquismo activo (cualquier número de cigarrillos), enfermedad de perforante (absceso, fístula entérica o perforación libre), y previa resección intestinal. Los pacientes sin estos factores de riesgo fueron considerados de bajo riesgo. A todos los pacientes se les indicó metronidazol 400 mg dos veces al día durante 3 meses después de la operación. Si el metronidazol no se toleraba, se indicaban 200 mg dos veces al día, alternativamente una vez al día, o se suspendía la droga. A los pacientes con un alto riesgo de recurrencia se los trató con azatioprina 2 mg/kg por día o 6-MP 1,5 mg/kg por día desde el momento de la cirugía y durante 18 meses hasta terminar el estudio. Los pacientes con intolerancia a tiopurinas recibieron 160 mg adalimumab, 80 mg 2 semanas más tarde y 40 mg cada 2 semanas durante 18 meses. Los pacientes con recurrencia de los síntomas se retiraban del ensayo, calculándose el CDAI siempre que fuera posible y realizando una endoscopía no programada. A los pacientes que recibían prednisolona se les suspendió dentro de las 12 semanas de la cirugía. Las colonoscopías a los 6 meses del grupo de asistencia activa y a los 18 meses de todos los pacientes se evaluaron utilizando el score de Rutgeerts y adicionalmente CDEIS y el SES-CD. A los pacientes del grupo de asistencia activa, con bajo riesgo, en los que se detectó recurrencia endoscópica a los 6 meses, se les indicó una tiopurina, mientras que a los pacientes con alto riesgo que recibían una tiopurina se les intensificó el tratamiento agregando adicionalmente adalimumab (inducción seguida de 40 mg bisemanal).494 Se incluyó a 122 pacientes en el grupo de asistencia activa y 52 pacientes en la atención estándar, categorizando a cada grupo en alto riesgo y bajo riesgo. De los 122 pacientes con asistencia activa 47 (39%) intensificaron el tratamiento. A 18 meses, la recurrencia endoscópica fue significativamente menor (49% vs. 67%, p = 0,03) en pacientes asignados al grupo de asistencia activa versus la estándar. La remisión completa (con completa normalidad de la mucosa) se mantuvo en el 22% de 122 pacientes en el grupo de asistencia activa comparado con el 8% de 52 pacientes del grupo de asistencia estándar (p = 0,03). En el brazo de asistencia activa, 38% de 47 pacientes que tenían recurrencia a 6 meses e intensificaron el tratamiento lograron la remisión en los siguientes 12 meses. A la inversa, 41% de 75 pacientes que estaban en remisión a los 6 meses y no cambiaron la terapia desarrollaron recurrencia 12 meses después. El tabaquismo y la presencia de dos o más factores clínicos de riesgo, incluyendo tabaquismo, aumentaron el índice de recaída endoscópica (OR = 2.4; IC95%: 1,2-4,8: p = 0,02, y OR 2,8; IC95%: 1,01-7.7; p = 0,05 respectivamente).494 A la inversa, en el mismo lapso, se observó recurrencia en 41% de 75 pacientes que estaban en remisión a los 6 meses y no cambiaron la terapia. El tabaquismo y la presencia de dos o más factores clínicos de riesgo, como el tabaquismo, aumentaron el índice de recaída endoscópica. Los eventos adversos no se diferenciaron entre grupos. En conclusión, en este primer estudio se demostró que para la prevención de la recurrencia postoperatoria de la EC, una estrategia de tratamiento según el riesgo de recurrencia, realizando una colonoscopía temprana y tratando la recurrencia con un esquema step-up de incremento del tratamiento es significativamente mejor que la sola terapia con el fármaco óptimo sin incremento del tratamiento guiado por las lesiones. Los autores concluyeron que la supresión inmune selectiva, ajustada para una recurrencia temprana, en lugar de un uso rutinario, conduce al control de la enfermedad en la mayoría de los pacientes. Además, observaron que los factores de riesgo clínico predicen la recurrencia, pero los pacientes con bajo riesgo también necesitan supervisión, y la remisión temprana no excluye la necesidad de un monitoreo continuo.494 Por lo tanto, ante estos resultados los autores postulan la elección de pacientes en alto riesgo de recurrencia para la indicación de la terapia inmunosupresora en lugar de aplicarla en todos los casos. Los pacientes con al menos un factor de riesgo son aproximadamente el 80%, y por esto los autores sugieren que ello puede ser más aceptable para los pacientes que se sienten bien después de la cirugía, si son conscientes del riesgo de recurrencia. Los autores consideran que la terapia inmunomoduladora de rutina, en términos de posibles efectos secundarios, puede justificarse aplicada a los pacientes con alto riesgo de recurrencia.
En una publicación más reciente del estudio POCER se comparó la eficacia relativa de tiopurinas y la terapia anti-TNF en el subgrupo de pacientes de alto riesgo de recurrencia de la enfermedad. Evaluada con análisis “intención de tratamiento”, la recurrencia endoscópica (score de Rutgeerts i2-i4) ocurrió en 45% de 73 pacientes tratados con tiopurinas versus 21% de 28 pacientes tratados con adalimumab (p = 0,028). La normalidad completa endoscópica de la mucosa (Rutgeerts i0) se observó en 23% de 73 pacientes tratados con tiopurinas versus 54% de 28 tratados con adalimumab (p = 0,003). Se observó enfermedad severa (Rutgeerts i3 e i4) en un 8% de los tratados con tiopurina y 4% del grupo de adalimumab. Los autores concluyeron en base a estos datos que en pacientes con alto riesgo de recurrencia postoperatoria el adalimumab es superior a las tiopurinas para la prevención de una recurrencia temprana de la enfermedad.495
Una reciente publicación de GETECCU (Grupo Español de Trabajo en EC y CU) realizó las siguientes recomendaciones en relación a dos temas: 1) el seguimiento de la recaída posquirúrgica y 2) el tratamiento de la recurrencia posquirúrgica establecida.496
– Recomiendan realizar una ileocolonoscopía a los 6 meses de la cirugía como primera evaluación independientemente del tratamiento preventivo recibido. Aconsejan la realización simultánea de aquellas exploraciones (como referencia basal) que se hayan escogido como método o, siendo la CF la preferida (cada 4 o 6 meses). Alternativamente, realizan la ecografía transabdominal de manera anual, recordando que es operador dependiente. No consideran indicada una nueva ileocolonoscopía con valores CF inferior a 100 mcg/mg, dado el elevado valor predictivo negativo que ha demostrado en todos los estudios.
– Sugieren repetir la ileocolonoscopía en los siguientes casos a) aparición de síntomas digestivos junto con elevación de marcadores biológicos como la CF o la PCR; b) sospecha de recaída por ecografía, c) elevación progresiva de CF en al menos 2 o 3 determinaciones consecutivas. Cuando en la ileocolonoscopía se observaron lesiones leves-moderadas (i1-i2) y con cifras de CF > 100 mcg/mg, podría plantearse la realización de ileocolonoscopías periódicas, debido a que la CF no ha demostrado discriminar la gravedad de las lesiones recurrentes y que el riesgo de progresión de las lesiones mucosas persiste en el tiempo. Como alternativa a la ileocolonoscopía (no adherencia o no posibilidad técnica) indican enterorresonancia con la misma periodicidad y con los mismos criterios mencionados que para la ileocolonoscopía.
– Sugieren tratamiento concomitante con metronidazol, tiopurina o anti-TNF en caso de los siguientes factores de riesgo: fumadores, pacientes con resecciones previas, indicación de cirugía distinta de estenosis indubablemente fibrótica predominante y corta. Si esos factores están ausentes, aconsejan limitarlo a metronidazol 3 meses. Fundamentan esta conducta en el hecho de que el 25-50% de los pacientes que inician tratamiento preventivo con tiopurinas o agentes anti-TNF desarrollarán lesiones endoscópicas en los primeros 6-12 meses tras la cirugía, y por lo tanto en ellos el objetivo debe orientarse a la reversión o mejoría de las lesiones para evitar el desarrollo de síntomas. Esto implica que en una proporción notable de pacientes será necesario cambiar u optimizar el tratamiento al detectar la recaída endoscópica. Estos autores fundamentan sus recomendaciones mediante una síntesis de los resultados de la optimización en el estudio POCER a 12 meses. En el mismo el tratamiento con tiopurinas (en aquellos pacientes sin tratamiento preventivo previo), se consiguió remisión endoscópica en el 25% de los casos, con adalimumab (en pacientes en tratamiento preventivo previo con tiopurinas) en el 39% y la intensificación de adalimumab de quincenal a semanal en el 50%. Ello significa que la intensificación del tratamiento, según los hallazgos endoscópicos a los 6 meses, permite un mejor control de la enfermedad y constituye una estrategia costo-efectiva, ya que en el mencionado estudio los pacientes bajo tratamiento preventivo a los que se les intensificaba el tratamiento, según los hallazgos endoscópicos a los 6 meses de la cirugía, presentaron una tasa de recaída endocópica significativamente menor, y una proporción de pacientes con ileoscopía normal (i0) presentaron una significativamente mayor a los 18 meses, en comparación con el grupo de pacientes a los que no se había monitorizado ni se les había realizado ningún cambio en el tratamiento hasta el final del estudio.496
Datos procedentes de dos estudios prospectivos abiertos que han comparado distintos tratamientos para recaída posquirúrgica demuestran que los pacientes tratados con agentes anti-TNF obtienen porcentajes significativamente más elevados de mejoría en el índice de Rutgeerts (69-75%) o curación mucosa completa (38-54%) respecto de los pacientes tratados con mesalazina (0%) o azatioprina (38%), así como una menor tasa de recaída posquirúrgica.496 Consideran que en este sentido, el antecedente de múltiples resecciones intestinales o de resecciones amplias podría justificar la indicación de anti-TNF (en monoterapia o en terapia combinada) dado el mayor riesgo de síndrome de intestino corto si aconteciese la recaída. Igualmente, la edad avanzada o el antecedente de linfoma podrían considerarse indicaciones de anti-TNF en monoterapia para evitar el uso de tiopurinas.496
Se ha demostrado con el infliximab en los estudios de Regueiro y Sorrentino y con adlimumab en el estudio de Papamichael y en el POCER. Ello no se ha observado con mesalazina. Concluyen que los aminosalicilatos no están indicados en el tratamiento de la RPQ establecida.496 Estos autores opinan que en aquellos pacientes que presentan recaída endocópica sin tratamiento preventivo previo se recomienda iniciar tratamiento con tiopurinas y/o agentes anti-TNF cuando aparezcan lesiones i2b o superiores, con los mismos criterios comentados en el algoritmo. En aquellos pacientes bajo tratamiento preventivo con tiopurinas o agentes anti-TNF, el escalamiento terapéutico parece más razonable solo en casos de recidiva posquirúrgica endoscópica avanzada (i3-i4). Se requiere una monitorización estrecha para valorar la respuesta. Aunque no se dispone de datos al respecto, parece también recomendable insistir en el cese del hábito tabáquico en aquellos pacientes fumadores con recidiva posquirúrgica endoscópica.496
Nuevo índice validado de recurrencia posoperatoria (el índice POCER): De Cruz y col. investigaron el valor predictivo de hallazgos endoscópicos específicos individuales tempranos en el curso posterior de la enfermedad, en el contexto del tratamiento farmacológico optimizado, para desarrollar y validar prospectivamente un índice de severidad endoscópico postoperatorio aplicable en la práctica clínica y en los ensayos clínicos.
Resumiendo lo mencionado sobre el estudio POCER, a un grupo de pacientes con diagnóstico de EC con resección intestinal se les realizaron endoscopías a 6 y 18 meses. Los pacientes de alto riesgo recibían tiopurinas o adalimumab (si eran intolerantes a tiopurinas). Cuando en los pacientes se detectaba recurrencia endoscópica se seguía una estrategia de escalamiento secuencial: iniciando con tiopurinas (adalimumab ante intolerancia), optimizando con el agregado adalimumab quincenal y, si se requería, con adalimumab semanal.
En este índice se determinó la correlación entre el pronóstico (recurrencia endoscópica) evaluando 4 parámetros (profundidad de la ulceras, tamaño, número y extensión circunsferencial), encontrando significativamente asociados con la recurrencia endoscópica posterior a dos de ellos (úlceras anastomóticas profundas y extensión circunferencial (> 25%). Un análisis de regresión mostró que el nuevo índice POCER incluyendo estas dos variables endoscópicas tenía un valor predictivo independiente significativo (OR = 1,8; IC95%: 1,2-2,7; p < 0,01). Tuvo valor predictivo de la recurrencia a los 6 meses después de la cirugía, con 58% de sensibilidad y 82% de especificidad, y a los 18 meses correlacionó con el CDEIS, SES-CD y Rutgeerts score (p = 0,003, 0,003 y 0,001). Se concluyó que un score elevado que comprenda factores de pronóstico adversos (ulceración anastomótica extensa o profunda), puede ayudar a identificar pacientes que requieren terapia más intensiva.497
Interpretación del manejo de la prevención de la recaída postoperatoria en la EC (conciliando las controversias): más allá de los detalles, y de resultados que pueden depender de la heterogeidad de las diferentes casuísticas, hay que tener en cuenta que en situaciones clínicas donde es difícil reclutar un número relevante de pacientes, lo importante es conocer que los enfermos deben ser monitoreados endoscópicamente y que si hay evidencia endoscópica de recaída, hay que realizar escalamientos y optimización del tratamiento, porque la actividad endoscópica se asocia con la recaída clínica y ambos con las reoperaciones. Respecto de la elección del tratamiento entre las drogas modificadoras de la inmunidad en cada caso en particular, no hay unanimidad mundial en la literatura. El manejo por magnitud del riesgo es la tendencia general y ha demostrado beneficios. Varios detalles relacionados con aspectos puntuales de las definiciones, y los tiempos específicos a considerar, pueden ser personalizados, según factores individuales como comorbilidades, tolerancia a cada tratamiento respuesta previa a una determinada droga. No es lo mismo una respuesta inadecuada que un tratamiento recibido inadecuadamente. Así, no es lo mismo haber indicado un tratamiento que podría haber sido eficaz cuando el paciente ya tenía una lesión irreversible, que indicarlo cuando no tenía lesión. No hay duda de que cualquier factor que exponga al paciente a un intestino corto (como el antecedente de resección extensa, mayor aún en el contexto pronóstico conocido de una lesión de yeyunal extensa o ileocecal extensa, múltiples cirugías y enfermedad fistulizante), debe ser tratado agresivamente. El tabaco es un claro factor de riesgo. La calprotectina fecal es una herramienta de gran ayuda en el seguimiento.
◊ Resumen de recomendaciones relacionadas con la eficacia y seguridad de los anti-TNFs
– Cuando se alcanza la remisión con un anti-TNF, el mantenimiento es mejor que una estrategia episódica.
– Todos los agentes anti-TNF son más efectivos cuando se introducen en un estadio precoz (< 2 años desde el inicio).117, 127-131
– Si hay pérdida de respuesta se aconseja optimizar el anti-TNF que está recibiendo, antes de cambiar la droga. La respuesta es menor en los que ya experimentaron un anti-TNF que en los ñaïve de esta clase y otras clases de biológicos. Internacionalmente es posible medir los niveles séricos de la droga (que se asocian con la respuesta) y los anticuerpos que se asocian con la inmunogenicidad, bajando los niveles de anti-TNFs.
– El tratamiento combinado (infliximab más tiopurinas) demostró mayor eficacia que la monoterapia en varios estudios, o al menos mayores niveles de anti-TNF, lo que favorece la respuesta. El reciente estudio abierto REACT (Randomised Evaluation of an Algorithm for Crohn’s Treatment A cluster randomised controlled trial), en el cual se randomizó el tratamiento según centros médicos (en el contexto del escenario de práctica basada en la comunidad de Bélgica y Canadá) se comparó la eficacia de inmunosupresión combinada temprana (n 1084 pacientes en 21 centros) con la del tratamiento según manejo convencional del centro (898 pacientes en 18 centros) para el tratamiento de la EC, estudio en el cual si bien la proporción de pacientes en remisión fue similar a 12 y 24 meses, hubo diferencia en los parámetros llamados mayor evolución adversa (incluyendo cirugías, hospitalizaciones y serias complicaciones de la enfermedad), y no se demostraron diferencias en serios eventos adversos ni mortalidad.498 En este estudio el anti-TNF más usado fue el adalimumab, aunque en la literatura no hay evidencia de la superioridad de la combinación en el caso de este biológico.
– Más allá de estos resultados, volviendo a la práctica clínica, aunque el linfoma es infrecuente, en el caso de la combinación debe evaluarse riesgo beneficio en cada paciente individual dado que hay datos recientes que aconsejan ser cautos en pacientes jóvenes, en especial de sexo masculino, y considerar si es posible suspender la combinación a los 2 años con estricto control (por las descripciones de linfoma hepatoesplénico, aunque muy infrecuente), además se recomienda evaluar la serología para el virus Eipsten Baar, ya que de ser negativa, la presentación de una mononucleosis en hombres jóvenes podría desencadenar un linfoma posmononucleosis, en ese caso se sugiere el uso de metotrexato o anti-TNF en lugar de tiopurinas (3 en 1000). También se aconseja ser cuidadosos en los ancianos, considerando la historia de la enfermedad, en especial si el paciente ha estado en remisión más de 5 años. Sin embargo, debe tenerse presente que estadísticamente la actividad de la enfermedad genera complicaciones que son más frecuentes que los mencionados eventos adversos.
– Seguir cuidadosamente las recomendaciones internacionales y locales para detectar y prevenir las infecciones (checklist de estudios de laboratorio, imágenes, interrogatorio, examen físico, calendario de vacunaciones, etc.).
– Realizar un interrogatorio minucioso de posibles comorbilidades (insuficiencia cardíaca, cáncer, desmielinización, EPOC, etc.).
– La concepción moderna del tratamiento requiere investigar y tratar más allá de los síntomas, porque los pacientes con cicatrización de la mucosa tienen mejor pronóstico, como demostraron los diversos ensayos clínicos y estudios poblacionales en los grupos que lograron este objetivo, demostrando evolución favorable en cuanto a remisión, ahorro de corticoides, hospitalización o cirugías (SUTD, SONIC, ACCESS, ACT 1 y 2, IBSEN cohort),84, 85, 113, 130, 131, 323, 328, 350, 354, así como en la mira del treat to target, según se observó en el estudio EXTEND.138, 339
Una información reciente proviene de los resultados del estudio CALM, ensayo abierto, realizado en 244 adultos con EC moderada a severa naïve a IMM y biológicos, con presencia de úlceras en la endoscopía, randomizados a: 1) un enfoque de tratamiento a un objetivo (realizando estrecha monitorización donde los biomarcadores PCR sérica ≥ 5mg/dl y calprotectina ≥ 250 µg/g fueron usados como objetivo para escalamiento del tratamiento oportunamente, en adición a los criterios de falla de CDAI y uso de prednisona, versus 2) manejo mediante síntomas clínicos según CDAI y uso de prednisona después de la randomización y solo por el CDAI antes de la randomización. El criterio de falla determinada por CDAI varió según el grupo, siendo para el control estrecho ≥ 150, para el manejo clínico postrandomización el no descenso de al menos 100 puntos para un previo de ≥ 200 y para el grupo prerandomización la no disminución de 70 puntos comparado con un basal de ≥ 200 puntos. Las opciones de tratamiento fueron a) solo prednisona administrada 8 semanas previas en descenso y suspensión, b) escalamiento desde adalimumab dosis estándar con opciones secuenciales de optimización a semanal y agregado de tiopurinas.
Los pacientes que presentaban falla en el momento de la randomización (según el criterio de falla para el grupo resultante de la randomización) recibieron de entrada adalimumab, al igual que un grupo de activos que se randomizaron tempranamente (venían recibiendo corticoides 4 semanas, de las cuales 2 semanas eran a altas dosis antes del reclutamiento, o eran intolerantes). Los pacientes podían escalar en visitas 12, 24, y 35 según los mencionados criterios de falla clínica o los mencionados de laboratorio realizados en las semanas 11, 23 y 35, o ser rescatados en visitas no programadas. A 24 y 36 semanas se desescalaba el adalimumb semanal a quincenal.
Discontinuaron un 24% del grupo de manejo clínico y un 26% del grupo de control estrecho, la mayoría por efectos adversos. Los resultados a 48 semanas fueron significativamente superiores para el logro del objetivo primario (CDEIS < 4 sin úlceras profundas, aunque no un CDEIS 0) y remisión profunda, con porcentajes de 45,9% con la indicación de escalamiento con enfoque de tratar hacia un objetivo con control estrecho en comparación a 30,3% con el seguimiento guiado por los síntomas (diferencia del riesgo 1 de 6,1% (IC95%: 3,9-28,3; p = 0,010) Cochran–Mantel–Haenszel test-ajustado.
Estas enfermedades tienen frecuentemente un curso progresivo con posible discapacidad, complicaciones, hospitalizaciones y requerimiento quirúrgico.
Por ello deben tenerse en cuenta aspectos relevantes que influyen en la decisión terapéutica (Tabla 75) y principios básicos de manejo del tratamiento tradicional (Tabla 76).
Tabla 75. Resumen de los aspectos relevantes que influyen en las decisiones terapéuticas en EII.
Tabla 76. Principios generales para el manejo de los tratamientos tradicionales. Mesalazina, esteroides e inmunomoduladores.
Los biológicos son actualmente el tratamiento más eficaz disponible para los pacientes que no responden al tratamiento inicial y para aquellos que tienen factores de mal pronóstico. Sin embargo, en algunos pacientes con complicaciones se requiere la cirugía antes de que pueda instaurarse el tratamiento o a pesar del tratamiento. La estrategia terapéutica para un individuo debe ser una decisión conjunta entre el paciente, el médico y el cirujano.
◊ Conceptos relevantes: cuándo y por qué escalar el tratamiento en la EC
– Los conceptos son similares a la CU respecto de: 1) riesgo/beneficio del tratamiento, 2) necesidad de adherencia al tratamiento, optimización y controles, 3) utilidad de marcadores objetivos de lesión intestinal, más allá de los síntomas, incluyendo además los marcadores serológicos y fecales, 4) procurar una remisión sostenida libre de esteroides.
– Al igual que en la CU, luego de inducir remisión, si el paciente recae, los tratamientos se van escalando, para reinducir la remisión, ya sea intensificando la dosis o la frecuencia, cambiando o combinando los tratamientos, según la gravedad del cuadro, la rapidez de acción requerida, la eficacia y seguridad de los fármacos a elegir y las comorbilidades.
– Varían con respecto a la CU el tipo de factores predictivos y las modalidades de complicación de la enfermedad (lesiones perianales, estenosis, riesgo de intestino corto).
– Intentar cambiar el curso de la enfermedad es un desafío.
– La cirugía no cura la enfermedad, pero puede ser necesaria en el tratamiento de las complicaciones.
d. Decisiones relevantes en la colitis indeterminada y la EII no clasificable
El manejo de la colitis no clasificable debe seguir la misma estrategia que en la CU y debe considerar la actividad, localización y comportamiento de la enfermedad. El diagnóstico de colitis indeterminada, por definición, lo realiza el patólogo con los hallazgos de la pieza quirúrgica. En ese caso, la decisión de restaurar el tránsito o no hacerlo, y la eventual decisión de un pouch ileal con ileoanal anastomosis es un tema que debe ser consensuado en el equipo multidisciplinario y abordado en una larga conversación con el paciente. En un estudio reciente de la Clínica Cleveland, fueron matcheados pacientes a los que se les efectuó pouch ileal ya sea con colitis indeterminada o con CU (n 488) con seguimiento medio de 122,06 meses (+/- 80,77 meses), comparando los resultados a largo plazo entre ambos diagnósticos. Los autores reportaron que el número de deposiciones y la tasa de sepsis pélvica fueron similares entre las colitis indeterminadas y las CU, al igual que lo fueron globalmente los índices de calidad de vida (sin embargo, las restricciones sociales fueron 22% versus 14% respectivamente, que resultó en una significancia marginal p = 0,05). Los parámetros adversos significativamente mayores en la colitis indeterminada en comparación con las CU fueron la formación de fístulas y la presentación de una EC del pouch (15,6 vs. 8,0% p = 001, y 6,7% vs. 2,7% p = 0,04) respectivamente. Aunque las tasas de incontinencia no fueron diferentes, existió una tendencia a ser mayores en la colitis indeterminada (26,1% vs. 18,3%, p = 0,09). No hubo en este estudio diferencias en las tasas de fracaso de bolsa para IC y UC (5,8% vs. 4,9%, p = 0,58), pese a que en otras series es del 3,4 al 27% para la colitis indeterminada y entre 2 y 11% para la CU. Al respecto no se reporta si los pacientes con fístulas o Crohn del pouch recibieron un tratamiento diferente de los pacientes CU o la buena evolución luego de tales diagnósticos fue el resultado de la historia natural.500
e. Situaciones especiales: embarazo y lactancia
Embarazo
Diversos estudios investigaron tanto el efecto actividad de la EII sobre el embarazo, como el efecto del embarazo sobre el curso de la enfermedad, para optimizar el conocimiento y manejo de las posibles influencias mutuas.
Desde las primeras descripciones emergió el concepto según el cual el principal predictor del curso del embarazo es la actividad de la enfermedad en el momento de la concepción.
Un metaanálisis realizado muy tempranamente, en 1986, por Miller J. en Manchester (University Hospital of South Manchester) que incluyó 1308 pacientes con CU y 748 con EC objetivó embarazos con una buena chance de tener un bebé normal similar a una persona sin EII en el 83% de las mujeres con EC y en el 85% de pacientes con CU. Los pacientes se categorizaron por la actividad al momento de la concepción en: a) enfermedad inactiva, b) enfermedad activa, c) enfermedad que debuta durante el embarazo y d) enfermedad que debuta luego del puerperio. En las dos últimas categorías (b, c) por la escasa muestra, no se pudieron generalizar los hallazgos. Pese a los resultados globales, en el subgrupo de pacientes con CU activa al momento de la concepción, se describió que aproximadamente el 45% de los casos empeora, mientras que alrededor de un cuarto mejora y otro cuarto se mantiene sin cambios. Además fue reportado que el mencionado grupo de pacientes con enfermedad activa puede tener más probabilidades de aborto espontáneo o parto prematuro que el grupo inactivo al momento de la concepción. Los resultados en la EC, resultantes de nueve series principales, describieron que si bien las posibilidades generales de tener un bebé normal son similares a las de la población general, la coexistencia de actividad severa puede conducir a un aumento en el riesgo de aborto espontáneo, muerte fetal o parto prematuro. En ambas enfermedades se observó un alto índice de interrupciones del embarazo por motivos personales.501
Un estudio de Mahadevan y col. realizado en el norte de California entre 1985 y 2002 incluyó a un total de 461 embarazadas con EII matcheadas con 493 embarazadas sin EII, reportando que las pacientes con EII tuvieron mayor probabilidad de presentar una evolución adversa con respecto a controles sin EII, aunque estas alteraciones podrían estar relacionadas con la actividad de la enfermedad. La evolución adversa consistió en abortos espontáneos: OR = 1,65 (IC95%:1,09-2,48), prematurez, bajo peso y fetos muertos: OR = 1,54 (IC95%:1-2,38) y complicaciones del parto: OR = 1,78 (IC95%:1,13-2,81), siendo los predictores la EC, una historia de cirugía en EII y etnicidad no caucásica. En este estudio no se observó un aumento de anomalías congénitas u otra evolución adversa diferente de las antes mencionadas en los recién nacidos (OR = 1,89; IC95%: 0,98-3,69).502
Otro metaanálisis realizado por Cornish J y col., que incluyó 12 estudios con un total 3907 pacientes con EII (EC 63%, CU 36%), y 320.531 controles, también reportó una mayor prevalencia de resultados adversos durante el embarazo, incluido un mayor riesgo de prematurez (< 37 semanas de gestación), bajo peso al nacer (< 2500 g), anomalías congénitas y parto por cesárea en mujeres con EII, en comparación con la población general.503
Un aporte sumamente relevante con respecto al manejo del embarazo fue el resultante de un consenso de expertos en Toronto en el año 2015, que en base a la bibliografía disponible y usando la metodología GRADE, elaboraron 29 recomendaciones (Toronto Consensus Statements for the Management of Inflammatory Bowel Disease in Pregnancy) que abarcan aspectos mucho más amplios que el tratamiento farmacológico.504
Para elaborar recomendaciones respecto del efecto de la enfermedad sobre el embarazo, este consenso analizó los diversos metaanálisis y varios estudios observacionales y de cohortes más recientes, que respaldan que la EII se asocia con un mayor riesgo de resultados adversos del embarazo en lo que se refiere a prematurez, bajo peso al nacer, fetos pequeños en relación con la edad gestacional, requerimiento de cesáreas, abortos espontáneos y muerte neonatal.504 Las evidencias apoyan que los eventos adversos se incrementan con la enfermedad activa.502, 504, 505
Respecto del efecto del embarazo sobre la actividad de la enfermedad, la experiencia clínica corrobora las primeras observaciones de Khosla y col. y Mogadan y col. con respecto a que las pacientes con enfermedad activa en la concepción a menudo continúan teniendo síntomas durante el embarazo y posparto, mientras que pacientes que conciben cuando están en remisión tienen una mayor probabilidad de permanecer con un curso quiescente de su EII.503-510
En un estudio de una cohorte europea con un período de seguimiento de 10 años, se observó que cuando la concepción se produjo durante la remisión, las tasas fueron comparables a las de las pacientes con EII no embarazadas, mientras que dos tercios de las pacientes recayeron, e incluso entre ellas, dos tercios se agravaron más cuando la concepción ocurrió durante un período de enfermedad activa.510
Por todo ello, se recomienda aconsejar a las pacientes concebir cuando la enfermedad está en remisión, lo cual impacta tanto en la evolución de la enfermedad de la madre como en el curso del embarazo y en las condiciones del neonato.505, 511
Pero más allá de este concepto que involucra a las EII globalmente, los informes de estudios más recientes, sugieren que en la probabilidad de que el embarazo sea factor de reactivación habría una diferencia entre la CU y la EC.505, 512 Un estudio prospectivo de Pedersen y col. en el contexto del estudio ECCO-EpiCom observó que las tasas de recaída durante el embarazo y puerperio, en mujeres embarazadas con EC que concibieron mientras su enfermedad estaba en remisión, fueron similares a las de pacientes controles no embarazadas con EC seguidas durante 15 meses desde el enrolamiento. Cuando se analizaron los datos de las tasas de recaídas durante el embarazo en mujeres con EC que concibieron cuando su enfermedad estaba activa, se observó que fueron mayores que en pacientes con EC no embarazadas (56% vs. 33% respectivamente).512 Los resultados del estudio no evidenciaron el mismo patrón en las pacientes con CU embarazadas, quienes demostraron un mayor riesgo de reactivarse durante el embarazo (RR = 2,19; IC95%: 1,25-3,97; p = 0,004) y en el período posparto (RR = 6,22; IC95%: 2,05-79,3; p = 0,0004) en comparación con las pacientes controles con CU no embarazadas, y ello ocurrió aunque las pacientes con este diagnóstico hubieran concebido mientras la enfermedad estaba en remisión (cociente de riesgo = 2,74; IC95%: 1,61-4,65).512 Las reactivaciones fueron más frecuentes en los primeros 6 meses del embarazo (mayor en el primer trimestre) y en los primeros 3 meses del período posparto.512 Sin embargo, si se comparan las dos enfermedades, entre las mujeres en remisión en la concepción, el riesgo observado de exacerbación de la enfermedad en el curso del embarazo es del 20% en la EC y del 33% en la CU.505
Es interesante, aparte de lo mencionado, que en este estudio, el Crohn de colon mostró en el posparto una tendencia a comportarse como la CU, aunque ello no ha sido referido por otros autores.512
Las recomendaciones del Consenso de Toronto, más allá de lo puramente relacionado con el tratamiento farmacológico, incluyen: a) administrar consejos previos a la concepción a toda mujer en edad reproductiva, b) evaluar la enfermedad objetivamente antes de la concepción para optimizar el manejo, c) en caso de enfermedad activa consultar a un obstetra, preferentemente dentro de un programa de alto riesgo, con control simultáneo por un gastroenterólogo, d) en caso de hospitalización de una embarazada, se aconseja también el manejo multidisciplinario.504
En coincidencia con las recomendaciones del Consenso de Toronto, un estudio danés de Julsgaard M y col. reportó una mayor adherencia entre las mujeres con CU que fueron aconsejadas previamente y durante el embarazo respecto del tratamiento médico a seguir. En este caso hubo un factor condicionante de una diferencia en esta enfermedad en las tasas de recaídas (40,3%) asociadas con la no adherencia al tratamiento, en comparación con los 6 meses previos al embarazo (13,6%), en coincidencia con el informe de Pedersen.513 La causa más frecuente de no adherencia al tratamiento es el miedo al efecto del tratamiento sobre el feto, por lo que la educación previa a la concepción es muy importante en las pacientes que por la edad tienen posibilidad de embarazarse.505
La interrupción de la terapia de mantenimiento, particularmente en el primer trimestre del embarazo, lleva comúnmente a exacerbaciones de la enfermedad, y la actividad de la enfermedad periparto puede tener un impacto negativo en el embarazo.
Hace ya casi una década que, también en un consenso, se definieron que los beneficios de la terapéutica según adecuados algoritmos las diferentes drogas, superan los riesgos de la medicación (Dignass y col., 2010). Es una excepción el metotrexato, y obviamente la talidomida está también absolutamente contraindicada.139
Otras declaraciones del Consenso de Toronto se refieren a los métodos para procedimientos diagnósticos o de evaluación de la actividad de la EII, recomendando el uso de sigmoidoscopía flexible o colonoscopía, cuando la falta de evaluación de la paciente afecte el manejo inmediato de la EII durante el embarazo, y el curso prenatal de la EII. La tasa global de aborto espontáneo se reportó menor en la EII que en los controles (4,8% vs. 23,8%; p = 0,01). Con respecto a la sedación, las pautas sugieren que la meperidina y el fentanilo parecen ser seguros en humanos durante el embarazo. En general se recomienda evitar las benzodiazepinas, particularmente en el primer trimestre. Sin embargo, si la sedación con meperidina o fentanilo es inadecuada, se prefiere el midazolam sobre otras benzodiazepinas. Siempre que sea posible, se prefiere la sigmoidoscopía flexible sobre la colonoscopía, pero esta se justifica en situación de un nuevo diagnóstico que lleve aparejado sangrado rectal, anemia o crecimiento fetal deficiente. En mujeres con EII que requieren sedación debe usarse la dosis efectiva más baja y evaluar en contexto multidisciplinario el monitoreo fetal antes y después del procedimiento.
Los procedimientos radiológicos con fines diagnósticos o de evaluación deberían si es posible al uso de la ecografía (en general no posterior 28-30 semanas por la interposición del feto en la visión del intestino) y la resonancia magnética sin contraste cuando sea posible. Sin embargo, se discuten otros aspectos como el campo magnético estático, el calentamiento de los tejidos por la radiofrecuencia y el ruido. Por efectos adversos solo observados en animales se discute el gadolinio y se prefieren protocolos que lo excluyan, en especial en el primer trimestre, versus en todo el curso del embarazo.
En términos prácticos, la TC es probablemente aceptable si se considera necesario, porque la realización de un solo procedimiento está muy por debajo (la mitad) de la dosis acumulativa que potencialmente puede afectar al feto.
Varios reportes de cohortes han informado que la cirugía de una CU complicada no presenta un mayor riesgo de morbilidad o mortalidad fetal o materna, por lo que, si está indicada, no debe retrasarse por el embarazo, ya que los riesgos de la actividad de la enfermedad deben compararse contra los riesgos de la cirugía, y son esperables consecuencias mayores por la demora de la cirugía que por la misma cirugía, aunque los casos reportados son escasos. Cuando sea posible, la cirugía urgente debe realizarse en un centro con neonatología, pediatría, obstetricia, con enfoque multidisciplinario.
Se informó una mayor incidencia de parto por cesárea y bajo peso al nacer en recién nacidos de mujeres con EC que se sometieron a cirugía para lesiones perianales, y por resección intestinal, lo que probablemente se explica por una enfermedad más grave. Los riesgos fueron más del doble para cesárea electiva y aproximadamente 1,5 veces para emergencias. Algunos estudios de cohorte han informado que no hay diferencia en las tasas de brotes de la enfermedad luminal o perianal sintomática después del parto según si fue por cesárea o vaginal.
Algunos estudios han informado el desarrollo de una nueva enfermedad perianal o un empeoramiento en mujeres EII con enfermedad perianal activa después de parto vaginal y las que están en alto riesgo de parto por cesárea, en comparación con la población general.
Algunos informes tradicionales han publicado que la enfermedad sintomática perianal o luminal se agrava después del parto según si el parto fue realizado por cesárea o vaginal. Otros estudios han informado el desarrollo de una nueva enfermedad perianal o empeoramiento en mujeres con enfermedad perianal activa después de un parto vaginal. Sin embargo, según las guías de práctica clínica 2016 para la EII en el embarazo, varias series de casos han sugerido que la cesárea no es protectora de episodios de actividad en mujeres con una historia de enfermedad perianal.504 Hay controversias entre la tasa de incontinencia y el parto por vía vaginal, porque los efectos podrían verse posteriormente en relación con la edad.504
Es poco probable que el parto vaginal ocasione la exacerbación de la enfermedad durante el período posparto en mujeres con CD perianal inactivo, y debe surgir del manejo multidisciplinario. Con enfermedad perianal activa se requiere contemplar una cesárea, según la longitud perineal y el trauma previo en el área.504
Respecto del impacto de un pouch ileal con anastomosis ileoanal, en la elección de la vía del parto, el grupo de consenso concluyó que dada la fisiología evidencia de deterioro de la calidad del esfínter y la falta de datos de seguimiento a largo plazo, puede ser prudente considerar el parto por cesárea en mujeres con IPAA, incluso si la indicación es débil, y que sea preferentemente realizada como cirugía electiva.508
Sin embargo, la enfermedad perianal activa, independiente de la presencia de EC, se ha asociado con un aumento de más de 10 veces del riesgo de laceración de 4º grado. Por ello, el grupo de consenso recomendó la cesárea en este patrón clínico de pacientes para reducir el riesgo de lesión perianal.504
Para mujeres embarazadas con EII que han sido sometidas a una cesárea, el consenso recomendó tromboprofilaxis anticoagulante durante la hospitalización.504
¿Cuál es la probabilidad de que el niño herede la EII?: un tema de frecuente consulta en un consultorio de EII es el temor de que el niño desarrolle una EII.
Los niños nacidos de padres con EC o CU están genéticamente predispuestos a desarrollar EII. Alrededor del 5,5-22,5% de los pacientes con EII tienen otro miembro de la familia también afectado por la enfermedad. El riesgo es mayor para la EC y cuando ambos padres están afectados (con ambos padres 33-36% de probabilidades de desarrollar EII). Los niños con un padre afectado por EII tienen un riesgo 2 a 13 veces mayor de desarrollar EII en su vida, en comparación con la población general, lo que se traduce en una probabilidad de 5,2 y 1,6% de desarrollar EII en la descendencia de un individuo con EC y CU respectivamente.508 El riesgo aumenta significativamente si la madre (más que el padre) es la afectada para una descendencia femenina. La transmisión de la EC de la madre afectada a su hija implica un patrón específico de herencia sexual femenina en EC, que no se pudo demostrar para la CU, para los padres afectados o para la descendencia masculina afectada. Los pacientes con EII y antecedentes familiares tienden a presentar la enfermedad a una edad más temprana, y muestran un aumento de concordancia en el tipo de enfermedad (EC o CU) y probablemente en la localización de la enfermedad, pero no en la gravedad.508
Manejo de la medicación en el embarazo y lactancia
Durante muchos años, la literatura se refería a una clasificación de las drogas en categorías realizada por la FDA. La clasificación que tradicionalmente se usó abarca desde la A a la C, y las contraindicadas se reconocían como X. Esta categorización, que constaba en los prospectos de los medicamentos de EE. UU., fue abandonada por haberse evaluado que su utilidad era limitada, y se remplazó por una descripción de la información disponible detallada en subsecciones sobre los potenciales riesgos y beneficios para la madre, el feto y el bebé en la lactancia.505
Hemos sumarizado los principales datos de eficacia y seguridad de las drogas usadas en el embarazo y lactancia, en una tabla (Tabla 77).
Tabla 77. Sumario de seguridad de las drogas usadas en el embarazo y lactancia.
Las principales drogas a considerar son
1) Mesalazina y sulfasalazina: en términos generales, el uso de ambas drogas durante el embarazo es seguro. Una de los mesalazinas (Asacol) con un sistema de liberación que contiene ftalato de dibutilo ha sido recientemente degradado desde la categoría B de la FDA a la C, porque se ha dosado en concentraciones elevadas, y en estudios con animales se observó riesgo de malformaciones en el tracto urogenital masculino (no en humanos), pero la exposición está posiblemente asociada con la pubertad precoz en humanos. Por ello si la paciente recibe la mencionada formulación, se aconseja cambiar de mesalazina ante la posibilidad de concebir.504, 505
Dado que el tratamiento con sulfasalazina interfiere con la absorción de folatos, se recomienda suplementar con folatos (aproximadamente 2 mg/día), 3 meses antes de la concepción.139 ,504, 505, 508, 509, 511
Lactancia: el metabolito de sulfasalazina sulfapiridina es secretado en la leche materna en mínimas cantidades y el radio leche/suero es aceptable. Los aminosalicilatos generalmente se consideran seguros durante la lactancia, aunque ha sido reportado un caso de diarrea con sangre en un infante (al respecto suponemos una reacción alérgica).505, 509
2) Corticosteroides: se pueden usar durante el embarazo, y más allá de reportes controvertidos de complicaciones de baja frecuencia, debe considerarse que la actividad es un factor deletéreo para el feto, por lo que deben usarse racional y convencionalmente. La FDA les había adjudicado la categoría C. Si bien se reportó que el tratamiento sistémico con corticosteroides durante el primer trimestre del embarazo podría aumentar la incidencia de fisura palatina y labio leporino (desde 1 a 3,3 por 1000 nacidos vivos, según estudios), la posible incidencia es muy baja y controvertida porque no fue observada en otros estudios, incluyendo uno que incluye 51.973 pacientes.504, 508, 509, 514 No hay un aumento global del número de anomalías congénitas.509 Se reportaron casos aislados de supresión adrenal usados al fin del embarazo.504 Si bien el riesgo de hipertensión, diabetes y preeclampsia podría aumentar durante el embarazo, pudiendo ser potenciados por los corticoides, esto no está bien establecido.508 La actividad de la enfermedad es reconocido que puede impactar sobre el bebé, considerando cada caso individual. A pesar de que los corticoides pueden atravesar la placenta, son rápidamente convertidos por la 11-hidroxigenasa placentaria a metabolitos menos activos, con baja concentración en la sangre fetal, prefiriéndose los de acción corta (prednisona y derivados) a los de vida media más prolongada (dexametasona y betametasona).504 Respecto de la budesonida oral, hay un reporte de 8 pacientes con EC tratados con budesonida en los que no se observaron efectos adversos.508, 509, 515
Lactancia: el tratamiento con corticosteroides es compatible con la lactancia materna. Menos del 0,1% de la dosis materna de prednisolona se secreta en leche, que corresponde a menos del 10% del nivel de cortisol endógeno infantil. Para mayor precaución podría realizarse la lactancia con una demora de 4 horas después de la ingesta.504-505
3) Tiopurinas: la azatioprina y la mercaptopurina son drogas que habían sido categorizadas como tipo D por la FDA para pacientes embarazadas, por lo que son los fármacos que mayor controversia generaron en el tratamiento de la EII. En una cohorte del registro CESAME se documentaron 215 mujeres embarazadas con EII entre el año 2004 y 2007. Se compararon tres grupos: uno de ellos (86 pacientes) en tratamiento con solo tiopurinas o asociada a otros fármacos como aminosalicilatos, corticoides, etc., otro grupo (84 pacientes) tratados con otra droga distinta de los inmunomoduladores, y el tercer grupo (45 pacientes) sin tratamiento. Las tiopurinas no se asociaron a mayor riesgo de malformaciones congénitas. La mayor prevalencia de prematurez y bajo peso al nacer no fue significativa y podría relacionarse con la actividad de la enfermedad de base.139, 516
Pese a que el tema fue controvertido, estudios controlados más recientes y un metaanálisis informaron que no aumenta el riesgo de eventos adversos del embarazo con tiopurinas, en comparación con pacientes con EII embarazadas sin este tratamiento.504, 505, 508, 509, 517 En un metaanálisis reciente, se reportó una asociación con parto prematuro, pero no con malformaciones congénitas, y se observó bajo peso al nacer.518 Pese a casos reportados de anomalías inmunológicas, hematológicas y aberraciones cromosómicas, un estudio prospectivo de niños expuestos a tiopurinas en el útero no reveló anormalidades en el desarrollo o inmunológicas en estos niños durante una mediana de seguimiento de 3,8 años.508, 519, 520 Hay que considerar también como causa de estas controversias la implicancia potencial de la causa de la indicación de las tiopurinas, se relacione con madres con mayor actividad de la enfermedad.
La clasificación de las tiopurinas como categoría D de la ya perimida clasificación de la FDA surgió originalmente por efectos teratogénicos de la azatioprina que en el año 1960 se observaron en ratones y conejos después de la administración intraperitoneal a altas dosis, relacionado con su uso como agente citostático.507, 509 Aunque en animales se observaron también con administración oral, en el embarazo humano, reportes numerosos de series de casos, estudios de cohortes y la experiencia clínica, principalmente en receptores de trasplantes y pacientes de EII, no revelaron una mayor incidencia de anomalías congénitas, por lo que actualmente casi 9 de cada 10 expertos continúan la azatioprina durante el embarazo.509
Un análisis intermedio del estudio prospectivo en curso PIANO (Pregnancy in IBD Neonatal Outcomes) confirmó que el uso de tiopurinas no conduce a resultados fetales adversos. Los investigadores De Meij TG, Jharap B, y sus colegas recientemente realizaron un estudio prospectivo que examina el efecto del embarazo sobre el metabolismo de las tiopurinas y el efecto del uso de tiopurinas en fetos expuestos, demostrando Apgar normal y no aumento de anomalías congénitas; sin embargo, el 60% de los recién nacidos tenía anemia, por lo que sí se aconseja realizar hemograma de control inmediato posnatal.521
El conjunto de la evidencia sugiere que las tiopurinas se pueden usar durante el embarazo, considerando que la actividad de la enfermedad en pacientes que necesitan inmunosupresores es más perjudicial que el perfil de efectos colaterales de estos agentes además, algunos estudios pueden confundir los efectos adversos de la droga con la enfermedad de la madre.139
Lactancia: Christensen y col. demostraron que hay bajos niveles de mercaptopurina en la leche materna, por lo que el tratamiento con azatioprina parece seguro. Como la mayoría de los metabolitos de la tiopurina se excretan en la leche en las primeras 4 h después de la ingesta, se recomienda reducir la exposición del bebé con un intervalo de tiempo de 4 horas entre ingesta de tiopurina y lactancia, o descartando la primera porción de la leche.522
4) Metotrexato: está contraindicado durante el embarazo. Deben usarse métodos de barrera para prevenir el embarazo durante la terapia con metotrexato. Aunque se describieron embarazos normales, la exposición, particularmente durante el primer trimestre, puede provocar aborto, retraso del crecimiento, pérdida fetal y malformaciones congénitas (craneofaciales, en las extremidades y del SNC). Si la concepción se produce accidentalmente, debe discutirse el aborto, aunque no necesariamente. Los metabolitos intracelulares, poliglutamatos de metotrexato, tienen una larga vida media, y el lavado requiere cerca de 6 semanas. Ante el planeamiento de embarazo debe suspenderse y comenzar a tomar dosis altas de folatos. Para evitar la exposición a metotrexato, debe suspenderse el tratamiento en mujeres y hombres, al menos durante 3-6 meses antes de intentar concebir.139, 504, 505
Lactancia: no se aconseja, debido a la presencia de niveles bajos pero detectables en le leche, y podrían acumularse en tejidos neonatales.
5) Talidomida: la contraindicación es absoluta. Su uso se ha asociado con mayores malformaciones en fetos, que involucran extremidades, oídos, ojos y defectos del tubo neural, y con una tasa de mortalidad neonatal del 40%. No hay datos sobre el período de lavado recomendado antes de la concepción para la talidomida.504, 509
6) Derivados de la ciclofilina
– Ciclosporina: no existe evidencia de efectos teratogénicos de la misma, según experiencia en transplantadas, aunque tiende a decrecer el peso al nacer. Se ha usado en la colitis severa como rescate, siendo efectiva y no presentando problemas de seguridad en reportes de baja muestra.505 Sin embargo, deben tenerse en cuenta los efectos descriptos de la droga en transplantados, hipertensión, diabetes, pre-eclampsia, bajo peso en el recién nacido. Cruza rápido la placenta pero es rápidamente aclarada en el feto. Se catalogó por la FDA como C porque no hay estudios controlados en humanos.505
Lactancia: debido a su eliminación a través de la leche materna, la ciclosporina está contraindicada durante la lactancia, por el riesgo de nefrotoxicidad.139, 504, 509
– Tacrolimus: hubo un solo informe de uso en embarazo, con informe de bajo peso y prematuridad, insuficiente para sacar conclusiones.
Lactancia: no hay suficiente evidencia con estas drogas.
7) Anti-TNF: el infliximab es un anticuerpo quimérico murino/inmunoglobulina humana (Ig) G1, y como tal, cruza la placenta, lo cual ocurre en el tercer trimestre. Por esta razón, este medicamento no interfiere con la organogénesis, la que se produce en el primer trimestre de embarazo. El adalimumab y golimumab son anticuerpos anti-TNF IgG1 completamente humanos, y, también cruzan la placenta después de 20 semanas de gestación. Diferente a los otros 3 agentes anti-TNF mencionados, el certolizumab pegol es un fragmento Fab’ de anticuerpo monoclonal humanizado, unido a polietilenglicol. No contiene la porción Fc del anticuerpo y no cruza la placenta.509
Hace ya más de una década se publicaron reportes donde no se observó un aumento significativo en la incidencia de nacidos muertos, embarazos ectópicos, abortos espontáneos ni bajo peso al nacer. Katz y col. describieron 96 embarazadas expuestas al IFX.522 Mahadevan y col. publicaron el primer reporte de infliximab intencional en el embarazo, siendo identificadas 10 mujeres, de las cuales 8 recibieron infusiones de mantenimiento con infliximab durante todo el embarazo y 2 iniciaron el infliximab durante el embarazo. Los 10 embarazos terminaron en nacimientos vivos. Ningún infante tenía malformaciones congénitas, retraso del crecimiento intrauterino ni eran pequeños para la edad gestacional. Tres bebés fueron prematuros y uno tenía bajo peso al nacer. Ocho mujeres tuvieron una cesárea.523
Similares datos fueron aportados por el registro TREAT, ya mencionado en esta publicación, que describió 36 pacientes embarazadas en tratamiento con IFX. Con los datos del mencionado registro, en el que se realizó una comparación entre pacientes tratadas con IFX y pacientes sin terapia biológica, no se lograron detectar malformaciones congénitas; el índice de abortos (11,1 vs. 7,1%) y las complicaciones perinatales (8,3 vs. 7,1%) fueron comparables en los dos respectivos grupos.209
Con respecto al adalimumab, que tiene una tasa de transferencia placentaria similar al infliximab, en un estudio prospectivo de 38 pacientes embarazadas en tratamiento con adalimumab, se observó que el índice de abortos espontáneos (5 de 38: 13%), feto muerto (0 de 38), prematurez y malformaciones congénitas (2 de 33: 6%) fue similar a la de las pacientes – control y a la población general.524
La bibliografía reciente ratifica que los mismos pueden usarse de forma segura en el período de la concepción y durante los dos primeros trimestres del embarazo, consensuándose la conducta del período (tercer trimestre) de mayor transferencia placentaria de los que incluyen IgG1.139, 504, 505, 508, 509, 511, 525
Al respecto debe entenderse la importancia de mantener la enfermedad en remisión en mujeres embarazadas con EII, ya que distinto a acarrear complicaciones, el uso de tiopurinas o agentes anti-TNF se asocian con menos complicaciones neonatales.526 Resultados similares se demostraron en el análisis del registro PIANO, en el que los niños nacidos de madres que fueron tratadas con monoterapia con adalimumab o certolizumab pegol no tuvieron mayor riesgo de anomalías congénitas, retraso en el crecimiento, problemas de desarrollo o infecciones.525 Sin embargo, el riesgo de infección se ha descripto mayor en hijos de madres tratadas con combinación de anti-TNF y tiopurinas, observándose a 9 y 12 meses en este subgrupo de pacientes, que se observarán durante 4 años.505, 525 Con base en los estudios en sangre materna y niveles en el cordón umbilical, se discute el momento en que debería suspenderse la terapia durante el embarazo. En un estudio de cuatro pacientes, se dosaron los niveles de IFX en el cordón umbilical y en la sangre materna en el momento del parto. Estas pacientes recibieron IFX hasta las semanas 21 y 30 de gestación. Tres neonatos, incluyendo dos que recibieron el IFX hasta las semanas 26 y otro en la semana 30, tenían niveles de IFX en el cordón umbilical 2-3 veces superiores al nivel en la sangre de las madres. Debido a estos niveles surgió la preocupación de que ocasionaran defectos en el desarrollo del sistema inmune. Los niños no tuvieron aumento de infecciones ni alteración a la respuesta a las vacunas. En la paciente que fue medicada hasta la semana 21 no se detectó IFX en el cordón umbilical.527 Mahadevan y col. detectaron concentraciones de infliximab y adalimumab mayores en los bebés y en el cordón umbilical que en sus madres (160% y 153% mayor que el de la madre para infliximab y adalimumab) y podían detectarse en los bebés hasta por 6 meses. No se informaron anomalías congénitas o complicaciones graves.528
No hay una conducta unánime respecto de cuándo suspender los anti-TNF para minimizar la transferencia de estos medicamentos a través de la placenta y al mismo tiempo lograr mantener la remisión. Algunos especialistas suspenden el infliximab, adalimumab y golimumab en la semana 20 de gestación. Otros centros administran la última dosis entre 6 y 8 semanas antes la fecha estimada de parto, o bien alrededor de la semana 24-26 de gestación.509 El segundo consenso ECCO de reproducción y embarazo sugiere suspender el tratamiento en las semanas 22 a 24 para minimizar los riesgos de transferencia transplacentaria y cualquier efecto hipotético a largo plazo en el recién nacido.508 Existen grandes controversias al respecto.
Contrariamente a las conductas mencionadas, el Consenso de Toronto hizo una fuerte recomendación a favor de la continuación de la terapia anti-TNF, porque llegaron a la conclusión de que no hay pruebas sólidas para apoyar la necesidad de una interrupción temprana de la terapia anti-TNF. Ellos encuentran poca evidencia de un mayor riesgo de infección o retraso en el desarrollo (al menos a corto plazo) con la terapia continuada con anti-TNF. Además de esta falta de evidencia de que la terapia continua anti-TNF durante el embarazo tenga un impacto negativo en el embarazo o los resultados en el recién nacido, la suspensión del tratamiento puede asociarse con un riesgo de recaída durante el embarazo y el período posparto y los bajos niveles resultantes pueden afectar el desarrollo de anticuerpos antidroga y la consiguiente pérdida de respuesta a la terapia. Ellos opinan que si se prefiere, debido a inquietudes teóricas o una fuerte preferencia del paciente, esta estrategia de interrupción temprana con el fin de minimizar la exposición fetal (recomendación condicional) solo debe considerarse en circunstancias especiales en las que un paciente tiene un bajo riesgo de recaída (remisión durante los 12 meses previos a la concepción, ausencia de enfermedad activa en la endoscopía o imágenes durante el período previo a la concepción, ausencia de pérdida secundaria de respuesta a la terapia anti-TNF o aumento de la dosis, niveles terapéuticos demostrados de terapia anti-TNF, no antecedente de resecciones intestinales ni de hospitalizaciones en los últimos 36 meses).
Por lo tanto, es una práctica de algunos centros de referencia modificar el programa de dosificación durante el tercer trimestre (realizando una infusión de infliximab en las semanas 30-32 y adalimumab en las semanas 34-36 y reanudar la terapia después del parto para minimizar el hiato del medicamento). Sin embargo, parece haber poca evidencia de que esta estrategia minimice la transferencia de drogas transplacentarias. En el caso de estar optimizado, administran la última dosis de infliximab 4 a 6 semanas antes de la fecha del parto. Luego del parto continúan a las 24 horas en caso de parto normal y 48 horas después en caso de cesárea, asumiendo que no hay infecciones. Son ejemplos algunos centros de referencia como la Universidad de San Francisco y Calgary.505, 528 En relación con el certolizumab, como no tiene un pasaje activo a través de la placenta, se podría continuar con la medicación hasta el final del embarazo.529
Terapia combinada (inmunosupresores más biológicos): los integrantes del Consenso de Toronto pautaron que, ya que no hay evidencia, la decisión de continuar o cambiar a monoterapia, y su duración óptima, debe individualizarse en función del riesgo de recaída y preferencia del paciente. Recomiendan que si se cambia a monoterapia, es preferible continuar el tratamiento con anti-TNF e interrumpir el inmunomodulador porque existen pruebas más sólidas del papel de la monoterapia con anti-TNF en el mantenimiento de la remisión sostenida. Además, dos ensayos de desescalamiento en pacientes con EC con la combinación de terapia anti-TNF y tiopurina durante al menos 6 meses mostraron que la interrupción del inmunomodulador no aumentó las tasas de recaída a corto plazo. Cuando sea posible, la transición a la monoterapia con anti-TNF debe realizarse con el tiempo adecuado para garantizar la remisión sostenida (es decir, 3 meses) antes de la concepción.
Las pacientes y sus parejas deben estar completamente informadas sobre los potenciales riesgos, y la decisión de la suspensión del tratamiento debe ser compartida entre el equipo médico y las pacientes.
Por lo expuesto anteriormente, debe tenerse la seguridad de que los niños expuestos a infliximab, adalimumab o golimumab luego de la semana 20ma de gestación no reciban vacunas a virus vivos, polio oral, rotavirus y BCG, durante los primeros 6 meses de vida.530 Se ha reportado el caso de un niño (único caso) de madre expuesta a IFX durante el embarazo, que murió a los 4,5 meses debido a la infección diseminada de BCG después de recibir la vacuna a los 3 meses de edad.
La información sobre vedolizumab es aún escasa, pero con los pocos datos disponibles se presume que probablemente será una alternativa segura.
Lactancia: los anti-TNFs no se detectan en la leche materna, por lo que no hay inconvenientes en la lactancia.
8) Antibióticos: metronidazol y ciprofloxacina
Usados en el tratamiento de la pouchitis y la enfermedad perianal, e infrecuentemente en el tratamiento de la EC activa.
El metronidazol no aumenta el riesgo de aborto espontáneo o anomalías congénitas, aunque hay resultados controvertidos respecto de mayores tasas de labio leporino con o sin paladar hendido en los bebés de las mujeres expuestas en el segundo y tercer mes de embarazo.
Con respecto a la ciprofloxacina, estudios en humanos no han mostrado un aumento del aborto espontáneo o anormalidad congénita. Sin embargo, los estudios en animales demuestran anomalías musculoesqueléticas inducidas por fluoroquinonas, y podrían causar artropatías en niños. Aunque se cree que tienen un riesgo mínimo en general, deben evitarse en el primer trimestre.505
Lactancia: la ciprofloxacina y el metronidazol no deben ser administrados porque están presentes en la leche materna. Una recomendación adicional es la profilaxis de la trombosis durante la hospitalización.
Se lista en una tabla una síntesis de los conceptos más relevantes con respecto al curso del embarazo y la lactancia en la EII (Tabla 78).
Tabla 78. Curso del embarazo en la EII. Principales conclusiones de la experiencia mundial.

f. Situaciones especiales: manifestaciones extraintestinales
Las manifestaciones extraintestinales (MEI) son frecuentes en la EC y CU, y el 50% de los pacientes tiene al menos una manifestación que puede o no preceder a la manifestación intestinal.72 Una desregulación de la respuesta inmune entérica provocaría alteraciones en diversos órganos fuera del intestino.531, 532 Las MEI pueden ser altamente invalidantes.72 Es relevante tener en cuenta el manejo multidisciplinario con otros especialistas y consensuar el tratamiento según la multiplicidad de patologías y el riesgo beneficio de los tratamientos. El 25% de los pacientes tiene más de una manifestación extraintestinal.533 También hay que tener en cuenta que las drogas utilizadas para el manejo de la EII pueden dar lugar a manifestaciones extraintestinales secundarias a efectos adversos, que también requieren diagnóstico y manejo multidisciplinario.
Nos limitaremos a mencionar las más frecuentes, y los lineamientos generales de las recomendaciones de manejo de las distintas entidades, en especial relacionadas con la necesidad y tipo de tratamiento farmacológico, ya que ese es el objetivo de esta revisión. Algunos de los fármacos son las mismas drogas utilizadas también en las manifestaciones intestinales de la EII.
Las más prevalentes en EII son las manifestaciones articulares, que pueden ser periféricas o axiales. La artritis periférica, el eritema nodoso, las úlceras aftosas orales y la epiescleritis parecen asociarse temporalmente con la actividad de la EC, mientras que el pioderma gangrenoso, la uveítis, la artropatía axial y la colangitis esclerosante primaria con frecuencia presentan un curso independiente.72, 532 Las manifestaciones extraintestinales presentan frecuentemente una base genética relacionada con los siguientes marcadores:
– En la CU: Se observan asociacios con diversas moléculas del complejo mayor de histocompatibilidad (CMH), también llamadas antígenos leucocitarios humanos (HLA) por sus siglas en inglés Human leucocite antigen. El HLA DRB*0103 (DR 103) es un marcador de riesgo de manifestaciones articulares y oftalmológicas; el HLA B27 se relaciona con esponditis anquilosante (25-75%) y también uveítis, al igual que el HLA*B58. Los pacientes con HLA-B8, fenotipo DR3 tienen un riesgo 10 veces mayor de colangitis esclerosante primaria.532
– En la EC: las manifestaciones se suelen asociar con HLA A2, HLA DR1, HLA DQw5. Tres polimorfismos del gen NOD2/CAR15 son genes de susceptibilidad de la enfermedad Crohn, y también se asocian con sacroileitis.72, 534
– El polimorfismo -1031 C del TNF-α se suele asociar con eritema nodoso.532
En aquellos pacientes con manifestaciones extraintestinales relacionadas con la actividad de la EC, el tratamiento puede efectuarse en forma concomitante con el de la enfermedad intestinal subyacente. En otras situaciones, debe abordarse el tratamiento de la manifestación extraintestinal en forma individual, dada la falta de evidencia para la actividad de la EII.535 Para la CU, también se aplican los mismos principios.536
1) Manifestaciones articulares
Las espondiloartropatías (SpAs) son un grupo de trastornos autoinmunes seronegativos con características comunes que incluyen: espondilitis anquilosante, artritis reactiva, artritis psoriásica, enfermedad inflamatoria del intestino, algunas formas de artritis juvenil y uveítis anterior aguda. Son seronegativas (o sea el factor reumatoideo es negativo). La afectación articular se clasifica, según su localización, en periférica y axial. Puede preceder, ser sincrónica o presentarse después el diagnóstico de la EII.532
Artritis periférica: diferente de la afectación axial, puede tener una asociación positiva significativa con las manifestaciones extraintestinales cutáneas, orales y oftalmológicas. Ocurren con mayor frecuencia en la EC (y particularmente en la localización colónica).532 Su prevalencia es de 5 a 20%, son más frecuentes en la EC y se dividen en dos grandes grupos: tipo 1 o pauciarticular, tipo 2 o poliarticular.72, 532, 533
a. Tipo 1: comprometen menos de 5 articulaciones. Correlacionan temporalmente con la actividad de la enfermedad, y los brotes se autolimitan y son relativamente cortos, menores a 10 semanas. Suelen asociarse a eritema nodoso y uveítis. Las articulaciones más afectadas son las rodillas (más de la mitad), los tobillos, y los dedos de manos y pies. En general se asocian a entesitis o dactilitis. No presentan destrucción articular. Las entesopatías consisten en una inflamación en la inserción de un tendón a erosiones y proliferación ósea. La dactilitis (dedos en salchicha de manos o pies) son características de las espondiloartropatías (2-4%).72 ,532, 533
b. Tipo 2: comprometen 5 o más articulaciones. Cursan con períodos prolongados de compromiso (semanas o años). No presentan relación con brotes o actividad de la enfermedad y solo se asocian a uveítis.72, 532, 533
– Recomendaciones
a. En las tipo 1, en primer lugar debe tratarse la inflamación intestinal subyacente, lo cual suele ser suficiente para manejar la artritis periférica, aunque las inyecciones locales de esteroides son útiles para proporcionar alivio sintomático a corto plazo.72 ,532, 533 El uso de antiinflamatorios no esteroides es controvertido. En nuestro centro no los recomendamos. Los corticosteroides orales a corto plazo son efectivos, pero deben interrumpirse tan pronto como sea posible. En la artritis persistente, la sulfasalazina y el metotrexato pueden ser útiles. En casos resistentes se recomienda la terapia con anti-TNF.
b. Las artritis tipo 2, como no dependen de la actividad de la enfermedad, deberían manejarse independientemente de la misma, con los mismos fármacos mencionados, y debe tratarse la uveítis si la hubiera.72, 532, 533
Artropatías axiales
Estas son la espondilitis anquilosante y la sacroileítis. El diagnóstico se realiza en los hallazgos de la resonancia magnética o las características radiográficas de la sacroilitis, asociada a las características (igual en CU y la EC). El HLA B-27 está asociado con artritis axial, pero tiene una prevalencia más baja que en las espondilitis anquilosantes idiopáticas. La espondititis anquilosante (EA) progresiva con sindesmofitos ocurre en baja prevalencia, solo en el 1-10% de los pacientes.72
La sacroileítis: es la artropatía axial más frecuente, con igual afectación en CU y EC. Por lo general no se acompaña de artropatías periféricas. Los pacientes pueden estar asintomáticos o presentar leve dolor de espalda o rigidez matinal, sin limitación del movimiento, y mejora con el ejercicio. La característica radiológica es la alteración bilateral y simétrica del espacio sacroilíaco erosionado, con esclerosis y estrechamiento.72, 532, 533
– Recomendaciones: la literatura reporta una alta incidencia de sacroilitis asintomática (del 10 al 52%), y viceversa, la mitad de los pacientes tienen dolor lumbar inflamatorio característico sin hallazgos radiológicos, por lo que en pacientes con EII, la historia y el examen físico son herramientas diagnósticas.532
La espondilitis anquilosante: en general se presenta con un curso totalmente independiente de la actividad de la EII y puede precederla por años. Son HLA-B27+ el 60-70% de las asociadas a EII, versus 95% en las no asociadas. No hay predominio de sexo y pueden presentarse a cualquier edad, más frecuentemente en los pacientes con EC. Los cambios en la radiología son semejantes a la idiopática. La clínica es dolor desde la columna lumbar a la cervical, que empeora por la mañana o después del descanso y mejora con el ejercicio. El dolor puede extenderse a la región glútea y también a la pared torácica. Se puede asociar con uveítis, entesitis y artritis periférica.72, 532, 533
– Recomendaciones: la espondilitis anquilosante es una condición progresiva con daño estructural e incapacidad, que afecta la calidad de vida. Es relevante identificarla precozmente para tratar de prevenir la progresión.
En especial en la espondilitis anquilosante, la sulfasalazina y el metotrexato son de eficacia limitada. Tampoco en este caso recomendamos los AINEs. Los anti-TNFs indicados precozmente son el tratamiento de elección en pacientes con EA y EII.72, 532, 533
El tratamiento debe ser encarado como multidisciplinario, dada la capacidad de progresión de la EII. Deberíamos insistir en que, si es posible, se elijan drogas con acción terapéutica en las dos patologías y se acuerden dosis para ambas.
Otras manifestaciones articulares u osteomusculares: pueden presentarse tendinitis, periostitis, osteopatía hipertrófica y lesiones granulomatosas articulares. La conducta a seguir varía según el diagnóstico.
2) Manifestaciones dermatológicas
Son relativamente frecuentes. La incidencia varía de alrededor del 10% en el momento del diagnóstico de EII a más del 20% en el curso de la enfermedad. Pueden clasificarse en tres clases principales: reactivas, granulomatosas y secundarias a la deficiencia nutricional.72, 537
– Recomendaciones según la patología
Eritema nodoso: debe tratarse la enfermedad subyacente, pero frecuentemente requiere corticoides, y los casos refractarios requieren inmunosupresores o incluso anti-TNFs.72
Pioderma gangrenoso: tiene un amplio espectro de severidad. Sus variedades son: ulcerado, pustuloso, ampollar, vegetante. Las variantes ulcerada y pustulosa se asocian a EII. Es sumamente compleja la situación de un pioderma paraileostomia, ya que el pioderma se exacerba con el traumatismo por un mecanismo llamado patergia y puede ser muy extenso y sintomático. Se utilizan corticoides sistémicos a altas dosis en casos severos, locales, o intralesionales. También se indican inmunosupresores (los más relevantes: ciclosporina, y tacrólimus, que puede ser tópico), azatioprina, dapsona.537
El infliximab es altamente efectivo y según la severidad puede ser de primera elección. El mayor estudio fue multicéntrico, aleatorizado, controlado con placebo de 30 pacientes, incluidos 19 pacientes tratados con infliximab 5 mg/kg o placebo en semanas 0. Se los controló a la semana 2, respondiendo 46% vs. 6%, respectivamente (p = 0,025). A partir de entonces, a los sujetos que no mejoraron se les ofreció un estudio abierto con una infusión más y a la semana 6 se constató mejoría en el 43% de ellos. Recibieron infliximab 29 pacientes con respuesta de 69%, remisión 21% a la semana 6. En los piodermas de duración menor a 12 semanas la tasa de respuesta fue superior al 90%, y con duración mayor respondieron menos del 50%. En una serie española reciente de 67 pacientes con EII con PG, el 46% requirió tratamiento anti-TNF, con respuesta cercana al 90%.537
Psoriasis: en formas moderadas a severas tienen eficacia los inmunosupresores metotrexato, azatioprina, ciclosporina y los anti-TNFs.
Lesiones inducidas por anti-TNFs: los anti-TNFs pueden inducir inflamación paradojal de la piel, como efecto de clase de drogas, generalmente reversible al suspender la droga. Pueden presentarse lesiones psoriasiformes, que en general se controlan con tratamientos tópicos, y generalmente pueden mantenerse los anti-TNFs. Debe intervenir un dermatólogo en el tratamiento Se realiza terapia tópica con corticosteroides, queratolíticos (ácido salicílico, urea), emolientes, análogos de vitamina D y terapia ultravioleta (UVA o UVB de banda estrecha = con remisión parcial o total en casi un 50% de los pacientes). En una mayoría de pacientes con lesiones psoriásicas que no mejoraron con la terapia tópica y con lesiones y que recidivan con otro anti-TNF, resulta útil el ustekinumab.538, 539
Síndrome de sweet (dermatosis aguda febril neutrofílica): suele tratarse con corticoides sistémicos o inmunosupresores.72 EC metastásica: es una complicación poco frecuente definida como la aparición de lesiones cutáneas granulomatosas específicas alejadas de la enfermedad intestinal. Se utilizaron con éxito corticosteroides, antibióticos, azatioprina, metotrexato y, más recientemente, infliximab.72, 532
3) Manifestaciones de la cavidad oral, auditiva y nasal
La estomatitis aftosa ocurre en una prevalencia del 10%, cursa generalmente con la actividad, y recidiva frecuentemente. La EC oral puede presentar ulceraciones profundas, pseudopólipos con aspecto de empedrado.532 Suele asociarse con enfermedad perineal y tiene un curso prolongado. Se ha reportado en EC afectación metastásica de la mucosa nasal.72 Se describió pérdida auditiva neurosensorial asociada a EII, mayor en CU, por una obliteración del oído interno (diagnosticada por RMI). El síndrome de Cogan es una rara enfermedad autoinmune, que a menudo conduce a la sordera.72
– Recomendaciones: la mayoría presentan buena respuesta al tratamiento intestinal. Pueden presentarse lesiones aftosas vaginales y otras muy infrecuentes como epidermolisis bullosa acquisita o poliarteritis nodosa, que requieren tratamiento de la patología de base.
4) Manifestaciones oftalmológicas
El diagnóstico y tratamiento deberá ser manejado por un oftalmólogo.
– Recomendaciones según la patología
Epiescleritis: pueden resolverse espontáneamente, con aines tópicos, o también con corticosteroides tópicos que pueden aliviar los síntomas.72
Uveítis: además de tratamiento tópico, requieren corticosteroides sistémicos, inmunosupresores convencionales y agentes anti-TNF, al igual que las iritis (uveítis anterior no granulomatosa).532
Otras manifestaciones oftalmológicas: queratitis, retinitis, uveítis intermedia, enfermedad marginal de la córnea, oclusión de las arterias retinianas y de la vena central de la retina, neuritis óptica, vasculitis de los vasos de la retina. También requieren conducta multidisciplinaria guiadas por el oftalmólogo.
5) Manifestaciones hepatobiliares
Son comunes, y pueden o no ser inmunomediadas. Se ha observado alteración de enzimas hepáticas de prevalencia variable, 11 al 49% en pacientes con EII en estudios observacionales.532 La colangitis esclerosante primaria (CEP) es la enfermedad hepatobiliar más común inmuno mediada, consiste en un trastorno colestásico crónico caracterizado por inflamación y fibrosis de los conductos biliares intrahepáticos y extrahepáticos; es más frecuente en el sexo masculino. La prevalencia de EII (principalmente con diagnóstico de CU) en la colangitis esclerosante primaria es de alrededor del 70-80%. Contrariamente, tienen CEP aproximadamente el 2 al 7% de los pacientes con CU; en la EC las tasas de prevalencia son cercanas a la mitad de las observadas en la CU, preferentemente en la enfermedad de localización colónica. Los síntomas cardinales sugestivos de CEP son prurito, ictericia, pero puede ser solo detectado por marcadores bioquímicos hepáticos de colestasis (fosfatasa alcalina y gamma-glutamil transpeptidasa).532
Las complicaciones de la CEP incluyen colestasis, colangitis, litiasis biliar, colangiocarcinoma, carcinoma colorrectal, osteoporosis, deficiencia de vitamina y esteatorrea, y puede estar asociada con enfermedades autoinmunes. La CEP a menudo conduce a la fibrosis y el desarrollo de estenosis y dilataciones en el árbol biliar extrahepático.72 Sin embargo, 15-70% de los pacientes con CEP son asintomáticos. La colangiografía (colangio RMI) o biopsia, según el tipo de lesión, son necesarias para el diagnóstico.532 La EII presenta a menudo extensión pancolónica con preservación rectal, ileítis por reflujo, menor actividad intestinal y alta incidencia de pouchitis luego de la cirugía.72 Existe un aumento del cáncer de colon (riesgo 4-10 veces) con respecto a la población general y otros pacientes con CU, que permanece después del trasplante hepático.72, 532
– Recomendaciones: se recomienda colangiorresonancia de alta calidad, para excluir la CEP secundaria si hay alteraciones del laboratorio. Si es normal, debe considerarse una biopsia hepática para descartar la CEP de los conductos pequeños, que se asocia con mejor pronóstico. Las concentraciones séricas elevadas de IgG4 (> 5 g/l) y/o una proporción elevada de IgG4/IgG1 deberían inducir la consideración de colangitis esclerosante asociada a IgG4.72
El ácido ursodesoxicólico 15-20 mg kg/día mejora los test hepáticos, pero no cambia el pronóstico.72, 532
El trasplante hepático es la única terapia que puede curar la CEP enfermedad hepática, indicado en etapa terminal o con importante colestasis, prurito intratable y casos seleccionados con colangitis bacteriana grave recurrente. La sobrevida a 5 años es cercana al 85%.72
Debe realizarse vigilancia para el riesgo de cáncer de colon desde el diagnóstico, y se propuso para el cribado y el estudio del colangiocarcinoma en la CEP, con el CA 19-9 y ultrasonografía, pero no está validado. Las lesiones polipoides de la vesícula biliar se asocian con un alto riesgo de malignidad, aconsejándose la ecografía anual.72 La fosfatasa alcalina sérica debería hacer sospechar CEP en un paciente con EII, aunque los valores son normales en el 10% de los pacientes.
Hepatitis autoinmune
– Recomendaciones
Los niveles de transaminasas séricas (TGO, TGP) suelen ser inferiores a 300 UI. En pacientes con CEP con características de hepatitis autoinmune (transaminasas elevadas, IgG sérica alta, deben realizarse autoanticuerpos ANA, ASMA, LKM, AMA, aunque tienen baja especificidad. La hipergammaglobulinemia se observa en aproximadamente el 30% de los pacientes con CEP y su hallazgo puede aumentar la probabilidad de hepatitis autoinmune, que se presenta en hasta el 10% de los pacientes con CEP. Se trata con corticoides sistémicos o budesonida o con inmunosupresores del tipo tiopurinas.72
Otras hepatopatías
La esteatosis se ha descrito en más del 30% de los pacientes.532 En hepatitis reactivas leves pueden ser observados aumentos de transaminasas inespecíficos. También la colelitiasis es más frecuente que en la población general, principalmente en EC ileal por malabsorción.532 También se han reportado casos de trombosis de la vena porta y hepática, pileflebitis supurativa, amiloidosis y hepatitis granulomatosa. La trombosis de la vena porta es una situación severa, observada más frecuentemente en condiciones post-operatorias, recomendándose medidas preventivas del tromboembolismo durante la hospitalización o exacerbaciones; luego del diagnóstico se recomienda realizar las determinaciones apropiadas de condiciones protrombóticas adquiridas o trombofilia hereditaria, asi como manejar la indicación de tratamiento anticoagulante según las guías internacionales.
Se reportaron además abscesos hepáticos, que son infrecuentes en la EII, sugiriéndose que su presentación se relaciona con la inflamación transmural, o de manera secundaria a una enfermedad fistulizante, a la extensión directa de un absceso intrabdominal, o a una pileflebitis portal.72 La asociación entre la cirrosis biliar primaria y la CU es rara, pero existe. La colectomía no parece alterar la progresión de la enfermedad.532
6) Complicaciones urogenitales
La insuficiencia renal en EC fue reportada en una prevalencia aumentada, entre el 2% y hasta del 15% en series de pacientes hospitalizados con EC o CU. Los factores de riesgo publicados son la magnitud de una resección intestinal, la duración de la enfermedad, la edad, y una historia de cálculos renales. Los pacientes con EC son propensos a presentar nefrolitiasis de ácido úrico u oxalato de calcio, por alteraciones en el cortocircuito de sales biliares, por malabsorción y resecciones intestinales. La amiloidosis secundaria es infrecuente y rara, se ha observado en pacientes con EC ileocolónica y/o perianal, y se han reportado algunos casos que presentaron respuesta al infliximab.
Se ha informado la presentación de nefritis intersticial, varios casos de glomerulonefritis asociada a EII, incluida la nefropatía por IgA, sugiriendo que sería una MEI. La hidronefrosis y las fístulas son secundarias a las complicaciones intestinales de la enfermedad. La sulfasalazina y el 5-ASA pueden causar toxicidad renal (glomerulonefritis, síndrome nefrótico, nefritis intersticial). Se describieron obstrucción de uréteres y fístulas al tracto urinario.
– Recomendaciones
Los salicilatos pueden causar nefritis intersticial aguda o crónica; la recomendación es la detección precoz, para la suspensión de la droga. Si bien estas no son manifestaciones extraintestinales genuinas sino secundarias, deben monitorearse también los inhibidores de la calcineurina.72
7) Otras manifestaciones: adicionalmente se puede presentar un gran espectro de otras categorías y otras manifestaciones adicionales dentro de las categorías citadas, la mayoría requiere control específico de otras especialidades.
Cardiológicas: hay un modesto aumento de cardiopatía isquémica, accidente cerebrovascular e isquemia mesentérica mayor en las mujeres. La inflamación sistémica predispone a la aterosclerosis prematura.72 Recomendaciones: la política es la preventiva, con chequeos cardiovasculares.
Respiratorias: el patrón más común es la inflamación de las vías respiratorias, que involucra al árbol bronquial a cualquier altura: laringe, glotis, tráquea (ocurriendo inflamación y posibles estenosis), bronquios (pudiendo presentarse bronquitis crónica no específica o granulomatosa), bronquiolos (bronquiolitis granulomatosa o pan-bronquiolitis difusa, pudiendo presentarse bronquiolitis obliterante), tejidos parenquimatosos (neumonía intersticial habitual que ocurre de la forma más comúnmente observada en otras patologías, o bien organizada, linfocítica, descamativa, eosinofílica), que generalmente correlacionan con la actividad de la enfermedad intestinal y/o manifestaciones extraintestinales adicionales. Raramente se observaron fístulas del tubo digestivo, vasculitis pulmonar y pleuritis.72
Recomendaciones: excluir etiología medicamentosa (suspender salicilatos o metotrexato). La mayoría responden a los corticosteroides, dependiendo la vía de administración del tipo y localización del compromiso. Los corticoides por vía inhalatoria (como budesonida) representan el tratamiento de primera línea en la afectación de las vías respiratorias grandes (administrándolos por nebulización si hay moco), los sistémicos se utilizan en la afección del parénquima y en la resistencia a los corticosteroides inhalados de la enfermedad de vías respiratorias grandes.72 La resistencia o dependencia a esteroides debe tratarse con inmunomoduladores y/o terapia biológica, y existen reportes con anti-TNF.540
8) Tromboembolismo y EII
Los pacientes con EII tienen un riesgo de tromboembolismo igual al triple que la población normal. La incidencia reportada en la literatura entre el 1,2 a 6,1 y alcanza el 39% en necropsias. Por lo tanto, realizar profilaxis de la tromboembolia es imperativo, porque es una causa importante de morbilidad y mortalidad. Los eventos más frecuentes son la trombosis venosa profunda de miembros inferiores y tromboembolismo pulmonar.532 El tromboembolismo venoso es al menos 2 veces más alto en la EII que en la población general. Se han descripto sitios inusuales de tromboembolismo venoso, como cerebrovascular, portal, mesentérico y de las venas de la retina. El tromboembolismo pulmonar o cerebral (por ejemplo: del seno cavernoso) y de la vena porta ocurren a una edad más temprana que en pacientes sin EII. Generalmente se dan en la EII activa, ya que la inflamación es un factor predisponente, pero no siempre ocurre en este contexto, ya que al menos 30 al 40% ocurren en la EII quiescente. En la EII se ha observado un imbalance entre coagulación y fibrinólisis en favor de la coagulación, que no ha sido completamente explicado. Algunas de estas anormalidades en la homeostasis de los factores de coagulación son: el aumento del fibrinógeno, la disminución de la protein C, de la protein S y de la antitrombina III, anormalidades en las plaquetas consistentes en aumento del número, activación y agregación, anormalidades de fibrinólisis, aumento del PAI-1, aumento de trombomodulina circulante, homocisteinemia. 532 Los factores como inmovilidad, cirugía, esteroides, catéter venoso central contribuyen al aumento del riesgo y también deben considerarse el tabaquismo, los anticonceptivos, pero los mencionados no son los únicos factores. También se han considerado en la patogenia otros predisponentes, entre ellos la mencionada hiperhomocisteinemia (secundaria a la deficiencia de folatos y vitamina B12, posible de presentarse en las EII).
Se ha estudiado la implicancia de las trombofilias hereditarias entre otros, la mutación del factor II protrombina (G20210A), la homozigocidad de la mutación del gene de la metiltentrahidrofolatoreductasa (MTHFR 6777T), el factor VIII (val34leu), la mutación del (PAI-1) gen plaminogen activator inhibitor type 1, pero no se los encontró significativamente asociados a EII, aunque los autores comentan que los resultados pudieron estar limitados por el tamaño de la muestra de pacientes.72,532
Respecto de la mutación genética del factor V [de Leiden], si bien preliminarmente había sido investigada simultáneamente con otras mutaciones recién mencionadas, no pudiéndo demostrarse una asociación con EII, en investigaciones más recientes, se ha reportado una prevalencia significativamente aumentada en pacientes con EII con trombosis (20%) en comparación con controles de EII sin trombosis (0%). Además se ha especulado sobre una posible contribución de la presencia de anticuerpos antifosfolípidos, lo cual es controvertido.532
Recomendaciones: eliminar los factores de riesgo que sean posibles, ello implica realizar profilaxis antitrombótica en caso de inmovilización como hospitalización, administrada según las normas internacionales, y debería ser considerada inmediato al alta ya que se describe un 2% de riesgo, y después de una reciente cirugía. Adicionalmente es aconsejable estudiar los factores de coagulación y los predisponentes genéticos en caso de trombosis.532 La heparina de bajo peso molecular, es la más comúnmente usada inicialmente, y para el largo término los antagonistas de la vitamina K, o los nuevos anticoagulantes orales no antagonistas de la vitamina k.
La duración depende del riesgo, considerando que si estaba en remisión podría discutirse si se prolonga indefinidamente. Con respecto a los tratamientos específicos para EII, debe tenerse en cuenta que las tiopurinas pueden reducir el efecto de la warfarina, los corticoides son factores que predisponen a la trombosis (tener encuenta la profilaxis en el hospitalizado, donde se asocian la inmovilización), los anti-TNFs disminuyen la actividad de los biomarcadores de coagulación y activan la fibrinólisis.72
9) Pancreatitis
La pancreatitis puede ser: autoinmune, idiopática, medicamentosa, asociada con CEP o tener las mismas las causas de la población general. La tasa en EC es del 4% de y la mitad en CU. La causa medicamentosa principal es el tratamiento con tiopurinas, que se ve precozmente (dentro del mes), 5-ASA en menor grado, los cálculos biliares, el alcohol y la CPRE. Se ha descrito pancreatitis autoinmune relacionada con IgG4 y se relaciona con un patrón específico de HLA.72 La lipasa está elevada asintomáticamente en el 7% de los pacientes con EII. Los autoanticuerpos pancreáticos dirigidos contra el páncreas exocrino se encuentran en alrededor de un tercio de EC y en el 4% de las CU.
La pancreatitis crónica en la EII se caracteriza por la presencia de anomalías del conducto pancreático, a veces un patrón pseudotumoral y, en la mayoría de los casos está ausente la calcificación parenquimatosa. Puede haber alteraciones morfológicas de los conductos pancreáticos, como así también los pacientes con colangitis esclerosante primaria.72
Recomendaciones: considerar que los pacientes con EII tienen factores potenciales de desarrollar una pancreatitis, y hacer diagnóstico precoz.
10) Manifestaciones neurológicas
Las manifestaciones del sistema nervioso central pueden ser más comunes en pacientes con EII que en la población general. Los mencionados fenómenos tromboembólicos son las más comunes, como se ha comentado previamente, en caso de la trombosis del seno cavernoso, el accidente cerebrovascular y la desmielinización central. La neuropatía periférica, por metronidazol, deficiencias vitamínicas, son raros pero descriptos. Se deben identificar las causas tratables, por ejemplo, deficiencias de vitaminas. Los diferentes tipos de neuropatías se presentan con igual frecuencia en EII que en la población control.72
Recomendaciones: la desmielinización es una contraindicación para la terapia anti-TNF. Las manifestaciones del sistema nervioso central por EII son muy raras y, por lo tanto, cuando ocurren síntomas que involucran el sistema nervioso central debe excluirse primero un evento tromboembólico. La estrategia es preventiva. Deben corregirse las deficiencias vitamínicas, hacer prtofilaxis de trombosis cuando esté indicado, y tener presente los efectos adversos de los medicamentos.
11) Desórdenes autoinmunes coexistentes
Dado que las EII tienen una alteración de la inmunidad, pueden verse enfermedades autoinmunes, algunos ya mencionadas, como pancreatitis, anemia hemolítica, enfermedad tiroidea, artritis de Takayasu, artritis reumatoidea seropositiva, y granulomatosis de Weneger.532
Recomendaciones generales: sumarizando, deben tenerse en cuenta complicaciones secundarias al deterioro causado por la enfermedad, las cirugías, los efectos adversos de las drogas utilizadas, como la osteopatía metabólica, las manifestaciones hematológicas secundarias de la enfermedad (el estudio y la corrección de la anemia, la prevención del riesgo de tromboembolismo, la corrección de trastornos del crecimiento, la malnutrición, una potencial insuficiencia suprarrenal, la amiloidosis, y el tratamiento de la nefrolitiasis).
g. Necesidad de nuevas opciones terapéuticas
Como ya hemos comentado, hasta hace poco tiempo, los objetivos principales del tratamiento de la EII para la práctica clínica eran la inducción de respuesta o remisión clínica y el mantenimiento de la remisión clínica con base en los síntomas Adicionalmente, los ensayos clínicos carecían frecuentemente de evaluaciones endoscópicas o estudios por imágenes, sobre todo en la EC. En los últimos años emergió la curación de la mucosa como objetivo terapéutico principal en la EII. La curación de la mucosa se asocia con tasas bajas de recurrencia, menores tasas de internación, menor lesión intestinal (fístulas) y reducción en la necesidad de cirugía.541 En la CU, la curación de la mucosa se asocia además con menor riesgo de cáncer colorrectal.542 Esta estrategia de considerar como objetivo, más allá del control de los síntomas clínicos, logrando la remisión profunda (remisión clínica y curación de la mucosa) es un concepto emergente en la EII, cuyo logro es actualmente señalado como la única forma de modificar el curso de la enfermedad.543
Los avances en el desarrollo de medicamentos suministraron tratamientos altamente efectivos para la EII, haciendo de la remisión profunda un objetivo posible de lograr en un porcentaje de pacientes que se diferencia significativamente del placebo. La expectativa que sugieren los resultados disponibles es que la remisión profunda podría modificar aspectos evolutivos relevantes como la necesidad de cirugía y el desarrollo de incapacidad. La magnitud de este cambio debe evaluarse más detalladamente a largo plazo en estudios de modificación de la enfermedad.
Sin embargo, pese a los avances en el tratamiento, aún hay necesidad de nuevas drogas debido a:
Pacientes “no respondedores primarios”.
Pacientes con “pérdida de respuesta”.
Pacientes que desarrollan “intolerancia”.
Gisbert y col. realizaron una revisión sistemática con meta-análisis donde evaluaron la eficacia del uso de un segundo anti-TNF tras la falla al primero. Ellos describieron que en pacientes con EC con fracaso al infliximab, el segundo anti-TNF puede llegar a lograr la remisión en un 43% de los casos y respuesta clínica en el 63%. En pacientes con CU la remisión fue de hasta el 50%.
Es un aspecto de interés que ellos describieron que la respuesta varía según el motivo de la suspensión de primer anti-TNF, y analizando como causas la falla primaria, la falla secundaria y la intolerancia al fármaco, reportaron tasas de remisión del 30%, 45% y 61% respectivamente.544
Nuevos tratamientos: comercializados, aprobados o en experimentación
Se necesitan opciones terapéuticas dirigidas a nuevos blancos, lo cual es indispensable para los pacientes con EII que fracasan con tratamiento anti-TNFs. Al respecto, se diseñaron y ya están aprobados o en fase investigación nuevos biológicos y otras drogas categorizados según sus propiedades farmacológicas como “moléculas pequeñas”. Las diferencias principales, que se describirán luego más extensamente, se muestran en una tabla (Tabla 79).
Entre los biológicos, el vedolizumab (un inhibidor de moléculas de adhesión) y el ustekinumab (un bloqueante de la subunidad p-40 de las IL-12 e IL-23) y entre las moléculas pequeñas, el tofacitinib (un inhibidor de la Janus Kinasa 1-3), serían las opciones alternativas con evidencia de eficacia más fácilmente disponibles a nivel mundial en la actualidad y probablemente en el futuro inmediato.545
Se describirán las principales nuevas opciones (actuales y en experimentación) agrupadas por su mecanismo de acción.
Tabla 79. Aspectos diferenciales entre los agentes biológicos y las pequeñas moléculas.
1. Diferencias principales entre biológicos y moléculas pequeñas
a. Inhibidores de moléculas de adhesión
Conceptos generales:545-548
Las células T efectoras, cruciales en la génesis del proceso inflamatorio y lesión tisular en EII, tienen receptores que les permiten migrar al tejido inflamado, principalmente a través de las vénulas poscapilares. Uno de los puntos cruciales en la patogenia de la EII es el aumento de la migración de las células T al tracto intestinal.
Los eventos relevantes de la migración leucocitaria se ilustran en una figura (Figura 25). Los leucocitos viajan a gran velocidad a través del tracto vascular, y para migrar a los tejidos blanco donde se está desarrollando un proceso inflamatorio, como el tracto intestinal, hay una secuencia de pasos mediada por un sistema de adhesión, que consiste en la captura/anclaje, rodamiento, activación, adhesión y migración a través de la pared vascular.
La captura de las células T en el endotelio se lleva a cabo por la interacción entre selectinas (L-selectinas expresadas en los leucocitos, E-selectinas y P-selectinas expresadas en el endotelio) y moléculas de oligosacáridos que actúan como ligandos. La P-selectina se almacena en gránulos intracitoplásmicos de plaquetas y células endoteliales y cuando estas se activan, transloca a la membrana plasmática, permitiendo las interacciones, participando específicamente en el rodamiento, por interacción con “P-selectin glycoprotein ligand-1” (PSGL-1), expresada por diferentes tipos de leucocitos.
Debido a estas interacciones, los leucocitos primero reducen su velocidad en el flujo vascular y luego ruedan a través de la pared vascular, transportándose secuencialmente de una selectina a otra.
Las moléculas de adhesión secundarias (miembros de la familia de las integrinas) son moléculas de adhesión de la superficie de los leucocitos, que les permiten dejar de rodar y comenzar la migración hacia los tejidos blanco, mediante extravasación a través de la pared vascular.
La expresión de integrinas y selectinas se activa mediante las quimioquinas, que son liberadas por las células T. Las integrinas implicadas en tal migración son: antígeno 1 asociado a la función leucocitaria (LFA-1 o a2β2) y dos integrinas a (a4β7 y a1β7). La subunidad a está implicada en la especificidad (Ej: a4, especificidad en intestino) y la subunidad β en las vías de señalización.
Para la migración de los leucocitos, cada una de estas integrinas, que se denominan por el nombre de las cadenas que las componen, se unen a ligandos específicos en el endotelio denominados adresinas:
– La integrina a a2β2: se expresa en neutrófilos e interactúa con la molécula de adhesión intercelular-1 (ICAM-1) expresada en leucocitos, células dendríticas, fibroblastos, células epiteliales y células endoteliales.
– La integrina a4β7: se expresa en los linfocitos que colonizan el intestino y el tejido linfoide asociado al intestino e interactúa con la llamada (por su nomenclatura en inglés) mucosal addressin-cell adhesion 1 (MAdCAM-1).
El ligando MAdCAM-1 se expresa en las vénulas endoteliales del intestino delgado, en las placas de Peyer y en el colon, y su interacción con la integrina a4β7 activa la migración de linfocitos a las placas de Peyer. Por lo mencionado, la interacción entre a4β7 y MAdCAM-1 es selectiva del intestino.
– La integrina aEb7: es otro miembro de la familia de integrinas β7 que se expresa solo en los linfocitos T intraepiteliales de la mucosa y que se une selectivamente a la E-cadherina en las células epiteliales.546 La expresión de aE β7b7 está elevada en CU y EC en la fase activa de la enfermedad y la interacción de aEb7/E-cadherin participaría en la retención de células T en el tejido de la mucosa intestinal.
• Quimioquinas: además de selectinas y moléculas de adhesión, los leucocitos también interactúan con las quimioquinas a través de receptores específicos de quimioquinas (CCR). En condiciones normales, atraen a los leucocitos cuando hay un agente infeccioso. Sin embargo, también pueden contribuir a la amplificación y perpetuación de la inflamación en EII.
Los diversos fármacos anti-moléculas de adhesión bloquean estas interacciones, según su especificidad, impidiendo que las células inflamatorias lleguen a los tejidos susceptibles de inflamación. Algunos son anticuerpos monoclonales y otros, moléculas pequeñas.
Se ilustran los principales mecanismos de bloqueo del tráfico leucocitario mediado por drogas anti-moléculas de adhesión (Figura 26).
◊ Natalizumab (Antegren, Tysabri):
fue el primer anticuerpo monocional anti-molécula de adhesión ensayado en EII.
· El Natalizumab, pimariamente desarrollado para esclerosis múltiple, se consideró inicialmente un fármaco promisorio para EII, pero su uso se desaprobó en la mayor parte del mundo (por serio evento adverso).
· Es un anticuerpo IgG4 monoclonal humanizado recombinante contra la subunidad a4 de integrina que bloquea tanto a4b7 como a4b1.
· Mientras la interacción a 4b7/MAdCAM-1 es específica del intestino, la interacción a4b1-VCAM-1 interfiere con la migración de linfocitos al Sistema Nervioso central. El Natalizumab bloquea las dos.
· En un estudio piloto controlado con placebo, Gordon y col. administraron en 30 pacientes con EC natalizumab 3 mg/kg en una infusión IV, observándose a la segunda semana un descenso significativo del CDAI (media 45 puntos) con natalizumab vs. placebo (media 11 puntos).
La inducción de remisión a semana 2 fue superior con natalizumab comparado con placebo (39% vs. 8%).549
· En un ensayo de fase 2, doble ciego, controlado con placebo en 248 pacientes, el natalizumab logró tasas de remisión más altas, así como una mejor calidad de vida y descenso de la PCR comparado con placebo. En este estudio, se compararon dos infusiones separadas por 4 semanas: dos infusiones de placebo, una de natalizumab de 3 mg /kg de peso seguida por placebo, dos infusiones de 3 mg/kg, y dos infusiones de 6 mg/kg. La dosis de natalizumab de 6 mg/kg no fue de eficacia superior a la de 3 mg/kg.
El objetivo primario (remisión a la semana 6 versus placebo) se logró en los pacientes que recibieron dos infusiones de 3 mg/kg (44% versus 27%, p = 0,030). Luego de la segunda infusión, se logró remisión en la semana 8, en ambos grupos (diferente dosis) que recibieron dos infusiones de natalizumab (ambas p < 0,001), y en la semana 12 en el grupo que recibió dos infusiones de 3 mg/kg (p = 0,042).
Los autores postulan que la falta de remisión en el grupo que recibió dos infusiones de 6 mg/kg se debió a una alta respuesta placebo puntual de la semana 6, ya que a 4 y 8 semanas se detectó diferencia (p = 0,028 y p < 0,001), ello asociado a un mayor porcentaje de EC fistulizante en el grupo de 6 mg/kg.
La respuesta en los tres grupos con natalizumab fue significativamente más alta que con placebo, lográndose el mejor resultado con 2 infusiones de 3 mg/kg separadas por 4 semanas (71% vs. 38%; p < 0,001).550
· La eficacia del natalizumab para inducir la remisión en la EC se confirmó adicionalmente en los ensayos ENACT-1 (Efficacy of Natalizumab as Active Crohn’s Therapy) y ENCORE (Efficacy of Natalizumab in Crohn’s disease respOnse and Remission trial).
· En el estudio ENACT-1, 905 pacientes con EC activa fueron aleatorizados a natalizumab o placebo. Las tasas de respuesta (56% y 49% respectivamente, p = 0,05) y remisión (37% y 30% respectivamente, p = 0,12) para los tratados con natalizumab 300 mg y placebo a las 10 semanas fueron similares.551
· Pero los pacientes continuaron en un segundo ensayo (ENACT-2) en el que 339 pacientes que habían tenido respuesta fueron randomizados para recibir cada 4 semanas 300 mg de natalizumab o placebo durante 56 semanas, evaluando la respuesta y remisión sostenidas a 36 semanas.
· En este estudio a largo plazo, el natalizumab demostró ser más eficaz que el placebo para mantener la remisión, con una mayor proporción de pacientes que lograron una respuesta sostenida (61% vs. 28%, p < 0,001) y también remisión sostenida (44% vs. 26%, p = 0,003) a la semana 36.
· En un estudio posterior abierto de mantenimiento se comprobó la eficacia en el mantenimiento de remisión en los pacientes que completaron el ENACT-2, lográndose remisión (n 146), quienes continuaron el tratamiento por otros 12 meses, logrando mantenerse en remisión el 86% y adicionalmente libres de corticoides el 85%.
· Si bien el porcentaje global de efectos adversos de los ENACT-1 y 2 fue similar a placebo, un paciente murió por leucoencefalopatía multifocal progresiva.551
· En el ensayo ENCORE, se asignaron al azar 509 pacientes con EC a natalizumab 300 mg o placebo. El natalizumab fue bien tolerado y logró en las semanas 4, 8 y 12 tasas superiores de respuesta al natalizumab vs. placebo (a semana 8 extendida a semana 12: 48% vs. 32%, p < 0,001) y remisión (26% vs. 16%, p < 0,002).552 La respuesta a la semana 4 fue 51% vs. 37% (p < 0,001) y la respuesta también se mantuvo en las sucesivas evaluaciones.
· Los datos que evalúan la efectividad del natalizumab en la CU son escasos. Gordon y col. realizaron un estudio piloto en el que 10 pacientes con CU activa (definida por un puntaje del score de Powell-Tuck > 4) recibieron una infusión única de natalizumab (3 mg/kg).
El punto final primario fue la disminución del score de Powell-Tuck a 2 semanas después de la infusión, lo que se logró en la mitad de los casos, y la PCR también disminuyó. La droga fue bien tolerada.553
· A pesar de la eficacia del natalizumab para inducir y mantener la remisión clínica en pacientes con EC, la razón de la limitación de su uso es el riesgo de leucoencefalopatía multifocal progresiva (PML), una infección cerebral oportunista y generalmente fatal causada por la reactivación del polyomavirus JC latente.
La misma se caracteriza por lesiones microscópicas progresivas y múltiples que provocan una desmielinización de consecuencias fatales. Su uso se restringió a la esclerosis múltiple, y desde entonces se administró solo dentro de un programa de control de PML en Crohn refractario a anti-TNF en EE.UU., lo cual no fue aprobado en el resto del mundo.
La fisiopatología de esta infección se explica por el bloqueo de la interacción a4b1/VCAM-1 por el natalizumab, lo que resulta en un bloqueo de la migración de las células T al sistema nervioso central que protege de la infección del JC susbyacente, generando la mencionada leucoencefalopatía multifocal progresiva. 545-548
◊ Vedolizumab (Entyvio®): es un anticuerpo monoclonal humanizado IgG1 que se dirige específicamente contra las integrinas a4β7, bloqueando las interacciones con MAdCAM-1 (mucosal vascular addressing cell adhesion molecule) que contribuyen a la inflamación.
De esta manera, presenta una inhibición del transporte de los linfocitos específicamente en el tracto gastrointestinal (bloqueo selectivo en el intestino), pero no afecta otros órganos por no bloquear las interacciones a4β1-VCAM, lo que es importante para mantener la vigilancia de la proliferación viral en el sistema nervioso central, previniendo el efecto adverso serio del natalizumab, la PML.546
Con vedolizumab, se efectuaron estudios clínicos en fase II y cuatro en fase III (GEMINI 1, GEMINI 2, GEMINI 3 y GEMINI LTS) en pacientes con CU y EC activa moderada a severa (involucrando estudios de inducción y/o mantenimiento).545-546
Se presenta un sumario en tablas adjuntas (Tablas 80, 81 y 82).
Tabla 80. Vedolizumab en la CU. Estudio GEMINI 1.

Tabla 81. Vedolizumab en la enfermedad de Crohn. Estudios GEMINI 2 Y GEMINI 3.

Tabla 82. Vedolizumab. Eficacia y seguridad a largo término: GEMINI LTS.
I. Eficacia en la CU. Estudios pivotales de inducción y mantenimiento
El GEMINI 1 es un estudio Fase 3, que consta de la integración de dos estudios randomizados, doble ciego, controlados versus placebo, en los que se estudió la inducción de remisión y el mantenimiento en la CU.554
Estudio de inducción de remisión
Se investigó la eficacia del vedolizumab a 6 semanas, en pacientes con enfermedad moderada a severa tratados con infusiones de 300 mg de vedolizumab a semanas 0 y 2.
Cohorte 1: los pacientes (n 374) fueron asignados randomizadamente a tratamiento con vedolizumab o placebo mediante infusiones realizadas los días 1 y 15.
Cohorte 2: los pacientes (n 521) entraron a un estudio abierto, recibiendo el tratamiento activo de inducción vedolizumab, en dosis e intervalo similar a la Cohorte 1.
En el estudio randomizado (cohorte 1) se observó una diferencia significativa a favor del vedolizumab versus placebo en la respuesta (47,1% vs. 25,5%; p < 0,001), en la remisión (16,9% vs. 5,4% p = 0,001), y en el logro de cicatrización de la mucosa (40,9% vs. 24,8%; p = 0,001).
En el estudio abierto (cohorte 2), de los 521 pacientes demostraron respuesta el 44,3%, presentaron remisión un 19,2% y lograron cicatrización de la mucosa el 36,7%.554 Los pacientes con previa exposición a anti-TNFs tuvieron significativa menor respuesta a la inducción.
Estudio de mantenimiento
Realizado con los respondedores a 6 semanas (n = 373) de las cohortes 1 y 2 de inducción. Se randomizaron en tres grupos, con comparaciones a 52 semanas:
– Vedolizumab cada 8 semanas de intervalo.
– Vedolizumab cada 4 semanas.
– Placebo.
A 52 semanas, los pacientes asignados a recibir vedolizumab estaban en remisión más frecuentemente que los que cambiaron a placebo. Los porcentajes de pacientes con vedolizumab cada 8 semanas, cada 4 semanas y placebo que estaban en remisión en ese punto de tiempo fueron 41,8%, 44,8% y 15,9% respectivamente, demostrando diferencia significativa (p < 0,001 para ambos intervalos versus placebo). Los porcentajes de pacientes que presentaban cicatrización de la mucosa para los tres grupos de randomización: vedolizumab cada 8 semanas, cada 4 semanas y placebo fueron 51,6%, 56% y 19,8% respectivamente, demostrando también una diferencia significativa (p < 0,001 para ambos intervalos, vs. placebo). Asimismo, fueron significativamente mayores las comparaciones de las tasas de vedolizumab (administrado cada 8 y cada 4 semanas) vs. placebo, para los siguientes end points: respuesta clínica durable (mantenida a ambos tiempos: 6 y 52 semanas), con tasas de 56,6%, 52,6% vs. 23,8% respectivamente (p < 0,001 para ambos intervalos), remisión clínica durable (20,5%, 24% vs. 8,7%, p = 0,008 y p = 0,001) y remisión libre de esteroides (45,2%, 31,4% vs. 13,8%, p = 0,01 y p < 0,001).
Por lo tanto, el vedolizumab fue significativamente más efectivo que el placebo tanto en la inducción como en el mantenimiento de la respuesta clínica y de la remisión en la CU.554
También hubo mejoría significativa en el IBDQ y en la calprotectina fecal a semanas 6 y 52. Los que recibieron placebo de la cohorte 1 continuaron con placebo hasta la semana 52. Los no respondedores a 6 semanas continuaron 52 semanas; con vedolizumab cada 4 semanas. Sus resutados se referirán dentro del análisis del largo plazo (GEMINI LTS).
II. Eficacia del Vedolizumab en la enfermedad de EC. Estudios pivotales de inducción y mantenimiento
3 GEMINI 2: La eficacia en la EC fue investigada en este estudio (integrado de inducción y mantenimiento), en el que se evaluó el vedolizumab en comparación con placebo en pacientes con enfermedad activa moderada a severa.555
Estudio de inducción: consistió en una cohorte de 368 pacientes aleatorizados a vedolizumab o placebo en las semanas 0 y 2, y una cohorte de 747 pacientes que recibieron el mismo esquema de vedolizumab en forma abierta. En el mencionado protocolo, a 6 semanas presentaron remisión el 14,5% de pacientes con vedolizumab y el 6,8% con placebo (p = 0,02), pero no se observó un descenso significativo de 100 puntos del CDAI (respuesta). De los que entraron al estudio abierto presentaron remisión el 17,7% y respuesta el 34,4%.
Estudio de mantenimiento: ingresaron aquellos pacientes (n = 461) que demostraron respuesta en la 6ta semana. Se comparó la la respuesta entre 300 mg de vedolizumab administrado cada 8 semanas y cada 4 semanas vs. placebo hasta la semana 52. Resultaron diferencias significativas en el logro de remisión clínica, con tasas para las tres ramas de 39%, 36,4% y 21,6% respectivamente (comparaciones de ambas dosis de vedolizumab vs. placebo p = 0,001 y p = 0,004).
También hubo resultados significativos en la respuesta: 43,5%, 45,5% vs. 30,1% (p = 0,01 y p = 0,005), y en la remisión libre de esteroides: 31,7%, 28,8% vs. 15,9% (p = 0,02 y p = 0,04) comparando los antes mencionados intervalos con placebo. Por lo tanto, el tratamiento con vedolizumab resultó en una tasa más alta de remisión que el placebo durante ambos estudios de inducción y mantenimiento. Sin embargo, en la inducción a semana 6, no se obtuvo una respuesta de disminución del CDAI de 100.
En este último resultado podrían haber influido características del grupo placebo, la duración de la enfermedad o la previa exposición a anti-TNFs (barajándose que el efecto probablemente podría ser más lento que seis semanas, como sugiere el GEMINI 3).555, 556
En el caso de EC, aquellos pacientes que no hayan mostrado respuesta en la semana 10, actualmente se considera que pueden beneficiarse de una dosis adicional de vedolizumab en la mencionada semana.
III. Eficacia en la enfermedad de Crohn con foco en falla a anti-TNFs
3 GEMINI 3: El estudio se focalizó en EC moderada a severa con falla a anti-TNFs, reclutándose 416 pacientes, de los cuales 76% (n 315) tenían antecedentes de falla a anti-TNF (intolerancia, no respuesta o pérdida de respuesta) con los que se realizó el análisis primario.556
De los mencionados pacientes con EC con falla a anti-TNFs, a 6 semanas estaban en remisión con vedolizumab el 15,2% vs. el 12,1% con placebo (NS); sin embargo, se detectó a las 10 semanas una diferencia estadística: 26,6% vs. 12,1% respectivamente (p = 0,001).
Para similar agrupamiento, se observó descenso del CDAI de 100 puntos (respuesta) en el 39,2% vs. el 22,3% a 6 semanas (p = 0,001) y en el 46,8% vs. el 24,8% a 10 semanas respectivamente (p < 0,001).
En la población total lograron remisión con vedolizumab el 19,1% versus el 12,1% con placebo a 6 semanas (p = 0,048) y el 28,7% y el 13% a 10 semanas respectivamente (p < 0,001).556
IV. Resultado de seguimiento a largo término de los estudios pivotales con vedolizumab (incluyendo eficia y seguridad)
· GEMINI LTS («Long Term Safety: seguridad a largo plazo): fueron incluidos los pacientes con CU y EC respondedores a 6 semanas de los estudios GEMINI 1 y 2 para UC y EC respectivamente, que continuaron con terapia de mantenimiento cada 4 u 8 semanas hasta 1 año y luego siguieron el tratamiento con vedolizumab cada 4 semanas en este estudio. En el LTS se han realizado análisis intermedios (provisionales) para CU y EC con buenos resultados.557-558
– En la EC se incluyeron pacientes de los estudios C13004, GEMINI 2 y GEMINI 3 y una cohorte de pacientes naïve que recibieron en el LTS vedolizumab cada 4 semanas, hasta junio de 2013. Se evaluaron la respuesta clínica y la remisión, definidos por el índice Harvey-Bradshaw y la calidad de vida relacionada con la salud hasta 152 semanas de tratamiento en la población de eficacia (focalizada en actividad moderada-severa). El 60% (n775) de la población de eficacia continuaba el tratamiento. Entre los pacientes con respuesta en la semana 6 del GEMINI 2 que recibieron vedolizumab continuamente, se encontraban en remisión después de 104 y 152 semanas el 83% (n 100) y el 89% (n 70) respectivamente, de los pacientes con datos disponibles. La frecuencia de dosificación, que escaló de cada 8 semanas (GEMINI 2) a cada 4 semanas (GEMINI LTS), logró un beneficio en los pacientes que se habían retirado temprano del GEMINI 2, logrando tasas de respuesta clínica del 47% (n = 27/57) y de remisión del 32% (n = 18/57) en la semana 52 del GEMINI LTS (aumento del 39% y 4% comparado con la previa al incremento de la dosis). También se demostraron beneficios en la calidad de vida en este largo plazo. Se observaron mejoras similares independientemente de la exposición previa a anti-TNF.557
– En la CU, además del GEMINI 1, se incluyeron los pacientes de los estudios C13004 de fase 2 y una cohorte de pacientes naïve que recibió vedolizumab de manera abierta cada 4 semanas. En un análisis intermedio con datos desde 2009 hasta el 27 de junio de 2013, se evaluaron la respuesta clínica y remisión, con el score parcial de mayo y la calidad de vida relacionada con la salud hasta 152 semanas de tratamiento acumulativo en la población de eficacia (se focalizó en la CU moderada a severa). El 63% (n 532) de la población de eficacia continuaba el tratamiento. Entre los pacientes que respondieron a la inducción de vedolizumab y tenían datos disponibles, el 88% (n 136) estaban en remisión después de 104 semanas de exposición y el 96% (n 70) a 152 semanas. Entre los pacientes que se retiraron del mantenimiento de vedolizumab cada 8 semanas en el estudio GEMINI 1 (n = 32) antes de la semana 52, el aumento de la dosis a cada 4 semanas en GEMINI LTS resultó a las 52 semanas en tasas de respuesta del 41% y de remisión del 28% respectivamente, correspondiente a un aumento del 19% y 6%, comparadas con las previas respectivas antes de incrementar la dosis. Se demostraron beneficios similares independientemente de la exposición previa a anti-TNFs. También se demostraron beneficios duraderos en la calidad de vida relacionada con la salud.558
– En estudios de los mismos autores presentados como abstracts en la ECCO 2017 https://www.ecco-ibd.eu/publications/congress-abstract-s (DPO021),559 la evaluación se realizó en los respondedores que llegaron a los 5 años (61 pacientes con EC y 63 pacientes con CU), reportándose que en la CU mantuvieron respuesta el 98% y remisión el 90%.558-559
– En Crohn la respuesta fue del 95% y la remisión del 89%.559
· Resultados de cicatrización de la mucosa en EC: se reportó que entre 68 pacientes tratados por más de un año y monitoreados endoscópicamente, la cicatrización ocurrió en el 29% en EC y el 50% en la CU.560
V. Estudios de seguridad: datos relevantes.
· Se publicaron los datos integrados de seis ensayos de vedolizumab (pacientes con ≥ 1 dosis de vedolizumab o placebo, tratados entre mayo de 2009 a junio de 2013), incluyendo 2830 pacientes (4811 pacientes-año de exposición a vedolizumab: 1-1977 días). Esta publicación, que incluye numerosos pacientes, informó un buen perfil de seguridad. La exposición a vedolizumab no se asoció con un mayor riesgo de infecciones o de infecciones graves u oportunistas (Clostridium, sepsis y tuberculosis fueron reportadas en tasas ≤ 0,6% de los pacientes).
Las infecciones entéricas y eventos autoinmunes se presentaron con frecuencia escasa, y adicionalmente, las reacciones de infusión se han reportaron en tasas menores al 5%.
No se reportaron casos de leucoencefalopatía multifocal progresiva.
La tasa de malignidad (diagnosticada en 0,1/100 personas-años de los expuestos) fue similar a la observada habitualmente en pacientes con EII.
El mencionado estudio concluye que el vedolizumab tiene un perfil de seguridad favorable, mostrando una frecuencia de eventos adversos similar al placebo y habiéndose observado una baja incidencia de infecciones graves, reacciones de infusión y tumores malignos durante un período de tratamiento prolongado.561
Se postula que este tratamiento podría ser de elección en quienes tienen comorbilidades o edad avanzada. Al respecto, se ha investigado la eficacia y la seguridad de vedolizumab en pacientes estratificados por edad a partir de los ensayos GEMINI, estudiados post hoc en pacientes agrupados en < 35, de 35 a < 55 y ≥ 55 años, correspondiendo a tales grupos 353, 412 y 130 pacientes con CU y 582, 443 y 90 pacientes con EC respectivamente. De estos pacientes, 56 tenían una edad ≥ 65 años (CU: n = 33, EC: n = 23). Con respecto a los criterios de valoración de eficacia, los datos que favorecen el vedolizumab sobre el placebo se observaron para la mayoría de las variables, independientemente de la edad del paciente. Los perfiles de seguridad del vedolizumab y placebo fueron similares en todos los grupos de edad. Los pacientes tratados con vedolizumab de edad ≥ 55 años tuvieron la incidencia más baja de infecciones graves (0,9 por 100 años-persona) y de eventos adversos que condujeron a la hospitalización (14,8 por 100 pacientes-años). No hubo diferencias relacionadas con la edad en la incidencia de eventos hematológicos adversos, malignidad o muerte, si bien el número de pacientes en el grupo de mayor edad en estos análisis fue pequeño.562
Similar experiencia describe navaneethan U y col. en una editorial de la revista Inflammatory Bowel Disease también con una muestra pequeña.563
· Travis y col. estudiaron la experiencia de seguridad poscomercialización de vedolizumab en pacientes mayores con enfermedad inflamatoria intestinal. Solo el 3% de los pacientes en los ensayos pivotales de vedolizumab tenían entre 65 y 80 años y los pacientes mayores de 80 años, fueron excluidos. Se analizaron los datos de seguridad posteriores a la comercialización para investigar si los pacientes mayores informaban un perfil de seguridad diferente con vedolizumab en comparación con los pacientes más jóvenes, tomando la base de datos de seguridad global de vedolizumab hasta mayo de 2017.
Se calcularon las frecuencias de efectos adversos para pacientes ≥ 65 años (mayores) y < 65 años (más jóvenes). De un estimado de 114.071 pacientes-años de exposición a vedolizumab después de la comercialización, 1927 pacientes eran mayores y 12.164 pacientes eran más jóvenes. En los grupos de mayores y más jóvenes, respectivamente, el 51% y el 61% de los pacientes informaron exposición previa o concomitante a anti-TNFs , el 43% y 40% a corticosteroides concomitantes, y el 17% y 21% a un inmunomodulador concomitante. El número global de eventos adversos no serios fue similar en ambos grupos (83 y 88 %).
Cuatro de los cinco efectos adversos no serios más comunes fueron compartidos por ambos grupos de edad: fatiga, aumento de la presión arterial, artralgia y cefalea. Respecto del quinto evento adverso, la diarrea fue observada más comúnmente en el grupo de mayor edad, y la exacerbación de CU en el grupo más joven.
Se reportaron efectos adversos serios en el 17% de los mayores y el 12% de los más jóvenes. Los eventos adversos serios más habitualmente experimentados por el grupo de mayor edad fueron los eventos más frecuentemente esperados en ese grupo de edad.
La mayoría de los pacientes que informaron evento adverso (76%) continuó el tratamiento. Cabe señalar que los autores reportan limitaciones en esta información de seguridad posterior a la comercialización, incluidos datos incompletos, informes voluntarios y la dificultad para establecer una relación causal entre el medicamento y el evento, que debe tenerse en cuenta al interpretar estos resultados.564
VI. Estudios recientes de eficacia y seguridad (VARSITY y VICTORY)
· El ensayo clínico VARSITY compara la eficacia y seguridad del tratamiento con vedolizumab y adalimumab durante 52 semanas en adultos con colitis ulcerosa de actividad moderada a severa. Este fue un ensayo de fase 3b, doble ciego, doble simulado, multicéntrico, con comparador activo que incluyó a pacientes con score de Mayo 6 a 12 y endoscópico ≥ 2, que habían fallado a otras terapias convencionales. La exposición previa al Anti-TNFs se limitó al 25%. Los pacientes fueron asignaron al azar 1: 1 a: 1) infusiones activas de vedolizumab intravenoso (300 mg) + placebo (inyecciones subcutáneas (SC); o 2) infusiones de placebo IV + inyecciones activas de adalimumab SC (160/80/40 mg). El mantenimiento fue el estándar, sin escalamiento de dosis. El criterio de valoración principal fue la remisión clínica (Mayo total ≤2 en la semana 52). Se incluyeron 769 pacientes: vedolizumab (n = 383) o adalimumab (n = 386). En la semana 52, vedolizumab mostró tasas significativamente mejores de remisión clínica (punto final primario) y curación de la mucosa. Las tasas de remisión clínica en la semana 52 fueron para vedolizumab 31,3% para vedolizumab y del 22,5% para adalimumab (p = 0,0061). La curación de la mucosa (subscore Mayo ≤1) en la semana 52 se logró en el 39,7% (n = 152/383) de los pacientes tratados con vedolizumab y en el 27,7% (n = 107/386) de los pacientes tratados con adalimumab (p = 0,0005). Las tasas de remisión sin corticosteroides en la semana 52 mostraron una diferencia numérica no significativa a favor del adalimumab. No hubo diferencia en los efectos adversos. Las reacciones adversas graves se produjeron en el 11,0% y el 13,7% de los pacientes tratados con vedolizumab y adalimumab, respectivamente y las tasas de infección ajustadas a la exposición fueron del 33,5% y del 43,5% en los pacientes tratados con vedolizumab y adalimumab. 565
· Los estudios VICTORY, fueron estudios de vida real realizados en ambas EII.
VICTORY (en la CU): estudio de vida real realizado con el objetivo de cuantificar la seguridad y efectividad de vedoizumab en CU e identificar predictores de respuesta al tratamiento.
Fue una revisión retrospectiva (mayo de 2014 a diciembre de 2016) de los datos del Consorcio VICTORY (10 centros de EE.UU.). Se incluyeron pacientes con CU clínicamente activa. Se evaluaron como eficacia primaria las tasas acumulativas de remisión clínica (resolución de todos los síntomas relacionados con CU) y remisión endoscópica (subscore endoscópico Mayo score 0). Resultados clave de eficacia secundaria: tasas acumuladas de remisión libre de corticosteroides y remisión profunda (remisión clínica y remisión endoscópica). Se utilizó regresión Cox para identificar predictores de la efectividad del tratamiento. Los resultados de efectividad se analizaron con con el criterio “no responder imputation”(NRI). Los resultados clave de seguridad fueron las tasas de infección grave, SAE, y colectomía. Se incluyeron 321 pacientes con CU (71% con previa exposición a anti-TNFs, mediana de seguimiento 10 meses). La mayoría de los pacientes tenían enfermedad de moderada a severa, con un 34% de los pacientes con enfermedad severa al inicio del estudio. Al inicio del tratamiento tenían pancolitis se presentó el 56% de los pacientes. Las tasas acumuladas de remisión clínica y remisión endoscópica a 12 meses fueron del 51% y del 41% respectivamente, y las de remisión libre de corticosteroides y la remisión profunda del 37% y 30% respectivamente. Usando NRI, las tasas de 12 meses fueron del 20% (n = 64/321) para la remisión clínica, 17% (n = 35/203) para la remisión endoscópica, 15% (n = 30/195) para la remisión sin corticosteroides, y 14% (n = 28/203) para remisión profunda. Cabe señalar que una mayoría de los pacientes sin seguimiento que a los 12 meses se consideraron no respondedores analizados por NRI previamente a los 12 meses habían logrado la remisión clínica (n = 70) o una respuesta clínica significativa (n = 36). Discontinuaron el vedolizumab antes de los 12 meses en 91 pacientes, por falta de respuesta (n = 56), necesidad de cirugía (n = 29), o evento adverso (n = 6). En los análisis multivariados, la exposición previa a anti-TNFs se asoció con una probabilidad reducida de lograr una remisión clínica (HR 0,53; IC del 95%: 0,38 a 0,75) y remisión endoscópica (HR 0,51; IC del 95%: 0,29 a 0,88). Los eventos adversos graves e infecciones graves, se reportaron en el 6% y 4% de los pacientes respectivamente. Las tasas acumuladas globales de colectomía más allá 12 los meses fueron del 13%, menores en anti-TNFs naïve (2%) versus los expuestos. Conclusión: en esta gran cohorte del mundo real, se observó que el vedolizumab fue bien tolerado y eficaz en el logro de resultados clínicos clave.566
· VICTORY (en la EC): también en esta enfermedad se llevó a cabo como un estudio de vida real de cohorte retrospectivo multicéntrico desarrollado en EE.UU. (mayo 2014 – diciembre 2015) que investigó la eficacia y seguridad, y cuyos objetivos primarios fueron evaluar factores predictivos de remisión clínica y cicatrización de la mucosa, en pacientes con EC moderada a severa tratados con vedolizumab.
Los objetivos secundarios fueron evaluar la remisión profunda (remisión clínica y curación de la mucosa), y por PGA (Physician Global Assessment) la respuesta (reducción de > 50% de la actividad o la gravedad de los síntomas) o la remisión (completa resolución). Además, se investigaron la remisión profunda, la respuesta libre de corticoides, el intervalo para escalamiento de dosis de VDZ por pérdida de respuesta o remisión, y adicionalmente la progresión a cirugía, complicaciones o muerte por agravamiento de la enfermedad. Se incluyeron 212 pacientes, el 90% expuestos a anti-TNF, durante un seguimiento de 39 semanas (25-53). Los objetivos primarios del estudio fueron evaluar predictores independientes de remisión clínica (resolución completa de los síntomas) y curación de la mucosa (ausencia de úlceras y erosiones con curación radiológica de la mucosa). Las proporciones acumuladas de remisión clínica, curación de la mucosa y remisión profunda a 6 meses fueron del 18%, 20% y 14%, y a 12 meses del 35%, 63% y 26% respectivamente. El tiempo en lograr la remisión clínica (mediana) fue de 25 semanas (rango: 14 – 35), y la cicatrización de la mucosa se logró en 33 semanas (rango: 21-41). La respuesta clínica a la semana 6 fue del 40,6%, la respuesta libre de esteroides del 22% y la remisión libre de esteroides del 8,6%. Las tasas acumulativas de los mismos parámetros (respuesta libre de esteroides y remisión libre de esteroides) a 6 meses fueron del 32%, 26% y 18%, y a 12 meses del 58%, 51% y 34% respectivamente. La mediana de tiempo en lograr respuesta clínica fue de 19 semanas (rango: 10 – 38) y en alcanzar la remisión libre de corticoides, de 30 semanas (rango: 17 – 51). La intensificación del vedolizumab fue requerida en 21 pacientes (9,9%) por falta de respuesta: 1,4%, por respuesta subóptima: 4,7%, por pérdida de respuesta: 2,8%, por pérdida de remisión: 0,9%. Entre los pacientes que intensificaron la dosis por falta de respuesta o respuesta subóptima, el 30,8% lograron respuesta clínica y el 7,7% entraron en remisión. Entre los que perdieron respuesta o remisión, recuperaron la respuesta clínica el 37,5% y la remisión clínica el 12,9%. La progresión a la cirugía en 6 meses fue del 10% y a 12 meses del 23%. Los predictores negativos de respuesta clínica fueron exposición previa a anti TNFs, (HR 0,40; IC95%: 0,20 – 0,81) enfermedad severa a tiempo basal (HR 0,54; IC95%: 0,31 – 0,95), enfermedad perianal desde el inicio (HR 0,49; IC95%: 0,27 – 0,88), historia de tabaquismo: (HR 0,47; IC95%: 0,25 – 0,89). Los predictores de falta de curación mucosa fueron: exposición previa a anti-TNF: (HR 0,29; IC95%: 0,12 – 0,73) y enfermedad grave desde el inicio: (HR 0,54; IC 95%:0,31-0,95). Las complicaciones durante 160 pac./años de seguimiento en 1422 infusiones fueron: reacciones de infusión: 5 pacientes (3,5 por 1000 infusiones), infecciones graves: 21 pacientes (13 por 100 Pas), Serios Efectos Adversos: 17 pacientes (10 por 100 Pas). Una minoría requirieron interrupción de tratamiento por EA: 6 por 100 PAs. Conclusiones: 1) un porcentaje sustancial de pacientes (1/3) logran la remisión clínica, remisión libre de esteroides, curación mucosa y remisión profunda, 2) la eficacia del tratamiento depende del tiempo, observándose el mayor beneficio tras 6 meses de tratamiento, 3) factores de riesgo (enfermedad grave al inicio del tratamiento, enfermedad perianal, tabaquismo o el tratamiento previo anti-TNFa, se asociaron con una menor probabilidad de alcanzar la remisión clínica, 4) una minoría de individuos requiere la interrupción del tratamiento debido a eventos adversos.567
· Estudios adicionales con agentes anti-molécula de adhesión (biológicos y moléculas pequeñas)
Las principales líneas de investigación se resumen en una tabla (Tabla 83).
Tabla 83. Principales inhibidores de moléculas de adhesión aprobados, en ensayo y en desarrollo.
◊ Etrolizumab: es un anticuerpo monoclonal humanizado anti-molécula de adhesión dirigido selectivamente contra la integrina β7 y la E-Cadherina de la célula epitelial (responsable de retener los linfocitos en el compartimiento intraepitelial). Ello implica que tiene dos mecanismos de acción diferentes: antagoniza el egreso de los linfocitos T efectores, por bloquear la interacción entre a4β7 y MAdCAM-1 a nivel vascular, y también bloquea la interacción E-cadherin y la aEβ7 integrina (con funciones en la adhesión de los linfocitos en el compartimiento intraepitelial), por lo cual podría controlar la inflamación a nivel de la mucosa actuando en la inmunidad celular.546
Estudio EUCALYPTUS: fase 2, doble ciego, aleatorizado, controlado con placebo en pacientes con actividad moderada a severa con CU refractaria a la terapia convencional (cuantificada por el Mayo score) y extensión mayor 25 cm. (Cabe señalar que el 61% eran refractarios a anti-TNF). Los pacientes se aleatorizaron en 2 grupos definidos por la dosis de etrolizumab subcutáneo:
a) Etrolizumab: 100 mg en semana 0, 4 y 8 (o placebo administrado a la semana 2).
b) Etrolizumab: una carga de 420 mg, seguida por 300 mg de etrolizumab (en las semanas 2, 4 y 8) (o matcheo con placebo).
Se compararon los valores del Score de Mayo, con endoscopía por lectura central a la semana 10, en quienes recibieron al menos una dosis. Los pacientes aleatorizados fueron 124 (previamente excluidos aquellos pacientes con scores endoscópicos 0 o 1.
A 10 semanas la remisión (objetivo primario) en el grupo de pacientes con 100 mg (n = 39) fue del 21%, y en el grupo con carga de 420 mg seguida por 300 mg (n = 39) las tasas fueron del 10% versus placebo 0% (n = 41), demostrando ambas dosis significancia estadística (p = 0,004 y 0,048 respectivamente).
La respuesta clínica no fue significativa. Obtuvieron remisión endoscópica (definida en este estudio como score 0) más score de sangrado también cero, una pequeña proporción de pacientes con tratamiento activo (8% y 10% para las diferentes dosis) y cero, (ningún paciente) con placebo. Con esta muestra pequeña los resultados no fueron significativos, pero este fue un end point muy estricto y además se realizó con lectura endoscópica central.
La prevalencia de eventos adversos para los respectivos grupos de etrolizumab 100 mg, etrolizumab carga de 420 mg seguida de 300 mg y etrolizumab carga seguida de placebo fue: 61%, 48% y 72%, y la de eventos adversos serios: 12%, 5% y 12% respectivamente para las ramas descriptas (no hubo infecciones oportunistas serias). Comparando los tres grupos, con la dosis menor (100 mg de etrolizumab) se observaron con más frecuencia reacciones de erupción, influenza-like y artragias que con la dosis de carga seguida por 300 mg y que con el plcebo; todas ellas leves a moderadas. Respecto de la ocurrencia de reacciones en el sitio de inyección: se observaron leves reacciones en 4 pacientes con 300 mg y en 2 con placebo.
Es interesante el dato obtenido de marcadores de farmacodinamia durante el tratamiento con etrolizumab, los receptores β7 en Linfocitos T y B en sangre periférica, y los pacientes con más altos niveles de aE expresión en el tejido colónico lograron mayor remisión que aquellos con bajos niveles.568
– Estudios de fase 3 con etrolizumab:
Estudio BERGAMOT: diseñado para evaluar la seguridad y eficacia de etrolizumab en pacientes con EC moderada a severa.569
Incluye 3 cohortes de inducción y una cohorte de mantenimiento a 52 semanas. La fase de mantenimiento se diseñó con todos los respondedores a la semana 14 de tres cohortes, re-randomizados a etrolizumab (105 mg subcutáneo cada 4 semanas) o placebo.
Los siguientes son los resultados de la fase de inducción de la cohorte 1 de pacientes, que fue usada como prueba de concepto (para evaluar el rendimiento de los diseños y tamaño de muestra) con EC moderada a severa refractarios al tratamiento (un 73% eran refractarios o intolerantes a un anti-TNF).
Randomizados 300 pacientes
→ Tres ramas (duración del tratamiento: 12 semanas, seguidos a 14 semanas).
• Régimen 1: (n = 120) etrolizumab subcutáneo: 105 mg cada 4 semanas.
• Régimen 2: (n = 121) etrolizumab subcutáneo 210 mg a semanas 0, 2, 4, 8 y 12.
• Placebo (n = 59).
– Ambas dosis de etrolizumab fueron superiores en tasas de remisión dsegún criterio del CDAI en la semana 10 (22,5% y 24% vs. 10,2% en el placebo) y en la semana 14 (23,3% y 28,9% vs. 16,9% en el placebo).
– Además, el etrolizumab fue superior al placebo al mejorar las tasas de remisión valorado según criterios del PRO2, en las semanas 6, 10 y 14, pero este parámetro no logró el objetivo que había sido previsto de identificar un criterio de valoración específico que reduzca las tasas de placebo.
– La mejoría sintomática con ambas dosis fue temprana, observándose en la semana 6 (15% y 25,6% vs. placebo 8,5%) y esta mejoría se mantuvo durante la semana 14 (20,8% y 24% vs. 11,9% en el placebo).
– Ambas dosis condujeron a una mejoría endoscópica significativa, evaluada por un modelo de lectura central rigurosa (al menos mejoría del 50% desde el score inicial) en la semana 14: etrolizumab 21% y 17,4% para las respectivas dosis (frente a solo 3,4% el grupo con placebo).
– El fármaco fue bien tolerado y los eventos adversos ocurrieron en proporciones comparables en todos los grupos. La infección más común fue la nasofaringitis y se produjo con mayor frecuencia con el fármaco del estudio (6,6% frente a 3,4).569
Están en estudio los siguientes grupos:
– Cohorte 2: estudio abierto (n = 350), etrolizumab (105 mg SC cada 4 semanas o etrolizumab alta dosis (210 mg SC a semanas 0, 2, 4, 8 y 12)
– Cohorte 3: la cohorte de inducción pivotal (n = 600), en la cual recibirán placebo, etrolizumab (105 mg SC cada 4 semanas) o etrolizumab alta dosis (210 mg SC a semanas 0, 2, 4, 8, and 12) por 14 semanas.569
Los respondedores a 14 semanas de todas las cohortes serán re-randomizados para placebo o etrolizumab (105 mg SC cada 4 semanas) para mantenimiento ≥ 52 semanas.
· Estudio HICKORY
Está en curso en CU moderada a severa con falla previa a anti-TNFs.
Es un estudio fase III, multicéntrico, doble ciego, controlado con placebo que evalúa la seguridad, eficacia y tolerabilidad de etrolizumab durante la inducción (a semana 14) y el mantenimiento de la remisión (semana 66) en comparación con placebo.
Los presentes resultados son solo los de una cohorte de un estudio de inducción abierto (n = 130, 45% con falla a anti-TNFs) que se presentó.570
Este estudio evaluó la respuesta al etrolizumab a través de la endoscopía con lectura centralizada y biomarcadores inflamatorios. Todos los pacientes recibieron inducción con etrolizumab 105 mg subcutáneo cada 4 semanas durante 14 semanas.
Se evaluaron el score Mayo, la endoscopía, el sangrado rectal y la frecuencia de las deposiciones (según los criterios de PROs al tiempo basal y a semana 14. Los datos basales demostraron enfermedad considerablemente activa (Mayo score 9,4, al igual que los valores medios de dos de marcadores: CRP 6,6 g/dL, calprotectina fecal 1778).
El tratamiento con etrolizumab se asoció con respuesta clínica en el 50,8% de los pacientes, remisión en el 12,3%, score endoscópico ≤ 1 en el 23,9%, remisión del sangrado rectal en el 52,3% y remisión en cuanto a frecuencia de deposiciones en el 35,4%.
En los resultados se demostró asociación con la remisión de ambos parámetros clínicos y la mejoría endoscópica.
Mejoraron el score endoscópico ≥ 1 punto el 43,9% de los pacientes, y ello se asoció con mayores tasas de remisión del sangrado y remisión de la frecuencia de las deposiciones.
Con score endoscópico 0, 100% reportaron sangrado ≤ 1, y 90% reportaron frecuencia de deposiciones ≤ 1.
Los pacientes con cualquiera de los 2 PROs (sangrado ≤ 1, o frecuencia de deposiciones ≤ 1) demostraron una reducción del 50% en los valores medios de la PCR, y una reducción de los valores medios de calprotectina fecal > 70%.
→ El reclutamiento para HICKORY continúa en las demás cohortes planeadas:
• De inducción pivotal (n 670).
• De mantenimiento, aleatorizada, de 53 semanas (con los respondedores a 14 semanas hasta la semana 66) (n 567).
· Mecanismos adicionales anti-moléculas de adhesión (biológicos y moléculas pequeñas)
◊ PF-00547659 (también llamado HP647): es un anticuerpo monoclonal IgG2 dirigido solamente contra MAdCAM-1 en las células endoteliales, no bloquea su ligando integrina.546, 568
· Estudio TURANDOT
Fase 2, randomizado doble ciego, controlado con placebo en coltitis ulcerosa moderada a severa:
(n = 587 pacientes).571
Randomizados a:
• PF-00547659 SC administrado a tiempo basal y cada 4 sem. (dosis 7,5 mg, 22,5 mg, 75 mg o 225 mg).
• Placebo
→ Los pacientes fueron estratificados por tratamiento previo con anti-TNFs.
→ El punto final primario fue la proporción de pacientes que alcanzaron la remisión (puntaje total de Mayo ≤ 2 sin subscore > 1 y sangrado rectal ≤ 1) en la semana 12.
Las tasas de remisión fueron significativamente mayores con PF-00547659 que con placebo a la semana 12 en tres de cuatro grupos de tratamiento activo (7,5 mg, 22,5 mg, 75 mg): 11,3%, 16,7%, 15,5% versus placebo 2,7%, (p = 0,0425, 0,0099 y 0,0119 respectivamente). 570
La eficacia fue mayor en anti-TNFs naïve. Se observó mayor respuesta clínica con dosis de 22,5 mg, 75 mg y 225 mg (el cuarto grupo). Las tasas respectivas fueron del 54,2%, 45,1% y 50,0%, que versus 28,8% placebo fueron significativas (p = 0,0044, p = 0,0479, p = 0,0157 respectivamente).
Las tasas de cicatrización mucosa por lectura central ciega fueron significativas para las 4 dosis: 15,5%, 27,8%, 25,4%, 14,3% versus placebo 8,2% (p = 0,0099, p = 0,0038 p = 0,0080, p = 0,0099).571
· Estudio OPERA: incluyó 265 pacientes con EC que recibieron PF-00547659 randomizadamente subcutánea a semanas 0, 4, 8 en tres dosis diferentes con seguimiento hasta 12 semanas 22,5 mg, 75 mg o 225 mg o placebo por 12 semanas con evaluación HBI (descenso de 70 puntos).
Se observó alta respuesta placebo y no se cumplió el objetivo primario. Sin embargo, se demostró un descenso de PCR y un incremento farmacológico dosis-relacionado de linfocitos T â7+.572
· Estudio OPERA II: los 149 que completaron el estudio OPERA I y tuvieron una respuesta clínica (disminución ≥ 3 puntos del HBI en un estudio abierto TOSCA, NCT01387594) recibieron PF-00547659 (75 mg, s.c.) cada 4 semanas desde el inicio hasta la semana 72, con seguimiento mensual durante otros 6 meses, y posible reducción de la dosis a 22,5 mg debido a intolerancia/eventos adversos, o escalamiento a 225 mg por no respuesta.
– Los EA más frecuentes relacionados con el tratamiento durante el tratamiento fueron nasofaringitis (5,6%), artralgia (6,0%) y cefalea (5,2%). Ningún paciente experimentó leucoencefalopatía multifocal progresiva. Los SAE que se consideraron relacionados con el tratamiento se observaron en 10 pacientes. Entre los pacientes que tuvieron eventos adversos que llevaron a la interrupción (n = 54), el EA más común fue la actividad de la EC. Hubo 2 muertes no relacionadas. Las tasas de remisión y respuesta de HBI fueron bastantes estables a lo largo de 72 semanas.373
◊ AMG 181 o MEDI7183 (Abrilumab) es un anticuerpo monoclonal IgG2, anti-a4β7 humano, que al igual que vedolizumab, se liga a a4β7, pero no a4β1, por lo que inhibe la ligadura de a4β7-MAdCAM-1.
El abrilumab ha demostrado eficacia para pacientes con CU en un estudio de inducción multidosis fase 2b (n 354 pacientes) aleatorizados para recibir:
• Abrilumab subcutáneo 7, 21 o 70 mg el día 1, semana 2 y 4, y luego cada 4 semanas.
• Abrilumab subcutáneo 210 mg el día 1.
• Placebo a equivalentes tiempos.
El punto final primario fue la remisión en la semana 8 (Tabla 83). Los objetivos secundarios en el mismo punto de tiempo fueron la respuesta y la curación de la mucosa.
En la semana 8, las tasas de remisión con las 2 dosis más altas de abrilumab mostraron una diferencia significativas en comparación con el placebo (4,3%). Las tasa de remisón para abrilumab 70 mg (n 98) fueron 13,3%, (OR 3,35; 90% IC 1,41-7,95, P = 0,021); para 210 mg 12,7% (n79) (OR 2,57; 90% CI 1.53–4.51; P =0,03). La respuesta observada versus placebo (25,9%) para abrilumab 70 mg fue 49% (OR 2,78; 90% IC 1,71–4,52; P < 0,001) y para 210 mg 46,8 % (OR 2,57; 90% CI 1.53–4.51; P =0,003). Las tasas de cicatrización mucosa fueron: 21,6% con placebo 32,7% y 29% con las dosis altas de abrilumab (para 70 mg: OR 2,34; 90% CI 1,35–4,07; P = 0,011 y para 210 mg: OR 2,10; 90% CI 1,15–3,82; P 0=0,041).
Las tasas más altas de remisión y respuesta con abralimumab ocurrieron diferente a lo habitual particularmente en pacientes con falla previa de antagonistas de TNF con 210 mg de abrilumab. Se observaron más altos niveles basales de integrina a4β7+, en células T naive fueron pronósticos. Los eventos adversos fueron similares entre los grupos de tratamiento hasta la semana 24, sin casos de PML o muertes. Ningún paciente desarrolló anticuerpos neutralizantes contra abrilumab. Se realizó continuidad del tratamiento con seguimiento a 24 semanas (administrado cada 4 semanas), que demostró una tendencia no clara a mantener la mejoría (la extensión incluyó a respondedores y no respondedores) y un estudio abierto a 108 semanas. Se publicaron recientemente los resultados hasta 24 semanas. 574
· En pacientes con enfermedad de Crohn se presento un estudio, fase 2b, donde abrilumab no fue superior al placebo para inducir la remisión clínica en la semana 8, pero en la semana 12 demostró una ventaja numérica sobre el placebo en términos de respuesta clínica y remisión, sobre todo para pacientes previamente expuestos a anti TNF-a 575 La empresa patrocinante decidió discontinuar los estudios.575, 577
◊ AMJ 300: es otro fármaco en desarrollo clínico que se dirige a un componente de la familia de integrinas. Similarmente al natalizumab, se une a la subunidad á4, inhibiendo las interacciones de a4β1 con VCAM-1 y a4β7 con MAdCAM-1, teniendo alta afinidad para ambas integrinas. Sin embargo, a diferencia del natalizumab, no es un anticuerpo monoclonal, sino una molécula pequeña, adecuada para la administración oral. Esta molécula deriva de la fenilalanina y parece ser una prodroga, que se convierte en un metabolito activo. Mostró eficacia en modelos murino de colitis.547, 576
AJM300 ha mostrado algunas evidencias de eficacia y seguridad en pacientes con CU y EC en estudios de fase 2 de inducción.
En lo que respecta a CU, Yoshimura y col. aleatorizaron 102 pacientes con enfermedad activa moderada a severa a pesar del tratamiento con mesalamina o esteroides, sin tratamiento previo con fármacos inmunosupresores o anti TNFs. 576
Duración 8 semanas. Ramas:
• AJM300 (960 mg) tres veces al día
• Un placebo equivalente.
AJM300 mostró una respuesta clínica significativamente más alta en la semana 8 en comparación con el placebo (62,7 y 25,5% respectivamente, p = 0,0002).
En el mismo punto de tiempo, hubo diferencias significativas con respecto al placebo en términos de remisión clínica y cicatrización de la mucosa/ remisión (23,5% y 3,9%; p = 0,0099) y cicatrización de la mucosa (58,8% y 29,4%, p = 0,0014).
Con respecto a la EC, 71 pacientes con enfermedad activa fueron aleatorizados para recibir AJM300 en tres dosis diferentes (40, 120 y 240 mg) tres veces al día o placebo. El punto final primario fue la respuesta clínica evaluada por la disminución de la media del CDAI desde el inicio hasta la semana 4 o posterior. No se encontraron diferencias en términos de respuesta clínica entre los pacientes en cualquiera de los grupos activos y los pacientes en el grupo placebo.547
◊ CCX282-B (Vercinon, Traficet): no es un biológico sino una pequeña molécula, de las cuales hablaremos más extensamente. Es biodisponible oralmente y bloquea selectivamente al receptor CCR9 humano impidiendo la interacción complejo receptor de quimioquinas CCL25–CCR9.
CCR9: es un receptor de quimioquinas expresada en los linfocitos de la circulación, que junto con las moléculas de adhesión, son necesarios para la migración de las células T al tracto GI.546 El vercinon demostró beneficios en modelos animales de EII.577
Se realizó un estudio multicéntrico, doble ciego, controlado con placebo, fase 2 llamado PROTECT-1, en el que se incluyeron 436 pacientes con EC, con CDAI entre 250-450 y proteína C reactiva > 7,5 mg. Los pacientes recibieron placebo o CCX282-B oral (250 mg una vez al día, 250 mg dos veces al día o 500 mg una vez al día) durante 12 semanas (período de inducción).578
Posteriormente, recibieron 250 mg de CCX282-B dos veces al día, en forma abierta, hasta la semana 16.
Los sujetos que tuvieron respuesta clínica (descenso ≥70 puntos en CDAI) en la semana 16 fueron asignados aleatoriamente a grupos que recibieron placebo o CCX282-B (250 mg 1 vez al día, 250 mg dos veces al día o 500 mg 1 vez al día) durante adicionales 36 semanas. Los puntos finales primarios fueron la respuesta clínica en la semana 8 y la respuesta clínica sostenida en la semana 52 (considerada desde el inicio).
Las tasas de respuesta en la semana 8 fueron similares entre los grupos. En la semana 12, fueron del 47%, 56% (OR = 1,44, p=0,168), 49% (OR=1,07, p=0,792) y 61% (OR=1,74; p=0,039), respectivamente, siendo sólo estadísticamente significativo el tratamiento con 500 mg una vez al día.578
Sin embargo, en la semana 52, el 47% de los sujetos bajo CCX282-B estaban en remisión, en comparación con el 31% tratado con placebo (OR = 2,01, p = 0,012). La droga fue bien tolerada.578
Luego se evaluó CCX282-B en sujetos adultos con EC moderada a severamente activa a través de un estudio aleatorizado, doble ciego, controlado con placebo de fase 3 para evaluar la eficacia y la seguridad de dos dosis (500 mg una vez al día y 500 mg dos veces al día) de la droga en comparación con el placebo hasta las 12 semanas. El programa de desarrollo se discontinuó por no cumplir el objetivo primario.546
◊ Eldelumab (BMS-936557) anti-CXCL10.
CXCL10 es una quimioquina que desempeña un papel importante en la activación y migración de integrinas de las células proinflamatorias. También se la conoce como interferón-γ-inducible protein-10 (IP-10). El receptor para IP-10 es la quimioquina (cys-x- cys motif) receptor 3 (CXCR3). Eldelumab es un anticuerpo monoclonal completamente humano que se une a IP-10 con alta afinidad y específicamente bloquea su interacción con CXCR3.579
Se realizó un estudio de 8 semanas, fase II, doble ciego, multicéntrico, aleatorizado, en el que los pacientes con CU activa recibieron placebo o 10 mg/kg de eldemumab por vía intravenosa cada dos semanas.
El punto final primario fue la tasa de respuesta clínica en el día 57, los puntos finales secundarios fueron la remisión clínica y curación de la mucosa.
Se incluyeron 109 pacientes (eldelumab: n = 55, placebo: n = 54). La tasa de respuesta clínica en el día 57 fue del 52,7% para eldelumab versus 35,2% para placebo (p = 0,083), la remisión clínica del 18,2% versus 16,7% (p = 1,00) y la curación de la mucosa del 41,8% versus 35,2% (p = 0,556), respectivamente.
Si bien no se cumplieron objetivos primarios y secundarios, una mayor exposición al fármaco (concentración de droga) se correlacionó con el aumento de la respuesta clínica (87,5% frente a 37,0% [(p < 0,001] y la mejoría histológica (73,0% vs. 41,0%; p = 0,004).579
Como se justificaban más ensayos de dosis-respuesta, se realizó un estudio de inducción en 252 pacientes con CU randomizados a placebo o eldelumab 15 o 25 mg/kg IV en días 1 y 8 y luego cada 2 semanas, de 11 semanas de duración.580 En el estudio no se logró remisión clínica significativamente más alta con eldelumab versus placebo. Las tasas de remisión y respuesta fueron de 1,6% y 47,1% con eldelumab 25 mg/kg, 13,1% y 44,0% con eldelumab 15 mg/kg, y 9,6% y 31,3% con placebo.
Sin embargo, en los resultados se observó una tendencia constante que sugiere actividad del eldelumab, medida por la respuesta clínica en la semana 11, la calidad de vida y la reducción de los niveles de calprotectina fecal, aunque hubo inconsistencias entre los parámetros farmacocinéticos. La respuesta fue mayor en los subgrupos de pacientes que no tenían tratamiento previo anti-TNF.
Se realizó otro ensayo aleatorizado, controlado con placebo para evaluar la seguridad y eficacia de CCX282-B en 436 pacientes con EC, CDAI de 250-450 y proteína C-reactiva > 7,5 mg al ingresar al estudio.
Los pacientes recibieron placebo o CCX282-B (250 mg una vez al día, 250 mg dos veces al día o 500 mg una vez al día) durante 12 semanas.
Luego recibieron 250 mg de CCX282-B dos veces al día, de forma abierta, hasta la semana 16.
Los que tuvieron una respuesta clínica (una caída de ≥ 70 puntos en CDAI) en la semana 16 fueron asignados aleatoriamente a grupos que recibieron placebo o CCX282-B (250 mg, dos veces al día) durante 36 semanas.
Los puntos finales primarios fueron la respuesta clínica en la semana 8 y la respuesta clínica sostenida en la semana 52.
Durante el período de inducción de 12 semanas, la respuesta clínica fue más alta en el grupo que recibió 500 mg de CCX282-B una vez al día.
Las tasas de respuesta en la semana 8 fueron del 49% en el grupo placebo, 52% en el grupo que recibió 250 mg de CCX282-B una vez al día (odds ratio [OR] = 1,12, p = 0,667 vs. placebo), 48% en el grupo tratado con CCX282-B 250 mg dos veces al día (OR = 0,95; p = 0,833) y 60% en el grupo que recibió 500 mg de CCX282-B una vez al día (OR = 1,53; p = 0,111).
En la semana 12, las tasas de respuesta fueron del 47%, 56% (OR = 1,44; p = 0,168), 49% (OR = 1,07, p = 0,792) y 61% (OR = 1,74; p = 0,039) respectivamente, siendo estadísticamente significativo el tratamiento con 500 mg una vez al día.
Es también positivo que al final del período de mantenimiento (semana 52), el 47% de los sujetos en CCX282-B estaban en remisión, en comparación con el 31% con placebo (OR = 2,01; p = 0,012).
Este tratamiento con CCX282-B fue bien tolerado. Debido a que no se alcanzó el objetivo primario, el programa de investigación con esta droga fue discontinuado.579
◊ Alicaforsen (ISIS 2302, ISIS Pharmaceuticals) es un oligonucleótido antisentido de ICAM-1 de 20 bases que reduce específicamente la expresión de ARNm y proteína de ICAM-1. Los estudios en Crohn fueron controvertidos. Fue positivo un estudio de 20 pacientes con alicaforsen administrado en 13 infusiones durante 26 días (alicaforsen 47% vs. placebo 20%). Al final del sexto mes, 5 de estos 7 respondedores tratados con ISIS 2302 seguían en remisión y un sexto paciente tenía un CDAI de 156.
El uso de corticosteroides fue significativamente menor (p = 0,0001) en los pacientes tratados con ISIS 2302.588 En otros dos estudios multicéntricos con cohortes más grandes, los resultados fueron negativos. Sin embargo, en uno de ellos, la remisión libre de esteroides estuvo altamente correlacionada con la exposición al fármaco (p = 0,0064).546
En la CU, Van Deventer y col. evaluaron la seguridad y la eficacia de una formulación de enema de alicaforsen en fase 2 aleatorizado, controlado con placebo, doble ciego, dosis creciente, en 40 pacientes con CU distal leve a moderadamente activa. Los pacientes fueron asignados a cuatro cohortes de dosificación de 10 pacientes cada uno (ocho activos, dos placebos). Cada paciente recibió 60 ml de enema de alicaforsen (con 0, 1, 0, 5, 2 o 4 mg/ml de alicaforsen o placebo) una vez al día durante 28 días consecutivos.
Al día 29 del estudio, se observó una mejoría dependiente de la dosis en el índice de actividad (p = 0,003), que con la administración de 4 mg/ml logro un 70% de mejoría en comparación con una respuesta al placebo del 28% (p = 0,004). A 3 meses 2 y 4 mg/ml habían mejorado el índice DAI 72% y 68% vs. 11,5% del placebo (p = 0,016 y 0,021 respectivamente). Los pacientes que recibieron 4 mg/ml no requirieron medicación adicional ni cirugía a 6 meses (comparado con la mitad de los tratados con placebo) y no se identificaron problemas importantes de seguridad.546
El alicaforsen ha mostrado datos contradictorios para pacientes con EC, y resultados prometedores en pacientes con CU, aunque se necesitan estudios con un mayor número de pacientes.
b. Bloqueo de interleuquina 12/23 (unidad P40).
Una estrategia que ya se está usando es el bloqueo de citoquinas diferentes al TNF. El bloqueo de las interleuquinas 12 y 23 a través de la subunidad p40, mecanismo de acción del Ustekinumab, demostró eficacia en la EC. Señalamos que en ensayo clínico el bloqueo de la IL-23 solamente.
Estos biológicos tienen su blanco en subunidades de los receptores de las mencionadas citoquinas. (Figura 27). También se están desarrollando biológicos que bloquen otras citoquinas, como los la anti-interleuquina 6. (Tablas 84,85,86)
Tabla 84. Ustekinumab. Estudios de inducción fase III.
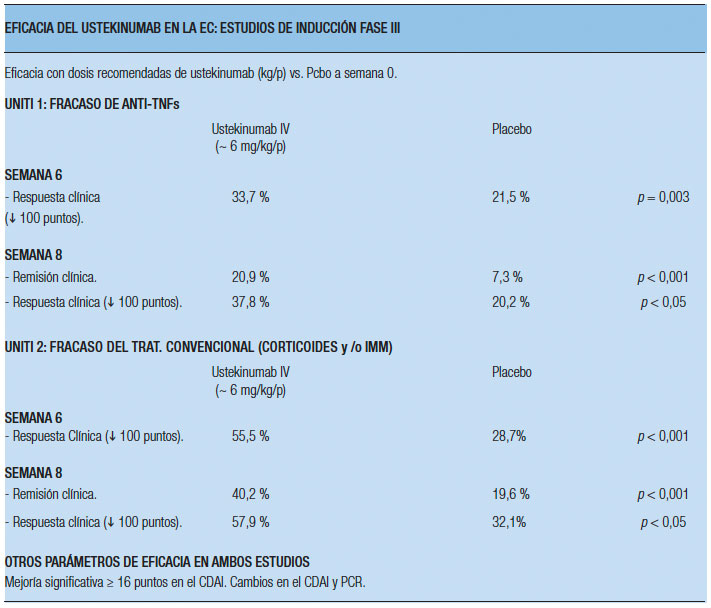
Tabla 85. Ustekinumab. Estudios de mantenimiento fase III.
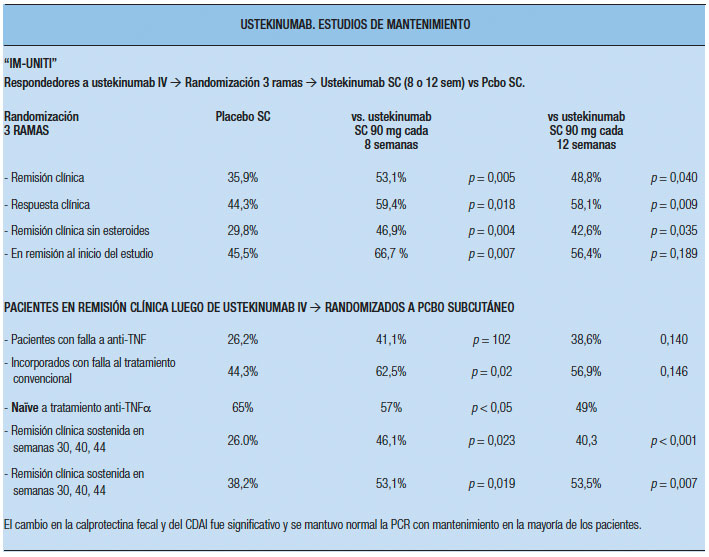
Tabla 86. Principales nuevos biológicos anti-citoquinas (uso actual internacional o potencial).
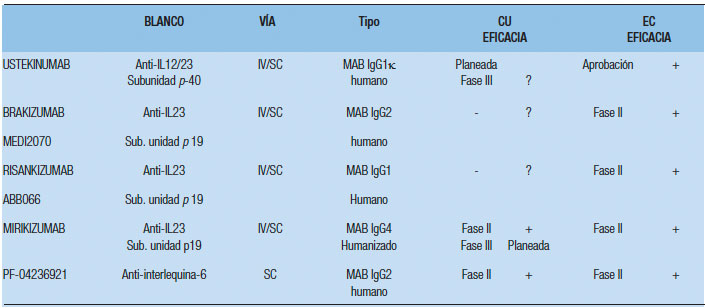
◊ Ustekinumab anti-interleuquina 12/23: (Stelara®) es un anticuerpo monoclonal IgG1κ humano que está dirigido contra la subunidad proteica p40 la cual es compartida por las interleukinas (IL) 12 e IL23.581 La IL-12 es un heterodímero compuesto por las subunidades p40 y p35, que induce diferenciación de células T CD4+ naïve a linfocitos Th1, que producen interferón-γ y media inmunidad celular. La IL-23 es un heterodímero formado por la misma subunidad p40 y subunidad p19, que induce células T CD4 naïve TH17, con producción de IL-17, IL-17F, IL-6, y TNFα para mediar inmunidad celular. El receptor β1 de lL-12 (IL12Rβ1) que se expresa en células T activadas, células B, células NK, células presentadoras de antígeno y macrófagos, es una subunidad común a los complejos receptores tanto de la IL-12 (junto con IL-12Rβ2) como de la IL-23 (junto con IL-23R). En condiciones homeostáticas normales en la mucosa intestinal hay un equilibrio entre Th1, Th2, Th17 y células T reguladoras, que se altera en la enfermedad inflamatoria intestinal. La IL-12 induce respuesta Th1 y la IL-23, TGF-β e IL-6 inducen respuesta Th17.581 El ustekinumab, al bloquear la ligadura de IL-12/IL-23 con el receptor IL-12Rß1, inhibe la señalización, la activación celular y producción de citoquinas mediadas por IL-12 e IL-23, lo que lograría restablecer la homeostasis en condiciones inflamatorias.5801Su empleo demostró efectividad en modelos de colitis. La sobrexpresión de estas citoquinas en tejidos y estudios de genoma wide scan sugieren que existiría una asociación patogénica. El ustekinumab se comenzó a comercializar por demostrar eficacia para el tratamiento de la psoriasis moderada a severa y artritis psoriásica, artritis reumatoidea juvenil, y espondilitis anquilosante.
· Estudio ABERRA: de fase IIa, de inducción multicéntrico, doble ciego, cruzado, que se desarrolló entre el año 2004 a 2006 en la EC moderada a severa. Este grupo, que se identifica como la población 1 fue de 104 pacientes con EC de moderada a severa.581 El diseño consistió en:
1) Ustekinumab subcutáneo (90 mg cada semana, administrado en las semanas 0 a 3) seguido por placebo subcutáneo (semanas 8 a 11), o viceversa, empezando por placebo seguido de ustekinumab en tiempos y dosis similares (n = 25 y n = 26 pacientes respectivamente).
2) Ustekinumab intravenoso 4,5 mg/kg en el tiempo basal (semana 0) seguido por placebo IV en la semana 8 o viceversa (n = 27 y n = 26 pacientes respectivamente).581
Las tasas de respuesta clínica fueron significativamente mayores entre los pacientes que recibieron ustekinumab (endovenoso o subcutáneo) que entre los que recibieron placebo (53% vs. 30%, p < 0,02 y 0,019) en las semanas 4 y 6 respectivamente, pero no hubo diferencia en la semana 8.
– Además, se realizó un estudio abierto en 27 pacientes que fracasaron en un tratamiento previo (falla primaria o secundaria) con agentes anti-TNF (grupo identificado como población 2). En esta última población se evaluó la efectividad de 4 inyecciones subcutáneas semanales de 90 mg o 1 infusión intravenosa de ustekinumab 4,5 mg en 27 pacientes, resultando que las tasas de respuesta clínica a ustekinumab a la semana 6 fueron mayores en el grupo con administración endovenosa (62%) que en el grupo con administración subcutánea (36%).581
I. Eficacia del Ustekinumab en la EC
· Estudio CERTIFI, de fase IIb, en el que se evaluó el ustekinumab en adultos con EC moderada a severa resistente al tratamiento anti-TNF en una población considerable de pacientes en cuanto al tamaño muestral. Durante la inducción, 526 pacientes fueron asignados aleatoriamente para recibir ustekinumab intravenoso (a una dosis de 1, 3 o 6 mg por kilogramo de peso corporal) o placebo en la semana 0.582
Durante la fase de mantenimiento, 145 pacientes que tuvieron una respuesta a ustekinumab a la semana 6, se re-randomizaron a inyecciones subcutáneas de ustekinumab (90 mg) o placebo en las semanas 8 y 16.
Los pacientes con ustekinumab lograron una diferencia significativa en la respuesta clínica a las 6 semanas (36,6%, 34,1% y placebo 39,7% con 1, 3 y 6 mg/kg de ustekinumab respectivamente) en comparación con 23,5% para el placebo (p = 0,005 para la comparación con el grupo de 6 mg, que es la mayor dosis). Si bien la tasa de remisión clínica con la dosis de 6 mg no difirió significativamente con el placebo a las 6 semanas, la terapia de mantenimiento con ustekinumab, a las 22 semanas, en comparación con placebo, mostró un efecto favorable, significativo de remisión clínica (41,7% vs. 27,4%, p = 0,03) y respuesta (69,4% vs. 42,5%, p < 0,001).582 Ello sustentó proseguir con la investigación.
· Los estudios en fase 3 en EC fueron los UNITI-1 y UNITI 2 y IM-UNITI.583
· UNITI-1 y UNITI-2: fueron estudios de inducción de 8 semanas de duración.
· UNITI-1: estudió la respuesta, en 741 pacientes con fracaso del tratamiento con anti-TNF.
· UNITI-2: incluyó 628 pacientes con fracaso al tratamiento convencional (corticosteriodes y/o inmunomoduladores).583
En ambos estudios de inducción los pacientes fueron aleatorizados en 3 ramas: administración de una dosis intravenosa única de ustekinumab: (a) 130 mg, (b) 6 mg/kg/p, o (c) placebo.583
· IM-UNITI: estudio de mantenimiento, en el que los pacientes de los mencionados estudios de inducción UNITI-1 y UNITI-2 que tuvieron respuesta al ustekinumab en la semana 8 fueron re-randomizados con seguimiento hasta la semana 44, con una extensión del estudio adicional planeada a 4 años.582
Esta re-randomización, realizada cuando los respondedores al ustekinumab a la semana 8 del UNITI -1 y UNITI-2 (n = 397) pasaron al IM-UNITI consistió en 3 ramas “ mantenimiento subcutáneo con inyecciones de 90 mg de ustekinumab: (a) cada 8 semanas, o (b) cada 12 semanas) o (c) placebo subcutáneo.
Los pacientes provenientes de la población de inducción NO respondedora al ustekinumab (n 476) “ fueron tratados con ustekinumab 90 mg cada 8 semanas y si no respondían se suspendía la droga.
Los pacientes que habían sido tratados con placebo IV en la primera randomización de los estudios de inducción:
1) Si habían respondido al placebo “ seguían con placebo
2) Si no habían respondido al placebo “ se indicaba ustekinumab, 1 infusión de 130 mg IV/kg y en ellos, a las 8 semanas se evaluaba la respuesta:
a) si respondían “ continuaban con 90 mg subcutáneos cada 12 semanas.
b) si no respondían “ se suspendía el tratamiento.
El “punto final primario” para los ensayos de inducción fue respuesta clínica en la semana 6 (caída ≥ 100 del CDAI).
El “punto final primario” para el estudio de mantenimiento fue la remisión en la semana 44, pero también se realizó a posteriori un estudio de extensión (LTE) a 4 años. Las tasas de respuesta en la semana 6 en los estudios de inducción (objetivo primario) entre los pacientes que recibieron ustekinumab intravenoso en una dosis fija de 130 mg, o en dosis de 6 mg por kilogramo de peso, fueron significativamente mayores que las tasas entre los pacientes que recibieron ustekinumab versus los que recibieron placebo.
· En el UNITI-1 fueron: 34,3%, 33,7% vs. 21,5% respectivamente (p ≤ 0,003 para ambas dosis vs. placebo).
– En el UNITI-2 fueron: 51,7%, 55,5% vs. 28,7% respectivamente (p < 0,001 para ambas dosis vs. placebo).
Tasas de remisión en la semana 8. En los estudios de inducción, el objetivo secundario principal entre los pacientes que recibieron ustekinumab intravenoso en una dosis fija de 130 mg, o en dosis de 6 mg por kilogramo de peso, fueron significativamente mayores que las tasas observadas entre los pacientes que recibieron placebo:
– En el UNITI-1: del 5,9%, 20,9% vs. 7,3% (p = 0,003 y p < 0,001).
– En el UNITI-2: del 30,6%, 40,2% vs. 19,6% (p = 0,009 y p < 0,001).583
En el estudio de mantenimiento IM-UNITI los porcentajes de remisión clínica en la semana 44 entre los que recibieron ustekinumab cada 8 semanas o cada 12 semanas fueron del 53,1% y 48,8%, permaneciendo en remisión en la semana 44, en comparación con el 35,9% de los que recibieron placebo (p = 0,005 y p = 0,04 respectivamente).583
– En cada uno de los estudios, las tasas de eventos adversos fueron similares entre los grupos de tratamiento. Entre los pacientes con EC moderada a severa, los que recibieron ustekinumab por vía intravenosa tuvieron una tasa de respuesta significativamente más alta que aquellos que recibieron placebo. La eficacia en la semana 8, fue más sostenida usando la dosis de aproximadamente 6 mg por kg de peso.583
– El ustekinumab subcutáneo mantuvo la remisión en pacientes que tuvieron una respuesta clínica a la terapia de inducción, y demostró hacerlo más eficazmente a largo plazo en aquellos pacientes que recibieron aproximadamente 6 mg/kg.
– La eficacia clínica en el mantenimiento se confirmó mediante el control de marcadores inflamatorios (por ejemplo, lactoferrina fecal y calprotectina fecal).583
II. Seguridad del Ustekinumab en la EC
En el UNITI-1, las tasas de eventos adversos en los grupos que recibieron 130 mg de ustekinumab, 6 mg de ustekinumab por kilogramo y placebo no difirieron entre grupos (64,6%, 65,9% y 64,9%) respectivamente, y tampoco los porcentajes de pacientes con al menos un evento adverso grave (4,9%, 7,2% y 6,1%).
Tampoco hubo diferencias en el UNITI-2 (eventos adversos: 50,0%, 55,6% y 54,3% y eventos adversos serios: 4,7%, 2,9% y 5,8%; informados en igual orden que en UNITI-1).
En el IM-UNITI, a 44 semanas, los porcentajes de pacientes en la población primaria que recibieron 90 mg de ustekinumab cada 8 semanas, 90 mg de ustekinumab cada 12 semanas y placebo también fueron similares (al menos un evento adverso 81,7%, 80% y 83,5%, evento adverso serio 9,9%, 12,1% y 15,0% respectivamente).
Por lo tanto, se concluye que no se detectaron diferencias ni en la inducción ni en el mantenimiento entre la droga activa y el placebo. Se observaron infecciones serias en 13 pacientes, entre todos los grupos de estudio (2,3% con ustekinumab cada 8 semanas, 5,3% con ustekinumab cada 12 semanas y 2,3% con placebo).
· Los eventos adversos de infusión o sitio de inyección fueron de baja frecuencia y similares en ambas dosis en UNITI-1 y UNITI-2.583
Hubo dos pacientes con carcinomas de células basales en la población primaria (aleatorizada) del IM-UNITI, uno en el grupo placebo y uno en el grupo que recibió 90 mg de ustekinumab cada 8 semanas. Entre los pacientes que no estaban en la población primaria, ocurrieron seis cánceres de piel no melanoma en cuatro pacientes, pero se presentaron con distribución similar en los tratados con ustekinumab y placebo. En un paciente con ustekinumab se describió el desarrollo de un adenocarcinoma metastásico y un carcinoide (este como incidentoma). En el total de la población estudiada, durante 1 año de tratamiento, no hubo muertes ni casos del síndrome de leucoencefalopatía. Se produjeron tres infecciones oportunistas, 2 con ustekinumab (meningitis y candidiasis esofágica) y uno con placebo (todos ellos habían recibido adicionalmente una o más medicaciones inmunosupresoras). Hubo un caso de tuberculosis pulmonar a 10 meses de una dosis única de ustekinumab seguida por placebo, y la ruptura de un aneurisma cerebral que no fue fatal.
· En el IM-UNITI la incidencia de anticuerpos anti droga en la semana 44 fue baja (2,3%), con muestra pequeña y su presencia no descartó eficacia. Respecto de la farmacodinamia se observó una asociación entre el nivel de ustekinumab en suero que fue dosis dependiente) y la remisión. Todo ello sugiere un buen perfil de seguridad para esta droga.583
Ya tiene aprobación y uso en muchos países del mundo y se han publicado estudios de vida real. Como ejemplo, en un estudio de vida real retrospectivo de 167 pacientes con EC tratados con ustekinumab de los cuales 95,2% presentaban previa falla a anti-TNF y que fueron seguidos por 45,6 semanas (IQR: 24,4-88,9), se observaron tasas de respuesta y remisión clínicas a 6 meses del 60,3% y 25,2% y a 12 meses del 59,5% y 27,9% respectivamente. Se observó respuesta endoscópica o radiológica (mejoría de TC o MRI) en el 54,5% (67/123) a 6 meses y el 55,8% (48/86) a 12 meses.584
Los resultados avalan la utilidad de ustekinumab para la EC moderada a severa, particularmente en aquellos con enfermedad sin respuesta al tratamiento anti-TNF previo. En CU aún se están realizando estudios clínicos. Si bien se presentó en ECCO 2018 un estudio que reportó eficacia en 17 pacientes con CU moderada a severa refractarios a otras drogas, estos datos son aún insuficientes.
c. Biológicos selectivos anti-IL23 (subunidad p-19)
◊ MEDI2070 (Brazikumab): es un MAB monoclonal humano IgG2 (anteriormente también conocido como AMG 139) que tiene un mecanismo parecido al ustekinumab, pero dirigido específicamente contra la subunidad P19 de la IL-23, y bloquea específicamente el enlace de IL-23 a su receptor, tanto recombinante como nativa. Recordemos que la IL-23 tiene 2 unidades, p19, y p40, compartida con la IL-12. La IL-23 induce expresión de IL-22, IL-17A. La IL-22 es una citoquina efectora que desempeña un papel clave en el mantenimiento de la integridad de la barrera mucosa, indicador de la actividad del eje IL-23.585
La IL-23 también inhibe células T reguladoras, y está implicada en la patogenia según estudios del genoma. El bloqueo de la activación del receptor de IL-23 impide el desarrollo de colitis murina. Inhibe la producción in vitro de IFN-γ en células NK estimuladas por IL-23 (en asociación con IL-18), pero no afecta la producción de IFN-γ inducida en células NK por IL-12.
Se evaluó el MEDI2070 como una terapia de inducción, con resultados promisorios en fase 2a, mostrando eficacia clara para la EC moderada a severa refractaria a anti TNF-α. Se realizó un estudio doble ciego, controlado, de 119 adultos con EC moderada a severa, con falla a anti-TNF, asignados aleatoriamente para recibir MEDI2070 (700 mg) o placebo por vía intravenosa en las semanas 0 y 4. Luego recibieron 210 mg de MEDI2070 en forma abierta, por vía subcutánea, cada 4 semanas desde la semana 12 hasta la 112. Los pacientes se estratificaron por el número de agentes anti-TNF previos.585
El objetivo primario (respuesta o remisión) usando el CDAI (respuesta: caída de 100 puntos desde el inicial), evaluado en la semana 8 se logró en el 49,2% de los pacientes con MEDI2070 (n = 59), versus el 26,7% que recibieron placebo (n = 60), (p = 0,010). Además, en el mismo tiempo se logró remisión en una tasa mayor con MEDI2070 (45,8% vs. placebo 25,0%, respectivamente [p = 0,017]. La respuesta clínica a la semana 24, ocurrió en el 53,8% de los pacientes que continuaron recibiendo MEDI2070 como estudio abierto y en el 57,7% de pacientes que habían recibido placebo durante el estudio doble ciego y en el posterior estudio abierto. Al mismo tiempo, se observó que los porcentajes de pacientes que presentaron al menos un 50% de descenso ya sea de la calprotectina fecal o la PCR fueron mayores en los que recibieron MEDI2070 que en los que recibieron placebo (42,4% vs. 10% [p < 0,001]). En la semana 24, la respuesta clínica no difirió en los pacientes que habían recibido en forma abierta ya sea MEDI2070 o placebo (53,8% y 57,7% respectivamente), como tampoco la PCR y la calprotectina fecal. La presencia de concentraciones séricas basales más altas de IL22, una citoquina cuya expresión es inducida por la IL23, se asoció con mayor probabilidad de respuesta. Los eventos adversos comunes fueron cefaleas y nasofaringitis. No se registraron en los estudios efectos adversos serios ni la formación de anticuerpos antidrogas.585
◊ Risankizumab (BI 655066, Boehringer Ingelheim, Ingelheim, Alemania) es un anticuerpo monoclonal humanizado dirigido a la subunidad p19 de la IL-23, que como expresamos previamente está implicada genética y biológicamente en la patogénesis de la EC. Se realizó un estudio aleatorizado, doble ciego, controlado con placebo de fase 2, con EC moderada a severa, según CDAI, o úlceras en el íleon o colon, o ambas, y con un índice endoscópico (CDEIS) de al menos 7 (≥ 4 para pacientes con ileítis aislada) en la ileocolonoscopía con lectura central ciega. Los pacientes se aleatorizaron a 200 mg de risankizumab intravenoso, risankizumab 600 mg o placebo en las semanas 0, 4 y 8. Además se estratificaron por exposición previa a antagonistas de TNF (sí vs. no). El resultado primario fue la remisión clínica (CDAI < 150) en la semana 12. La seguridad se evaluó en pacientes que recibieron al menos una dosis del fármaco del estudio.586
Se seleccionaron 213 pacientes y se aleatorizaron 121. Al inicio del estudio, 69% habían sido tratados previamente con al menos un anti-TNF, con falla en el 79% de los casos. En la semana 12, un 31% de 82 pacientes con risankizumab (la mitad con 200 mg, la mitad con 600 mg) tuvieron remisión clínica versus un 15% de 39 pacientes con placebo (p = 0,0489). Lograron remisión clínica el 24% de los pacientes con risankizumab 200 mg (NS), 37% con 600 mg, (p = 0,0252) vs. placebo. La respuesta clínica fue del 21% con placebo, 37% con risankizumab 200 mg y 42% con 600 mg, demostrando la mayor dosis una diferencia significativa favorable (p = 0,0273). La remisión endoscópica fue del 3%, 15% y 20% siendo significativas versus placebo ambas dosis (p = 0,0357 y p = 0,0107). Los eventos adversos se distribuyeron proporcionalmente entre placebo (n = 32), risankizumab 200 (n = 32), risankizumab 600 mg (n = 31). Los efectos adversos severos, los serios y las discontinuaciones fueron proporcionales entre placebo y los dos grupos de risankizumab sumados. Los mismos se distribuyeron en los siguientes porcentajes para placebo, 200 mg y 600 mg: severos (23%, 15% 7%), discontinuación (15%, 12%, 2%), SAE (31%, 22%, 7%). El evento adverso más común fue náuseas (10%, 20% y 7%) para placebo, risankizumab 200 mg y risankizumab 600 mg) y el serio evento adverso más común fue el empeoramiento de la EC subyacente (15% con placebo, 5% con risankizumab 200 mg y 0% con 600 mg). No hubo muertes.586
◊ Mirikizumab: es otro biológico inhibidor de la subunidad p19 (IL-23) que se administra subcutáneamente. Un estudio de fase 2 investigó la seguridad y la eficacia de mirikizumab en comparación con el placebo en pacientes con CU de moderada a severa (Score Basal Mayo 6-12, endocóspico ≥2) que habían fallado previamente a la terapia convencional o biológica. Los pacientes fueron aleatorizados a mirikizumab cada 4 semanas, en dosis de 50 mg (n = 63) o 200 mg (n = 62) con la posibilidad de aumentar hasta 600 mg, o 600 mg de dosis fija (n = 61) o placebo (n = 63). Los resultados fueron estadísticamente significativos. Remisión clínica: en todas las dosis estudiadas, los porcentejes oscilaron entre el 11,5% 22,6 %, versus 4,8 % en el placebo (valor p nominal <0.05 para 200 mg). Respuesta clínica: tasas entre 41,3% y 59,7 %, versus 20,6 % placebo (p<0,05 para todos los grupos). Curación endoscópica: entre el 13,1% y el 30,6 % lograron la curación endoscópica, versus 6,3 % (valor p nominal <0,05 para 50 mg y 200 mg en comparación con placebo). Además, una mayor proporción (pero NS) lograron remisión endoscópica y remisión sintomática en comparación con el placebo a las 12 semanas.587
Luego se reasignaron aleatoriamente a los pacientes que respondieron a la semana 12 para recibir 200 mg de mirikizumab SC, cada 4 semanas (n 47) o cada 12 semanas (n 47) hasta la semana 52. El 46,8% con mirikizumab cada 4 semanas y el 37% cada 12 sem estaban en remisión clínica, mientras que 80,9% y el 76,1% obtuvieron respuesta clínica, respectivamente. Además, el 57,4% en el grupo cada 4 semanas y el 47,8% en el grupo cada 12 semanas tuvieron score 0 ó 1.587 En la semana 12, las proporciones de pacientes con puntaje total de IBDQ ≥170 fueron mayores con mirikizumb 50 mg, 200 mg y 600 mg que con placebo (44%, 56%, 54% vs. 30%, respectivamente) y mayores proporciones pacientes con mirikizumab, que los pacientes tratados con placebo tuvieron mejoría ≥16 puntos desde el tiempo basal. En la semana 12, la respuesta clínica y las tasas de curación endoscópica fueron mayores para mirikizumab 50 mg y 200 mg en comparación con placebo.587
d. Bloqueo de IL-6
◊ PF-04236921: La interleuquina-6 es otra citoquina proinflamatoria involucrada en la fisiopatología de la EII. Se trata de un anticuerpo monoclonal IgG2 anti-IL-6 completamente humano, que se administra por vía subcutánea. Está en desarrollo clínico para pacientes con EC refractaria a anti TNF-α, de actividad moderada a severa. Como resultado preliminar se dispone de un ensayo de fase 2, en el que 247 pacientes con EC fueron aleatorizados para recibir PF-04236921 (10, 50 o 200 mg) o placebo por inyección subcutánea en la semana 0 y 4. Después de la inducción, los pacientes ingresaron a un seguimiento de 28 semanas, o una extensión abierta de 48 semanas con un seguimiento de 28 semanas donde se administraba 50 mg de anti-IL-6 cada 8 semanas (hasta seis dosis) con 28 semanas de seguimiento. Se incluyeron adultos con EC confirmada y respuesta inadecuada al tratamiento anti-TNF. Los pacientes tratados con anti-interleuquina 6 mostraron una respuesta clínica significativa en el grupo de 50 mg frente a placebo en la semana 8 y semana 12 (49,3% vs. 30,6% y 47,4% vs. 28,6%, respectivamente, p < 0,05). También fue significativamente mayor la tasa de remisión clínica en la semana 12 en el grupo de 50 mg, en comparación con el placebo (27,4% vs. 10,9%, respectivamente, p < 0,05). El brazo de 200 mg se interrumpió temprano debido a problemas de seguridad, que se presentaron solo con esta dosis. El anticuerpo disminuyó los niveles séricos de PCR, en relación con el aumento de la dosis del fármaco, y disminuyeron los neutrófilos. PF-04236921, no indujo la formación de anticuerpos antidrogas. Se reportaron como EA abscesos GI y perforación, lo cual debe ser evaluado en estudios futuros.589
Moléculas pequeñas: las terapias biológicas antes mencionadas son efectivas para una proporción de pacientes con EII, pero cerca de los 2/3 presentan falla primaria o secundaria a los anti-TNFs, y estos también son más susceptibles para fallar a vedolizumab y ustekinumab. Existe una enorme necesidad de nuevos mecanismos. Moléculas pequeñas que actúan en diferentes vías se han convertido en una alternativa atractiva a los productos biológicos, y presentan diferencias importantes con estos, listadas en la mencionada tabla (Tabla 79). Ello se basa en la factibilidad para su administración oral, su muy bajo riesgo de inmunogenicidad y la menor variabilidad farmacocinética entre pacientes.590-592 Los productos biológicos son proteínas complejas resultantes de células vivas, con un peso de hasta 150 kDa, de estructura compleja, que requiere administración intravenosa o subcutánea. Sus características posibilitan variabilidad farmacocinética e inmunogenicidad. Por el contrario, las moléculas pequeñas tienen por definición un peso molecular de menos de 900 Da, que permite la difusión a través de membranas celulares, y la administración oral con menor variabilidad farmacocinética. La vía de administración influye en la adherencia de los pacientes al tratamiento.
La vida media más corta es también un beneficio cuando se necesita un retiro rápido en caso de infección, cirugía o embarazo. Debido a su tamaño, tienen significativamente menos potencial antigénico que los biológicos. Aunque las moléculas pequeñas pueden tener diferentes efectos secundarios, como mayor cantidad de interacciones con otras drogas, los beneficios mencionados son importantes.590-592 Las principales moléculas pequeñas que se están ensayando para EII se listan en una tabla (Tabla 87).
Tabla 87. Moléculas pequeñas disponibles, en investigación y desarrollo, para potencial uso en EII.
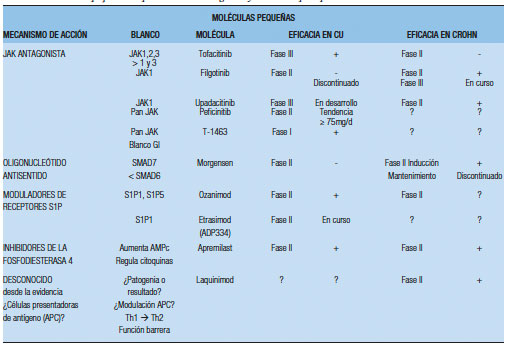
e. Nuevas moléculas pequeñas
· Inhibidores de las janus kinasa
Las proteínas kinasas son un tipo de enzimas intracelulares que modifican otras moléculas (sustrato) y median amplificación de información fundamental para el control de la fisiología celular. Las Tirosina Kinasas catalizan la transferencia de un grupo fosfato desde moléculas de adenosin trifosfato (ATP) a un residuo de tirosina de una proteína. Esta fosforilación es una función esencial para la transducción de señales para la comunicación intracelular e intercelular.
Si la Tirosina Kinasa se encuentra asociada a la membrana celular como receptor, se denomina Tirosina Kinasa Receptora, con actividad kinasa intrínseca. De hallarse en el citoplasma se denomina citoplasmática o Tirosina Kinasas no receptora. Las mismas están relacionadas con funciones celulares esenciales como la regulación del crecimiento, división, diferenciación, supervivencia y migración celular, así como el sistema de señalización inmunológica celular. Regulan la respuesta celular ante señales químicas, como citoquinas anti inflamatorias, patógenos, activación de células inmunes, actividad hormonal, división celular y expresión génica.
La familia de la Janus Kinasa (JAK según sus siglas en inglés) incluye cuatro Tirosina-Kinasas intracelulares: JAK1 JAK2, JAK3 y tyrosina kinasa 2 (TYK2).
Varias citoquinas actúan activando la vía JAK-STAT. Las proteínas JAK, luego de la unión con una citoquina asociada, que varía para los diversos tipos, median la señalización intracelular de los receptores transmembrana.
En síntesis, se trata de enzimas que operan como transductores de señales, estando asociadas por la parte intracelular a receptores de citoquinas de la membrana citoplasmática.
La ligadura de una citoquina a su receptor conduce a la activación de JAKS intracelulares. Inicialmente se acercan dos receptores en la porción extracelular (cada uno un monómero) formando dímeros, de modo que cada monómero de citoquina se une a dos moléculas de receptor. Cuando ello ocurre, las porciones intracelulares del receptor (transformado en dímero) se aproximan, y la aproximación de las JAKS asociadas a los receptores intracelulares permite una fosforilación cruzada entre ambas.
Las JAKS así asociadas, al fosforilarse, pueden fosforilar otros sustratos. En este caso, los sustratos que fosforilan son las proteínas STAT (transductores de señalización y activadores de transcripción). Ello facilita el reclutamiento de las proteínas STAT, las cuales se activan, dimerizan y translocan al núcleo dando lugar a la transcripción (entrada al núcleo y unión al ADN para regular la expresión génica). De este modo, participan en la transcripción de múltiples vías de citoquinas cruciales para el desarrollo del proceso inflamatorio, incluyendo enfermedades autoinmunes, según se observa en modelos de inflamación en murinos.
Los inhibidores JAK que se han ensayado con fines terapéuticos inhiben la actividad de una o más enzimas kinasas de la familia de Janus Kinasas, interfiriendo con la señalización JAK-STAT. La acción de los inhibidores de JAKS varía según el espectro de mediadores que inhibe el fármaco.590, 591
Se grafica en una figura el mecanismo de acción de los inhibidores de la Janus kinasas (Figura 28).
En síntesis, el tratamiento con inhibidores JAK apunta a blancos relacionados con la fisiopatología de la EII, ya que pueden interferir con el desarrollo de células patogénicas Th1 y Th17, con la función de las células B, y potencialmente, modular la inmunidad adaptativa e innata, factores que contribuyen a la génesis del proceso inflamatorio en EII y otras enfermedades autoinmunes, como AR y psoriasis. Sin embargo, por afectar múltiples vías celulares, que regulan el desarrollo y crecimiento normal, hay que evaluar la especificidad y su relación con las dosis.
Según el miembro de la familia JAK bloqueado, se inhiben diferentes mediadores de la inflamación. Los diferentes tipos de citoquinas se ligan a determinadas proteínas JAK asociadas (implica que diferentes tipos de citoquinas seleccionan diferentes tipos de JAK). Se produce la señalización a partir de la unión con receptores transmembrana de citoquinas intracelulares, que, según la citoquina, es mediada por un solo tipo de JAK o por varios).
Los receptores transmembrana involucrados en este mecanismo configuran subgrupos diferentes para las citoquinas tipo I (cadena U, cadena β, glicoproteína gp 130, dímeros y hormonas) y las citoquinas tipo II (la familia interferón y la familia IL-10). Las proteínas STAT asociadas (se asocian una o más según el caso) también difieren según las distintas citoquinas y JAKS.591
Se ilustran en una figura diferentes tipos de receptores JAK, mecanismos de acción y blanco comparativo de inhibidores JAK que se ensayaron en EII (Figura 29).
Ejemplificando, para las citoquinas tipo I, la respuesta inflamatoria está mediada por asociaciones predeterminadas (combinaciones) de ciertos tipos de citoquinas, con proteínas JAK específicas, y proteínas STAT seleccionadas.591
Como ejemplos de las combinaciones:
– Las citoquinas de la familia del receptor de citoquinas gp130 (IL-6, IL-11, IL 27) se asocian a JAK1, JAK2, TYK2, pero la primera mencionada a STAT1 y STAT3, la segunda mencionada solo a STAT3, y la tercera a STAT1, STAT2, STAT3, STAT4 y STAT 5
– Las citoquinas correspondientes al receptor común cadena U son: IL-2, IL-4, IL-7, IL-9, IL-15 e IL-21, y la señalización está mediada por JAK1 y JAK3, agregándose TYK2 en el caso de la IL-13. Los tipos de STAT asociados también varían con según citoquinas y subtipo de JAK.
Estas citoquinas usan JAK1 y JAK3 en la respuesta inmune adaptativa.
– La cadena β funciona como receptora de IL-3, IL-5, y GM-CSF (factor colónico estimulante de colonias de granulocitos macrófagos) y se asocia específicamente con señalización JAK2, combinaciones que se asocian con determinado tipo de STAT.
– El receptor dímero está predestinado a IL-12, IL-23, IL-27, IL-35. Las dos primeras se asocian a JAK1, TYK2, que interaccionan con diferentes tipos de STAT. La IL-12 y IL-23, conducen a la transformación de células T CD4 en Th1 y Th17, con insuficiente actividad regulatoria, vía JAK1-JAK2.
– Los receptores hormonales son eritropoyetina, GM-CSF, hormona de crecimiento, lectina y trombopoyetina. Todas ellas asociadas a JAK2 y STAT específicas.591
Para las citoquinas tipo II (IFN-a, IFN-β e IL-10), la respuesta inflamatoria está mediada por las siguientes asociaciones:
– La familia IL-10, se asocia con IL-10.IL-19, IL-20, IL-22. También se requieren STAT específicos.591
Con respecto a la relación con la patogénesis, se encontraron polimorfismos de JAK2, TYK2, STAT3, IL-23 receptor e IL-12 que aumentan el riesgo de EII.591
◊ Tofacitinib
Es el primer inhibidor desarrollado y utilizado en estudios clínicos de la familia Janus Kinasa que inhibe en particular a JAK1 y JAK3, y en menor grado JAK2, logrando una amplia limitación de la inflamación por la interferencia de la señalización/transducción de múltiples citoquinas, varias de las cuales son esenciales para la función de activación y proliferación de linfocitos.
El mecanismo de acción de tofacitinb se ilustra en una figura (Figura 30).
El tofacinib antes de ensayarse en EII, fue aprobado para la artritis reumatoidea.
Se administra por vía oral.590-592
Se sumarizan en una tabla los principales ensayos clínicos (Tabla 88).
Tabla 88. Tofacitinib en la colitis ulcerosa.
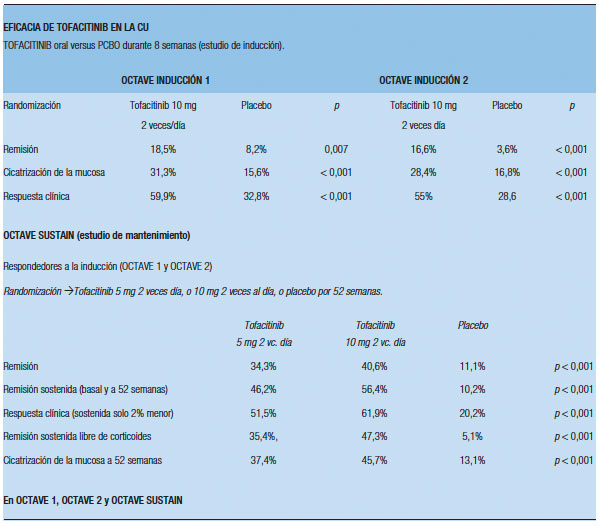
I. Eficacia del tofacitinib en la colitis ulcerosa
– En un ensayo de fase II, aleatorizado, controlado con placebo de dos semanas de duración, el tofacitinib mostró un efecto beneficioso significativo dosis-dependiente en pacientes con CU moderada a severamente activa.
Se incluyeron 195 pacientes (194 tratados) en los que se administraron 0,5 mg 3, 10 y 15 de tofacitinib o placebo 2 veces por día.
Se definió remisión a un score de Mayo total ≤2, sin subscores >1 y subscore de sangrado rectal de 0, a 8 semanas, y el objetivo secundario principal fue la cicatrización mucosa (subscore endoscópico ≤1) a 8 semanas.
Para las mencionadas dosis, la tasas de respuesta clínica a 8 semanas (objetivo primario) fueron: 32%, 48%, 61% y 78% respectivamente (placebo 42%), las de remisión clínica: 13%, 33%, 48%, y 41% (placebo 10%), y las de remisión endoscópica: 10%, 18%, 30% y 27% (placebo 2%).592
– Significancia estadística: con la dosis de 15 mg se lograron todos los objetivos que seleccionaron para evaluar la eficacia, estadísticamente significativas unánimemente al nivel de al menos p = 0,001, con 10 mg se logró remisión clínica y cicatrización endoscópica (p < 0,001), evidenciándose una tendencia estadística favorable en los otros objetivos.
Con la dosis de 3 mg hubo algunos resultados que sugerían eficacia, pero no fueron homogénea entre objetivos, y debido al tamaño pequeño de la muestra no fueron significativos.
Además las dosis más altas mostraron reducción de los marcadores objetivos de inflamación (PCR y calprotectina fecal).592
Los estudios pivotales de fase 3 de inducción fueron el OCTAVE 1 y 2 y el de mantenimiento fue el OCTAVE Sustain. Estos fueron aleatorizados, doble ciego, controlados con placebo, de tratamiento con tofacitinib en adultos con CU.
· En los estudios OCTAVE 1 y 2 se incluyeron pacientes (598 y 541 respectivamente), asignados aleatoriamente para recibir terapia de inducción con tofacitinib (10 mg dos veces al día) o placebo durante 8 semanas.
Definiciones: 1) Remisión: fue un objetivo primario, se definió como Mayo score total ≤2, con ningún subscore >1 y sangrado rectal de 0 o 1, a 8 semanas, 2) objetivo secundario central: cicatrización mucosa: subscore endoscópico de Mayo ≤1; 3) respuesta: criterio usado para el ingreso al mantenimiento, fue definido como Mayo score descenso ≥3 puntos y al menos 30% del basal, con disminución del sangrado rectal ≥1 punto o un score absolute de sangrado de 0 o 1.
· En el OCTAVE Inducción 1, la remisión a las 8 semanas ocurrió en el 18,5% de los pacientes con tofacitinib versus el 8,2% en el grupo placebo (p = 0,007), la respuesta clínica fue de 59,9% versus 32,8% (p < 0,001) y la cicatrización de la mucosa de 31,3% versus 15,6% (p < 0,001), todos valores altamente significativos.
· En el ensayo OCTAVE Inducción 2, también hubo resultados significativos; la remisión ocurrió en el 16,6% versus el 3,6% (p < 0,001), la respuesta clínica en el 55% versus 28,6% (p < 0,001) y las tasas de cicatrización mucosa fueron 28,4% con tofacitinib versus 16,8% con placebo (p < 0,001).
· En el OCTAVE Sustain, se estudió el mantenimiento con tofacitinib en 593 pacientes que tuvieron una respuesta clínica a la terapia de inducción según el criterio previamente definido. Estos pacientes respondedores fueron asignados aleatoriamente para recibir terapia de mantenimiento con tofacitinib (5 mg o 10 mg dos veces al día) o placebo durante 52 semanas. 594
· Las diferencias entre las 2 dosis de tofacininib versus placebo en todos los end points fueron de p < 0,001. La remisión a las 52 semanas se observó en el 34,3% de los pacientes en el grupo de 5 mg de tofacitinib, 40,6% en el grupo de 10 mg versus 11,1% con placebo. La respuesta clínica con 5 mg fue de 51,5% y con 10 mg de 61,9%, versus 20,2% con placebo.
La cicatrización de la mucosa a 52 semanas con 5 mg ocurrió en el 37,4%, con 10 mg 45,7% versus el 13,1% con placebo.
– Se evaluaron diversos parámetros de eficacia mantenidos en forma sostenida (en ambos tiempos, basalmente al salir de la inducción y a 52 semanas), todos ellos fueron significativamente mayores que en el placebo, a un nivel de p<0,001, describiéndose los datos específicos a continuación. La respuesta sostenida (tanto al ingreso al mantenimiento como a las 52 semanas) con ambas dosis difiere solo en un 2% de la respuesta a 52 semanas.
La remisión sostenida fue de 46,2% y 56,4% con 5 y 10 mg respectivamenente versus 10,2% para placebo, y la remisión sostenida libre de corticoides fue de 35,4%, 47,3% para las respectivas dosis de tofacitinib versus 5,1% con placebo. -La cicatización mucosa sostenida se observó en en 33,3%, 39,3% para 5 y 10 mg de tofacitinib y 8,9% en la placebo.593
· En los ensayos de inducción 1 y 2 del OCTAVE, las tasas de infección general fueron más altas con tofacitinib que con placebo, pero las de infección grave no fueron significativamente diferentes. En los estudios de tofacininib (en EC y en AR) las tasas generales de infección (bronquitis, influenza, respiratorias altas y urinarias, y la infección por herpes zoster) fueron más elevadas con tofacitinib que con placebo, siendo riesgos independientes una mayor edad y el uso de corticoides.
Las tasas de infección grave en EC fueron más altas que lo que se observó en el estudio de AR, aunque similares al placebo (3,09 por 100 pacientes-año [IC95%: 2,73-3,95]).
El riesgo de herpes zoster (4,4 por 100 pacientes/años) se reportó en relación con la edad, sin casos de mortalidad ni diseminación, postulándose recomendar la vacuna de virus no vivos, que es altamente efectiva, previo al inicio del tratamiento.
La malignidad (observada en 14 estudios en AR), a excepción del cáncer de piel no melanoma, no se observó elevada, reportándose la tasa de linfoma en 0,08 eventos por 100 pacientes años (NS).
El tofacitinib se asoció con un aumento de los niveles de lípidos en comparación con el placebo, dosis dependiente, reversible con la suspensión (entre 10 y 20%, tanto del colesterol LDL como HDL), pero hasta el tiempo de seguimiento no se trasladó a efectos cardiovasculares. Respecto de un potencial efecto de supresión de la médula ósea, en los estudios de AR se observó disminución de los leucocitos con tasas bajas de neutropenia (1,2% y 0,8% para el primer y segundo trimestre desde el debut), que no se asoció con un descenso de la hemoglobina.
Se reportaron eventos cardiovasculares adjudicados a la droga en cinco pacientes que recibieron tofacitinib y en ninguno que recibió placebo. No se observó aumento de malignidad, pese a una capacidad potencial de disrupción de las vías encargadas de la vigilancia (células NK e INF).593
Eficacia del Tofacitinib en la enfermedad de Crohn
En dos estudios no se logró el objetivo de respuesta (tomado como descenso del CDAI de 70 puntos) ni tampoco el de remisión, aunque hubo una muy alta respuesta placebo. Se detectó una disminución modesta de la PCR y las concentraciones de calprotectina fecal.594
◊ Filgotinib
Es un nuevo inhibidor oral selectivo de Janus Kinasa 1. Los inhibidores selectivos de JAK1 intentan mejorar la eficacia y minimizar los efectos secundarios de la inhibición de JAK2 y JAK3. Esta molécula tiene una vida media de 6 horas, con efectos farmacodinámicos máximos mediante la administración una vez al día. El filgotinib, para inhibir JAK1, muestra una selectividad 50 veces mayor que para JAK3 y 30 veces mayor que para JAK2. Inhibe la diferenciación de células Th1 y Th2 con un efecto sobre Th17 menor que tofacitinib. Se reportó un efecto dosis-dependiente contra un modelo de artritis en roedor. En un ensayo clínico de fase IIB en AR, el filgotinib mostró una respuesta dosis-dependiente en combinación con metotrexato.590, 591, 595, 596
· Estudio FITZROY
Estudio de fase II de filgotinib en la EC. Fué el primer ensayo clínico de fase II, el cual mostró evidencia temprana pero sólida que apoya la eficacia y seguridad de filgotinib para la EC moderada a severa. Fue un ensayo clínico aleatorizado, controlado con placebo, utilizando filgotinib 200 mg/d durante 10 semanas, con una fase de extensión exploratoria en 174 pacientes.
El estudio fue cuidadosamente diseñado para incluir pacientes con EC sintomáticamente activa (CDAI 220-450), y endoscópicamente activa definida por un SES-CD endoscópico ≥ 7 o bien ≥ 4 en caso de ileítis aislada y confirmada por lectura endoscópica central.595
La remisión clínica se logró en el 47% de los pacientes con 200 mg/d de filgotinib vs. el 23% de los pacientes con placebo (p = 0,0077), porcentaje que fue progresivamente incrementando sugiriendo que la eficacia potencialmente podría incrementar con el tiempo. Además, con filgotinib, hubo tasas significativamente más altas de respuesta con descenso del CDAI de 100 puntos, normalización de la PCR y mejora de la calidad de vida.
El 25% de los pacientes con filgotinib en comparación con el 14% en el placebo redujo a la mitad el puntaje de SES-CD. La remisión endoscópica también mostró una diferencia significativa favorable, aunque ello requiere mayor seguimiento y nuevas evaluaciones metodológicas, debido a que la tasa de respuesta endoscópica, usando lectura centralizada, fue baja en la semana 10.595
Con respecto a la seguridad, no se detectaron cambios significativos en los recuentos de linfocitos o neutrófilos; las infecciones graves fueron del 3% con filgotinib (versus 0% con placebo), pero la seguridad debe chequearse con muestras de mayor tamaño y mayor seguimiento.595
Interesantemente, se presentó como abstract en la DDW 2017 la información de que la eficacia es independiente de previa exposición con anti-TNF.596
Están en desarrollo varias moléculas y se realizaron algunos ensayos clínicos para la EC.
◊ Upadacitinib (ABT-494)
Es un inhibidor específico de JAK1.597
· Estudio CELEST: Un ensayo clínico de fase II (NCT0236549) para la EC reclutó a 220 pacientes con enfermedad moderada a severa (CDAI 220-450, con frecuencia de deposiciones > 2,5 y dolor > 2) y puntaje del SES-CD ≥ 6 (o ≥ 4 para enfermedad ileal localizada). El 92% había fallado o era intolerante a Anti-TNFs.
Los pacientes se randomizaron para recibir ABT-494 a 3, 6, 12, 24 mg dos veces al día o 24 mg una vez al día o placebo durante 16 semanas, seguido de terapia de extensión ciega durante 36 semanas. Los pacientes también fueron aleatorizados 1: 1 al inicio del estudio para la ileocolonoscopia de seguimiento en las semanas 12/16.
Desde la semana 2, las dosis de esteroides debían reducirse en pacientes con corticosteroides al inicio del estudio. Los end-points primarios fueron la remisión clínica (con scores de frecuencia de deposiciones ≤ 1,5 y dolor abdominal ≤ 1) en la semana 16, y remisión endoscópica (SES-CD < 4 con disminución de 2 puntos) en las semanas 12/16. Los 2rios fueron la mejoría clínica y endoscópica (scores ≤30% y del 20% respectivamente respecto al basal).
De los 220 enrolados, 180 (82%) pacientes completaron 16 semanas de inducción. Se logró la remisión clínica en el 27% de los pacientes tratados con upacitinib 6 mg dos veces al día, comparado con 10,7% en el grupo placebo (p < 0,10). Se observó una relación dosis-respuesta significativa con ABT-494 vs placebo para la remisión endoscópica.
La remisión endoscópica se produjo en el 22,2% de los pacientes con upadacitinib 24 mg dos veces al día y el 14,3% de los que recibieron 24 mg una vez al día en comparación con el 0% con placebo (p < 0,01 y 0,05 respectivamente).597
Se presentó en sesiones de la ECCO 2018 en un trabajo oral sobre la velocidad de la eficacia. El análisis de los datos de inducción a 16 semanas del estudio CELEST mostró que un porcentaje significativamente mayor de pacientes tratados con upadacitinib (6, 12 y 24 mg dos veces al día) lograron remisión clínica rápidamente en la semana 4 en comparación con placebo, al igual que un criterio de respuesta clínica mejorada (scores que duplican la respuesta estándar).
Los niveles medios de PCR disminuyeron significativamente en todas las dosis de upadacitinib en la semana 2 y se mantuvieron hasta 16 semanas con 12 y 24 mg 2 veces por día, o 24 mg una vez por día. Un análisis por separado de los datos de inducción de CELEST mostró que un porcentaje significativamente mayor de pacientes tratados con upadacitinib 24 mg dos veces al día lograron remisión clínica y remisión clínica sin esteroides en la semana 16 en comparación con los tratados con placebo.
Además, se presentaron los resultados del mencionado CELEST con extensión a 52 semanas, mostrando que muchos pacientes tratados con upadacitinib que lograron respuesta clínica después de la fase de inducción de 16 semanas mantuvieron su respuesta después de la fase de extensión a 36 semanas.598
◊ Otros inhibidores JAK
Se están desarrollando otros inhibidores adicionales de JAK, con especificidades diseñadas para maximizar el efecto clínico y minimizar los efectos secundarios. Un ejemplo es la formulación TD-1473, cuya capacidad inhibitoria se ensayó en un modelo de colitis murina inducida por oxazolone, y que fue planeada con la intención de lograr un efecto local inmediato a la administración oral, lo que minimiza considerablemente el efecto sistémico.599
· Oligonucleótido antisentido (morgensen)
◊ Morgensen
Es un oligonucleótido oral antisentido SMAD7 (y en menor grado 6) que por unirse a estos SMAD produce degradación de los respectivos ARN mensajeros.
En pacientes con EC, la señalización transforming growth factor β (TGFβ) intracelular, expresada en el intestino, tiene una función relevante en las vías de regulación de la inflamación. Las proteínas intracelulares llamadas SMADs transducen señales extracelulares hacia el núcleo donde activan la transcripción de genes. El TGFβ1 tiene una función inhibitoria de la inflamación que es bloqueada por los altos niveles de la proteína SMAD7.
Las proteínas SMAD7 (y 6 en menor medida) bloquean la activación de las otras subfamilias de SMADs que interactúan para la señalización TGF-β1. Normalmente el receptor TGF-β RI (subunidad de un heterodímero) es fosforilado y activado por la unión a TGF-β1, fosforilando a su vez moléculas de señalización (SMAD2 y SMAD3, reguladas por el receptor R-SMAD). Se forma así un complejo con la molécula mediadora común Co-SMADs (SMAD4), que transloca al núcleo para iniciar los cambios transcripcionales que suprimen la expresión de genes inflamatorios.
El mencionado oligonucleótido morgensen fue descripto con la potencialidad de restaurar la señalización de TGF-β y reducir la producción de citoquinas proinflamatorias, según los primeros ensayos clínicos realizados en la EC.590, 591,600-601
El oligonucleótido propuesto para el tratamiento consiste en una secuencia complementaria que se une al ARN mensajero de SMAD7 y cataliza la rotura de cadenas del ácido ribonucleico mediante un mecanismo hidrolítico, disminuyendo la expresión de SMAD7. El fármaco está provisto de una cubierta pH dependiente de metacrilato de etilo, que facilita la llegada del oligonucleótido antisentido directamente al íleon terminal y al colon derecho, que tiene solo mínima absorción sistémica por endocitosis por el epitelio y células mononucleares de la lámina propia.600, 601 Se esquematiza en una figura el mecanismo de acción de los inhibidores SMAD 7 (Figura 31).
En un ensayo de fase 2, doble ciego, controlado con placebo, se evaluó la eficacia del mongersen para el tratamiento de la EC activa moderada a severa ileal, ileocolónica o colónica limitada a colon derecho. Cabe señalar que el estudio excluyó a pacientes con EC, con lesiones en el tracto gastrointestinal superior o en el colon izquierdo, así como en aquellas con fístulas o enfermedad perianal.600
Los pacientes fueron asignados aleatoriamente para recibir 10, 40 o 160 mg de mongersen o placebo por día durante 2 semanas.600
Se observó un beneficio significativo en la inducción de remisión (cuantificado por el CDAI) al día 15 con mantenimiento de la remisión por al menos 2 semanas en 55% y el 65% para los grupos con mongersen de 40 mg y 160 mg respectivamente (pero no con la dosis menor) en comparación con 10% para el grupo placebo (p < 0,001). El objetivo secundario (respuesta clínica en el día 28 con descenso de 100 puntos del CDAI), fue significativamente mayor entre pacientes que recibieron ya sea 10 mg (37%), 40 mg (58%) o 160 mg (72%) de mongersen comparado con los que recibieron placebo (17%) (p = 0,04, p < 0,001 y p < 0,001 respectivamente), lo que sugiere un efecto dosis dependiente. La mayoría de los eventos adversos (mayores al 5%) se relacionaron con complicaciones y síntomas de la EC y no fueron diferentes al placebo.600
En un estudio de fase 1b presentado en la DDW 2017, y recientemente publicado como full paper, se exploró la correlación entre los índices clínicos y endoscópicos.
Los pacientes con EC activa (CDAI 220-450), puntaje endoscópico SES-CD ≥ 7, o en el caso de enfermedad ileal SES-CD ≥ 4, se aleatorizaron para recibir 4, 8 o 12 semanas de morgensen oral 160 mg al día, seguido de un período de observación sin el fármaco del estudio. Se evaluó la endoscopía por lectura central, al inicio y en semana 12. Se incluyeron 63 pacientes (media de CDAI 294), 46% con exposición previa a TNF-α, el 33% de los cuales tenía una cirugía previa por EC.
Se reportaron cambios tempranos en la respuesta (a las 2 semanas) en los diversos grupos.
A 12 semanas, las tasas de respuesta clínica, según los grupos de duración del tratamiento (4, 8, 12 semanas) se informaron del 53%, 44% y 67%, la remisión clínica 32%, 35% y 48% y el cambio medio del CDAI de -124, -113 y -133 respectivamente.
En total, 52 pacientes tuvieron endoscopías evaluables en la semana 12, de los cuales el 37% fue descripta como respuesta endoscópica (a la semana 12 reducción ≥ 25% en el SES-CD). Entre los pacientes con SES-CD > 12, en el 63% se describió una disminución en CDAI ≥ 25% y en el 31% una reducción ≥ 50%.
En los pacientes con menor severidad (SES-CD ≤ 12 o CDAI score ≤ 300) y los que tenían solo enfermedad proximal se reportó el mayor beneficio clínico.
En los pacientes sin cirugía previa (n = 32) se describió un cambio en el SES-CD, con una correlación significativa (r = 0,48; p = 0,01).601, 602 Sin embargo, luego de nuevas evaluaciones y un análisis intermedio de datos de los ensayos clínicos realizados, la compañía que desarrollaba la droga (CELGENE) decidió suspender la investigación por no encontrar evidencia de su eficacia.
· Agonistas del receptor de esfingosina-1-fosfato (S1P)
El tráfico de linfocitos desempeña un papel central en el sistema inmune innato y adaptativo.
Los agonistas del receptor de esfingosina-1-fosfato (S1P: por las siglas de su nombre en inglés Sphingosine 1 Phosphate) son moléculas pequeñas administradas por vía oral (ya aprobados para esclerosis múltiple), que se están ensayando en el tratamiento de la EII, cuyo mecanismo de acción para regular la inflamación es interferir con el tráfico de linfocitos, de una manera diferente al bloqueo de las moléculas de adhesión.
S1P es una molécula de señalización derivada de los fosfolípidos de la membrana, que se une a receptores (de cinco subtipos diferentes: S1P1 a S1P5), que se localizan en la membrana celular, acoplados a la proteína G. S1P1-3 son ampliamente expresados, mientras S1P4-5 se expresan en pocos tipos celulares.
Tienen funciones diversas, y según el tipo de S1P, regulan ya sea el sistema inmune, el cardiovascular o el nervioso.
Han sido implicados también en condiciones patológicas.590, 591, 604, 605
S1P1, S1P4 and S1P5 están involucradas en la regulación del sistema inmune, mientras S1P2 y S1P3 pueden asociarse a riesgo de efectos cardiovasculares, pulmonares y, teóricamente, a riesgo de cáncer.605
◊ Ozanimod
Es una de las mencionadas moléculas pequeñas que modula los receptores S1P1 y S1P5 (esfingosina 1 fosfato, por su nombre en inglés: Sphingosine 1 Phosphate Receptors 1 y 5).
Los agonistas de los receptores S1P1 internalizan/degradan los receptores S1P1.590, 591, 605 En el sistema inmune, la interacción entre S1P y S1P1 regula el tráfico de linfocitos fuera de los órganos linfoides secundarios, en la sangre y la linfa.
Se incluye una figura cuyo panel A) provee una visión integral del sistema linfático y sitios de activación de células T, y el panel B) esquematiza la estructura del ganglio linfático (Figura 32).
Las células T naïve entran en los ganglios linfáticos por los conductos linfáticos aferentes, y también ingresan desde la circulación de la sangre hacia las vénulas endoteliales altas (por sus siglas en inglés HEV, high endothelial venules), y egresan por un mecanismo S1P/S1P1 dependiente, consistente en que los linfocitos, en base a la expresión de receptores S1P1 (receptor de quimioquina 7) en su superficie, son atraídos desde los ganglios linfáticos hacia los conductos linfáticos eferentes, y posteriormente hacia la sangre, debido a la existencia de un gradiente S1P.
Las mencionadas HEV se encuentran en todos los órganos linfoides secundarios (a excepción del bazo), son pos capilares, tienen la configuración de dilataciones venosas, están caracterizadas por células endoteliales especializadas de mayor altura que las convencionales, y contienen gran cantidad de linfocitos dentro de sus paredes, expresando su función de reclutamiento. Las HEV permiten el tráfico de los linfocitos T naïve dentro y fuera de los ganglios linfáticos del sistema circulatorio. Estas células endoteliales altas especializadas interactúan con los linfocitos expresando receptores, ligandos y moléculas de adhesión específicas que se unen a las L-selectinas de los linfocitos anclándolos a la pared para facilitar el cruce del endotelio, soportando altos niveles de extravasación de los mismos.
Cuando se produce la presentación al antígeno, las células T naïve que ingresaron se activan entrando en una fase proliferativa, lo cual requiere un período prolongado de tiempo para facilitar una activación óptima y diferenciación. Para ello, se produce una hipo modulación de estos receptores (S1P1), disminuyendo así transitoriamente la capacidad de respuesta a S1P, por lo cual los linfocitos no egresan hasta que la fase proliferativa termine. Cuando este proceso de activación finaliza, los receptores S1P1 de los linfocitos T activados son híper-regulados y egresan del ganglio linfático, debido al gradiente S1P. La concentración SP1 es más baja en el líquido intersticial de la corteza, médula y centros germinales de los ganglios linfáticos que en los senos cortical y medular, por donde pasa la linfa, para salir a los conductos linfáticos eferentes que drenan los mismos. Por lo tanto, al haber en el ganglio bajas concentraciones de S1P y en los conductos linfáticos eferentes altas concentraciones, los linfocitos que tienen receptores para S1P1 funcionantes se dirigen hacia afuera del ganglio, en dirección a los linfáticos eferentes, para unirse con la S1P. Las células dendríticas al igual que las endoteliales son capaces de expresar S1P1, mediando efectos sobre la migración y función vascular de barrera.591, 605
Los 5 receptores en la familia (S1P1-5), al unirse a S1P, ayudan a regular una variedad de funciones celulares, incluido el tráfico de linfocitos (entre ellos el tono vascular y ritmo cardíaco).
Como se mencionó, los receptores de S1P1 son los que regulan la salida de linfocitos de los ganglios linfáticos según gradientes de concentración de S1P, lo que significa que migran porque la expresión de S1P es típicamente más baja en los ganglios linfáticos que en los vasos que drenan los mismos. Ello produce expresión S1P1 en los linfocitos facilitando su migración a los tejidos efectores de la respuesta inmune. Cuando salen del ganglio linfático, la expresión de receptores S1P1 disminuye. Se esquematiza en una figura el tráfico de linfocitos mediado por gradiente S1P y la inhibición por agonistas de receptores S1P1. (Figura 33). El efecto final es que estas células quedan atrapadas en los ganglios linfáticos hasta que mueren, en lugar de migrar a los linfáticos periféricos y la circulación de la sangre, que les permitiría llegar a los tejidos efectores de la respuesta inmune, regulando la inmunidad. La modulación exitosa de esta vía conduce a una reducción en el número de células T efectoras que circulan en la sangre periférica y en los órganos blanco, como el tracto gastrointestinal.
Cuando se retira el agonista S1P1 que actúa como modulador, la expresión del receptor se restaura normalmente, y los linfocitos salen de los ganglios linfáticos.591, 605
I. Ozanimod en la CU: un estudio fase II, doble ciego, controlado con placebo de ozanimod (NCT01647516) examinó la seguridad y eficacia en pacientes con CU moderada a severamente activa (n 197) mostrando un efecto clínico positivo. Los pacientes fueron aleatorizados a ozanimod 0,5 mg, 1 mg o placebo durante 32 semanas.
El resultado primario fue remisión clínica con un score de Mayo ≤ 2 en la semana 8 con lectura centralizada endoscópica, lográndose remisión en 14% y 16% con los grupos de ozanimod a dosis de 0,5 mg y 1 mg, respectivamente, en comparación con 6% en placebo, pero las diferencias solo fueron estadísticamente significativas entre el grupo de 1 mg de ozanimod y el placebo (p = 0,0048).
Con respecto a la respuesta clínica, en la semana 8 fue mayor (54% y al 57% en los brazos de 0,5 mg y 1 mg de ozanimod), respectivamente, en comparación con un 37% en el placebo. Además, las respectivas tasas de curación de la mucosa para los grupos de ozanimod de 0,5 mg y 1 mg fueron más altas (28% y 34%), en comparación con el 12% en placebo (p = 0,06 y p = 0,02 respectivamente).590, 604
Cabe señalar que se observaron tasas crecientes de remisión desde la semana 8 a la semana 32 lo que sugiere que tendría inicio de acción relativamente lento, con una respuesta que aumenta con la duración de la terapia. En la semana 32 las tasas fueron del 26% y 21% en los grupos de 0,5 mg y 1 mg respectivamente, en comparación con el 6% en el grupo placebo.590, 591, 605, 606 Se usó lectura central ciega de la endoscopía con criterios estrictos para la remisión clínica. En general, el estudio sugiere que parece ser efectivo en la CU, aunque falta completar con resultados de fase III. Respecto de la seguridad, la droga fue bien tolerada.
En contraste con fingolimod, otro agonista de los receptores S1P1, hubo un solo paciente con efectos cardiovasculares, con bradicardia preexistente, que experimentó un episodio transitorio y asintomático de bloqueo aurículoventricular de primer grado. Adicionalmente, cuatro pacientes con ozanimod desarrollaron concentraciones de TGP que triplicaron el valor normal, sin secuelas adicionales. Se desconoce el mecanismo de esta anomalía, que también se observa con filgotinib.591
El ozanimod tiene efecto en el recuento de linfocitos. En el estudio de fase II de ozanimod en la CU, el recuento medio absoluto de linfocitos de la sangre disminuyó en un 32% y 49% en pacientes con 0,5 mg y 1 mg de ozanimod, respectivamente, en la semana 8. En el grupo de 1 mg de ozanimod, aproximadamente el 50% de los pacientes tenían recuentos de linfocitos absolutos por debajo del rango normal con una dosis efecto dependiente; sin embargo, no hubo recuento absoluto de linfocitos < 2000/mL o complicaciones infecciosas.591, 605
II. Ozanimod en la EC; aunque no hay datos actualmente disponibles para evaluar la eficacia de ozanimod en la EC, se está llevando a cabo un estudio abierto de fase II de ozanimod en la EC activa moderada a severa para evaluarla. Basado en la eficacia de los inhibidores del tráfico de linfocitos en la EC, el ozanimod tiene una alta probabilidad de ser una terapia efectiva para la EC, aunque puede tener un inicio de acción lento.
En comparación con vedolizumab, el ozanimod podría tener efectos inmunosupresores adicionales. Es un aspecto favorable que se elimine de manera rápida.591
◊ Fingolimod (FTY720): es el antecesor del ozanimod, como modulador de esfingosina-1-fosfato. Fue el primer modulador no selectivo del receptor S1P utilizado en ensayos clínicos y aprobado para el uso en la esclerosis múltiple. Es un profármaco, fosforilado y activado que funciona como agonista de los receptores S1P1 al 5. En pacientes con esclerosis múltiple tratada con FTY720, se demostró una reducción de células T CD4+ y CD8+, del 80% y del 60% respectivamente, con una reducción selectiva en las células T naïve y las células T centrales de memoria. Las células T de memoria efectora que mantienen la vigilancia inmunológica están preservadas. Esta droga induce la internalización y degradación del receptor S1P1 con una reducción dosis dependiente en los linfocitos periféricos. La vida media del fingolimod es relativamente larga, traduciéndose en períodos prolongados de linfopenia. La modulación de la vía S1P1 conduce a la supresión inmune, pero adicionalmente, la falta de especificidad es perjudicial, ya que se describe que mecanismos mediados por S1P3 produjeron efectos secundarios cardíacos, incluyendo bradicardia, prolongación de QT y bloqueo aurículo-ventricular.605
En cambio, el ozanimod ha sido desarrollado con especificidad para modular los receptores S1P1 y S1P5 y tiene una selectividad 10.000 veces mayor para S1P1 que para S1P2-4, lo que disminuye los posibles efectos secundarios cardíacos. La vida media del ozanimod es más corta que fingolimod en modelos animales, lo que lleva a períodos de linfopenia más cortos. En los modelos murinos de colitis (TNBS y por transferencia células T naïve adoptivas), el ozanimod se asoció con una disminución dosis dependiente de los índices de inflamación, lo que proporciona un fundamento para el uso en humanos con EII.605
◊ Otros moduladores S1 P
◊ Etrasimod: es un agonista potente y de receptores S1P1 humanos. Es selectivo para S1P1, en humanos, comparado con otros S1p, vs. S1P4 es 24 veces mayor y comparado S1P5 es 4 veces mayor, y no demostró ninguna actividad con S1P2 y S1P3 (> 1.000 veces la selectividad).607 Por lo tanto, parece tener un mejor perfil de eventos adversos y probablemente mayor eficacia.607
◊ Amiselimod (MT-1303): es un modulador selectivo oral de S1P1, que estaba bajo investigación para la EC activa de moderada a severa y en la CU, esclerosis múltiple y otras enfermedades autoinmunes, pero Biogen anunció recientemente que se descontinuaba su desarrollo.607
· Inhibidores de la fosfodiesterasa 4
◊ Apremialast
El apremilast es una molécula pequeña, inhibidor oral de la fosfodiesterasa 4, que funciona intracelularmente para modular una amplia gama de mediadores pro y antiinflamatorios en la CU. Ya ha sido aprobado en psoriasis y artritis psoriásica. Los inhibidores de fosfodiesterasa 4 generan niveles intracelulares elevados de monofosfato cíclico de adenosina (AMPc), lo que, por consiguiente, regula negativamente la liberación de citoquinas proinflamatorias en la mucosa de pacientes con EII.608
Se realizó un estudio de 12 semanas de fase 2, incluyendo 170 pacientes con CU activa que fallaron al menos a un agente de tratamiento convencional, y naïve de biológicos, que fueron randomizados a apremialast en las siguientes dosis: 30mg diarios, 40 mg diarios, 40 mg 2 veces por día, y un grupo placebo.
Se observó beneficio clínicamente significativo en los síntomas, la endoscopía, los biomarcadores y la curación de la mucosa en comparación con placebo. La remisión se observó en el 31,6% de los tratados con apremialast vs. 13,8% con placebo, la cicatrización de la mucosa en el 33,3% versus 15,5% respectivamente, y se detectó mejoría de la calprotectina y PCR ultrasensible. De la experiencia en psoriasis y artritis psoriásica se rescata la necesidad de precaución con las dosis en insuficiencia renal grave (usar la dosis de 30 mg) y cautela en cuadros depresivos. Este estudio se presentó en sesiones de la ECCO 2018.608
· Otros mecanismos en investigación que mostraron potencial utilidad
◊ Laquinimod
El laquinimod es un medicamento oral, sintético, una quinolona-carboxamida derivada de roquinimex, con propiedades antiinflamatorias, que demostró efecto supresor de la neuritis autoinmune experimental, y cuando se estaba ensayando en fase III, se suspendió la investigación por efectos cardiovasculares. Se ha ensayado en enfermedades autoinmunes, incluyendo la esclerosis múltiple, enfermedad de Huntington, y se observó efectividad en algunos modelos murinos de colitis.
Tiene acción moduladora sobre las células presentadoras de antígeno y células T. Cambia el perfil Th1 y TH17 (IFN-γ, TNF-α, IL-17) por TH2 (IL-4, IL-10) y TGF-β, y se ha observado que mejora la función de barrera, lo cual fue evaluado mediante la expresión de proteínas de unión estrecha. Disminuye el factor nuclear NF-κB.
D’Haens y col. evaluaron la seguridad y eficacia de 8 semanas de terapia de inducción con laquinimod en pacientes Crohn con actividad, moderada a severa. Los pacientes (n 117) se randomizaron a 0,5, 1, 1,5 o 2 mg/día y 63 pacientes fueron asignados al azar a placebo, por 8 semanas con otras 4 semanas de seguimiento.
Se permitieron terapias concomitantes estables y previo uso de anti-TNF. Interesantemente, la dosis más baja de laquinimod (0,5 mg/día) mostró mayores tasas de remisión (48,3% vs. 15,9%). Los efectos adversos fueron cefalea, dolor abdominal y elevación de amilasa pancreática.609
¿Desescalar drogas modificadoras de la enfermedad?
La posibilidad de desescalar la terapia con dogas modificadoras de la inmunidad (inmunomoduladores y/o biológicos) y de qué manera es un tema controvertido.
Una excelente revisión y análisis del tema ha sido publicada por Frias Gomes CF y col. en 2018, cuya lectura se recomienda.610 La razón del planteo es que el tratamiento de la EII inmunomoduladores y / o biológicos, puede prevenir daños irreversibles, pero mantenido a largo plazo puede asociarse con efectos secundarios y altos costos. Se han realizado algunos estudios que estiman la probabilidad y el riesgo de recaída en diferentes subgrupos de pacientes, luego de suspender ya sea los inmunosupresores o los biológicos, o disminuir las dosis. Investigaciones recientes han demostrado una tasa predecible de recaída después de suspender la terapia biológica o inmunomoduladora.
En la mencionada revisión se reporta que en general, alrededor del 40-50% de los pacientes finalmente recaerán durante el año siguiente a la retirada del fármaco, y las tasas de recaída aumentan con el tiempo. La suspensión de la monoterapia con inmunomoduladores, en ambas enfermedades, se asoció en la mayoría de los estudios, con tasas de recaída mayores y más precoces en comparación con la estrategia de continuar la droga.
Ello se observó en meta-análisis de Cochrane publicado en 2018 (Boyapa RK et al, 2017) donde se reporta que 32,4% de los pacientes asignados discontinuación de la azatioprina experimentaron una recaida clínica, comprado con 13,5% en los que continuaron el tratamiento (32, 4% versus 13,5%, RR 0,42, 95% CI 0,24–0,72, p = 0,002), en estudios de seguimiento (a 5 años se reportó recaída del 43 al 65%), en estudios retrospectivos (recaída a 5 años del 85%, estadísticamente diferente a continuar los inmunomoduladores, al igual que en RCT). En el caso de la suspensión de inmunomoduladores en pacientes que están con terapia combinada los datos son controvertidos, encontrándose un estudio en EC cuyos resultados favorece la suspensión y otro en CU que la desalienta.
En caso de suspensión de anti-TNFs en general se reporta una recaída entre 40 al 50% a 2 años (no evaluables datos de un posible impacto de la asociación o no de inmunosupresores). El previamente mencionado estudio STORI (diseñado para evaluar riesgo y predictores de recaída al discontinuar Anti-TNFs) en EC luminal (perianal excluída) demostró tasas de recaída a 12 y 24 meses de 43.9 ± 5.0 y 52.2 ± 5.2% respectivamente.
Este estudio reportó que una pequeña proporción (1/5 de los pacientes) no requirieron retratamiento ni tuvieron complicaciones, 71% necesitaron restablecer los anti-TNFs en un tiempo medio de 13 meses, con una falla del 30.1% en un períodos de 6 años y 18% tuvieron una complicación mayor (cirugía resectiva o lesiones perianales complejas).
Los datos actuales de la magnitud de la influencia favorecedora de la remisión clínica biológica y endoscópica, previa a la suspensión son menos alentadores que lo previamente sostenido con disponibilidad de datos a corto plazo. También en colitis ulcerosa la bibliografía demuestra datos de recaída a largo plazo al suspender los biológicos, sin diferencia entre las dos enfermedad, de alrededor de la cuarta parte de los pacientes al año, más de un tercio a los 2 años, aumentando progresivamente, pudiendo sobrepasar el 50% a 5 años.610
La estratificación de los pacientes y la monitorización terapéutica de fármacos podrían ser herramientas prometedoras para guiar el manejo terapéutico, ya sea para la suspensión o reducción de alguna de las terapias. Por ejemplo se observó que los pacientes que están en remisión con bajos o indetectables niveles de infliximab tuvieron mejor pronóstico (más tiempo hasta la recaída) porque su remisión no depende del infliximab. En cambio niveles adecuados de tiopurinas apoyan la remisión. Se considera que los pacientes en los que el tratamiento se inició tempranamente, tienen una enfermedad estable, no extensa, con remisión clínica, bioquímica y endoscópica son los mejores candidatos para la toma de estas decisiones.610
Actualmente, la estrategia de desescalamiento se considera una conducta posible de realizar en pacientes individuales altamente seleccionados, que deben participar en la decisión.
Se han programado estudios prospectivos para responder diversos interrogantes que se plantean al respecto en la práctica clínica:
· SPARE un studio en EC de tres ramas, IMM + Infliximab, IMM monoterapia, IFX monoterapia.
· CURE (The Changing the coUrse of cRohn’s Disease With an Early Use of Adalimumab): Evaluará el impacto del uso temprano de adalimumab y la suspensión en remisión profunda.610
Se sumarizan en los factores que contribuyen a la decisiones de ya sea desescalar o continuar los inmunosupresores y/o biológicos (Tabla 89).
Tabla 89. Factores que impactan en la decision de desescalar o continuar el tratamiento con drogas modificadoras de la inmunidad.
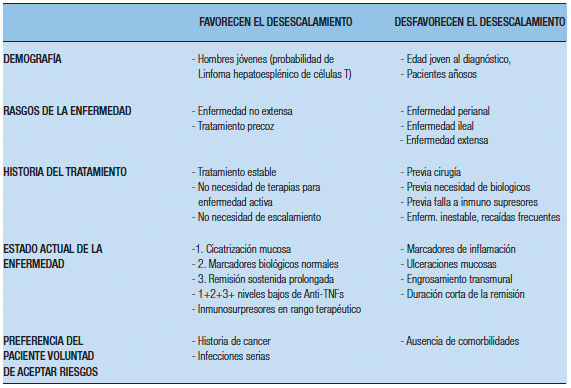
Consideraciones finales
Hacia nuevos objetivos que superen los actuales
Con el objetivo de aportar los criterios útiles que fundamentan las conductas terapéuticas, hemos descripto las características clínicas de las enfermedades inflamatorias intestinales, sus clasificaciones y curso clínico, enfatizando su capacidad de progresar, presentar complicaciones y la potencialidad de evolucionar a una condición discapacitante.
Se han descripto los métodos de cuantificación de la actividad que se utilizaron a través del tiempo, para evaluar las conductas terapéuticas, así como los factores predictivos que, por consenso o evidencia estadística, se consideran relevantes. Se ha revisado y resumido la bibliografía sobre las opciones terapéuticas disponibles.
Convalidamos la necesidad de cambiar la historia natural empleando parámetros objetivos. Una evidencia de ello es que frecuentemente se detectan signos endoscópicos o radiológicos de enfermedad activa progresiva, en pacientes que están asintomáticos, por lo que basarse solo en los síntomas como indicadores para guiar el tratamiento es insuficiente.
Con el soporte de esas evidencias, se diseñaron nuevos objetivos, estrategias y medicamentos en los últimos años, que intentan mejorar los resultados. Los objetivos se centraron entonces, en la necesidad de mirar más allá de los síntomas.
Se postuló la estrategia llamada treat to target, que consiste en una evaluación regular de la actividad según objetivos predefinidos con ajuste del tratamiento en caso de inflamación persistente.
Luego, con el fin de seleccionar aquellos pacientes de alto riesgo para una terapia efectiva de modificación de la enfermedad, se han postulado factores predictivos de mal pronóstico que emergen de revisiones de la literatura y resultados de consensos.
Los objetivos o blancos más eficientes de la estrategia propuesta son la cicatrización de la mucosa, la remisión profunda y los marcadores objetivos de laboratorio como adjuntos (PCR marcadores fecales, en particular la calprotectina fecal).
Además, se formuló una definición de EII temprana, específicamente de Crohn temprano, en un consenso realizado de París, que busca una ventana de oportunidad para intentar cambiar el curso progresivo de la evolución natural de la enfermedad, con base en estudios que lograron mejores resultados en pacientes tratados más precozmente con anti-TNF.
Sin embargo, es también importante no perder la visión de que aún no estamos frente a los objetivos ideales. Si tomáramos en cuenta una descripción ambiciosa de la literatura de que el objetivo terapéutico ideal en cualquier enfermedad crónica es aquel que está claramente definido, es alcanzable con terapia médica o quirúrgica, predictivo de resultados a largo plazo, accesible, no invasivo y relevante para todos los subtipos de enfermedad, con una baja variabilidad de prueba a prueba,611 es claro que objetivos con estas características están aún fuera de nuestro alcance.
No obstante, lo que tenemos que perseguir es que, a partir de los progresos de la investigación, la comunidad de pacientes tenga un pronóstico mejor que el que tenía previamente.
También se ha sostenido que el medicamento ideal debería ser efectivo, seguro, con pocos efectos secundarios, simple de administrar y accesible. Pero la complejidad y heterogeneidad de la EII determina que, a menos que un gran descubrimiento revolucionara extensas áreas la medicina, no parece existir en el corto plazo la posibilidad del desarrollo de una única terapia ideal para la EII, sino que existen diversas terapéuticas que deben adaptarse a las necesidades individuales de los pacientes, y aun a diversos momentos del mismo paciente.
Con ese criterio, ya que no hay un solo tipo de EII, hemos diseñado algoritmos para los distintos patrones clínicos de estas enfermedades, con base en los factores pronósticos que hasta ahora se aceptan, y a la necesidad de cambiar la historia natural.
Pero es importante considerar que, en todas las circunstancias, es necesario adaptar los algoritmos sugeridos a las comorbilidades, los tratamientos concomitantes y los deseos del paciente.
Debemos considerar, además, que los algoritmos son dinámicos y, dado el vertiginoso avance en el conocimiento de la patogenia, su aplicabilidad podría diferir entre países y regiones en función de la accesibilidad de los tratamientos y métodos de monitoreo.
No todos los países, entre ellos el nuestro, cuentan con la metodología para monitorear los niveles de biológicos; e incluso contando con la disponbilidad de tal tecnología, en algunos casos se reservan solo para investigación. Asimismo, la accesibilidad a los tratamientos es variable entre países, en especial en aquellos en vía de desarrollo. Incluso en países desarrollados la aprobación y sus tiempos para algunas terapéuticas no son homogéneos.
El certolizumab, por ejemplo, fue rechazado por la EMA (European Medicines Agency) en el 2008. Sin embargo, ha recibido una reciente aprobación para mujeres en situación de embarazo y lactancia.
Asimismo, el vedolizumab fue aprobado recientemente en nuestro país y comenzó a comercializarse también hace muy poco. Sin embargo, ha integrado tempranamente algoritmos publicados internacionalmente, se avaló su utilización en pacientes con respuesta inadecuada a corticoides y/o inmunosupresores, y anti-TNF y también alternativamente a ellos en varios países, aunque se desaconseja el uso como rescate en la colitis severa fulminante, condición clínica en las que la evidencia se circunscribe a infliximab y ciclosporina.612, 613
En la Argentina está aprobado en la CU y EC “de moderada a grave, en pacientes adultos que hayan tenido una respuesta inadecuada, presenten pérdida de respuesta o sean intolerantes al tratamiento convencional o con un antagonista del factor de necrosis tumoral alfa (TNFα)”.
Respecto del ustekinumab, el uso compasivo era la única posibilidad de obtenerlo, no contábamos hasta recientemente en el país con la formulación intravenosa para realizar la inducción (en psoriasis se usa por vía subcutánea solamente) y aun en el supuesto de que se lo utilizara off-label, hay un solo trabajo de tamaño de muestra intermedia en que se ha usado una inducción subcutánea, intentando equiparar en un subgrupo los niveles séricos de una inducción con ustekinumab intravenoso.614
Según estudios preliminares, podrían representar una opción futura otros inhibidores de moléculas de adhesión, biológicos, como el etrolizumab o los nuevos bloqueantes de la subunidad p-19 de la IL-23.547, 585-588
Adicionalmente, algunas moléculas pequeñas que se están desarrollando, o eventualmente sus derivados, podrían convertirse en medicamentos de elección en pacientes que desarrollaron anticuerpos a los productos biológicos.547, 590-591
Se especula que probablemente los antagonistas JAK (de los que probablemente el tofacitinib ha sido recientemente aprobado por la FDA para CU) podrían cubrir la brecha de los pacientes que desarrollan inmunogenicidad con los biológicos, ya que, aunque existe la posibilidad de cambiar de clase de biológicos, los que no son naïve para biológicos responden estadísticamente menos a otro biológico. Pero es imprescindible la evaluación según las evidencias de eficacia y seguridad a largo plazo.
Sería apropiado buscar suficiente especificidad para que pacientes con comorbilidades puedan realizar un tratamiento a largo plazo (postulándose, debiendo corroborarse que con especificidad JAK 1 podría mejorarse el perfil de seguridad).547, 590-591
Asimismo, los nuevos agentes inhibidores del tráfico de linfocitos, como agonistas de los receptores S1P1, podrían quizás constituir una opción futura, también evaluando eventos adversos y buscando especificidad para el largo plazo.604
Por otro lado, la combinación de mecanismos y tipos de drogas (biológicos y no biológicos) podría inhibir varias vías inflamatorias simultáneamente. Sin embargo, con más razón deben estudiarse las posibles comorbilidades y efectos de drogas concomitantes, a corto y largo término.547, 591
Una de las preguntas más frecuentes en el consultorio de EII es si el medicamento que se está recibiendo es “de por vida”. El vertiginoso progreso en los conocimientos de inmunogenética determina que la respuesta a esa pregunta sea muy diferente a la que manejábamos en décadas pasadas, ya que las expectativas de varias formulaciones con mecanismos diferentes son ahora, o en el futuro cercano, probables.
Hemos descripto varios medicamentos innovadores, de reciente uso y en investigación, pero la lista de proyectos actuales es diametralmente más extensa que la descripta aquí, y la que se avecina es absolutamente apabullante, a tal punto que no es fácil actualizar profundamente el conocimiento de los mecanismos patogénicos y leer la extensa variedad de propuestas terapéuticas que surgen día a día.
Reiterando que la conocida tendencia a la progresión de estas enfermedades es lo que marca la necesidad de tratar de cambiar la historia natural, el principal objetivo actual debería ser no correr detrás de las complicaciones, sino anticiparlas.
Con base en los conocimientos limitados que tenemos, por el momento debemos detenernos a evaluar los factores pronósticos que hemos mencionados que en general se limitan a determinar estadísticamente la gravedad de la enfermedad y su tendencia evolutiva, para seleccionar mejor a los pacientes de alto riesgo.
Pero estas enfermedades no son solo clínicamente heterogéneas. Según el patrón inmunogenético del paciente, diferentes mecanismos proinflamatorios pueden dar lugar a lesiones similares que, claramente, respondan a drogas diferentes. Ante la gran oferta de drogas, se plantea cuáles son primera línea en las distintas situaciones.
Es relevante que algunas de las nuevas moléculas descriptas puedan cubrir la falta de respuesta primaria a los medicamentos actuales.
El reconocimiento de la capacidad progresiva de la EII nos señala imperativamente que no debemos desaprovechar la “ventana de la oportunidad’, porque sabemos que ese tiempo es de oro para los pacientes.
Debido a los costos elevados de muchos de estos medicamentos, los posibles efectos colaterales y la capacidad progresiva de la enfermedad, es de suma importancia indicar el medicamento correcto, con la dosis requerida y la duración adecuada
El grave problema es que, pese a que la situación es sin duda mejor que la que teníamos antes, en lo que se refiere al mecanismo patogénico que predomina en un individuo en particular, los factores predictivos para evaluar de antemano la respuesta de los pacientes individuales aún son insuficientes.
Los objetivos tienen que seguir cambiando
El objetivo futuro, a corto plazo, debería ser no solo indicar de forma temprana aquella medicación que estadísticamente es capaz de cambiar la historia natural de la enfermedad, sino poder conocer cuál es, entre las disponibles, precisamente aquella droga específica que le va a cambiar la historia a ese paciente en particular.
Cuando se les explica a los pacientes por qué se les cambia un medicamento que ha sido ineficaz, usando la sabiduría popular y el sentido común para definirlo, los pacientes emplean una terminología muy adecuada: “prueba y error”.
Con esta creciente disponibilidad de moléculas que se avecina, se hace necesario el avance de la medicina personalizada, para un mayor desarrollo de marcadores específicos pretratamiento que sean indicadores de eficacia y seguridad, concretamente en el paciente individual.
Son reconocidos los desniveles de desarrollo tecnológico, y es fundamental que los Estados entiendan el costo beneficio de estimular la investigación en este sentido, siendo los países de menores recursos los más necesitados de seleccionar de manera rápida el medicamento adecuado.
Aunque esta revolución de la biología molecular deba ser fuertemente alentada, hay otros aspectos de extraordinaria importancia que deben constituir un requisito básico para aquellos que deciden dedicarse a enfermedades inflamatorias intestinales.
Uno de estos aspectos es remarcar la absoluta necesidad de un minucioso interrogatorio y examen clínico, ya que en el proceso de la compleja elección entre una amplia disponibilidad de tecnologías, la omisión de una pregunta básica puede poner en riesgo a un paciente y tener grandes costos económicos.
Para ilustrar otro aspecto relevante a considerar, nada más apropiado que citar a quien fue un extraordinario gastroenterólogo dedicado a EII, jefe de gastroenterología de la Universidad de Chicago Joseph Kirsner en un reflexivo paper: We are still more than molecules.615 En una discusión realmente enriquecedora, que debería tener cada vez más vigencia para el futuro que se avecina, afirma: “como muchos médicos han enfatizado en el pasado, la información científica, sin importar cuán molecular sea, no puede abarcar la totalidad de una persona enferma ni replicar la respuesta psicológica y emocional individual a las circunstancias desafiantes de la vida. En su sentido más amplio, la enfermedad humana abarca mucho más que las moléculas.
Los logros de la investigación de los últimos tiempos son de hecho magníficos y prometen aún más emocionante revelaciones científicas. La necesidad de más investigación en gastroenterología ciertamente continúa. Pero, en el cuidado de las personas enfermas también hay una necesidad de consideración compasiva del paciente como ser humano”.
Asimismo, este brillante profesional enfatiza: “La necesidad de humanismo y sensibilidad en los contactos con pacientes. Están enfermos y tal vez demasiado sensibles. De hecho, a medida que observan nuestra amplia gama de médicos, personal del hospital y máquinas, y mientras reflexionan sus propios síntomas y las muchas formidables pruebas diagnósticas que les pedimos que realicen, a veces se vuelven muy aprensivos.
Si aún no has tenido esta experiencia, encontrarás que una discusión cautelosa, informativa y amistosa fomentará el desarrollo de la confianza que podrá aumentar la comprensión y la cooperación, y mejorar los resultados de su terapia mucho más allá de las explicaciones tecnológicas.”
Abreviaturas
Ac-Anti-HBsAg: Anticuerpos anti-Antígeno de Superficie Virus Hepatitis BAcAnti-HBc: Anticuerpo Anti-core Hepatitis B.
ACCA: Anticuerpo IgA Anti-chitobioside.
ADA: Adalimumab.
AHLC: Anti-Human Antibody Lambda Chain.
AHLC: Antihuman Lambda Chain.
AI: Activity Index.
AIJ: Artritis idiopática juvenil.
AINEs: Antiinflamatorios no esteroides.
ALCA: Anticuerpo IgG Anti-laminaribioside.
AMA: Anticuerpo antimitocondrial.
AMCA: Anticuerpo IgG anti-mannobioside.
AMPc: Monofosfato cíclico de adenosina.
ANA: Anticuerpos anti-nucleares.
ANCA: Anticuerpo anticitoplama de los neutrófilos.
Anti-Cbir: Anticuerpo anti-flagellina.
Anti-HBc: Hepatitis B Anticuerpos Anti Core.
Anti-HBs: Anticuerpo anti HBsAg.
Anti-I2: Anticuerpo Anti-Pseudomonas fluorescens componente I2.
Anti-OmpC: Anticuerpo Anti-outer-membrana porina C de la Escherichia coli.
Anti-TNF: Anticuerpo Anti-Factor de Necrosis Tumoral.
AR: Artritis reumatoidea.
ASCA IgA: Anticuerpo Anti-Saccharomyces cerevisiae IgA.
ASCA IgG: Anticuerpo Anti-Saccharomyces cerevisiae IgG.
ASMA: Anticuerpo anti-músculo liso.
ATI: Anticuerpos anti-infliximab.
AUC: Área bajo la curva.
AZA: Azatioprina.
5-ASA: Ácido 5-aminosalicílico.
BCG: Bacillus de Calmette y Guérin.
BSG: British Society of Gastroenterology.
CAI: Clínical activity index.
CDAI: Crohn’s Disease Activity Index.
CDC: Center For Disease Control and Prevention.
CDEIS: Crohn’s Disease Endoscopic Index of Severity.
CEP: Colangitis esclerosante primaria.
CESAME: Cancers et Surrisque Associés aux Maladies Inflammatoires Intestinales en France.
CF: Calprotectina fecal.
CMH: Moléculas del complejo mayor de histocompatibilidad.
CMV: Citomegalovirus.
COX-2: Ciclooxigenasa 2.
CUCQ: Crohn’s and Ulcerative Colitis Questionnaire.
CVRS: Score de calidad de vida relacionada con la salud.
CZP: Certolizumab Pegol.
DMARDs: Disease-modifying antirheumatic drugs.
DPTa: Difteria/pertussis/ tetano acelular (Triple viral).
DRESS: Drug Rash Eosinophilia Systemic Symptoms.
DTa: Difteria/tétano acelular (Doble viral).
EA: Espondilitis anquilosante.
EBNA: Epstein-Barr virus nuclear antigen.
EBV: Eipstein Barr Virus.
ECCDS: European Cooperative Crohn’s Disease Study.
ECCO: European Crohn’s and Colitis Organization.
ECLIA: Electrochemiluminescence immunoassay.
ELISA: Enzyme-linked immunosorbent assay.
EMS: Extended Modified Score.
EQ-5D: EuroQoL Quality of Life Scale.
F(ab’)2: Fragment antigen bingding.
FDA: Administración de Drogas y Alimentos (EE.UU.).
GAES: Global assessment of endoscopic severity.
GETAID: Groupe d’Étude Thérapeutiques des Affections Inflammatoires Digestives.
GETTECCU: Grupo Español de trabajo en Enfermedad de Crohn y Colitis ulcerosa ACG: America College of Gastroenterology.
GLM: Golimumab.
HAI: Hemaglutinación Indirecta.
HAV IgG: IgG Anti-Virus Hepatitis A.
HAV IgM: IgM Anti-Virus Hepatitis A.
HBeAg: Hepatitis B e-Antigen.
HBI: Harvey-Bradshaw Index.
HBsAg: Surface antigen Hepatistis B Virus.
HEV: High endothelial venules.
HIV: Human Immunodeficiency Virus Infection.
HLA: Human leucocite antigen.
HMSA: Homogenous mobility shift assay.
HPRT: Hipoxantina-fosforibosiltransferasa.
HPV: Human papillomavirus.
HR: Hazard Ratio.
I.D.O.M.E: Inflamación detectada objetivamente por métodos de estudio.
IBDQ: Inflammatory Bowel Disease Questionnary.
IBSEN: Inflammatory Bowel South-Eastern Norway.
ICC: Insuficiencia cardíaca congestiva.
ICF: International Classification of Functioning, Disability and Health.
IFX: Infliximab.
IGRA: Ensayo de liberación de IFNγ.
IMM: Inmunomoduladores.
IMPDH: Inosin-monofosfato dehidrogenasa.
IOIBD: International Organization for the Study of Inflammatory Bowel Diseases.
IOIBD: Organización Mundial de Gastroenterología (WGO), la Organización International para la Enfermedad Inflamatoria Intestinal.
IPAA: Ileal pouch anal anastomosis.
IPV/Salk: Inactivated Polio Vaccine.
IS: Inmunosupresores.
JAK: Janus Kinasa.
LC-MS/MS: Liquid chromatog raphy-mass spectrometry.
LFA-1: Lymphocyte function-associated antigen 1.
LKM: Anticuerpo anti-microsomales de hígado y riñón tipo 1.
LOCF: Last Observation Carried Forward.
LTS: Long Term Safety.
MAdCAM-1: mucosal addressin-cell adhesion 1.
MAP: Mycobacterium avium, subespecie paratuberculosis.
MaRIA: Magnetic Resonance Index of Activity.
MEI: Manifestaciones extraintestinales.
MMES: The Modified Mayo Endoscopic Score.
MMR: Measles, mumps, and rubella Vaccine (Triple Viral).
MMX: Multi-matrix technology.
MR: Mumps, and rubella Vaccine (Doble viral).
MRS: Modified Riley Score.
MS: Modified Score.
MTHFR: La metiltentrahidrofolatoreductasa.
MTX: Metotrexato.
6-MMPR: 6-metilmercaptopurina ribonucleótido.
6MMP: 6-Metil Mercapto Purina.
6-MP: 6-mercaptopurina.
NCCDS: National cooperative Crohn’s disease study.
NFAT: Nuclear factor of activated T-cells.
NMSC: Por sus siglas en inglés Nonmelanona Skin Cancer.
NNH: Number needed to harm.
NRI: No responder imputation.
OPV/Sabin: Oral Polio Vaccine.
PA: Pacientes año.
PAB: Anti-pancreatic antibody.
PAI-1: Gen plaminogen activator inhibitor tipe 1.
PAR-γ: Peroxisome proliferator-activated receptor-γ.
PCR: Proteína C reactiva.
PCRus: PCR ultrasensible.
PDAI: Perianal Disease Activity Index.
PGA: Physician Global Assessment.
PML: Leucoencefalopatía multifocal progresiva.
PPD: Derivado proteico purificado.
PPSV23: Pneumococcal polysaccharide vaccine.
ProNaCEI: Programa Nacional de Control de Enfermedades Inmunoprevenibles.
PROs: “Patient-reported outcomes” (Resultados informados por los pacientes).
PS: Psoriasis.
PSGL-1: P-selectin glycoprotein ligand-1.
RIA: Radioimmunoassay.
RMN: Resonancia Magnética Nuclear.
S1P: Esfingosina-1-Fosfato, Sphingosine 1 Phosphate.
SAE: Serious Adverse Events.
SAES: Segmental assessment of endoscopic severity.
SASP: Salicilizasulfapiridina.
SES-CD: Simple Endoscopic Score for Crohn’s Disease.
SF-36: Short-form 36 health survey.
SIEs: Serious Infectious Events.
SII: Síndrome de intestino irritable.
SIR: Standardized Incidence Rates.
SMAD: Mothers against decapentaplegic homolog.
SP: Sulfapiridina.
SpAs: Las espondiloartropatías.
STRIDE: Selecting Therapeutic Targets in Inflammatory in Bowel Disease.
TAC: Tomografia Axia computarizada.
TDM: Therapeutic Drug Monitoring.
TEM: Tasa Estandarizada de Mortalidad.
TG: Tiogranina.
TGFβ: Transforming growth factor β.
TNF-a: Fator de necrosis tumora Alfa.
TPMT: Tiopurin Metil Transferasa.
TREAT: The Crohn’s Therapy, Resource, Evaluation, and Assessment Tool.
6-TG: 6-tioguanina nucleótido.
6-TIMP: 6-tioinosínico 5’monofosfato.
UCCIS: Ulcerative colitis colonoscopic index of severity.
UCEIS: Ulcerative colitis endoscopic index of severity.
VDRL: Venereal Disease, Research Laboratory test.
VPN: Valor predictivo negativo.
VSG: Velocidad de Sedimentación Globular.
VZV: Varicella Zoster Virus.
WGO: Organización Mundial de Gastroenterología (WGO).
XO: Xantino oxidasa.
Referencias
- Lakatos L, Lakatos PL. Is the incidence and prevalence of inflammatory bowel diseases increasing in Eastern Europe? Postgrad Med J 2006; 82: 332-337.
- Molodecky NA, Soon IS, Rabi DM, Ghali WA, Ferris M, Chernoff G, Benchimol EI, Panaccione R, Ghosh S, Barkema HW, Kaplan GG. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology 2012; 142: 46-54.
- Baumgart DC, Carding SR. Inflammatory bowel disease: cause and immunobiology. The Lancet 2007; 369: 1627-1640.
- Loftus EV Jr. Clinical epidemiology of inflammatory bowel disease. Incidence, prevalence, and environmental influences. Gastroenterology 2004; 12: 1504-1517.
- Burisch J, Jess T, Martinato M, Lakatos PL; ECCO-EpiCom. The burden of inflammatory bowel disease in Europe. J Crohns Colitis 2013; 7: 322-337.
- Hou Jk, El-Serag H, Thirumurthi S. Distribution and manifestations of inflammatory bowel disease in Asians, Hispanics and African Americans: a systematic review. Am J Gastroenterol 2009; 104: 2100-2109.
- Kaplan GG. The global burden of IBD: from 2015 to 2025. Nat Rev Gastroenterol Hepatol 2015; 12: 720-727.
- Pena AS. Contribution of genetics to a new vision in the understanding of inflammatory bowel disease. World J Gastroenterol 2006; 12: 4784-4787.
- Kaistha A, Levine J. Inflammatory bowel disease: the classic gastrointestinal autoimmune disease. Curr Probl Pediatr Adolesc Health Care 2014; 44: 328-334.
- Macdonald TT, Monteleone G, Pender SL. Recent developments in the immunology of inflammatory bowel disease. Scand J Immunol 2000; 51: 2-9.
- Scharl M, Rogler G. Inflammatory bowel disease pathogenesis: what is new? Curr Opin Gastroenterol 2012; 28: 301-309.
- Dignass A, Eliakim R, Magro F, Maaser C, Chowers Y, Geboes K, Mantzaris G, Reinisch W, Colombel JF, Vermeire S, Travis S, Lindsay JO, Van Assche G. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 1: definitions and diagnosis. J Crohns Colitis 2012; 6: 965-990.
- Ananthakrishnan AN, McGinley EM, Binion DG, Saeian K. Ambient air pollution correlates with hospitalizations for inflammatory bowel disease. An ecologic analisis. Inflamm Bowel Dis 2011; 17: 1138-1145.
- Lindberg E, Tysk C, Andersson K, Järnerot G. Smoking and inflammatory bowel disease. A case control study. Gut 1988; 29: 352-357.
- Cosnes J, Beaugerie L, Carbonnel F, Gendre JP. Smoking cessation and the course of Crohn’s disease: an intervention study. Gastroenterology 2001; 120: 1093-1099.
- Boyko EJ, Koepsell TD, Perera DR, Inui TS. Risk of ulcerative colitis among former and current cigarette smokers. N Engl J Med 1987; 316: 707-710.
- Beaugerie L, Massot N, Carbonnel F, Cattan S, Gendre JP, Cosnes J. Impact of cessation of smoking on the course of ulcerative colitis. Am J Gastroenterol 2001; 96: 2113-2116.
- Mahid SS, Minor KS, Soto RE, Hornung CA, Galandiuk S. Smoking and inflammatory bowel disease: a meta-analysis. Mayo Clin Proc 2006; 81: 1462-1471.
- Calkins BM. A meta-analysis of the role of smoking in inflammatory bowel disease. Dig Dis Sci 1989; 34: 1841-1854.
- Franceschi S, Panza E, La Vecchia C, Parazzini F, Decarli A, Bianchi Porro G. Nonspecific inflammatory bowel disease and smoking. Am J Epidemiol 1987; 125: 445-452.
- Buisson A, Chevaux JB, Allen PB, Bommelaer G, Peyrin-Biroulet L. Review article: the natural history of postoperative Crohn’s disease recurrence. Aliment Pharmacol Ther 2012; 35: 625-633.
- Nunes T, Etchevers MJ, Merino O, Nunes T, Merino O, Gallego S, García-Sánchez V, Marín-Jiménez I, Menchén L, Barreiro-de Acosta M, Bastida G, García S, Gento E, Ginard D, Martí E, Gomollón F, Arroyo M, Monfort D, García-Planella E, González B, Loras C, Agustí C, Figueroa C, Sans M; TABACROHN Study Group of GETECCU. High smoking cessation rate in Crohn’s disease patients after physician advice – the TABACROHN Study. J Crohns Colitis 2013; 7: 202-207.
- Kaplan GG, Pedersen BV, Andersson RE, Sands BE, Korzenik J, Frisch M. The risk of developing Crohn’s disease after an appendectomy: a population-based cohort study in Sweden and Denmark. Gut 2007; 56: 1387-1392.
- Andersson RE, Olaison G, Tysk C, Ekbom A. Appendectomy is followed by increased risk of Crohn’s disease. Gastroenterology 2003; 124: 40-46.
- Bridger S, Lee JC, Bjarnason I, Jones JE, Macpherson AJ. In siblings with similar genetic susceptibility for inflammatory bowel disease, smokers tend to develop Crohn’s disease and non-smokers develop ulcerative colitis. Gut 2002; 51: 21-25.
- Van Assche G, Dignass A, Panes J, Beaugerie L, Karagiannis J, Allez M, Ochsenkühn T, Orchard T, Rogler G, Louis E, Kupcinskas L, Mantzaris G, Travis S, Stange E; European Crohn’s and Colitis Organisation (ECCO). The second European evidence-based consensus on the diagnosis and management of Crohn’s disease: definitions and diagnosis. J Crohns Colitis 2010; 4: 7-27.
- Molodecky NA, Kaplan GG. Environmental risk factors for inflammatory bowel disease. Gastroenterol Hepatol 2010; 6: 339-346.
- Martin J, Kane S, Feagins L. Fertility and contraception in women with inflammatory bowel disease. Gastroenterology & Hepatology 2016; 12: 101.
- Reinisch W, Miehsler W, Dejaco C, Harrer M, Waldhoer T, Lichtenberger C, Vogelsang H. An open-label trial of the selective cyclo-oxygenase-2 inhibitor, rofecoxib, in inflammatory bowel disease-associated peripheral arthritis and arthralgia. Aliment Pharmacol Ther 2003; 17: 1371-1380.
- García Rodríguez LA, Ruigomez A, Panes J. Acute gastroenteritis is followed by an increased risk of inflammatory bowel disease. Gastroenterology 2006; 130: 1588-1594.
- Kaplan GG, Hubbard J, korzenik J, Sands BE, Panaccione R, Ghosh S, Wheeler AJ, Villeneuve PJ. The inflammatory bowel diseases and ambient air pollution: a novel association. Am J Gastroenterol 2010; 105: 2412-2419.
- Järnerot G, Jarnmark I, Nilsson K. Consumption of refined sugar by patients with Crohn’s disease, ulcerative colitis, or irritable bowel syndrome. Scand J Gastroenterol 1983; 18: 999-1002.
- Liverani E, Scaioli E, Cardamone C, Dal Monte P, Belluzzi A. Mycobacterium avium subspecies paratuberculosis in the etiology of Crohn’s disease, cause or epiphenomenon? World J Gastroenterol 2014; 20: 13060-13070.
- Sands BE. From symptom to diagnosis: clinical distinctions among various forms of intestinal inflammation. Gastroenterology 2004; 126: 1518-1532.
- Lennard-Jones JE. Crohn’s disease: definition, pathogenesis, aetiology. Clin Gastroenterol 1980: 173-189.
- Angelberger S, Schweiger K, Peyrin-Biroulet L, Panes J, Reinisch W. Sensitivity of Lennard-Jones criteria in the diagnosis of Crohn’s disease. Gastroenterology 2013; 144: S426.
- Silverberg MS, Satsangi J, Ahmad T, Arnott ID, Bernstein CN, Brant SR, Caprilli R, Colombel JF, Gasche C, Geboes K, Jewell DP, Karban A, Loftus EV Jr, Peña AS, Riddell RH, Sachar DB, Schreiber S, Steinhart AH, Targan SR, Vermeire S, Warren BF. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol 2005; 19: 5A-36A.
- Baumgart DC, Sandborn WJ. Inflammatory bowel disease: clinical aspects and established and evolving therapies. The Lancet 2007; 369: 1641-1657.
- Magro F, Langner C, Driessen AJ, Ensari A, Geboes K, Mantzaris GJ, Villanacci V, Becheanu G, Borralho Nunes P, Cathomas G, Fries W, Jouret-Mourin A, Mescoli C, de Petris G, Rubio CA, Shepherd NA, Vieth M, Eliakim R; European Society of Pathology (ESP); European Crohn’s and Colitis Organisation (ECCO). European consensus on the histopathology of inflammatory bowel disease. Crohns Colitis 2013; 7: 827-851.
- Geboes K. Histopathology of Crohn’s disease and ulcerative colitis. In: Satsangi J, Sutherland L (eds). Inflammatory bowel disease, 4th London: Harcourt 2003; cap 18: 255-276.
- Riley SA, Mani V, Goodman MJ, Dutt S, Herd ME. Microscopic activity in ulcerative colitis: what does it mean? Gut 1991; 32: 174-178.
- Villanacci V, Antonelli E, Geboes K, Casella G, Bassotti G. Histological healing in inflammatory bowel disease: a still unfulfilled promise. World Journal of Gastroenterology 2013; 19: 968-978.
- Feagan BG, Greenberg GR, Wild G, Fedorak RN, Paré P, McDonald JW, Dubé R, Cohen A, Steinhart AH, Landau S, Aguzzi RA, Fox IH, Vandervoort MK. Treatment of ulcerative colitis with a humanized antibody to the alpha4beta7 integrin. N Engl J Med 2005; 352: 2499-2507.
- Mosli MH, Feagan BG, Zou G, Sandborn WJ, D’Haens G, Khanna R, Shackelton LM, Walker CW, Nelson S, Vandervoort MK, Frisbie V, Samaan MA, Jairath V, Driman DK, Geboes K, Valasek MA, Pai RK, Lauwers GY, Riddell R, Stitt LW, Levesque BG. Development and validation of a histological index for UC. Gut 2017; 66: 50-58.
- Marchal-Bressenot A, Salleron J, Boulagnon-Rombi C, Bastien C, Cahn V, Cadiot G, Diebold MD, Danese S, Reinisch W, Schreiber S, Travis S, Peyrin-Biroulet L. Gut 2017; 66: 43-49.
- Mosli MH, Parker CE, Nelson SA, Baker KA, MacDonald JK, Zou GY, Feagan BG, Khanna R, Levesque BG, Jairath V. Histologic scoring indices for evaluation of disease activity in ulcerative colitis. Cochrane database of systematic reviews 2017; 5: CD011256.
- Barreiro-de Acosta M, Magro F, Carpio D, Lago P, Echarri A, Cotter J, Pereira S, Gonçalves R, Lorenzo A, Carvalho L, Castro J, Barros L, Días JA, Rodrigues S, Portela F, Días C, Da Costa-Pereira A; GEDII; EIGA. Ulcerative colitis in northern Portugal and Galicia in Spain. Inflamm Bowel Dis 2010; 16: 1227-1238.
- Solberg IC, Høivik Ml, Cvancarova M, Moum B, IBSEN Study Group. Risk matrix model for prediction of colectomy in a population-based study of ulcerative colitis patients (the IBSEN study). Scand J Gastroenterol 2015; 50: 1456-1462.
- Truelove SC, Witts LJ. Cortisone in ulcerative colitis; final report on a therapeutic trial. Br Med J 1955; 2: 1041-1048.
- Brown SR, Haboubi N, Hampton J, George B, Travis SP. The management of acute severe colitis: ACPGBI position statement. Colorectal Dis 2008; 10: 8-29.
- Kornbluth A, Sachar DB. Ulcerative colitis practice guidelines in adults (update). American College of Gastroenterology, Practice Parameters Committee. Am J Gastroenterol 2004; 99: 1371-1385.
- Gomollón F, García-López S, Sicilia B, Gisbert JP, Hinojosa J; Grupo Español de Trabajo de Enfermedad de Crohn y Colitis Ulcerosa [Spanish Group for Working on Crohn’s Disease and Ulcerative Colitis] (GETECCU). Guía clínica GETECCU del tratamiento de la colitis ulcerosa elaborada con la metodología GRADE. Gastroenterol Hepatol 2013; 36: e1-e47.
- Schroeder KW, Tremaine WJ, Ilstrup DM. Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis. A randomized study. N Engl J Med 1987; 317: 1625-1629.
- Lewis JD, Chuai S, Nessel L, Lichtenstein GR, Aberra FN, Ellenberg JH. Use of the noninvasive components of the Mayo score to assess clinical response in ulcerative colitis. Inflamm Bowel Dis 2008; 14: 1660-1666.
- Seo M, Okada M, Yao T, Ueki M, Arima S, Okumura M. An index of disease activity in patients with ulcerative colitis. Am J Gastroenterol 1992; 87: 971-976.
- Lichtiger S. Cyclosporin therapy in inflammatory bowel disease: open-label experience. Mt Sinai J Med 1990; 57: 315-319.
- Ho GT, Mowat C, Goddard CJR, Fennell JM, Shah NB, Prescott RJ, Satsangi J. Predicting the outcome of severe ulcerative colitis: development of a novel risk score to aid early selection of patients for second-line medical therapy or surgery. Aliment Pharmacol Ther 2004; 19: 1079-1087.
- Rachmilewitz D. Coated mesalazine (5-aminosalicylic acid) versus sulphasalazine in the treatment of active ulcerative colitis: a randomised trial. Br Med J 1989; 298: 82-86.
- Powell-Tuck J, Brown Rl, Lennard-Jones E. A comparison of oral prednisolone given as a single or multiple daily doses for active proctocolitis. Scand J Gastroenterol 1978; 13: 833-837.
- Travis SP, Farrant JM, Ricketts C, Nolan DJ, Mortensen NM, Kettlewell MG, Jewell DP. Predicting outcome in severe ulcerative colitis. Gut 1996; 38: 905-910.
- Lindgren SC, Flood LM, Kilander AF, Löfberg R, Persson TB, Sjödahl RI. Early predictors of glucocorticosteroid treatment failure in severe and moderately severe attacks of ulcerative colitis. Eur J Gastroenterol Hepatol 1998; 10: 831-835.
- Aceituno M, García-Planella E, Heredia C, Zabana Y, Feu F, Domènech E, Gassull Ma, Panés J. Steroid-refractory ulcerative colitis: predictive factors of response to cyclosporine and validation in an independent cohort. Inflamm Bowel Dis 2008; 14: 3.
- Walmsley RS, Ayres RCS, Pounder RE, Allan RN. A simple clinical colitis activity index. Gut 1998; 43: 29-32.
- Sutherland LR, Martin F, Greer S, Robinson M, Greenberger N, Saibil F, Martin T, Sparr J, Prokipchuk E, Borgen L. 5-aminosalicylic acid enema in the treatment of distal ulcerative colitis, proctosigmoiditis, and proctitis. Gastroenterology 1987; 92: 1894-1898.
- Travis SP, Schnell D, Krzeski P, Abreu MT, Altman DG, Colombel JF, Feagan BG, Hanauer SB, Lémann M, Lichtenstein GR, Marteau PR, Reinisch W, Sands BE, Yacyshyn BR, Bernhardt CA, Mary JY, Sandborn WJ. Developing an instrument to assess the endoscopic severity of ulcerative colitis: the ulcerative colitis endoscopic index of severity (UCEIS). Gut 2012; 61: 535-542.
- Travis SP, Schnell D, Krzeski P, Abreu MT, Altman DG, Colombel JF, Feagan BG, Hanauer SB, Lichtenstein GR, Marteau PR, Reinisch W, Sands BE, Yacyshyn BR, Schnell P, Bernhardt CA, Mary JY, Sandborn WJ. Reliability and initial validation of the ulcerative colitis endoscopic index of severity. Gastroenterology 2013; 145: 987-995.
- Vuitton L, Peyrin-Biroulet L, Colombel JF, Pariente B, Pineton de Chambrun G, Walsh AJ, Panes J, Travis SP, Mary JY, Marteau P. Defining endoscopic response and remission in ulcerative colitis clinical trials: an international consensus. Aliment Pharmacol Ther 2017; 45: 801-813.
- Corte C, Fernandopulle N, Catuneanu AM, Burger D, Cesarini M, White L, Keshav S, Travis S. Association between the ulcerative colitis endoscopic index of severity (UCEIS) and outcomes in acute severe ulcerative colitis. J Crohns Colitis 2015; 9: 376-381.
- Samuel S, Bruining DH, Loftus EV Jr, Thia KT, Schroeder KW, Tremaine WJ, Faubion WA, Kane SV, Pardi DS, de Groen PC, Harmsen WS, Zinsmeister AR, Sandborn WJ. Validation of the ulcerative colitis colonoscopic index of severity and its correlation with disease activity measures. Clin Gastroenterol Hepatol 2013; 11: 49-54.
- Carbonnel F, Gargouri D, Lémann M, Beaugerie L, Cattan S, Cosnes J, Gendre JP. Predictive factors of outcome of intensive intravenous treatment for attacks of ulcerative colitis. Aliment Pharmacol Ther 2000; 14: 273-279.
- Lobaton T, Bessissow T, De Hertogh G, Lemmens B, Maedler C, Van Assche G, Bisschops R, Rutgeerts P, Bitton A, Afif W, Marcus V, Ferrante M. The modified Mayo endoscopic score (MMES): a new index for the assessment of extension and severity of endoscopic activity in ulcerative colitis patients. J Crohns Colitis 2015; 9: 846-852.
- Harbord M, Annese V, Vavricka SR, Allez M, Barreiro-de Acosta M, Boberg KM, Burisch J, De Vos M, De Vries AM, Dick AD, Juillerat P, Karlsen TH, Koutroubakis I, Lakatos PL, Orchard T, Papay P, Raine T, Reinshagen M, Thaci D, Tilg H, Carbonnel F; European Crohn’s and Colitis Organisation (ECCO). The first european evidence-based consensus on extra-intestinal manifestations in inflammatory bowel disease. J Crohns Colitis 2016; 10: 239-254.
- Best WR, Becktel JM, Singleton JW, Kern F Jr. Development of a Crohn’s disease activity index. National Cooperative Crohn’s Disease Study. Gastroenterology 1976; 70: 439-444.
- Sandborn WJ, Feagan BG, Hanauer SB, Lochs H, Löfberg R, Modigliani R, Present DH, Rutgeerts P, Schölmerich J, Stange EF, Sutherland LR. A review of activity indices and efficacy endpoints for clinical trials of medical therapy in adults with Crohn’s disease. Gastroenterology 2002; 122: 512-530.
- Harvey RF, Bradshaw JM. A simple index of Crohn’s-disease activity. Lancet 1980; 1: 514.
- Vermeire S, Schreiber S, Sandborn WJ, Dubois C, Rutgeerts P. Correlation between the Crohn’s disease activity and Harvey-Bradshaw indices in assessing Crohn’s disease severity. Clin Gastroenterol Hepatol 2010; 8: 357-363.
- Panaccione R, Loftus EV, Binion D, Mchugh K, Alam S, Chen N, Guérette B, Mulani P, Chao J. Efficacy and safety of adalimumab in canadian patients with moderate to severe Crohn’s disease: results of the adalimumab in canadian subjects with moderate to severe Crohn’s disease (ACCESS) trial. Can J Gastroenterol 2011; 25: 419-425.
- Van Hees PA, Van Elteren P H, Van Lier H J, Van Tongeren J H. An index of inflammatory activity in patients with Crohn’s disease. Gut 1980; 21: 279-286.
- Mary JY, Modigliani R. Development and validation of an endoscopic index of the severity for Crohn’s disease: a prospective multicentre study. Groupe d’Etudes Therapeutiques des Affections Inflammatoires du Tube Digestif (GETAID). Gut 1989; 30: 983-989.
- Peyrin-Biroulet L, Sandborn W, Sands BE, Reinisch W, Bemelman W, Bryant RV, D’Haens G, Dotan I, Dubinsky M, Feagan B, Fiorino G, Gearry R, Krishnareddy S, Lakatos PL, Loftus EV Jr, Marteau P, Munkholm P, Murdoch TB, Ordás I, Panaccione R, Riddell RH, Ruel J, Rubin DT, Samaan M, Siegel CA, Silverberg MS, Stoker J, Schreiber S, Travis S, Van Assche G, Danese S, Panes J, Bouguen G, O’Donnell S, Pariente B, Winer S, Hanauer S, Colombel JF. Selecting therapeutic targets in inflammatory bowel disease (STRIDE): determining therapeutic goals for treat-to-target. Am J Gastroenterol 2015; 110: 1324-3138.
- Daperno M, D’Haens G, Van Assche G, Baert F, Bulois P, Maunoury V, Sostegni R, Rocca R, Pera A, Gevers A, Mary JY, Colombel JF, Rutgeerts P. Development and validation of a new, simplified endoscopic activity score for Crohn’s disease: the SES-CD. Gastrointest Endosc 2004; 60: 505-512.
- Sipponen T, Nuutinen H, Turunen U, Farkkila M. Endoscopic evaluation of Crohn’s disease activity: comparison of the CDEIS and the SES-CD. Inflamm Bowel Dis 2010; 16: 2131-2136.
- Schnitzler F, Fidder H, Ferrante M, Noman M, Arijs I, Van Assche G, Hoffman I, Van Steen K, Vermeire S, Rutgeerts P. Mucosal healing predicts long-term outcome of maintenance therapy with infliximab in Crohn’s disease. Gut 2009; 15: 1295-1301.
- Frøslie KF, Jahnsen J, Moum BA, Vatn MH; Ibsen Group. Mucosal healing in inflammatory bowel disease: results from a norwegian population-based cohort. Gastroenterology 2007; 133: 412-422.
- Present DH, Rutgeerts P, Targan S, Hanauer SB, Mayer L, Van Hogezand RA, Podolsky DK, Sands BE, Braakman T, DeWoody KL, Schaible TF, Van Deventer SJ. Infliximab for the treatment of fistulas in patients with Crohn’s disease. N Engl J Med 1999; 340: 1398-1405.
- Irvine EJ. Usual therapy improves perianal Crohn’s disease as measured by a new disease activity index. McMaster IBD Study Group. J Clin Gastroenterol 1995; 20: 27-32.
- Satsangi J, Silverberg MS, Vermeire S, Colombel J. The Montreal classification of inflammatory bowel disease: controversies, consensus and implications. Gut 2006; 55: 749-753.
- Gisbert JP, González-Lama Y, Mate J. Role of biological markers in inflammatory bowel disease. Gastroenterol Hepatol 2007; 30: 117-1129.
- Tibble JA, Bjarnason I. Non-invasive investigation of inflammatory bowel disease. World J Gastroenterol 2001; 7: 460-465.
- Díaz-Jiménez D, Núñez LE, Beltrán CJ, Candia E, Suazo C, Álvarez-Lobos M, González MJ, Hermoso MA, Quera R. Soluble ST2: a new and promising activity marker in ulcerative colitis. Soluble ST2: a new and promising activity marker in ulcerative colitis. World J Gastroenterol 2011; 17: 2181-2190.
- Vermeire S, Van Assche G, Rutgeerts P. C-reactive protein as a marker for inflammatory bowel disease. Inflamm Bowel Dis 2004; 10: 661-665.
- Boirivant M, Leoni M, Tariciotti D, Fais S, Squarcia O, Pallone F. The clinical significance of serum C reactive protein levels in Crohn’s disease. Results of a prospective longitudinal study. J Clin Gastroenterol 1988; 10: 401-405.
- Sachar DB, Luppescu NE, Bodian C, Shlien RD, Fabry TL, Gumaste VV. Erythrocyte sedimentation as a measure of Crohn’s disease activity: opposite trends in ileitis versus colitis. J Clin Gastroentero 1990; 12: 643-646.
- Sipponen T, Bjorkesten CG, Farkkila M, Nuutinen H, Savilahti E, Kolho KL. Faecal calprotectin and lactoferrin are reliable surrogate markers of endoscopic response during Crohn’s disease treatment. Scand J Gastroenterol 2010; 45: 325-331.
- Sipponen T, Savilahti E, Kolho KL, Nuutinen H, Turunen U, Farkkila M. Crohn’s disease activity assessed by fecal calprotectin and lactoferrin: correlation with Crohn’s disease activity index and endoscopic findings. Inflamm Bowel Dis 2008; 14: 40-46.
- Molander P, Sipponen T, Kemppainen H, Jussila A, Blomster T, Koskela R, Nissinen M, Rautiainen H, Kuisma J, Kolho KL, Färkkilä M. Achievement of deep remission during scheduled maintenance therapy with TNFa-blocking agents in IBD. J Crohns Colitis 2013; 7: 730-735.
- Vermeire S, Van Assche G, Rutgeerts P. Laboratory markers in IBD: useful, magic, or unnecessary toys? Gut 2006; 55: 426-431.
- Naismith GD, Smith LA, Barry SJ, Munro JI, Laird S, Rankin K, Morris AJ, Winter JW, Gaya DR. A prospective evaluation of the predictive value of faecal calprotectin in quiescent Crohn’s disease. J Crohns Colitis 2014; 8: 1022-1029.
- Schoepfer AM, Beglinger C, Straumann A, Trummler M, Vavricka SR, Bruegger LE, Seibold F. Fecal calprotectin correlates more closely with the simple endoscopic score for Crohn’s disease (SES-CD) than CRP, blood leukocytes and the CDAI. Am J Gastroenterol 2009; 105: 162-169.
- D’Haens G, Ferrante M, Vermeire S, Baert F, Noman M, Moortga L, Geens P, Iwens D, Aerden I, Van Assche G, Van Olmen G, Rutgeert P. Fecal calprotectin is a surrogate marker for endoscopic lesions in inflammatory bowel disease. Inflamm Bowel Dis 2012; 18: 2218-2224.
- Costa F, Mumolo MG, Ceccarelli L, Bellini M, Romano MR, Sterpi C, Ricchiuti A, Marchi S, Bottai M. Calprotectin is a stronger predictive marker of relapse in ulcerative colitis than in Crohn’s disease. Gut 2005; 54: 364-368.
- Meuwis MA, Vernier-Massouille G, Grimaud JC, Bouhnik Y, Laharie D, Piver E, Seidel L, Colombel JF, Louis E; GETAID (Groupe d’Étude Thérapeutique des Affections Inflammatoires du Tuve Digestif). Serum calprotectin as a biomarker for Crohn’s disease. J Crohns Colitis 2013; 7: e678-e683.
- Dubinsky MC, Kugathasan S, Mei L, Picornell Y, Nebel J, Wrobel I, Quiros A, Silber G, Wahbeh G, Katzir L, Vasiliauskas E, Bahar R, Otley A, Mack D, Evans J, Rosh J, Hemker MO, Leleiko N, Crandall W, Langton C, Landers C, Taylor KD, Targan SR, Rotter JI, Markowitz J, Hyams J; Western Regional Pediatric IBD Research Alliance; Pediatric IBD Collaborative Research Group; Wisconsin Pediatric IBD Alliance. Increased immune reactivity predicts aggressive complicating Crohn’s disease in children. Clin Gastroenterol Hepatol 2008; 6: 1105-1111.
- Ferrante M, Henckaerts L, Joossens M, Pierik M, Joossens, Dotan N, Norman GL, Altstock RT, Van Steen K, Rutgeerts P, Van Assche G, Vermeire S. New serological markers in inflammatory bowel disease are associated with complicated disease behaviour. Gut 2007; 56: 1394-1403.
- Vasiliauskas EA, Kam LY, Karp LC, Gaiennie J, Yang H, Targan SR. Marker antibody expression stratifies Crohn’s disease into immunologically homogeneous subgroups with distinct clinical characteristics. Gut 2000; 47: 487-496.
- Masachs M, Casellas F, Malagelada JR. Spanish translation, adaptation, and validation of the 32-item questionnaire on quality of life for inflammatory bowel disease (IBDQ-32). Rev Esp Enfermedades Dig Organo Of Soc Esp Patol Dig 2007; 99: 511-519.
- Alcalá MJ, Casellas F, Fontanet G, Prieto L, Malagelada JR. Shortened questionnaire on quality of life for inflammatory bowel disease. Shortened questionnaire on quality of life for inflammatory bowel disease. Inflamm Bowel Dis 2004; 10: 383-391.
- D’Haens G, Sandborn WJ, Feagan BG, Geboes K, Hanauer SB, Irvine EJ, Lémann M, Marteau P, Rutgeerts P, Scholmerich J, Sutherland LR. A review of activity indices and efficacy end points for clinical trials of medical therapy in adults with ulcerative colitis. Gastroenterology 2007; 132: 763-786.
- Bessidow T, Lemmens B, Ferrante M, Bisschops R, Van Steen K, Geboes K, Van Assche, Vermeire S, Rutgeerts P, De Hertogh G. Prognostic value of serologic and histologic markers on clinical relapse in ulcerative colitis patients with mucosal healing. Am J Gastroenterol 2012; 107: 1684-1692.
- Edwards FC, Truelove SC. The course and prognosis of ulcerative colitis. Gut 1963; 4: 299-315.
- Faubion WA, Loftus EV Jr, Harmsen WS, Zinsmeister AR, Sandborn WJ. The natural history of corticosteroid therapy for inflammatory bowel disease: a population-based study. Gastroenterology 2001; 121: 255-260.
- Truelove SC, Jewell DP. Intensive intravenous regimen for severe attacks of ulcerative colitis. Lancet 1974; 1: 1067-1070.
- Hanauer SB, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, Rachmilewitz D, Wolf DC, Olson A, Bao W, Rutgeerts P. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet 2002; 359: 1541-1549.
- Rutgeerts P, D’Haens G, Targan S, Vasiliauskas E, Hanauer SB, Present DH, Mayer L, Van Hogezand RA, Braakman T, Dewoody KL, Schaible TF, Van Deventer SJ. Efficacy and safety of retreatment with anti-tumor necrosis factor antibody (infliximab) to maintain remission in Crohn’s disease. Gastroenterology 1999; 117: 761-769.
- Rutgeerts P, Geboes K, Vantrappen G, Beyls J, Kerremans R, Hiele M. Predictability of the postoperative course of Crohn’s disease. Gastroenterology 1990; 99: 956-963.
- Rimola J, Ordás I, Rodriguez S, García-Bosch O, Aceituno M, Llach J, Ayuso C, Ricart E, Panés J. Magnetic resonance imaging for evaluation of Crohn’s disease: validation of parameters of severity and quantitative index of activity. Inflamm Bowel Dis 2011; 17: 1759-1768.
- Peyrin-Biroulet L, Loftus EV, Colombel JF, Sandborn WJ. Early Crohn disease: a proposed definition for use in disease-modification trials. Gut 2010; 59: 141-147.
- Louis E, Collard A, Oger AF, Degroote E, Aboul Nasr El Yafi F, Belaiche J. Behaviour of Crohn’s disease according to the Vienna classification: changing pattern over the course of the disease. Gut 2001; 49: 777-782.
- Cosnes J, Cattan S, Blain A, Beaugerie L, Carbonnel F, Parc R, Gendre JP. Long-term evolution of disease behavior of Crohn’s disease. Inflamm Bowel Dis 2002; 8: 244-250.
- Sambuelli A, Negreira SM, Gil A, Huernos S, Bai J. Variation of Crohn´s disease (CD) behavior during the course of the disease. Gastroenterology 2002; 122: A605.
- Rieder F, Zimmermann EM, Remzi FH, Sandborn WJ. Crohn’s disease complicated by strictures: a systematic review. Gut 2013; 62: 1072-1084.
- Thia KT, Sandborn WJ, Harmsen WS, Zinsmeister AR, Loftus EV Jr. Risk factors associated with progression to intestinal complications of Crohn’s disease in a population-based cohort. Gastroenterology 2010; 139: 114-1155.
- Peyrin-Biroulet L, Loftus EV Jr, Colombel JF, Sandborn WJ. The natural history of adult Crohn’s disease in population-based cohorts. Am J Gastroenterol 2010; 105: 289-297.
- Munkholm P, Langholz E, Davidsen M, Binder V. Show more Intestinal cancer risk and mortality in patients with Crohn’s disease. Gastroenterology 1993; 105: 1716-1723.
- Kugathasan S, Saubermann LJ, Smith L, Kou D, Itoh J, Binion DG, Levine AD, Blumberg RS, Fiocchi C. Mucosal T-cell immunoregulation varies in early and late inflammatory bowel disease. Gut 2007; 56: 1696-1705.
- Zorzi F, Monteleone I, Sarra M, Calabrese E, Marafini I, Cretella M, Sedda S, Biancone L, Pallone F, Monteleone G. Distinct profiles of effector cytokines mark the different phases of Crohn’s disease. PloS One 2013; 8: e54562.
- Colombel JF, Sandborn WJ, Rutgeerts P, Enns R, Hanauer SB, Panaccione R, Schreiber S, Byczkowski D, Li J, Kent JD, Pollack PF. Adalimumab for maintenance of clinical response and remission in patients with Crohn’s disease: the CHARM trial. Gastroenterology 2007; 132: 52-65.
- Rutgeerts P, Van Assche G, Sandborn WJ, Wolf DC, Geboes K, Colombel JF, Reinisch W, Kumar A, Lazar A, Camez A, Lomax KG, Pollack PF, D’Haens G. Adalimumab induces and maintains mucosal healing in patients with Crohn’s disease: data from the EXTEND trial. Gastroenterology 2012; 142: 1102-1111.
- Schreiber S, Colombel JF, Bloomfield R, Nikolaus S, Schölmerich J, Panés J, Sandborn WJ; PRECiSE 2 Study Investigators. Increased response and remission rates in short-duration Crohn’s disease with subcutaneous certolizumab pegol: an analysis of PRECiSE 2 randomized maintenance trial data. Am J Gastroenterol 2010; 105: 1574-1582.
- Colombel JF, Sandborn WJ, Reinisch W, Mantzaris GJ, Kornbluth A, Rachmilewitz D, Lichtiger S, D’Haens G, Diamond RH, Broussard DL, Tang KL, Van Der Woude CJ, Rutgeerts P. Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med 2010; 362: 1383-1395.
- D’Haens G, Baert F, Van Assche G, Caenepeel P, Vergauwe P, Tuynman H, De Vos M, Van Deventer S, Stitt L, Donner A, Vermeire S, Van de Mierop FJ, Coche JC, Van der Woude J, Ochsenkühn T, Van Bodegraven AA, Van Hootegem PP, Lambrecht GL, Mana F, Rutgeerts P, Feagan BG, Hommes D; Belgian Inflammatory Bowel Disease Research Group; North-Holland Gut Club. Early combined immunosuppression or conventional management in patients with newly diagnosed Crohn’s disease: an open randomised trial. Lancet 2008; 371: 660-667.
- Markowitz J, Grancher K, Kohn N, Lesser M, Daum F. A multicenter trial of 6-mercaptopurine and prednisone in children with newly diagnosed Crohn’s disease. Gastroenterology 2000; 119: 895-902.
- Panés J, López-Sanromán A, Bermejo F, García-Sánchez V, Esteve M, Torres Domènech E, Piqueras M, Gómez-García M, Gutiérrez A, Taxonera C, Sans M; AZTEC Study Group. Early azathioprine therapy is no more effective than placebo for newly diagnosed Crohn’s disease. Gastroenterology 2013; 145: 766-774.
- Cosnes J, Bourrier A, Laharie D, Nahon S, Bouhnik Y, Carbonnel F, Allez M, Dupas JL, Reimund JM, Savoye G, Jouet P, Moreau J, Mary JY, Colombel JF; Groupe d’Etude Thérapeutique des Affections Inflammatoires du Tube Digestif (GETAID). Early Administration of azathioprine vs. conventional management of Crohn’s disease. A randomized controlled trial. Gastroenterology 2013; 145: 758-765.
- Peyrin-Biroulet L, Billioud V, D’Haens G, Panaccione R, Feagan B, Panés J, Danese S, Schreiber S, Ogata H, Hibi T, Higgins PD, Beaugerie L, Chowers Y, Louis E, Steinwurz F, Reinisch W, Rutgeerts P, Colombel JF, Travis S, Sandborn WJ. Development of the Paris definition of early Crohn’s disease for disease-modification trials: results of an international expert opinion process. Am J Gastroenterol 2012; 107: 1770-1717.
- Pariente B, Mary JY, Danese S, D’Haens G, Panaccione R, Feagan B, Panés J, Danese S, Schreiber S, Ogata H, Hibi T, Higgins PD, Beaugerie L, Chowers Y, Louis E, Steinwurz F, Reinisch W, Rutgeerts P, Colombel JF, Travis S, Sandborn WJ. Development of the Crohn’s disease digestive damage score, the Lémann score. Inflamm Bowel Dis 2011; 17: 1415-1422.
- Pariente B, Cosnes J, Danese S, Sandborn WJ, Mary JY, Danese S, Chowers Y, De Cruz P, D’Haens G, Loftus EV Jr, Louis E, Panés J, Schölmerich J, Schreiber S, Vecchi M, Branche J, Bruining D, Fiorino G, Herzog M, Kamm MA, Klein A, Lewin M, Meunier P, Ordas I, Strauch U, Tontini GE, Zagdanski AM, Bonifacio C, Rimola J, Nachury M, Leroy C, Sandborn W, Colombel JF, Cosnes J. Development of the Lémann index to assess digestive tract damage in patients with Crohn’s disease. Gastroenterology 2015; 148: 52-63.
- Peyrin-Biroulet L, Cieza A, Sandborn WJ, Coenen M, Chowers Y, Hibi T, Kostanjsek N, Stucki G, Colombel JF; International Programme to Develop New Indexes for Crohn’s Disease (IPNIC) group. Development of the first disability index for inflammatory bowel disease based on the international classification of functioning, disability and health. Gut 2012; 61: 241-247.
- Dignass A, Van Assche G, Lindsay JO, Lémann M, Söderholm J, Colombel JF, Danese S, D’Hoore A, Gassull M, Gomollón F, Hommes DW, Michetti P, O’Morain C, Oresland T, Windsor A, Stange EF, Travis SP; European Crohn’s and Colitis Organisation (ECCO). The second European evidence-based consensus on the diagnosis and management of Crohn’s disease: current management. J Crohns Colitis 2010; 4: 28-62.
- Rousseaux C, Lefebvre B, Dubuquoy L. Intestinal antiinflammatory effect of 5-aminosalicylic acid is dependent on peroxisome proliferator–activated receptor-g. Journal of Experimental Medicine 2005; 201: 1205-1215.
- Svart N. Salazopyrin: a new sulfanilamide preparation. Acta Scand 1942; 110: 557-596.
- Azad Khan AK, Piris J, Truelove SC. An experiment to determine the active therapeutic moiety of sulphasalazine. Lancet 1977; 2: 892-895.
- Caprilli R, J Cesarini M, Angelucci E. The long journey of salicylates in ulcerative colitis: the past and the future. Journal of Crohn’s and Colitis 2009; 3: 149-156.
- Williams C, Panaccione R, Ghosh S, Rioux K. Optimizing clinical use of mesalazine (5-aminosalicylic acid) in inflammatory bowel disease. Therapeutic Advances in Gastroenterology 2011; 4: 237-248.
- Ford AC, Achkar JP, Khan KJ, Kane SV, Talley NJ, Marshall JK, Moayyedi P. Efficacy of 5-aminosalicylates in ulcerative colitis: systematic review and meta-analysis. Glucocorticosteroid therapy in inflammatory bowel disease: systematic review and meta-analysis. Am J Gastroenterol 2011; 106: 590-599.
- Hanauer S, Schwartz J, Robinson M, Roufail W, Arora S, Cello J, Safdi M. Mesalamine capsules for treatment of active ulcerative colitis: results of a controlled trial. Pentasa Study Group. Am J Gastroenterol 1993; 88: 1188-1197.
- Hanauer SB, Sandborn WJ, Kornbluth A, Katz S, Safdi M, Woogen S, Regalli G, Yeh C, Smith-Hall N, Ajayi F. Delayed-release oral mesalamine at 4.8 g/day (800 mg tablet) for the treatment of moderately active ulcerative colitis: the ASCEND II trial. Am J Gastroenterol 2005; 100: 2478-2485.
- Lichtenstein GR, Ramsey D, Rubin DT. Randomised clinical trial: delayed-release oral mesalazine 4.8 g/day vs. 2.4 g/day in endoscopic mucosal healing – ASCEND I and II combined analysis. Aliment Pharmacol Ther 2011; 33: 672-678.
- Sandborn WJ, Regula J, Feagan BG, Belousova E, Jojic N, Lukas M, Yacyshyn B, Krzeski P, Yeh CH, Messer CA, Hanauer SB. Delayed-release oral mesalamine 4.8 g/day (800-mg tablet) is effective for patients with moderately active ulcerative colitis. Gastroenterology 2009; 137: 1934-1943.
- Irvine EJ, Yeh CH, Ramsey D, Stirling AL, Higgins PD. The effect of mesalazine therapy on quality of life in patients with mildly and moderately active ulcerative colitis. Aliment Pharmacol Ther 2008; 28: 1278-1286.
- Kamm MA, Sandborn WH, Gassull M, Schreiber S, Jackowski L, Butler T, Lyne A, Stephenson D, Palmen M, Joseph RE. Once-daily, high-concentration MMX mesalamine in active ulcerative colitis. Gastroenterology 2007; 132: 66-75.
- Kruis W, Bar-Meir S, Feher J, Mickisch O, Mlitz H, Faszczyk M, Chowers Y, Lengyele G, Kovacs A, Lakatos L, Stolte M, Vieth M, Greinwald R. The optimal dose of 5-aminosalicylic acid in active ulcerative colitis: a dose-finding study with newly developed mesalamine. Clin Gastroenterol Hepatol 2003; 1: 36-43.
- Safdi AV, Cohen RD. Review article: increasing the dose of oral mesalazine therapy for active ulcerative colitis does not improve remission rates. Aliment Pharmacol Ther 2007; 26: 1179-1186.
- Dignass AU, Bokemeyer B, Adamek H, Mross M, Vinter-Jensen L, Börner N, Silvennoinen J, Tan G, Pool MO, Stijnen T, Dietel P, Klugmann T, Vermeire S, Bhatt A, Veerman H. Mesalamine once daily is more effective than twice daily in patients with quiescent ulcerative colitis. Mesalamine once daily is more effective than twice daily in patients with quiescent ulcerative colitis. Clin Gastroenterol Hepatol 2009; 7: 762-769.
- Leifeld L, Pfützer R, Morgenstern J, Gibson PR, Marakhouski Y, Greinwald R, Mueller R, Kruis W. Mesalazine granules are superior to Eudragit-L-coated mesalazine tablets for induction of remission in distal ulcerative colitis – a pooled analysis. Mesalazine granules are superior to Eudragit-L-coated mesalazine tablets for induction of remission in distal ulcerative colitis – a pooled analysis. Aliment Pharmacol Ther 2011; 34: 1115-1122.
- Lichtenstein GR, Kamm MA, Boddu P, Gubergrits N, Lyne A, Butler T, Lees K, Joseph RE, Sandborn WJ. Effect of once – or twice- daily MMX mesalamine (SPD476) for the induction of remission of mild to moderately active ulcerative colitis. Effect of once -or twice- daily MMX mesalamine (SPD476) for the induction of remission of mild to moderately active ulcerative colitis. Clin Gastroenterol Hepatol 2007; 5: 95-102.
- Hanauer SB, Present DH, Rubin DT. Emerging issues in ulcerative colitis and ulcerative proctitis: individualizing treatment to maximize outcomes. Gastroenterol Hepatol (NY) 2009; 5: 4-16.
- Kane S, Huo D, Aikens J, Hanauer S. Medication nonadherence and the outcomes of patients with quiescent ulcerative colitis. Am J Med 2003; 114: 39-43.
- Van Bodegraven AA, Boer RO, Lourens J, Tuynman HA, Sindram JW. Distribution of mesalazine enemas in active and quiescent ulcerative colitis. Aliment Pharmacol Ther 1996; 10: 327-332.
- Safdi M, DeMicco M, Sninsky C, Banks P, Wruble L, Deren J, Koval G, Nichols, Targan S, Fleishman C, Wiita B. A double-blind comparison of oral versus rectal mesalamine versus combination therapy in the treatment of distal ulcerative colitis. Am J Gastroenterol 1997; 92: 1867-1871.
- Marteau P, Probert CS, Lindgren S, Gassul M, Tan TG, Dignass A, Befrits R, Midhagen G, Rademaker J, Foldager M. Combined oral and enema treatment with Pentasa (mesalazine) is superior to oral therapy alone in patients with extensive mild/moderate active ulcerative colitis: a randomised, double blind, placebo-controlled study. Gut 2005; 54: 960-965.
- Lamet MA. A multicenter, randomized study to evaluate the efficacy and safety of mesalamine suppositories 1 g at bedtime and 500 mg twice daily in patients with active mild-to-moderate ulcerative proctitis. Dig Dis Sci 2011; 56: 513-522.
- Hanauer SB, Robinson M, Pruitt R, Lazenby AJ, Persson T, Nilsson LG, Walton-Bowen K, Haskell LP, Levine JG. Budesonide enemas for the treatment of active distal ulcerative colitis and proctitis: a dose-ranging study. US Budesonide enema study group. Gastroenterology 1998; 115: 525-532.
- Nikfar S, Rahimi R, Rezaie A, Abdollahi M. A meta-analysis of the efficacy of sulfasalazine in comparison with 5-aminosalicylates in the induction of improvement and maintenance of remission in patients with ulcerative colitis. Dig Dis Sci 2009; 54: 1157-1170.
- Feagan BG, Macdonald JK. Oral 5-aminosalicylic acid for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2012; 17: 10: CD000544.
- Truelove SC, Watkinson G, Draper G. Comparison of corticosteroid and sulphasalazine therapy in ulcerative colitis. Br Med J 1962; 2: 1708-1711.
- Singleton JW, Hanauer SB, Gitnick GL, Peppercorn MA, Robinson MG, Wruble LD, Krawitt EL. Mesalamine capsules for the treatment of active Crohn’s disease: results of a 16-week trial. Pentasa Crohn’s Disease Study Group. Gastroenterology 1993; 104: 1293-1301.
- Tremaine WJ, Schroeder KW, Harrison JM, Zinsmeister AR. A randomized, double-blind, placebo-controlled trial of the oral mesalamine (5-ASA) preparation, Asacol, in the treatment of symptomatic Crohn’s colitis and ileocolitis. J Clin Gastroenterol 1994; 19: 278-282.
- Panaccione R, Rutgeerts P, Sandborn WJ, Feagan B, Schreiber S, Ghosh S. Review article: treatment algorithms to maximize remission and minimize corticosteroid dependence in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2008; 28: 674-688.
- Hanauer SB, Sandborn W; Practice Parameters Committee of the American College of Gastroenterology. Management of Crohn’s disease in adults. Am J Gastroenterol 2001; 96: 635-643.
- Hanauer SB, Stromberg U. Oral Pentasa in the treatment of active Crohn’s disease: a meta-analysis of double-blind, placebo-controlled trials. Clin Gastroenterol Hepatol 2004; 2: 379-388.
- Akobeng AK, Gardener E. Oral 5-aminosalicylic acid for maintenance of medically-induced remission in Crohn’s disease. Cochrane Database Syst Rev 2005; 1: CD003715-CD003715.
- Camma C, Giunta M, Rosselli M, Cottone M. Mesalamine in the maintenance treatment of Crohn’s disease: a meta-analysis adjusted for confounding variables. Gastroenterology 1997; 113: 1465-1473.
- Messori A, Brignola C, Trallori G, Rampazzo R, Bardazzi G, Belloli C, d’Albasio G, De Simone G, Martini N. Effectiveness of 5-aminosalicylic acid formaintaining remission in patients with Crohn’s disease: a meta-analysis. Am J Gastroenterol 1994; 89: 692-698.
- Salomon P, Kornbluth A, Aisenberg J, Janowitz HD. How effective are current drugs for Crohn’s disease? A meta-analysis. J Clin Gastroenterol 1992; 14: 211-215.
- Steinhart AH, Hemphill D, Greenberg GR. Sulfasalazine and mesalazine for the maintenance therapy of Crohn’s disease: a meta-analysis. Am J Gastroenterol 1994; 89: 2116-2124.
- Steinhart A, Forbes A, Mills EC, Rodgers-Gray BS, Travis SP. Systematic review: the potential influence of mesalazine formulation on maintenance of remission in Crohn’s disease. Aliment Pharmacol Ther 2007; 25: 1389-1399.
- Malchow H, Ewe K, Brandes JW, Goebell H, Ehms H, Sommer H, Jesdinsky H. European Cooperative Crohn’s Disease Study (ECCDS): results of drug treatment. Gastroenterology 1984; 86: 249-266.
- Summers RW, Switz DM, Sessions JT Jr, Becktel JM, Best WR, Kern F Jr, Singleton JW. National cooperative Crohn’s disease study: results of drug treatment. Gastroenterology 1979; 77: 847-869.
- Loftus EV Jr, Kane SV, Bjorkman D. Systematic review: short-term adverse effects of 5-aminosalicylic acid agents in the treatment of ulcerative colitis. Aliment Pharmacol Ther 2004; 19: 179-189.
- Ransford RA, Langman MJ. Sulphasalazine and mesalazine: serious adverse reactions re-evaluated on the basis of suspected adverse reaction reports to the Committee on Safety of Medicines. Gut 2002; 51: 536-539.
- Van Staa TP, Travis S, Leufkens HG, Logan RF. 5-aminosalicylic acids and the risk of renal disease: a large british epidemiologic study. Gastroenterology 2004; 126: 1733-1739.
- Shimodate Y, Takanashi K, Waga E, Fujita T, Katsuki S, Nomura M. Exacerbation of bloody diarrhea as a side effect of mesalamine treatment of active ulcerative colitis. Case Rep Gastroenterol 2011; 5: 159-165.
- D’Haens G, van Bodegraven AA. Mesalazine is safe for the treatment of IBD. Gut 2004; 53: 155.
- Das KM, Eastwood MA, Mc Manus JPA, Circus SW. Adverse reactions during salicylazo-sulphapyridine therapy and the relation with drug metabolism and acetylator phenotype. N Engl J Med 1973; 289: 491.
- Toth A. Reversible toxic effect of salicylazosulphapyidine on semen quality. Fertil Steril 1979, 31: 533-540.
- Steinhart AH, Ewe K, Griffiths AM, Modigliani R, Thomsen OO. Corticosteroids for maintenance of remission in Crohn’s disease. Cochrane Database Syst Rev 2003; 4: CD000301.
- Truelove SC, Witts LJ. Cortisone in ulcerative colitis; preliminary report on a therapeutic trial. Br Med J 1954; 2: 375-378.
- Bebb JR, Scott BB. How effective are the usual treatments for ulcerative colitis? Aliment Pharmacol Ther 2004; 20: 143-149.
- Lennard-Jones JE, Longmore AJ, Newell AC, Wilson CW, Jones FA. An assessment of prednisone, salazopyrin and topical hydrocortisone hemisuccinate used as out-patient treatment for ulcerative colitis. Gut 1960; 1: 217-222.
- Ford AC, Bernstein CN, Khan KJ, Abreu MT, Marshall JK, Talley NJ, Moayyedi P. Glucocorticosteroid therapy in inflammatory bowel disease: systematic review and meta-analysis. Am J Gastroenterol 2011; 106: 590-599.
- Travis SP, Stange EF, Lémann M, Oresland T, Bemelman WA, Chowers Y, Colombel JF, D’Haens G, Ghosh S, Marteau P, Kruis W, Mortensen NJ, Penninckx F, Gassull M; European Crohn’s and Colitis Organisation (ECCO). European evidence-based consensus on the management of ulcerative colitis: current management. J Crohns Colitis 2008; 2: 24-62.
- Sandborn WJ, Travis S, Moro L, Jones R, Gautille T, Bagin R, Huang M, Yeung P, Ballard ED 2nd. Once-daily budesonide MMX®extended-release tablets induce remission in patients with mild to moderate ulcerative colitis: results from the CORE I study. Gastroenterology 2012; 143: 1218-1226.
- Jakobovits SL, Travis SP. Management of acute severe colitis. Br Med Bull 2006; 75-76: 131-144.
- Turner D, Walsh CM, Steinhart AH, Griffiths AM. Response to corticosteroids in severe ulcerative colitis: a systematic review of the literature and a meta-regression. Clin Gastroenterol Hepatol: 2007; 5: 103-110.
- Järnerot G, Rolny P. Sandberg-Gertzén H. Intensive intravenous treatment of ulcerative colitis. Gastroenterology 1985; 89: 1005-1013.
- Turner D, Griffiths AM. Acute severe ulcerative colitis in children: a systematic review. Inflamm Bowel Dis 2011; 17: 440-449.
- Gan SI, Beck PL. A new look at toxic megacolon: an update and review of incidence, etiology, pathogenesis, and management. Am J Gastroenterol 2003; 98: 2363-2371.
- Marshall JK, Irvine EJ. Rectal corticosteroids versus alternative treatments in ulcerative colitis: a meta-analysis. Gut 1997; 40: 775-881.
- Sandborn WJ, Bosworth B, Zakko S, Gordon GL, Clemmons DR, Golden PL, Rolleri RL, Yu J, Barrett AC, Bortey E, Paterson C, Forbes WP. Budesonide foam induces remission in patients with mild to moderate ulcerative proctitis and ulcerative proctosigmoiditis. Gastroenterology 2015; 148: 740-750.
- Otley A, Steinhart AH. Budesonide for induction of remission in Crohn’s disease. Cochrane Database Syst Rev 2005; CD000296.
- Singleton JW, Law DH, Kelley ML, Mekhjian HS, Sturdevant RAL. National Cooperative Crohn’s Disease Study: Adverse Reactions to Study Drugs. Gastroenterology 1979; 77: 870-882.
- Rutgeerts P, Löfberg R, Malchow H, Lamers C, Olaison G, Jewell D, Danielsson A, Goebell H, Thomsen OO, Lorenz-Meyer H, Hodgson H, Persson T, Seidegard C. A comparison of budesonide with prednisolone for active Crohn’s disease. N Engl J Med 1994; 331: 842-845.
- Schoon EJ, Bollani S, Mills PR, Israeli E, Felsenberg D, Ljunghall S, Persson T, Haptén-White L, Graffner H, Bianchi Porro G, Vatn M, Stockbrügger RW; Matrix Study Group. Bone mineral density in relation to efficacy and side effects of budesonide and prednisolone in Crohn’s disease. Clin Gastroenterol Hepatol 2005; 3: 113-121.
- Campieri M, Ferguson A, Doe W, Persson T, Nilsson LG. Oral budesonide is as effective as oral prednisolone in active Crohn’s disease. The Global Budesonide Study Group. Gut 1997; 41: 209-214.
- Aberra FN, Lewis JD, Hass D, Rombeau JL, Osborne B, Lichtenstein GR. Corticosteroids and immunomodulators: postoperative infectious complication risk in inflammatory bowel disease patients. Gastroenterology 2003; 125: 320-327.
- Fidder H, Schnitzler F, Ferrante M, Noman M, Katsanos K, Segaert S, Henckaerts L, Van Assche G, Vermeire S, Rutgeerts P. Long-term safety of infliximab for the treatment of inflammatory bowel disease: a single-centre cohort study. Gut 2009; 58: 501-508.
- Toruner M, Loftus EV Jr, Harmsen WS, Zinsmeister AR, Orenstein R, Sandborn WJ, Colombel JF, Egan LJ. Risk factors for opportunistic infections in patients with inflammatory bowel disease. Gastroenterology 2008; 13: 929-936.
- Lichtenstein GR, Feagan BG, Cohen RD, Salzberg BA, Diamond RH, Chen DM, Pritchard ML, Sandborn WJ. Serious infections and mortality in association with therapies for Crohn’s disease: TREAT registry. Clin Gastroenterol Hepatol 2006; 4: 621-630.
- Scott EM, Gaywood I, Scott BB. Guidelines for osteoporosis in coeliac disease and inflammatory bowel disease. British Society of Gastroenterology. Gut 2000; 46: 1-8.
- Cuffari C. A Physician’s Guide to azathioprine metabolite testing. Gastroenterology & Hepatology 2006; 2: 58-63.
- Nielsen OH, Vainer B, Rask-Madsen J. Review article: the treatment of inflammatory bowel disease with 6-mercaptopurine or azathioprine. Aliment Pharmacol Ther 2001; 15: 1699-1708.
- Sandborn W. A review of immune modifier therapy for inflammatory bowel disease: azathioprine, 6-mercaptopurine, cyclosporine, and methotrexate. Am J Gastroenterol 1996; 91: 423-433.
- Dubinsky MC. Optimizing immunomodulator therapy for inflammatory bowel disease. Curr Gastroenterol Rep 2003; 5: 506-511.
- Cuffari C, Hunt S, Bayless T. Utilisation of erythrocyte 6-thioguanine metabolite levels to optimize azathioprine therapy in patients with inflammatory bowel disease. Gut 2001; 48: 642-646.
- Dubinsky MC, Lamothe S, Yang HY, Targan SR, Sinnett D, Theoret Y, Seidman EG. Pharmacogenomics and metabolite measurement for 6-mercaptopurine therapy in inflammatory bowel disease. Gastroenterology 2000; 118: 705-713.
- Sandborn WJ. Pharmacogenomics and IBD: TPMT and thiopurines. Inflamm Bowel Dis 2004; 10: S35-S37.
- Tiede I, Fritz G, Strand S, Poppe D, Dvorsky R, Strand D, Lehr HA, Wirtz S, Becker C, Atreya R, Mudter J, Hildner K, Bartsch B, Holtmann M, Blumberg R, Walczak H, Iven H, Galle PR, Ahmadian MR, Neurath MF. CD28-dependent Rac1 activation is the molecular target of azathioprine in primary human CD4+ T lymphocytes. J Clin Invest 2003; 111: 1133-1145.
- Konidari A, Matary WE. Use of thiopurines in inflammatory bowel disease: safety issues. World J Gastrointest Pharmacol Ther 2014; 5: 63-76.
- Sparrow MP, Hande SA, Friedman S, Cao D, Hanauer SB. Effect of allopurinol on clinical outcomes in inflammatory bowel disease nonresponders to azathioprine or 6-mercaptopurine. Clin Gastroenterol Hepatol 2007; 5: 209-214.
- Egan LJ, Sandborn WJ. Methotrexate for inflammatory bowel disease: pharmacology and preliminary results. Mayo Clin Proc 1996; 71: 69-80.
- Durai D, Hawthorne AB. Review article: how and when to use ciclosporin in ulcerative colitis. Aliment Pharmacol ther. 2005; 15: 22: 907-916.
- Gisbert JP, Linares PM, Mcnicholl AG, Mate J, Gomollon F. Meta-analysis: the efficacy of azathioprine and mercaptopurine in ulcerative colitis. Aliment Pharmacol Ther 2009; 30: 126-137.
- Timmer A, McDonald JW, Macdonald JK. Azathioprine and 6-mercaptopurine for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2007; 24: CD000478.
- Ohno K, Masunaga Y, Ogawa R. Systematic review of the clinical effectiveness of azathioprine in patients with ulcerative colitis. Yakugaku Zasshi 2004; 124: 555-560.
- Ardizzone S, Maconi G, Russo A, Imbesi V, Colombo E, Bianchi Porro G. Randomised controlled trial of azathioprine and 5-aminosalicylic acid for treatment of steroid dependent ulcerative colitis. Gut 2006; 55: 47-53.
- Sambuelli A, Bellicoso M, Negreira S, Goncalves S, Huernos S, Chavero P, Tirado P, Cabanne A, Gil A. Infliximab in moderate to severe ulcerative colitis: comparison between scheduled treatment strategy and bridge strategy. J Crohns Colitis 2017; 11: S378-S379.
- Fraser AG, Orchard TR, Jewell DP. The efficacy of azathioprine for the treatment of inflammatory bowel disease: A 30 year review. Gut 2002; 50: 485-489.
- Wang Y, MacDonald JK, Vandermeer B, Griffiths AM, El-Matary W. Methotrexate for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2015; 11: CD007560.
- Carbonnel F, Colombel JF, Filippi J, Katsanos KH, Peyrin-Biroulet L, Allez M, Nachury M, Novacek G, Danese S, Abitbol V, Bossa F, Moreau J, Bommelaer G, Bourreille A, Fumery M, Roblin X, Reinisch W, Bouhnik Y, Brixi H, Seksik P, Malamut G, Färkkilä M, Coulibaly B, Dewit O, Louis E, Deplanque D, Michetti P, Sarter H, Laharie D; European Crohn’s and Colitis Organisation (ECCO); Groupe d’Étude Thérapeutique des Affections Inflammatoires du Tube Digestif (GETAID). Methotrexate is not superior to placebo for inducing steroid-free remission, but induces steroid-free clinical remission in a larger proportion of patients with ulcerative colitis. Gastroenterology 2016; 150: 380-388.
- Lichtiger S, Present DH, Kornbluth A, Gelernt I, Bauer J, Galler G, Michelassi F, Hanauer S. Cyclosporine in severe ulcerative colitis refractory to steroid therapy. N Engl J Med 1994; 330: 1841-1845.
- Kornbluth AA, Lichtiger S, Present D, Hanauer S. Long term results of oral cyclosporine in patients with severe ulcerative colitis: a doble blind randomized multicenter trial. Gastroenterology 1996; 106: A714.
- Cohen RD, Stein R, Hanauer SB. Intravenous cyclosporin in ulcerative colitis: a five-year experience. Am J Gastroenterol 1999; 94: 1587-1592.
- Moskovitz DN, Van Assche G, Maenhout B, Arts J, Ferrante M, Vermeire S, Rutgeers P. Incidence of colectomy during long-term follow-up after cyclosporine-induced remission of severe ulcerative colitis. Clin Gastroenterol Hepatol 2006; 4: 760-765.
- Actis GC, Fadda M, David E, Sapino A. Colectomy rate in steroid refractory colitis initially responsive to cyclosporin: a long-term retrospective cohort study. BMC Gastroenterol 2007; 7: 13.
- D’haens G, Lemmens L, Geboes K, Vandeputte L, Van Acker F, Mortelmans L, Peeters M, Vermeire S, Penninckx F, Nevens F, Hiele M, Rutgeerts P. Intravenous cyclosporine versus intravenous corticosteroids as single therapy for severe attacks of ulcerative colitis. Gastroenterology 2001; 120: 1323-1329.
- Van Assche G, D’haens G, Noman M, Vermeire S, Hiele M, Asnong K, Arts J, D’hoore A, Penninckx F, Rutgeerts P. Randomized, double-blind comparison of 4 mg/kg versus 2 mg/kg intravenous cyclosporine in severe ulcerative colitis. Gastroenterology 2003; 125: 1025-1031.
- Dignass A, Lindsay JO, Sturm A, Windsor A, Colombel JF, Allez M, D’haens G, D’hoore A, Mantzaris G, Novacek G, Oresland T, Reinisch W, Sans M, Stange E, Vermeire S, Travis S, Van Assche G. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 2: current management. J Crohns Colitis 2012; 6: 991-1030.
- Baumgart DC, Wiedenmann B, Dignass AU. Rescue therapy with tacrolimus is effective in patients with severe and refractory inflammatory bowel disease. Aliment Pharmacol Ther 2003; 17: 1273-1281.
- Sandborn W, Sutherland L, Pearson D, May G, Modigliani R, Prantera C. Azathioprine or 6-mercaptopurine for inducing remission of Crohn’s disease. Cochrane Database Syst Rev 2000: CD000545.
- Pearson DC, May GR, Fick GH, Sutherland LR. Azathioprine and 6-mercaptopurine in Crohn’s disease. A meta-analysis. Ann Intern Med 1995; 123: 132-142.
- Present DH, Korelitz BI, Wisch N, Glass JL, Sachar DB, Pasternack BS. Treatment of Crohn’s disease with 6-mercaptopurine. A long-term, randomized, double-blind study. N Engl J Med 1980; 302: 981-987.
- Prefontaine E, Sutherland LR, Macdonald JK, Cepoiu M. Azathioprine or 6-mercaptopurine for maintenance of remission in Crohn’s disease. Cochrane Database Syst Rev 2009; 21: CD000067.
- Sandborn WJ, Van OE, Zins BJ, Tremaine WJ, Mays DC, Lipsky JJ. An intravenous loading dose of azathioprine decreases the time to response in patients with Crohn’s disease. Gastroenterology 1995; 109: 1808-1817.
- Sandborn WJ, Tremaine WJ, Wolf DC, Targan SR, Sninsky CA, Sutherland LR, Hanauer SB, Mcdonald JW, Feagan BG, Fedorak RN, Isaacs KL, Pike MG, Mays DC, Lipsky JJ, Gordon S, Kleoudis CS, Murdock RH Jr. Lack of effect of intravenous administration on time to respond to azathioprine for steroid-treated Crohn’s disease. North American Azathioprine Study Group. Gastroenterology 1999; 117: 527-535.
- Peyrin-Biroulet L, Deltenre P, Ardizzone S, D’Haens G, Hanauer SB, Herfarth H, Lémann M, Colombel JF. Azathioprine and 6-mercaptopurine for the prevention of postoperative recurrence in Crohn’s disease: a meta-analysis. Am J Gastroenterol 2009; 104: 2089-2096.
- De Cruz P, Kamm MA, Prideaux L, Allen PB, Moore G. Mucosal healing in Crohn’s disease: a systematic review. Inflamm Bowel Dis 2013; 19: 429-444.
- D’haens G, Geboes K, Ponette E, Penninckx F, Rutgeerts P. Healing of severe recurrent ileitis with azathioprine therapy in patients with Crohn’s disease. Gastroenterology 1997; 112: 1475-1481.
- Fraser AG. Methotrexate: first-line or second-line immunomodulator? Eur J Gastroenterol Hepatol 2003; 15: 225-231.
- Feagan BG, Rochon J, Fedorak RN, Irvine EJ, Wild G, Sutherland L, Steinhart AH, Greenberg GR, Gillies R, Hopkins M, Hanauer SB, McDonald JWD; The North American Crohn’s Study Group Investigators. Methotrexate for the treatment of Crohn’s disease. N Engl J Med 1995; 332: 292-297.
- Mcdonald JW, Tsoulis DJ, Macdonald JK, Feagan BG. Methotrexate for induction of remission in refractory Crohn’s disease. Cochrane Database Syst Rev 2012; 12: CD003459.
- Fellermann K, Tanko Z, Herrlinger KR, Witthoeft T, Homann N, Bruening A, Ludwig D, Stange EF. Response of refractory colitis to intravenous or oral tacrolimus (FK506). Inflamm Bowel Dis 2002; 8: 317-324.
- Hamilton RA, Kremer JM. Why intramuscular methotrexate may be more efficacious than oral dosing in patients with rheumatoid arthritis. Br J Rheumatol 1997; 36: 86-90.
- Feagan BG, Fedorak RN, Irvine EJ, Wild G, Sutherland L, Steinhart AH, Greenberg GR, Koval J, Wong CJ, Hopkins M, Hanauer SB, McDonald JW. A comparison of methotrexate with placebo for the maintenance of remission in Crohn’s disease. North American Crohn’s Study Group Investigators. N Engl J Med 2000; 342: 1627-1632.
- Mahadevan U, Marion JF, Present DH. Fistula response to methotrexate in Crohn’s disease: a case series. Aliment Pharmacol Ther 2003; 18: 1003-1008.
- Lémann M, Zenjari T, Bouhnik Y, Cosnes J, Mesnard B, Rambaud JC, Modigliani R, Cortot A, Colombel JF. Methotrexate in Crohn’s disease: long-term efficacy and toxicity. Am J Gastroenterol 2000; 95: 1730-1734.
- Feagan B, MacDonald JWD, Panaccione R, Enns RA, Bernstein CN, Ponich TP, Bourdages R, Macintosh DG, Dallaire C, Cohen A, Fedorak RN, Paré P, Bitton A, Saibil F, Anderson F, Donner A, Wong CJ, Zou G, Vandervoort MK, Hopkins M, Greenberg GR. Methotrexate in combination with infliximab is no more effective than infliximab alone in patients with Crohn’s disease. Gastroenterology 2014; 146: 681-688.
- Hawthorne AB. Methotrexate: a useful alternative in Crohn’s disease? Gut 2001; 49: 9-10.
- Brynskov J, Freund L, Rasmussen SN, Lauritsen K, de Muckadell OS, Williams N, MacDonald AS, Tanton R, Molina F, Campanini MC, Bianchi P, Ranzi T, Quarto di Palo F, Malchow-Moller A, Thomsen OO, Tage-Jensen U, Binder V, Rus P. A placebo-controlled, double-blind, randomized trial of cyclosporine therapy in active chronic Crohn’s disease. N Engl J Med 1989; 321: 845-850.
- Feagan BG, McDonald JW, Rochon J, Laupacis A, Fedorak RN, Kinnear D, Saibil F, Groll A, Archambault A, Gillies R, Valberg B, Jan Irvine E, for the Canadian Crohn’s Relapse Prevention Trial Investigators. Low-dose cyclosporine for the treatment of Crohn’s disease. N Engl J Med 1994; 330: 1846-1851.
- Jewell DP, Lennard-Jones JE. Oral cyclosporin for chronic active Crohn’s disease: a multicentre controlled trial. European Journal of Gastroenterology & Hepatology 1994; 6: 499-506.
- Stange EF, Modigliani R, Pena AS, Wood AJ, Feutren G, Smith PR. European trial of cyclosporine in chronic active Crohn’s disease: a 12-month study. The European Study Group. Gastroenterology 1995; 109: 774-782.
- McSharry K, Dalzell AM, Leiper K, El-Matary W. Systematic review: the role of tacrolimus in the management of Crohn’s disease. Aliment Pharmacol Ther 2011; 34: 1282-1294.
- Lennard L. Implementation of TPMT testing. Br J Clin Pharmacol 2014; 7: 704-714.
- Weinshilboum RM, Sladek SL. Mercaptopurine pharmacogenetics: monogenic inheritance of erythrocyte thiopurine methyltransferase activity. Am J Hum Genet 1980; 32: 651-662.
- Cuffari C, Dassopoulos T, Turnbough L, Thompson RE, Bayless TM. Thiopurine methyltransferase activity influences clinical response to azathioprine in inflammatory bowel disease. Clin Gastroenterol Hepato 2004; 2: 410-417.
- Winter JW, Gaffney D, Shapiro D, Spooner RJ, Marinaki AM, Sanderson JD, Mills PR. Assessment of thiopurine methyltransferase enzyme activity is superior to genotype in predicting myelosuppression following azathioprine therapy in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2007; 25: 1069-1077.
- Deshpande AR, Abreu MT. Optimizing therapy with 6-mercaptopurine and azathioprine: to measure or not to measure? Therapeutic Advances in Gastroenterology 2010; 3: 275-279.
- Osterman MT, Kundu R, Lichtenstein GR, Lewis JD. Association of 6-thioguanine nucleotide levels and inflammatory bowel disease activity: a meta-analysis. Gastroenterology 2006; 130: 1047-1053.
- Dubinsky MC, Yang H, Hassard PV, Seidman EG, Kam LY, Abreu MT, Targan SR, Vasiliauskas EA. 6-MP metabolite profiles provide a biochemical explanation for 6-MP resistance in patients with inflammatory bowel disease. Gastroenterology 2002; 122: 904-915.
- Smith MA, Blaker P, Marinaki AM, Anderson SH, Irving PM, Sanderson JD. Optimising outcome on thiopurines in inflammatory bowel disease by co-prescription of allopurinol. J Crohns Colitis 2012; 6: 905-912.
- Frei P, Biedermann L, Nielsen OH. Use of thiopurines in inflammatory bowel disease. World J Gastroenterol 2013; 21: 1040-1048.
- Vögelin M, Biedermann L, Frei P, Vavricka SR, Scharl S, Zeitz J, Sulz MC, Fried M, Rogler G, Scharl M. The impact of azathioprine-associated lymphopenia on the onset of opportunistic infections in patients with inflammatory bowel disease. PLoS One 2016; 11: e0155218.
- Present DH, Meltzer SJ, Krumholz MP, Wolke A, Korelitz BI. 6-Mercaptopurine in the management of inflammatory bowel disease: short- and long-term toxicity. Ann Intern Med 1989; 15; 111: 641-649.
- Bermejo F, López-Sanromán A, Algaba A, Van-Domselaar M, Gisbert JP, García-Garzón S, Garrido E, Piqueras B, De La Poza G, Guerra I. Mercaptopurine rescue after azathioprine-induced liver injury in inflammatory bowel disease. Aliment Pharmacol Ther 2010; 31: 120-124.
- Louis E, Irving P, Beaugerie L. Use of azathioprine in IBD: modern aspects of an old drug. Gut 2014; 63: 1695-1699.
- Beaugerie L. Inflammatory bowel disease therapies and cancer risk: where are we and where are we going? Gut 2012; 61: 476-483.
- Kandiel A, Fraser AG, Korelitz BI, Brensinger C, Lewis, JD. Increased risk of lymphoma among inflammatory bowel disease patients treated with azathioprine and 6-mercaptopurine. Gut 2005; 54: 1121-1125.
- Beaugerie L, Brousse N, Bouvier AM, Colombel JF, Lémann M, Cosnes J, Hébuterne X, Cortot A, Bouhnik Y, Gendre JP, Simon T, Maynadié M, Hermine O, Faivre J, Carrat F; CESAME Study Group. Lymphoproliferative disorders in patients receiving thiopurines for inflammatory bowel disease: a prospective observational cohort study. Lancet 2009; 374: 1617-1625.
- Siegel CA, Marden SM, Persin SM, Larson RJ, Sands BE. Risk of lymphoma associated with combination anti-tumor necrosis factor and immunomodulator therapy for the treatment of Crohn’s disease: a meta-analysis. Clin Gastroenterol Hepatol 2009; 7: 874-881.
- Dayharsh GA, Loftus EV Jr, Sandborn W, Tremaine WJ, Zinsmeister AR, Witzig TE, Macon WR, Burgart LJ. Epstein-Barr virus-positive lymphoma in patients with inflammatory bowel disease treated with azathioprine or 6-mercaptopurine. Gastroenterology 2002; 122: 72-77.
- Smedby KE, Baecklund E, Askling J. Malignant lymphomas in autoimmunity and inflammation: a review of risks, risk factors, and lymphoma characteristics. Cancer Epidemiol Biomarkers Prev 2006; 15: 2069-2077.
- Rosh JR, Gross T, Mamula P, Griffiths A, Hyams J. Hepatosplenic T-cell lymphoma in adolescents and young adults with Crohn’s disease: a cautionary tale? Inflamm Bowel Dis 2007; 13: 1024-1030.
- Lewis JD, Schwartz JS, Lichtenstein GR. Azathioprine for maintenance of remission in Crohn’s disease: benefits outweigh the risk of lymphoma. Gastroenterology 2000; 118: 1018-1024.
- Hindorf U, Johansson M, Eriksson A, Kvifors E; Almer SHC. Mercaptopurine treatment should be considered in azathioprine intolerant patients with inflammatory bowel disease. Aliment Pharmacol Ther 2009; 29: 654-661.
- Peyrin-Biroulet L, Khosrotehrani K, Carrat F, Bouvier AM, Chevaux JB, Simon T, Carbonnel F, Colombel JF, Dupas JL, Godeberge P, Hugot JP, Lémann M, Nahon S, Sabaté JM, Tucat G, Beaugerie L; Cesame Study Group. Increased risk for nonmelanoma skin cancers in patients who receive thiopurines for inflammatory bowel disease. Gastroenterology 2011; 141: 1621-1628.
- Singh H, Demers AA, Nugent Z, Mahmud SM, Kliewer EV, Bernstein CN. Risk of cervical abnormalities in women with inflammatory bowel disease: a population-based nested case-control study. Gastroenterology 2009; 136: 451-458.
- Kane S, Khatibi B, Reddy D. Higher incidence of abnormal Pap smears in women with inflammatory bowel disease. Am J Gastroenterol 2008; 103: 631-636.
- Lees CW, Critchley J, Chee N, Chee N, Beez T, Gailer RE, Williams AR, Shand AG, Arnott ID, Satsangi J. Lack of association between cervical dysplasia and IBD: a large case-control study. Inflamm Bowel Dis 2009; 15: 1621-1629.
- Penn I. The effect of inmunosupresión on pre-existing cancers. Transplantation 1993; 55: 742-747.
- Laharie D. Previous cancer and/or lymphoma in patients with refractory IBD – Pro: anti-TNF or immunosuppressive treatment. Dig Dis 2014; 32: 116-121.
- Shelton E, Laharie D, Scott Fi, Mamtani R, Lewis JD, Colombel JF, Ananthakrishnan AN. Cancer recurrence following immune-suppressive therapies in patients with immune-mediated diseases: a systematic review and meta-analysis. Gastroenterology 2016; 151: 97-109.
- Te HS, Schiano TD, Kuan SF, Hanauer SB, Conjeevaram HS, Baker AL. Hepatic effects of long-term methotrexate use in the treatment of inflammatory bowel disease. Am J Gastroenterol 2000; 95: 3150-3156.
- Sternthal MB, Murphy SJ, George J, Kornbluth A, Lichtiger S, Present DH. Adverse events associated with the use of cyclosporine in patients with inflammatory bowel disease. Am J Gastroenterol 2008; 103: 937-943.
- De Groen PC, Aksamit AJ, Rakela J, Forbes GS, Krom RA. Central nervous system toxicity after liver transplantation. The role of cyclosporine and cholesterol. N Engl J Med 1987; 317: 861-866.
- Murch SH, Braegger CP, Walker-Smith JA, MacDonald TT. Location of tumour necrosis factor alpha by immunohistochemistry in chronic inflammatory bowel disease. Gut 1993; 34: 1705.
- Braegger CP, Nicholls S, Murch SH, Stephens S, MacDonald TT. Tumour necrosis factor alpha in stool as a marker of intestinal inflammation. Lancet 1992; 339: 89.
- Komatsu M, Kobayashi D, Saito K, Furuya D, Yagihashi A, Araake H, Tsuji N, Sakamaki S, Niitsu Y, Watanabe N. Tumor necrosis factor-alpha in serum of patients with inflammatory bowel disease as measured by a highly sensitive immuno-PCR. Clin Chem 2001; 47: 1297.
- Watkins PE, Warren BF, Stephens S, Ward P, Foulkes R. Treatment of ulcerative colitis in the cotton top tamarin using antibody to tumour necrosis factor alpha. Gut 1997; 40: 628.
- Van Dullemen HM, van Deventer SJ, Hommes DW, Bijl HA, Jansen J, Tytgat GN, Woody J. Treatment of Crohn’s disease with anti-tumor necrosis factor chimeric monoclonal antibody (cA2). Gastroenterology 1995; 109: 129-135.
- Targan SR, Hanauer SB, van Deventer SJ, Mayer L, Present DH, Braakman T, DeWoody KL, Schaible TF, Rutgeerts PJ. A short-term study of chimeric monoclonal antibody cA2 to tumor necrosis factor alpha for Crohn’s disease. Crohn’s Disease cA2 Study Group. N Engl J Med 1997; 337: 1029-1035.
- Sandborn WJ, Faubion WA. Biologics in inflammatory bowel disease: how much progress have we made? Gut 2004; 53: 1366-1373.
- Ordás I, Mould DR, Feagan BG, Sandborn WJ. Anti-TNF monoclonal antibodies in inflammatory bowel disease: pharmacokinetics-based dosing paradigms. Clin Pharmacol Ther 2012; 91: 635-646.
- Levin AD, Wildenberg ME, Van den Brink GR. Mechanism of action of anti-TNF therapy in inflammatory bowel disease. J Crohns Colitis 2016; 10: 989-997.
- Danese S, Vuitton L, Peyrin-Biroulet L. Biologic agents for IBD: practical insights. Nat Rev Gastroenterol Hepatol 2015; 12: 537-545.
- Järnerot G, Hertervig E, Friis-Liby I, Blomquist L, Karlén P, Grännö C, Vilien M, Ström M, Danielsson A, Verbaan H, Hellström PM, Magnuson A, Curman B. Infliximab as rescue therapy in severe to moderately severe ulcerative colitis: a randomized, placebo-controlled study. Gastroenterology 2005; 128: 1805-1811.
- Laharie D, Bourreille A, Branche J, Allez M, Bouhnik Y, Filippi J, Zerbib F, Savoye G, Nachury M, Moreau J, Delchier JC, Cosnes J, Ricart E, Dewit O, López-Sanroman A, Dupas JL, Carbonnel F, Bommelaer G, Coffin B, Roblin X, Van Assche G, Esteve M, Färkkilä M, Gisbert JP, Marteau P, Nahon S, De Vos M, Franchimont D, Mary JY, Colombel JF, Lémann M; Groupe d’Etudes Thérapeutiques des Affections Inflammatoires du Tube Digestif (GETAID). Ciclosporin versus infliximab in patients with severe ulcerative colitis refractory to intravenous steroids: a parallel, open-label randomised controlled trial. Lancet 2012; 380: 1909-1915.
- Van den Bosch F, Kruithof E, De Vos M, De Keyser F, Mielants H. Crohn’s disease associated with spondyloarthropathy: effect of TNF-alpha blockade with infliximab on articular symptoms. Lancet 2000; 356: 1821-1822.
- Danese S, Semeraro S, Papa A, Roberto I, Scaldaferri F, Fedeli G, Gasbarrini G, Gasbarrini A. Extraintestinal manifestations in inflammatory bowel disease. World Journal of Gastroenterology 2005; 11: 7227-7236.
- Ferrante M, D’Haens G, Dewit O, Baert F, Holvoet J, Geboes K, De Hertogh G, Van Assche G, Vermeire S, Rutgeerts P; Belgian IBD Research Group. Efficacy of infliximab in refractory pouchitis and Crohn’s disease-related complications of the pouch: a Belgian case series. Inflamm Bowel Dis 2010; 16: 243-249.
- Barreiro-de Acosta M, García-Bosch O, Gordillo J, Mañosa M, Menchén L, Souto R, Marin-Jiménez I; Grupo Joven GETECCU. Efficacy of adalimumab rescue therapy in patients with chronic refractory pouchitis previously treated with infliximab: a case series. Eur J Gastroenterol Hepatol 2012; 24: 756-758.
- Shen B, Remzi FH, Lavery IC, López R, Queener E, Shen L, Goldblum J, Fazio VW. Administration of adalimumab in the treatment of Crohn’s disease of the ileal pouch. Aliment Pharmacol Ther 2009; 29: 519-526.
- Herfarth HH, Long MD, Isaacs KL. Use of biologics in pouchitis: a systematic r eview. J Clin Gastroenterol 2015; 49: 647-654.
- Rutgeerts P, Sandborn WJ, Fedorak RN, Rachmilewitz D, Tarabar D, Gibson P, Haagen Nielsen O, Wild G, Schreiber S, Pena Rossi C, Zignani M. Onercept for moderate-to-severe Crohn’s disease: a randomized, double-blind, placebo-controlled trial. Clin Gastroenterol Hepatol 2006; 4: 888-893.
- Sandborn WJ, Hanauer SB, Katz S, Safdi M, Wolf DG, Baerg RD, Tremaine WJ, Johnson T, Diehl NN, Zinsmeister AR. Etanercept for active Crohn’s disease: a randomized, double-blind, placebo-controlled trial. Gastroenterology 2001; 121: 1088-1094.
- Rutgeerts P, Sandborn WJ, Feagan BG, Reinisch W, Olson A, Johanns J, Travers S, Rachmilewitz D, Hanauer SB, Lichtenstein GR, De Villiers WJ, Present D, Sands BE, Colombel JF. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005; 35: 2462-2476.
- Lawson MM, Thomas AG, Akobeng AK. Tumour necrosis factor alpha blocking agents for induction of remission in ulcerative colitis. Cochrane Database Syst Rev 2006: CD005112.
- Gisbert JP, González-Lama Y, Maté J. Systematic review: infliximab therapy in ulcerative colitis. Aliment Pharmacol Ther 2007; 25:19-37.
- Sands BE, Tremaine WJ, Sandborn WJ, Rutgeerts PJ, Hanauer SB, Mayer L, Targan, SR, Podolsky DK. Infliximab in the treatment of severe, steroid-refractory ulcerative colitis: a pilot study. Inflamm Bowel Dis 2001; 7: 83-88.
- Probert CS, Hearing SD, Schreiber S, Kühbacher T, Ghosh S, Arnott ID, Forbes A. Infliximab in moderately severe glucocorticoid resistant ulcerative colitis: a randomised controlled trial. Gut 2003; 52: 998-1002.
- Järnerot G, Hertervig E, Friis-Liby I, Blomquist L, Karlén P, Grännö C, Vilien M, Ström M, Danielsson A, Verbaan H, Hellström PM, Magnuson A, Curman B. Infliximab as rescue therapy in severe to moderately severe ulcerative colitis: a randomized, placebo-controlled study. Gastroenterology 2005; 128: 1805-1811.
- Sandborn WJ, Rutgeerts P, Feagan BG, Reinisch W, Olson A, Johanns J, Lu J, Horgan K, Rachmilewitz D, Hanauer SB, Lichtenstein GR, De Villiers WJ, Present D, Sands BE, Colombel JF. Colectomy rate comparison after treatment of ulcerative colitis with placebo or infliximab. Gastroenterology 2009; 137: 1250-1260.
- Colombel JF, Rutgeerts P, Reinisch W, Esser D, Wang Y, Lang Y, Marano CW, Strauss R, Oddens BJ, Feagan BG, Hanauer SB, Lichtenstein GR, Present D, Sands BE, Sandborn WJ. Early mucosal healing with infliximab is associated with improved long-term clinical outcomes in ulcerative colitis. Gastroenterology 2011; 141: 1194-1201.
- Gustavsson A, Järnerot G, Hertervig E, Friis-Liby I, Blomquist L, Karlén P, Grännö C, Vilien M, Ström M, Verbaan H, Hellström PM, Magnuson A, Halfvarson J, Tysk C. Clinical trial: colectomy after rescue therapy in ulcerative colitis – 3-year follow-up of the Swedish-Danish controlled infliximab study. Aliment Pharmacol Ther 2010; 3: 984-989.
- Gibson DJ, Heetun ZS, Redmond CE, Nanda KS, Keegan D, Byrne K, Mulcahy HE, Cullen G, Doherty GA. An accelerated infliximab induction regimen reduces the need for early colectomy in patients with acute severe ulcerative colitis. Clin Gastroenterol Hepatol 2015; 13: 330-335.
- Hindryckx P, Novak G, Vande Casteele N, Laukens D, Parker C, Shackelton LM, Narula N, Khanna R, Dulai P, Levesque BG, Sandborn WJ, D’Haens G, Feagan BG, Jairath V. Review article: dose optimisation of infliximab for acute severe ulcerative colitis. Aliment Pharmacol Ther 2017; 4: 617-630.
- Nalagatla N, Falloon K, Tran G, Borren NZ, Avalos D, Luther J, Colizzo F, Garber J, Khalili H, Melia J, Bohm M, Ananthakrishnan AN. Effect of Accelerated Infliximab Induction on Short-and Long-term Outcomes of Acute Severe Ulcerative Colitis: A Retrospective Multicenter Study and Meta-analysis. Clin Gastroenterol Hepatol. 2019:17:502-509.
- Panaccione R, Ghosh S, Middleton S, Márquez JR, Scott BB, Flint L, Van Hoogstraten HJ, Chen AC, Zheng H, Danese S, Rutgeerts P. Combination therapy with infliximab and azathioprine is superior to monotherapy with either agent in ulcerative colitis. Gastroenterology 2014; 146: 392-400.
- Laharie D, Bourreille A, Branche J, Allez M, Bouhnik Y, Filippi J, Zerbib F, Savoye G, Vuitton L, Moreau J, Amiot A, Cosnes J, Ricart E, Dewit O, López-Sanroman A, Fumery M, Carbonnel F, Bommelaer G, Coffin B, Roblin X, van Assche G, Esteve M, Farkkila M, Gisbert JP, Marteau P, Nahon S, De Vos M, Lambert J, Mary JY, Louis E; Groupe d’Etudes Thérapeutiques des Affections Inflammatoires du Tube Digestif (GETAID). Long-term outcome of patients with steroid-refractory acute severe UC treated with ciclosporin or infliximab. Gut 2018; 67: 237-243.
- Seagrove AC, Alam MF, Alrubaiy L, Cheung WY, Clement C, Cohen D, Grey M, Hilton M, Hutchings H, Morgan J, Rapport F, Roberts SE, Russell D, Russell I, Thomas L, Thorne K, Watkins A, Williams JG. Randomised controlled trial. Comparison of infliximab and ciclosporin in steroid resistant ulcerative colitis: Trial design and protocol (CONSTRUCT). BMJ Open 2014; 4: e005091.
- Williams JG, Alam HF, Aubaiy L, Arnott I, Clement C, Cohen D, Gordon JN, Hawthorne AB, Hilton M, Hutchings HA, Jawhari AU, Longo M, Mansfield J, Morgan JM, Rapport F, Seagrove AC, Sebastian S, Shaw I, Travis SP, Watkins A. Infliximab versus ciclosporin for steroid-resistant acute severe ulcerative colitis (CONSTRUCT): a mixed methods, open-label, pragmatic randomised trial. Lancet Gastroenterol Hepatol 2016; 1: 15-24.
- Narula N, Marshall JK, Colombel JF, Leontiadis GI, Williams JG, Muqtadir Z, Reinisch W. Systematic review and meta-analysis: infliximab or cyclosporine as rescue therapy in patients with severe ulcerative colitis refractory to steroids. Am J Gastroenterol 2016; 111: 477-491.
- Chaparro M, Burgueño P, Iglesias E, Panés J, Muñoz F, Bastida G, Castro L, Jiménez C, Mendoza JL, Barreiro-de Acosta M, Senent SG, Gomollón F, Calvet X, García-Planella E, Gómez M, Hernández V, Hinojosa J, Mañosa M, Nyssen OP, Gisbert JP. Infliximab salvage therapy after failure of ciclosporin in corticosteroid-refractory ulcerative colitis: a multicentre study. Aliment Pharmacol Ther 2012; 35: 275-283.
- Fiorino G, Peyrin-Biroulet L, Repici A, Malesci A, Danese S. Adalimumab in ulcerative colitis: hypes and hopes. Expert Opin Biol Ther 2011; 11: 109-116.
- Oussalah A, Laclotte C, Chevaux JB, Bensenane M, Babouri A, Serre AA, Boucekkine T, Roblin X, Bigard MA, Peyrin-Biroulet L. Long-term outcome of adalimumab therapy for ulcerative colitis with intolerance or lost response to infliximab: a single-centre experience. Aliment Pharmacol Ther 2008; 28: 966-972.
- Peyrin-Biroulet L, Laclotte C, Roblin X, Bigard Ma. Adalimumab induction therapy for ulcerative colitis with intolerance or lost response to infliximab: an open-label study. World J Gastroenterol 2007; 13: 2328-2332.
- Reinisch W, Sandborn WJ, Hommes DW, D’Haens G, Hanauer S, Schreiber S, Panaccione R, Fedorak RN, Tighe MB, Huang B, Kampman W, Lazar A, Thakkar R. Adalimumab for induction of clinical remission in moderately to severely active ulcerative colitis: results of a randomised controlled trial. Gut 2011; 60: 780-787.
- Sandborn WJ, Van Assche G, Reinisch W, Colombel JF, D’Haens G, Wolf DC, Kron M, Tighe MB, Lazar A, Thakkar RB. Adalimumab induces and maintains clinical remission in patients with moderate to severe ulcerative colitis. Gastroenterology 2012; 142: 257-265.
- Colombel JF, Rutgeerts PJ, Sandborn WJ Yang M, Camez A, Pollack PF, Thakkar RB, Robinson AM, Chen N, Mulani PM, Chao J. Adalimumab induces deep remission in patients with Crohn’s disease. Clinical Gastroenterology and Hepatology 2014; 12: 414-422.
- Italian Group for the Study of Inflammatory Bowel Disease; Armuzzi A, Biancone L, Daperno M, Coli A, Pugliese D, Annese V, Aratari A, Ardizzone S, Balestrieri P, Bossa F, Cappello M, Castiglione F, Cicala M, Danese S, D’Incà R, Dulbecco P, Feliciangeli G, Fries W, Genise S, Gionchetti P, Gozzi S, Kohn A, Lorenzetti R, Milla M, Onali S, Orlando A, Papparella LG, Renna S, Ricci C, Rizzello F, Sostegni R, Guidi L, Papi C. Adalimumab in active ulcerative colitis: a “real-life” observational study. Dig Liver Dis 2013; 45: 738-743.
- García-Bosch O, Gisbert JP, Cañas-Ventura A, Merino O, Cabriada JL, García-Sánchez V, Gutiérrez A, Nos P, Peñalva M, Hinojosa J, García-Planella E, Muñoz F, Calvet X, Panés J. Observational study on the efficacy of adalimumab for the treatment of ulcerative colitis and predictors of outcome. J Crohns Colitis 2013; 7: 717-722.
- Afif W, Leighton JA, Hanauer SB, Loftus EVJ, Faubion WA, Pardi DS, Tremaine WJ, Kane SV, Bruining DH, Cohen RD, Rubin DT, Hanson K, Sandborn WJ. Open-label study of adalimumab in patients with ulcerative colitis including those with prior loss of response or intolerance to infliximab. Inflamm Bowel Dis 2009; 15: 1302-1307.
- Peyrin-Biroulet L, Laclotte C, Roblin X, Bigard MA. Adalimumab induction therapy for ulcerative colitis with intolerance or lost response to infliximab: an open-label study. World J Gastroenterol 2007; 13: 2328-2332.
- Taxonera C, Estelles J, Fernández-Blanco I, Merino O, Marín- Jiménez I, Barreiro-de Acosta M, Saro C, García-Sánchez V, Gento E, Bastida G, Gisbert JP, Vera I, Martínez-Montiel P, García-Morán S, Sánchez M, Mendoza J. Adalimumab induction and maintenance therapy for patients with ulcerative colitis previously treated with infliximab. Aliment Pharmacol Ther 2011; 33: 340-348.
- Travis S, Feagan BG, Peyrin-Biroulet L, Panaccione R, Danese S, Lazar A, Robinson AM, Petersson J, Pappalardo BL, Bereswill M, Chen N, Wang S, Skup M, Thakkar RB, Chao J. Effect of adalimumab on clinical outcomes and health-related quality of life among patients with ulcerative colitis in a clinical practice setting: results from InspirADA. J Crohns Colitis 2017; 11: 1317-1325.
- Sandborn WJ, Sakuraba A, Wang A, Macaulay D, Reichmann W, Wang S, Chao J, Skup M. Comparison of real-world outcomes of adalimumab and infliximab for patients with ulcerative colitis in the United States. Curr Opin Immunol 2016; 32: 1233-1241.
- Sandborn W, Feagan BG, Marano CW, Zhang H, Strauss R, Johanns J, Adedokun O, Guzzo C, Colombel J, Reinisch W, Gibson PR, Collins J, Järnerot G, Hibi T, Rutgeerts P; PURSUIT-SC Study Group. Subcutaneous golimumab induces clinical response and remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2014; 146: 85-95.
- Sandborn WJ, Feagan BG, Marano C, Zhang H, Strauss R, Johanns J, Adedokun OJ, Guzzo C, Colombel JF, Reinisch W, Gibson PR, Collins J, Järnerot G, Rutgeerts P; PURSUIT-Maintenance Study Group. Subcutaneous golimumab maintains clinical response in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2014; 146: 96-109.
- Rutgeerts P, Feagan BG, Marano CW, Padgett L, Strauss R, Johanns J, Adedokun O, Guzzo C, Zhang H, Colombel JF, Reinisch W, Gibson PR, Sandborn WJ; PURSUIT-IV study group. Randomised clinical trial: a placebo-controlled study of intravenous golimumab induction therapy for ulcerative colitis. Aliment Pharmacol Ther 2015; 42: 504-514.
- Rutgeerts P, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, Rachmilewitz D, Wolf DC, Olson A, Bao W, Hanauer SB. Comparison of scheduled and episodic treatment strategies of infliximab in Crohn’s disease. Gastroenterology 2004; 126: 402-413.
- Sands BE, Anderson FH, Bernstein CN, Chey WY, Feagan BG, Fedorak RN, Kamm MA, Korzenik J, Lashner BA, Onken J, Rachmilewitz D, Rutgeerts P, Wild G, Wolf DC, Marsters P, Travers S, Blank MA, Van Deventer SJ. Infliximab maintenance therapy for fistulizing Crohn’s disease. N Engl J Med 2004; 350: 876-885.
- Sands BE, Blank MA, Patel K, Van Deventer SJ; ACCENT II Study. Long-term treatment of rectovaginal fistulas in Crohn’s disease: response to infliximab in the ACCENT II Study. Clin Gastroenterol Hepatol 2004; 2: 912-920.
- Lichtenstein GR, Yan S, Bala M, Blank MA, Sands BE. Infliximab maintenance treatment reduces hospitalizations, surgeries, and procedures in fistulizing Crohn’s disease. Gastroenterology 2005; 128: 862-869.
- Baert F, Moortgat L, Van Assche G, Caenepeel P, Vergauwe P, De Vos M, Stokkers P, Hommes D, Rutgeerts P, Vermeire S, D’Haens G; Belgian Inflammatory Bowel Disease Research Group; North-Holland Gut Club. Mucosal healing predicts sustained clinical remission in patients with early-stage Crohn’s disease. Gastroenterology 2010; 138: 463-468.
- Hanauer SB, Sandborn WJ, Rutgeerts P, Fedorak RN, Lukas M, Macintosh D, Panaccione R, Wolf DC, Pollack PF. Human anti-tumor necrosis factor monoclonal antibody (adalimumab) in Crohn’s disease: the CLASSIC-I trial. Gastroenterology 2006; 130: 323-333.
- Sandborn WJ, Hanauer SB, Rutgeerts P, Fedorak RN, Lukas M, Macintosh D, Panaccione R, Wolf DC, Kent J, Bittle B, Li J, Pollack PF. Adalimumab for maintenance treatment of Crohn’s disease: results of the CLASSIC II trial. Gut 2007; 56: 1232- 1239.
- Panaccione R, Colombel JF, Sandborn WJ, D’Haens G, Zhou Q, Pollack PF, Thakkar R, Robinson AM. Adalimumab maintains remission of Crohn’s disease after up to 4 years of treatment: data from CHARM and ADHERE. Aliment Pharmacol Ther 2013; 38: 1236-1247.
- Panaccione R, Colombel JF, Sandborn WJ, Rutgeerts P, D’Haens GR, Robinson AM, Chao J, Mulani PM, Pollack PF. Adalimumab sustains clinical remission and overall clinical benefit after 2 years of therapy for Crohn’s disease. Aliment Pharmacol Ther 2010; 31: 1296-1309.
- Sandborn WJ, Rutgeerts P, Enns R, Hanauer SB, Colombel JF, Panaccione R, D’haens G, Li Rosenfeld MR, Kent J, Pollack PF. Adalimumab induction therapy for Crohn disease previously treated with infliximab: a randomized trial. Ann Intern Med 2007; 146: 829-838.
- Colombel J, Schwartz DA, Sandborn WJ, Kamm MA, D’Haens G, Rutgeerts P, Enns R, Panaccione R, Schreiber S, Li J, Kent J, Lomax KG, Pollack PF. Adalimumab for the treatment of fistulas in patients with Crohn’s disease. Gut 2009; 58: 940-948.
- Schreiber S, Rutgeerts P, Fedorak, RN, Khaliq-Kareemi M, Kamm MA, Boivin M, Bernstein CN, Staun M, Thomsen O, Innes A. A randomized, placebo-controlled trial of certolizumab pegol (CDP870) for treatment of Crohn’s disease. Gastroenterology 2005; 129: 807-818.
- Sandborn WJ, Feagan BG, Stoinov S, Honiball PJ, Rutgeerts P, Mason D, Bloomfield R, Schreiber S. Certolizumab pegol for the treatment of Crohn’s disease. N Engl J Med 2007; 357: 228-238.
- Sandborn WJ, Lee SD, Randall C, Gutiérrez A, Schwartz DA, Ambarkhane S, Kayhan C, Pierre-Louis B, Schreiber S, Lichtenstein GR. Long-term safety and efficacy of certolizumab pegol in the treatment of Crohn’s disease: 7-year results from the PRECiSE 3 study. Aliment Pharmacol Ther 2014; 40: 903-916.
- Feagan BG, Sandborn WJ, Wolf DC, Coteur G, Purcaru O, Brabant Y, Rutgeerts P. Randomised clinical trial: improvement in health outcomes with certolizumab pegol in patients with active Crohn’s disease with prior loss of response to infliximab. Aliment Pharmacol Ther 2011; 33: 541-550.
- Hebuterne X, Lémann M, Bouhnik Y, Dewit O, Dupas JL, Mross M, D’haens G, Mitchev K, Ernault E, Vermeire S, Brixi- Benmansour H, Moreels TG, Mary JY, Marteau P, Colombel JF. Endoscopic improvement of mucosal lesions in patients with moderate to severe ileocolonic Crohn’s disease following treatment with certolizumab pegol. Gut 2013; 62: 201-208.
- Vande Casteele N, Khanna R, Levesque BG, Stitt L, Zou GY, Singh S, Lockton S, Hauenstein S, Ohrmund L, Greenberg GR, Rutgeerts PJ, Gils A, Sandborn WJ, Vermeire S, Feagan BG. The relationship between infliximab concentrations, antibodies to infliximab and disease activity in Crohn’s disease. Gut 2015; 64: 1539-1545.
- Vande Casteele N, Gils A, Singh S, Ohrmund L, Hauenstein S, Rutgeerts P, Vermeire S. Antibody response to infliximab and its impact on pharmacokinetics can be transient. Am J Gastroenterol 2013; 108: 962-971.
- Strik AS, Van den Brink GR, Ponsioen C, Mathot R, Löwenberg M, D’Haens GR. Suppression of anti-drug antibodies to infliximab or adalimumab with the addition of an immunomodulator in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2017; 45: 1128-1134.
- Sofia M, Rubin D. Current approaches for optimizing the benefit of biologic therapy in ulcerative colitis. Ther Adv Gastroenterol 2016; 9: 548-559.
- Vande Casteele N, Compernolle G, Ballet V, Van Assche G, Gils A, Vermeire S, Rutgeerts P. OP11 Individualised infliximab treatment using therapeutic drug monitoring: a prospective controlled Trough level Adapted infliXImab Treatment (TAXIT) trial. J Crohns Colitis 2012; 6: S6.
- Vaughn BP, Sandborn WJ, Cheifetz AS. Biologic concentration testing in inflammatory bowel disease. Inflammatory Bowel Diseases 2015; 21: 1435-1442.
- Feuerstein JD, Nguyen GC, Kupfer SS, Falck-Ytter Y, Singh S; American Gastroenterological Association Institute Clinical Guidelines Committee. American Gastroenterological Association Institute guideline on therapeutic drug monitoring in inflammatory bowel disease. Gastroenterology 2017; 153: 827-834.
- Vande Casteele N, Herfarth H, Katz J, Falck-Ytter Y, Singh S. American Gastroenterological Association Institute technical review on the role of therapeutic drug monitoring in the management of inflammatory bowel diseases. Gastroenterology 2017; 153: 835-857.
- Zittan E, Kabakchiev B, Milgrom R, Nguyen GC, Croitoru K, Steinhart AH, Silverberg MS. Higher adalimumab drug levels are associated with mucosal healing in patients with Crohn’s disease. J Crohns Colitis 2016; 10: 510-515.
- Khanna R, Sattin B, Afif W, Bernard E, Bitton A, Bressler B, Fedorak RN, Ghosh S, Greenberg G, Marshall JK, Panaccione R, Seidman E, Silverberg MS, Steinhart AH, S y R, Van Assche G, Walters T, Sandborn WJ, Feagan BG. Review article: a clinician’s guide for therapeutic drug monitoring of infliximab in inflammatory bowel disease. Aliment Pharmacol Ther 2013; 38: 447-459.
- Colombel JF, Loftus EV, Tremaine WJ, Egan LJ, Harmsen WS, Schleck CD, Sandborn WJ. The safety profile of infliximab in patients with Crohn’s disease: the Mayo clinic experience in 500 patients. Gastroenterology 2004; 126: 19-31.
- Ljung T, Karlen P, Schmidt D, Hellstrom PM, Lapidus A, Janczewska I, Sjögvist U, Löfberg R. Infliximab in inflammatory bowel disease: clinical outcome in a population-based cohort from Stockholm County. Gut 2004; 53: 849-853.
- Keane J, Gershon S, Wise RP, Mirabile-Levens E, Kasznica J, Schwieterman W, Siegel J, Braun M. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. N Engl J Med 2001; 345: 1098-1104.
- Burmester GR, Matucci-Cerinic M, Mariette X, Navarro-Blasco F, Kary S, Unnebrink K, Kupper H. Safety and effectiveness of adalimumab in patients with rheumatoid arthritis over 5 years of therapy in a phase 3b and subsequent postmarketing observational study. Arthritis Research & Therapy 2014; 16: R24.
- Burmester GR, Panaccione R, Gordon KB, McIlraith MJ, Lacerda AP. Adalimumab: long-term safety in 23.458 patients from global clinical trials in rheumatoid arthritis, juvenile idiopathic arthritis, ankylosing spondylitis, psoriatic arthritis, psoriasis and Crohn’s disease. Ann Rheum Dis 2013; 72: 517-524.
- Colombel JF, Sandborn WJ, Panaccione R, Robinson AM, Lau W, Li J, Cardoso AT. Adalimumab safety in global clinical trials of patients with Crohn’s disease. Inflamm Bowel Dis 2009; 15: 1308-1319.
- Canavan C, Abrams KR, Mayberry JF. Meta-analysis: mortality in Crohn’s disease. Aliment Pharmacol Ther 2007; 25: 861- 870.
- Lichtenstein GR, Langholff W, Feagan BG, Cohen RD, Salzberg B, Popp Y, Nissinen R, Sandborn W. Risk factors for serious infections in elderly patients receiving infliximab and other Crohn’s disease therapies: TREAT™ Registry. Gastroenterology 2016; 150: S779-S780.
- Lichtenstein GR, Feagan BG, Cohen RD, Salzberg BA, Diamond RH, Langholff W, Londhe A, Sandborn WJ. Drug therapies and the risk of malignancy in Crohn’s disease: results from the TREAT™ Registry. Am J Gastroenterol 2014; 109: 212-223.
- Siegel CA. Risk of lymphoma in inflammatory bowel disease. Gastroenterology & Hepatology 2009; 5: 784-790.
- D´Haens GR, Reinisch W, Satsangi J, Loftus EV Jr, Panaccione R, Alperovich G, Kalabic J, Bereswill M, Arikan D, Petersson J, Robinson AM. Long-term safety of adalimumab in patients with Crohn’s disease: final data from PYRAMID registry. ECCO 2017. Disponible en línea: https://www.ecco-ibd.eu/ publications/congress-abstract-s/abstracts-2017/item/p353.
- Rahier JF, Magro F, Abreu C, Armuzzi A, Ben-Horin S, Chowers Y, Cottone M, de Ridder L, Doherty G, Ehehalt R, Esteve M, Katsanos K, Lees CW, MacMahon E, Moreels T, Reinisch W, Tilg H, Tremblay L, Veereman-Wauters G, Viget N, Yazdanpanah Y, Eliakim R, Colombel JF. Second European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohns Colitis 2014; 8: 443-468.
- Cheifetz AS, Smedley M, Martin S, Reiter M, Leone G, Mayer L, Plevy S. The incidence and management of infusion reactions to infliximab: a large center experience. Am J Gastroenterol 2003; 98: 1315-1324.
- Cheifetz A, Mayer L. Monoclonal antibodies, immunogenicity, and associated infusion reactions. Mt Sinai J Med 2005; 72: 250-256.
- Lecluse LL, Piskin G, Mekkes JR, Bos JD, de Rie MA. Review and expert opinion on prevention and treatment of infliximab-related infusion reactions. Br J Dermatol 2008; 159: 527-536.
- Bermejo F, López San Román A, Algaba A, Van Domselaar M, Carneros JA, Rivero M, Piqueras B, Valer MP. Efficacy of premedication with intravenous corticosteroids and antihistaminics in preventing infusion reactions to infliximab. Gastroenterol Hepatol 2008; 31: 629-632.
- D’Arcy CA, Mannik M. Serum sickness secondary to treatment with the murine-human chimeric antibody IDEC-C2B8 (rituximab). Arthritis Rheum 2001; 44: 1717-1718.
- Sutherland L, Singleton J, Sessions J, Hanauer S, Krawitt E, Rankin G, Summers R, Mekhjian H, Greenberger N, Kelly M. Double blind, placebo-controlled trial of metronidazole in Crohn’s disease. Gut 1991; 32: 1071-1075.
- Ursing B, Alm T, Barany F, Bergelin I, Ganrot-Norlin K, Hoevels J, Huitfeldt B, Järnerot G, Krause U, Krook A, Lindström B, Nordle O, Rosén A. A comparative study of metronidazole and sulfasalazine for active Crohn’s disease: the cooperative Crohn’s disease study in Sweden. II. Result. Gastroenterology 1982; 83: 550-562.
- Sandborn WJ, Feagan B, Lichtenstein GR. Medical management of mild to moderate Crohn’s disease: evidence-based treatment algorithms for induction and maintenance of remission. Aliment Pharmacol Ther 2007; 26: 987-1003.
- Colombel JF, Lémann M, Cassagnou M, Bouhinik Y, Duclos B, Dupas J, Notteghem B, Mary JY. A controlled trial comparing ciprofloxacin with mesalazine for the treatment of active Crohn’s disease. Groupe d’Etudes Therapeutiques des Affections Inflammatoires du Tube Digestif (GETAID). Am J Gastroenterol 1999; 94: 674-678.
- Rutgeerts P, Hiele M, Geboes K, Peeters M, Penninckx F, Aerts R, Kerremans R. Controlled trial of metronidazole treatment for prevention of Crohn’s recurrence after ileal resection. Gastroenterology 1995; 108: 1617-1621.
- Bouguen G, Levesque BG, Feagan BG, Kavanaugh A, Peyrin-Biroulet L, Colombel JF, Hanauer SB, Sandborn WJ. Treat to Target: a proposed new paradigm for the management of Crohn’s disease. Clin Gastroenterol Hepatol 2015; 13: 1042-1050.
- Gilletta C, Lewin M, Bourrier A, Nion-Larmurier I, Rajca S, Beaugerie L, Sokol H, Pariente B, Seksik P, Cosnes J. Changes in the Lémann index values during the first years of Crohn’s disease. Clin Gastroenterol Hepatol 2015; 13: 1633-1640.
- European Crohn’s and Colitis Organisation (ECCO). Published ECCO Guidelines [Internet]. Inflammatory Bowel Diseases. ECCO Opportunistic Infections Consensus Checklist. Disponible en línea: https://www.ecco-ibd.eu/images/6_Publication/6_3_ECCO%20Guidelines/MASTER_OI_Consensus_ UpdateCheckList_OI_guidelines_2014.pdf
- Jordan R, Valledor A. Guías de recomendaciones de prevención de infecciones en pacientes que reciben modificadores de la respuesta biológica. Rev Arg Reumatol 2014; 25: 8-26.
- ProNaCEI. Recomendaciones nacionales de vacunación argentina [Internet]. Disponible en línea: http://www.msal.gob.ar/ images/stories/bes/graficos/0000000451cnt-201306_recomendaciones vacunacion-argentina-2012.pdf
- Domènech E, Vega R, Ojanguren I, Hernández A, Garcia-Planella E, Bernal I,Rosinach M, Boix J, Cabré E, Gassull MA. Cytomegalovirus infection in ulcerative colitis: a prospective, comparative study on prevalence and diagnostic strategy. Inflamm Bowel Dis 2008; 14: 1373-1379.
- Pillet S, Pozzetto B, Roblin X. Cytomegalovirus and ulcerative colitis: place of antiviral therapy. World Journal of Gastroenterology 2016; 22: 2030-2045.
- Torres J, Billioud V, Peyrin-Biroulet L, Colombel JF. Ulcerative colitis as a sole mucosal disease: another misunderstanding? Gut 2012; 61: 633.
- Torres J, Billioud V, Sachar DB, Peyrin-Biroulet L, Colombel J. Ulcerative colitis as a progressive disease: the forgotten evidence. Inflamm Bowel Dis 2012; 18: 1356-1363.
- Torres J, Caprioli F, Katsanos KH, Lobatón T, Micic D, Zerôncio M, Van Assche G, Lee JC, Lindsay JO, Rubin DT, Panaccione R, Colombel JF. Predicting Outcomes to Optimize Disease Management in Inflammatory Bowel Diseases. J Crohns Colitis 2016; 12: 1385-1394.
- García-López S, Gomollón García F, Sicilia Aladrén B. Tratamiento medico de la colitis ulcerosa, en relación con el patrón clínico y con la gravedad del brote. Capítulo 5, págs. 75-87. En Conductas de actuación en la enfermedad inflamatoria crónica intestinal. Manual Práctico. 6ta edición. Editorial: Ergon. C/ Arboleda, 1. 28221 Majadahonda (Madrid). Coordinadores; Joaquín Hinojosa del Val y Pilar Nos Mateu.
- Harbord M, Eliakim R, Bettenworth D, Karmiris K, Katsanos K, Kopylov U, Kucharzik T, Molnár T, Raine T, Sebastian S, de Sousa HT, Dignass A, Carbonnel F; European Crohn’s and Colitis Organisation (ECCO). Third european evidence-based consensus on diagnosis and management of ulcerative colitis. Part 2: Current Management. J Crohns Colitis 2017; 11: 769-784.
- Llaó J, Naves JE, Ruiz-Cerulla A. Intravenous corticosteroids in moderately active ulcerative colitis refractory to oral corticosteroids. J Crohns Colitis 2014; 8: 1523-1528.
- Gomollón F, Dignass A, Annese V, Tilg H, Van Assche G, Lindsay JO, Peyrin-Biroulet L, Cullen GJ, Daperno M, Kucharzik T, Rieder F, Almer S, Armuzzi A, Harbord M, Langhorst J, Sans M, Chowers Y, Fiorino G, Juillerat P, Mantzaris GJ, Rizzello F, Vavricka S, Gionchetti P; ECCO. 3rdEuropean evidence-based consensus on the diagnosis and management of Crohn’s disease 2016: Part 1: diagnosis and medical management. J Crohns Colitis 2017; 11: 3-25.
- Su C, Lichtenstein GR, Krok K, Brensinger C, Lewis JD. A meta-analysis of the placebo rates of remission and response in clinical trials of active Crohn’s disease. Gastroenterology 2004; 126: 1257-1269.
- Beaugerie L, Seksik P, Nion-Larmurier I, Gendre JP, Cosnes J. Predictors of Crohn’s disease. Gastroenterology 2006; 130: 650-656.
- Seksik P, Loftus EV, Beaugerie L, Harmsen WS, Zinsmeister AR, Cosnes J, Sandborn WJ. Validation of predictors of 5-year disabling CD in a population-based cohort from Olmsted County, Minnesota, 1983-1996. Gastroenterology 2007; 132: A17.
- Allez M, Lémann M, Bonnet J, Cattan P, Jian R, Modigliani R. Long term outcome of patients with active Crohn’s disease exhibiting extensive and deep ulcerations at colonoscopy. Am J Gastroenterol 2002; 97: 947-953.
- Ho GT, Chiam P, Drummond H, Loane J, Arnott I, Satsangi J. The efficacy of corticosteroid therapy in inflammatory bowel disease: analysis of a 5-year UK inception cohort. Aliment Pharmacol Ther 2006; 24: 319-330.
- Tromm A, Bunganič I, Tomsová E, Tulassay Z, Lukáš M, Kykal J, Bátovský M, Fixa B, Gabalec L, Safadi R, Kramm HJ, Altorjay I, Löhr H, Koutroubakis I, Bar-Meir S, Stimac D, Schäffeler E, Glasmacher C, Dilger K, Mohrbacher R, Greinwald R; International Budenofalk Study Group. Budesonide 9 mg is at least as effective as mesalamine 4.5 g in patients with mildly to moderately active Crohn’s disease. Gastroenterology 2011; 140: 425-434.
- Peyrin-Biroulet L, Fiorino G, Buisson A, Danese S. First-line therapy in adult Crohn’s disease: who should receive anti-TNF agents? Nat Rev Gastroenterol Hepatol 2013; 10: 345-351.
- Lazarev M, Huang C, Bitton A, Cho JH, Duerr RH, McGovern DP, Proctor DD, Regueiro M, Rioux JD, Schumm PP, Taylor KD, Silverberg MS, Steinhart AH, Hutfless S, Brant SR. Relationship between proximal Crohn’s disease location and disease behavior and surgery: a cross-sectional study of the IBD Genetics Consortium. Am J Gastroenterol 2013; 108: 106-112.
- Hellers G, Bergstrand O, Ewerti S, Holmstrom B. Occurrence and outcome after primary treatment of anal fistulae in Cohn’s disease. Gut 1980; 21: 525-527.
- Schwartz DA, Loftus EV Jr, Tremaine WJ, Panaccione R, Harmsen WS, Zinsmeister AR, Sandborn WJ. The natural history of fistulizing Crohn’s disease in Olmsted County, Minnesota. Gastroenterology 2002; 122: 875-880.
- Parks AG, Gordon PH, Hardcastle JD. A classification of fistula-in-ano. Br J Surg 1976; 63: 1-12.
- Bell SJ, Williams AB, Wiesel P, Wilkinson K, Cohen R, Kamm M. The clinical course of fistulating Crohn’s disease. Aliment Pharmacol Ther 2003; 17: 1145-1151.
- Sandborn WJ, Fazio VW, Feagan BG, Hanauer SB, American Gastroenterological Association Clinical Practice Comtitte. AGA technical review on perianal Crohn’s disease. Gastroenterology 2003; 125: 1508-1530.
- Gecse K, Bemelman W, Kamm MA, Stoker J, Khanna R, Ng S, Panés J, Van Assche G, Liu Z, Hart A, Levesque BG, D’Haens G; World Gastroenterology Organization; International Organisation for Inflammatory Bowel Diseases IOIBD; European Society of Coloproctology and Robarts Clinical Trials. A global consensus on the classification, diagnosis and multidisciplinary treatment of perianal fistulising Crohn’s disease. Gut 2014; 63: 1381-1392.
- Bernstein LH, Frank MS, Brandt LJ, Boley SJ. Healing of perineal Crohn’s disease with metronidazole. Gastroenterology 1980; 79: 357-365.
- Brandt LJ, Bernstein LH, Boley SJ, Frank MS. Metronidazole therapy for perineal Crohn’s disease: a follow-up study. Gastroenterology 1982; 83: 383-387.
- Jakobovits J, Schuster MM. Metronidazole therapy for Crohn’s disease and associated fistulae. Am J Gastroenterol 1984; 79: 533-540.
- Gionchetti P, Dignass A, Danese S, Magro Dias FJ, Rogler G, Lakatos PL, Adamina M, Ardizzone S, Buskens CJ, Sebastian S, Laureti S, Sampietro GM, Vucelic B, Van der Woude CJ, Barreiro-de Acosta M, Maaser C, Portela F, Vavricka SR, Gomollón F; ECCO. 3rdEuropean Evidence-based Consensus on the Diagnosis and Management of Crohn’s Disease 2016, Part 2: Surgical Management and Special Situations. J Crohns Colitis 2017; 11: 135-149.
- Prefontaine E, Macdonald JK, Sutherland LR. Azathioprine or 6-mercaptopurine for induction of remission in Crohn’s disease. Cochrane Database Syst Rev 2010: CD000545.
- Dejaco C, Harrer M, Waldhoer T, Miehsler W, Vogelsang H, Reinisch W. Antibiotics and azathioprine for the treatment of perianal fistulas in Crohn’s disease. Aliment Pharmacol Ther 2003; 18: 1113-1120.
- Echarri A, Castro J, Barreiro M, Echarri A, Carpio D, Pereira S, Lorenzo A. Evaluation of adalimumab therapy in multidisciplinary strategy for perianal Crohn’s disease patients with infliximab failure. J Crohn’s Colitis 2010; 4: 654-660.
- Lichtiger S, Binion DG, Wolf DC, Present DH, Bensimon AG, Wu E, Yu AP, Cardoso AT, Chao J, Mulani PM, Lomax KG, Kent JD. The CHOICE trial: adalimumab demonstrates safety, fistula healing, improved quality of life and increased work productivity in patients with Crohn’s disease who failed prior infliximab therapy. Aliment Pharmacol Ther 2010; 32: 1228-1239.
- Tozer P, Ng SC, Siddiqui MR, Lichtiger S, Binion DG, Wolf DC, Present DH, Bensimon AG, Long-term MRI-guided combined anti-TNF and thiopurine therapy for Crohn’s perianal fistulas. Inflamm Bowel Dis 2012; 18: 1825-1834.
- Thomson AW, Carroll PB, McCauley J, Woo J, Abu-Elmagd K, Starzl TE, Van Thiel DH. FK 506: a novel immunosuppressant for treatment of autoimmune disease. Rationale and preliminary clinical experience at the University of Pittsburgh. Springer Semin Immunopathol 1993; 14: 323-344.
- Sandborn WJ. Preliminary report on the use of oral tacrolimus (FK506) in the treatment of complicated proximal small bowel and fistulizing Crohn’s disease. Am J Gastroenterol 1997; 92: 876–879.
- Lowry PW, Weaver AL, Tremaine WJ, Sandborn WJ. Combination therapy with oral tacrolimus (FK506) and azathioprine or 6-mercaptopurine for treatment-refractory Crohn’s disease perianal fistulae. Inflamm Bowel Dis 1999; 5: 239-245.
- Ierardi E, Principi M, Rendina M, Francavilla R, Ingrosso M, Pisani A, Amoruso A, Panella C, Francavilla A. Oral tacrolimus (FK 506) in Crohn’s disease complicated by fistulae of the perineum. J Clin Gastroenterol 2000; 30: 200-202.
- Sandborn WJ, Present DH, Isaacs KL, Wolf DC, Greenberg E, Hanauer SB, Feagan BG, Mayer L, Johnson T, Galanko J, Martin C, Sandler RS. Tacrolimus for the treatment of fistulas in patients with Crohn’s disease: a randomized, placebo-controlled trial. Gastroenterology 2003; 125: 380-388.
- Maeda Y, Ng SC, Durdey P, Maeda Y, Ng SC, Durdey P, Burt C, Torkington J, Rao PK, Mayberry J, Moshkovska, T, Stone CD, Carapeti E, Vaizey CJ. Randomized clinical trial of metronidazole ointment versus placebo in perianal Crohn’s disease. Br J Surg 2010; 97: 1340-1347.
- Thia KT, Mahadevan U, Feagan BG, Wong C, Cockeram A, Bitton A, Bernstein C, Sandborn WJ. Ciprofloxacin or metronidazole for the treatment of perianal fistulas in patients with Crohn’s disease: a randomized, double-blind, placebo-controlled pilot study. Inflamm Bowel Dis 2009; 15: 17-24.
- Solomon M, Mcleod R, O’Conner B, Cohen Z. Combination ciprofloxacin and metronidazole in severe perianal Crohn’s disease. Can J Gastroenterol 1993; 7: 571-573.
- Dewint P, Hansen B, Verhey E, Oldenburg B, Hommes DW, Pierik M, Ponsioen C, van Dullemen H, Russel M, van Bodegraven A, Van Der Woude CJ. Adalimumab combined with ciprofloxacin is superior to adalimumab monotherapy in perianal fistula closure in Crohn’s disease: a randomised, double-blind, placebo-controlled trial. Gut 2014; 63: 292-299.
- West R, van der Woude C, Hansen B, Felt-Bersma R, van Tilburg A, Drapers J, Kuipers E. Clinical and endosonographic effect of ciprofloxacin on the treatment of perianal fistulae in Crohn’s disease with infliximab: a double-blind placebo-controlled study. Aliment Pharmacol Ther 2004; 20: 1329-1336.
- D’Haens GR, Panaccione R, Higgins PD, Vermeire S, Gassull M, Chowers Y, Hanauer SB, Herfarth H, Hommes DW, Kamm M, Löfberg R, Quary A, Sands B, Sood A, Watermeyer G, Lashner B, Lémann M, Plevy S, Reinisch W, Schreiber S, Siegel C, Targan S, Watanabe M, Feagan B, Sandborn WJ, Colombel JF, Travis S. The London Position Statement of the World Congress of Gastroenterology on Biological Therapy for IBD with the European Crohn’s and Colitis Organization (ECCO): when to start, when to stop, which drug to choose, and how to predict response? Am J Gastroenterol 2011; 106: 199-212.
- Colombel JF, Mathieu D, Bouault JM, Lesage X, Zavadil P, Quandalle P, Cortot A. Hyperbaric oxygenation in severe perineal Crohn’s disease. Dis Colon Rectum 1995; 38: 609-614.
- De la Portilla F, Alba F, García-Olmo D, Herrerias JM, González FX, Galindo A. Expanded allogeneic adipose-derived stem cells (eASCs) for the treatment of complex perianal fistula in Crohn’s disease: results from a multicenter phase I/IIa clinical trial. Int J Colorectal Dis 2013; 28: 313-323.
- Ciccocioppo R, Bernardo ME, Sgarella A, Maccario R, Avanzini MA, Ubezio C, Minelli A, Alvisi C, Vanoli A, Calliada F, Dionigi P, Perotti C, Locatelli F, Corazza GR. Autologous bone marrow-derived mesenchymal stromal cells in the treatment of fistulising Crohn’s disease. Gut 2011; 60: 788-798.
- Panés J, García-Olmo D, Van Assche G, Colombel JF, Reinisch W, Baumgart DC, Dignass A, Nachury M, Ferrante M, Kazemi-Shirazi L, Grimaud JC, de la Portilla F, Goldin E, Richard MP, Leselbaum A, Danese S; ADMIRE CD Study Group Collaborators. Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fistulas in Crohn’s disease: a phase 3 randomised, double-blind controlled trial. Lancet 2016; 388: 1281-1290.
- Hvas CL, Dahlerup JF, Jacobsen BA, Ljungmann K, Qvist N, Staun M, Tøttrup A. Diagnosis and treatment of fistulising Crohn’s disease. Dan Med Bull 2011; 58: C4338.
- Nielsen OH, Rogler G, Hahnloser D, Thomsen O. Diagnosis and management of fistulizing Crohn’s disease. Nat Clin Pract Gastroenterol Hepatol 2009; 6: 92-106.
- Amiot A, Setakhr V, Seksik P, Amiot A, Setakhr V, Seksik P, Allez M, Treton X, De Vos M, Laharie D, Colombel JF, Abitbol V, Reimund JM, Moreau J, Veyrac M, Flourié B, Cosnes J, Lémann M, Bouhnik Y. Long-term outcome of enterocutaneous fistula in patients with Crohn’s disease treated with anti-TNF therapy: a cohort study from the GETAID. Am J Gastroenterol 2014; 109: 1443-1449.
- Taxonera C, Barreiro-de-Acosta M, Bastida G, Martínez-González J, Merino O, García-Sánchez V, Gisbert JP, Marín-Jiménez I, López-Serrano P, Gómez-García M, Iglesias E, López-Sanroman A, Chaparro M, Saro C, Bermejo F, Pérez-Carazo L, Plaza R, Olivares D, Alba C, Mendoza J, Fernández-Blanco I. Outcomes of medical and surgical therapy for entero-urinary fistulas in Crohn’s disease. J Crohn Colitis 2016; 10: 657-662.
- MacDermott R, Regueiro W, Tremaine W. Management of internal and external fistulas in Crohn’s disease, Chapter 123. In Advanced therapy of inflammatory bowel disease, volume 2: IBD and Crohn’s disease. Bayless TM, Hanauer SB Editors. People Medical publishing house, USA- SHELTON. Connecticut 2011; 2: 764-777.
- De la Poza G, López-Sanroman A, Taxonera C, Marín-Jiménez I, Gisbert JP, Bermejo F, Opio V, Muriel A. Genital fistulas in female Crohn’s disease patients.: clinical characteristics and response to therapy. Journal of Crohn’s & Colitis 2012; 6: 276-280.
- Farmer RG, Whelan G, Fazio VW. Long-term follow-up of patients with Crohn’s disease. Relationship between the clinical pattern and prognosis. Gastroenterology 1985; 88: 1818-1825.
- Hassan C, Zullo A, De Francesco VIerardi E, Giustini M, Pitidis A, Taggi F, Winn S, Morini S. Systematic review: endoscopic dilatation in Crohn’s disease. Aliment Pharmacol Ther 2007; 26: 1457-1464.
- Thienpont C, D’Hoore A, Vermeire S, Demedts I, Bisschops R, Coremans G, Rutgeerts P, Van Assche G. Long-term outcome of endoscopic dilatation in patients with Crohn’s disease is not affected by disease activity or medical therapy. Gut 2010; 59: 320-324.
- Alexander-Williams J. The technique of intestinal strictureplasty. Int J Colorectal Dis 1986; 1: 54-57.
- Hurst RD, Michelassi F. Strictureplasty for Crohn’s disease: techniques and long-term results. World J Surg 1998; 22: 359-363.
- Michelassi F. Side-to-side isoperistaltic strictureplasty for multiple Crohn’s strictures. Dis Colon Rectum 1996; 39: 345-349.
- Munkholm P, Langholz E, Davidsen M, Binder V. Intestinal cancer risk and mortality in patients with Crohn’s disease. Gastroenterology 1993; 105: 1716-1723.
- Mekhjian HS, Switz DM, Melnyk CS, Rankin GB, Brooks RK. Clinical features and natural history of Crohn’s disease. Gastroenterology 1979; 77: 898-906.
- Peyrin-Biroulet L, Loftus EV Jr, Colombel JF, Sandborn WJ. The natural history of adult Crohn’s disease in population-based cohorts. Am J Gastroenterol 2010; 105: 289.
- Solberg IC, Vatn MH, Hoie O, Stray N, Sauar J, Jahnsen J, Moum B, Lygren I; IBSEN Study Group. Clinical course in Crohn’s disease: results of a Norwegian population based ten-year follow-up study. Clin Gastroenterol Hepatol 2007; 5: 1430e8.
- Bougen G, Peyrin-Biroulet L. Surgery for adult Crohn’s disease: what is the actual risk? Gut 2011; 60: 1178-1181.
- Regueiro M. Medical Review. Management and prevention of postoperative Crohn’s disease. Inflamm Bowel Dis 2009; 15: 1583-1590.
- Nos P, Domenech E. Postoperative Crohn’s disease recurrence: a practical approach. World J Gastroenterol 2008; 28: 5540-5548.
- Reese GE, Nanidis T, Borysiewicz C, Yamamoto T, Orchard T, Tekkis PP. The effect of smoking after surgery for Crohn’s disease: a meta-analysis of observational studies. Int J Colorectal Dis 2008; 23: 1213-1221.
- Simillis C, Yamamoto T, Reese GE, Umegae S, Matsumoto K, Darzi AW, Tekkis PP. A meta-analysis comparing incidence of recurrence and indication for reoperation after surgery for perforating versus nonperforating Crohn’s disease. Am J Gastroenterol 2008; 103: 196-205.
- Bernell O, Lapidus A, Hellers G. Risk factors for surgery and recurrence in 907 patients with primary ileocaecal Crohn’s disease. Br J Surg 2000; 87: 1697-1701.
- Hellers G. Crohn’s disease in Stockholm county 1955-1974. A study of epidemiology, results of surgical treatment and long-term prognosis. Acta Chir Scand 1979; 490: 1-84.
- Van Assche G, Dignass A, Reinisch W, Van Der Woude CJ, Sturm A, De Vos M, Guslandi M, Oldenburg B, Dotan I, Marteau P, Ardizzone S, Baumgart DC, D’Haens G, Gionchetti P, Portela F, Vucelic B, Söderholm J, Escher J, Koletzko S, Kolho KL, Lukas M, Mottet C, Tilg H, Vermeire S, Carbonnel F, Cole A, Novacek G, Reinshagen M, Tsianos E, Herrlinger K, Oldenburg B, Bouhnik Y, Kiesslich R, Stange E, Travis S, Lindsay J; European Crohn’s and Colitis Organisation (ECCO). The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: special situations. J Crohns Colitis 2010; 4: 63-101.
- Sokol H, Polin V, Lavergne-Slove A, Panis Y, Treton X, Dray X, Bouhnik Y, Valleur P, Marteau P. Plexitis as a predictive factor of early postoperative clinical recurrence in Crohn’s disease. Gut 2009; 58: 1218-1225.
- Ng SC, Lied GA, Kamm MA, Sandhu F, Guenther T, Arebi N. Predictive value and clinical significance of myenteric plexitis in Crohn’s disease. Inflamm Bowel Dis 2009; 15: 1499-1507.
- Álvarez-Lobos M, Arostegui JI, Sans M, Tassies D, Plaza S, Delgado S, Lacy AM, Pique JM, Yagüe J, Panés J. Crohn’s disease patients carrying Nod2/CARD15 gene variants have an increased and early need for first surgery due to stricturing disease and higher rate of surgical recurrence. Ann Surg 2005; 242: 693-700.
- Maconi G, Colombo E, Sampietro GM, Lamboglia F, D’Incà R, Daperno M, Cassinotti A, Sturniolo GC, Ardizzone S, Duca P, Porro GB, Annese V. CARD15 gene variants and risk of reoperation in Crohn’s disease patients. Am J Gastroenterol 2009; 104: 2483-2491.
- Scarpa M, Bortolami M, Morgan SL, Kotsafti A, Ferraro S, Ruffolo C, D’Incà R, Polese L, Barollo M, D’Amico DF, Sturniolo GC, Angriman I. TGF-beta1 and IGF-1 production and recurrence of Crohn’s disease after ileo-colonic resection. J Surg Res 2009; 152: 26-34.
- Wright EK, Kamm MA, De Cruz P, Hamilton AL, Ritchie KJ, Krejany EO, Leach S, Gorelik A, Liew D, Prideaux L, Lawrance IC, Andrews JM, Bampton PA, Jakobovits SL, Florin TH, Gibson PR, Debinski H, Macrae FA, Samuel D, Kronborg I, Radford-Smith G, Selby W, Johnston MJ, Woods R, Elliott PR, Bell SJ, Brown SJ, Connell WR, Day AS, Desmond PV, Gearry RB. Measurement of fecal calprotectin improves monitoring and detection of recurrence of Crohn’s disease after surgery. Gastroenterology 2015; 148: 938-947.
- Doherty G, Bennet G, Patil S, Cheifetz AS, Moss AC. Interventions for prevention of post-operative recurrence of Crohn’s disease. Cochrane Database Syst Rev 2009; 7: CD006873.
- Ford AC, Khan KJ, Talley NJ. 5-aminosalicylates prevent relapse of Crohn’s disease after surgically induced remission: systematic review and meta-analysis. Am J Gastroenterol 2011; 106: 413-420.
- Doherty G, Bennet G, Cheifetz AS, Moss AC. Meta-analysis: targeting the intestinal microbiota in prophylaxis for post-operative Crohn’s disease. Aliment Pharmacol Ther 2010; 31: 802-809.
- Rutgeerts P, Van Assche G, Vermeire S, D’Haens G, Baert F, Noman M, Aerden I, De Hertogh G, Geboes K, Hiele M, D’Hoore A, Penninckx F. Ornidazole for prophylaxis of postoperative Crohn’s disease recurrence: a randomized, double-blind, placebo-controlled trial. Gastroenterology 2005; 128: 856-861.
- Hellers G, Cortot A, Jewell D, Leijonmarck C, Löfberg R, Malchow H, Nilsson L, Pallone F, Pena S, Persson T, Prantera C, Rutgeerts P. Oral budesonide for prevention of postsurgical recurrence in Crohn’s disease. Gastroenterology 1999; 116: 294-300.
- Ewe K, Böttger T, Buhr H, Ecker K, Otto H, German Budesonide Study Group. Low-dose budesonide treatment for prevention of postoperative recurrence of Crohn’s disease: a multicentre randomized placebo-controlled trial. Eur J Gastroenterol Hepatol 1999; 11: 277-282.
- Domenech E, Mañosa M, Bernal I, García-Planella E, Cabré E, Piñol M, Lorenzo-Zúñiqa V, Boix J, Gassull MA. Impact of azathioprine therapy on the prevention of postoperative Crohn’s disease recurrence: results of a prospective, observational, long-term follow-up study. Inflamm Bowel Dis 2008; 14: 508-513.
- Hanauer SB, Korelitz BI, Rutgeerts P, Peppercorn MA, Thisted RA, Cohen RD, Present DH. Post-operative maintenance of Crohn’s disease remission with mercaptopurine, and MP to 6-MP, mesalamine or placebo: a 2-year trial. Gastroenterol 2004; 127: 723-729.
- D’Haens GR, Vermeire S, Van Assche G, Noman M, Aerden I, Van Olmen G, Rutgeerts P. Therapy of metronidazole with azathioprine to prevent postoperative recurrence of Crohn’s disease: a controlled randomized trial. Gastroenterology 2008; 135: 1123-1129.
- Ardizzone S, Maconi G, Sampietro G, Russo A, Radice E, Colombo E, Imbesi V, Molteni M, Danelli P, Taschieri A, Bianchi Porro G. Azathioprine and mesalamine for the prevention of relapse after conservative surgery for Crohn’s disease. Gastroenterology 2005; 127: 730-740.
- Regueiro M, Schraut W, Baidoo L, Kip K, Sepulveda A, Pesci M, Harrison JM, Plevy S. Infliximab prevents Crohn’s disease recurrence after ileal resection. Gastroenterology 2009; 136: 441-450.
- Regueiro M, Kip K, Baidoo L, Swoger J, Schraut W. Postoperative therapy with infliximab prevents long-term Crohn’s disease recurrence. Clin Gastroenterol Hepatol 2014; 12: 1494-1502.
- Savarino E, Bodin G, Dulbecco P, Assandri L, Bruzzone L, Mazza F, Frigo A, Fazio V, Marabotto E, Savarino V. Adalimumab is more effective than azathioprine and mesalamine at preventing postoperative recurrence of Crohn’s disease: a randomized controlled trial. Am J Gastroenterol 2013; 108: 1731-1742.
- Armuzzi A, Felice C, Papa A, Marzo M, Pugliese D, Andrisani G, Federico F, De Vitis I, Rapaccini GL, Guidi L. Prevention of postoperative recurrence with azathioprine or infliximab in patients with Crohn’s disease: an open-label pilot study. J Crohns Colitis 2013; 7: e623-e629.
- De Cruz P, Kamm MA, Hamilton AL, Ritchie KJ, Krejany EO, Gorelik A, Liew D,Prideaux L, Lawrance IC, Andrews JM, Bampton PA, Gibson PR, Sparrow M, Leong RW, Florin TH, Gearry RB, Radford-Smith G, Macrae FA, Debinski H, Selby W, Kronborg I, Johnston MJ, Woods R, Elliott PR, Bell SJ, Brown SJ, Connell WR, Desmond PV. Crohn’s disease management after intestinal resection: a randomised trial. Lancet 2015; 385: 1406-1417.
- De Cruz P, Kamm MA, Hamilton AL, Ritchie KJ, Krejany EO, Gorelik A, Liew D, Prideaux L, Lawrance IC, Andrews JM, Bampton PA, Jakobovits S, Florin TH, Gibson PR, Debinski H, Gearry RB, Macrae FA, Leong RW, Kronborg I, Radford-Smith G, Selby W, Johnston MJ, Woods R, Elliott PR, Bell SJ, Brown SJ, Connell WR, Desmond PV. Efficacy of thiopurines and adalimumab in preventing Crohn’s disease recurrence in high-risk patients – a POCER study analysis. Aliment Pharmacol Ther 2015; 42: 867-879.
- Domènech E, López-Sanromán A, Nos P, Vera M, Chaparro M, Esteve M, Gisbert JP, Mañosa M; en representación de GETECCU. Recommendations of the Spanish Working Group on Crohn’s Disease and Ulcerative Colitis (GETECCU) on the monitoring, prevention and treatment of post-operative recurrence in Crohn’s disease. Gastroenterol Hepatol 2017; 40: 472-483.
- De Cruz P, Kamm MA, Hamilton A, Ritchie KJ, Gorelik A, Liew D, Lawrance I, Andrews J, Bampton P, Gibson PR, Sparrow M, Leong R, Florin T, Gearry RB, Radford-Smith GL, Finlay A, Debinski H, Selby W, Kronborg P, Johnston M, Woods R, Elliott PR, Bell S, Brown S, Connell W, Desmond P. The first validated post-operative endoscopic Crohn’s disease index: the POCER index. Identification of key endoscopic prognostic factors. Gastroenterology 2016; 150: S72.
- Khanna R, Bressler B, Levesque BG, Zou G, Stitt LW, Greenberg GR, Panaccione R, Bitton A, Paré P, Vermeire S, D’Haens G, MacIntosh D, Sandborn WJ, Donner A, Vandervoort MK, Morris JC, Feagan BG; REACT Study Investigators. Early combined immunosuppression for the management of Crohn’s disease (REACT): a cluster randomised controlled trial. Lancet 2015; 386: 1825-1834.
- Colombel JF, Panaccione R, Bossuyt P, Lukas M, Baert F, Vaňásek T, Danalioglu A, Novacek G, Armuzzi A, Hébuterne X, Travis S, Danese S, Reinisch W, Sandborn WJ, Rutgeerts P, Hommes D, Schreiber S, Neimark E, Huang B, Zhou Q, Mendez P, Petersson J, Wallace K, Robinson AM, Thakkar RB, D’Haens G. Effect of tight control management on Crohn’s disease (CALM): a multicentre, randomised, controlled phase 3 trial. Lancet 2018; 390: 2779-2789.
- Jackson KL, Stocchi L, Duraes L, Rencuzogullari A, Bennett AE, Remzi FH. Long-Term outcomes in indeterminate colitis patients undergoing ileal pouch-anal anastomosis: function, quality of life, and complications. J Gastrointest Surg 2017; 21: 56-61.
- Miller JP. Inflammatory bowel disease in pregnancy: a review. J R Soc Med 1986; 79: 221-225.
- Mahadevan U, Sandborn WJ, Li D, Hakimian S, Kane S, Corley D. Pregnancy outcomes in women with inflammatory bowel disease: a large community-based study from Northern California. Gastroenterology 2007; 133: 1106-1112.
- Cornish J, Tan E, Teare J, Teoh TG, Rai R, Clark SK, Tekkis PP. A meta-analysis on the influence of inflammatory bowel disease on pregnancy. Gut 2007; 56: 830-837.
- Nguyen GC, Seow CH, Maxwell C, Huang V, Leung Y, Jones J, Leontiadis GI, Tse F, Mahadevan U, Van der Woude CJ; IBD in Pregnancy Consensus Group; Canadian Association of Gastroenterology. The Toronto Consensus Statements for the Management of Inflammatory Bowel Disease in Pregnancy. Gastroenterology 2016; 150: 734-757.
- Mahadevan U, McConnell RA, Chambers CD. Drug safety and risk of adverse. Outcomes for pregnant patients with inflammatory bowel disease. Gastroenterology 2017; 152: 451-462.
- Mogadam M, Korelitz BI, Ahmed SW, Dobbins WO 3rd, Baiocco PJ. The course of inflammatory bowel disease during pregnancy and postpartum. Am J Gastroenterol 1981; 75: 265-269.
- Khosla R, Willoughby CP, Jewell DP. Crohn’s disease and pregnancy. Gut 1984; 25: 52-56.
- Van der Woude CJ, Ardizzone S, Bengtson MB, Fiorino G, Fraser G, Katsanos K, Kolacek S, Juillerat P, Mulders AG, Pedersen N, Selinger C, Sebastian S, Sturm A, Zelinkova Z, Magro F; European Crohn’s and Colitis Organization (ECCO). The second european evidenced-based consensus on reproduction and pregnancy in inflammatory bowel disease. J Crohns Colitis 2015; 9: 107-124.
- Vermeire S, Carbonnel F, Coulie PG, Geenen V, Hazes JM, Masson PL, De Keyser F, Louis E. Management of inflammatory bowel disease in pregnancy. J Crohns Colitis 2012; 6: 811-823.
- Riis L, Vind I, Politi P, Wolters F, Vermeire S, Tsianos E, Freitas J, Mouzas I, Ruiz Ochoa V, O’Morain C, Odes S, Binder V, Moum B, Stockbrügger R, Langholz E, Munkholm P. Does pregnancy change the disease course? A study in a European cohort of patients with inflammatory bowel disease. Am J Gastroenterol 2006; 101: 1539-1545.
- Hashash JG, Kane S. Pregnancy and inflammatory bowel disease. Gastroenterology & Hepatology 2015; 11: 96-102.
- Pedersen N, Bortoli A, Duricova D, D Inca R, Panelli MR, Gisbert JP, Zoli G, López-Sanromán A, Castiglione F, Riegler G, Annese V, Gionchetti P, Prada A, Pont ED, Timmer A, Felley C, Shuhaibar M, Tsianos EV, Dejaco C, Baert FJ, Jess T, Lebech M, Hommes DW, Munkholm P; European Crohn-Colitis Organisation-ECCO-Study; Group of Epidemiology Committee-EpiCom. The course of inflammatory bowel disease during pregnancy and postpartum: a prospective european ECCO-EpiCom Study of 209 pregnant women. Aliment Pharmacol Ther 2013; 38: 501-512.
- Julsgaard M, Norgaard M, Hvas CL, Buck D, Christensen LA. Self-reported adherence to medical treatment prior to and during pregnancy among women with ulcerative colitis. Inflamm Bowel Dis 2010: 1-8.
- Hviid A, Molgaard-Nielsen D. Corticosteroid use during pregnancy and risk of orofacial clefts. CMAJ 2011; 183: 796-804.
- Beaulieu DB, Ananthakrishnan AN, Issa M, Rosenbaum L, Skaros S, Newcomer JR, Kuhlmann RS, Otterson MF, Emmons J, Knox J, Binion DG. Budesonide induction and maintenance therapy for Crohn’s disease during pregnancy. Inflamm Bowel Dis 2009; 15: 25-28.
- Coelho J, Beaugerie L, Colombel JF, Hébuterne X, Lerebours E, Lémann M, Baumer P, Cosnes J, Bourreille A, Gendre JP, Seksik P, Blain A, Metman E, Nisard A, Cardiot G, Veyrac M, Coffin B, Dray X, Carrat F, Marteau P; CESAME Pregnancy Study Group. Pregnancy outcome in patients with inflammatory bowel disease treated with thiopurines: cohort from the CESAME study. Gut 2011; 60: 198-203.
- Hutson JR, Matlow JN, Moretti ME, Koren G. The fetal safety of thiopurines for the treatment of inflammatory bowel disease in pregnancy. J Obstet Gynaecol 2013; 33: 1-8.
- Akbari M, Shah S, Velayos FS, Mahadevan U, Cheifetz AS. Systematic review and meta-analysis on the effects of thiopurines on birth outcomes from female and male patients with inflammatory bowel disease. Inflamm Bowel Dis 2013; 19: 15-22.
- Goldstein LH, Dolinsky G, Greenberg R, Schaefer C, Cohen-Kerem R, Diav-Citrin O, Malm H, Reuvers-Lodewijks ME, Rost van Tonningen-van Driel MM, Arnon J, Ornoy A, Clementi M, Di Gianantonio E, Koren G, Braunstein R, Berkovitch M. Pregnancy outcome of women exposed to azathioprine during pregnancy. Birth Defects Research Part A. Clin Mol Teratol 2007; 79: 696-701.
- De Meij TGJ, Jharap B, Kneepkens CMF, Van Bodegraven AA, De Boer NKH; Dutch Initiative Crohn C. Long-term follow-up of children exposed intrauterine to maternal thiopurine therapy during pregnancy in females with inflammatory bowel disease. Aliment Pharmacol Ther 2013; 38: 38-43.
- Christensen LA, Dahlerup JF, Nielsen MJ, Fallingborg JF, Schmiegelow K. Azathioprine treatment during lactation. Aliment Pharmacol Ther 2008; 28: 1209-1213.
- Katz JA, Antoni C, Keenan GF, Smith DE, Jacobs SJ, Lichtenstein GR. Outcome of pregnancy in women receiving infliximab for the treatment of Crohn’s disease and rheumatoid arthritis. Am J Gastroenterol 2004; 99: 2385-2392.
- Mahadevan U, Kane S, Sandborn WJ, Cohen RD, Hanson K, Terdiman JP, Binion D. Intentional infliximab use during pregnancy for induction or maintenance of remission in Crohn’s disease. Aliment Pharmacol Ther 2005; 21: 733-738.
- Johnson D, Jones K, Chambers C. Pregnancy outcomes in women exposed to adalimumab: the OTIS autoimmune diseases in pregnancy project. Gastroenterology 2009; 136: A27.
- Mahadevan U, Martin CF, Sandler RS, Kane SV, Dubinsky M, Lewis JD, Sandborn WJ, Sands BE. PIANO: a 1000 patient prospective registry of pregnancy outcomes in women with IBD exposed to immunomodulators and biologic therapy. Gastroenterology 2012; 142: S149.
- Casanova MJ, Chaparro M, Domènech E, Barreiro-de Acosta M, Bermejo F, Iglesias E, Gomollón F, Rodrigo L, Calvet X, Esteve M, García-Planella E, García-López S, Taxonera C, Calvo M, López M, Ginard D, Gómez-García M, Garrido E, Pérez-Calle JL, Beltrán B, Piqueras M, Saro C, Botella B, Dueñas C, Ponferrada A, Mañosa M, García-Sánchez V, Maté J, Gisbert JP. Safety of thiopurines and anti-TNF-a drugs during pregnancy in patients with inflammatory bowel disease. Am J Gastroenterol 2013; 108: 433-440.
- Zelinkova Z, De Harr C, De Ridder L, Pierik M, Kuipers E, Peppelenbosch M, Van Der Woude CJ. High intra-uterine exposure to infliximab following maternal anti-TNF treatment during pregnancy. Aliment Pharmacol Ther 2011; 33: 1053-1058.
- Mahadevan U, Wolf DC, Dubinsky M, Cortot A, Lee SD, Siegel CA, Ullman T, Glover S, Valentine JF, Rubin DT, Miller J, Abreu MT. Placental transfer of anti-tumor necrosis factor agents in pregnant patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2013; 11: 286-292.
- Leung Y, Panaccione R, Ghosh S, Seow CH. Management of the pregnant inflammatory bowel disease patient on antitumour necrosis factor therapy: state of the art and future directions. Can J Gastroenterol Hepatol 2014; 28: 505-509.
- Cheent K, Nolan J, Shariq S, Kiho L, Pal A, Arnold J. Case Report: fatal case of disseminated BCG infection in an infant born to a mother taking infliximab for Crohn’s disease. J Crohns Colitis 2010; 4: 603-605.
- Su CG, Judge TA, Lichtenstein GR. Extraintestinal manifestations of inflammatory bowel disease. Gastroenterol Clin North Am 2002; 31: 307-327.
- Danese S, Semeraro S, Papa A, Roberto I, Scaldaferri F, Fedeli G, Gasbarrini G, Gasbarrini A. Extraintestinal manifestations in inflammatory bowel disease. World J Gastroenterol 2005; 11: 7227-7236.
- Levine JS, Burakoff R. Extraintestinal manifestations of inflammatory bowel disease. Gastroenterology & Hepatology 2011; 7: 235-241.
- Jose FA, Heyman MB. Extraintestinal manifestations of inflammatory bowel disease. Journal of Pediatric Gastroenterology and Nutrition 2008; 46: 124-133.
- Van Assche G, Dignass A, Reinisch W, Van Der Woude CJ, Sturm A, De Vos M, Guslandi M, Oldenburg B, Dotan I, Marteau P, Ardizzone S, Baumgart DC, D’Haens G, Gionchetti P, Portela F, Vucelic B, Söderholm J, Escher J, Koletzko S, Kolho KL, Lukas M, Mottet C, Tilg H, Vermeire S, Carbonnel F, Cole A, Novacek G, Reinshagen M, Tsianos E, Herrlinger K, Oldenburg B, Bouhnik Y, Kiesslich R, Stange E, Travis S, Lindsay J; European Crohn’s and Colitis Organisation (ECCO). The second european evidence-based consensus on the diagnosis and management of Crohn’s disease: special situations. J Crohns Colitis 2010; 4: 63-101.
- Van Assche G, Dignass A, Bokemeyer B, Danese S, Gionchetti P, Moser G, Beaugerie L, Gomollón F, Häuser W, Herrlinger K, Oldenburg B, Panes J, Portela F, Rogler G, Stein J, Tilg H, Travis S, Lindsay JO. Second european evidence-based consensus on the diagnosis and management of ulcerative colitis part 3: special situations. J Crohns Colitis 2013; 7: 1-33.
- Brooklyn TN, Dunnill MG, Shetty A, Bowden JJ, Williams JD, Griffiths CE, Forbes A, Greenwood R, Probert CS. Infliximab for the treatment of pyoderma gangrenosum: a randomised, double blind, placebo-controlled trial. Gut 2006; 55: 505-509.
- Juillerat P, Mottet C, Pittet V, Froehlich F, Felley C, Vader JP, Burnand B, Gonvers JJ, Michetti P. Extraintestinal manifestations of Crohn’s disease. Digestion 2007; 76: 141-148.
- Tillack C, Ehmann LM, Friedrich M, Laubender RP, Papay P, Vogelsang H, Stallhofer J, Beigel F, Bedynek A, Wetzke M, Maier H, Koburger M, Wagner J, Glas J, Diegelmann J, Koglin S, Dombrowski Y, Schauber J, Wollenberg A, Brand S. Anti-TNF antibody-induced psoriasiform skin lesions in patients with inflammatory bowel disease are characterised by interferon-g-expressing Th1 cells and IL-17A/IL-22-expressing Th17 cells and respond to anti-IL-12/IL-23 antibody treatment. Gut 2014; 63: 567-577.
- Krishnan S, Banquet A, Newman L, Katta U, Patil A, Dozor AJ. Lung lesions in children with Crohn’s disease presenting as nonresolving pneumonias and response to infliximab therapy. Pediatrics 2006; 117: 1440-1443.
- Solem CA, Loftus EV, Tremaine WJ, Harmsen WS, Zinsmeister AR, Sandborn WJ. Correlation of C-reactive protein with clinical, endoscopic, histologic, and radiographic activity in inflammatory bowel disease. Inflamm Bowel Dis 2005; 11: 707-712.
- Peyrin-Biroulet L, Ferrante M, Magro F, Campbell S, Franchimont D, Fidder H, Strid H, Ardizzone S, Veereman-Wauters G, Chevaux JB, Allez M, Danese S, Sturm A; Scientific Committee of the European Crohn’s and Colitis Organization (ECCO). Results from the 2ndScientific Workshop of the ECCO. I: Impact of mucosal healing on the course of inflammatory bowel disease. J Crohns Colitis 2011; 5: 477-483.
- Zallot C, Peyrin-Biroulet L. Deep remission in inflammatory bowel disease: looking beyond symptoms. Curr Gastroenterol Rep 2013; 15: 315.
- Gisbert JP, Marín AC, McNicholl AG, Chaparro M. Systematic review with meta-analysis: the efficacy of a second anti-TNF in patients with inflammatory bowel disease whose previous anti-TNF treatment has failed. Aliment Pharmacol Ther 2015; 41: 613-623.
- Amiot A, Peyrin-Biroulet L. Current, new and future biological agents on the horizon for the treatment of inflammatory bowel diseases. Therapeutic Advances in Gastroenterology 2015; 8: 66-82.
- Lobatón T, Vermeire S, Van Assche G, Rutgeerts P. Review article: anti-adhesion therapies for inflammatory bowel disease. Aliment Pharmacol Ther 2014; 39: 579-594.
- Currò D, Pugliese D, Armuzzi A. Frontiers in drug research and development for inflammatory bowel disease. Front Pharmacol 2017; 8: 400.
- Ghosh S, Panaccione R. Anti-adhesion molecule therapy for inflammatory bowel disease. Therap Adv Gastroenterol 2010; 3: 239-258.
- Gordon FH, Lai CW, Hamilton MI, Allison MC, Srivastava ED, Fouweather MG, Donoghue S, Greenlees C, Subhani J, Amlot PL, Pounder RE. A randomized placebo-controlled trial of a humanized monoclonal antibody to alpha4 integrin in active Crohn’s disease. Gastroenterology 2001; 121: 268-274.
- Ghosh S, Goldin E, Gordon FH, Malchow HA, Rask-Madsen J, Rutgeerts P, Vyhnálek P, Zádorová Z, Palmer T, Donoghue S; Natalizumab Pan-European Study Group. Natalizumab for active Crohn’s disease. N Engl J Med 2003; 348: 24-32.
- Sandborn WJ, Colombel JF, Enns R, Feagan BG, Hanauer SB, Lawrance IC, Panaccione R, Sanders M, Schreiber S, Targan S, Van Deventer S, Goldblum R, Despain D, Hogge GS, Rutgeerts P; International Efficacy of Natalizumab as Active Crohn’s Therapy (ENACT-1) Trial Group; Evaluation of Natalizumab as Continuous Therapy (ENACT-2) Trial Group. Natalizumab induction and maintenance therapy for Crohn’s disease. N Engl J Med 2005; 353: 1912-1925.
- Targan SR, Feagan BG, Fedorak RN, Lashner BA, Panaccione R, Present DH, Spehlmann ME, Rutgeerts PJ, Tulassay Z, Volfova M, Wolf DC, Hernandez C, Bornstein J, Sandborn WJ; International Efficacy of Natalizumab in Crohn’s Disease Response and Remission (ENCORE) trial Group. Natalizumab for the treatment of active Crohn’s disease: results of the ENCORE Trial. Gastroenterology 2007; 132: 1672-1683.
- Gordon FH, Hamilton MI, Donoghue S, Greenlees C, Palmer T, Rowley-Jones D, Dhillon AP, Amlot PL, Pounder RE. A pilot study of treatment of active ulcerative colitis with natalizumab, a humanized monoclonal antibody to alpha-4 integrin. Aliment Pharmacol Ther 2002; 16: 699-705.
- Feagan BG, Rutgeerts P, Sands BE, Hanauer SB, Colombel JF, Sandborn W, Van Assche G, Axler J, Kim H, Danese S, Fox I, Milch C, Sankoh S, Wyant T, Xu J, Parikh A; GEMINI 1 Study Group. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013; 369: 699-710.
- Sandborn WJ, Feagan BG, Rutgeerts P, Hanauer S, Colombel JF, Sands BE, Lukas M, Fedorak RN, Lee S, Bressler B, Fox I, Rosario M, Sankoh S, Xu J, Stephens K, Milch C, Parikh A; GEMINI 2 Study Group. Vedolizumab as induction and maintenance therapy for Crohn’s disease. N Engl J Med 2013; 369: 711-721.
- Sands BE, Feagan BG, Rutgeerts P, Colombel JF, Sandborn WJ, Sy R, D’Haens G, Ben-Horin S, Xu J, Rosario M, Fox I, Parikh A, Milch C, Hanauer S. Effects of vedolizumab induction therapy for patients with Crohn’s disease in whom tumor necrosis factor antagonist treatment failed. N Engl J Med 2013; 369: 699-710.
- Vermeire S, Loftus EV Jr, Colombel JF, Feagan BG, Sandborn WJ, Sands BE, Danese S, D’Haens GR, Kaser A, Panaccione R, Rubin DT, Shafran I, McAuliffe M, Kaviya A, Sankoh S, Mody R, Abhyankar B, Smyth M. Long-term efficacy of vedolizumab for Crohn’s disease. J Crohns Colitis 2017; 11: 412-424.
- Loftus EV Jr, Colombel JF, Feagan BG, Vermeire S, Sandborn WJ, Sands BE, Danese S, D’Haens GR, Kaser A, Panaccione R, Rubin DT, Shafran I, McAuliffe M, Kaviya A, Sankoh S, Mody R, Abhyankar B, Smyth M. Long-term efficacy of vedolizumab for ulcerative colitis. J Crohns Colitis 2017; 114: 400-411.
- Vermeire S, Loftus EV, Colombel JF, Feagan B, Sandborn W, Sands B, Danese S, D’Haens G, Kaser A, Panaccione R, Rubin D, Shafran I, O’Byrne S, Geransar P, Previtali A, Khalid JM, Kaviya A. DOP021 Long-term effectiveness and safety of vedolizumab in patients with Crohn’s disease: 5-year cumulative exposure of GEMINI 2 completers rolling into the GEMINI open-label extension study. Journal of Crohn’s and Colitis 2017; 11: S39.
- Noman M, Ferrante M, Bisschops R, De Hertogh G, Van den Broeck K, Rans K, Rutgeerts P, Vermeire S, Van Assche G. Vedolizumab induces long-term mucosal healing in patients with Crohn’s disease and ulcerative colitis. J Crohns Colitis 2017; 11: 1085-1089.
- Colombel JF, Sands BE, Rutgeerts P, Sandborn W, Danese S, D’Haens G, Panaccione R, Loftus EV Jr, Sankoh S, Fox I, Parikh A, Milch C, Abhyankar B, Feagan BG. The safety of vedolizumab for ulcerative colitis and Crohn’s disease. Gut 2017; 66: 839-851.
- Yajnik V, Khan N, Dubinsky M, Axler J, James A, Abhyankar B, Lasch K. Efficacy and safety of vedolizumab in ulcerative colitis and Crohn’s disease patients stratified by age. Adv Ther 2017; 34: 542-559.
- Navaneethan U, Edminister T, Zhu X, Kommaraju K, Glover S. vedolizumab is safe and effective in elderly patients with inflammatory bowel disease. Inflamm Bowel Dis 2017; 23: E17.
- Travis S, Ungaro R, Blake A, Bhayat F, Card T. P461 Post-marketing safety experience of vedolizumab in older patients with inflammatory bowel disease. Journal of Crohn’s and Colitis 2018; 16: S337-S338.
- Schreiber S., Peyrin-Biroulet L., Loftus Edward V, Danese S, Colombel JC, Abhyankar B, Chen J, Rogers R, Lirio RA, Bornstein JD, Sands BE. A double-blind, double-dummy, randomised, controlled trial of vedolizumab versus adalimumab in patients with active ulcerative colitis. Journal of Crohn’s and Colitis, Volume 13, Issue, Supplement_1, March 2019, Pages S612–S613.
- Narula N, Peerani F, Meserve J, Kochhar G, Chaudrey K, Hartke J, Chilukuri P, Koliani-Pace J, Winters A, Katta L, Shmidt E, Hirten R, Faleck D, Parikh MP, Whitehead D, Boland BS, Singh S, Sagi SV, Fischer M, Chang S, Barocas M, Luo M, Lasch K, Bohm M, Lukin D, Sultan K, Swaminath A, Hudesman D, Gupta N, Shen B, Kane S, Loftus EV, Siegel CA, Sands BE, Colombel JF, Sandborn WJ, Dulai PS. Vedolizumab for ulcerative colitis: treatment outcomes from the VICTORY consortium. Am J Gastroenterol 2018; 113: 1345-1354.
- Dulai PS, Singh S, Jiang X, Peerani F, Narula N, Chaudrey K, Whitehead D, Hudesman D, Lukin D, Swaminath A, Shmidt E, Wang S, Boland BS, Chang JT, Kane S, Siegel CA, Loftus EV, Sandborn WJ, Sands BE, Colombel JF. The real-world effectiveness and safety of vedolizumab for moderate-severe Crohn’s disease: results from the US VICTORY consortium. Am J Gastroenterol 2016; 111: 1147-1155.
- Vermeire S, O’Byrne S, Keir M, Williams M, Lu TT, Mansfield JC, Lamb CA, Feagan BG, Panes J, Salas A, Baumgart DC, Schreiber S, Dotan I, Sandborn WJ, Tew GW, Luca D, Tang MT, Diehl L, Eastham-Anderson J, De Hertogh G, Perrier C, Egen JG, Kirby JA, Van Assche G, Rutgeerts P. Etrolizumab as induction therapy for ulcerative colitis: a randomised, controlled, phase 2 trial. Lancet 2014; 384: 309-318.
- Sandborn WJ, Panés J, Jones J, Hassanali A, Jacob R, Sharafali Z, Oh JS, Tole S. Etrolizumab as induction therapy in moderate to severe Crohn’s disease: results from BERGAMOT cohort 1. LB03. United European Gastroenterology Journal 2017; 5: 1138-1150.
- Peyrin-Biroulet L, Rubin DT, Feagan BG, Oh YS, Arulmani U, Tyrrell H, Maciuca R, Williams S. Tole S, Thommes J. Etrolizumab induction therapy improved endoscopic score, patient-reported outcomes and inflammatory biomarkers in patients with moderate to severe UC who had failed tnf antagonist therapy: results from the HICKORY open-label induction (OLI) trial. LB02. United European Gastroenterology Journal 2017; 5: 1138-1150.
- Vermeire S, Sandborn WJ, Danese S, Hébuterne X, Salzberg BA, Klopocka M, Tarabar D, Vanasek T, Greguš M, Hellstern PA, Kim JS, Sparrow MP, Gorelick KJ, Hinz M, Ahmad A, Pradhan V, Hassan-Zahraee M, Clare R, Cataldi F, Reinisch W. Anti-MAdCAM antibody (PF-00547659) for ulcerative colitis (TURANDOT): a phase 2, randomised, double-blind, placebo-controlled trial. Lancet 2017; 390: 135-144.
- Sandborn WJ, Lee SD, Tarabar D, Louis E, Klopocka M, Klaus J, Reinisch W, Hébuterne X, Park DI, Schreiber S, Nayak S, Ahmad A, Banerjee A, Brown LS, Cataldi F, Gorelick KJ, Cheng JB, Hassan-Zahraee M, Clare R, D’Haens GR. Phase II evaluation of anti-MAdCAM antibody PF-00547659 in the treatment of Crohn’s disease: report of the OPERA study. Gut 2018; 67: 1824-1835.
- D’Haens GR, Reinisch W, Lee SD, Tarabar D, Louis E, Kłopocka M, Klaus J, Schreiber S, Park DI, Hébuterne X, Cataldi F, Banerjee A, Gorelck K, Sandborn WJ. OP024 Long-term safety and efficacy of the anti-MAdCAM monoclonal antibody SHP647 for the treatment of Crohn’s disease: the OPERA II study. Journal of Crohn’s and Colitis 2018; 12: S017-S018.
- Sandborn WJ, Cyrille M, Hansen MB, Feagan BG, Loftus EV Jr, Rogler G, Vermeire S, Cruz ML, Yang J, Sullivan BA, Reinisch W. Efficacy and safety of abrilumab in subjects with moderate to severe ulcerative colitis: results of a phase 2b, randomised, double-blind, multiple-dose, placebo-controlled study. J Crohns Colitis 2017; 11: S21-S22.
- Sandborn WJ, Cyrille M, Berner Hansen M, Feagan BG, Loftus EV Jr, Vermeire S, Cruz ML, Mo M, Sullivan BA, Reinisch W. Efficacy and safety of abrilumab (AMG 181/MEDI 7183) therapy for moderate to severe Crohn’s disease. J. Crohns Colitis 2017; 11: S22-S23.
- Yoshimura N, Watanabe M, Motoya S, Tominaga K, Matsuoka K, Iwakiri R, Watanabe K, Hibi T; AJM300 Study Group. Safety and efficacy of AJM300, an oral antagonist of a4 Integrin, in induction therapy for patients with active ulcerative colitis. Gastroenterology 2015; 149: 1775-1783.
- Walters MJ, Wang Y, Lai N, Baumgart T, Zhao BN, Dairaghi DJ, Bekker P, Ertl LS, Penfold ME, Jaen JC, Keshav S, Wendt E, Pennell A, Ungashe S, Wei Z, Wright JJ, Schall TJ. Characterization of CCX282-B, an orally bioavailable antagonist of the CCR9 chemokine receptor, for treatment of inflammatory bowel disease. J Pharmacol Exp Ther 2010; 335: 61-69.
- Mayer L, Sandborn WJ, Stepanov Y, Geboes K, Hardi R, Yellin M, Tao X, Xu LA, Salter-Cid L, Gujrathi S, Aranda R, Luo AY. Anti-IP-10 antibody (BMS-936557) for ulcerative colitis: a phase II randomised study. Gut 2014; 63: 442-450.
- Sandborn WJ, Colombel J-F, Ghosh S, Sands BE, Dryden G, Hébuterne X, Leong RW, Bressler B, Ullman T, Lakatos PL, Reinisch W, Xu LA, Luo A. Eldelumab [Anti-IP-10] induction therapy for ulcerative colitis: a randomised, placebo-controlled, phase 2b study. Journal of Crohn’s & Colitis 2016; 10: 418-428.
- Keshav S, Vaňásek T, Niv Y, Petryka R, Howaldt S, Bafutto M, Rácz I, Hetzel D, Nielsen OH, Vermeire S, Reinisch W, Karlén P, Schreiber S, Schall TJ, Bekker P; Prospective Randomized Oral-Therapy Evaluation in Crohn’s Disease Trial-1 PROTECT-1 Study Group. A randomized controlled trial of the efficacy and safety of CCX282-B, an orally-administered blocker of chemokine receptor CCR9, for patients with Crohn’s disease. PLoS One 2013; 8: e60094.
- Yacyshyn BR, Bowen-Yacyshyn MB, Jewell L, Tami JA, Bennett CF, Kisner DL, Shanahan WR Jr. A placebo-controlled trial of ICAM-1 antisense oligonucleotide in the treatment of Crohn’s disease. Gastroenterology 1998; 114: 1133-1142.
- Van Deventer SJH, Tami JA, Wedel MK; European Colitis Study Group. A randomised, controlled, double blind, escalating dose study of alicaforsen enema in active ulcerative colitis. Gut 2004; 53: 1646-1651.
- Sandborn WJ, Feagan BG, Fedorak RN, Scherl E, Fleisher M, Katz S, Johanns J, Blank MA, Rutgeerts P; Ustekinumab Crohn’s Disease Study Group. A randomized trial of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with moderate-to-severe Crohn’s disease. Gastroenterology 2008; 135: 1130-1141.
- Sandborn WJ, Gasink C, Gao LL, Blank MA, Johanns J, Guzzo C, Sands BE, Hanauer SB, Targan S, Rutgeerts P, Ghosh S, de Villiers WJ, Panaccione R, Greenberg G, Schreiber S, Lichtiger S, Feagan BG; CERTIFI Study Group. Ustekinumab induction and maintenance therapy in refractory Crohn’s disease. N Engl J Med 2012; 367: 1519-1528.
- Feagan BG, Sandborn WJ, Gasink C, Jacobstein D, Lang Y, Friedman JR, Blank MA, Johanns J, Gao LL, Miao Y, Adedokun OJ, Sands BE, Hanauer SB, Vermeire S, Targan S, Ghosh S, de Villiers WJ, Colombel JF, Tulassay Z, Seidler U, Salzberg BA,Desreumaux P, Lee SD, Loftus EV Jr, Dieleman LA, Katz S, Rutgeerts P; UNITI–IM-UNITI Study Group. Ustekinumab as induction and maintenance therapy for Crohn’s disease. N Engl J Med 2016; 375: 1946-1960.
- Ma C, Fedorak RN, Kaplan GG, Dieleman LA, Devlin SM, Stern N, Kroeker KI, Seow CH, Leung Y, Novak KL, Halloran BP, Huang VW, Wong K, Blustein PK, Ghosh S, Panaccione R. Clinical, endoscopic and radiographic outcomes with ustekinumab in medically-refractory Crohn’s disease: real world experience from a multicenter cohort. Aliment Pharmacol Ther 2017; 45: 1232-1243.
- Sands BE, Chen J, Feagan BG, Penney M, Rees WA, Danese S, Higgins PDR, Newbold P, Faggioni R, Patra K, Li J, Klekotka P, Morehouse C, Pulkstenis E, Drappa J, Van der Merwe R, Gasser RA Jr. Efficacy and safety of MEDI2070, an antibody against interleukin 23, in patients with moderate to severe Crohn’s disease: a phase 2a study. Gastroenterology 2017; 153: 77-86.
- Feagan BG, Sandborn WJ, D’Haens G, Panés J, Kaser A, Ferrante M, Louis E, Franchimont D, Dewit O, Seidler U, Kim KJ, Neurath MF, Schreiber S, Scholl P, Pamulapati C, Lalovic B, Visvanathan S, Padula SJ, Herichova I, Soaita A, Hall DB, Böcher WO. Induction therapy with the selective interleukin-23 inhibitor risankizumab in patients with moderate-to-severe Crohn’s disease: a randomised, double-blind, placebo-controlled phase 2 study. Lancet 2017; 389: 1699-1709.
- Danese S, Vermeire S, Hellstern P, Panaccione R, Rogler G, Fraser G, Kohn A, Desreumaux P, Leong RW, Comer GM, Cataldi F, Banerjee A, Maguire MK, Li C, Rath N, Beebe J, Schreiber S. Randomised trial and open-label extension study of an anti-interleukin-6 antibody in Crohn’s disease (ANDANTE I and II). Gut 2017 15. pii: gutjnl-2017-314562.
- Olivera P, Danese S, Peyrin-Biroulet L. Next generation of small molecules in inflammatory bowel disease. Gut 2017; 66: 199-209.
- Boland BS, Vermeire S. Janus kinase antagonists and other novel small molecules for the treatment of Crohn’s disease. Gastroenterol Clin North Am 2017; 46: 627-644.
- Sandborn WJ, Ghosh S, Panes J, Vranic I, Su C, Rousell S, Niezychowski W; Study A3921063 Investigators. Tofacitinib, an oral Janus kinase inhibitor, in active ulcerative colitis. N Engl J Med 2012; 367: 616-624.
- Sandborn WJ, Su C, Sands BE, D’Haens GR, Vermeire S, Schreiber S, Danese S, Feagan BG, Reinisch W, Niezychowski W, Friedman G, Lawendy N, Yu D, Woodworth D, Mukherjee A, Zhang H, Healey P, Panés J; OCTAVE Induction 1, OCTAVE Induction 2 and OCTAVE Sustain Investigators. Tofacitinib as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2017; 376: 1723-1736.
- Sandborn WJ, Ghosh S, Panes J, Vranic I, Wang W, Niezychowski W; Study A3921043 Investigators. A phase 2 study of tofacitinib, an oral Janus kinase inhibitor, in patients with Crohn’s disease. Clin Gastroenterol Hepatol 2014; 12: 1485-1493.
- Vermeire S, Schreiber S, Petryka R, Kuehbacher T, Hebuterne X, Roblin X, Klopocka M, Goldis A, Wisniewska-Jarosinska M, Baranovsky A, Sike R, Stoyanova K, Tasset C, Van der Aa A, Harrison P. Clinical remission in patients with moderate-to-severe Crohn’s disease treated with filgotinib (the FITZROY study): results from a phase 2, double-blind, randomised, placebo-controlled trial. Lancet 2017; 389: 266-275.
- D’Haens GR, Schreiber S, Petryka R, Kuehbacher R, Hebuterne X, Roblin X, Klopocka M, Goldis A, Wisniewska-Jarosinska MA, Baranovsky A, Sike R, Kremena Stoyanova, Luc Meuleners, Chantal T, Tasset, Annegret Van der Aa, Harrison P, Vermeire S. Efficacy of filgotinib, a selective JAK1 inhibitor, is independent of prior anti-TNF exposure: subgroup analysis of the phase 2 FITZROY study in moderate-to-severe Crohn’s disease. Gastroenterology 2017; 152: S597.
- Sandborn WJ, Feagan BG, Panes J, D’Haens GR, Colombel JF, Zhou Q, Huang B, Enejosa JV, Pangan AL, Lacerda AP. Safety and efficacy of upadacitinib (ABT-494), an oral JAK1 inhibitor, as induction therapy in patients with Crohn’s disease: results from CELEST. Gastroenterology 2017; 152: S1308-S1309.
- Schreiber S, Peyrin-Biroulet L, Boland B, Higgins PD, Armuzzi A, Terdiman J, Zhou W, Alperovich G, Cataldi F, Goteti S, Lacerda AP. Rapidity of clinical and laboratory improvements following upadacitinib induction treatment: data from the CELEST study. Journal of Crohn’s & Colitis 2018; 12: S015.
- Beattie D, Tsuruda P, Shen F, Brassil P, Langrish C, Janc J, Ren Z, Hudson R, Smith J, Hegde S. TD-1473, a novel, potent, and orally administered, GI-targeted, pan-Janus kinase (JAK) inhibitor. Journal of Crohn’s & Colitis 2016; 10: S123.
- Monteleone G, Neurath MF, Ardizzone S, Di Sabatino A, Fantini MC, Castiglione F, Scribano ML, Armuzzi A, Caprioli F, Sturniolo GC, Rogai F, Vecchi M, Atreya R, Bossa F, Onali S, Fichera M, Corazza GR, Biancone L, Savarino V, Pica R, Orlando A, Pallone F. Mongersen, an oral SMAD7 antisense oligonucleotide, and Crohn’s disease. N Engl J Med 2015; 372: 1104-1113.
- Monteleone G, Pallone F. Mongersen, an Oral SMAD7 Antisense Oligonucleotide, and Crohn’s disease. N Engl J Med 2015; 372: 2461.
- Feagan BG, Colombel JF, Rossiter G, Li X, Usiskin K, Zhan X, Sands BE. Correlation of Clinical and Endoscopic Outcomes in Patients with Active Crohn’s Disease Treated with Mongersen (GED-0301). European Crohn’s and Colitis Organisation (ECCO) 2017; 152: S198.
- Feagan BG, Sands BE, Rossiter G, Li X, Usiskin K, Zhan X, Colombel JF. Effects of mongersen (GED-0301) on endoscopic and clinical outcomes in patients with active Crohn’s disease. Gastroenterology 2018; 154: 61-64.
- Sandborn WJ, Feagan BG, Wolf DC, D’Haens G, Vermeire S, Hanauer SB, Ghosh S, Smith H, Cravets M, Frohna PA, Aranda R, Gujrathi S, Olson A; TOUCHSTONE Study Group. Ozanimod induction and maintenance treatment for ulcerative colitis. N Engl J Med 2016 5; 374: 1754-1762.
- Peyrin-Biroulet L, Christopher R, Behan D, Lassen C. Modulation of sphingosine-1-phosphate in inflammatory bowel disease. Autoimmun Rev 2017; 16: 495-503.
- Sandborn WJ, Feagan BG. Ozanimod treatment for ulcerative colitis. N Engl J Med 2016; 375: 1946-1960.
- Kühbacher T, Christopher R, Trokan L, Lassen C, Adams J, Peyrin-Biroulet L. DOP078 Pharmacology and safety of etrasimod (APD334), an oral, potent, next-generation, selective S1P receptor modulator. European Crohn’s and Colitis Organisation (ECCO) 2017.
- Danese S, Neurath M, Kopon A, Zakko S, Simmons T, Fogel R, Maccarone J, Zhan X, Usiskin K, Chitkara D. Apremialast for active ulcerative colitis: a phase 2, randomised, double-blind, placebo-controlled induction study. OP006. Journal of Crohn’s & Colitis 2018; 12: S004-S005.
- D’Haens G, Sandborn WJ, Colombel JF, Rutgeerts P, Brown K, Barkay H, Sakov A, Haviv A, Feagan BG; Laquinimod for Crohn’s Disease Investigators. A phase II study of laquinimod in Crohn’s disease. Gut 2015; 64: 1227-1235.
- Frias Gomes C, Colombel JF, Torres J. De-escalation of Therapy in Inflammatory Bowel Disease. Curr Gastroenterol Rep 2018; 20: 35.
- Sandborn WJ, Hanauer S, Van Assche G, Panés J, Wilson S, Petersson J, Panaccione R. Treating beyond symptoms with a view to improving patient outcomes in inflammatory bowel diseases. J Crohn’s Colitis 2014; 8: 927-935.
- Danese S, Fiorino G, Peyrin-Biroulet L, Lucenteforte E, Virgili G, Moja L, Bonovas S. Biological agents for moderately to severely active ulcerative colitis: a systematic review and network meta-analysis. Ann Intern Med 2014; 160: 704-711.
- Danese S, Panés J. Development of drugs to target interactions between leukocytes and endothelial cells and treatment algorithms for inflammatory bowel diseases. Gastroenterology 2014; 147: 981-989.
- Greenup AJ, Rosenfeld G, Bressler B. Ustekinumab use in Crohn’s disease: a Canadian tertiary care centre experience. Scand J Gastroenterol 2017; 52: 1354-1359.
- Kirsner JB. We still are more than molecules. Inflamm Bowel Dis 2002; 8: 56-57.
Correspondencia: Alicia María Sambuelli
Correo electrónico: alicia.sambuelli@gmail.com
Acta Gastroenterol Latinoam 2019;49(S2)
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE