Carmen Aguiar,1 Sylvia Jaumandreu,2 Carmen Álvarez,3 María Carmen Rodríguez3
1Área de Diagnóstico y Tratamiento HPV Rectoanal. Corporación de Asistencia Médica, MUCAM.
2Laboratorio de Citopatología, CITOLAB.
3Laboratorio Carmen Álvarez Santín.
Montevideo, Uruguay.
Acta Gastroenterol Latinoam 2018;48(3):206-212
Recibido: 24/09/2017 / Aprobado: 23/04/2018 / Publicado en www.actagastro.org el 17/09/2018
Resumen
El cáncer anal ha aumentado su incidencia en la población general y especialmente en grupos de riesgo donde llega a 100/100.000 habitantes por año. El diagnóstico de la neoplasia intraepitelial anal (NIA) es el objetivo de los programas de screening. El análisis histológico es el patrón de oro y las muestras son tomadas a través de una colposcopía anal, técnica llamada anoscopía de alta resolución. Objetivos. Describir los hallazgos de NIA en una población seleccionada por su riesgo clínico, en una institución de asistencia médica colectiva. Describir el uso de la cromoendoscopía digestiva con magnificación en sustitución de la colposcopia anal. Material y métodos. Se analizó una población de 230 pacientes. Se los categorizó de acuerdo con el riesgo clínico en 4 grupos. Se realizó PAP anal en todos los casos y se indicó una cromoendoscopía digestiva magnificada, con biopsias dirigidas, cuando el PAP informó anomalías celulares. Se utilizaron equipos Fujinon: videocolonoscopio EC-590 ZW/M, videocolonoscopio EC-L 590 ZW/M. Procesador EPX4450 y Fuente Laséreo LL-4450. Resultados. 73% perteneció al sexo femenino, la edad mediana fue de 33 años (rango 18- 66). El PAP fue positivo en el 62%. El análisis histológico informó NIA en el 76% de los casos y en el 30% fueron NIA de alto grado. Conclusiones. Se halló un alto porcentaje de casos con NIA en el PAP anal y en el análisis histológico, el porcentaje de NIA de alto grado fue muy elevado en comparación con otras series y el uso de la cromoendoscopía digestiva con magnificación es un buen método para el diagnóstico de las lesiones precursoras del cáncer anal en grupos de riesgo.
Palabras claves. Neoplasia intraepitelial, anoscopía de alta resolución, cromoendoscopía magnificada.
Magnification chromoendoscopy for the diagnosis of anal intraepithelial neoplasia
Summary
Anal cancer incidence has grown over general population, especially over risk groups in which it can be found in 100 over 100,000 habitants per year. The diagnosis of these precursor lesions, anal intraepithelial neoplasia (AIN) is the objective of the screening programs. The histological analysis is the golden pattern and the samples are taken through anal colposcopy, a technique called high resolution anoscopy. Objective. Describe the AIN found in a group of people selected by their clinical risk in a private reference center. Describe the use of magnified digestive chromoendoscopy to substitute the anal colposcopy. Material and methods. 230 people were analyzed. Anal PAP test was performed in each case and magnified digestive chromoendoscopy with digested biopsies when the PAP test showed cellular anomalies. Equipment used. EC-590 ZW/M video colonoscope, EC-L 590 ZW/M video colonoscope, EPX4450 processor and Lasereo font LL-4450. Results. The 73% were females with median age of 33 years (range 18-66). The PAP test was found positive in 62%. The histologic analysis showed AIN in 76% of the cases, which 30% were high degree AIN. Conclusions. A high percentage of cases with AIN in both the PAP test and the histologic analysis were found, the percentage of high degree AIN cases was much higher when compared with other series and magnified digestive chromoendoscopy is a good method for the diagnosis of anal cancer precursory injuries in risk groups.
Key words. Anal intraepithelial neoplasia, high resolution anoscopy, magnification chromoendoscopy.
Abreviaturas
NIA: neoplasia intraepitelial anal.
AAR: anoscopía de alta resolución.
VPH: virus del papiloma humano.
HsexH: hombres que tienen sexo con hombres.
El aumento de la incidencia del cáncer anal en pacientes VIH+ en los últimos 20 años ha sido el motivo fundamental para el desarrollo de la investigación sobre esta patología.1-3
Hace más de 30 años que se describió la relación histológica, etiopatogénica y epidemiológica entre el cáncer anal y el cáncer de cérvix.4 El VPH es el responsable del 90% de los cánceres anales.5 El diagnóstico de las lesiones displásicas precursoras y su tratamiento constituyen la mayor herramienta en la prevención.
En los centros de diagnóstico de lesiones precursoras de cáncer anal, se utiliza el PAP anal como método de tamizaje previo a la anoscopía de alta resolución (AAR) con biopsias dirigidas.2, 6-9 La única publicación realizada en el Uruguay sobre lesiones anorrectales por VPH mostró una sensibilidad del PAP anal del 91,7% y una especificidad del 45,8%.10 En esa investigación se valoró el rendimiento diagnóstico de la citología, PAP anal, frente a la histología. El buen rendimiento del PAP en la población referida y con la metodología que se aplica en nuestro servicio nos llevó a utilizarlo como método de tamizaje. Desde enero de 2015 indicamos endoscopía de alta resolución con biopsias solo en los pacientes con anomalías celulares por VPH en el PAP anal. Para la realización de esta endoscopía utilizamos la cromoendoscopía digestiva magnificada como una variante de la AAR.
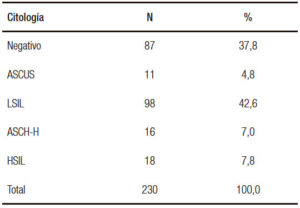
La AAR convencional es una colposcopía del canal anal donde el espéculo es sustituido por un anoscopio transparente y la tinción de la pared del canal se realiza con ácido acético al 4%. Esta técnica facilita la identificación de las lesiones, con una sensibilidad variable que depende del entrenamiento del observador. La semiología de la imagen endoscópica es en sí misma un capítulo aparte dado que no existe una nomenclatura definida. Es realizada por ginecólogos y proctólogos que concurren a centros de entrenamiento donde se les valida el ejercicio de la técnica de acuerdo con exigencias más o menos rigurosas. Para la clasificación histopatológica de las displasias se utiliza la terminología NIA, neoplasia intraepitelial anal, de bajo grado (NIA1) y NIA de alto grado (NIA2, NIA3) homóloga al conocido nomenclador de las lesiones intraepiteliales de cérvix. Para el análisis citológico se utiliza el método de PAP y la clasficación de Bethesda: LSIL, ASC-US, HSIL, ASC-H.
La prevalencia de las lesiones internas es netamente superior en hombres que tienen sexo con hombres, HsexH, VIH+ y VIH-.2, 3, 6, 9 Las mujeres VIH+, las mujeres en general con neoplasias en tracto genital inferior y todas las personas con verrugas en piel anal tienen prevalencia aumentada.10-13 Se ha investigado sobre la prevalencia de la infección en los distintos grupos a través de análisis biomolecular, test de VPH, y se ha comprobado un paralelismo en las prevalencias de infección y lesión en los mismos grupos.13-16 Los genotipos de bajo riesgo, riesgo potencial y alto riesgo son los mismos observados en el tracto genital inferior, apareciendo el VPH16 como el prevalente en NIA de alto grado y cáncer anal.
La tasa de incidencia del cáncer anal en el grupo clínico de mayor riesgo, HsexH VIH+, es mayor a 100/100.000 habitantes por año y entre 10 y 30/100.000 habitantes por año para los otros grupos descriptos. Se sugiere que en todos los grupos de riesgo debería aplicarse una metodología de prevención similar a la utilizada en cáncer de cérvix, pero el conocimiento sobre la biología y la evolución de la neoplasia intraepitelial anal es aún muy limitado. Actualmente se les denomina neoplasias relacionadas al VPH y su presencia en un sitio del área ano genital debe llevarnos a la búsqueda en el resto del área.1
Objetivos
- Describir los hallazgos de NIA en una población seleccionada por su riesgo clínico, en una institución de asistencia médica colectiva.
- Describir el uso de la cromoendoscopía digestiva con magnificación para la realización de la anoscopía de alta resolución en sustitución de la colposcopia anal.
Material y métodos
Se analizó una población de 230 pacientes, usuarios de una institución de asistencia médica colectiva, MUCAM. Fueron referidos a nuestro servicio “Área de Diagnóstico y Tratamiento del VPH Rectoanal”, entre enero de 2015 y julio de 2017.
Criterio de inclusión
- Pacientes mayores de 18 años que solicitaron mediante una orden médica el diagnóstico de lesiones anorrectales vinculables al VPH.
Criterio de exclusión
- Menores de 18 años.
- Imposibilidad de obtener el consentimiento informado.
Fueron derivados para la pesquisa de lesiones VPH rectoanales por infectólogos, dermatólogos, cirujanos, ginecólogos y gastroenterólogos con diagnóstico presuntivo de estas lesiones. Se categorizaron en grupos de riesgo de acuerdo con la literatura existente.
- Grupo 1: HSexH VIH+.
- Grupo 2: HSexH.
- Grupo 3: mujeres con patología VPH en el tracto genital inferior (TGI).
- Grupo 4: hombres y mujeres con verrugas en la piel perianal.
Una vez obtenido el consentimiento informado, se les realizó PAP anal a todos los pacientes tomando las muestras con espátula baja lenguas, a través de un anoscopio de plástico, fenestrado. Las muestras fueron analizadas siempre por el mismo citopatólogo. A los pacientes con PAP+, resultados: ASC-US, LSIL, ASC-H y HSIL se les indicó cromoendoscopía digestiva magnificada con biopsias dirigidas. El análisis histológico se realizó en todos los casos por el mismo patólogo quien utilizó la clasificación de NIA de bajo grado para NIA1 y NIA de alto grado para NIA 2 y 3.
Se utilizaron equipos Fujinon: videocolonoscopio EC-590 ZW/M, videocolonoscopio EC-L 590 ZW/M. Procesador EPX4450 y Fuente Laséreo LL-4450.
El protocolo de trabajo se ajustó a las normas éticas de la declaración de Helsinki de 1975 en la versión revisada de 1983. Fue evaluado y aprobado por el Comité de Ética de MUCAM. No existió conflicto de intereses. No recibió subvenciones públicas o privadas.
Resultados
Se realizó un estudio transversal, observacional, descriptivo de una muestra de pacientes elegidos por conveniencia, a partir de grupos de riesgo tomados de la literatura.
Se realizó una descripción estadística de la población estudiada. Se muestran las variables cualitativas mediante frecuencia absoluta y relativa porcentual; para las variables cuantitativas se describe media y desvío estándar. Se observa de forma específica la distribución de las variables de interés utilizando como factor los grupos de riesgo. Para el procesamiento de la información se utilizó paquete estadístico PSPP, software libre.
El 73% de los pacientes fueron de sexo femenino, con una mediana de edad de 33 años (rango 18-66). El grupo 4 fue el más frecuente (54%).
Dentro de la clasificación citológica, la categoría más observada fue LSIL (43%), el acumulado de displasia de alto grado se ubicó en el 15%. Los negativos representaron un 38%.
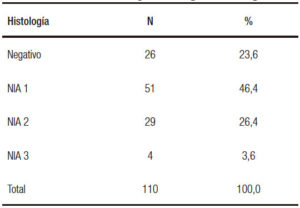
Un 23% de los pacientes no concurrieron a realizarse la endoscopía por no presentar indicación u otros motivos. Dentro de los pacientes que tienen algún tipo de lesión intraepitelial (76%), la categoría NIA 1 es la de mayor porcentaje (46%).
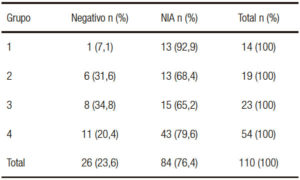
Se evidencia el patrón de lesión en un 93% para el grupo 1; para los grupos restantes el porcentaje de lesión varía entre el 65% (grupo 3) y el 80% (grupo 4).
Discusión
Hubo un franco predominio del sexo femenino (72,6%), similar a la tendencia observada en nuestra primera serie publicada.10 El grupo 4, constituido por pacientes con verrugas en la piel perianal, es el más numeroso, seguido por el grupo 3 compuesto por mujeres enviadas por ginecólogos, con antecedentes o historia actual de lesiones en el tracto genital inferior. Si bien los grupos 1 y 2 HsexH VIH+ y VIH- son los de mayor riesgo para cáncer anal, aún son escasamente referidos a nuestro servicio (Tabla 1). Aún con estas consideraciones hubo un alto porcentaje de pacientes con anomalías en el PAP anal vinculables a VPH, 141 pacientes 61,3% (Tabla 2). De acuerdo con nuestro protocolo de trabajo se les indicó cromoendoscopía digestiva magnificada rectoanal. Todos los pacientes recibieron información en la entrevista inicial y luego se les comunicó personalmente el resultado del PAP. No concurrieron a realizarse la endoscopía el 23% de las personas citadas. Los motivos que expresaron fueron varios, entre los más frecuentes fue el olvido, la desafiliación de la institución, o embarazo luego del PAP. Consideramos importante no perder el vínculo con el paciente aunque no haya concurrido en una primera instancia a la endoscopía. El análisis histológico es el patrón de oro en el diagnóstico de la NIA. El PAP anal es un método sensible pero con especificidad limitada, por lo que no deberá concluirse en cuanto al diagnóstico y/o tratamiento sin el resultado de la histología.10, 17, 18 El modelo reproduce el utilizado en la prevención de cuello uterino desde hace varias décadas: luego de un PAP patológico debe realizarse la biopsia dirigida. La International Anal Neoplasia Society (IANS) ratificó en 2016 las guías elaboradas por expertos en la 30a conferencia de la International Papillomavirus Society (IPVS) Lisboa 2015. Se describen en ellas las recomendaciones para la detección de las lesiones precursoras del cáncer anal.19
Tabla 1. Descriptiva del total de pacientes.
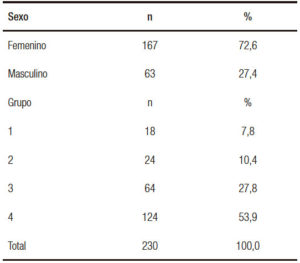
Tabla 2. Distribución del total de los pacientes según la citología.
En el análisis histológico se observó un 23,4% de negativos, y en el 76,4% se encontraron lesiones intraepiteliales en las muestras histológicas (Tabla 3). Del total de los pacientes biopsiados, en el 30 % se hallaron lesiones con alto grado de displasia, NIA 2 y 3. Esta cifra es muy alta incluso comparada con series donde solo se incluyen pacientes del grupo 1.2, 3, 9, 20 No podemos afirmar si estos resultados se deben a una mayor eficiencia por la técnica utilizada o a una baja especificidad del análisis histológico entre NIA de bajo grado y NIA de alto grado. Estamos utilizando actualmente técnicas de inmunohistoquímica P 16 y Ki 67 que aportarán una mayor precisión en el diagnóstico de la neoplasia de alto grado. En cuanto a la distribución de las lesiones de acuerdo con el grupo de riesgo (Tabla 4), se observa que un 93% de los pacientes del grupo 1 presentaron algún grado de NIA. La distribución inhomogénea de la población y la escasa representación de los grupos de mayor riesgo nos impiden analizar la presencia de lesiones de acuerdo con el riesgo clínico.
Tabla 3. Distribución de los pacientes según la histología.
Tabla 4. Distribución por grupo de riesgo de los hallazgos histológicos en las biopsias obtenidas en la endoscopía.
Se realizó tratamiento en todos los casos con lesiones, haciendo hincapié en el seguimiento dada la alta tasa de recurrencia.21 Utilizamos la topicación con ácido acético al 85% y la electrofulguración con sedación anestésica, en caso de lesiones extendidas.
Cromoendoscopía digestiva magnificada en sustitución de la AAR convencional
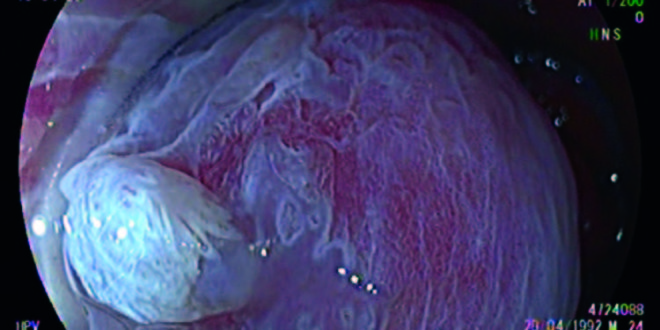
La AAR en la literatura actual es sinónimo de colposcopía anal con tinción química.5, 7, 17, 18 Utilizando las nuevas tecnologías de la videoendoscopía digestiva es posible alcanzar una magnificación óptica de 200x, significativamente superior a la de un colposcopio de última generación. Nosotros trabajamos con una imagen magnificada de 100x que nos permite un mejor manejo del foco (Figuras 1 y 2). El uso de capuchón es necesario al comienzo del entrenamiento. Con el advenimiento del sistema Laséreo, hemos sustituído la acetotinción por la cromotinción electrónica. Esto ha simplificado la técnica, acortando los plazos y las rotaciones del anoscopio, que pueden resultar molestas especialmente cuando hay hemorroides. El destaque de los cambios en el patrón vascular y glandular es igual de efectivo (Figura 3). El uso del colonoscopio permite valorar el recto, más allá del canal anal, con el fin de diagnosticar las metaplasias escamosas que pueden ser asiento de displasias VPH (Figura 4). En cuanto a las tomas de muestras, el uso del fórceps de biopsia es sin duda menos cruento dado que presenta una apertura de 4 mm. En colposcopía se utiliza la pinza baby tischler; desconocemos las complicaciones de este procedimiento dado que no hemos encontrado trabajos publicados al respecto. Es una zona de difícil manejo para la biopsia dada la vascularización y la presencia de fibras nerviosas inmediatamente por debajo de la línea criptopapilar. La frecuencia de la patología digestiva asociada en el canal anal y el recto bajo (hemorroides, fisuras, abscesos, fístulas, pólipos) implica la necesidad de su conocimiento para el tratamiento de estas o sus complicaciones.
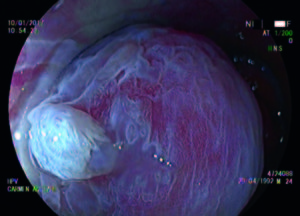
Figura 1. Técnica de cromoendoscopía y magnificación, tinción con ácido acético al 4%. Lesión HPV acetoblanca.
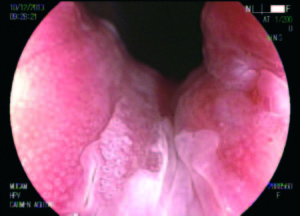
Figura 2. Patrón en mosaico. Neoplasia intraepitelial de alto grado.
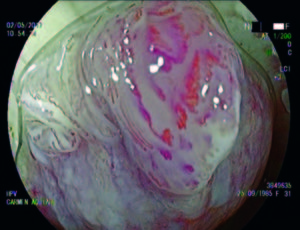
Figura 3. Técnica de cromoendoscopía láser, LCI. Destaque del patrón vascular.
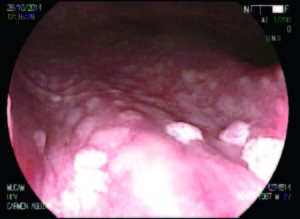
Figura 4. Lesiones HPV en recto.
Es la primera vez que se describe el uso de la cromoendoscopía digestiva magnificada en el diagnóstico de la neoplasia intraepitelial anal. El defecto de esta investigación ha sido el tamaño pequeño de la muestra y la distribución inhomogénea de la población, con escasa representación de los grupos de mayor riesgo.
El manejo de una patología donde el tubo digestivo bajo es el órgano blanco debe incluir a gastroenterólogos endoscopistas. La frecuencia de estas lesiones y su relación con el cáncer anal abre un camino para el aprendizaje y la búsqueda sistematizada de las mismas.
Conclusiones
- Se halló un alto porcentaje de casos con NIA en el análisis citológico, PAP anal y en el análisis histológico de muestras obtenidas mediante cromoendoscopía digestiva magnificada.
- A pesar del bajo número de pacientes pertenecientes a los grupos 1 y 2, considerados como los de mayor riesgo, nuestro porcentaje de NIA de alto grado fue muy elevado en comparación con otras series.
- La patología digestiva asociada en el canal anal y la posible existencia de lesiones displásicas por VPH en recto bajo nos permite afirmar que la cromoendoscopía digestiva magnificada puede ser un buen método diagnóstico de las lesiones precursoras del cáncer anal.
Sostén financiero. No se recibió apoyo en forma de subvenciones, equipamiento, fármacos u otros.
Referencias
- Palefsky J, Rubin M. The epidemilogy of anal human papillomavirus and related neoplasia. Obstet Gynecol Clin North Am 2009; 36: 187-200.
- Palefsky JM. Human papillomavirus-related disease in people with HIV. Curr Opin HIV AIDS 2009; 4: 52-56.
- D Souza G, Wiley D, Li X, Chmiel J, Margolick J, Cranston R, Jacobson L. Incidence and epidemiology of anal cancer in the multicenter AIDS cohort study. J Acquir Inmune Defic Syndr 2008; 48: 491-499.
- Scholefield JH, Sonnex C, Talbot IC, Palmer JG, Wathrup C, Mindel A, Northover JM. Anal and cervical intraepithelial neoplasia possible parallel. Lancet 1989; 2: 765-769.
- Daling JR, Madeleine M, Johnson L. Human Papillomavirus, smoking and sexual practices in the etiology of anal cáncer. Cancer 2004; 101: 270-280.
- Park I, Palefsky JM. Evaluation and management of anal intraepithelial neoplasia in HIV- negative and HIV+ positive men who have sex with men. Curr Infect Dis Rep 2010; 12: 126-133.
- Nadal S, Calore E, Manzione L, Couto S, Manzione C. Citología anal para rastreamento de lesiones pré-neoplásicas. Rev Assoc Med Bras 2007; 53: 147-151.
- Chin-Hong P, Berry M, Cheng S, Catania J, Da Costa M, Darragh T, Fishman F, Jay N, Pollack L, Palefsky J. Comparison of patient – and clinician – collected anal cytology samples to screen for human papillomavirus-associated anal intraepithelial neoplasia in men have sex with men. Ann Intern Med 2008; 149: 300-306.
- Richel O, Hallensleben N, Kreuter A, Van Noesel C, Prins J, De Vries H. Hight Resolution Anoscopy: Clinical features of anal intraephitelial neoplasia in HIV positive men. Dis Colon Rectum 2013; 56: 1237-1242.
- Aguiar C, Jaumandreu S, Alvarez C, Rodríguez M, Ortega C. Lesiones recto-anales internas por VPH, diagnóstico mediante PAP anal y anoscopía de alta resolución con biopsias, 1era serie en Uruguay. Rev Med Urug 2015; 31: 96-101.
- Moscicki A, Palefsky JM. HPV in men: an update. J Low Genit Tract Dis; 2011; 15: 231-234.
- Hessol N, Holly E, Efird J, Minkoff H, Schowalter K, Darragh T, Burk R, Strickler H, Greenblatt R, Palefsky J. Anal intraepithelial neoplasia in multisite of HIV-uninfected women. AIDS 2009; 23: 59-70.
- Heard I, Poizot-Martin I, Etienney I, Crenn-Hebert C, Moore C, Touraine P, Cubie H, Costagliola D. Prevalence and risks factors for anal oncogenic papillomavirus infections among HIV- infected women in France in the combination antiretroviral therapy era. JID 2016; 213: 1455-1461.
- Goldstone S, Moshier E. Detection of oncogenic human papillomavirus impacts anal screenings guidelines in men who have sex with men. Dis Colon Rectum 2010; 53: 1135-1142.
- Berry JM, Palefsky J, Jay N, Cheng SC, Darragh T, Ching-Hong PV. Performance characteristics of anal cytology and human papillomavirus testing in patients with high resolution anoscopy guided biopsy of high grade anal intraepithelial neoplasia. Dis Colon Rectum 2009; 53: 239-247.
- Sanjosé S, Palefsky JM. Cervical and anal HPV infections in HIV positive women and men. Virus Research 2002; 89: 201-221.
- Panther L, Wagner K, Proper J, Fugelso D, Chatis P, Weeden W, Nasser I, Doweiko J, Dezube B. High resolution anoscopy findings for men who have sex with men: inaccuracy of anal cytology as a predictor of histologic high grade intraepithelial neoplasia and the impact of HIV serostatus. CID 2004; 38: 1490-1492.
- Berry JM, Chrobak D, Jay N, Palefsky J. Who is ready to screen for anal squamous intraepithelial lesions and why should they perform high-resolution anoscopy? Sex Transm Dis 2014; 41: 254- 256.
- Hillman RJ, Cuming T, Darragh T, Nathan M, Berry M, Goldstone S, Law C, Palefsky J, Barroso L, Stier E, Bouchard C, Almada J and Jay N. 2016 IANS International guidelines for practice standards in the detection of anal cancer precursors. J Low Genit Tract Dis 2016; 20: 283-291.
- Berry M, Jay N, Cranston R, Darragh T, Holly E, Welton M, Palefsky J. Progression of anal high-grade squamous intraepithelial lesions to invasive anal cancer among HIV infected men who have sex with men. Int J Cancer 2014; 134: 1147-1155.
- Richel O de Vries HJ, van Noesel CJ, Dijkgraaf MG, Prins JM. Comparisson of imiquimod, topical fluorouracil and electrocautery for the treatment of anal intraepithelial neoplasia in HIV+ men who have sex with men: an open-label randomized controlled trial. Lancet Oncol 2013; 14: 273-274.
Acta Gastroenterol Latinoam 2018;48(3):206-212
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE