Melissa Jiménez-Morales, J Octavio Alonso-Lárraga, J Guillermo De La Mora-Levy, Julio C Sánchez-del Monte, María del Carmen Manzano-Robleda, Armando Alonso-Martínez, Flora M Oña-Ortiz, Mauro E Ramírez-Solís, Angélica Hernández-Guerrero
Departamento de Endoscopía Gastrointestinal, Instituto Nacional de Cancerología. Ciudad de México, México.
Acta Gastroenterol Latinoam 2019;49(1):44-53
Recibido: 22/01/2018 / Aprobado: 16/03/2018 / Publicado en www.actagastro.org el 18/03/2019
Resumen
Se ha estudiado la posibilidad de predecir de forma preoperatoria la respuesta patológica completa en el cáncer de recto con el fin de identificar a los pacientes que responderían a la neoadyuvancia e individualizar las estrategias terapéuticas. El ultrasonido endoscópico de recto es un método preciso para la evaluación de la invasión local tumoral y de los ganglios linfáticos. Objetivo. Evaluar el potencial del ultrasonido endoscópico como predictor de la respuesta patológica completa a la neoadyuvancia posterior a la cirugía en pacientes con cáncer de recto localmente avanzado. Material y métodos. Estudio retrospectivo de pacientes con cáncer de recto de enero 2014-diciembre 2016. Resultados. Obtuvimos una asociación estadística entre el estadio de la T por ultrasonido endoscópico y la respuesta patológica completa (p = 0,015). No así para la N, afectación de esfínteres, afectación circunferencial y grosor máximo del tumor (p = 0,723, p = 0,510, p = 0,233 y p = 0,114; respectivamente). Al aplicar el análisis de regresión logística multivariado para valorar el grado de influencia de las variables predictoras sobre la respuesta patológica, ninguna de estas variables se asoció con la respuesta patológica completa. Conclusión. La predicción de la respuesta patológica completa en el cáncer de recto se ha considerado como el punto crucial sobre el cual se podrían individualizar los tratamientos para el cáncer de recto. Hasta el momento ningún método de imagen ha logrado demostrar eficacia en la predicción de la respuesta patológica completa, y a su vez no hay una asociación directa entre algún hallazgo endosonográfico que la pueda predecir con exactitud.
Palabras claves. Respuesta patológica completa, cáncer de recto, ultrasonido endoscópico.
Endoscopic ultrasound and complete pathological response in rectal cancer
Summary
The possibility of preoperatively predict the complete pathological response in rectal cancer has been studied in order to identify patients who would respond to neoadjuvant and individualize therapeutic strategies. The endoscopic ultrasound of the rectum is an accurate method for the evaluation of the local invasion of the tumor and the lymph nodes. Aim. To evaluate the potential of endoscopic ultrasound as a predictor of the complete pathological response to neoadjuvant after surgery in patients with locally advanced rectal cancer. Material and methods. A retrospective study was realized in patients with rectal cancer from January 2014 to December 2016. Results. We obtained a statistical association between the stage of the T by endoscopic ultrasound and the complete pathological response (p = 0.015). Not so for N, sphincter involvement, circumferential involvement and maximum tumor thickness (p = 0.723, p = 0.510, p = 0.233 and p = 0.114, respectively). When applying the multivariate logistic regression analysis to assess the degree of influence of the predictor variables on the pathological response, none of these variables was associated with the complete pathological response. Conclusion. The prediction of the complete pathological response in rectal cancer has been considered as the crucial point on which treatments for rectal cancer could be individualized. So far, no imaging method has been able to demonstrate efficacy in predicting the complete pathological response, and in turn there is no direct association between an endosonography finding that can accurately predict it.
Key words. Complete pathological response, rectal cancer, endoscopic ultrasound.
Abreviaturas
QR: quimio-radioterapia.
ETM: escisión total del mesorrecto.
RPc: respuesta patológica completa.
ACE: antígeno carcinoembrionario.
USE: ultrasonido endoscópico.
TC: tomografía computarizada.
La terapia de elección para el cáncer de recto localmente avanzado no metastásico (estadio II/III de la American Joint Committee on Cancer) consiste en la terapia multimodal basada en quimio-radioterapia (QR) preoperatoria, escisión total del mesorrecto (ETM), y quimioterapia adyuvante.1-3
La respuesta patológica completa (RPc) a la QR neoadyuvante se ha asociado con reducción en la enfermedad a distancia, mejoría en el control local, recurrencias locales menores al 1% y supervivencia en más del 95% a 5 años, en comparación con pacientes sin RPc.4, 5
Se ha estudiado la posibilidad de predecir de forma preoperatoria la RPc mediante métodos clínicos, patológicos, radiológicos y moleculares.6-9 Con el fin de identificar a los pacientes que responderían a la neoadyuvancia, individualizar las estrategias terapéuticas, evitar cirugías radicales y estomas definitivos, conservando el recto, sin comprometer los resultados oncológicos de los pacientes.4, 10
Resultados de tres grupos han encontrado asociación entre el estadio clínico de la T (sistema de estadificación TNM) y la posibilidad de obtener RPc de 58% para T1, 28% para T2, 16% para T3 y 12% para T4.8 A su vez la RPc se ha asociado con una buena diferenciación tumoral, el diámetro tumoral pequeño, estadio temprano para T y N, tumores no circunferenciales, no ulcerados, y bajos niveles de antígeno carcinoembrionario (ACE) pretratamiento.6, 11, 12 Sin embargo, estos tienen baja sensibilidad y especificidad y otros estudios contradicen estos resultados.6
El ultrasonido endoscópico (USE) de recto es uno de los métodos más precisos para la evaluación de la invasión local del cáncer de recto y los ganglios linfáticos peri-rectales.13 Estudios comparativos muestran que la precisión del USE para el estadiaje de la T es del 80-95% (Figura 1) comparada con la tomografía computada (TC) (65-75%) y la RM (75-85%). Para la estadificación de los ganglios linfáticos es del 70-75% (Figura 2), en comparación con la TC (55-65%) y la RM (60-70%) (14). El USE se recomienda como un método de estadiaje preciso para la selección de lesiones tempranas apropiadas para resección endoscópica o resección transanal.13
La exactitud del estadiaje posterior a la radioterapia neoadyuvante disminuye significativamente debido al edema, necrosis y fibrosis causadas por la radioterapia, es por esto que la precisión diagnóstica del USE para la T disminuye a un 50% en el contexto post-radioterapia.15, 16 Ningún estudio de imagen ha demostrado ser el más preciso para re-estadificar posterior a la terapia preoperatoria y antes de la cirugía.17
No obstante, el uso del USE como predictor de la RPc no ha sido ampliamente evaluado. El estudio de Li y col. es el primero en proponer mediciones seriadas del USE y el grosor del tumor posterior a QR como predictores de la RPc, y a su vez de mejoría en la supervivencia.18
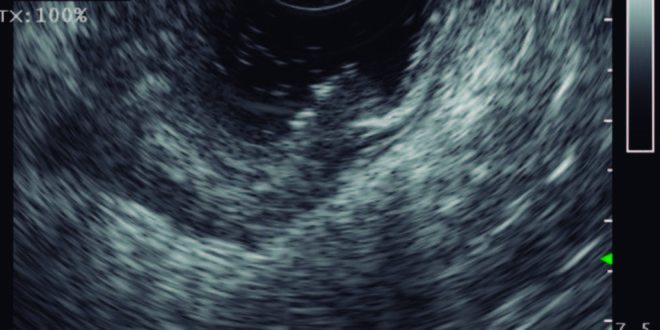
Figura 1. Valoración por ultrasonido endoscópico del tumor primario (T) según TNM en cáncer de recto. El tumor invade a través de la muscular propia el tejido peri-colorrectal (T3).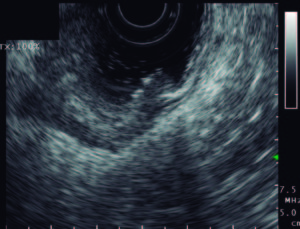
Figura 2. Valoración por ultrasonido endoscópico de las adenopatías regionales en tumores de recto.
Objetivo
Este estudio tiene como objetivo evaluar el potencial del ultrasonido endoscópico como predictor de la respuesta patológica completa a la neoadyuvancia posterior a la cirugía en pacientes con cáncer de recto localmente avanzado.
Material y métodos
Se realizó un estudio retrospectivo de pacientes con cáncer de recto registrados durante el período enero 2014-diciembre 2016 en el Instituto Nacional de Cancerología de México, obteniéndose la aprobación por el Comité de Ética de dicho Instituto.
Criterios de inclusión
Se incluyeron pacientes con cáncer de recto localmente avanzado (estadio II/III de la American Joint Committee on Cancer) confirmado por examen físico, radiografía de tórax, o TC, sin tratamiento previo. A los que se les realizó colonoscopía con confirmación histopatológica de adenocarcinoma, con localización del tumor inferior a la unión recto-sigmoidea o en los primeros 15 cm desde la línea pectínea.
Estadificados en el período pretratamiento con ultrasonido endoscópico de recto, que recibieron QR neoadyuvante, resección quirúrgica con ETM y estadiaje patológico posterior al tratamiento.
Criterios de exclusión
Los pacientes excluidos fueron aquellos con tumores estenosantes no franqueables por colonoscopía o ultrasonido endoscópico, con tumores irresecables o sincrónicos.
Se determinó el estadio pretratamiento mediante un ultrasonido endoscópico utilizando un ecoendoscopio radial Olympus GF-UE160 con frecuencias de 7,5-12 MHz, con el paciente en decúbito lateral izquierdo se realizó el rastreo desde la bifurcación de la aorta hasta la identificación de los esfínteres anales. Se describieron las siguientes variables: grosor máximo del tumor (> 10 y ≤ 10 mm), afectación de esfínteres, afectación circunferencial del tumor (> 50% y ≤ 50%) y el estadio clínico por USE de acuerdo a la clasificación TNM de la AJCC 7ª edición.
Se recolectaron datos demográficos, clínicos y patológicos de los pacientes, como edad, género, medición del antígeno carcinoembrionario (ACE) pretratamiento, con un valor de corte > 10 y ≤ 10 ng/ml. El tratamiento neoadyuvante fue un esquema largo de radioterapia de intensidad modulada, más quimioterapia concomitante.
El análisis de los especímenes patológicos se realizó por el Servicio de Patología y fue tomado del expediente electrónico. Se evaluó la calidad de la escisión del mesorrecto, el grado de resección quirúrgica del tumor, el estadio patológico (ypTNM) y el grado de respuesta patológica.
Clasificándose esta última de acuerdo al grado de regresión tumoral (GRT) de la AJCC 2010 (clasificación de Ryan modificada) en: GRT0, respuesta completa (sin células tumorales viables); GRT1, respuesta moderada (grupo pequeño de células tumorales o células individuales); GRT2, respuesta mínima (cáncer residual con fibrosis) y GRT3, respuesta pobre (con mínima o sin eliminación de células tumorales).
A su vez para el fin de este estudio la respuesta patológica se clasificó en el grupo con RPc (GRT0) y todos los demás sin respuesta o con respuesta variable como el grupo sin respuesta patológica completa (GRT1, GRT2, GRT3).19
Para este estudio se consideró afectación de esfínteres, cuando el tumor infiltra uno o ambos esfínteres del recto; afectación circunferencial del tumor, cuando existe compromiso circunferencial si el tumor se distribuye en más del 50% de la circunferencia del recto; grosor del tumor, a la máxima medida en milímetros de grosor de la pared del recto en el sitio del tumor; grado de resección quirúrgica, definiéndose como R1 si el margen de resección circunferencial es positiva por neoplasia, o si el margen de resección está a menos de 1 mm y R0 si el margen de resección circunferencial es negativo por neoplasia;4 respuesta patológica completa (RPc), la ausencia de células de adenocarcinoma en la pared del recto ni en nódulos linfáticos regionales (ypT0N0M0), clasificada como GRT0;20, 4 sin respuesta patológica completa, a la ausencia de respuesta patológica completa o grado variable de respuesta (GRT1, GRT2, GRT3).
Análisis estadístico
Las posibles diferencias entre los pacientes que tuvieron RPc vs aquellos que no tuvieron RPc en variables clínico-patológicas se evaluaron con la prueba chi cuadrado. Se realizó análisis de regresión logística para la predicción de la RPc. Para el análisis estadístico se empleó el programa Stata/MP 13.0 (Stata, College Station, TX), considerando significativos los valores de p < 0,05.
Las diferencias entre los grupos se evaluaron con la prueba chi cuadrado. Se realizó análisis de regresión logística para la predicción de la variable dependiente. El valor de p <0,05 fue considerado estadísticamente significativo. Se utilizó el programa Stata/MP 13.0 (Stata, College Station, TX) para el análisis estadístico.
Resultados
Se incluyó a 78 pacientes, los cuales cumplieron con los criterios de inclusión establecidos. A todos se les realizó USE rectal, recibieron QR neoadyuvante, resección quirúrgica más ETM, y estadificación patológica postoperatoria.
Los pacientes incluidos recibieron radioterapia de intensidad modulada a dosis de 50,4 Gy en 28 fracciones. El régimen de quimioterapia concomitante utilizado fue capecitabina 2,5g/m2 día 1-14 cada 3 semanas por 4 ciclos en un 87,2% de los pacientes, y capecitabina más oxaliplatino en 12,8%.
Las características demográficas de los pacientes y las variables asociadas a la RPc se muestran en la Tabla 1.
Tabla 1. Características basales de los pacientes y variables asociadas con la RPc (n = 78).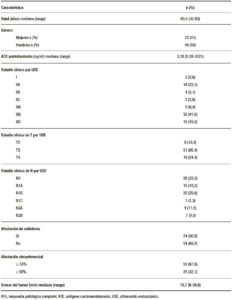
Las mujeres (n = 32) corresponden a un 41,0%, y un 59,0% (n = 46) a hombres, con una mediana de edad de 60,5 años (rango: 32-83). ACE pretratamiento con una mediana de 3,28 ng/ml (rango: 0,39-3321). Los estadios clínicos obtenidos según ecoendoscopía fueron los estadios I al IIIC. Por hallazgos endosonográficos en cuanto a la valoración tumoral de la pared del recto un 10,3% (n = 8) corresponden a T2, 65,4% a T3 (n = 51), y 24,4% a T4 (n = 19). Para el estadiaje linfático un 33,3% (n = 26) corresponden a N0, y con presencia de nódulos linfáticos en 66,7% (n = 52). Afección de esfínteres en 30,7% (n = 24), compromiso circunferencial del recto por el tumor en > 50% del lumen en 67,9% de los casos (n = 53). Con respecto a la medición del grosor máximo del tumor este se valoró en 56 de los 78 pacientes. La mediana del grosor máximo del tumor fue de 15,7 mm (rango: 8-34.,6), para este se estableció un corte de > 10 mm y ≤ 10 mm de acuerdo a la distribución de los datos. En cuanto a los resultados histopatológicos posteriores a neoadyuvancia y cirugía (Tabla 2) se estadificaron como T0 16,7% (n = 13), Tis 2,6% (n = 2), T1 10,2% (n = 8), T2 30,7% (n = 24), T3 33% (n = 26) y T4 6,4% (n = 5). Para el estadiaje patológico de nódulos linfáticos, N0 70,5% (n = 55), y agrupando todos los estadios con presencia de adenopatías positivas por malignidad un 29,5% (n = 23). Para el grado de resección R0 la tasa fue de 92,3% (n = 72) y R1 de 7,7% (n = 6). En un 80,8% (n = 63) se realizó ETM, y en un 19,2% (n = 15) la escisión del mesorrecto fue incompleta. Finalmente, la RPc (GRT0) obtenida fue de 16,7% (n = 13), y al agrupar las respuestas moderada, mínima y sin respuesta (GRT1, GRT2 y GRT3) la tasa fue de 83,3% (n = 65).Dentro del grupo de los pacientes con RPc 30,7% correspondieron a T2 (n = 4), 38,5% a T3 (n = 5) y 30,7% a T4 (n = 4). Para el grupo sin RPc encontramos que el estadio T2 fue de 6,1% (n = 4), T3 70,8% (n = 46) y T4 23,1% (n = 15).
De acuerdo con el objetivo del estudio que es evaluar el potencial del ultrasonido endoscópico como predictor de la RPc, al realizar el análisis de los factores que determinamos como posibles predictores mediante la prueba chi cuadrado obtuvimos una asociación estadística entre el estadio de la T por USE y la RPc (p = 0,015). No así para la N por USE, afectación de esfínteres, afectación circunferencial y grosor máximo del tumor (p = 0,723, p = 0,510, p = 0,233 y p = 0,114; respectivamente) (Tabla 3).
Tabla 2. Resultados histopatológicos posteriores al tratamiento (n = 78).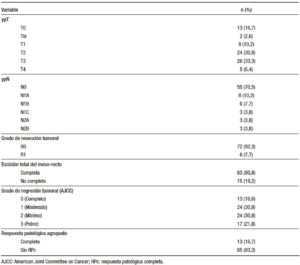
Tabla 3. Predictores de RPc posterior a QR neoadyuvante y cirugía (n = 78).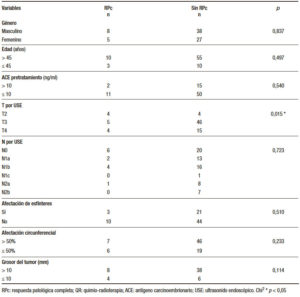
A su vez al aplicar el análisis de regresión logística multivariado para valorar el grado de influencia de las variables predictoras sobre la respuesta patológica, ninguna de estas variables se asoció con la RPc (Tabla 4).
Tabla 4. Predictores multivariables de la RPc.
Discusión
En nuestro estudio documentamos una tasa de respuesta patológica completa de 16,7%, lo cual concuerda con los reportes de la literatura del 10 al 20%.4, 6, 21 En el análisis estadístico univariado encontramos una asociación entre el estadio de la T por USE con la RPc, no así con los otros probables predictores (afectación de esfínteres, afectación circunferencial del tumor, grosor del tumor). Sin embargo, en el análisis de regresión logística ningún valor de p obtenido fue estadísticamente significativo. Por lo tanto, podemos decir que no existe una relación directa entre alguna medición del ultrasonido endoscópico en el período pretratamiento con la predicción de la RPc, y la identificación de los pacientes que obtendrían una RPc antes del tratamiento no la podemos establecer de forma contundente.
En el estudio de Ning Li y col. realizaron mediciones secuenciales del diámetro mayor tumoral mediante ultrasonido endoscópico en 41 pacientes con cáncer de recto estadio II y III, previo al inicio del tratamiento neoadyuvante, 2 semanas posteriores a su inicio, y de 6 a 8 semanas posterior al término de la quimio-radioterapia. Ellos encontraron una correlación entre la medida del grosor máximo posterior al tratamiento y del radio de la medición posterior a la QR neoadyuvante con el diámetro pretratamiento, con la RPc y el grado de regresión tumoral (p = 0,001 y p = 0,026, respectivamente).
A pesar de que estudios previos han sugerido que la exactitud y utilidad del USE en el re-estadiaje del cáncer de recto se ve comprometida por el edema y fibrosis que el tratamiento neoadyuvante ocasiona, estos resultados sugieren que la correlación de la medición por ultrasonido endoscópico posterior y pretratamiento, además de la medición máxima del grosor tumoral en el período posterior a la neoadyuvancia pudieran predecir la sensibilidad terapéutica del cáncer de recto.18 Cabe mencionar que además del tamaño de la muestra, el hecho de tener solamente una medición pretratamiento puede afectar los resultados obtenidos en nuestro estudio.
Distintos factores influyen en la respuesta patológica a la neoadyuvancia, desde la distinta sensibilidad a la quimio-radioterapia por la naturaleza individual del tumor, el tiempo entre el término de la neoadyuvancia a la resección quirúrgica, entre otros.9, 22, 23
Múltiples estudios prospectivos no controlados reportan que la tasa de recurrencia local y supervivencia general en pacientes con RPc sometidos a procedimientos quirúrgicos sin ETM es similar a las de aquellos a los que sí se les realizó ETM.10, 24
Dado los buenos resultados oncológicos de los pacientes con respuesta patológica completa los esfuerzos por identificar este grupo se han convertido en un reto.
El mayor obstáculo es que dicha respuesta solo puede ser evaluada con la pieza quirúrgica. La predicción clínica de la respuesta patológica permitiría una selección de los pacientes en los cuales la cirugía y la ETM podría evitarse.3, 25
Conclusión
La predicción de la respuesta patológica completa en el cáncer de recto localmente avanzado es un reto que continúa bajo investigación, ya que este tema se ha considerado como el punto crucial sobre el cual se podrían dirigir de forma personalizada los tratamientos para el cáncer de recto localmente avanzado. Hasta el momento ningún método de imagen ha logrado demostrar eficacia en la predicción de la respuesta patológica completa, y a su vez no hay una asociación directa entre algún hallazgo endosonográfico que pueda predecirla con exactitud.21
Las respuestas variables entre los tumores a la quimio-radioterapia neoadyuvante sugieren una compleja relación con la biología del tumor, debido probablemente a diversas vías moleculares que regulan la sensibilidad a la quimio-radioterapia.6
Contribuciones de los autores
Todos los autores contribuyeron de forma sustancial para la realización de este manuscrito.Todos ellos han participado en el diseño del estudio, la redacción del manuscrito y su discusión. Todos los autores leyeron y aprobaron el texto final. La presente investigación no ha recibido becas específicas provenientes de agencias del sector público, sector comercial o sin ánimo de lucro.
Referencias
- Sauer R, Becker H, Hohenberger W, Rödel C, Wittekind C, Fietkau R, Martus P, Tschmelitsch J, Hager E, Hess CF, Karstens JH, Liersch T, Schmidberger H, Raab R, German Rectal Cancer Study Group. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351: 1731-1740.
- Berardi R, Maccaroni E, Onofri A, Morgese F, Torniai M, Tiberi M, Ferrini C, Cascinu S. Locally advanced rectal cancer: the importance of a multidisciplinary approach. World J Gastroenterol 2014; 20: 17279-17287.
- Moaven J, Shami VM. Predicting pathologic response: the «bottom line» in the management of locally advanced rectal cancer. Gastrointest Endosc 2017; 85: 675-676.
- Garland ML, Vather R, Bunkley N, Pearse M, Bissett IP. Clinical tumour size and nodal status predict pathologic complete response following neoadjuvant chemoradiotherapy for rectal cancer. Int J Colorectal Dis 2014; 29: 301-307.
- Smith JJ, Garcia-Aguilar J. Advances and challenges in treatment of locally advanced rectal cancer. J Clin Oncol 2015; 33: 1797- 1808.
- Ryan JE, Warrier SK, Lynch AC, Ramsay RG, Phillips WA, Heriot AG. Predicting pathological complete response to neoadjuvant chemoradiotherapy in locally advanced rectal cancer: a systematic review. Colorectal Dis 2016; 18: 234-246.
- Russo AL, Ryan DP, Borger DR, Wo JY, Szymonifka J, Liang WY, Kwak EL, Blaszkowsky LS, Clark JW, Allen JN, Zhu AX, Berger DL, Cusack JC, Mamon HJ, Haigis KM, Hong TS. Mutational and clinical predictors of pathologic complete response in the treatment of locally advanced rectal cancer. J Gastrointest Cancer 2014; 45: 34-39.
- Yoo BC, Yeo SG. Clinical utility of pretreatment prediction of chemoradiotherapy response in rectal cancer: a review. EPMA J 2017; 8: 61-67.
- Pérez RO. Predicting response to neoadjuvant treatment for rectal cancer: a step toward individualized medicine. Dis Colon Rectum 2011; 54: 1057-1058.
- Habr-Gama A, Pérez RO, São Julião GP, Proscurshim I, Gama- Rodrigues J. Nonoperative approaches to rectal cancer: a critical evaluation. Semin Radiat Oncol 2011; 21: 234-239.
- Qiu HZ, Wu B, Xiao Y, Lin GL. Combination of differentiation and T stage can predict unresponsiveness to neoadjuvant therapy for rectal cancer. Colorectal Dis 2011; 13: 1353-1360.
- Huh JW, Kim HR, Kim YJ. Clinical prediction of pathological complete response after preoperative chemo radiotherapy for rectal cancer. Dis Colon Rectum 2013; 56: 698-703.
- Cârţânå ET, Gheonea DI, Såftoiu A. Advances in endoscopic ultrasound imaging of colorectal diseases. World J Gastroenterol 2016; 22: 1756-1766.
- Siddiqui AA, Fayiga Y, Huerta S. The role of endoscopic ultrasound in the evaluation of rectal cancer. Int Semin Surg Oncol 2006; 3: 36.
- Marone P, de Bellis M, Avallone A, Delrio P, di Nardo G, D’Angelo V, Tatangelo F, Pecori B, Di Girolamo E, Iaffaioli V, Lastoria S, Battista Rossi G. Accuracy of endoscopic ultrasound in staging and restaging patients with locally advanced rectal cancer undergoing neoadjuvant chemoradiation. Clin Res Hepatol Gastroenterol 2011; 35: 666-670.
- Vanagunas A, Lin DE, Stryker SJ. Accuracy of endoscopic ultrasound for restaging rectal cancer following neoadjuvant chemo-radiation therapy. Am J Gastroenterol 2004; 99: 109-112.
- de Jong EA, ten Berge JC, Dwarkasing RS, Rijkers AP, van Eijck CH. The accuracy of MRI, endorectal ultrasonography, and computed tomography in predicting the response of locally advanced rectal cancer after preoperative therapy: A metaanalysis. Surgery 2016; 159: 688-699.
- Li N, Dou L, Zhang Y, Jin J, Wang G, Xiao Q, Li Y, Wang X, Ren H, Fang H, Wang W, Wang S, Liu Y, Song Y. Use of sequential endorectal US to predict the tumor response of preoperative chemoradiotherapy in rectal cancer. Gastrointest Endosc 2017; 85: 669-674.
- Kim SH, Chang HJ, Kim DY, Park JW, Baek JY, Kim SY, Park SC, Oh JH, Yu A, Nam BH. What is the ideal tumor regression grading system in rectal cancer patients after preoperative chemoradiotherapy? Cancer Res Treat 2016; 48: 998-1009.
- Martin ST, Heneghan HM, Winter DC. Systematic review and meta-analysis of outcomes following pathological complete response to neoadjuvant chemo radiotherapy for rectal cancer. Br J Surg 2012; 99: 918-928.
- Kawai K, Ishihara S, Nozawa H, Hata K, Kiyomatsu T, Morikawa T, Fukayama M, Watanabe T. Prediction of pathological complete response using endoscopic findings and outcomes of patients who underwent watchful waiting after chemoradiotherapy for rectal cancer. Dis Colon Rectum 2017; 60: 368-375.
- São Julião GP, Habr-Gama A, Vailati BB, Araujo SEA, Fernández LM, Perez RO. New strategies in rectal cancer. Surg Clin North Am 2017; 97: 587-604.
- Pérez RO, Habr-Gama A, São Julião GP, Vailati BB, Fernández LM, Gama-Rodrigues J, Camargo AA. Should we give up the search for a clinically useful gene signature for the prediction of response of rectal cancer to neoadjuvant chemo-radiation? Dis Colon Rectum 2016; 59: 895-897.
- Habr-Gama A, Sabbaga J, Gama-Rodrigues J, São Julião GP, Proscurshim I, Bailão Aguilar P, Nadalin W, Pérez RO. Watch and wait approach following extended neoadjuvant chemoradiation for distal rectal cancer: are we getting closer to anal cancer management? Dis Colon Rectum 2013; 56: 1109-1117.
- Heald RJ, Beets G, Carvalho C. Report from a consensus meeting: response to chemoradiotherapy in rectal cancer – predictor of cure and a crucial new choice for the patient: on behalf of the Champalimaud 2014 Faculty for ‘Rectal cancer: when NOT to operate’. Colorectal Dis 2014; 16: 334-337.
Correspondencia: Melissa Jiménez-Morales
Av. Sagrada Familia 359. Córdoba, Argentina
Tel.: +52 15534919132
Correo electrónico: melijm@gmail.com
Acta Gastroenterol Latinoam 2019;49(1): 44-53
Calzada de Tlalpan 4456. Ciudad de México, México
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE