Ofelia Castillo Contreras,1 Jorge L Maguiña Quispe,2 Bryan Medina Morales,1 Héctor Malaverry Lozano3
1 Departamento de Aparato Digestivo del Hospital Nacional Edgardo Rebagliati Martins, EsSalud.
2 Escuela de Medicina, Universidad Peruana de Ciencias Aplicadas.
3 Departamento de Ginecología y Obstetricia del Hospital Nacional Edgardo Rebagliati Martins, EsSalud.
Lima, Perú.
Acta Gastroenterol Latinoam 2017;47(4):288-296
Recibido: 31/01/2017 / Aprobado: 23/03/2017 / Publicado en www.actagastro.org el 18/12/2017
Resumen
Existen estudios que encontraron mayor prevalencia de anticuerpos contra Helicobacter pylori (Hp) en gestantes con hiperémesis gravídica, en comparación con mujeres embarazadas asintomáticas. Objetivos. Determinar la relación entre la seropositividad a Hp y la presencia de náusea y vómitos durante las primeras 20 semanas del embarazo en gestantes de una red hospitalaria, entre marzo y diciembre de 2015. Material y métodos. Estudio de casos y controles no pareado en gestantes hasta las 20 semanas de embarazo. El índice de Rhodes para náusea y vómitos clasificó a las gestantes en casos (9-40 puntos) y en controles (8 puntos). La seropositividad a Hp fue definida como IgG ≥ 1,1 U/mL. La asociación entre Hp y náusea y vómitos del embarazo se determinó con el análisis de regresión logística, controlando por edad, paridad, edad gestacional y nivel socioeconómico. Resultados. Un total de 108 pacientes fueron incluidas, 21 controles y 87 casos. No hubo diferencias significativas en edad (p = 0,916), paridad (p = 0,18) y nivel socioeconómico (p = 0,36). La seropositividad a Hp en los casos fue 78,2% (68/87) y en los controles 61,9% (13/21). En el análisis de regresión logística, los casos presentaron mayor riesgo de seropositividad a Hp que los controles (OR = 3,05; IC 95%: 0,92-10,1; p = 0,068), pero no fue significativa. Conclusiones. Las pacientes con náusea y vómitos en las primeras 20 semanas de gestación tuvieron un mayor riesgo de haber estado expuestas a Hp, aunque esta relación no fue significativa debido al pequeño tamaño de muestra.
Palabras claves. Helicobacter pylori, náusea, vómitos, embarazo, pruebas serológicas.
Helicobacter pylori seropositivity and its relationship with nausea and vomiting during the first 20 weeks of pregnancy
Summary
There are studies that found a higher prevalence of antibodies against Helicobacter pylori (Hp) in patients with hyperemesis gravidarum, compared to asymptomatic pregnant women. Objective. To determine the relationship between seropositivity to Hp and the presence of nausea and vomiting during the first 20 weeks of gestation in pregnant women of a hospital network, from March to December 2015. Material and methods. Unmatched case-control studies in pregnant women until 20 weeks of gestation. The Rhodes’ index for nausea and vomiting classified pregnant women in cases (9-40 points) and controls (8 points). Hp seropositivity was defined as IgG ≥ 1.1 U/mL. The association between Hp and nausea and vomiting of pregnancy was determined by logistic regression analysis controlling for age, parity, gestational age and socioeconomic status. Results. A total of 108 patients were included, 21 controls and 87 cases. There were no significant differences in age (p = 0.916), parity (p = 0.18) and socioeconomic status (p = 0.36). Hp seropositivity in cases was 78.2% (68/87) and controls 61.9% (13/21). In the logistic regression analysis, cases had higher risk of Hp seropositivity than controls (OR = 3.05; 95% CI: 0.92-10.1; p = 0.068), but was not significant. Conclusions. Patients with nausea and vomiting in the first 20 weeks of gestation had a higher risk of having been exposed to Hp, although this relationship was not significant due to the small sample size.
Key words. Helicobacter pylori, nausea, vomiting, pregnancy, serologic tests.
Abreviaturas
Hp: Helicobacter pylori.
NVE: náusea y vómitos del embarazo.
La infección por Helicobacter pylori (Hp) tiene un rol en el desarrollo de la gastritis crónica, úlcera péptica y es un importante factor de riesgo para el desarrollo del cáncer gástrico.1 La prevalencia de Hp se encuentra entre 10% a 30% en países desarrollados y hasta 80% a 90% en países en vías de desarrollo.2 La infección aguda por Hp causa gastritis aguda con dolor abdominal y náusea, y puede progresar a una gastritis crónica con dolor y distensión abdominal, náusea, reflujo y algunas veces vómitos; sin embargo, la mayoría de las infecciones son asintomáticas.3
La náusea y los vómitos del embarazo (NVE) son comunes en Occidente y poblaciones urbanas,4 ocurren entre el 45% a 90% de las gestantes, y la manifestación severa de este desorden, conocida como hiperémesis gravídica, ocurre en el 0,3 al 2% de las gestantes.4, 5 En la mayoría de los casos, los síntomas de NVE ceden entre las 16 a 20 semanas, pero en algunas pacientes persiste luego de las 20 semanas.4, 6 Algunos estudios señalan una relación entre la infección por Hp y varios desórdenes de la gestación como la hiperémesis gravídica.7 Existen estudios que encontraron una mayor prevalencia de anticuerpos contra Hp en pacientes con hiperémesis gravídica, en comparación con mujeres embarazadas asintomáticas.8-12 Un estudio en Puerto Rico encontró una asociación significativa entre IgG anti-Hp y dispepsia matinal en gestantes entre la sexta y decimosexta semana del embarazo; el 89% de las gestantes eran seropositivas a Hp.13 Por el contrario, Bromberg y col.,14 en 146 gestantes brasileñas entre 10 y 23 semanas de embarazo; encontró una seropositividad a Hp de 65,7%, pero no tuvo asociación significativa con los síntomas dispépticos de la gestación.
Estudios epidemiológicos de Hp en gestantes sintomáticas de Chile15 y en gestantes de una población rural asintomática en México16 reportaron prevalencias de 68,6% y 52,2%, respectivamente, con métodos de InmunoComb II y ELISA para determinación de anticuerpos IgG. En Lima, nosotros hemos encontrado en mujeres en edad fértil que acudieron a consultorio externo de la Red Asistencial Rebagliati del Seguro Social del Perú (EsSalud) una prevalencia de Hp de 51,1% con la prueba en aliento con urea-13 C.17 Para nuestro conocimiento, aún no existen estudios publicados de prevalencia de Hp en gestantes y su relación con NVE en nuestro medio, por lo que realizamos la presente investigación.
Material y métodos
Diseño y lugar del estudio
El presente es un estudio prospectivo de casos y controles no pareado realizado en establecimientos de la Red Asistencial Rebagliati de EsSalud en Lima, Perú: Policlínicos Chincha, Pablo Bermúdez, Suárez-Angamos, Hospital Uldarico Roca y Hospital Nacional Edgardo Rebagliati Martins (HNERM). Estos establecimientos fueron seleccionados por tener las mayores atenciones prenatales obstétricas durante el año 2014 (421 atenciones en promedio por mes) y por su cercanía al hospital de referencia. El HNERM es un establecimiento de tercer nivel que actualmente atiende a más de un millón y medio de asegurados y es centro de referencia de la red hospitalaria.
Población del estudio y muestra
Participaron gestantes que acudían a sus controles prenatales. Las pacientes fueron invitadas a participar entre marzo y diciembre de 2015. Fueron elegibles las gestantes mayores de 18 años de edad con diagnóstico de embarazo por serología o ecografía obstétrica. Se excluyeron aquellas que manifestaron diagnóstico de infección reciente por Hp y/o recibieran tratamiento erradicador previo al estudio.
Otros criterios de exclusión fueron: edad gestacional mayor de 20 semanas, infección urinaria concurrente (confirmado con urocultivo) y embarazo gemelar.
Definición de casos y controles
Los casos fueron aquellas gestantes que presentaron síntomas de NVE con un índice de Rhodes18 desde 9 hasta 40 puntos. Los controles fueron las gestantes asintomáticas o con un índice de Rhodes igual a 8 puntos. Ambos grupos fueron seleccionados por muestreo aleatorio simple de las atenciones ambulatorias obstétricas en los establecimientos ya señalados.
Procedimientos del estudio
Las pacientes fueron captadas en el consultorio de obstetricia de los establecimientos. Las gestantes elegibles que acudían a sus controles prenatales, durante los días seleccionados para la recolección de los datos, fueron incluidas en el estudio. Se les explicó el propósito del estudio y, si aceptaban participar, firmaban el consentimiento informado, se les administraban los cuestionarios por el mismo entrevistador y se procedía a la toma de muestras sanguíneas.
Los datos sociodemográficos se recolectaron a través de un cuestionario que incluyó variables como edad de la gestante (años), edad gestacional (semanas), paridad (número de niños nacidos vivos), lugar de residencia y nivel socioeconómico, que se estableció según categorías de la versión modificada 2011-2012 APEIM (Asociación Peruana de Empresas de Investigación de Mercado).19 La valoración del nivel socioeconómico estuvo compuesta por preguntas sobre el nivel de instrucción de ambos padres, material del piso de la vivienda, número de dormitorios y número de personas que viven en el hogar, salario mensual de la familia y atención médica en el sistema de salud.19
Se utilizó el índice de Rhodes (formato INV-2), que es un instrumento de 8 ítems que miden la duración e intensidad de náusea, vómitos y regurgitación de las últimas 12 horas en una escala del 1 al 5 (1 = no síntomas y 5 = síntomas severos),18 con un puntaje mínimo de 8 puntos (ausencia de síntomas) y máximo de 40 puntos (síntomas severos). La traducción del inglés al español del índice de Rhodes (INV-2) fue evaluada por juicio de expertos (3 médicos ginecoobstetras del HNERM) y se hizo una prueba piloto en 10 gestantes para asegurar la comprensión y secuencia de las preguntas.
Las muestras sanguíneas fueron recolectadas por un técnico de laboratorio en tubos BD Vacuteiner® SST™ II Advanced de 5 mL, luego fueron centrifugadas a 3500 rpm durante 7 minutos y procesadas inmediatamente con analizadores INMULITE® 2000 Helicobacter pylori IgG (Siemens, Llanberis, United Kingdom) según las instrucciones del fabricante. Se realizó la medición cualitativa de anticuerpos IgG para Hp en el suero de gestantes, expresadas en unidades por mililitro (U/mL). La prueba es un ensayo inmunométrico quimioluminiscente en fase sólida con sensibilidad de 95,6% (IC 95%: 89,6-100%) y especificidad de 89,4% (IC 95%: 80,6-98,2%).20
Análisis estadístico
Los datos se ingresaron en una base de datos Excel 2010 (Microsoft Office para Windows XP) y se analizaron con el paquete estadístico STATA versión14.0 (STATA Corp. LP, College Station, TX, USA).
El nivel socioeconómico se estableció según el puntaje total obtenido en la escala validada de APEIM versión 2011-201219 en cinco categorías: A (33 puntos o más), B (27-32 puntos), C (21-26 puntos), D (13-20 puntos) y E (5-12 puntos).
El índice de Rhodes clasificó a los casos (> 8 puntos) según la severidad de los síntomas:21 leve (9-18 puntos), moderada (19-32 puntos) y severa (33-40 puntos).
Los resultados de la serología fueron expresados cualitativamente con rangos de reactivo (≥ 1,1 U/mL), no reactivo (< 0,9 U/mL) e indeterminado (≥ 0,9-1,09 U/ mL). En el análisis de regresión logística se consideraron a los indeterminados en dos escenarios como positivos y negativos, evaluando el efecto en el resultado final. Para el propósito del estudio se muestran los resultados como positivo si la serología es ≥ 1,1 U/mL o negativo si es < 1,1 U/mL.
Las pruebas estadísticas comprendieron una descripción de las características demográficas y clínicas de los casos y controles mediante medidas de tendencia central y de dispersión. La asociación entre las variables categóricas según grupos se evaluó usando Chi2 y prueba exacta de Fisher; y para las variables cuantitativas una prueba de T-Student o U de Mann-Whitney, según correspondiera. Se calculó la fuerza de asociación entre el índice de Rhodes y la seropositividad a Hp usando un análisis de regresión logística crudo y ajustado con un intervalo de confianza de 95%. Se consideró como posibles confusores la edad, la paridad, la edad gestacional y el nivel socioeconómico. Además, se hizo un análisis de sensibilidad para considerar la potencial clasificación errónea del resultado serológico debido a la sensibilidad y especificidad de la prueba por debajo de 100%.
Consideraciones éticas
Se respetaron los principios éticos de la Declaración de Helsinki. El proyecto fue aprobado por el Comité de Ética del HNERM y se obtuvo el consentimiento informado de las participantes, con respeto a la confidencialidad de la información. El proyecto de investigación fue financiado por EsSalud, por lo que las pruebas serológicas de Hp fueron gratuitas para las gestantes.
El resultado de la serología fue comunicado a cada participante a través de correos electrónicos y llamadas telefónicas. En caso que el resultado fuera positivo se recomendaba la confirmación de la infección por Hp con una prueba diagnóstica que determinara infección activa y el tratamiento en el seguro social (EsSalud), preferentemente luego del embarazo.
Resultados
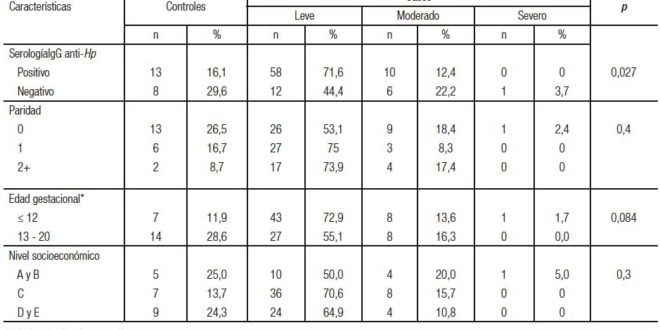
Un total de 110 participantes fueron elegibles para el estudio. Sin embargo, dos de ellas fueron excluidas, una debido a que fue dada de alta antes de la toma de muestra sanguínea y otra porque rechazó participar del estudio. Ciento ocho pacientes (87 casos y 21 controles) fueron incluidas entre marzo y diciembre de 2015. Las características de las participantes (casos y controles) se muestran en la Tabla 1. La mediana de edad de las participantes en los casos fue de 29 años (rango intercuartil (RIC): 26-34) y en el grupo control fue de 28 años (RIC: 25-35) (p = 0,916). El promedio de la edad gestacional (EG) en los casos fue 11,3 semanas y en el grupo control fue 13,5 semanas (p = 0,022). El porcentaje de casos que se encontraban en las primeras 12 semanas de EG fue 59,8% (52/87), mientras que en los controles fue 33,3% (7/21) (p = 0,029). No hubo diferencias significativas entre casos y controles respecto de la edad, paridad y nivel socioeconómico.
Tabla 1. Características sociodemográficas y clínicas de las gestantes del grupo casos y controles de la Red Rebagliati (EsSalud), marzo-diciembre de 2015.
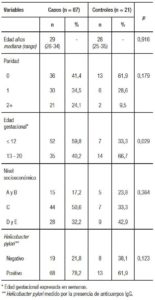
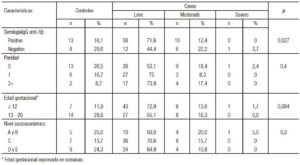
De acuerdo con la severidad de los síntomas, los casos en grado leve fueron 64,1% (70/108), moderado en 14,8% (16/108) y severo en 0,93% (1/108). Se encontró diferencia estadística entre los grupos de severidad de NVE y el resultado positivo a Hp (p = 0,027) (Tabla 2). Hubo mayor seropositividad a Hp entre los casos con un porcentaje de 78,2% (68/87), en relación con los controles que fueron el 61,9% (13/21), pero sin significancia estadística (p = 0,123).
Tabla 2 Clasificación de las gestantes según el grado de severidad del índice de Rhodes y su relación con las características de las participantes en la Red Rebagliati (EsSalud), marzo-diciembre de 2015.
En la Tabla 3 se observa la asociación entre la seropositividad a Hp y los síntomas de NVE en cualquier grado de severidad, además de otros factores asociados. En el análisis de regresión logística, considerando el resultado indeterminado como negativo se obtuvo un odds ratio (OR) crudo para la asociación de Hp y NVE de 2,20 (IC 95%: 0,80-6,09; p = 0,128). Si el resultado indeterminado se consideraba como positivo, se encontró que la asociación entre seropositividad a Hp y NVE obtuvo un OR de 2,84 (IC 95%: 0,85-9,52; p = 0,09). Se muestran los datos de la Tabla 3, se consideró a las tres gestantes con resultado indeterminado (un control y dos casos) como serología negativa.
Tabla 3. Asociación entre náusea y vómitos del embarazo y características de las gestantes hasta las 20 semanas de edad gestacional en la Red Rebagliati (EsSalud), marzo-diciembre de 2015.
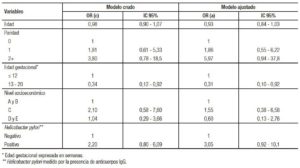
El análisis crudo y ajustado muestra a la edad gestacional mayor a 12 semanas como factor protector de NVE (OR = 0,31; IC 95%: 0,10-0,92; p = 0,034). El análisis de sensibilidad de la asociación de Hp y NVE considerando una posible clasificación errónea de la prueba proporcionó un odds ratio crudo de 2,04 (IC 95%: 0,8-5,5) (Anexo).
Anexo. Cálculo del efecto crudo de Helicobacter pylori en náusea y vómitos ajustado para clasificación errónea de la exposición de Hp. Datos observados: OR = 2,20 [0,80-6,09]
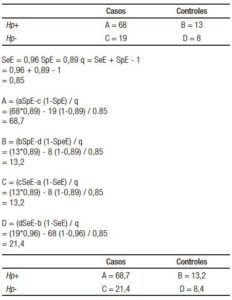
El valor ajustado para los casos que estuvieron expuestos es 68,7 en lugar de 68, para los controles expuestos es 13,2 en lugar de 13, para los casos no expuestos es 21,4 en lugar de 19 y para los controles no expuestos es 8,4 en lugar de 8. Esto resulta en un OR ajustado para un error de clasificación de Hp debido a la prueba imperfecta de: 2,04 (IC 95%; 0,8-5,5) en lugar del 2,20 (0,80-6,09).
Discusión
La prevalencia de Hp es alta en países en vías de desarrollo y está inversamente relacionada con el nivel socioeconómico.2 Frigo y col. fueron los primeros en demostrar una relación entre Hp e hiperémesis gravídica.8 Posteriormente, otros autores han demostrado diferencias en la seroprevalencia de Hp entre gestantes asintomáticas y con hiperémesis gravídica.10-12, 22, 23 Por otro lado, algunos estudios no encontraron esta relación entre seropositividad a Hp e hiperémesis gravídica en regiones con alta prevalencia de Hp.24, 25 Jacobson y col. no hallaron dicha asociación en un estudio que comparó dos poblaciones de gestantes con distintas seroprevalencias de Hp.26
Revisiones sistemáticas en Canadá (2007) y Noruega (2009) encontraron asociación significativa entre Hp e hiperémesis gravídica.5, 27 Un meta-análisis que incluyó 29 estudios de casos y controles y 3 transversales28 encontró asociación en 19 de ellos y en 13 no, y concluyeron que la exposición a Hp estuvo asociada con mayor riesgo de hiperémesis gravídica (OR = 3,34; IC 95%: 2,32-4,81; p < 0,001), especialmente en África. Nuestros resultados muestran que la seropositividad a Hp es elevada en las gestantes atendidas en la Red Asistencial Rebagliati comparada con las seroprevalencias en gestantes reportadas en otros países latinoamericanos.15, 16 A pesar de la alta prevalencia de Hp en países en vías de desarrollo, no se han reportado altos porcentajes de hiperémesis gravídica.29
Nosotros realizamos el estudio en gestantes con síntomas de NVE, ya que a diferencia de la hiperémesis gravídica, estos son muy comunes en el embarazo, disminuyen la calidad de vida e incrementan los costos de salud y el ausentismo laboral.4 Además se incluyeron pacientes en las primeras 20 semanas de gestación para diferenciar NVE del reflujo gastroesofágico que aparece al final del segundo trimestre y que persiste hasta el parto.6 Encontramos un mayor porcentaje de seropositividad a Hp en los casos que en los controles (78,2% vs. 61,9%). Nuestros resultados señalan que existiría una probable asociación entre Hp y síntomas de NVE (OR = 3,05; IC 95%: 0,92-10,1; p = 0,068), pero sin significancia estadística. Un estudio en Puerto Rico que evaluó la asociación entre la “dispepsia matinal”, frecuente en mujeres gestantes entre la sexta y decimosexta semana del embarazo y la serología a Hp encontró una positividad de 89% de IgG anti- Hp en las gestantes con síntomas de NVE y solo 7% de seropositividad en asintomáticas (p < 0,001);13 mientras que en Taiwán, Wu y col. no hallaron asociación entre Hp y síntomas gastrointestinales severos en la gestación temprana, a pesar de una seropositividad a Hp alta (69%) en gestantes sintomáticas.30
De acuerdo a la severidad de los síntomas, se describe que los casos leves no restringen las actividades diarias de la gestante,11 mientras que los casos severos (hiperémesis gravídica) requieren hospitalización.31 Nuestro estudio se realizó principalmente en policlínicos, por lo que la mayoría de los casos fueron leves. Gungoren y col.32 usaron el índice de Rhodes para clasificar la severidad de los síntomas y usaron tanto la determinación serológica con IgG e IgM, encontrando que el porcentaje de gestantes con IgG positivo era mayor de acuerdo con la gravedad del cuadro, así como que todos los pacientes con IgM positivos eran casos severos. Por el contrario, nosotros encontramos que a mayor severidad de NVE, disminuye el porcentaje de gestantes con seropositividad de IgG anti-Hp. Los resultados contradictorios pueden explicarse porque la mayoría fueron casos leves, hubo cambios en la respuesta inmune durante la gestación, y además no se determinó anticuerpos IgM anti-Hp que sugirieran infección reciente. En relación con la presentación clínica, Karaer y col.33 determinaron que los síntomas de náusea y vómitos matutinos no se asociaron con la infección por Hp, mientras que los vómitos durante todo el día se observaron más frecuentemente en gestantes con infección por Hp (OR = 2,5; IC 95%: 1,2-4,9; p = 0,01), pero esto no fue considerado en nuestro estudio ya que el índice de Rhodes evalúa los síntomas de NVE en las últimas 12 horas.18
Los síntomas de NVE ocurren frecuentemente en primigrávidas, gestaciones múltiples, gestantes obesas y con antecedente de NVE en embarazos previos,4, 34 y la genética materna también es un factor de riesgo, como se señala en un estudio noruego.4 Es más frecuente en el primer trimestre del embarazo; un 50% mejora a las 14 semanas y el 90% a las 22 semanas, solo continua en el 10% luego de las 22 semanas.4, 6, 29 En nuestro estudio, encontramos que la edad gestacional mayor de 12 semanas fue un factor protector independiente para la presencia de NVE (OR = 0,31; IC 95%: 0,10-0,92; p = 0,034).
Shirin y col. señalan que la infección por Hp está relacionada con vómitos en la gestación temprana, pero no con síntomas gastrointestinales en etapas tardías.35 Un estudio en Turquía no encontró ninguna asociación entre seropositividad a Hp y los síntomas dispépticos al final del embarazo.36 Por el contrario, un estudio en Chile encontró que el malestar gástrico de las gestantes y la continuidad de los síntomas severos de la dispepsia y la hiperémesis después de los tres primeros meses de gestación se correlacionan significativamente con la infección por Hp.15 En el presente estudio encontramos que la edad gestacional tiene asociación con la presentación de síntomas de NVE. Asimismo, nuestros resultados muestran una probable asociación no significativa entre mayor paridad y presencia de NVE, contrariamente a lo reportado.4 Por otro lado, el nivel socioeconómico no estuvo asociado a la presencia de NVE. Cabe señalar que la mayoría de las gestantes del presente estudio pertenecían al estrato socioeconómico bajo.
No hay una explicación satisfactoria sobre la etiología y fisiopatología de los síntomas de NVE en todas las gestantes. Las patogénesis son factores metabólicos y endocrinos de origen placentario. La elevación de las hormonas esteroideas produce una retención de fluidos que cambia el pH del tracto gastrointestinal y se afecta la inmunidad celular y humoral con activación del Hp latente (asintomático), aunque el mecanismo exacto durante la gestación no se conoce.37, 38 Además, la dismotilidad gastrointestinal y la alteración de la inmunidad favorecerían la activación de la gastritis crónica, con lo que se exacerban los síntomas de NVE.11, 37 Lanciers y col. determinaron que hay mayor susceptibilidad de adquirir una infección por Hp al inicio del embarazo.38 Baguis y col. sugieren que la densidad gástrica de la infección por Hp adquirida antes o durante la gestación puede asociarse desde síntomas leves o casos severos de NVE.37 A pesar de ello, la importancia del Hp como factor contribuyente de los síntomas de NVE es aún controversial.
Entre las limitaciones de nuestro estudio está el bajo poder estadístico para poder determinar la asociación significativa entre Hp y NVE, debido al tamaño de muestra con menos controles de la cantidad estimada. Sin embargo, los análisis de regresión logística, así como el análisis de sensibilidad muestran consistencia, pudiéndose ver una probable asociación entre Hp y NVE si se aumentara el tamaño de la muestra. Otra limitación fue el uso de la prueba serológica que no diferencia infección activa de una exposición previa, y puede permanecer positivo por meses luego de erradicar la bacteria. Para minimizar esto, excluimos a gestantes que tuvieron infección reciente conocida con Hp. Además, se recomienda el uso de serología en gestantes, en lugar de endoscopía y biopsia, por ser mejor tolerado.39 La endoscopía alta y biopsia se realizaría luego de la semana 22 de gestación, si persisten los síntomas de dispepsia o náusea y/o vómitos para descartar úlcera péptica o cáncer gástrico.6 Asimismo, no pudimos determinar algunos potenciales factores confusores como la historia de NVE en gestaciones previas, la obesidad, ni los factores genéticos.
Una fortaleza del estudio fue el uso del índice de Rhodes (INV-2), que es un instrumento exhaustivo en la medición de síntomas de náusea y vómitos; mientras que otro instrumento conocido, por sus siglas en inglés, como PUQE (Motherisk Pregnancy-Unique Quantification of Emesis and Nausea) solo evalúa síntomas objetivos de NVE sin considerar el estrés asociado a los síntomas gastrointestinales.21
Si bien se encontró que las pacientes que presentaron náusea y vómitos en las primeras 20 semanas de gestación tuvieron un mayor riesgo de haber estado expuestas a Hp, esta relación no fue significativa debido al pequeño tamaño de muestra. Por lo tanto, futuros estudios son necesarios para establecer esta relación.
Agradecimientos. A la obstétrica Lic. Eudelia Hurtado y Lic. Gloria Pajuelo por su colaboración. A la Dra. Larissa Otero del Instituto de Evaluación de Tecnologías en Salud e Investigación de EsSalud (IETSI) por la asesoría en la elaboración del manuscrito a través del “Programa de Mentoring”.
Sostén financiero. El proyecto fue financiado por el “Fondo concursable de proyectos innovadores en investigación de EsSalud – 2014”.
Conflicto de interés. Los autores declaran que no hay conflicto de interés. El proyecto fue financiado por el “Fondo concursable de proyectos innovadores en investigación de EsSalud – 2014”.
Referencias
- Ramírez-Ramos A, Sánchez-Sánchez R. Helicobacter pylori 25 años después (1983-2008): Epidemiología, microbiología, patogenia, diagnóstico y tratamiento. Rev Gastroenterol del Perú 2008; 29: 158-170.
- Hunt R, Xiao S, Megraud F, León-Barua R, Bazzoli F, Van der Merwe S, Vaz Coelho LG, Fock M, Fedail S, Cohen H, Malfertheiner P, Vakil N, Hamid S, Goh KL, Wong BC, Krabshuis J, Le Mair A. Helicobacter pylori in developing countries. World Gastroenterol Organ Glob Guidel 2010. J Gastrointestin Liver Dis 2011; 20: 299-304.
- McColl K. Helicobacter pylori infection. N Engl J Med 2010; 362: 1597-1604.
- Lee N, Saha S. Nausea and Vomiting of Pregnancy. Gastroenterol Clin North Am 2011; 40: 309-334.
- Golberg D, Szilagyi A, Graves L. Hiperemesis gravidarum and Helicobacter pylori infection: A Systematic Review. Obstet Gynecol 2007; 110: 695-703.
- Winbery S, Blaho K. Dyspepsia in pregnancy. Curr Obstet Gynaecol 2001; 28: 333-350.
- Cardaropoli S, Rolfo A, Todros T. Helicobacter pylori and pregnancy-related disorders. World J Gastroenterol 2014; 20: 654- 664.
- Frigo P, Lang C, Reisenberger K, Kölbl H, Hirschl A. Hyperemesis gravidarum associated with Helicobacter pylori seropositivity. Obstet Gynecol 1998; 91: 615-617.
- Mansour G, Nashaat E. Role of Helicobacter pylori in the pathogenesis of hyperemesis gravidarum. Arch Gynecol Obstet 2011; 284: 843-847.
- Sandven I, Abdelnoor M, Wethe M, Nesheim B, Vikanes A, Gjonnes H, Melby KK. Helicobacter pylori infection and Hyperemesis gravidarum. An institution-based case-control study. Eur J Epidemiol 2008; 23: 491-498.
- Shaban M, Kandil H, Elshafei A. Helicobacter pylori seropositivity in patients with hyperemesis gravidarum. Am J Med Sci 2014; 347: 101-105.
- Xia L, Yang J, Li A, Tang S, Xie Q, Cheng D. Relationship between hyperemesis gravidarum and Helicobacter pylori seropositivity. Chin Med J 2004; 117: 301-302.
- Reymunde A, Santiago N, Perez L. Helicobacter pylori and severe morning sickness. Am J Gastroenterol 2001; 96: 2279-2280.
- Bromberg S, Takei K, Lagrosa S, Da Costa A, Zanoto A, Farah F. O Helicobacter pylori e sua correlação com os Sintomas dispépticos e evoluçao da gravidez. Rev Assoc Med Bras 2006; 52: 318- 322.
- Poveda GF, Carrillo KS, Monje ME, Cruz CA, Cancino AG. Helicobacter pylori infection and gastrointestinal symptoms on Chilean pregnant women. Rev Assoc Med Bras 2014; 60: 306-310.
- Alvarado-Esquivel C. Seroepidemiology of Helicobacter pylori infection in pregnant women in rural Durango, Mexico. Int J Biomed Sci 2013; 9: 224-229.
- Castillo Contreras O, Maguiña Quispe J, Benites Goñi H, Chacaltana Mendoza A, Guzmán Calderón E, Dávalos Moscol M, Frisancho Velarde O. Prevalencia de Helicobacter pylori en pacientes sintomáticos de consulta externa de la Red Rebagliati (EsSalud), Lima, Perú, en el período 2010-2013. Rev Gastroenterol del Perú 2016; 36: 49-55.
- Rhodes VA, McDaniel R. The Index of Nausea, Vomiting, and Retching: a new format of the lndex of Nausea and Vomiting. Oncol Nurs Forum 1999; 26: 889-894.
- Vera-Romero O, Vera-Romero F. Evaluación del nivel socioeconómico : presentación de una escala adaptada en una población de Lambayeque. Rev Cuerpo Médico HNAAA 2013; 6: 41-45.
- Burucoa C, Delchier JC, Courillon-Mallet A, de Korwin JD, Mégraud F, Zerbib F, Raymond J and Fauchère JL. Comparative evaluation of 29 commercial Helicobacter pylori serological kits. Helicobacter 2013; 18: 169-179.
- Koren G, Boskovic R, Hard M, Maltepe C, Navioz Y, Einarson A. Motherisk-PUQE (pregnancy-unique quantification of emesis and nausea) scoring system for nausea and vomiting of pregnancy. Am J Obstet Gynecol 2002; 186: S228-S231.
- Guven MA, Ertas IE, Coskun A, Ciragil P. Serologic and stool antigen assay of Helicobacter pylori infection in hyperemesis gravidarum: Which test is useful during early pregnancy? Taiwan J Obstet Gynecol 2011; 50: 37-41.
- Mansour G, Nashaat E. Helicobacter pylori and hyperemesis gravidarum. Int J Gynecol Obstet 2009; 106: 63-64.
- Vikanes AV, Stoer NC, Gunnes N, Grjibovski AM, Samuelsen SO, Magnus P, Melby KK. Helicobacter pylori infection and severe hyperemesis gravidarum among immigrant women in Norway: A case-control study. Eur J Obstet Gynecol Reprod Biol 2013; 167: 41-46.
- Lee RH, Pan VL, Wing DA. The prevalence of Helicobacter pylori in the Hispanic population affected by hyperemesis gravidarum. Am J Obstet Gynecol 2005; 193: 1024-1027.
- Jacobson G, Autry A, Somer-Shely T, Pieper K, Kirby R. Helicobacter pylori seropositivity and hyperemesis gravidarum. J Reprod Med 2003; 48: 578-582.
- Sandven I, Abdelnoor M, Nesheim B, Melby KK. Helicobacter pylori infection and hyperemesis gravidarum: a systematic review and meta-analysis of case-control studies. Acta Obstet Gynecol 2009; 88: 1190-1200.
- Li L, Li L, Zhou X, Xiao S, Gu H, Zhang G. Helicobacter pylori infection is associated with an increased risk of hyperemesis gravidarum: A meta-analysis. Gastroenterol Res Pract 2015; 2015: 278905.
- Verberg MFG, Gillott DJ, Al-Fardan N, Grudzinskas JG. Hyperemesis gravidarum, a literature review. Hum Reprod Update 2005; 11: 527-539.
- Wu C, Tseng J, Chou M, Lin S, Poon S, Chen G. Correlation between Helicobacter pylori infection and gastrointestinal symptoms in pregnancy. Adv Ther 2000; 17: 152-158.
- Sonkusare S. Hyperemesis gravidarum: A review. Med J Malaysia 2008; 63: 272-276.
- Güngüren A, Bayramoglu N, Duran N, Kurul M. Association of Helicobacter pylori positivity with the symptoms in patients with hyperemesis gravidarum. Arch Gynecol Obstet 2013; 288: 1279- 1283.
- Karaer A, Ozkan O, Ozer S, Bayir B, Kilic S, Babur C, Danişman N. Gastrointestinal Symptoms and Helicobacter pylori Infection in Early Pregnancy. Gynecol Obstet Invest 2008; 66: 44-46.
- Lacasse A, Rey E, Ferreira E, Morin C, Bérard A. Epidemiology of nausea and vomiting of pregnancy: prevalence, severity, determinants, and the importance of race/ethnicity. BMC Pregnancy Childbirth 2009; 9: 26.
- Shirin H, Sadan O, Shevah O, Bruck R, Boaz M, Moss SF, Everon S, Glezerman M, Avni Y. Positive serology for Helicobacter pylori and vomiting in the pregnancy. Arch Gynecol Obstet 2004; 270: 10-14.
- Tanriverdi HA, Ustundag Y, Tekin IO, Barut A. Dyspeptic complaints after 20 weeks of gestation are not related to Helicobacter pylori seropositivity. Med Sci Monit 2005; 11: CR445-CR448.
- Bagis T, Gumurdulu Y, Kayaselcuk F, Yilmaz ES, Killicadag E, Tarim E. Endoscopy in hiperemesis gravidarum and Helicobacter pylori infection. Int J Gynecol Obstet 2002; 79: 105-109.
- Lanciers S, Despinasse B, Mehta DI, Blecker U. Increased susceptibility to Helicobacter pylori infection in pregnancy. Infect Dis Obs Gynecol 1999; 7: 195-198.
- Aytac S, Turkay C, Kanbay M. Helicobacter pylori stool antigen assay in hyperemesis gravidarum: A risk factor for hyperemesis gravidarum or not? Dig Dis Sci 2007; 52: 2840-2843.
Correspondencia: Ofelia Castillo Contreras
Av. Santa Cruz 232, Dpto. 601. Distrito de Jesús María, Lima, Perú
Correo electrónico: brisaida2@yahoo.es
Acta Gastroenterol Latinoam 2017;47(4): 288-296
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE