Aníbal D Genna
Servicio de Cirugía Digestiva. Sanatorio Junín. Junín, Provincia de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2016;46:48-51
Recibido: 09/04/2015 / Aprobado: 06/01/2016 / Publicado en www.actagastro.org el 31/03/2016
Resumen
El pólipo fibroide inflamatorio o tumor de Vanek es una lesión polipoidea, benigna, que puede localizarse en cualquier parte del tubo digestivo. La ubicación más frecuente es el estómago y cuando se presenta en este órgano la sintomatología con la cual se manifiesta es como una hemorragia digestiva alta, generalmente silente, con anemia y melena. El caso presentado, por el contrario, es el de un pólipo fibroide inflamatorio gástrico que produjo una hemorragia digestiva alta aguda que requirió tratamiento quirúrgico.
Palabras claves. Pólipo fibroide inflamatorio gástrico, tumor de Vanek.
Inflammatory fibroid polyp as the cause of upper gastrointestinal bleeding
Summary
The inflammatory fibroid polyp or Vanek’s tumor is a benign polypoid lesion that can be found in any section of the digestive tract. It is most frequently located in the stomach and when found in this organ, the symptoms include upper gastrointestinal bleeding (often silent), anemia and melena. The case described below, on the contrary, presents a gastric inflammatory fibroid polyp which developed acute upper gastrointestinal bleeding and required surgical treatment.
Key words. Inflammatory fibroid gastric polyp, Vanek’s tumor.
El pólipo fibroide inflamatorio (PFI) o tumor de Vanek es una lesión tumoral benigna, poco frecuente, submucosa, muy vascularizada, caracterizada por la proliferación de tejido fibroso, infiltrado por células inflamatorias, especialmente eosinófilos.
Si bien puede encontrarse en todo el tubo digestivo, lo más frecuente es que asiente en el antro gástrico o en el íleon distal y consecuentemente puede producir sintomatología muy diferente, desde asintomático hasta ser la causa de una hemorragia digestiva alta o la de una intususcepción.
El presente reporte describe el caso de una mujer de 79 años que consulta a guardia por un cuadro de hemorragia digestiva alta que requiere una resección quirúrgica llegándose, luego al diagnóstico de PFI gástrico.
El objetivo del presente trabajo ha sido presentar dos casos de lesiones quirúrgicas de la vía biliar en variantes F de la misma y poner énfasis en el uso sistemático de la colangiografía operatoria.
Caso Clínico
Mujer de 79 años que concurre al Sanatorio por un cuadro clínico de una hora de evolución, caracterizado por sudoración profusa, vómitos alimentarios y deposiciones diarreicas. A su ingreso en el Servicio de Guardia se constató palidez de piel y mucosas, sudoración y un registró de tensión arterial de 80/40 mm Hg. Surge del interrogatorio el antecedente de epigastralgia de un mes de evolución y dos deposiciones melénicas. Se decide su internación y en el laboratorio de ingreso se constata un hematocrito de 25%; el resto de los análisis (incluye medio interno y coagulograma completo) fueron normales. Se transfunde con dos unidades de hematíes y se expande con solución fisiológica con posterior estabilización hemodinámica.
La videoendoscopía digestiva alta (VEDA), realizada a las 4 horas de ingresada la paciente, describe en curvatura mayor y sobre cara posterior una formación elevada de aspecto submucoso con ulceración central de +/- 3 cm, con signos de sangrado reciente (en la ulceración, no se realizó tratamiento endoscópico).
A continuación de la VEDA se completa el estudio de la paciente con una tomografía computada con contraste oral y endovenoso que no identifica la lesión gástrica ni otro hallazgo patológico.
Se decide la resolución quirúrgica mediante una laparotomía por incisión mediana supraumbilical. Se realiza una gastrotomía sobre la cara anterior; se identifica la lesión en la cara posterior del antro con tracción hacia el cenit de la misma y se procede a la resección con un disparo de sutura mecánica lineal cortante y la gastrorrafia de la cara anterior. La impresión diagnóstica intraoperatoria fue de un tumor estromal gastrointestinal (GIST). La paciente evolucionó satisfactoriamente, sin complicaciones postoperatorias obteniendo el alta sanatorial el cuarto día del postoperatorio.
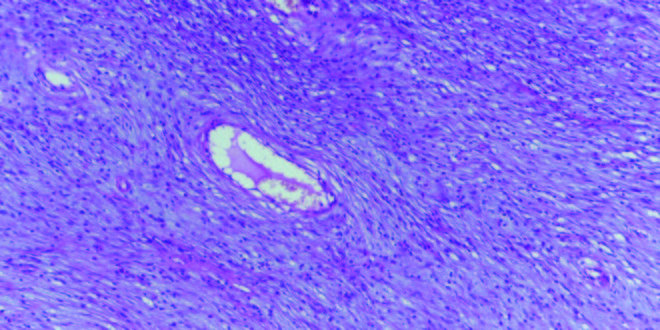
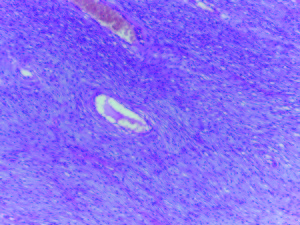
El informe de la anatomía patológica describe la lesión como una formación nodular, de bordes netos, revestida por una mucosa rosada y centralmente ulcerada; la microscopía la define como una lesión bien delimitada, no encapsulada en la submucosa, de tejido conectivo laxo, ricamente vascularizado y con prominente infiltrado inflamatorio eosinófilo: PFI (Figura 1).
Figura 1. Hematoxilina-eosina x 10: proliferación de elementos fusados tipo fibroblastos, dispuestos alrededor de vasos y con infiltrado eosinofílico.
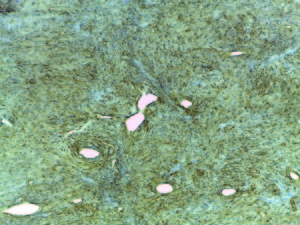
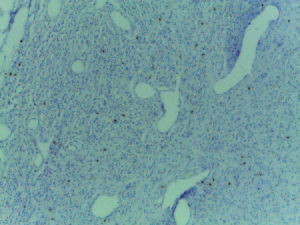
Posteriormente se confirma el diagnóstico en un centro de referencia (Hospital de Gastroenterología “Dr Carlos Bonorino Udaondo”) con el siguiente análisis inmunohistoquímico: CD34 positivo (Figura 2) y CD117 negativo (Figura 3).
Discusión
El PFI fue descrito por primera vez por Vanek en Praga en 1949 como un “granuloma submucoso gástrico con infiltración eosinofílica”.1 Actualmente se define al PFI como una proliferación de tejido fibroso, sumamente vascularizado, infiltrado por una inflamación rica en eosinófilos, que puede presentarse en cualquier localización del tubo digestivo, pero es encontrado mayormente en el antro gástrico, después en el íleon distal y mucho menos frecuentemente en el resto de los órganos.2-4
El PFI es uno de los pólipos gástricos menos frecuentes, representa aproximadamente el 3% de los mismos.4-6
El examen anatomopatológico macroscópico demuestra una lesión de bordes bien definidos con base en la submucosa que puede extenderse hasta la muscular propia o hasta la mucosa. Histologicamente tiene epicentro en la submucosa con alteraciones epiteliales reactivas en la mucosa suprayacente y bordes bien delimitados, sin estar encapsulado; es muy vascularizado, con aspecto en “capas de cebolla”, por tener células mononucleares y mesenquimales con citoplasma fusocelular, prolifera alrededor de dichos vasos y presenta siempre abundantes eosinófilos. En el análisis inmunohistoquímico expresan positividad para CD34 y son sistemáticamente negativos para CD117.2, 3, 7
La etiología permanece desconocida; las más reproducidas en las publicaciones son la genética y la inflamatoria.
I- Genética: avalada por el hecho que los pacientes con PFI tienen mutaciones del gen del receptor α del factor de crecimiento derivado de las plaquetas (PDGFRA) con expresión de la proteína PDGFR-α (exón 18 en los gástricos y exón 12 en los de intestino delgado).2, 4 Hay raros casos con agregación familiar que se denominan “síndrome de poliposis Devon”.8
II- Inflamatoria: como respuesta a una lesión local, consecuencia de: trauma, infección bacteriana (helicobacter pylori), agente químico o el estímulo metabólico que incitan a una respuesta inflamatoria en la submucosa que produce un tejido de granulación como masa polipoide. Al ser una respuesta inflamatoria, algunos hipotetizan que posiblemente libere citoquinas y esto cause fiebre y otros síntomas símil autoinmunes.4, 6, 9-12
La sintomatología varía según la ubicación. La gran mayoría son asintomáticos y son hallazgos en endoscopías realizadas por otras causas. Los PFI gástricos se pueden manifestar por obstrucción del tracto de salida (síndrome pilórico) o por presentar una hemorragia digestiva alta, generalmente silente, con anemia y melena. En ocasiones los pacientes consultan por epigastralgia. Los PFI de intestino delgado pueden ser causa de intususcepción, pero también hay reportes de sintomatología símil apendicitis aguda. Hay casos de pacientes con sintomatología totalmente diferente e inespecífica como el de un paciente pediátrico (4 años) con fiebre, artralgias y anemia que revirtió luego de la extirpación de un PFI gástrico de 5 x 8 cm.3, 4, 6, 10-17 Los diagnósticos diferenciales que se plantean son: GIST (como en el presente caso), tumor miofribroblástico inflamatorio, schwanoma, fibromatosis mesentérica y granuloma eosinófilo.2
El tratamiento de los PFI gástricos es la resección radical. Por VEDA se pueden extirpar los pólipos más pequeños (hasta 2 cm), mediante los diferentes métodos de polipectomía endoscópica o con técnica de mucosectomía.6, 9, 18, 19 Los pólipos más grandes requieren de cirugía, ya sea por laparotomía o por laparoscopía. La magnitud de la resección no requiere más que la resección completa, no necesita margen de seguridad. Generalmente alcanza con una gastrotomía y polipectomía (tal fue la conducta realizada), pero en algunos casos se llega a la gastrectomía parcial, proximal, subtotal o total según la ubicación de la lesión.10, 12-15, 20 No requiere ningún tratamiento a posteriori de la cirugía ni tampoco seguimiento alguno. Existen muy pocos casos publicados de recidiva de un PFI.20
Agradecimientos. Agradezco el fundamental aporte de los especialistas en anatomía patológica: Dra. Graciela Larroza (Sanatorio Junín) y la Dra. Ana Cabanne (Hospital de Gastroenterología “Dr Carlos Bonorino Udaondo”).
Referencias
- Vanek J. Gastric submucosal granuloma with eosinophilic infiltration. Am J Pathol 1949; 25: 397-411.
- Montgomery E. Pólipo fibroide inflamatorio. Greenson JK. Diagnóstico. Patología Gastrointestinal. Lippincott Williams & Wilkins and Amirsys®, 2013: 494-497.
- Day DW, Jass JR, Price AB, Shepherd NA, Sloan JM, Talbot IC, Warren BF, Williams GT. Gastric inflammatory fibroid polyps. En Morson and Dawsons Gastrointestinal Pathology. 4ta ed. Blackwell Publishing; 2003: 219.
- Morales Fuentes GA, de Ariño Suárez M, Zárate Osorno A, Rodríguez Jerkov J, Terrazas Espitia F, Pérez-Manauta J. Pólipo de Vanek o pólipo fibroide inflamatorio. Informe de un caso y revisión de la literatura. Cir Cir 2011; 79: 263-267.
- Muehldorfer SM, Stolte M, Martus P, Hahn EG, Ell C; Multicenter Study Group «Gastric Polyps». Diagnostic accuracy of forceps biopsy versus polypectomy for gastric polyps: a prospective multicentre study. Gut 2002; 50: 465-470.
- Bernal Eusse A, Cock Botero AM, Pérez MP, Bernal Cuartas C. Tumor de Vanek o pólipo fibroide inflamatorio gástrico. Presentación de dos casos en Medellín. Rev Col Gastroenterol 2012; 27: 327-330.
- Ozolek JA, Sasatomi E, Swalsky PA, Rao U, Krasinskas A, Finkelstein SD. Inflammatory fibroid polyps of the gastrointestinal tract: clinical, pathologic, and molecular characteristics. Appl Immunohistochem Mol Morphol 2004; 12: 59-66.
- Allibone RO, Nanson JK, Anthony PP. Multiple and recurrent inflammatory fibroid polyps in a Devon Family (“Devon polyposis syndrome”): an update. Gut 1992; 33:1004-1005.
- Nishiyama Y, Koyama S, Andoh A, Kishi Y, Yoshikawa K, Ishizuka I, Yokono T, Fujiyama Y. Gastric inflammatory fibroid polyp treated with Helicobacter pylori eradication therapy. Intern Med 2003; 42: 263-267.
- Chongdrisawat V, Yimyeam P, Wisedopas N, Viravaidya, Poovorawan Y. Unusual Manifestations of gastric inflammatory fibroid polyp in a child. World J Gastroenterol 2004; 10: 460-462.
- Yoon JH. An inflammatory fibroid polyp (Vanek’s tumor) of the ileum that presented as intussusception. Advances in Computed Tomography 2013; 2: 140-144.
- He H, Shen Z, Fang Y, Sun Y, Qin X. Bleeding and hyperpyrexia in an adult with gastric inflammatory fibroid polyp. Chin Med J 2013; 126: 2594.
- Aguilar Davidov B, Medina Franco H, Chablé Montero F. Pólipo fibroide inflamatorio gástrico gigante. Reporte de caso y revisión de la literatura. Rev Gastroenterol Mex 2008; 73: 239-241.
- Guerra Bautista J, Ibáñez Delgado F, Hernández de la Torre Bustillo J, Alcántara Gijón F. Pólipo fibroide inflamatorio gástrico. Rev Esp Enferm Dig 2006; 98: 477-483.
- Ortiz Moyano C, Martínez García R, Sánchez Muñoz D, Romero Gómez M. Pólipo fibroide inflamatorio gástrico. Rev Esp Enferm Dig 2010; 102: 282-291.
- Akbolut S. Intussusception due to inflammatory fibroid polyp: a case report and comprehensive literature review. World J Gastroenterol 2012; 18: 5745-5752.
- Kordzadeh A. Vanek’s tumour mimicking an acute appendicitis. International Journal of Surgery Case Reports 2011; 2: 264-266.
- Park YB, Cheung DY, Kim JI, Park SH, Cho SH, Han JY, Kim JK, Choi KY. A large inflammatory fibroid polyp in the sigmoid colon treated by endoscopic resection. Intern Med 2007; 46: 1647-1649.
- Hattori Y, Kobayashi S, Takahashi H, Yoneda M, Inamori M, Abe Y, Kubota K, Saito S, Nakajima A. Gastric inflammatory fibroid polyp treated by endoscopic submucosal dissection. Case Rep Gastroenterol 2008; 2: 283-286.
- Zinkiewicz K, Zgodziñski W, D’browski A, Szumi J, AEwik G, Wallner G. Recurrent inflammatory fibroid polyp of cardia: a case report. World J Gastroenterol 2004; 10: 767-768.
Correspondencia: Aníbal D. Genna
Correo electrónico: genna@hotmail.com.ar
Acta Gastroenterol Latinoam 2016;46(1):48-51
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE