Daniela Caamaño,1 Carlos Ocampo,1 Facundo Alonso,1 Hugo Zandalazini,1 Adelina Coturel,1 Vanina Leyton,1 Silvia Gutiérrez,2 Fabio Leiro3
1Hospital General de Agudos Dr. Cosme Argerich.
2Hospital General de Agudos José M. Penna.
Ciudad Autónoma de Buenos Aires, Argentina.
3Hospital Nacional Profesor Alejandro Posadas. Provincia de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2018;48(3):190-196
Recibido: 18/09/2017 / Aprobado: 08/05/2018 / Publicado en www.actagastro.org el 17/09/2018
Resumen
La pancreatitis aguda tiene una forma variada de presentación, desde formas leves y autolimitadas hasta graves con compromiso vital. La influencia de la obesidad sobre las enfermedades agudas como esta no es bien conocida. Objetivos. Investigar la relación existente entre el índice de masa corporal (IMC) y la prevalencia de pancreatitis grave, de complicaciones locales y sistémicas. Métodos. Se analizó una base de datos prospectiva de un estudio multicéntrico de 23 centros que aportaron datos acerca de la evolución de 854 pacientes ingresados con diagnóstico de pancreatitis aguda desde junio 2010 hasta junio de 2013. Resultados. De los 854 pacientes, 626 tenían constatado el IMC. El 36% de los pacientes tenían concomitantemente algún grado de obesidad. No hubo diferencias significativas entre los pacientes con menos de 30 IMC en relación con los de más de 30 IMC respecto de la incidencia de formas graves, complicaciones locales y mortalidad. Sí hubo diferencias significativas en el desarrollo de complicaciones sistémicas. Conclusiones. La obesidad no constituye un factor de riesgo para el desarrollo de formas graves de pancreatitis, pero sí está asociada a una mayor frecuencia de complicaciones sistémicas.
Palabras claves. Pancreatitis, obesidad abdominal, síndrome metabólico.
Obesity and the risk of severe acute pancreatitis
Summary
Acute pancreatitis has a varied form of presentation, from mild and self-limited to severe forms with vital commitment. The influence of obesity on acute diseases like this one is not well known. Objective. To investigate the relationship between the body mass index (BMI) and the prevalence of severe pancreatitis, local and systemic complications. Methods. It was analyzed a prospective database of a multicenter study of 23 centers that provided data about the evolution of 854 patients admitted with diagnosis of acute pancreatitis from June 2010 to June 2013. Results. Of the 854 patients, 626 had BMI. Thirty-six percent of the patients had concurrently some degree of obesity. There were no significant differences between patients with less than 30 BMI in relation to those of more than 30 BMI in respect of the incidence of severe forms, local complications and mortality. There were significant differences in the development of systemic complications. Conclusions. Obesity is not a risk factor for the development of severe forms of pancreatitis, but it is associated with a higher incidence of systemic complications.
Key words. Pancreatitis, abdominal obesity, metabolic syndrome.
La pancreatitis aguda (PA) es una entidad que se manifiesta mediante un espectro de presentaciones clínicas que van desde formas leves y auto-limitadas, en más del 75% de los casos, con una mortalidad del 1-2%, hasta formas graves con complicaciones locales y sistémicas con una mortalidad mayor al 20%.1-7
Por otra parte, en las últimas décadas el sobrepeso alcanzó razones epidémicas. La proporción de adultos con un IMC mayor o igual a 25 se incrementó de 28,8% a 36,9% en los hombres y de 29,8% a 38% en las mujeres entre los años 1980 y 2013.2
La influencia negativa de la obesidad en el curso de enfermedades crónicas ha sido bien estudiada y definida, sin embargo, no está bien determinado aún el grado de impacto que ejerce sobre afecciones inflamatorias agudas como la pancreatitis. Varios autores la han propuesto como factor de riesgo independiente para el desarrollo de formas graves, complicaciones locales, sistémicas e incremento de la mortalidad. Asimismo, se la ha incluido dentro de scores pronósticos validados con el fin de elevar el grado de certeza en la predicción de complicaciones y mortalidad. Los resultados obtenidos han sido variables.3, 4
El objetivo del presente estudio es investigar la relación existente entre el IMC y la prevalencia de pancreatitis grave, así como su relación con la presencia de complicaciones locales y sistémicas en 626 pacientes incluidos en una base de datos de pancreatitis aguda.
Material y métodos
Se realizó un análisis retrospectivo de una base que contenía datos sobre pacientes con PA ingresados en forma consecutiva en 23 centros de la Argentina desde junio de 2010 hasta junio de 2013. La base de datos incluía información sobre la etiología, la epidemiología, el diagnóstico y el tratamiento de los pacientes con PA.
El criterio de inclusión fue pacientes que ingresaron a los distintos centros con diagnóstico de PA, basado en el cuadro clínico más hiperamilasemia y/o el uso de algún método por imágenes. Los criterios de exclusión fueron pacientes menores de 15 años y con episodio agudo en el contexto de una pancreatitis crónica.
Fueron registrados los siguientes datos: edad, peso, altura, criterios diagnósticos de pancreatitis, etiología, gravedad, complicaciones sistémicas, complicaciones locales, realización de procedimientos, evolución, morbilidad y mortalidad. Los resultados del estudio multicéntrico fueron publicados en la revista Acta Gastroenterológica Latinoamericana.5
Para determinar el grado de obesidad de un paciente se utilizó el índice de masa corporal (IMC) que resulta del cociente de peso expresado en kilogramos y la altura expresada en centímetros elevada al cuadrado. Se consideró normal aquel IMC < 25, sobrepeso entre 25 y 29,9 y obesidad ≥ 30.6
La etiología fue clasificada en biliar, alcohólica, y otras. Para el diagnóstico de pancreatitis biliar se requirió la evidencia de litiasis vesicular o coledociana, dilatación de la vía biliar por ecografía (US) o colangioresonancia (CRNM) y/o perfil bioquímico compatible con ictericia obstructiva. La pancreatitis alcohólica se definió por la referencia de la ingesta de alcohol superior a 30 gr/día, en ausencia de otras causas aparentes.
Tanto para definir el grado de severidad de la PA como la presencia de complicaciones locales y sistémicas se utilizó la clasificación de Atlanta.7
Todos los pacientes fueron estratificados según los scores de riesgo pronóstico de RANSON y APACHE II.8, 9
Para el análisis estadístico se utilizó test de Chi2; p < 0,05 fue considerada estadísticamente significativa. La relación entre la presencia de obesidad y el desarrollo de formas graves, mortalidad, complicaciones locales y sistémicas se evaluó utilizando el Odds ratio (OR) con intervalo de confianza 95%.
Resultados
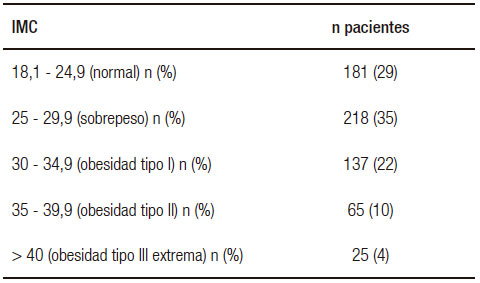
Durante un período de tres años fueron incorporados a la base de datos 854 pacientes con diagnóstico de pancreatitis aguda. De estos, 626 tenían constatado el IMC. Las características clínicas y demográficas de la población estudiada se presentan en la Tabla 1. En la Tabla 2 se divide a los pacientes de acuerdo con el IMC. El 36% de los pacientes mostraron algún grado de obesidad al momento del cuadro agudo de pancreatitis.
Tabla 2. Distribución del IMC.
De acuerdo con los criterios de Atlanta, 102 pacientes fueron clasificados como pancreatitis aguda grave (PAG) y los restantes 524 presentaron las formas leve y moderada.
La etiología más prevalente fue la litiasis biliar en el 88% de los casos, seguida por la causa alcohólica en el 4% de los casos. En ningún caso se constató uso de drogas que causen la pancreatitis.
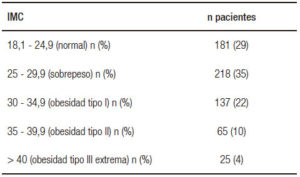
No hubo diferencias significativas entre los pacientes con IMC < 30 o > de 30 en la frecuencia de formas graves, complicaciones locales y mortalidad (p = NS). Sí hubo diferencias significativas en el desarrollo de complicaciones sistémicas (OR: 2,37; IC95%: 1,15 – 4,86; p = 0,02). Los pacientes con más de 30 de IMC tuvieron significativamente mayor prevalencia de complicaciones sistémicas que los pacientes con IMC < 30 (Tabla 3).
Al realizarse el análisis estadístico de los datos estratificando a los pacientes según el IMC en aquellos con peso normal, sobrepeso, obesidad I y II y obesidad mórbida, tampoco se encontraron diferencias significativas en relación con formas graves, complicaciones locales y mortalidad entre los grupos (p = NS). En relación con las complicaciones sistémicas, el grupo con IMC < 24 tuvo menor presentación de complicaciones sistémicas que todos los grupos, excepto el de obesidad mórbida (Tabla 4).
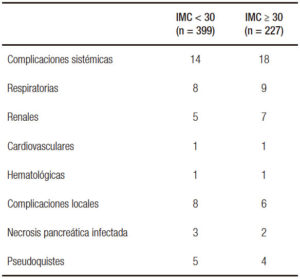
Se registraron 32 complicaciones sistémicas, las más frecuentes fueron las respiratorias y las renales. Catorce pacientes desarrollaron complicaciones locales. En la Tabla 5 se detallan las complicaciones sistémicas y locales; no hubo diferencias significativas en el tipo de complicaciones entre los dos grupos (p = NS). Once pacientes fallecieron, 4 por fallo orgánico múltiple dentro de las 72 horas de su ingreso (pancreatitis fulminante) y 7 por sepsis con fallo orgánico múltiple.
Tabla 3. Distribución de las complicaciones según el IMC.
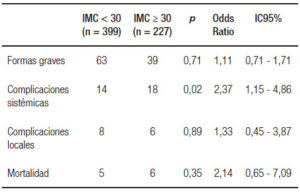
Tabla 4. Distribución de las complicaciones según el IMC estratificado.
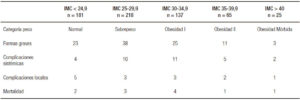
Tabla 5. Distribución de complicaciones según IMC, detalladas.
Discusión
En este trabajo la presencia de obesidad tiene un riesgo aumentado para desarrollar complicaciones sistémicas, pero no para el desarrollo de formas graves, complicaciones locales o mortalidad. La evidencia muestra resultados contradictorios sobre la influencia de la obesidad en el curso de la pancreatitis aguda.
Algunos trabajos señalan a la obesidad como un factor pronóstico tanto para el desarrollo de complicaciones sistémicas y locales como para una mayor mortalidad, mientras que otros autores, por el contrario, no encuentran relación entre el IMC y la gravedad de la pancreatitis aguda.10-14 De Waele14 realizó sobre un estudio de 250 pacientes un análisis más detallado en lo que respecta al grado de obesidad determinado por el IMC. Globalmente ha encontrado una relación estadísticamente significativa en la prevalencia de formas severas y complicaciones locales dentro del grupo de pacientes con IMC > 25. Sin embargo, no ocurre lo mismo con la prevalencia de complicaciones sistémicas, metabólicas, disfunción orgánica y muerte. Posteriormente, al analizar y estratificar el grado de obesidad de acuerdo con su IMC y compararlo con el grupo control encontró mayores complicaciones sistémicas y locales conforme aumenta el IMC. En nuestro análisis, en cambio, el estudio estratificado de los pacientes según IMC únicamente arrojó diferencias significativas en relación con complicaciones sistémicas. El grupo con IMC < de 24 tuvo marcadamente menor número de complicaciones sistémicas que todos los grupos, excepto el de obesidad mórbida, sin llegar a ser este un resultado estadísticamente significativo (p = NS). Creemos que estos resultados se deben al bajo número de pacientes con obesidad mórbida.
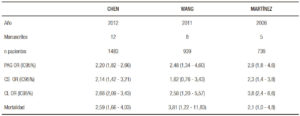
En los metaanálisis los resultados son más homogéneos.15-18 En tres metaanálisis que reunieron 3161 pacientes se encontró en forma consistente que la obesidad es un factor de riesgo en el desarrollo de formas graves, complicaciones sistémicas, complicaciones locales y mortalidad. Solo en un metaanálisis la obesidad no se asoció a un mayor desarrollo de complicaciones sistémicas (Tabla 6). La diferencia entre los hallazgos de nuestro trabajo y los metaanálisis podría explicarse por las diferentes etiologías, la ausencia de estratificación según el IMC y la variable presencia de comorbilidades entre los pacientes.
Tabla 6. Metaanálisis publicados.
La patogénesis de la mayor severidad del ataque de pancreatitis aguda en obesos es probablemente multifactorial, con participación de mecanismos locales y sistémicos. Dentro de los mecanismos locales se mencionan la hipoxemia secundaria a la restricción del movimiento diafragmático, grasa peripancreática con ácidos grasos no saturados que predispone a lipotoxicidad y necrosis. Por otro lado, la elevada secreción de mediadores inflamatorios, los bajo niveles de citoquinas inflamatorias, el bajo grado de estado proinflamatorio y la elevada respuesta inflamatoria sistémica son los principales mecanismos sistémicos involucrados.
La grasa visceral que rodea el páncreas es la fuente principal de liberación de ácidos grasos libres. Se estima que, en personas con un peso promedio de 84 kg, la grasa visceral puede estar en el orden de los 3 kg. Los cálculos a partir de imágenes estiman que la grasa visceral ocupa entre el 10 y el 30% de la zona abdominal. El volumen intraabdominal de los obesos es de aproximadamente 23 a 30 litros, y por lo tanto la grasa visceral representa entre 2 y 9 litros.19
En la pancreatitis aguda la liberación de enzimas pancreáticas en la grasa visceral puede generar grandes cantidades de ácidos grasos libres con el consiguiente aumento de la respuesta inflamatoria. Patel20 observó en un clásico modelo experimental de pancreatitis aguda por ceruleína que los ratones obesos tienen significativamente mayores lesiones pulmonares e insuficiencia renal que los ratones magros.
Otra prueba del efecto de los ácidos grasos libres proviene de estudios experimentales en los que lo inyectan a los ratones en forma pura. En estos trabajos se comprobó que la administración de ácidos grasos libres produce lesión pulmonar aguda, injuria tubular aguda e insuficiencia renal. Por lo tanto, la grasa visceral en los obesos puede ser fuente de liberación de grandes cantidades de ácidos grasos libres que producen complicaciones sistémicas aún en casos con mínima necrosis pancreática. Trabajos clínicos recientes confirman esta hipótesis.21-23
En un trabajo reciente de Katuchova se demostró que la severidad del ataque de PA en los obesos no solo está en relación con la cantidad total de grasa corporal sino con su localización, siendo la grasa visceral la que entraña mayor riesgo.24
En relación con el estado inflamatorio, se postula que el obeso presenta un bajo grado en condiciones normales. Este estado de inflamación de bajo grado se caracteriza por los niveles elevados de determinadas citoquinas, tales como TNF alfa, IL-6, L-10, IL-1 beta, PAI-1 y CRP.25 Cuando el paciente obeso recibe el estrés de la PA amplifica su respuesta inflamatoria por medio de estos factores proinflamatorios, lo que contribuye al desarrollo del síndrome de respuesta inflamatoria sistémica (SRIS) y a la disfunción orgánica. Las citoquinas producidas por el tejido adiposo se denominan adipokinas.25 Entre ellas encontramos la vinfastina, la leptina, la resistina y la adiponectina, todas con influencia en la modulación de la respuesta inflamatoria. La adiponectina es la única adipokina con franca acción antiinflamatoria.26 Sharma describe una concentración de esta inversamente proporcional al aumento del IMC e intenta explicar de esta manera uno de los mecanismos fisiopatogénicos de la producción de complicaciones en pacientes obesos que sufren PA.27
Existen también factores inherentes a la mecánica respiratoria propuestos como determinantes de pancreatitis grave. La restricción de los movimientos respiratorios en el paciente obeso es un hecho frecuente. Esta limitación en la excursión del diafragma y de la pared torácica reduce la capacidad funcional e incrementa los shunt fisiológicos arteriovenosos pulmonares, con la consecuente hipoxemia. Esta hipoxemia predispone a la hipoxia tisular, lo que incrementa el SIRS habitual del paciente con PAG y contribuye al daño orgánico.
A pesar de que la mayoría de los estudios epidemiológicos muestran una mayor gravedad en pacientes obesos, no se ha logrado demostrar aún que adicionar el factor obesidad dentro de scores pronósticos (APACHE-O) incremente la efectividad para predecir formas graves.28, 29
Conclusión
En nuestro trabajo la obesidad está asociada en forma significativa a una mayor prevalencia de complicaciones sistémicas. No se encontró un aumento significativo del riesgo en relación con el desarrollo de formas graves, complicaciones locales y mortalidad. La mayoría de los trabajos epidemiológicos y meta análisis muestran un aumento de la gravedad de la PA en pacientes obesos.
Es necesario que en estudios posteriores se discriminen los grados de obesidad, distribución del tejido adiposo y su relación con el desarrollo de la PA, como también que se diferencien las enfermedades concomitantes, también asociadas a la obesidad que presenten los pacientes, inherentes al desarrollo de complicaciones sistémicas (síndrome metabólico).
Sostén financiero. Ninguno.
Referencias
- Ioannidis O, Lavrentieva A, Botsios D. Nutrition support in acute pancreatitis. JOP 2008; 9: 375-390.
- Ng M, Fleming T, Robinson M, Thomson B, Graetz N, Margono C, Mullany E, Biryukov S, Abbafati C, Abera SF, Abraham JP, Abu-Rmeileh NM, Achoki T, AlBuhairan FS, Alemu ZA, Alfonso R, Ali MK, Ali R, Guzman NA, Ammar W, Anwari P, Banerjee A, Barquera S, Basu S, Bennett DA, Bhutta Z, Blore J, Cabral N, Nonato IC, Chang JC, Chowdhury R, Courville KJ, Criqui MH, Cundiff DK, Dabhadkar KC, Dandona L, Davis A, Dayama A, Dharmaratne SD, Ding EL, Durrani AM, Esteghamati A, Farzadfar F, Fay DF, Feigin VL, Flaxman A, Forouzanfar MH, Goto A, Green MA, Gupta R, Hafezi-Nejad N, Hankey GJ, Harewood HC, Havmoeller R, Hay S, Hernández L, Husseini A, Idrisov BT, Ikeda N, Islami F, Jahangir E, Jassal SK, Jee SH, Jeffreys M, Jonas JB, Kabagambe EK, Khalifa SE, Kengne AP, Khader YS, Khang YH, Kim D, Kimokoti RW, Kinge JM, Kokubo Y, Kosen S, Kwan G, Lai T, Leinsalu M, Li Y, Liang X, Liu S, Logroscino G, Lotufo PA, Lu Y, Ma J, Mainoo NK, Mensah GA, Merriman TR, Mokdad AH, Moschandreas J6, Naghavi M, Naheed A, Nand D, Narayan KM, Nelson EL, Neuhouser ML, Nisar MI, Ohkubo T, Oti SO, Pedroza A, Prabhakaran D, Roy N, Sampson U, Seo H, Sepanlou SG, Shibuya K, Shiri R, Shiue I, Singh GM, Singh JA, Skirbekk V, Stapelberg NJ, Sturua L, Sykes BL, Tobias M, Tran BX, Trasande L, Toyoshima H, van de Vijver S, Vasankari TJ, Veerman JL, Velásquez-Meléndez G, Vlassov VV, Vollset SE, Vos T, Wang C, Wang X, Weiderpass E, Werdecker A, Wright JL, Yang YC, Yatsuya H, Yoon J, Yoon SJ, Zhao Y, Zhou M, Zhu S, Lopez AD, Murray CJ, Gakidou E. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet 2014; 384: 766-781.
- Premkumar R, Phillips AR, Petrov MS, Windsor JA. The clinical relevance of obesity in acute pancreatitis: targeted systematic reviews. Pancreatology 2015; 15: 25-33.
- Abu Hilal M, Armstrong T. The impact of obesity on the course and outcome of acute pancreatitis. Obes Surg 2008; 18: 326-328.
- Ocampo C, Kohan G, Leiro F, Basso S, Gutiérrez S, Perna L, Serafini V, Lada P, Lanceloti T, García H, Tolino M, Stork G, Zandalazini H, Buonomo L, Mercade J, Ferreres A, Troubul F, Latif J, Klappenbach R, Capitanich P, Rainone P, Sisco P, Zartarian D, Álvarez S, Fraile A. Diagnóstico y tratamiento de la pancreatitis aguda en la Argentina. Resultados de un estudio prospectivo en 23 centros. Acta Gastroenterol Latinoam 2015; 45: 295-302.
- World Health Organization: Obesity: preventing and managing the global epidemic. Report of WHO Convention, Geneva 1999. WHO Tech Rep Ser 894. Geneva, WHO, 2000.
- Banks PA, Bollen TL, Dervenis C, Gooszen HG, Johnson CD, Sarr MG, Tsiotos GG, Swaroop Vege S. Acute Pancreatitis Classification Working Group. Classification of acute pancreatitis – 2012: revision of the Atlanta classification and definitions by international consensus. Gut 2012; 62: 102-111.
- Ranson JH, Rifkind KM, Roses DF, Fink SD, Eng K, Spencer FC. Prognostic signs and the role of operative management in acute pancreatitis. Surgery, Gynecology & Obstetrics 1974; 139: 69-81.
- Johnson CD, Toh SK, Campbell MJ. Combination of APACHE-II score and an obesity score (APACHE-O) for the prediction of severe acute pancreatitis. Pancreatology 2004; 4: 1-6.
- Lankisch PG, Schirren CA. Increased body weight as a prognostic parameter for complications in the course of acute pancreatitis. Pancreas 1990; 5: 626-629.
- Yang F, Wu H, Li Y, Li Z, Wang C, Yang J, Hu B, Huang Z, Ji R, Zhan X, Xie H, Wang L, Zhang M, Tang C. Prevention of severe acute pancreatitis with octreotide in obese patients: a prospective multi-center randomized controlled trial. Pancreas 2012; 41: 1206-1212.
- Shin KY, Lee WS, Chung DW, Heo J, Jung MK, Tak WY, Kweon YO, Cho CM. Influence of obesity on the severity and clinical outcome of acute pancreatitis. Gut Liver 2011; 5: 335- 339.
- Sawalhi S, Al-Maramhy H, Abdelrahman AI, Allah SE, Al-Jubori S. Does the presence of obesity and/or metabolic syndrome affect the course of acute pancreatitis? A prospective study. Pancreas 2014; 43: 565-570.
- De Waele B, Vanmierlo B, Van Nieuwenhove Y, Delvaux G. Impact of body overweight and class I, II and III obesity on the outcome of acute biliary pancreatitis. Pancreas 2006; 32: 343- 345.
- Hong S, Qiwen B, Ying J, Wei A, Chaoyang T. Body mass index and the risk and prognosis of acute pancreatitis: a meta-analysis. Eur J Gastroenterol Hepatol 2011; 23: 1136-1143.
- Wang S, Li S, Feng Q, Feng X, Zhao Q. Overweight Is an Additional Prognostic Factor in Acute Pancreatitis: A Meta-Analysis. Pancreatology 2011; 11: 92-98.
- Martínez J, Johnson CD, Sánchez-Payá J, de Madaria E, RoblesDíaz G, Pérez-Mateo M. Obesity is a definitive risk factor of severity and mortality in acute pancreatitis: an updated metaanalysis. Pancreatology 2006; 6: 206-209.
- Chen SM, Xiong GS, Wu SM. Is obesity an indicator of complications and mortality in acute pancreatitis? An updated meta-analysis. J Dig Dis 2012; 13: 244-251.
- Lyon CJ, Law RE, Hsueh WA. Minireview: adiposity, inflammation, and atherogenesis. Endocrinology 2004; 144: 2195-2200.
- Patel K, Trivedi RN, Durgampudi C, Noel P, Cline RA, DeLany JP, Navina S, Singh VP. Lipolysis of visceral adipocytetriglyceride by pancreatic lipases converts mild acute pancreatitis to severe pancreatitis independent ofnecrosis and inflammation. Am J Pathol 2015; 185: 808-819.
- Fain JN, Madan AK, Hiler ML, Cheema P, Bahouth SW. Comparison of the release of adipokines by adipose tissue, adipose tissue matrix, and adipocytes from visceral and subcutaneous abdominal adipose tissues of obese humans. Endocrinology 2004; 145: 2273-2282.
- Sempere L, Martínez J, de Madaria E, Lozano B, Sánchez-Payá J, Jover R, Pérez-Mateo M. Obesity and fat distribution imply a greater systemic inflammatory response and a worse prognosis in acute pancreatitis. Pancreatology 2008; 8: 257-264.
- Tilg H, Moschen AR. Adipocytokines: mediators linking adipose tissue, inflammation and immunity. Nat Rev Immunol 2006; 6: 772-783.
- Katuchova J, Bober J, Harbulak P, Hudak A, Gajdzik T, Kalanin R, Radonak J. Obesity as a risk factor for severe acute pancreatitis patients. Wien Klin Wochenschr 2014; 126: 223-227.
- Navina S, Acharya C, DeLany JP, Orlichenko LS, Baty CJ, Shiva SS, Durgampudi C, Karlsson JM, Lee K, Bae KT, Furlan A, Behari J, Liu S, McHale T, Nichols L, Papachristou GI, Yadav D, Singh VP. Lipotoxicity causes multisystem organ failure and exacerbates acute pancreatitis in obesity. Sci Transl Med 2011; 3: 107-110.
- Fantuzzi G. Adipose tissue, adipokines, and inflammation. J Allergy Clin Immunol 2005; 115: 911-919.
- Sharma A, Muddana V, Lamb J, Greer J, Papachristou GI, Whitcomb DC. Low serum adiponectin levels are associated with systemic organ failure in acute pancreatitis. Pancreas 2009; 38: 907- 912.
- Martínez J, Sánchez-Payá J, Palazón JM, Aparicio JR, Picó A, Pérez-Mateo M. Obesity: a prognostic factor of severity in acute pancreatitis. Pancreas 1999; 19: 15-20.
- Halonen KI, Leppaniemi AK, Puolakkainen PA. Severe acute pancreatitis: prognostic factors in 270 consecutive patients. Pancreas 2000; 21: 266-271.
Correspondencia: Daniela Caamaño
Combate de los Pozos 495, 2do B (CP: C1080AAE). Ciudad Autónoma de Buenos Aires, Argentina / Tel.: 011-1555949251
Correo electrónico: daniela.s.caamanio@hotmail.com
Acta Gastroenterol Latinoam 2018;48(3): 190-196
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE