Mirta Ciocca,1 Alejandro Costaguta,2 Miriam Cuarterolo,3 Laura Delgado,4 Lidia Garcete,5 Marcela Godoy,6 Carmen Esther López,7 Carola López,8 Margarita Ramonet9
1 Hospital Alemán. Buenos Aires, Argentina.
2 Sanatorio de Niños. Rosario, Santa Fe, Argentina.
3 Hospital Nacional de Pediatría “Juan P Garrahan”. Buenos Aires, Argentina.
4 Centro Hospitalario Pereira Rossell. Montevideo, Uruguay.
5 Servicio y Cátedra de Pediatría de la Facultad de Ciencias Médicas, UNA. Paraguay.
6 Hospital Clínico San Borja Arriaran. Santiago, Chile.
7 Hospital de Niños J M de los Ríos. Caracas, Venezuela.
8 Centro Hospitalario Pereira Rossell. Montevideo, Uruguay.
9 Universidad de Morón. Provincia de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2016;46:52-70
Recibido: 06/10/2015 / Aprobado: 11/12/2015 / Publicado en www.actagastro.org el 31/03/2016
Resumen
La insuficiencia hepática aguda pediátrica es un síndrome de disfunción severo y repentino de los hepatocitos que lleva a un fallo de la función de síntesis y detoxificación. Es una enfermedad grave y poco frecuente, pero potencialmente fatal, que se presenta en un niño previamente sano. La etiología se relaciona con la edad del paciente y la región geográfica de procedencia, reconociéndose el origen: metabólica, infecciosa, tóxica, autoinmune, vascular y tumoral. La causa indeterminada, donde la búsqueda etiológica es negativa, puede oscilar entre el 18 y el 47%, dependiendo del centro y acceso a la realización de los estudios etiológicos. El proceso que determina la injuria hepática no es aún bien conocido y se considera multifactorial. Depende esencialmente de la susceptibilidad del huésped, la causa y severidad del daño y la capacidad de regeneración hepática. La presentación clínica depende de la etiología, comenzando habitualmente con un episodio de hepatitis aguda, que en días o semanas evidencia una evolución desfavorable, profundizando la ictericia, acompañada del gran compromiso del estado general y de una severa coagulopatía. El tratamiento consiste en la implementación de medidas generales que tenderán a corregir las alteraciones metabólicas, el aspecto nutricional, y la prevención y tratamiento de todas las complicaciones que se presentan en el transcurso evolutivo como infecciosas, neurológicas, etc. Además, es fundamental implementar el tratamiento específico de aquellas enfermedades que pueden beneficiarse del mismo (hepatitis aloinmune, galactosemia, tirosinemia, infección por herpes simple, enfermedad de Wilson, etc). Sin embargo, a pesar de los avances terapéuticos, la insuficiencia hepática aguda resulta en muerte o trasplante hepático en más del 45% de los casos.
Palabras claves. Insuficiencia hepática aguda, revisión, tratamiento médico, trasplante hepático, mortalidad.
Pediatric acute liver failure. Working group of the latinamerican society of pediatric gastroenterology, hepatology and nutrition (LASPGHAN)
Summary
Pediatric acute liver failure is a syndrome of severe and sudden dysfunction of the hepatocytes which produces a failure in synthetic and detoxifying function. It is an infrequent and severe disease but potentially fatal, occurring in children with no prior history of liver disease. Etiology is related to the age and geographic region of the patient, recognizing the origin: metabolic, infectious, drug exposure, autoinmune, vascular and oncologic. Indeterminate cause where all the etiological search is negative, can range between 18 and 47%, depending on the center and access to the realization of etiological studies. The process which determines the liver injury is still not well known and is considered multifactorial. Essentially, it depends on host susceptibility, the cause and severity of the damage and the ability of liver regeneration. The clinical presentation depends on the etiology, which usually begins with an episode of acute hepatitis, that in the following days or weeks presents unfavorable outcome, deepening jaundice, affecting the general state and presenting severe coagulopathy that characterizes the syndrome. The treatment consists of general measures which take into account the metabolic disorders, nutritional aspect, and the prevention and treatment of all complications that occur in the evolutionary course (infectious, neurological, etc). Besides it is also vital to implement the specific treatment of those diseases which can benefit from it (alloimmune hepatitis, galactosemia, tyrosinemia, herpes simplex infection, Wilson’s disease, etc.). However, despite therapeutic advances, acute liver failure results in death or liver transplantation in over 45% of cases.
Key words. Acute liver failure, review, medical treatment, liver transplantation, mortality.
Abreviaturas
IHA: insuficiencia hepática aguda.
EH: encefalopatía hepática.
GEFHAP: Grupo de Estudio de la IHA Pediátrica.
TH: trasplante hepático.
RIN: razón internacional normalizada.
NAC: N-acetilcisteína.
MARS: molecular absorbent regenerating system.
LIU: Unidades de injuria hepática.
KCH: King´s College Hospital.
VPP: valor predictivo positivo.
VPN: valor predictivo negativo.
La insuficiencia hepática aguda (IHA) pediátrica es una enfermedad multisistémica infrecuente, pero potencialmente fatal, que se presenta en un niño previamente sano, con rápida progresión a la disfunción hepática y severa falla de síntesis dentro de las ocho semanas del comienzo de los síntomas, con o sin la presencia de encefalopatía hepática (EH).
En un intento de estandarizar la nomenclatura, en adultos, se ha propuesto el intervalo de tiempo entre la ictericia y la aparición de la EH en 0-7 días, 8-28 días y 29 días-12 semanas, respectivamente para definirla como hiperaguda, aguda y subaguda. Sin embargo, estas definiciones resultan inadecuadas en lactantes y niños con IHA.
Durante muchos años, la caracterización de la IHA pediátrica estuvo basada en la experiencia de centros aislados, generando sesgos debido a las diferencias poblacionales y a las variadas definiciones que incluían diferentes períodos de tiempo. En el año 1999, se creó el Grupo de Estudio de la IHA Pediátrica (GEIHAP) para salvar estas deficiencias, recolectando datos demográficos, clínicos, humorales y resultados a corto plazo de manera uniforme y con una nomenclatura estandarizada, para casos de IHA de 24 centros pediátricos (21 en Estados Unidos, 2 en el Reino Unido y 1 en Canadá).
Este Grupo propuso la siguiente definición de IHA en niños de 0 a 18 años de edad:
- Niños sin manifestaciones de enfermedad hepática crónica.
- Evidencia bioquímica de lesión hepática aguda (transaminasas elevadas).
- Coagulopatía irreversible con la administración de vitamina K parenteral, definida como tiempo de protrombina ≥ 15 segundos o razón internacional normalizada (RIN) ≥ 1,5 en presencia de EH o tiempo de protrombina ≥ 20 segundos o RIN ≥ 2 en pacientes sin EH.1-3
Etiología
La etiología de la IHA está en relación con la edad del paciente y la región geográfica de procedencia (grado de desarrollo socioeconómico del país), puediéndose agrupar aquellas de origen: metabólica, infecciosa, tóxica, autoinmune, vascular y tumoral.
La causa indeterminada, donde toda la búsqueda etiológica es negativa, puede oscilar entre el 18-47%, dependiendo del centro y acceso a la realización de los estudios etiológicos.
La tasa de sobrevida varía de acuerdo a la etiología, por tal motivo es importante la identificación temprana de la misma. En algunos casos se puede revertir con la iniciación inmediata de terapias específicas, como en los casos de enfermedades metabólicas (galactosemia, fructosemia, tirosinemia y enfermedad de Wilson), enfermedad autoinmune o intoxicación con acetaminofen. Por otro lado, algunas enfermedades no tienen indicación de trasplante hepático (TH) (leucemia, síndrome de Reye, trastornos de la cadena respiratoria mitocondrial con compromiso neurológico), sino que está contraindicado.
Tanto la disponibilidad de factores pronósticos predictores de mortalidad como la indicación de TH son importantes en el manejo inicial del paciente crítico, resultando aún más difícil la selección de los niños que pueden recuperarse de manera espontánea, sin la mencionada intervención quirúrgica. Dicha selección se debe realizar en centros con disponibilidad de TH pediátrico, donde los niños con IHA deben ser derivados precozmente para su evaluación.1-5
De acuerdo a la edad del paciente, la etiología la podemos agrupar en:
Neonatos y lactantes menores de 7 meses
La infección viral y los trastornos metabólicos congénitos son las dos causas principales de IHA en esta etapa de la vida.
Infecciones virales
Dentro de los enterovirus, los echovirus, en particular el serotipo 11, es el más frecuentemente identificado. Las infecciones son graves, con compromiso multisistémico, afectando casi exclusivamente a los recién nacidos, entre los 4 y 7 días de vida. La mortalidad es alta, sin la administración del tratamiento antiviral, o el TH.
El virus del herpes simple origina infección neonatal que puede ser adquirida en el momento del parto o después del nacimiento. Generalmente los síntomas se desarrollan después de los 5 días de vida. La IHA puede ocurrir con enfermedad diseminada (piel, ojos, membranas mucosas, cerebro, pulmones) o como una única manifestación. El uso de la terapia con aciclovir en los recién nacidos es recomendable. A pesar del tratamiento, el pronóstico suele ser desfavorable, se asocia con una alta mortalidad (85%). En estos caso el TH es una opción terapéutica que mejora ampliamente la sobrevida.
Otros virus: adenovirus, parvovirus B19 y paramixovirus también han sido asociados con IHA durante este período.1-5, 10-13
Trastornos metabólicos congénitos
La galactosemia es un trastorno hereditario, autosómico recesivo, que debe ser considerado en los recién nacidos con cataratas y / o sepsis con Escherichia coli.
La intolerancia hereditaria a la fructosa es un trastorno hereditario, autosómico recesivo, cuyos síntomas se presentan sólo una vez que la fructosa es introducida en la dieta. Por lo tanto, los síntomas generalmente no se observan en los recién nacidos que son alimentados con fórmulas de leche libre de fructosa, con excepción de los que reciben medicamentos o fórmulas que contienen fructosa, sacarosa o sorbitol.
La tirosinemia hereditaria tipo 1 es un trastorno hereditario autosómico recesivo que ocasiona la acumulación de metabolitos tóxicos responsables de la afectación hepática y disfunción tubular renal proximal. Los lactantes con mayor frecuencia presentan coagulopatía precoz luego del nacimiento. Los signos clínicos de IHA se manifiestan entre 1-6 meses de vida. Desde 1993, la administración de nitisinona, asociada a una dieta libre de tirosina y fenilalanina, resulta exitosa en el 90% de los casos. Es importante el seguimiento de estos pacientes, por el riesgo aumentado de presentar hepatocarcinoma a pesar de recibir el tratamiento específico. Los pacientes que no responden a la medicación (menos del 10%) requerirán un TH.
Los trastornos de la cadena respiratoria mitocondrial (por ejemplo, errores innatos de la fosforilación oxidativa) pueden presentarse con IHA neonatal.
Dentro de los errores innatos en la síntesis de ácidos biliares, la deficiencia de Δ4-3-oxoesteroide 5β-reductasa es el principal defecto que ha sido reconocido como causa de IHAl asociada con colestasis neonatal. El diagnóstico temprano es importante porque la administración oral de ácido cólico es efectiva y puede evitar el TH.
La hemocromatosis neonatal, también denominada hepatitis aloinmune neonatal, es un trastorno perinatal infrecuente, el cual consiste en el almacenamiento intra y extrahepático de hierro anormal, evitando el sistema reticuloendotelial. La causa no está clara, pero probablemente es producida por aloinmunización feto-materna dirigida contra el hígado fetal. Los recién nacidos son a menudo prematuros y / o pequeños para la edad gestacional. Se suele presentar en los primeros días o semanas de vida con una severa coagulopatía, niveles de aminotransferasas normales, ascitis y fallo multiorgánico asociado con la acumulación de hierro en tejidos extrahepáticos, incluyendo el páncreas, parótidas, y corazón. La terapia temprana con dosis altas de IgG intravenosa en combinación con exanguinotransfusión se ha asociado con una tasa de supervivencia del 75%, sin necesidad de TH.
La linfohistiocitosis hemofagocítica es una enfermedad infrecuente que implica la activación inapropiada de los macrófagos, puediéndose presentar como IHA neonatal. Puede ser primaria y familiar, o puede estar asociada con deficiencias inmunes. También puede presentarse luego de infecciones virales o bacterianas. El manejo inicial consiste en tratamiento quimioterápico, pero la supervivencia a largo plazo requiere de un trasplante de médula ósea. El TH está contraindicado debido a la recidiva de la enfermedad en el injerto.1, 4-7, 10-13
Niños mayores de 7 meses
Las causas más frecuentes son: IHA inducida por drogas, hepatitis autoinmune e infecciones virales. En un estudio multicéntrico pediátrico (período 1999-2008), del total de los pacientes con IHA, la hepatotoxicidad representó el 19%, principalmente debido a una sobredosis de acetaminofen o paracetamol. La hepatitis autoinmune y la hepatitis viral aguda representaron el 9 y 4% respectivamente, correspondiendo el 48% a causa indeterminada.
En la serie de Bicêtre (período 1986-2006), las principales causas fueron: inducida por virus (26%), metabólica (21%), por tóxicos (19%), autoinmune (5%) y causa indeterminada (25%).1-3
Drogas o IHA inducida por toxinas
Puede ocurrir como consecuencia de la sobredosis o como una reacción idiosincrásica a la dosis terapéutica de un medicamento. El paracetamol es la causa más frecuente de IHA en los niños que habitan países occidentales. La injuria hepatocitaria depende de la dosis administrada. Se describen dos formas clínicas de presentación, una aguda, intencional, y la segunda, denominada una «desventura terapéutica», que se refiere a la ingestión de múltiples dosis tomadas durante varios días, con intención de tratar síntomas clínicos tales como el dolor o la fiebre. Si se sospecha intoxicación por paracetamol, se deben determinar los niveles séricos del mismo y de sus metabolitos para confirmar su responsabilidad, con el objeto de iniciar tratamiento específico con N-acetilcisteína (NAC), el cual debe iniciarse sin demora y puede ser todavía útil 48 hs después de la ingestión.
Otros fármacos referidos como causa de IHA incluyen la amiodarona, isoniazida y anticonvulsivantes, como la fenitoína, carbamazepina y fenobarbital. Sin embargo, en una serie reciente de 113 casos de IHA por lesión hepática inducida por fármacos, más de 60 agentes individuales se vieron implicados, incluyendo muchos antimicrobianos (46%).
La lesión hepática inducida por toxina es poco común en niños y está principalmente relacionada con la ingestión de amatoxina, que es una hepatotoxina presente en diferentes especies de hongos silvestres, especialmente en la Amanita phalloides.1-5, 8-11
Hepatitis autoinmune
Se produce como resultado de una reacción inmune a los antígenos de las células hepáticas. Los pacientes se presentan con ictericia progresiva, encefalopatía y coagulopatía incorregible durante un período de 1-6 semanas. Cursan con presencia de anticuerpos séricos positivos (por ejemplo, anti-microsomas de hígado y riñón tipo 1 (anti-LKM1), también anticuerpos antinucleares (ANA), anticuerpo anti-músculo liso (SMA) y anti-citosol hepático tipo 1 (anti-LC1). La biopsia hepática en los niños con alteración de la coagulación al diagnóstico, está contraindicada, lo cual no debe retrasar el comienzo del tratamiento. El diagnóstico de hepatitis autoinmune es urgente porque el tratamiento con inmunosupresores (corticosteroides y otras drogas) antes de la aparición de la EH puede evitar la necesidad de un TH.7-13
Síndrome de activación macrofágica
Se puede asociar con IHA, pudiendo desarrollarse después de una infección viral o bacteriana tanto en pacientes normales como en inmunodeprimidos.
Inducida por virus
El virus de la hepatitis A es la causa más común en áreas donde la enfermedad es endémica. En Argentina, durante los años 1982–2002, de un total de 210 pacientes, el 61% correspondió al virus A. Luego de implementarse la vacunación universal al año de vida en el 2005, la IHA por este virus fue descendiendo hasta desaparecer desde el 2007. Es una causa infrecuente en América del Norte o Europa.
La IHA inducida por el virus de la hepatitis B puede ocurrir en el momento de una infección aguda, en el caso de una reactivación de una infección crónica o en la seroconversión de una hepatitis B con HBeAg a anti-HBe. Los niños nacidos de madres HBeAg negativos tienen un riesgo mayor y podrían presentar IHA en un plazo entre las 6 semanas y 9 meses de vida. La infección por el virus de la hepatitis C no ha sido registrada como causa de IHA en la edad pediátrica.
La hepatitis E se produce dentro de las áreas endémicas, como India y África.
Los miembros de la familia herpes virus como el citomegalovirus, el virus de Epstein-Baar, el virus varicela-zoster y el virus del herpes simple pueden provocar IHA, de ellos el herpes 1 y 2 es la causa predominante durante el primer mes de vida.
Entre otras causas virales se consideran los adenovirus, virus del herpes humano-6 y el parvovirus B19.1-4, 8-11
Causas metabólicas
La enfermedad de Wilson es actualmente la enfermedad metabólica vinculada más frecuentemente con la evolución a la IHA en niños y adolescentes. Las características bioquímicas incluyen la presencia de anemia hemolítica Coombs-negativa, coagulopatía, aumento moderado de los niveles de aminotransferasas séricas, bilirrubina sérica marcadamente elevada y nivel de fosfatasa alcalina sérica normal o bajo. La afectación tubular renal es frecuente con aminoaciduria, glucosuria, fosfaturia, uricosuria y acidosis tubular renal. Esta complicación es causada por el depósito de cobre en los túbulos renales proximales. El nivel de ceruloplasmina sérica se encuentra disminuido. El cobre en suero y la cupruria de 24 hs se encuentran incrementados. El diagnóstico puede realizarse con rapidez por un oftalmólogo con experiencia, cuando se observan los anillos de Kayser-Fleischer en el examen con lámpara de hendidura. El inicio de agentes quelantes del cobre puede evitar la necesidad de un TH, sin embargo, cuando la enfermedad de Wilson se asocia con EH, se considera que es letal sin trasplante.10-13
Causas vasculares
La IHA puede estar asociada con o ser secundaria a causas vasculares como el síndrome de Budd-Chiari, enfermedad venooclusiva, shock muy severo caracterizado por la presencia de necrosis centrolobulillar.10, 11
Enfermedades neoplásicas
Se puede presentar IHA en niños con linfomas, leucemias y con la linfohistiocitosis hemofagocítica, la cual tiene un mal pronóstico, representando una contraindicación para el TH.10-13
Patogenia
Si bien el proceso que determina la injuria hepática no es aún bien conocido, se señala como multifactorial y depende del balance entre:
- La susceptibilidad del huésped.
- La severidad y causa del daño hepático.
- La capacidad de regeneración hepática.
El paso inicial es la exposición de un individuo susceptible a un agente capaz por sí mismo de causar amplia injuria a las células del parénquima hepático o de inducir una respuesta por parte del huésped que ocasione dicha injuria. La susceptibilidad de un individuo está determinada por:
- La edad (por ejemplo, los neonatos son más susceptibles al virus herpes).
- El estado inmunológico.
- El polimorfismo bioquímico individual para generar susceptibilidad a la injuria por drogas.
La necrosis hepatocítica es en general extensa y el mecanismo por el cual ocurre se desconoce en la mayoría de los casos. Por ejemplo, la cascada de eventos que determinan necrosis en una hepatitis viral no ha sido aún determinada y por qué ello ocurre en algunos de los individuos expuestos mientras que en la mayoría es desconocido.
Disponemos de mayor información, en relación a lo que ocurre luego de la exposición a algunas toxinas hepáticas. Por ejemplo, el hongo Amanita phalloides determina muerte celular por acción de dos toxinas, una de ellas que altera la membrana celular y otra que inhibe la RNA polimerasa y la síntesis proteica.
En ciertas circunstancias poco frecuentes, es el daño funcional del hepatocito, sin necrosis, lo que determina la IHA. En estos casos, la histología revela hepatoesteatosis difusa, por ejemplo, en los desórdenes del metabolismo de los ácidos grasos, hígado graso del embarazo, etc.13-15
En la presentación aguda de la intolerancia hereditaria a la fructosa puede existir IHA funcional, siendo la necrosis más bien limitada. Los hepatocitos pueden presentar balonización y condensación de los elementos del citoplasma, pero ello puede revertirse eliminando la fructosa de la dieta.10-13
El huésped desempeña un rol importante si la injuria determina una IHA. La activación de las células de Kupffer participaría en este proceso, activándose por factores elaborados por los hepatocitos dañados (intrínsecos) y por endotoxinas circulantes (extrínsecos) probablemente originadas en el intestino y ser capaces de causar necrosis de los hepatocitos por la liberación de citoquinas, particularmente factor de necrosis tumoral α (TNF-α) e interleukina-6. Los cambios circulatorios e isquemia tisular que se producen, son capaces de ocasiona más injuria. La idiosincrasia del huésped juega un rol importante y probablemente determine el destino del sujeto. Se ha demostrado que el fenotipo del TNF-α se correlaciona con la evolución de los pacientes que consumen sobredosis de acetaminofén.10-15
Luego de la necrosis de los hepatocitos, el proceso de regeneración se concreta a través de varios factores: factor de crecimiento epidérmico, factor de crecimiento transformante-α y factor humano de crecimiento de hepatocitos. Los niveles circulantes de los factores de crecimiento dependen del tipo y grado de injuria hepática. Niveles más altos se ven en la IHA, estando mínimamente elevados en la hepatitis aguda y en la enfermedad hepática crónica. También circulan factores que inhiben la replicación celular y que parecen surgir de los hepatocitos necrosados. Teóricamente, del exceso de inhibición circulante resultaría una necrosis hepática “hiporregenerativa”. La persistencia del agente responsable puede perpetuar la injuria, extendiéndola hacia los hepatocitos regenerados.10-13, 16-19
Producida la injuria, existen 3 posibles desenlaces:
- Regeneración inadecuada para reparar el daño, desencadenándose entonces IHA terminal. Se desconoce cuál es la masa hepatocítica mínima para mantener las funciones vitales.
- Recuperación espontánea, ya sea por eliminación del agente o del efecto que el agente ocasiona. Si la injuria no fue muy severa, la regeneración hepática puede resultar en reparación y recuperación.
- El proceso puede quedar “suspendido” y determinar cronicidad. Éste parecería ser el caso en una pequeña proporción de pacientes con hepatitis B aguda severa.
En todo momento, sin embargo, el paciente puede presentar una complicación y fallecer o requerir un TH.
El entendimiento de la interrelación entre factores del huésped, predisposición genética, causas específicas de injuria hepática y el microambiente hepático no es bien conocido. El análisis adecuado de cada uno de estos factores podría responder el interrogante de por qué algunos pacientes sobreviven espontáneamente, finalizan el proceso de necrosis y tienen regeneración adecuada, mientras otros fallecen excepto que se les realice un TH.14-19
La severa injuria hepatocelular compromete las funciones metabólicas del hígado. Los pacientes ven afectada la homeostasis de la glucemia, hay incremento en la producción de ácido láctico, compromiso en la síntesis de factores de la coagulación, disminución de la capacidad para eliminar drogas, toxinas y bilirrubina. Como resultado ocurre hipoglucemia, acidosis y coagulopatía, todo lo cual incrementa el riesgo de sangrado gastrointestinal, EH y disfunción miocárdica. Las infecciones bacterianas y fúngicas frecuentemente complican la IHA.18-21
La falla multiorgánica ocurre con frecuencia en el desarrollo de la IHA y se atribuye a lesión microvascular. El inicio y la perpetuación de la injuria de los pequeños vasos está incompletamente comprendida y podría reflejar la compleja interacción entre varios factores como compromiso del clearence hepático de los mediadores de inflamación o el incremento en la polimerización de la actina. El rol de esta última ha sido propuesto recientemente. Cuando el hígado es lesionado, se liberan monómeros de actina desde los hepatocitos, que son rápidamente polimerizados a filamentos de actina. En situaciones de normalidad, la polimerización es prevenida por la gelsolina, una proteína que se encuentra en monocitos y plaquetas, y se une a la actina. Los filamentos de actina en la microcirculación podrían alterar el flujo sanguíneo o incluso obstruir los pequeños vasos. La función de protección frente a la liberación de actina está comprometida por depleción de la gelsolina, por lo que ocurre la polimerización, con el consiguiente compromiso de la microvascularización. El efecto clínico de esta cascada destructiva es el compromiso cardiovascular, con alteración en el intercambio de O2, síndrome de distress respiratorio agudo, disfunción renal y coagulación intravascular diseminada.10-14
Clínica
La presentación clínica depende de la etiología de la IHA. Habitualmente comienza con un episodio de hepatitis aguda en un niño previamente sano. En ocasiones, el notable aumento de transaminasas genera preocupación en el pediatra, sin embargo, durante los primeros días de la enfermedad no se evidencian signos que hagan sospechar la posible evolución hacia una IHA. Posteriormente, al transcurrir los días o semanas, el paciente suele presentar una evolución desfavorable, evidenciando los primeros signos y síntomas de EH. Los padres pueden notar la aparición de un estado letárgico, que marca la progresión evidente de la enfermedad. Al examen físico se presenta con intensa ictericia, el paciente puede estar somnoliento, confuso de acuerdo al grado de EH. El tamaño hepático puede estar aumentado, normal o disminuido, según el momento evolutivo de la enfermedad.
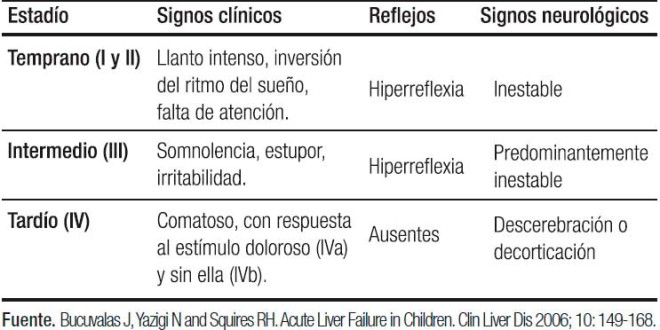
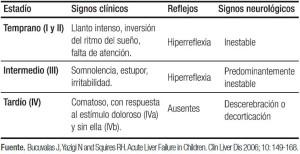
La existencia de ictericia y EH es variable, sin embargo, todos los pacientes presentan coagulopatía. La clasificación convencional en grados de EH (I a IV) es aplicada para diagnóstico en niños mayores y adultos, no siendo utilizada en neonatos. En este grupo etario, los signos de EH temprana consisten en llanto inconsolable y alteraciones del sueño, los cuales pueden progresar a somnolencia, irritabilidad, para pasar posteriormente al coma superficial y finalmente profundo. El GEFHAP estableció una escala para valorar EH en niños menores de 4 años (Tabla 1).1-4, 9-11, 22, 23
Tabla 1. Encefalopatía en niños menores de 4 años.
Diagnóstico
Ante un paciente pediátrico con IHA, el primer paso consiste en realizar una evaluación clínica y confirmar su existencia con las pruebas habituales de función hepática y de coagulación. Desde el punto de vista clínico, la enfermedad se presenta como una hepatitis aguda que va evolucionando en un período variable de tiempo, de acuerdo a la etiología y la edad del paciente. En su progresión se manifiesta como un síndrome clínico grave, expresado en el deterioro de la función hepática. En algunos niños puede poner al descubierto una enfermedad hepática crónica subyacente.
La pérdida de las funciones hepáticas incluye alteraciones de la homeostasis de la glucosa, de la coagulación, deficiencia inmunitaria innata y específica, disfunción hemodinámica e insuficiencia renal. Hay hipoglucemia, reducción de las proteínas procoagulantes (factores V, VII, X, y fibrinógeno) y anticoagulantes (anti-trombina, proteína C y proteína S), lo que determina el estado de coagulopatía.1-4, 10-13
Neonatos y niños menores de 7 meses
Los hallazgos clínicos en el recién nacido implican una agresion intrauterina como una infección congénita, hepatitis aloinmune neonatal o trastornos mitocondriales. La presentación posterior puede estar relacionada con una infección bacteriana o viral o una condición metabólica expresada por la introducción de ciertos alimentos (galactosemia, intolerancia hereditaria a la fructosa o tirosinemia tipo 1).
Una historia familiar detallada, que incluye información sobre la existencia de consanguinidad, abortos involuntarios, muertes neonatales y enfermedad hepática en hermanos, son antecedentes importantes a registrar.
Los síntomas tempranos son inespecíficos, a veces sólo relacionados con una alteración del estado general, rechazo del alimento, letargo, retardo del crecimiento y vómitos. La ictericia es inconstante, sobre todo cuando están involucradas algunas enfermedades metabólicas. La EH puede ser tardía y es particularmente difícil de diagnosticar en los recién nacidos. Cambios en el comportamiento, la irritabilidad y la inversión del ritmo del sueño indican EH. Las convulsiones pueden reflejar la presencia de meningoencefalitis o estar relacionadas con la existencia de hipoglucemia. La hepatomegalia está a menudo presente. En aquellos casos de enfermedades graves que progresan a la cirrosis, se pueden detectar esplenomegalia y ascitis. El diagnóstico de la IHA debe ser considerado en cualquier recién nacido con coagulopatía. La hipoglucemia y la hiperamonemia son comunes, aunque pueden estar relacionadas con la enfermedad subyacente. Las transaminasas elevadas por lo general son el resultado de necrosis hepatocitaria asociada a infecciones virales agudas, tóxicos o lesiones isquémicas. En enfermedades metabólicas puede observarse transaminasas normales a levemente elevadas e ictericia mínima a moderada.10-13, 22, 23
Niños mayores de 7 meses
En niños mayores, los síntomas y signos son similares a los de los adultos, aunque síntomas clásicos como asterixis, temblores y fetor hepático suelen estar ausentes. Por lo general, hay una fase prodrómica de malestar, náuseas y anorexia. Posteriormente se desarrolla ictericia progresiva. La presentación hemorrágica puede ocurrir de forma espontánea y se centra principalmente en el tracto digestivo. Como el hígado es fuente de factores coagulantes y anticoagulantes, la reducción balanceada de ambos explica el infrecuente sangrado clínicamente significativo en ausencia de infecciones o hipertensión portal. La hipoglucemia severa puede conducir a convulsiones. Un estudio en niños reportó un 25% de infección bacteriana, presentándose la mayoría a partir de la segunda semana de internación.1-4, 18-20
Exámenes complementarios
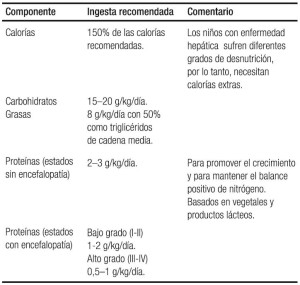
Los estudios de laboratorio son necesarios con urgencia e incluyen pruebas específicas hepáticas, pruebas para evaluar anormalidades hematológicas, renales y electrolíticas, y los estudios destinados a caracterizar las diferentes causas de IHA en los niños según la edad. La identificación temprana de la causa es de suma importancia porque, en algunos casos, puede ser revertida con la iniciación inmediata de terapias específicas, como en el caso de enfermedades metabólicas como galactosemia, fructosemia, tirosinemia, enfermedad de Wilson, hepatitis autoinmune o intoxicación por acetaminofén (Tabla 2).
Tabla 2. Evaluación del paciente con insuficiencia hepática aguda.
Tratamiento médico
- General
Nutrición y aporte de glucosa
En niños con IHA se debe prevenir la desnutrición. Para la evaluación nutricional, el índice de masa corporal para la edad es la prueba más precisa.28
La IHA es un estado catabólico caracterizado por un balance negativo de nitrógeno. La alimentación oral o por sonda nasogástrica o nasoduodenal es generalmente bien tolerada y debe comenzar lo más temprano posible. La vía enteral de alimentación es preferible porque es más fisiológica y está asociada con un menor riesgo de infecciones sistémicas severas. Si no hay signos de encefalopatía, no se aconseja la restricción proteica. Se prefiere indicar proteína de origen vegetal.10, 11, 24, 25
Las recomendaciones nutricionales en niños con IHA se presentan en el siguiente cuadro:
Es aconsejable la administración de glucosa a un flujo entre 4 y 6 mg/kg/min. En algunos pacientes es necesario colocar una vía venosa central para lograr este propósito. La importancia de estas medidas se refleja en el dato que muestra que la mortalidad en niños con glucosa sanguínea ≤ a 45 mg/dl es mayor que en aquellos con niveles superiores. La detección temprana y el apropiado tratamiento de esta complicación potencialmente tratable, pueden mejorar la evolución.10-13
Prevención y hemodinamia
La administración profiláctica de inhibidores de la bomba de protrones para la prevención de hemorragia gastrointestinal, es una indicación habitual.
Las drogas vasoactivas deberían utilizarse en los pacientes hipotensos, que no mejoran luego de la corrección adecuada de la volemia.
Los medicamentos que afectan el nivel de conciencia deben ser evitados ya que es importante la evaluación de la EH. Si la sedación es obligatoria, podría administrarse propofol 1-2 mg/kg.
La rifaximina es un antibiótico oral semisintético, no absorbible, derivado de la rifamicina y un análogo estructural de la rifampicina. Es activo contra los aerobios y los anaerobios Gram-positivos y Gram-negativos. Su uso ha sido aprobado recientemente para el tratamiento de la EH en pacientes adultos. Dosis 10-15 mg/kg/día y de 20-30 mg/kg/día en niños mayores y menores de 12 años respectivamente, han sido utilizadas para el tratamiento de la diarrea del viajero y la enfermedad infamatoria intestinal.10-13, 25-28
Monitorización
- Se deben controlar los signos vitales y la saturación de oxígeno en forma continua.
- Los gases en sangre arterial, electrolitos plasmáticos y glucemia deben efectuarse cada 12 ó 24 horas (más frecuente en el niño inestable), al igual que el tiempo de protrombina (TP), hasta que el paciente se estabiliza o se decida el TH.
- Se recomiendan cultivos de vigilancia bacteriana frecuentes (sangre, orina, pulmón y catéter).
- Se aconseja instalar una línea venosa central para medir presión venosa central, tomar muestras de sangre, administrar líquidos, medicamentos y productos sanguíneos.
- La monitorización de la presión intracraneana (PIC) por métodos invasivos es útil en casos seleccionados. Sin embargo, la colocación de los monitores conlleva asociado el riesgo de sangrado y existe poca experiencia reportada en pacientes pediátricos. Se la ha utilizado en niños con EH grados III y IV, que requerían intubación y ventilación mecánica. Las alteraciones de la hemostasia deberían ser corregidas antes del procedimiento. El monitoreo no invasivo del flujo arterial cerebral usando doppler transcraneal podría constituir una herramienta útil para la identificación de hipertensión intracraneana en manos experimentadas.10, 11, 20, 29, 30
Observación neurológica
La detección precoz de injuria neurológica en niños con IHA puede permitir intervenciones que eviten la progresión del daño y mejoren la evolución. Squires y col han reportado que los niños con alteraciones en el EEG, moderadas a severas al ingreso, tenían más probabilidades de requerir TH o fallecer. Estos hallazgos, de confirmarse, podrían ayudar a distinguir los pacientes con IHA con evolución más favorable.19, 22, 25
Alteraciones metabólicas
Suele ser necesaria la administración de fosfato, magnesio y potasio. La kaliuresis inadecuada y la hipokalemia consecuente son significativamente más frecuentes en pacientes con IHA y hepatitis viral durante la fase aguda de la enfermedad. La primera evaluación es la medición de la concentración de potasio en la orina. La fracción de excreción del potasio es una prueba sencilla para determinar el potasio urinario en una muestra de orina al azar y el gradiente transtubular de potasio es un marcador indirecto de la bioactividad de la aldosterona en la nefrona distal. Con estas dos determinaciones se pueden estimar las pérdidas urinarias de potasio. Es fundamental vigilar el volumen que se administra. El edema pulmonar es una complicación que suele ser subestimada. Se recomienda una restricción relativa de agua. La ingesta de líquidos debe limitarse a los dos tercios del mantenimiento normal.25, 30
Coagulopatía
Los pacientes con IHA desarrollan disfunción plaquetaria, hipofibrinogenemia y déficit de vitamina K. No se recomienda la corrección de rutina.
La indicación de plasma fresco congelado debe realizarse en pacientes con sangrado significativo, previa realización de procedimientos invasivos o en coagulopatía severa con RIN > 7, en dosis de 15-20 ml/kg cada 6 horas o infusión continua a 3-5 ml/kg/h. Se debe indicar Vitamina K1 en todos los niños con IHA, lentamente, no más de 1 mg/min al menos durante 3 días.
Los crioprecipitados pueden ser útiles en pacientes con hipofibrinogenemia severa < 100 mg/dl. El factor VIIa recombinante es beneficioso en pacientes que mantienen RIN prolongado a pesar de la administración de plasma fresco congelado y riesgo de sobrecarga de volumen, pero es una terapia de alto costo.
Indicar transfusión de plaquetas si el recuento es de 10.000-20.000/mm3 o si hay hemorragia significativa con recuento de plaquetas < 50.000/mm3. Un recuento de plaquetas de 50.000-70.000/mm3 se considera seguro para realizar un procedimiento invasivo.2, 3, 22, 25
N acetilcisteína
El uso indiscriminado de la NAC en todos los casos de IHF no se justifica. El estudio de Squires y col es el único que intenta investigar la utilidad de la NAC en IHA pediátrica no causada por acetaminofen. Son necesarios más estudios prospectivos para poder establecer el papel de la NAC en este contexto.25, 31-36
Hipotermia
Hipotermia moderada de 32º-34º C, es también eficiente para prevenir el edema y la hipertensión intracraneana.37, 38
Transporte
El niño con IHA se debe trasladar de un modo seguro y oportuno a una Unidad de Cuidados Intensivos Pediátricos (UCIP) en un centro de TH.
Si el niño presenta EH grado III o IV debe ser intubado para tener la vía aérea asegurada previo al traslado. El acceso vascular también debe ser garantizado. Se debe realizar el monitoreo continuo de la frecuencia cardíaca, el ritmo cardíaco, oximetría de pulso y presión arterial durante el transporte. Es conveniente disponer durante el traslado de drogas vasoactivas por si fuera necesaria su utilización.10, 11, 25
- Específico
Hepatitis aloinmune
El tratamiento prenatal con inmunoglobulina intravenosa 1 g/kg a las 14 semanas, 16 semanas y semanal desde las 18 semanas de gestación hasta el final de embarazo ha demostrado que previene su desarrollo en embarazos posteriores.
El tratamiento postnatal, basado previamente en el uso de anti-oxidantes y la terapia de quelación, ha sido reemplazado por exanguinotransfusiones de doble volemia para eliminar los anticuerpos y terapia de sustitución de inmunoglobulinas intravenosas 1 g/kg para bloquear la acción del anticuerpo e interferir con la activación del complemento.10, 11, 39
Galactosemia
Dieta libre de lactosa.40
Tirosinemia Tipo 1
Nitisinona 1 mg/kg/día por vía oral en dos dosis.
Restricción dietética de tirosina y fenilalanina.
Los pacientes que no responden a la nitisinona deben ser considerados para TH.10, 11, 25
Infección por herpes simple
Iniciar frente a la sospecha, tratamiento con aciclovir a dosis alta 60 mg/kg/d, intravenoso durante 21 días o hasta que la PCR se negativice. Es necesario documentar la PCR negativa al final de la terapia.10, 11
Linfohistiocitosis hemofagocítica
Administración de inmunoglobulina intravenosa (1 g/ kg) para detener la cascada inflamatoria. Se recomienda que en niños con IHA de etiología desconocida, con valores del receptor soluble de IL2 mayores a 5.000 U/ml, especialmente si se evidencia disregulación inmune (fiebre, exantema, citopenias), tratamiento empírico con corticoides EV a dosis de inmunosupresión, aún cuando no se reúnan los criterios establecidos para diagnóstico de esta entidad.23
Intoxicación por paracetamol
Debe indicarse NAC IV en forma rápida, 150 mg/kg durante 90 minutos en solución glucosada al 5%, continuando luego con 300 mg/kg/día durante 5 días. Realizar hidratación IV, agregar lactulosa 1,8 g/kg/día y una única dosis de vitamina K IV de 5 mg.
La administración de NAC previene el progreso de la necrosis hepática y evita el agotamiento del glutatión. El tiempo entre la ingestión del acetaminofen y el tratamiento con NAC es un factor importante en la prevención del progreso del daño hepático. En estudios multicéntricos, el uso del NAC dentro de las 16 a 24 hs evitó muertes relacionadas con la toxicidad del paracetamol. Otro estudio señala que su uso entre las 8 a 10 hs de la última ingesta del fármaco, sería más eficaz.25, 41-42
Enfermedad de Wilson
Se debe indicar D-penicilamina desde el diagnóstico, 9-15 mg/kg/día, hasta su recuperación o el TH. El MARS (Molecular Absorbent Regenerating System) puede ser usado efectivamente como puente hasta el TH.43-45
Intoxicación por Amanita phalloides
La amanita phalloides es la causa más común de intoxicación letal por hongos. El principal componente hepatotóxico de la misma es el alfa-amanitina, que induce la muerte celular después de inhibición de la síntesis de proteínas a nivel transcripcional.
El tratamiento conservador recomendado consiste en:
- Administrar carbón activado vegetal por vía oral.
- Silibinina 20 mg/kg/24 h IV.
- Penicilina G.
La desintoxicación precoz con plasmaféresis o diálisis con el MARS podrían evitar el TH.25, 31
Hepatopatía mitocondrial
La administración de coenzima Q10 podría ser de utilidad. El TH podría ser considerado en algunos casos seleccionados, con enfermedad hepática exclusiva.46
Manejo de las complicaciones
La pérdida de la función hepática lleva a un daño sistémico complejo, con alteraciones metabólicas, neurológicas, de la coagulación, hemodinámicas, deficiencia inmunitaria e insuficiencia renal, entre otros.
El tratamiento debe estar a cargo de un equipo multidisciplinario, que debe focalizarse en prevenir y tratar las complicaciones para minimizar la morbimortalidad.
El abordaje médico inicial es fundamental, tanto para revertir el cuadro, cuando esto es posible, como para referir al paciente estable y sin daños irreversibles a un centro de TH. Por esta razón, el tratamiento de estos pacientes debe realizarse en una institución que disponga de una UCIP experimentada en el tratamiento de estos pacientes, con disponibilidad para la realización de un eventual TH en el caso que lo requiera.10, 11, 25
Neurológicas
Las complicaciones neurológicas son las que con mayor frecuencia determinan la evolución de los pacientes. Su progresión es siempre un signo de gravedad: los niños que desarrollan EH severa tienen una sobrevida del 20% sin TH. Por ello, la monitorización continua del compromiso neurológico es fundamental para realizar una intervención temprana, con el fin de evitar daños irreversibles.
Los mecanismos que conducen al EC y la consecuente hipertensión endocraneana no están completamente entendidos, destacándose dos hipótesis posibles: la acción de la glutamina a nivel intracelular y la pérdida de regulación del flujo sanguíneo cerebral.
La hiperamoniemia juega un rol fundamental en el desarrollo de la EH. Niveles mayores de 200 uM/L son un fuerte predictor del desarrollo de hipertensión endocraneana. Hay dos vías principales para la metabolización del amonio: las síntesis de urea y de glutamina. En condiciones fisiológicas, el hígado es el órgano encargado de sintetizar urea a partir del amonio. El otro órgano que puede metabolizar el amonio es el cerebro, a través de su conversión a glutamina en los astrocitos. En la IHA, la disfunción del ciclo de la urea a nivel hepático provoca hiperamonemia con la consecuente acumulación de glutamina en los astrocitos, que se edematizan debido al efecto osmótico producido en el citoplasma.
La pérdida de la autorregulación de la circulación cerebral altera la perfusión, que aumenta o disminuye según la presión sanguínea, facilitando el ingreso de agua a nivel cerebral por diferencia de gradiente osmótico, con la consiguiente hipoxia cerebral. La liberación de citoquinas, producto de una respuesta inflamatoria sistémica contribuiría a la vasodilatación sistémica y al aumento de volumen de sangre intracraneal.
El EC debe ser agresivamente prevenido y tratado. Las siguientes terapéuticas pueden ser implementadas:
- Colocar al paciente en posición supina con una sobreelevación de la cabeza de 30º.
- Administración de manitol al 20% (0,5-1 g/kg) intravenoso (requiere monitoreo de PIC).
- Los bolos de cloruro de sodio hipertónico son cada vez más usados con eficacia similar a la del manitol.
Estudios recientes evidencian que la hipotermia puede ser eficaz, entre 32-34ºC, probablemente porque disminuye el gradiente de presión hidrostática transcapilar, reduciendo así la extracción del amonio por parte del cerebro y restaurando la autorregulación del flujo sanguíneo cerebral.
La hiperventilación proporciona una mejora rápida pero transitoria en la presión intracraneal, con la restauración de la autorregulación cerebral en pocos minutos. El objetivo de la hiperventilación es inducir hipocapnia que causa vasoconstricción cerebral, si bien existe la preocupación de que esto pueda agravar la hipoxia cerebral con la consiguiente isquemia, por lo que es recomendable una constante monitorización de la perfusión cerebral.
La administración continua de glucosa, sodio, potasio, magnesio y fosfato es necesaria para prevenir trastornos metabólicos que puedan agravar la EH. Restricción hídrica y bajos aportes proteicos (0,5-1gr/k/día) son recomendados con el fin de disminuir la volemia y la generación de amonio.
Los barbitúricos, por su efecto vasoconstrictor, pueden ser usados en la hipertensión endocraneana severa, que no responde a los tratamientos mencionados.19, 25, 37, 38
Coagulopatía
Es necesario ser cuidadoso con el volumen a administrar en caso de decidir una transfusión de sangre, no sólo por la hipervolemia que podría resultar, sino también por el aporte proteico, ya que ambos pueden desencadenar o agravar el EC. Las indicaciones precisas se deben analizar individualmente en cada caso.10, 11, 25
Insuficiencia renal
Una adecuada perfusión renal y evitar el uso de drogas nefrotóxicas son esenciales para mantener la función renal. La necrosis tubular aguda puede ser secundaria a diferentes complicaciones que se presentan en la IHA tales como hipotensión, sepsis y sangrado.
El síndrome hepatorrenal es otra de las causas responsables del fallo renal y es secundario a la activación de sustancias vasoconstrictoras en la circulación renal, lo que lleva al aumento de la resistencia vascular renal, con la consiguiente disminución del filtrado glomerular. Se manifiesta por una disminución en el volumen urinario, con una baja excreción de sodio y un aumento del índice de creatinina y osmolaridad urinaria.
La terlipresina puede mejorar la circulación renal por vasoconstricción de la circulación esplácnica, revirtiendo así, la activación endógena de los sistemas vasoconstrictores, especialmente cuando se la asocia con la administración de albúmina.
Cuando es necesario, las terapias continuas de reemplazo renal son preferibles a la hemodiálisis intermitente, debido a la inestabilidad hemodinámica que presentan los pacientes.10-13, 32
Complicaciones infecciosas
Las infecciones continúan siendo una de las principales causas de muerte de los pacientes con IHA. Esta predisposición a padecer infecciones se debe a múltiples factores como mala función de los leucocitos polimorfonucleares, alteración en las inmunidades celular y humoral, disminución de la opsonización, quimiotactismo y activación del complemento. Es por ello que la mayoría de los autores recomiendan un relevamiento infeccioso de rutina e iniciar tratamiento inmediato ante la sospecha de infección. Si bien no hay datos suficientes para el uso rutinario de tratamiento profiláctico, hay centros que lo realizan. Estos últimos utilizan antibióticos de amplio espectro como cefalosporinas de tercera generación, antifúngicos (fluconazol) y antivirales (aciclovir) por la frecuente infección con virus herpes, principalmente en el neonato.10, 11, 20, 25
Disturbios metabólicos e hidroelectrolíticos
Los trastornos metabólicos y electrolíticos son frecuentes en los pacientes con IHA. La necrosis de los hepatocitos produce una disminución del glucógeno disponible, lo que genera interferencia en la gluconeogénesis, dando como consecuencia la presencia de hipoglucemia. Es por ello que la infusión de glucosa (4-6 mg/k/min) es necesaria. La hiponatremia debe ser corregida, debido a que contribuye al edema cerebral. El fosfato, magnesio y potasio deben ser suplementados. La acidosis láctica secundaria a una perfusión tisular inadecuada por la hipotensión, con la consiguiente hipoxia, debe ser corregida. El estado hipercatabólico de estos pacientes obliga a una alimentación temprana. Si por alguna razón la vía enteral está contraindicada, debe iniciarse nutrición parenteral.25, 47
Falla cardiopulmonar
Es frecuente que la hipovolemia esté presente desde el comienzo de la IHA, pero debe realizarse una reposición cuidadosa de la misma. La vasoplejía con hipotensión o inestabilidad hemodinámica puede ocurrir a pesar de un adecuado aporte de volumen, pero generalmente responde bien a la administración de alfa adrenérgicos como la noradrenalina. Como suele observarse insuficiencia adrenal, los pacientes pueden beneficiarse con la administración de hidrocortisona, cuando ocurren trastornos hemodinámicos.
La disfunción miocárdica no es frecuente pero debe ser monitoreada con ecocardiograma. El edema pulmonar es una complicación habitualmente subestimada. El mismo tiene varios mecanismos: sobrecarga de volumen por una secreción inadecuada de hormona antidiurética, hiperaldosteronismo y una alteración en la ventilación/ perfusión pulmonar por pérdida del mecanismo de vasoconstricción vascular por hipoxia. Dicho mecanismo se altera por las sustancias vasodilatadoras que existen en la circulación sistémica (aumento de prostaglandinas y óxido nítrico). La insuficiencia respiratoria puede ser severa y requerir asistencia ventilatoria.10, 11, 25, 47-49
Otros tratamientos
La administración de lactulosa, antibióticos no absorbibles, la L-ornitina y L-aspartato tienen el objetivo de disminuir el aporte de amonio, pero no hay evidencias de su eficacia.25, 47, 49
Evaluación de la severidad de la enfermedad hepática
Pronóstico
A pesar de los avances terapéuticos, la IHA pediátrica resulta en muerte o TH en más del 45% de los casos. Representa el 10-13% de las causas que requieren TH de todos los centros pediátricos. En la era pre-TH, la sobrevida sin dicho procedimiento era del 29%; con la implementación de mejoras en los tratamientos de soporte y del TH, la misma aumentó al 31-36% en no trasplantados y al 55-60% en trasplantados. Las herramientas para determinar la evolución clínica y el requerimiento de un TH son limitadas. Se han desarrollado sistemas de puntuación que pueden resultar relevantes para propósitos epidemiológicos, pero la indicación de TH continúa dependiendo de la evaluación dinámica clínica y bioquímica del paciente. Las decisiones se basan en las causas etiológicas y la severidad de la IHA, la potencialidad de la regeneración hepática espontánea, la disponibilidad de una terapéutica que pueda revertir el cuadro y la presencia de comorbilidades, especialmente el riesgo de compromiso neurológico permanente.6, 8, 16, 17
El TH de emergencia debería ser considerado en un paciente con encefalopatía mayor a grado II, asociada a factor V < 20% o TP < 20% o RIN ≥ 2. Otros elementos a considerar son la disminución rápida del tamaño hepático, convulsiones, ascitis, síndrome hepatorrenal, niveles de fibrinógeno < 1g/L, bilirrubinemia > 400 μ mol/L (23 mg/dl), incremento progresivo del ácido láctico e hiperamoniemia > 150 μmol/L. El TH puede estar contraindicado hasta en un 11-20% de los pacientes con este síndrome. Las contraindicaciones para esta terapéutica son enfermedades malignas, síndrome de Reye, enfermedades de la cadena respiratoria mitocondrial con compromiso neurológico, la hipertensión endocraneana no controlada o el fallo multiorgánico. Por otro lado, los pacientes con posibilidad de recuperación espontánea o pasibles de terapias específicas no deberían ser colocados prematuramente en lista de emergencia para TH. Existen terapias temporarias de soporte hepático basadas en dispositivos extracorpóreos artificiales y bioartificiales, y el trasplante de hepatocitos como puentes hacia el TH o idealmente para evitarlo.24, 32, 43, 48-53
Una publicación reciente del grupo del King´s College mostró que el TP es el mejor predictor de sobrevida. El RIN máximo alcanzado durante el curso de la enfermedad fue el predictor más sensible, con un 73% de sobrevida de los niños que presentaban un RIN < 4 y el 16,6% entre aquellos con RIN > 4.53 El nivel de factor V < 25% se utiliza en Francia como parámetro para la inclusión en lista de TH.2-4, 51
Los niños menores de 1 año de vida, y en especial los menores de 3 meses de edad, representan un grupo particular que plantea desafíos importantes, debido a sus proporciones anatómicas, a la severidad de la enfermedad en el momento de la presentación y a las causas etiológicas. Un trabajo reciente mostró resultados sobre niños ≤ 90 días de vida con IHA, utilizando datos recolectados en el registro internacional, del GEIHAP. Las etiologías de la IHA en este grupo etario fueron: hemocromatosis neonatal (o hepatitis aloinmune neonatal), infecciones virales (predominando la infección herpética), enfermedades metabólicas, (galactosemia fue la más frecuente) y la etiología indeterminada, que se observó en el 38% de los pacientes. El análisis demostró que la edad de presentación de la IHA es un claro predictor de evolución. La sobrevida espontánea fue del 59,9%, menor que la observada en niños mayores, la cual fue del 79%. Sólo el 40% de este grupo de niños incluidos en lista para TH recibió un órgano versus el 66% de los niños mayores de esa edad, esta diferencia pudo haber reflejado la severidad de la enfermedad en los niños más pequeños, así como la escasez de órganos apropiados para esos receptores. Estos pacientes de menor edad requieren además hospitalizaciones más prolongadas post-TH, presentan alta tasa de reoperaciones por sangrado, sepsis y complicaciones de la herida quirúrgica y biliares, sin embargo, la sobrevida del TH (87,8%) y del injerto (76,1%) es similar a la obtenida en niños mayores.16, 17, 54, 55
Fue publicado un sistema de puntuación creado para predecir la sobrevida libre de TH en IHA pediátrica, utilizando una base de datos bioquímicos de un centro y validado en una segunda cohorte independiente de pacientes con IHA atendidos en ese mismo centro. El sistema fue denominado “Sistema de Score de Unidades de Injuria Hepática” (LIU), cuya fórmula es [3,584 x pico de bilirrubina total (mg/dL)] + [1,809 x pico de TP (seg.)] + [0,307 x pico de amonio (μmol/L)]. También fue calculado sustituyendo TP por RIN: [3,507 x pico de bilirrubina total] + [45,51 x pico RIN] + [0,254 x pico de amonio]. Asimismo, fue calculado el LIU en el momento de la admisión del paciente (aLIU), que si bien fue validado en un solo centro, no mostró un valor predictivo fuerte. Un estudio realizado posteriormente se planteó como objetivo determinar la eficacia predictiva de los scores LIU y aLIU en niños enrolados en la base de datos del GEIHAP. Se incluyeron durante el período 1999-2008, pacientes de hasta 17 años de edad, con IHA sin evidencias de enfermedad hepática crónica. Se registraron los datos en forma diaria durante los primeros 7 días desde la admisión y hasta los 21 días de evolución, hasta el TH o la muerte. Obtuvieron los siguientes resultados: fueron incluidos 709 pacientes, en 461 se calculó LIU y en 579 también aLIU. Al día 21 desde la admisión, el 50,3% de los pacientes estaban vivos sin TH, 36,2% fueron trasplantados y el 13,4% fallecieron sin TH. El score de LIU fue fuertemente predictivo de sobrevida libre de TH, mientras que el score de aLIU mostró una fuerza predictiva moderada; esto último puede reflejar el intervalo variable entre el comienzo de los síntomas, la admisión y el amplio espectro de severidad de la IHA. El score de LIU pareció predecir la eventualidad del TH mejor que el riesgo de muerte, a su vez, fue menos predictivo de la evolución en los niños menores de 6 meses de edad, aunque no se identificó una explicación para este hecho. Los autores concluyeron que los scores de LIU aportaron un modelo predictivo cuantitativo que podría contribuir a establecer criterios objetivos para ser utilizados en el proceso de decisión en relación a la indicación y el momento oportuno del TH. Destacaron que las manipulaciones terapéuticas, como la administración de plasma fresco, factor VII activado o plasmaféresis, pudieron alterar los parámentros del score e impactar artificialmente sobre su valor predictivo.56-58
La percepción de los modelos de pronóstico está fuertemente influenciada según su función sea concentrarse en el valor predictivo positivo (VPP) o negativo (VPN). El primero favorece al paciente individual, pero su apreciación equivocada se traduciría en realizar trasplantes innecesarios. Por otro lado, la preferencia por el VPN, minimizaría los trasplantes innecesarios, pero su tasa de error podría conducir a muertes potencialmente evitables. Los criterios del King’s College Hospital (KCH) descriptos en el año 1989, fueron los primeros en diferenciar entre la IHA inducida por paracetamol de otras causas. Presentan elevada especificidad (82% para IHA no-paracetamol y 92-95% para IHA por paracetamol) pero baja sensibilidad (69%).59-61
Criterios de severidad según el KCH (predictores de riesgo de muerte)
Criterio aislado:
- TP > 100s (RIN > 6,5).
O tres de los siguientes:
- Edad: < 10 ó > 40 años.
- Etiología: hepatitis no A no B, o hepatitis inducida por drogas.
- Duración de la ictericia hasta el comienzo de la EH > 7 días.
- TP > 50s (RIN > 3,5).
- Bilirrubina > 300 micromoles/L (17,5mg/dL).
El objetivo general de un reciente estudio prospectivo multicéntrico observacional fue validar el score realizado por el KCH en una cohorte de niños con IHA no causada por acetaminofén. El objetivo específico fue determinar si la redefinición de los parámetros utilizados por el KCH aumentaría la predicción de mortalidad de este modelo.
Participaron 20 sitios de TH: 17 de EE.UU., 1 de Canadá, 2 del Reino Unido. Los casos incluidos siguieron las pautas diagnósticas y terapéuticas de cada centro. Se registraron datos clínicos y de laboratorio diariamente, durante 7 días y medida de resultados a los 21 días.
Los criterios de inclusión fueron: niños desde el nacimiento hasta los 18 años, con IHA y sin evidencias de enfermedad hepática crónica previa. Los criterios de exclusión fueron pacientes con IHA secundaria a acetaminofén, dado que este grupo de pacientes tiene mejor sobrevida y en su mayoría no requiere de un TH, y los pacientes con TH previo, dado que el análisis original del KCH fue predecir la evolución natural a la muerte o a la recuperación de la IHA con hígado nativo. Fueron evaluados un total de 895 pacientes desde 1999 a 2009, de los cuales 784 cumplieron con los criterios de inclusión. La media de edad fue 2,7 años y 36,8% fueron menores de un año. Género masculino 52,3% y caucásicos 69%. El 43,1% correspondió a IHA de causa indeterminada. Fallecieron 110 pacientes (14%). Fueron trasplantados 262 (33,4%). A los 21 días de seguimiento 412 (52,6%) mejoraron sin trasplante. La cohorte de 522 pacientes resultante (110 + 412) sin TH, permitió medir la historia natural de la IHA no secundaria a acetaminofén, independiente del TH.59-61
Validación de los criterios de KCH
De los 522 pacientes, 163 (31,2%) reunieron los criterios del KCH y se pudo predecir la muerte por IHA no vinculada al acetaminofén, 286 (56,1%) no reunieron los criterios y en 70 (13,4%) los datos fueron insuficientes. En 132 pacientes no pudo medirse el tiempo transcurrido entre el inicio de la ictericia y la EH porque la información no fue registrada al momento de la admisión, o no había evidencias clínicas de la misma. De los 163 que reunían los criterios del KCH, 28 (17,1%) presentaron un RIN > 6,5; la media de edad fue de 1 año y el porcentaje de menores de un año fue mayor (49,7 vs 29,8%). No encontraron diferencias significativas en cuanto al sexo y etnia tanto en los que reunían los criterios del KCH como en los que no los reunían. De los que reunían los criterios, 54 (33,1%) murieron a los 21 días de evolución y 109 (66,9%) sobrevivieron. La sensibilidad y aplicabilidad de los criterios del KCH para esta cohorte fue menos significativa que en la original (61 vs 91%), pero en la especificidad no encontraron diferencias significativas (70 vs 90%). El VPP fue del 33% (pacientes que reunieron los criterios y murieron), pero el 88% de los que no reunieron los criterios sobrevivieron (VPN). El VPP fue menor que en la cohorte original (96%) y el VPN no se pudo comparar dado que en el trabajo original no fue evaluado.59-61
Redefinición de los parámetros de los criterios del KCH
Usaron análisis de regresión para medir pronóstico (sobrevida vs mortalidad) y optimizar los puntos de corte con respecto al trabajo original. Ese análisis está disponible en www.jpeds.com. Redefiniendo estos parámetros, el VPP pasó del 33% al 50% y el VPN de 88% a 92%.
En conclusión, este estudio mostró que los criterios del KCH tienen baja sensibilidad y bajo VPP para predecir la muerte en los niños con IHA no ocasionada por el acetaminofén. Es más probable que los niños que no los reúnan, presenten sobrevida espontánea a los 21 días de evolución. Depender de los criterios de KCH como VPP de muerte puede guiar a un TH innecesario. Estos hallazgos pueden ser útiles para determinar los pacientes que pueden sobrevivir, en los cuales se debe considerar continuar con las medidas de apoyo y no apresurar la decisión de un TH. La re-optimización de los valores de corte mejoró el VVP del 33 al 50% y el VPN al 92%. Este aumento del VPP implica que la mitad de los pacientes que reúnen los criterios corren el riesgo de recibir un TH innecesario.
Las diferencias importantes en los criterios del KCH aplicados en la población pediátrica, pueden explicarse por las siguientes eventualidades:
- La EH es difícil de medir en niños e incluso puede no ser evidente clínicamente durante la evolución de una IHA.
- Los criterios del KCH relacionan la etiología de la IHA con el pronóstico. La etiología del niño difiere enormemente de la del adulto. En este estudio, el 50% fue de causa indeterminada, por lo que es una variable independiente menos discriminativa.
- Ninguno de los 29 niños del estudio original fue menor de 1 año ni tuvo una IHA por causa metabólica.
Los autores compararon los resultados de esta cohorte con los resultados del trabajo de Ciocca y col donde también fueron aplicados los criterios del KCH para la IHA no debida a acetaminofén. Fue un trabajo retrospectivo de 210 pacientes donde el VPP y VPN fueron del 96% y 82% respectivamente para predecir mortalidad, siendo los VPP y VPN del 95% y 82% respectivamente para indicar un TH. Los autores explicaron estas diferencias en los resultados por la etiología de las IHA, donde predominó como causa etiológica la hepatitis A, mientras que en esta cohorte fue en su mayoría de causa indeterminada. Ellos argumentaron que esta diferencia fue importante porque entre las causas indeterminadas, las etiologías que quedaron sin tratamiento pudieron ser múltiples, en cambio, en hepatitis A hay una única causa responsable. El trabajo de Ciocca excluyó los menores de un año y en esta cohorte el 27,4% fueron menores de un año. Con esta exclusión se eliminaron causas propias de ese grupo etario como son las IHA secundarias a errores del metabolismo.8, 61
Las limitaciones de este estudio son las siguientes:
- Los datos recogidos fueron los del momento de entrada al estudio y no los de la admisión.
- Las medidas de soporte, como la administración de vitamina K o el plasma fresco, pudieron haber mejorado los parámetros.
- La dependencia de variables tales como la EH y la presencia de ictericia se basaron en datos subjetivos del médico que los asistía, así como la incorporación del TP que pudo variar entre los diferentes centros.
En resumen, se plantea como necesario un modelo confiable para determinar el pronóstico de la IHA pediátrica no inducida por acetaminofén. Los criterios del KCH fueron de utilidad para predecir sobrevida, tanto en el trabajo original como en la cohorte con nuevos puntos de corte. Sin embargo, no podrían ser usados para predecir muerte, ya que conduciría a la realización de más TH de los realmente necesarios. Redefiniendo los criterios, mejoró el VPP y el TH pudo no ser necesario en la mitad de los pacientes que reunieron dichos criterios.
Los autores recomiendan realizar investigaciones con la incorporación de un conjunto de parámetros dinámicos en modelos futuros, para predecir sobrevida y mortalidad.
Este trabajo es relevante porque demostró que en la edad pediátrica los criterios del KCH no son confiables para predecir muerte y que en los pacientes que reúnen los criterios originales se puede incurrir en una sobreindicación del TH.8, 22, 59-61
Medidas de sostén
Como ya se ha dicho, la IHA es una enfermedad multisistémica con un curso impredecible. La mortalidad es predominantemente precipitada por una EH progresiva, infecciones y fallo multiorgánico; por lo tanto, los esfuerzos deben dirigirse hacia el manejo de estas condiciones mientras se espera la recuperación de la función hepática o el TH.
Soporte artificial
El objetivo es eliminar las toxinas que se producen, o no son metabolizadas por el hígado, para estabilizar al paciente, dando tiempo hasta la obtención de un órgano o permitir la espontánea regeneración del hígado nativo. Las técnicas de soporte hepático son hígados bioartificiales utilizando hepatocitos o sistemas de desintoxicación no biológicos, tales como la diálisis con albúmina (MARS®) o la separación fraccionada del plasma y la adsorción con el sistema Prometheus (Fresenius, BadHomburg, Alemania).
Actualmente existen: sistema de recirculación de absorbentes moleculares (MARS), diálisis con intercambio de plasma (PE) y hemodiálisis (HD) en niños con IHA.
Se ha incrementado el uso de las terapias de soporte hepático extracorpóreo, pero los estudios son de pequeños grupos. Se ha reportado eficacia superior del PE/ HD con respecto a la eliminación de toxinas unidas a la albúmina y solubles en agua en relación al MARS. El mejor sistema de soporte artificial para neuroprotección de niños con IHA es aún tema de controversia.25, 32, 43, 55, 62-64
Mars
El sistema MARS puede ser atractivo en niños mayores y adolescentes, pero deben realizarse modificaciones para adaptarlo a niños pequeños. Los estudios actuales no permiten extraer conclusiones definitivas acerca de la utilidad del MARS para mejorar el pronóstico neurológico de pacientes pediátricos con IHA.
El sistema de soporte extracorpóreo en niños con IHA no está suficientemente evaluado. Estudios controlados aleatorizados, realizados en adultos, han demostrado mejoría de la colestasis, hipertensión portal, estabilidad hemodinámica y EH, pero no un beneficio consistente en la sobrevida de los pacientes. Estos estudios se ven obstaculizados por el bajo número de pacientes y la heterogeneidad de la etiología en pediatría. Aun así, teniendo en cuenta la buena tolerabilidad clínica, acumulando experiencia clínica y la creciente evidencia de los beneficios con respecto a un número de importantes complicaciones de la IHA, parece justificado el uso de sistemas de apoyo extracorpóreo hepático en niños. Otros reportes clínicos apoyan el uso de MARS en niños con prurito intratable y coagulación levemente deteriorada. En los casos con reducida síntesis hepática, atrapamiento esplénico de plaquetas y depleción de factores de coagulación con sangrado, los riesgos de sangrado adicionales asociados al MARS y la necesidad de sustitución de plasma, argumentan a favor de la utilización combinada de plasmaféresis y hemodiálisis. Debido a la baja incidencia de IHA en niños, la realización de ensayos aleatorios prospectivos es improbable en el futuro próximo.25, 43, 51, 62, 63
Plasmaféresis
Remueve toxinas, disminuye los niveles de amonio del plasma y mejora la EH, generalmente en horas. El flujo sanguíneo y la presión de perfusión cerebral mejoran. El efecto de la plasmaféresis en la sobrevida de IHA, ha sido difícil de determinar.25, 63, 64
Trasplante hepático
El advenimiento del trasplante ha constituido el avance más significativo en el tratamiento de la IHA.
Como se ha dicho, sin embargo, la disponibilidad de esta herramienta supone una enorme presión para el equipo tratante, generando una de las situaciones más difíciles de resolver: con escaso margen de error y en breve tiempo, ofrecer oportunamente el órgano a quien se beneficiará con el TH y evitar trasplantar a quien podría recuperarse con tratamiento médico exclusivo.
De acuerdo a datos de la base SPLIT (Grupo de Estudio para el Trasplante Hepático Pediátrico), la indicación de trasplante por IHA comprende el 13% del total entre los pacientes menores de 18 años, con una sobrevida anual del 75%, algo inferior a lo publicados para otras etiologías. La falla multiorgánica descripta anteriormente y la mayor tendencia a utilizar donantes marginales, podrían explicar esta diferencia, que ha sido reducida en series más recientes.
Frente al paciente con IHA, el proceso diagnóstico que se pone en marcha es doble, buscando por un lado evaluar la capacidad residual funcional del hígado y tratando, por el otro, de establecer la etiología, cuya identificación podría abrir la oportunidad de un tratamiento específico. Sin embargo, esto en ningún caso debería demorar la derivación a un centro de referencia con capacidad para realizar el trasplante, dado que el paciente en IHA presenta una evolución impredecible.6, 51, 65-71
Las causas infecciosas y tóxico-metabólicas son las reportadas con mayor frecuencia entre los menores de 18 años. Sin embargo, en la mayoría de las series publicadas la categoría “indeterminada” es la más prevalente. Esto podría permitir un efecto continuo del agente “desconocido” en el postoperatorio, incrementando potencialmente la morbilidad. La aplasia medular que se ha descripto en algunos pacientes post-trasplante hepático podría ser un buen ejemplo de lo anterior.1-5, 22
En los últimos años, una tendencia creciente a optimizar el tratamiento médico ha logrado evitar el trasplante en situaciones antes consideradas como indicaciones típicas tales como la enfermedad de Wilson o la hepatitis autoinmune de presentación fulminante. Esto refuerza la idea de poner en marcha todos los recursos disponibles a fin de establecer la etiología de la IHA.22, 53-55, 72-74
El tiempo de permanencia en lista de espera ha sido consignado como factor de mal pronóstico, haciendo atractiva la posibilidad de utilizar un donante vivo para proceder inmediatamente con el TH. Los resultados publicados en las diferentes series disponibles son muy alentadores, comparables a los obtenidos con donante cadavérico, y la mayoría de los grandes centros lo acepta como alternativa. Sin embargo, existen consideraciones éticas insoslayables en el abordaje de esta situación debido a la presión que pueden experimentar los potenciales donantes. La disponibilidad “inmediata” del órgano de un donante vivo, por otra parte, puede volcar la decisión a favor de trasplantar pacientes que podrían recuperarse con tratamiento médico, especialmente teniendo en cuenta las dificultades predictivas de los scores actuales, como fuera discutido anteriormente. Por todos estos motivos, el TH con donante vivo relacionado en el contexto de la IHA debe ser analizado cuidadosamente caso por caso.
Los niños pequeños constituyen un reto particularmente complejo. Las dificultades técnicas aumentan tanto en relación al tamaño relativamente grande del injerto, como al pequeño calibre de las anastomosis que se realizan. El desarrollo de técnicas como la “hiperreducción” o el trasplante de monosegmentos permite adaptar la mayoría de los implantes aún en los receptores más pequeños, aunque con resultados algo inferiores en comparación a niños de mayor edad y tamaño. Datos sobre una serie de 15 lactantes con etiología desconocida trasplantados por IHA ilustran cabalmente este concepto: con una sobrevida de sólo el 26% a 5 años, se presentaron complicaciones quirúrgicas en 8 de los pacientes. Curiosamente, la principal causa de muerte fue el rechazo agudo centrolobular, lo que demuestra que aún es incompleto nuestro conocimiento en este contexto tan particular.75, 76
El TH auxiliar es una técnica reportada ocasionalmente. Su atractivo reside en que permite superar el evento agudo sin ablacionar el órgano nativo, otorgándole tiempo suficiente para regenerarse y retomar la función. Una vez alcanzado el punto crítico, la inmunosupresión puede retirarse sin consecuencias para el paciente. La elección correcta del candidato y la atención cuidadosa de los aspectos técnicos de este complejo procedimiento son imprescindibles para alcanzar resultados satisfactorios.
En resumen, el TH ortotópico constituye el avance más significativo en el tratamiento de la IHA. La disponibilidad de esta poderosa herramienta terapéutica obliga a realizar todos los esfuerzos posibles para ofrecerlo en forma oportuna sólo a aquellos pacientes que lo necesitan. Los progresos logrados con el tratamiento de algunas enfermedades permiten actualmente evitar el trasplante en indicaciones que anteriormente se consideraban absolutas. La cuidadosa selección de los candidatos y el desarrollo de nuevas técnicas quirúrgicas, permiten resultados actuales de sobrevida a un año, superiores al 80%.55, 75- 77
Conclusiones
- La IHA es una enfermedad muy grave, multisistémica, que requiere un abordaje multidisciplinario.
- La hepatitis indeterminada es actualmente la causa más frecuente en el mundo.
- Hoy el TH es la única opción terapéutica eficaz.
- Futuros esfuerzos deben estar destinados a encontrar:
- Modelos pronósticos más adecuados.
- Tratamientos de sostén más efectivos.
- Identificar la causa de la hepatitis indeterminada y su eventual tratamiento.
Referencias
- Narkewicz MR, Dell Olio D, Karpen SJ, Murray KF, Schwarz K, Yazigi N, Zhang S, Belle SH, Squires RH; Pediatric Acute Liver Failure Study Group. Pattern of diagnostic evaluation for the causes of pediatric acute liver failure: an opportunity for quality improvement. J Pediatr 2009; 155: 801-806.
- Devictor D, Tissieres P, Afanetti M, Debray D. Acute liver failure in children. Clin Res Hepatol and Gastroenterol 2011; 35: 430-437.
- Devictor D, Tissieres P, Durand P, Chevret L, Debray D. Acute liver failure in neonates, infants and children. Expert Rev Gastroenterol Hepatol 2011; 717-729.
- Kaur S, Kumar P, Kumar V, Sarin SK, Kumar A. Etiology and prognostic factors of acute liver failure in children. Indian Pediatrics 2013; 50: 677-679.
- Rajanayagam J, Coman D, Cartwright D, Lewindon PJ. Pediatric acute liver failure: etiology, outcomes, and the role of serial pediatric end-stage liver disease scores. Pediatric transplantation 2013; 17: 362-368.
- Oh SH, Kim KM, Kim DY, Kim Y, Song SM, Lee YJ, Park SJ, Yoon CH, Ko GY, Sung KB, Hwang GS, Choi KT, Yu E, Song GW, Ha TY, Moon DB, Ahn CS, Kim KH, Hwang S, Park KM, Lee YJ, Lee SG. Improved outcomes in liver transplantation in chidren with acute liver failure. J Pediatr Gastroenterol Nutr 2014; 58: 68–73.
- Balistreri W. Acute liver failure-we don´t know or we didn´t look? J Pediatr 2014; 164: 679.
- Ciocca M, Ramonet M, Cuarterolo M, López S, Cernadas C, Álvarez F. Prognostics factors in paediatric acute liver failure. Arch Dis Child 2008; 93: 48-51.
- Sartorelli MR, Comparola D, Nobili V. Acute liver failure and pediatric ALF: strategic help for the pediatric hepatologist. J Pediatr 2009; 156: 342.
- Whittington P, Alonso EM. Fulminant hepatitis and acute liver failure. In Disease of de liver and biliary system in children. Edited by Deidre A. Kelly. 2nd edition, 2004; 107-126.
- Alonso EM, Squires R, Whittington P. Acute liver failure in children. In Liver Disease in children. Edited by F Suchy, R Sokol, W Balistreri. 3rd edition, 2007; 71-96.
- Thao N, Nguyen T, Vierling JM. Acute liver failure. Curr Opin in Organ Transpt 2011; 16; 289-296.
- Bucuvalas J, Yazigi N, Squires R Jr. Acute liver failure in children. Clin Liver Dis 2006; 10: 149-168.
- Azhar N, Ziraldo C, Barclay D, Rudnick DA, Squires RH, Vodovotz Y; Pediatric Acute Liver Failure Study Group. Analysis of serum inflamatory mediators identifies unique dynamic networks associated with death and spontaneous survival in pediatric acute liver failure Group. PLoS One 2013; 8: e78202.
- Rajanayagam J, Frank E, Shepherd RW, Lewindon PJ. Artificial neural network is highly predictive of outcome in paediatric acute liver failure. Pediatr Transplant 2013; 17: 535-542.
- Lu BR, Zhang S, Narkewicz MR, Belle SH, Squires RH, Sokol RJ; Pediatric Acute Liver Failure Study Group. Evaluation of the Liver Injury Unit Scoring System to Predict Survival in a Multinational Study of Pediatric Acute Liver Failure. J Pediatr 2013; 162: 1010-1016.
- Sundaram V, Shneider BL, Dhawan A, Ng e S, Squires RH. King’s College Hospital Criteria for non-acetaminophen induced acute liver failure in an international cohort of children. J Pediatr 2013; 162: 319-323.
- Di Paola F, Grimley M, Bucuvalas. Pediatric acute liver failure and immune dysregulation. J Pediatr 2014; 164: 407-409.
- Squires R. Expanded neurologic assessment in pediatric acute liver failure: an important initial step. J Pediatr Gastroenterol Nutr 2014; 58: 394-395.
- Godbole G, Shanmugam N, Dhawan A, Verma A. Infectious complications in pediatric acute liver failure. J Pediatr Gastroenterol Nutr 2011; 53: 320-325.
- Srivastava A, Yadav SK, Borkar VV, Yadav A, Yachha SK, Thomas MA, Rathore RK, Pandey CM, Gupta RK. Serial Evaluation of Children with ALF with Advanced MRI, Serum Proinflammatory Cytokines, Thiamine, and Cognition Assessment. J Pediar Gastroenterol Nutr 2012; 55: 580-586.
- Squires RH Jr, Shneider BL, Bucuvalas J, Alonso E, Sokol RJ, Narkewicz MR, Dhawan A, Rosenthal P, Rodriguez-Baez N, Murray KF, Horslen S, Martin G, James Lopez, Soriano H, Mc Guire B, Jonas MM, Yazigi N, Shepherd RW, Schwarz K, Lobritto S, Thomas DW, Lavine JE, Karpen S, Ng V, Kelly D, Simonds N, and Hynan LS. Acute Liver Failure in Children: the first 348 patients in the Pediatric Acute Liver Failure Study Group. J Pediatr 2006; 148: 652-658.
- Ryu JM, Kim KM, Oh SH, Koh KN, Im HJ, Park CJ, Chi HS, Seo JJ. Differential clinical characteristics of acute liver failure caused by hemophagocytic lymphohistiocytosis in children. Pediatr Int 2013; 55: 748-752.
- Shanmugam NP, Dhawan A. Selection criteria for liver transplantation in paediatric acute liver failure: The saga continues. Pediatr Transplant 2011; 15: 5-6.
- Bhatia V, Bavdekar A, Yachha SK. Management of acute liver failure in infants and children: consensus statement of the pediatric gastroenterology chapter, Indian Academy of Pediatrics. Indian Pediatr 2013; 50: v477-v482.
- Iadevaia MD, Prete AD, Cesaro C, Gaeta L, Zulli C, Loguercio C. Rifaximin in the treatment of hepatic encephalopathy. Hepat Med 2011; 3: 109-117.
- Malla I, Torres Cerino V, Villa A, Cheang Y, Giacove G, Pedreira A, Silva M. Rifaximin for hepatic encephalopathy in children. Case report. Arch Argent Pediatr 2011; 109: 113-115.
- Bass NM, Mullen KD, Sanyal A, Poordad F, Neff G, Leevy CB, Sigal S, Sheikh MY, Beavers K, Frederick T, Teperman L, Hillebrand D, Huang S, Merchant K, Shaw A, Bortey E, Forbes WP. Rifaximin Treatment in Hepatic Encephalopathy. N Engl J Med 2010; 362: 1071-1081.
- Kamat P, Kunde S, Vos M, Vats A, Gupta N, Heffron T, Romero R, Fortenberry JD. Invasive intracranial pressure monitoring is a useful adjunct in the management of severe hepatic encephalopathy associated with pediatric acute liver failure. Pediatr Crit Care Med 2012; 13: e33-e38.
- Bhatia V, Dhawan A, Arora NK, Mathur P, Das MK, Irshad M. Urinary potassium loss in children with acute liver failure and acute viral hepatitis. J Pediatr Gastroenterol Nutr 2013; 57: 102-108.
- Grabhorn E, Nielsen D, Hillebrand G, Brinkert F, Herden U, Fischer L, Ganschow R. Successful outcome of severe Amanita phalloides poisoning in children. Pediatr Transplantat 2013; 17: 550-555.
- Schaefer B, Schaefer F, Engelmann G, Meyburg J, Heckert KH, Zorn M, Schmitt CP. Comparison of Molecular Adsorbents Recirculating System (MARS) dialysis with combined plasma exchange and haemodialysis in children with acute liver failure. Nephrol Dial Transplant 2011; 26: 3633-3639.
- Bourgoin P, Merouani A, Phan V, Litalien C, Lallier M, Alvarez F, Jouvet P. Molecular Absorbent Recirculating System therapy (MARS®) in pediatric acute liver failure: a single center experience. Pediatr Nephrol 2014; 29: 901-908.
- Hadzic N, Dhawan A. Steroids in Acute Liver Failure? J Pediatr 2014; 165: 211-212.
- Squires RH, Dhawan A, Alonso E, Narkewicz MR, Shneider BL, Rodriguez-Baez N, Olio DD, Karpen S, Bucuvalas J, Lobritto S, Rand E, Rosenthal P, Horslen S, Ng V, Subbarao G, Kerkar N, Rudnick D, Lopez MJ, Schwarz K, Romero R, Elisofon S, Doo E, Robuck PR, Lawlor S, Belle SH; Pediatric Acute Liver Failure Study Group. Intravenous N-acetylcysteine in pediatric patients with nonacetaminophen acute liver failure: A placebo-controlled clinical trial. Hepatology 2013; 57: 1542-1549.
- Sharma M, Verma N. N-acetylcysteine in non-acetaminophen pediatric acute liver failure: recent evidence. Indian Pediatr 2013; 50: 972.
- Hansen G, Grimason M, Collins JW, Wainwright MS. Selective head cooling for the treatment of neurologic complications of acute liver failure in a newborn with disseminated herpes infection. Springerplus 2013; 29: 2: 572.
- Castillo L, Pérez C, Ruiz C, Bugedo G, Hernández G, Martínez J, Jarufe N, Pérez R, Mellado P, Domínguez P. Intravascular hypothermia for the management of intracranial hypertension in acute liver failure: case report. Rev Med Chil 2009; 137: 801-806.
- Lopriore E, Mearin ML, Oepkes D, Devlieger R, Whitington PF. Neonatal hemochromatosis: management, outcome, and prevention. Prenat Diagn 2013; 33: 1221-1225.
- Kundak AA, Zenciroğlu A, Yaralı N, Saygılı Karagöl B, Dursun A, Gökçe S, Karadağ N, Okumuş N. An unusual presentation of galactosemia: hemophagocytic lymphohistiocytosis. Turk J Haematol 2012; 29: 401-404.
- Savino F, Lupica MM, Tarasco V, Locatelli E, Garazzino S, Tovo PA. Fulminant hepatitis after 10 days of acetaminophen treatment at recommended dosage in an infant. Pediatric 2011; 127: e494-e497.
- Örün E, Polat A, Andan H, Cizmeci N, Tufan N. Incorrect Prescription of Intravenous Paracetamol in a Pediatric Patient. Hippokratia 2013; 17: 77-78.
- Rustom N, Bost M, Cour-Andlauer F, Lachaux A, Brunet AS, Boillot O, Bordet F, Valla F, Richard N, Javouhey E. Effects of molecular adsorbents recirculation system treatment in children with acute liver failure caused by Wilson disease. J Pediatr Gastroenterol Nutr 2014; 58: 160-164.
- Kumar V. Plasma Exchange for Hemolytic Crisis and Acute Liver Failure in Wilson Disease. Indian J Pediatr 2014; 81: 633.
- Verma N, Lodha R. Plasma Exchange for Hemolytic Crisis and Acute Liver Failure in Wilson Disease: Authors’ Reply. Indian J Pediatr 2014; 81: 634.
- Lee WS, Sokol RJ. Mitochondrial hepatopathies: advances in genetics, therapeutic approaches, and outcomes. J Pediatr 2013; 163: 942-948.
- Sundaram V, Shaikh OS. Acute Liver Failure: Current Practice and Recent Advances. Gastroenterol Clin North Am 2011; 40: 523-539.
- D’Agostino D, Diaz S, Sanchez MC, Boldrini G. Management and prognosis of acute liver failure in children. Curr Gastroenterol Rep 2012; 14: 262-269.
- Dhawan A. Acute liver failure in children and adolescents. Clin Res Hepatol Gastroenterol 2012; 36: 278-283.
- Hussain E, Grimason M, Goldstein J, Smith CM, Alonso E, Whitington PF, Wainwright MS. EEG abnormalities are associated with increased risk of transplant or poor outcome in children with acute liver failure. J Pediatr Gastroenterol Nutr 2014; 58: 449-456.
- Devictor D, Desplanques L, Debray D, Ozier Y, Dubousset AM, Valayer J, Houssin D, Bernard O, Huault G. Emergency liver transplantation for fulminant liver failure in infants and children. Hepatology 1992; 16: 1156-1162.
- Dhawan A. Etiology and Prognosis of Acute Liver Failure in Children. Liver Transplantation 2008; 14: S80-S84.
- Bhaduri BR, Mieli-Vergani G. Fulminant hepatic failure: pediatric aspects. Semin Liver Dis 1996; 16: 349-355.
- Sundaram S, Alonso E, Narkewicz M, Zhang S, Squires RH; Pediatric Acute Liver Failure Study Group. Characterization and Outcomes of Young Infants with Acute Liver Failure. J Pediatr 2011; 159: 813-818.
- Sundaram S, Alonso E, Anand R. Outcomes after liver transplantation in young infants. J Pediatr Gastroenterol Nutr 2008; 47: 486-492.
- Liu E, MacKenzie T, Dobyns EL, Parikh CR, Karrer FM, Narkewicz MR, Sokol RJ. Characterization of acute liver failure and development of a continuous risk of death staging system in children. J Hepatol 2006; 44: 134-141.
- Lu BR, Gralla J, Liu E, Dobyns EL, Narkewicz MR, Sokol RJ. Evaluation of a scoring system for assessing prognosis in pediatric acute liver failure. Clin Gastrohepatol 2008; 6: 1140-1145.
- Lu BR, Zhang S, Narkewicz M, Belle SH, Squires RH, Sokol RJ, and on behalf of the Pediatric Acute Liver Failure Study Group. Evaluation of the Liver Injury Unit Scoring System to Predict Survival in a Multinational Study of Pediatric Acute Liver Failure. J Pediatr 2013; 162: 1010-1016.
- O’Grady JG. Timing and benefit of liver transplantation in acute liver failure. Journal of Hepatology 2014; 60: 663-670.
- O’Grady JG, Alexander GJ, Hallyar KM, Williams R. Early indicators of prognosis in fulminant hepatic failure. Gastroenterology 1989; 97: 439-445.
- Sundaram V, Shneider B, Dhawan A Ng VL, Im K, Belle S, Squires RH. King’s College Hospital Criteria for Non-Acetaminophen Induced Acute Liver Failure in an International Cohort of Children. J Pediatr 2013; 162: 319-323.
- Bhatia V, Lodha R. Intensive care management of children with acute liver failure. Indian J Pediatr 2010; 77: 1288-1295.
- Schaefer B, Schmitt CP. The role of molecular adsorbent recirculating system dialysis for extracorporeal liver support in children. Pediatr Nephrol 2013; 28: 1763-1769.
- Lee WM, Squires RH Jr, Nyberg SL, Doo E, Hoofnagle JH. Acute Liver Failure: Summary of a Workshop. Hepatology 2008; 47: 1401-1415.
- Baliga P, Alvarez S, Lindblad A, Zeng L; Studies of Pediatric Liver Transplantation Research Group. Posttransplant survival in pediatric fulminant hepatic failure: the SPLIT experience. Liver Transpl 2004; 10: 1364-1371.
- Strauss A, Grabhorn E, Sornsakrin M, Briem-Richter A, Fischer L, Nashan B, Ganschow R. Liver transplantation for fulminant hepatic failure in infancy: a single center experience. Pediatr Transplant 2009; 13: 838-842.
- Heffron T, Pillen T, Smallwood G, Rodriguez J, Sekar S, Henry S, Vos M, Casper K, Gupta NA, Fasola CG, Romero R. Liver transplantation for acute liver failure at a single center: a 10-yer experience. Pediatr Transplant 2010; 14: 228-232.
- Miloh T, Kerkar N, Parkar S, Emre S, Annunziato R, Mendez C, Arnon R, Suchy F, Rodriguez-Laiz G, Del Rio Martin J, Sturdevant M, Iyer K. Improved outcomes in pediatric liver transplantation for acute liver failure. Pediatr Transplant 2010: 14; 863-869.
- Uribe M, Alba A, Hunter B, Valverde C, Godoy J, Ferrario M, Buckel E, Cavallieri S, Rebolledo R, Herzog C, Calabrán L, Flores L, Soto P. Chilean experience in liver transplantation for acute liver failure in children. Transplant Proc 2010; 42: 293-295.
- Oh SH, Kim KM, Kim DY, Kim Y, Song SM, Lee YJ, Park SJ, Yoon CH, Ko GY, Sung KB, Hwang GS, Choi KT, Yu E, Song GW, Ha TY, Moon DB, Ahn CS, Kim KH, Hwang S, Park KM, Lee YJ, Lee SG. Improved outcomes in liver transplantation in children with acute liver failure. J Pediatr Gastroenterol Nutr 2014; 58: 68-73.
- Farmer D, Vernick R, Mc Diarmid S, Duffy JP, Kattan O, Hong JC, Vargas J, Yersiz H, Busuttil RW. Fulminant hepatic failure in children. Superior and durable outcomes with liver transplantation over 25 years at a single center. Ann Surg 2009; 250: 484-493.
- Mahadeb P, Grass J, Sokal E, Otte JB, Lerut J, Detaille T, de Cléty SC, Reding R. Liver transplantation in children with fulminant hepatic failure: the UCL experience. Pediatr Transplant 2009; 13: 414-420.
- Fischer R, Soltys K, Squires RH, Jaffe R, Mazariegos GV, Shneider BL. Prognostic scoring indices in Wilson´s disease: a case series and cautionary tale. J Pediatr Gastroenterol Nutr 2011; 52: 466-469.
- Cuarterolo ML, Ciocca ME, Lopez SI, de Dávila MT, Álvarez F. Immunosuppressive therapy allows recovery from liver failure in children with autoimmune hepatitis. Clin Gastroenterol Hepatol 2011; 9: 145-149.
- Squires R. Living donor liver transplantation in pediatric acute liver failure: an important option, but when do we use it? J Pediatr Gastroenterol Nutr 2014; 58: 1-2.
- Sakamoto S, Haga H, Egawa H, Kasahara M, Ogawa K, Takada Y, Uemoto S. Living donor liver transplantation for acute liver failure in infants: the impact of unknown etiology. Pediatr Transplant 2008; 12: 167-173.
- Faraj W, Dar F, Bartlett A, Melendez HV, Marangoni G, Mukherji D, Vergani GM, Dhawan A, Heaton N, Rela M. Auxiliary liver transplantation for acute liver failure in children. Ann Surg 2010; 251: 351-356.
Correspondencia: Mirta Ciocca
Hospital Alemán. Av. Pueyrredón 1640, Buenos Aires, Argentina
Correo electrónico: mciocca@intramed.net
Acta Gastroenterol Latinoam 2016;46(1):52-70
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE