Sandra Basso,1 Marisa Canicoba,9 Pablo Capitanich,2 Marcela Carballido,1 Javier Crisci,12 Federico Della Giustina,13 Lucas Granero,14 Silvia C Gutiérrez,3 Hui Jer Hwang,4, 10 Ignacio Jerez,14 Gustavo Kohan,5 María Eugenia Linares,6 Laura Marchi,9 Giselle Martini,14 Oscar Mazza,7 Mariano Moro,11 Martín Palavecino,7 Analía Pasqua,8 Graciela Uranga12
1 Hospital Dr. Carlos Bonorino Udaondo.
2 Hospital Alemán.
3 Hospital Británico.
4 Fundación Favaloro.
5 Hospital Cosme Argerich.
6 Hospital de Clínicas.
7 Hospital Italiano.
8 Hospital Italiano, CEMIC.
Ciudad Autónoma de Buenos Aires, Argentina.
9 Hospital Alejandro Posadas.
10 Hospital El Cruce
11 Hospital Italiano, Bahía Blanca.
Provincia de Buenos Aires, Argentina.
12 Sanatorio Parque, Rosario.
Santa Fe, Argentina.
13 Hospital San Roque.
14 Sanatorio Allende.
Córdoba, Argentina.
Acta Gastroenterol Latinoam 2018;48(3):213-225
Recibido: 14/06/2018 / Aprobado: 02/07/2018 / Publicado en www.actagastro.org el 17/09/2018
Directores del consenso
Lucas Granero – Oscar Mazza
Generalidades – IPE en pancreatitis crónica
Coordinadora: Sandra Basso
Secretaria: Analía Pasqua
IPE en pancreatitis aguda
Coordinador: Martín Palavecino
Secretario: Mariano Moro
IPE en cáncer de páncreas
Coordinadora: Marcela Carballido
Secretario: Ignacio Jerez
IPE post cirugía pancreática
Coordinador: Gustavo Kohan
Secretario: Javier Crisci
Resumen
La insuficiencia pancreática exocrina (IPE) es un trastorno producido por numerosas patologías pancreáticas y extrapancreáticas, muchas de las cuales son habituales en la práctica cotidiana de los gastroenterólogos, oncólogos y cirujanos. Las deficiencias nutricionales ocasionadas por esta entidad incrementan la morbimortalidad de los pacientes, por lo cual su diagnóstico temprano y su tratamiento oportuno e individualizado son mandatorios en pacientes con patologías tales como pancreatitis crónica, pancreatitis aguda necrotizante y tumores pancreáticos o en individuos con antecedentes de cirugías pancreáticas y gastroduodenales.
Palabras clave. Insuficiencia pancreática exocrina, diagnóstico, tratamiento, consenso.
I Argentine Consensus for Diagnosis and Treatment of Pancreatic Exocrine Insufficiency
Summary
Pancreatic exocrine insufficiency (PEI) is a condition that occurs in numerous pancreatic and extrapancreatic diseases, many of which are frequent in daily practice of gastroenterologists, oncologists and surgeons. Nutritional deficiencies caused by PEI increase morbimortality of patients, so its early diagnosis and timely and individualized treatment are mandatory for patients with diseases such as chronic pancreatitis, necrotising acute pancreatitis and pancreatic tumours or individuals with history of pancreatic and gastroduodenal surgeries.
Key words. Pancreatic exocrine insufficiency, diagnosis, treatment, consensus.
La insuficiencia pancreática exocrina (IPE) es un trastorno producido por numerosas patologías pancreáticas y extrapancreáticas, muchas de las cuales son habituales en la práctica cotidiana de los gastroenterólogos, oncólogos y cirujanos. Además de la pancreatitis crónica, entidad a menudo subdiagnosticada en nuestro medio, las causas más frecuentes de IPE son la fibrosis quística, la pancreatitis aguda necrotizante, los tumores de páncreas y las cirugías pancreáticas o gastroduodenales.
Las herramientas para diagnosticar una IPE dependerán del escenario particular y el tratamiento debe ser individualizado con el propósito de prevenir y corregir los déficits nutricionales que impactan negativamente en la morbimortalidad de los pacientes debido al aumento de la probabilidad de presentar eventos cardiovasculares, infecciones y fracturas patológicas, entre otras complicaciones. Es pertinente mencionar que no todos los pacientes con IPE presentan pérdida de peso o síntomas digestivos, por lo cual es mandatorio pesquisar este trastorno aun en pacientes asintomáticos en todos los escenarios en los cuales la IPE sea factible.
Objetivo
El objetivo de este consenso multidisciplinario fue establecer pautas de diagnóstico y tratamiento de la IPE en distintos escenarios en nuestro medio y fue organizado por el Club del Páncreas de la República Argentina con la participación de gastroenterólogos, oncólogos, cirujanos y una nutricionista.
Metodología
Los especialistas fueron distribuidos en cuatro grupos multidisciplinarios de trabajo, los cuales realizaron la búsqueda, el análisis y la presentación de la bibliografía disponible hasta noviembre de 2017 relacionada con los siguientes temas:
a. Consideraciones generales en IPE
b. IPE en pancreatitis crónica
c. IPE en pancreatitis aguda
d. IPE en cáncer de páncreas
e. IPE post cirugía pancreática
Se efectuaron 3 reuniones de trabajo presenciales en noviembre de 2017, diciembre de 2017 y abril de 2018 para la discusión y la confección del documento final.
Consideramos necesario mencionar que la mayoría de los estudios publicados hasta el inicio de este consenso son, en general, poco comparables entre sí debido a las diferencias en el diseño metodológico, la inclusión de pacientes heterogéneos dentro de una misma patología y/o a las limitaciones relacionadas con el método utilizado para evaluar IPE.
En la mayoría de los temas abordados, los estudios prospectivos, randomizados y controlados son limitados.
Por las razones mencionadas, entendemos que la información para la confección de una guía de práctica clínica basada en evidencia resulta insuficiente y el presente documento final consiste en recomendaciones de expertos obtenidas por consenso.
a. Consideraciones generales
- ¿Cómo se define la IPE?
La IPE es el estado de maldigestión de nutrientes causado por la insuficiente secreción de enzimas pancreáticas, su inadecuada activación, su degradación precoz y/o la ineficiente interacción enzima-alimento, lo cual condiciona una malnutrición calórico-proteica y déficits vitamínicos.1-5
- ¿Cuáles son las principales causas de IPE?
Causas pancreáticas
– Pancreatitis crónica, recurrente y aguda.
– Fibrosis quística y otros síndromes congénitos.
– Esteatosis pancreática.
– Diabetes.
– Tumores pancreáticos y periampulares.
– Cirugía pancreática.
Causas extrapancreáticas
– Inadecuado aporte calórico-proteico.
– Enteropatías difusas (enfermedad celíaca, enfermedad de Crohn, linfoma, otras).
– Tumores neuroendócrinos funcionantes (gastrinoma, somatostatinoma) y no funcionantes.
– Fármacos: somatostatina y análogos (octeotride), inhibidores de la lipasa.
– Virus de inmunodeficiencia humana adquirida.
– Cirugía gastroduodenal, incluidos algunos procedimientos bariátricos.1-3, 6
- ¿Cuáles son las manifestaciones y consecuencias clínicas de la IPE?
– Distensión abdominal, diarrea, dispepsia y dolor abdominal producidos por la presencia de restos alimentarios no digeridos en la luz intestinal.
– Signos y síntomas causados por malnutrición calórico-proteica* y déficits específicos tales como pérdida de peso, sarcopenia y anemia con astenia y adinamia, xeroftalmia, anomalías de la visión nocturna, espasmos musculares, osteopenia, osteoporosis, fracturas espontáneas, ataxia, neuropatía, deterioro cognitivo, coagulopatía, riesgo aumentado de eventos cardiovasculares y de infecciones.
* Deficiencia de energía, proteínas y otros nutrientes, que ocurre cuando el aporte es menor a los requerimientos.21
– Deterioro de la actividad laboral y de la calidad de vida.
– Mortalidad precoz.1, 2, 7
- ¿Cuáles son los métodos diagnósticos de IPE disponibles en nuestro país?
– Pruebas de secreción pancreática: test de elastasa en materia fecal.
– Pruebas de función digestiva: test de Van de Kamer/ esteatocrito.
– Parámetros nutricionales: bioquímicos y antropométricos (peso, talla, índice de masa corporal, variaciones en el peso corporal, medición de pliegues, dinamometría).
- ¿Cuál es el mejor método a utilizar para el diagnóstico de IPE?
La elección del método dependerá del escenario en el que deba diagnosticarse la IPE y de la disponibilidad de los tests (desarrollado en cada módulo).
b. IPE en pancreatitis crónica
La pancreatitis crónica (PC) es una de las causas más frecuentes de IPE y los mecanismos que la originan son los cambios parenquimatosos y/o ductales resultantes de la inflamación, la fibrosis y sus consecuencias. La IPE puede ser uno de los pilares en el diagnóstico de la PC dado que puede estar presente en casos de PC temprana en los cuales los cambios anatómicos aún no son evidentes. La detección y el tratamiento oportuno de la IPE afectan el pronóstico de los pacientes con PC.
- ¿Debe evaluarse la presencia de IPE en todo paciente con diagnóstico de PC?
Sí, debe evaluarse en todo paciente con PC. El tiempo de presentación de IPE puede variar según la etiología de la PC; en general, en la PC de etiología alcohólica se presenta antes que en la PC idiopática de presentación temprana (early-onset idiopathic pancreatitis).
Se recomienda realizar un test de secreción y/o función y valoración de parámetros nutricionales bioquímicos con una frecuencia anual, aunque este intervalo podría ser menor de acuerdo con el estado clínico del paciente. En cada consulta deben evaluarse síntomas, signos y parámetros antropométricos (índice de masa corporal y porcentaje de pérdida de peso en los últimos 6 meses, entre otros).1, 2, 8
- ¿Los cambios morfológicos se correlacionan linealmente con la presencia de IPE?
No. Si bien los cambios morfológicos y la función pancreática exocrina se correlacionan, hay pacientes que presentan cambios anatómicos mínimos o inaparentes con IPE, y otros con marcadas alteraciones morfológicas sin IPE.1, 7, 9, 10, 12
- ¿Cuál es el mejor método para diagnosticar IPE en un paciente con PC en nuestro medio?
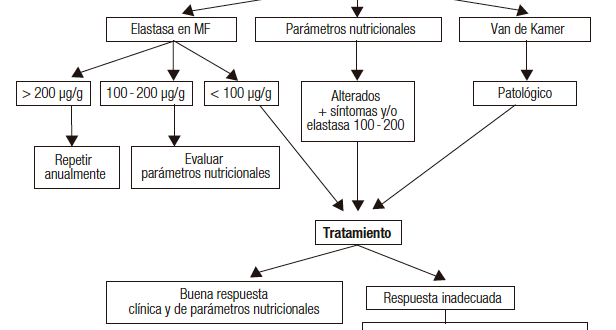
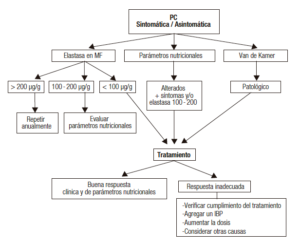
En la práctica clínica, la determinación de elastasa en materia fecal es el método de elección por su sencillez y disponibilidad; este test evalúa la secreción pancreática, el principal mecanismo fisiopatológico de IPE en PC. No existe un valor de corte ampliamente consensuado para diagnosticar IPE.
Cuanto menor sea el valor de elastasa fecal, mayor será la probabilidad de IPE. Cuando el valor es menor de 100 ug/g, el diagnóstico de IPE es altamente probable y cuando el valor es 100 ug/g – 200 ug/g se recomienda considerar otras herramientas adicionales, como los parámetros nutricionales, las imágenes y también el cuadro clínico. Pueden observarse valores “falsos positivos” en presencia de diarrea acuosa.
Una alternativa es la determinación cuantitativa de grasa en materia fecal (test de Van de Kamer). Si bien ha sido considerado el “patrón de oro”, su uso se ha limitado por su realización dificultosa y la escasa aceptación de los pacientes. Es importante recordar que este test no discrimina maldigestión por IPE de otras causas de malabsorción.
No hay consenso sobre la utilidad del esteatocrito en este escenario.
En pacientes con PC y alta sospecha clínica de IPE, la valoración de parámetros nutricionales bioquímicos es una herramienta útil especialmente cuando no se dispone de otros métodos o cuando los resultados de los mismos no son concluyentes.
Los parámetros bioquímicos a evaluar en un paciente con sospecha y/o diagnóstico de IPE son: prealbúmina, albúmina, transferrina, proteína ligadora de retinol, vitaminas liposolubles (A, D, E y K), vitamina B12, hierro, zinc, magnesio, hemoglobina, hemoglobina glicosilada.1, 3, 7, 8, 13-15
- ¿Cuáles son los pacientes con IPE que deben recibir tratamiento?
Los pacientes con PC e IPE deben ser tratados aun en ausencia de síntomas, debido a que los déficits nutricionales provocan aumento de la morbimortalidad.1, 13, 16
- ¿Cuál es el tratamiento de la IPE?
– Terapia de reemplazo enzimático pancreático (TREP).
– Plan de alimentación adecuado y saludable.
– Suspensión de los hábitos tóxicos para el páncreas (especialmente tabaco y alcohol).
- ¿Cuál debe ser el esquema de TREP?
Como esquema inicial se recomienda indicar cápsulas con 20.000-25.000 UI de lipasa durante las ingestas:
– Comidas principales (almuerzo y cena): 2 cápsulas.
– Comidas menores (desayuno y merienda): 1 cápsula.
La dosis debe ser individualizada y suficiente para lograr el control de los síntomas y la normalización del estado nutricional.1, 3-6, 8, 17
- ¿Se recomiendan, además de la TREP, los suplementos vitamínicos y minerales, ácidos grasos de cadena media, etc.?
Se recomienda suplementar vitaminas, minerales y oligoelementos solo en casos de deficiencias. No existe evidencia suficiente para la recomendación sistemática de ácidos grasos de cadena media.2, 8, 13, 15, 19
- ¿Cuáles son las recomendaciones respecto del plan de alimentación y los hábitos de vida?
Se recomienda un plan de alimentación normal saludable (50-55% de hidratos de carbono, 30-35% de grasas y 15% de proteínas), suficiente para mantener un adecuado estado nutricional. No está indicada la restricción de grasa. Los pacientes malnutridos requieren ingestas frecuentes, pequeñas y de alto valor energético.
El seguimiento de los pacientes debe estar acompañado por la evaluación periódica de un nutricionista para determinar requerimiento de soporte nutricional.
La suspensión del tabaco y del alcohol disminuye el riesgo de progresión de la enfermedad.1-4, 13, 20
- ¿Cómo debe monitorearse la respuesta al tratamiento?
– Clínicamente: aumento de peso y ausencia de distensión, diarrea, dispepsia y dolor abdominal.
– El monitoreo de los parámetros nutricionales (antropométricos y bioquímicos) es de especial utilidad en esta etapa.1, 13, 15, 18
La determinación de elastasa fecal no debe ser usada para evaluar la respuesta al tratamiento ya que solo valora la secreción exocrina propia del paciente.1, 13, 15, 18
El objetivo del tratamiento es el cese de los síntomas y la normalización de los parámetros nutricionales.
- ¿Cuáles consideraciones deben realizarse en pacientes no respondedores al tratamiento?
– Verificar que la TREP (dosis y momento de la toma) y el plan de alimentación sean adecuados.
– Agregar un inhibidor de la bomba de protones (IBP) para mejorar la biodisponibilidad de las enzimas pancreáticas.
– Aumentar progresivamente la dosis de enzimas (2 o 3 veces la dosis inicial).
– Considerar otras causas de falta de respuesta al tratamiento tales como el sobrecrecimiento bacteriano del intestino delgado, giardiasis, enfermedad celíaca, etcétera.1, 2, 4, 18
Conclusiones
Se recomienda evaluar IPE en todos los pacientes con PC ya que su presencia influye en el pronóstico de la enfermedad.
En cada consulta deben evaluarse los síntomas y signos de la IPE y de sus consecuencias.
Las herramientas disponibles para evaluar IPE son la determinación de elastasa en materia fecal, el test de Van de Kamer y los parámetros nutricionales (bioquímicos y antropométricos).
Todo paciente con PC e IPE debe ser tratado con cápsulas que contengan 20.000-25.000 UI de lipasa durante las ingestas principales (2 cápsulas durante el almuerzo y la cena) y menores (1 cápsula durante el desayuno y la merienda).
El plan de alimentación saludable y suficiente y la suspensión de tabaco y alcohol forman parte del tratamiento.
El objetivo del tratamiento es el cese de los síntomas y la normalización de los parámetros nutricionales.
En pacientes no respondedores, se recomienda verificar el adecuado cumplimiento del tratamiento, agregar un IBP, aumentar la dosis inicial 2 o 3 veces y considerar la presencia de otras entidades asociadas.
Algoritmo sugerido
c. IPE en pancreatitis aguda
La pancreatitis aguda (PA) puede causar el deterioro de la función pancreática exocrina y/o endocrina como consecuencia de la pérdida de la masa celular y de la capacidad funcional a nivel acinar y/o de los islotes de Langerhans. La IPE luego de una PA es secundaria a la inflamación, necrosis, infección, fibrosis, obstrucción del sistema ductal y/o tratamientos intervencionistas con necrosectomías.
Ha sido postulado que el desarrollo y la evolución de la IPE luego de una PA podrían estar relacionados con la etiología de la pancreatitis, la gravedad del episodio, la presencia de necrosis, su localización y extensión, el requerimiento de tratamiento endoscópico, percutáneo o quirúrgico de la necrosis infectada, la recurrencia de la pancreatitis y la enfermedad pancreática previa (ejemplo: pancreatitis crónica subyacente).
Es importante resaltar que, en los estudios publicados, existe variabilidad en cuanto al método utilizado para evaluar la función pancreática, el tiempo de la evaluación (post-PA inmediata o tardía) y la gravedad de la pancreatitis de los pacientes incluidos.
- ¿Cuál es la frecuencia de IPE post-PA?
– La IPE posterior a la PA es frecuentemente subdiagnosticada.
– La frecuencia de IPE post-PA publicada es variable debido a la heterogeneidad de los estudios y oscila entre 0% y 83%.6-21
– Según dos metaanálisis la frecuencia es de 30% y 27,1%, respectivamente.4, 5
En la práctica clínica frecuentemente no se considera a la IPE como una complicación probable luego de una PA. Habitualmente la IPE se asocia a la PA necrotizante, PA grave y/o al antecedente de necrosectomía (endoscópica, percutánea, quirúrgica o tratamientos combinados). Se ha demostrado que la IPE también puede presentarse transitoriamente en PA leve.
- ¿La frecuencia de IPE aumenta con la gravedad de la PA?
Las características de los estudios publicados hacen difícil responder de manera categórica a esta pregunta. Parece haber una tendencia a una mayor frecuencia de IPE en la PA grave. No obstante, hay que resaltar que la PA leve puede causar IPE, a menudo subdiagnosticada en la práctica clínica, usualmente transitoria y con normalización de la función exocrina a posteriori.5, 7, 10, 13, 15, 17
- ¿Existe relación entre la extensión de la necrosis y el desarrollo de IPE?
La presencia de necrosis glandular aumenta la frecuencia de IPE.4-6, 9, 11, 14, 16, 18, 19
La relación entre el porcentaje de extensión de la necrosis y la frecuencia de IPE es controversial.16, 19 En presencia de necrosis pancreática cefálica o total, los valores de elastasa en materia fecal son más bajos.16
Además, se ha reportado una mayor frecuencia de IPE en pacientes sometidos a necrosectomía pancreática.12, 18
- ¿Existe una etiología de PA que predisponga a mayor frecuencia de IPE?
Sí, la frecuencia de IPE en PA de etiología alcohólica (sin signos de pancreatitis crónica) fue significativamente mayor que en la PA de etiología biliar.5, 11, 15, 17, 18
- ¿La recurrencia de PA incrementa el riesgo de IPE?
La bibliografía disponible al respecto es limitada y los estudios publicados concluyen que no hubo relación estadísticamente significativa entre la recurrencia de la PA y el riesgo de IPE.17, 21 Sin embargo, algunas pancreatitis recurrentes cursan con deterioro de la función exocrina, por lo cual sugerimos la pesquisa de IPE ante esta situación.
- ¿Cuál es el manejo recomendado?
Considerar los factores de riesgo para IPE, las variables clínicas, los parámetros nutricionales bioquímicos y el valor de elastasa fecal en cada paciente.1-3, 5, 10, 12, 21
– Como esquema inicial se recomienda indicar cápsulas con 20.000-25.000 UI de lipasa durante las ingestas:
– Comidas principales (almuerzo y cena): 2 cápsulas
– Comidas menores (desayuno y merienda): 1 cápsula
– Plan de alimentación adecuado y saludable.
– Supresión de tóxicos (alcohol, tabaco, cannabis).
- ¿Puede recuperarse la función exocrina?
Sí. El tiempo de recuperación y el porcentaje de pacientes que normalizaron la función pancreática fueron muy variables en los estudios publicados. Se ha descripto la recuperación de la función pancreática exocrina a largo plazo.14, 15
Si bien la función exocrina puede recuperarse progresivamente luego de la injuria aguda, esto puede tardar varios años, por lo cual se recomienda un seguimiento periódico con evaluación del cuadro clínico, determinación de elastasa en materia fecal y evaluación de los parámetros nutricionales.
- ¿Existe una relación entre la IPE y la insuficiencia pancreática endocrina post-PA?
La relación entre la IPE y la insuficiencia endocrina post-PA no es lineal debido a que diferentes regiones pancreáticas afectadas son más propensas a generar una u otra insuficiencia.20-23
Conclusiones
Si bien la frecuencia publicada de IPE posterior a una PA es muy variable, se estima que es aproximadamente del 30%.
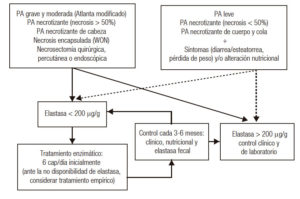
La probabilidad de desarrollar IPE es elevada si las formas clínicas de PA son graves o moderadamente graves, con necrosis > 50%, necrosis de la cabeza pancreática o necrosis con pared (WON “walled off necrosis”) y posterior a necrosectomía. Los integrantes del presente consenso recomiendan realizar un test de elastasa en materia fecal e iniciar TREP cuando los valores son menores de 200 μg/g.
Asimismo, es recomendación del consenso solicitar este test para confirmar IPE en pacientes que presentan síntomas (diarrea, dispepsia, dolor abdominal, meteorismo, pérdida de peso) y/o alteración de parámetros nutricionales bioquímicos durante el seguimiento, aun con el antecedente de haber presentado una PA leve, necrosis < 50% o necrosis de cuerpo-cola de páncreas.
Confirmada la IPE, el TREP debería iniciarse cuando comienza la nutrición oral sólida o, eventualmente, la nutrición enteral polimérica. La dosis puede incrementarse según la necesidad; una alternativa es el agregado de un inhibidor de bomba de protones para mejorar la biodisponibilidad de las enzimas.
Es importante una alimentación variada saludable, así como la supresión de tóxicos como el alcohol, el tabaco y el cannabis para evitar la progresión del daño tisular y favorecer la recuperación.
Los controles deberían realizarse periódicamente cada 3 a 6 meses e incluir evaluación clínica, parámetros nutricionales y elastasa fecal. El TREP podrá suspenderse cuando la función exocrina se haya recuperado.1-3, 5, 10, 12, 21
Algoritmo sugerido
d. IPE en cáncer de páncreas
El adenocarcinoma ductal de páncreas representa el 90% de los tumores sólidos malignos de esta glándula; el 10 % restante incluye a los tumores neuroendócrinos y a los acinares, entre otras estirpes. En estas recomendaciones nos referimos específicamente al adenocarcinoma ductal de páncreas.
La amplia mayoría de los pacientes con cáncer de páncreas presenta pérdida de peso al momento del diagnóstico; la misma es secundaria al síndrome anorexia-caquexia y a la IPE, e impacta negativamente en el pronóstico de estos pacientes ya que condiciona su ingreso a los protocolos de tratamiento y afecta las tasas de respuesta y de efectos adversos.
En el paciente con cáncer de cabeza de páncreas, la IPE se debe principalmente a la obstrucción ductal y falta de liberación de enzimas pancreáticas hacia la luz duodenal; en este escenario clínico, la IPE es, a menudo, subdiagnosticada y, por lo tanto, no tratada.1
En los tumores de cabeza de páncreas, la prevalencia de IPE es del 60-70% y se incrementa a 92% luego de un promedio de seguimiento de 2 meses. En otras localizaciones, la prevalencia es menor.2
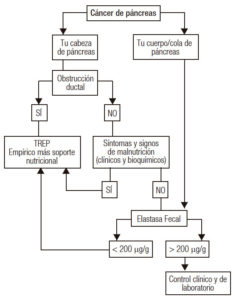
- En el paciente con cáncer de cabeza de páncreas, ¿la presencia de IPE debe ser investigada con algún test o puede iniciarse el tratamiento sin estudios previos?
En pacientes que presentan obstrucción ductal en los estudios por imágenes, la alta frecuencia de IPE justifica el TREP empírico temprano asociado al apoyo nutricional con el objetivo de mejorar y/o mantener los parámetros nutricionales y la calidad de vida.
Si no hay evidencia de obstrucción ductal y el paciente no presenta síntomas y signos de malnutrición (clínica y/o bioquímica) se puede utilizar el test de elastasa fecal para decidir si requiere TREP.3
- En el paciente con cáncer de cuerpo-cola de páncreas, ¿la presencia de IPE debe ser evaluada?
Si. Se recomienda la utilización del test de elastasa fecal para el diagnóstico de IPE. La frecuencia de esta condición es menor en los tumores de cuerpo-cola de páncreas comparada con los de localización cefálica.4
- ¿Los pacientes con cáncer de páncreas requieren evaluación por nutricionistas?
En esta población de pacientes se recomienda fuertemente la evaluación temprana por nutricionistas en forma sistemática, aun en aquellos con parámetros nutricionales conservados.5
- ¿Cuál es el tratamiento recomendado de la IPE?
Como esquema inicial se recomienda indicar cápsulas con 20.000-25.000 UI de lipasa durante las ingestas.
– Tumor cefálico:
Comidas principales (almuerzo y cena): 2-3 cápsulas.
Comidas menores (desayuno y merienda): 1-2 cápsulas.
– Tumor de cuerpo-cola:
Comidas principales (almuerzo y cena): 2 cápsulas.
Comidas menores (desayuno y merienda): 1 cápsula.3
Según la respuesta, y luego de verificar el adecuado cumplimiento de la TREP (y del plan alimentario adecuado), se puede considerar agregar un inhibidor de la bomba de protones para mejorar la biodisponibilidad de la TREP y/o aumentar la dosis de las enzimas progresivamente (2-3 veces la dosis inicial).
- ¿Cuáles son los métodos de monitoreo recomendados para valorar la respuesta al tratamiento de la IPE?
El objetivo del tratamiento es el cese de los síntomas y la normalización de los parámetros nutricionales. La mejoría de los síntomas de IPE no siempre se correlaciona con una mejoría del estado nutricional, mientras que la ganancia de peso y el índice de masa corporal sí lo hacen.
El monitoreo de los parámetros nutricionales (antropométricos y bioquímicos) es de especial utilidad en esta etapa. La determinación de elastasa fecal no debe ser usada para evaluar la respuesta al tratamiento ya que solo valora la secreción exocrina propia del paciente.
Si a pesar de haber optimizado el tratamiento no se logra mejorar los parámetros nutricionales, se recomienda considerar otras causas de malnutrición.6
- ¿Cuál es el impacto del TREP previo a la cirugía en pacientes con cáncer de cabeza de páncreas?
Se ha observado una disminución de la morbimortalidad posoperatoria, por lo cual se recomienda el TREP en pacientes con obstrucción ductal, síntomas o test diagnóstico de IPE positivo.7
Conclusiones
En el cáncer de cabeza de páncreas, la IPE se debe principalmente a la obstrucción ductal con ausencia de liberación de enzimas pancreáticas hacia la luz duodenal.
En pacientes que presentan obstrucción ductal, la alta frecuencia de IPE justifica el TREP empírico precoz asociado al apoyo nutricional con el objetivo de mejorar y/o mantener los parámetros nutricionales y la calidad de vida.
Si no hay evidencia de obstrucción ductal y el paciente no presenta síntomas y signos de malnutrición (clínica y/o bioquímica) se puede utilizar el test de elastasa fecal para decidir si requiere TREP.
En pacientes con tumores de cuerpo-cola de páncreas se recomienda la utilización del test de elastasa fecal para el diagnóstico de IPE.
En preoperatorio, se recomienda el TREP en pacientes con obstrucción ductal, presencia de síntomas o test diagnóstico de IPE positivo, ya que se ha observado una disminución de la morbimortalidad posoperatoria.
Algoritmo sugerido
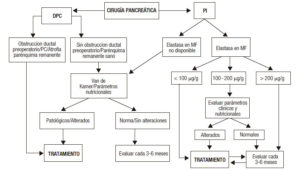
e. IPE post cirugía pancreática
La IPE posquirúrgica se define como la condición en la cual las enzimas pancreáticas secretadas no logran mantener la normal digestión-absorción de nutrientes debido a las modificaciones anatómicas y funcionales ocasionadas por los procedimientos quirúrgicos. Los factores involucrados en esta situación de maldigestión dependen del tipo de cirugía e incluyen el volumen de parénquima pancreático resecado, la enfermedad de base y el estado del parénquima remanente, la disminución de la estimulación posprandial y la asincronía entre el vaciado gástrico de los alimentos y la secreción biliopancreática.
En estas recomendaciones solamente serán discutidos los mecanismos causantes de IPE en los dos tipos de cirugía pancreática más frecuentemente realizados: la duodenopancreatectomía cefálica (DPC) y la pancreatectomía izquierda (PI). No serán analizadas la pancreatectomía central ni las cirugías realizadas en pacientes con pancreatitis crónica (cirugías de Frei, de Beger o de Partington- Rochelle).
- ¿Cuáles son los principales mecanismos involucrados en la IPE post resección pancreática?
En DPC:
– Disminución de la estimulación de la secreción pancreática debido a la alteración en la relajación del fundus gástrico y a la reducción de la secreción de colecistokinina secundaria a la resección duodenal.
– Reducción de la secreción de enzimas por resección de parénquima.
– Alteración de la interacción enzima-alimento por la llegada al yeyuno de partículas de mayor tamaño post resección del antro gástrico (cirugía de Whipple).
– Asincronía entre el vaciado gástrico de nutrientes y la secreción biliopancreática.
En PI:
– En este caso la IPE se relaciona con la reducción del parénquima pancreático secretante y la calidad del parénquima remanente.1
- ¿Cuál es la frecuencia de IPE luego de las resecciones pancreáticas?
La frecuencia reportada es variable. En la DPC, la mayoría de las publicaciones muestra una elevada frecuencia entre el 64 y el 100%. En el caso de la PI, la bibliografía reporta mayor variabilidad de presencia de IPE, aunque es menor que en la DPC. La aparición de IPE luego de las resecciones de cuerpo-cola dependerá tanto de la magnitud de la resección como de las características anatomo funcionales del páncreas remanente.2-5
- ¿Cuáles son los test útiles para diagnosticar IPE luego de los distintos tipos de resecciones pancreáticas?
Los mecanismos que causan IPE varían de acuerdo con el tipo de cirugía y esto debe ser considerado en el momento de seleccionar el test a utilizar para evaluar la presencia de esta entidad.
Luego de la DPC, la prueba más adecuada para evaluar IPE es el test del aire espirado utilizando triglicéridos marcados con13 C ya que valora el proceso digestivo global. Este test no se encuentra disponible en Argentina al momento de la elaboración de este consenso.
En nuestro medio, una opción válida para diagnosticar IPE posoperatoria es el test de Van de Kamer, pero su uso está limitado principalmente por la baja aceptación de esta prueba por parte de los pacientes.
Es importante tener en cuenta que la determinación de elastasa fecal no es un buen método para evaluar IPE después de una DPC debido a que la maldigestión secundaria a esta cirugía depende fundamentalmente de la asincronía entre el vaciado gástrico de los alimentos y la secreción biliopancreática. Un test de elastasa fecal normal no asegura un proceso digestivo global adecuado en este escenario.
Los parámetros nutricionales (antropométricos y bioquímicos) son indispensables para una correcta evaluación y seguimiento de estos pacientes.
En el caso de la pancreatectomía corporocaudal, la determinación de elastasa fecal es un método útil para evaluar secreción pancreática ya que no está alterado el eje gastro-duodeno-pancreático. El resto de los estudios como el test del aire espirado, el test de Van de Kamer y los parámetros nutricionales tienen la misma utilidad que en la DPC.1, 6-8
- ¿Deben solicitarse tests para evaluar IPE a todo paciente sometido a DPC o PI?
En lo que respecta a la DPC, si el paciente presentó obstrucción ductal preoperatoria o la causa de la resección fue pancreatitis crónica, no sería necesario realizar tests diagnósticos; en estos casos se acepta indicar TREP en forma empírica.
Cuando el paciente no tuvo obstrucción ductal prequirúrgica o presenta un remanente pancreático aparentemente sano se sugiere realizar una evaluación de la suficiencia exocrina antes de indicar TREP. En estos pacientes, el test de Van de Kamer y los parámetros nutricionales son herramientas útiles para tomar una decisión de tratamiento.
En las PI la variabilidad de la frecuencia de IPE hace necesaria la realización de tests diagnósticos. En estos pacientes, la determinación de elastasa fecal es un estudio útil como primera aproximación. El test de Van de Kamer y los parámetros nutricionales también son útiles como herramientas para tomar una decisión de tratamiento.1
- ¿Cuál debería ser la dosis de TREP en pacientes sometidos a cirugías pancreáticas?
La dosis de reemplazo se establece teniendo en cuenta múltiples factores, entre los cuales está la patología de base (tumor, pancreatitis crónica) ya que esta tiene impacto en la calidad del parénquima pancreático remanente y, por lo tanto, en la capacidad secretoria exocrina posoperatoria. Como en otras situaciones, deben ser consideradas las características de las ingestas (volumen, valor calórico, contenido de grasa, duración).
Como esquema inicial se recomienda indicar cápsulas con 20.000-25.000 UI de lipasa durante las ingestas.
Post DPC:
Comidas principales (almuerzo y cena): 2-3 cápsulas.
Comidas menores (desayuno y merienda): 1-2 cápsulas.
Post PI:
Comidas principales (almuerzo y cena): 2 cápsulas.
Comidas menores (desayuno y merienda): 1 cápsula.
Post duodenopancreatectomía total:
Comidas principales (almuerzo y cena): 3 cápsulas.
Comidas menores (desayuno y merienda): 2 cápsulas.9
- ¿Cómo debería ser el seguimiento de los pacientes con TREP?
No hay estudios publicados sobre el seguimiento a largo plazo de pacientes en tratamiento con enzimas pancreáticas por IPE post resección quirúrgica.
Se recomienda que los pacientes sometidos a una resección pancreática sean monitoreados periódicamente debido a la posibilidad de desarrollo tardío de IPE post DPC y de normalización de la secreción pancreática post PI. La dosis de TREP deberá adecuarse a cada paciente de acuerdo a la respuesta clínica y a los parámetros nutricionales.
Conclusiones
Los principales mecanismos de IPE post cirugías pancreáticas son los cambios anatomo-funcionales derivados de la cantidad y calidad de parénquima pancreático remanente y especialmente las modificaciones en el tránsito gastrointestinal en las diferentes reconstrucciones post DPC.
Si bien la frecuencia publicada de IPE post resecciones pancreáticas es muy variable, concluimos que es elevada luego de la DPC por lo que en la mayoría de los casos debería indicarse TREP de manera empírica, especialmente si el paciente presentó obstrucción ductal preoperatoria o la causa de la resección fue una complicación de una PC. En cambio, luego de una PI es necesario realizar algún test para evaluar la funcionalidad.
El mejor test para diagnosticar IPE luego de una PI es medir la elastasa en materia fecal. Luego de la DPC, la prueba más adecuada es el test del aire espirado, pero al no estar disponible en nuestro país al momento del consenso, el test de Van de Kamer y los parámetros nutricionales son herramientas útiles para la toma de decisiones y seguimiento.
Se recomienda el monitoreo periódico de la funcionalidad pancreática, así como también de las dosis administradas en cada paciente sometido a resecciones pancreáticas de acuerdo con la respuesta clínica y los parámetros nutricionales.
En pacientes sometidos a DPC con obstrucción ductal preoperatoria o con diagnóstico de PC, el TREP debería iniciarse cuando comienza la nutrición oral sólida. La dosis puede incrementarse según necesidad.
Algoritmo sugerido
Referencias
Consideraciones generales – Insuficiencia pancreática exocrina en pancreatitis crónica
- Löhr JM, Domínguez-Muñoz E, Rosendahl J, Besselink M, Mayerle J, Lerch MM, Haas S, Akisik F, Kartalis N, Iglesias-García J, Keller J, Boermeester M, Werner J, Dumonceau JM, Fockens P, Drewes A, Ceyhan G, Lindkvist B, Drenth J, Ewald N, Hardt P, de Madaria E, Witt H, Schneider A, Manfredi R, Brøndum FJ, Rudolf S, Bollen T, Bruno M. HaPanEU/UEG Working Group. UEG evidence-based guidelines for diagnosis and therapy of chronic pancreatitis. United European Gastroenterol J 2017; 5: 153-199.
- Struyvenberg MR, Martin CR, Freedman SD. Practical guide to PEI. Breaking the myths. BMC Medicine 2017; 15: 29.
- Lindkvist B. Diagnosis and treatment of PEI. WJG 2013; 19: 7258-7266.
- Working Party of the Australasian Pancreatic Club, Smith RC, Smith SF, Wilson J, Pearce C, Wray N, Vo R, Chen J, Ooi CY, Oliver M, Katz T, Turner R, Nikfarjam M, Rayner C, Horowitz M, Holtmann G, Talley N, Windsor J, Pirola R, Neale R. Australasian Pancreatic Club, Summary and recommendations from the Australian guidelines for the management of pancreatic exocrine insufficiency. Pancreatology 2016; 16: 164-180.
- Gheorghe C, Seicean A, Saftoiu A, Tantau M, Dumitru E, Jinga M, Negreanu L, Mateescu B, Gheorghe L, Ciocirlan M, Cijevschi C, Constantinescu G, Dima S, Diculescu M; Romanian Association for Pancreatic Pathology. Romanian guidelines on the diagnosis and treatment of exocrine pancreatic insufficiency. J Gastrointestin Liver Dis 2015; 24: 117-123.
- Pezzilli R, Andriulli A, Bassi C, Balzano G, Cantore M, Delle Fave G, Falconi M, Frulloni L, Exocrine Pancreatic Insufficiency collaborative (EPIc) group. Exocrine pancreatic insufficiency in adults: a shared position statement of the Italian Association for the Study of the Pancreas. World J Gastroenterol 2013; 19: 7930-7946.
- Domínguez-Muñoz JE, D Hardt P, Lerch MM, Löhr MJ. Potential for screening for pancreatic exocrine insufficiency using the Fecal Elastase-1 Test. Dig Dis Sci 2017; 62: 1119-1130.
- Sheth SG, Conwell DL, Whitcomb DC, Alsante M, Anderson MA, Barkin J, Brand R, Cote GA, Freedman SD, Gelrud A, Gorelick F, Lee LS, Morgan K, Pandol S, Singh VK, Yadav D, Wilcox CM, Hart PA. Academic Pancreas Centers of Excellence: Guidance from a multidisciplinary chronic pancreatitis working group at PancreasFest. Pancreatology 2017; 17: 419-430.
- Hopper A. Improving outcomes of chronic pancreatitis: is isolated PEI an early marker to identify modifiable risks? AJG 2017; 59.
- Domínguez-Muñoz JE. Pancreatic enzyme therapy for pancreatic exocrine insufficiency. Gastroenterol Hepatol (NY) 2011; 7: 401-403.
- Domínguez-Muñoz JE. Pancreatic exocrine insufficiency: diagnosis and treatment. J Gastroenterol Hepatol 2011; 26: 12-16.
- Hoffmeister A, Mayerle J, Beglinger C, Büchler MW, Bufler P, Dathe K, Fölsch UR, Friess H, Izbicki J, Kahl S, Klar E, Keller J, Knoefel WT, Layer P, Loehr M, Meier R, Riemann JF, Rünzi M, Schmid RM, Schreyer A, Tribl B, Werner J, Witt H, Mössner J, Lerch MM; members of the guideline committee. English language version of the S3-consensus guidelines on chronic pancreatitis: Definition, aetiology, diagnostic examinations, medical, endoscopic and surgical management of chronic pancreatitis. Z Gastroenterol 2015; 53: 1447-1495.
- Iglesia-García D de la, Huang W, Szatmary P, Baston-Rey I, González-López J, Prada-Ramallal G, Mukherjee R, Nunes QM, Domínguez-Muñoz JE, Sutton R, NIHR Pancreas Biomedical Research Unit Patient Advisory Group1. Efficacy of pancreatic enzyme replacement. Gut 2016; 0: 1-13.
- Lindkvist B, Domínguez-Muñoz JE, Luaces-Regueira M, Castiñeiras-Alvariño M, Nieto-García L, Iglesias-García J. Serum nutritional markers for prediction of PEI in chronic pancreatitis. Pancreatology 2012; 12: 305-310.
- Lindkvist B, Phillips ME, Domínguez-Muñoz JE. Clinical, anthropometric and laboratory nutritional markers of PEI. Pancreatology 2015; 15: 589-597.
- Iglesia-García De la, Vallejo-Senra N, Iglesias-García J, López- López A, Nieto L, Domínguez-Muñoz JE. Increased risk of mortality associated with pancreatic exocrine insufficiency in patients with chronic pancreatitis. J Clin Gastroenterol 2017, Aug 30. [Epub ahead of print].
- D’Haese JG, Ceyhan GO, Demir IE, Layer P, Uhl W, Löhr M, Rychlik R, Pirilis K, Zöllner Y, Gradl B, Foerster D, Möbius J, Henniges F, Friess H. Pancreatic enzyme replacement therapy in patients with exocrine pancreatic insufficiency due to chronic pancreatitis: a 1-year disease management study on symptom control and quality of life. Pancreas 2014; 43: 834-841.
- Madaria E de, Abad-González A, Aparicio JR, Aparisi L, Boadas J, Boix E, de Las Heras G, Domínguez-Muñoz E, Farré A, Fernández-Cruz L, Gómez L, Iglesias-García J, García-Malpartida K, Guarner L, Lariño-Noia J, Lluís F, López A, Molero X, Moreno- Pérez Ó, Navarro S, Palazón JM, Pérez-Mateo M, Sabater L, Sastre Y, Vaquero EC, Martínez J, en representación del Club Español Pancreático. Recomendaciones del Club Español Pancreático para el diagnóstico y tratamiento de la pancreatitis crónica: parte 2(tratamiento). Gastroenterol Hepatol 2013; 36: 422-436.
- Sikkens E, Cahen DL, Koch AD, Braat H, Poley JW, Kuipers EJ, Bruno MJ. The prevalence of fat-soluble vitamin deficiencies and a decreased bone mass in patients with chronic pancreatitis. Pancreatology 2013; 13: 238-242.
- Meier R, Ockenga J, Pertkiewicz M, Pap A, Milinic N, Macfie J, DGEM (German Society for Nutritional Medicine), Löser C, Keim V, ESPEN (European Society for Parenteral and Enteral Nutrition). Clinical Nutrition 2006; 25: 275-284.
- Jeejeebhoy KN, Duerksen DR. Malnutrition in Gastrointestinal Disorders: Detection and Nutritional Assessment. Gastroenterol Clin North Am 2018; 47: 1-22.
Insuficiencia Pancreática Exocrina en Pancreatitis Aguda
- Pezzilli R, Andriulli A, Bassi C, Balzano G, Cantore M, Delle Fave G, Falconi M, Frulloni L. Exocrine pancreatic insufficiency in adults: A shared position statement of the Italian association for the study of the páncreas. World J Gastroenterol 2013; 19: 7930-7946.
- Smith RC, Smith SF, Wilson J, Pearce C, Wray N, Vo R, Chen J, Ooi CY, Oliver M, Katz T, Turner R, Nikfarjam M, Rayner C, Horowitz M, Holtmann G, Talley N, Windsor J, Pirola R, Neale R. Summary and recommendations from the Australasian guidelines for the management of pancreatic exocrine insufficiency. Working Party of the Australasian Pancreatic Club. Pancreatology 2016; 16: 164-180.
- Gheorghe C, Seicean A, Saftoiu A, Tantau M, Dumitru E, Jinga M, Negreanu L, Mateescu B, Gheorghe L, Ciocirlan M, Cijevschi C, Constantinescu G, Dima S, Diculescu M. Romanian Guidelines on the Diagnosis and Treatment of Exocrine Pancreatic Insufficiency. J Gastrointestin Liver Dis 2015; 24: 117-123.
- Iglesia-García D de la, Huang W, Baston Rey I, Lariño Noia J, Iglesias-García J, Szatmary P, Nunes QM, Mukherjee R, Sutton R, Domínguez-Muñoz JE. Incidence of exocrine pancreatic insufficiency after acute pancreatitis: systemic review and meta-analysis. Abstract. Pancreatology 2017; 17: SS1- SS21.
- Hollemans RA, Hallensleben NDL, Mager DJ, Kelder JC, Besselink MG, Bruno MJ, Verdonk RC, van Santvoort HC. Pancreatic exocrine insufficiency following acute pancreatitis: Systematic review and study level meta-analysis. Pancreatology 2018; 18: 253-262.
- Beattie GC, Mason J, Swan D, Madhavan KK, Siriwardena AK. Outcome of necrosectomy in acute pancreatitis: The case for continued vigilance. Scand J Gastroenterol 2002; 37: 1449-1453.
- Boreham B, Ammori A. Prospective evaluation of pancreatic exocrine function in patients with acute pancreatitis: Correlation with extent of necrosis and pancreatic endocrine insufficiency. Pancreatology 2003; 3: 303-308.
- Sabater L, Pareja E, Aparisi L, Calvete J, Camps B, Sastre J, Artigues E, Oviedo M, Trullenque R, Lledo S. Pancreatic function after severe acute biliary pancreatitis: The role of necrosectomy. Pancreas 2004; 28: 65-68.
- Connor S, Alexakis N, Raraty T, Ghaneh P, Evans J, Hughes M, Garvey CJ, Sutton R, Neoptolemos JP. Early and late complications after pancreatic necrosectomy. Surgery 2005; 137: 499-505.
- Symersky T, van Hoorn B, Masclee AAM. The outcome of a long-term follow-up of pancreatic function after recovery from acute pancreatitis. JOP 2006; 7: 447-453.
- Reszetow J, Hac S, Dobrowolski S, Stefaniak T, Wajda Z, Gruca Z, Sledzinski Z, Studniarekal M. Biliary versus alcohol-related infected pancreatic necrosis similarities and differences in the follow-up. Pancreas 2007; 35: 267-272.
- Van Santvoort HC, Besselink MG, Bakker OJ, Hofker HS, Boermeester MA, Dejong CH, van Goor H, Schaapherder AF, van Eijck CH, Bollen TL, van Ramshorst B, Nieuwenhuijs VB, Timmer R, Laméris JS, Kruyt PM, Manusama ER, van der Harst E, van der Schelling GP, Karsten T, Hesselink EJ, van Laarhoven CJ, Rosman C, Bosscha K, de Wit RJ, Houdijk AP, van Leeuwen MS, Buskens E, Gooszen HG; Dutch Pancreatitis Study Group. A step-up approach or open necrosectomy for necrotizing pancreatitis. N Engl J Med 2010; 362: 1491-1502.
- Andersson B, Pendse ML, Andersson R. Pancreatic function, quality of life and costs at long-term follow-up after acute pancreatitis. World J Gastroenterol 2010; 16: 4944-4951.
- Uomo G, Gallucci F, Madrid E, Miraglia S, Manes G, Rabitti PG. Pancreatic functional impairment following acute necrotizing pancreatitis: Long-term outcome of a non-surgically treated series. Digestive and Liver Disease 2010; 42: 149-152.
- Xu Y, Wu D, Zeng Y, Wang X. Pancreatic exocrine function and morphology following an episode of acute pancreatitis. Pancreas 2012; 41: 922-927.
- Garip G, Sarandöl E, Kaya E. Effects of disease severity and necrosis on pancreatic dysfunction after acute pancreatitis. World J Gastroenterol 2013; 19: 8065-8070.
- Vujasinovic M, Tepes B, Makuc J, Rudolf S, Zaletel J, Vidmar T, Seruga M, Birsa B. Pancreatic exocrine insufficiency, diabetes mellitus and serum nutritional markers after acute pancreatitis. World J Gastroenterol 2014; 20: 18432-18438.
- Chandrasekaran P, Gupta R, Shenvi S, Kang M, Rana SS, Singh R, Bhasin DK. Prospective comparison of long term outcomes in patients with severe acute pancreatitis managed by operative and non-operative measures. Pancreatology 2015: 478-484.
- Tu J, Zhang J, Ke L, Yang Y, Yang Q, Lu G, Li B, Tong Z, Li W, Li J. Endocrine and exocrine pancreatic insufficiency after acute pancreatitis: long term follow-up study. BMC Gastroenterology 2017; 17: 114.
- Das SLM, Kennedy JIC, Murphy R, Phillips ARJ, Windsor JA, Petrov MS. Relationship between the exocrine and endocrine pancreas after acute pancreatitis. World J Gastroenterol 2014; 20: 17196-17205.
- Nikkola J, Laukkarinen J, Lahtela J, Seppänen H, Järvinen S, Nordback I, Sand J. The long-term prospective follow-up of pancreatic function after the first episode of acute alcoholic pancreatitis. J Clin Gastroenterol 2017; 51: 183-190.
- Lankisch PG, Breuer N, Bruns A, Weber-Dany B, Lowenfels AB, Maisonneuve P. Natural history of acute pancreatitis: A long-term population-based study. Am J Gastroenterol 2009; 104: 2797-2805.
- Wu D, Xu Y, Zeng Y, Wang X. Endocrine pancreatic function changes after acute pancreatitis. Pancreas 2011; 40: 1006-1011.
- Domínguez-Muñoz JE, Hardt PD, Lerch MM, Lohr MJ. Potential for screening for pancreatic exocrine insufficiency using the Fecal Elastase-1 Test. Dig Dis Sci 2017; 62: 1119-1130.
Insuficiencia Pancreática Exocrina en Cáncer de Páncreas
- Domínguez-Muñoz JE. Pancreatic exocrine insufficiency: Diagnosis and treatment. J Gastroenterol Hepatol 2011; 26: 12-16.
- Sikkens ECM, Cahen DL, de Wit J, Looman CWN, Van Eijck C, Bruno MJ. J Clin Gastroenterol 2014; 48: e43-e46.
- Bruno MJ, Haverkort EB, Tijssen GP, Tytgat GN, van Leeuwen DJ. Placebo controlled trial of enteric coated pancreatin microsphere treatment in patients with unresectable cancer of the pancreatic head region. Gut 1998; 42: 92-96.
- Tseng DSJ, Molenaar IQ, Besselink MG, Van Eijck CH, Rinkes IHB, Van Santvoort HC. Pancreas 2016; 45: 325-330.
- Gilliland TM, Villafane-Ferriol N, Shah KP, Shah RM, Tran Cao HS, Massarweh NN, Silberfein EJ, Choi EA, Hsu C, Mc Elhany AL, Barakat O, Fisher W, Van Buren G. Nutritional and metabolic derangements in pancreatic cancer and pancreatic resection. Nutrients 2017; 9: 243.
- Lindkvist B, Phillips ME, Domínguez-Muñoz JE. Clinical, anthropometric and laboratory nutritional markers of pancreatic exocrine insufficiency. Pancreatology 2015; 6: 589-597.
- Phillips ME. Pancreatic exocrine insufficiency following pancreatic resection. Pancreatology 2015; 15: 449-455.
Insuficiencia Pancreática Exocrina Post Cirugía Pancreática
- Domínguez-Muñoz JE. Pancreatic enzyme replacement therapy: exocrine pancreatic insufficiency after gastrointestinal surgery. HPB 2009; 11: 3-6.
- Sikkens EC, Cahen DL, de Wit J, Looman CW, van Eijck C, Bruno MJ. A prospective assessment of the natural course of the exocrine pancreatic function in patients with a pancreatic head tumor. J Clin Gastroenterol. 2014; 48: e43-e46.
- Falconi M, Mantovani W, Crippa S, Mascetta G, Salvia R, Pederzoli P. Pancreatic insufficiency after different resections for benign tumours. Br J Surg 2008; 95: 85-91.
- Sato N, Yamaguchi K, Chijiiwa K, Tanaka M. Duct-parenchymal ratio predicts exocrine pancreatic function after pancreatoduodenectomy and distal pancreatectomy. Am J Surg 1998; 176: 270-273.
- Speicher JE, Traverso LW. Pancreatic exocrine function is preserved after distal pancreatectomy. J Gastrointest Surg 2010; 14: 1006-1011.
- Sabater L, Ausania F, Bakker OJ, Boadas J, Domínguez-Muñoz JE, Falconi M, Fernández-Cruz L, Frulloni L, González-Sánchez V, Lariño-Noia J, Lindkvist B, Lluís F, Morera-Ocón F, Martín- Pérez E, Marra-López C, Moya-Herraiz Á, Neoptolemos JP, Pascual I, Pérez-Aisa Á, Pezzilli R, Ramia JM, Sánchez B, Molero X, Ruiz-Montesinos I, Vaquero EC, de-Madaria E. Evidence-based guidelines for the management of exocrine pancreatic insufficiency after pancreatic surgery. Ann Surg 2016; 264: 949-958.
- Philips M. Pancreatic exocrine insufficiency following pancreatic resection. Pancreatology 2015; 449-455.
- Xu S, Zhu Y, Zhpu W, Xie K, Mou Y. Patients get more long-term benefit from central pancreatectomy tan distal resection: A meta-analysis. EJSO 2013; 567-574.
- Kern V, Klar E, Poll M, Schoenberg M. Postoperative care following Pancreatic Surgery. Dtsch Arztebl Int 2009; 106: 789-794.
Correspondencia: Oscar Mazza
Gascón 450, Hospital Italiano de Buenos Aires.
Ciudad Autónoma de Buenos Aires, Argentina
Tel.: 4959-0200
Correo electrónico: oscar.mazza@hospitalitaliano.org.ar
Acta Gastroenterol Latinoam 2018;48(3): 213-225
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE