José Carlos Sotelo,1, 2 Adrián Sambresqui,1 Rodrigo Ubeira,1 Guido Orbe,1 José Luis Fernández,1 Nicolás Ortiz,1 Guillermo Pfaffen,1 Rodrigo Morán Azzi,1 Víctor Serafini,1 Luis Viola1
1 Servicio de Gastroenterología, Hepatología y Endoscopía.
2 Servicio de Cirugía, Sector de Cirugía Hepatobiliopancreática.
Sanatorio Güemes de Buenos Aires, Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2018;48(2):131-137
Recibido: 29/07/2017 / Aprobado: 20/12/2017 / Publicado en www.actagastro.org el 18/06/2018
Resumen
La complicación más frecuente de la colangiopancreatografía retrógrada endoscópica (CPRE) es la pancreatitis, su prevalencia oscila entre el 3,5% y el 20% en pacientes de alto riesgo. El uso de supositorios de antiinflamatorios no esteroides (AINEs) ha demostrado ser eficaz y seguro, siendo una medida recomendada por las últimas guías de prevención. Objetivo. Evaluar la efectividad de la aplicación de la indometacina rectal en la prevención de la pancreatitis post CPRE. Material y métodos. Se incluyeron 202 pacientes consecutivos sometidos a CPRE. Divididos en dos grupos: grupo control (n = 100) y grupo indometacina (n = 102). Ambos grupos fueron homogéneos en cuanto a las variables demográficas. Resultados. La tasa de pancreatitis post CPRE tuvo una reducción en el grupo indometacina (5,9% vs. 13%, p = 0,083). El riesgo relativo (RR) fue de 0,45 (IC 95%: 0,16-1,22), la reducción del riesgo relativo (RRR) 0,55 (IC 95%: – 0,22-0,84), la reducción del riesgo absoluto (RRA) 0,07 (IC 95%: – 0,02-0,14) y el número necesario a tratar (NNT) 14 (IC 95%: 7-infinito). También hubo una reducción significativa en la tasa de hiperamilasemia asintomática en el grupo indometacina (10,8% vs. 25%, p = 0,014), el RR fue 0,43 (IC 95%: 0,21-0,86), la RRR 0,57 (IC 95%: 0,14-0,79), la RRA 0,14 (IC 95%: 0,03- 0,24) y el NNT 7 (IC 95%: 4,25-37,19). Conclusiones. La indometacina rectal es una medida segura, efectiva y de bajo costo para prevenir la pancreatitis post CPRE y la hiperamilasemia asintomática, tanto en pacientes de alto riesgo como en aquellos de riesgo promedio.
Palabras claves. Pancreatitis aguda, indometacina, CPRE, antiinflamatorios no esteroides, pancreatitis post CPRE, prevención.
Effectiveness of rectal indomethacin in the prevention of post Endoscopic Retrograde Colangiopancreatography pancreatitis
Summary
The most common complication of endoscopic retrograde cholangiopancreatography (ERCP) is pancreatitis, its prevalence ranges from 3.5% to 20% in high-risk patients. The use of non-steroidal anti-inflammatory suppositories (NSAIDs) has been effective and safe, being a measure recommended by the latest prevention guidelines. Objective. To evaluate the effectiveness of the application of rectal indomethacin in the prevention of post-ERCP pancreatitis. Material and methods. 202 consecutive patients undergoing ERCP were included. Divided into two groups: control group (n = 100) and indomethacin group (n = 102). Both groups were homogeneous in terms of demographic variables. Results. The rate of post-ERCP pancreatitis had a reduction in the indomethacin group (5.9% versus 13%, p = 0.083). The relative risk (RR) was 0.45 (95% CI: 0.16-1.22), the relative risk reduction (RRR) 0.55 (95% CI: – 0.22-0.84), the absolute risk reduction (RRA) 0.07 (95% CI: – 0.02-0.14) and the number needed to treat (NNT) 14 (95% CI: 7-infinity). There was also a significant reduction in the rate of asymptomatic hyperamylasemia in the indomethacin group (10.8% vs. 25%, p = 0.014), the RR was 0.43 (95% CI: 0.21-0.86), the RRR 0.57 (95% CI: 0.14-0.79), RRA 0.14 (95% CI: 0.03-0.24) and NNT 7 (95% CI: 4.25-37.19). Conclusions. Rectal indomethacin is a safe, effective, and low-cost measure to prevent post-ERCP pancreatitis and asymptomatic hyperamylasemia, both in high-risk patients and those at average risk.
Key words. Acute pancreatitis, indomethacin, ERCP, nonsteroidal anti-inflammatory drugs, post-ERCP pancreatitis, prevention.
Dentro de las complicaciones de la colangiopancreatografía retrógrada endoscópica (CPRE), la pancreatitis aguda es la más frecuente, su prevalencia global es del 3,5%, pudiendo llegar hasta un 20% en pacientes con alto riesgo.1, 2 En algunos casos estos episodios pueden ser severos, lo que aumenta la morbimortalidad y los costos de salud. Anteriormente se consideraba la utilización de stents pancreáticos como la principal medida de prevención de la pancreatitis post CPRE en pacientes de alto riesgo. Sin embargo, la colocación de un stent pancreático no es un procedimiento sencillo de realizar y no siempre está disponible en nuestro medio de trabajo en países en vías de desarrollo. Es por esto que debemos recurrir a estrategias adicionales para intentar prevenir estos episodios. Con este propósito se ha estudiado la prevención a través de diversos agentes farmacológicos, dentro de los cuales, los antiinflamatorios no esteroides (AINEs) administrados por vía rectal en forma de supositorios son los más estudiados. En diferentes ensayos clínicos y metanálisis se demostró su mayor eficacia para disminuir la prevalencia y la severidad de la pancreatitis post CPRE, tanto en los pacientes con alto riesgo como en aquellos con bajo riesgo de esta complicación.
La última guía clínica sobre la profilaxis de la pancreatitis post CPRE, publicada en el año 2014 por la European Society of Gastrointestinal Endoscopy, recomienda la utilización de supositorios de AINEs en todo paciente sometido a CPRE, independientemente del riesgo de pancreatitis post CPRE, con un nivel de evidencia 1 y un grado de recomendación A. Adicionalmente, en la guía se recomienda considerar la utilización de stents pancreáticos como medida complementaria en aquellos pacientes con alto riesgo de pancreatitis post CPRE (nivel de evidencia 1, grado de recomendación A).3-5
A raíz de las diferentes publicaciones y recomendaciones de las sociedades científicas, la utilización de estos agentes está siendo implementada como práctica de rutina por la mayor parte de los equipos de trabajo, inicialmente para pacientes de alto riesgo y hoy en día también para aquellos de bajo riesgo, ya que existen evidencias de que estos pacientes se benefician con esta estrategia que es segura y de bajo costo. En nuestro centro la posibilidad de contar con stents pancreáticos es difícil y no utilizábamos los AINEs como agentes de prevención de la pancreatitis post CPRE, hasta que decidimos implementar la utilización de la indometacina rectal, debido a las crecientes evidencias y recomendaciones, en todos los pacientes sometidos a CPRE que no tengan contraindicación para recibir AINEs.
Con el objetivo de analizar los resultados obtenidos con el uso de los supositorios de AINEs, evaluamos la experiencia de nuestro centro mediante una comparación entre los pacientes sometidos a CPRE antes de la utilización de AINEs por vía rectal y aquellos en los que se implementó el uso de supositorios de indometacina.
Material y métodos
En este estudio analítico y retrospectivo se incluyeron 202 pacientes que fueron sometidos a CPRE entre diciembre de 2014 y enero de 2017, previamente a la implementación de la indometacina rectal y luego de su introducción en nuestra práctica clínica. Todos los pacientes fueron tratados en el Servicio de Gastroenterología y Endoscopía del Sanatorio Güemes de Buenos Aires, Argentina.
Criterios de inclusión:
- Pacientes sometidos a una CPRE sin importar el diagnóstico ni el riesgo de pancreatitis post CPRE.
- Pacientes en los que el procedimiento fue fallido por imposibilidad de canular, pero el riesgo de pancreatitis estaba aumentado debido a múltiples intentos, precorte y/o canulación del conducto pancreático.
Criterios de exclusión:
- Colangitis aguda y/o pancreatitis aguda en curso.
- Mal estado general (ASA IV o V).
- Menores de 18 años.
- Alergia o hipersensibilidad a AINEs.
- Falla renal (creatinina mayor de 1,4 mg/dl).
- Hemorragia gastrointestinal activa o reciente (dentro de las 4 semanas).
- CPRE previa con esfinterotomía.
- CPRE para extracción de stent.
La CPRE se realizó según la técnica descripta.25 Los pacientes recibieron sedación consciente y se colocaron en posición de decúbito prono. Se utilizó un duodenoscopio Olympus TJ140 y la canulación de la vía biliar se realizó con la técnica de papilótomo sobre guía. En todos los casos se realizó una esfinterotomía luego de la canulación exitosa de la vía biliar. En caso de una canulación difícil, luego de reiterados intentos y a discreción del endoscopista a cargo, se realizó una sección del techo papilar con cuchilla de precorte para facilitar la canulación. El procedimiento continuó de acuerdo con el objetivo de este (extracción de litiasis, colocación de stent, etc.). Los pacientes permanecieron en sala de recuperación alrededor de 60 minutos y luego fueron llevados a una sala general donde se realizó control clínico y de laboratorio con el objetivo de detectar complicaciones como pancreatitis, hemorragia o perforación.
Los datos fueron recolectados en una base de datos de Microsoft Excel. Se analizaron 100 pacientes estudiados en el período en el que no se utilizaron supositorios de indometacina (diciembre de 2014 a enero de 2016) y 102 estudiados en el período en el que se aplicó el supositorio (febrero de 2016 a enero de 2017). El supositorio de indometacina de 75 mg fue colocado dentro de los 30 minutos previos o posteriores a la realización de la CPRE.
Se analizaron las diferentes características de los pacientes incluidos (edad, sexo, comorbilidades y otros factores que pudieran influir en los resultados).
La pancreatitis post CPRE fue definida como la presencia de dolor tipo pancreático y elevación de enzimas pancreáticas tres veces por encima del valor normal dentro de las 24 horas del procedimiento, con la necesidad de hospitalización más allá de las 24 horas. El resultado fue analizado retrospectivamente revisando la historia clínica de los pacientes incluidos.
Análisis estadístico
El análisis de los datos se realizó usando el software SPSS v.20. Para el análisis de las variables categóricas se utilizó la prueba de chi cuadrado o la de Fisher, según correspondiera, y para el de las variables continuas la prueba de t de Student. Se consideró significativo una p < 0,05.
Resultados
Los 202 pacientes estudiados se dividieron en dos grupos consecutivos: 100 pacientes sin indometacina (grupo control) y 102 pacientes con indometacina (grupo indometacina).
Con respecto a las variables demográficas ambos grupos fueron homogéneos en cuanto a sexo, edad, comorbilidades, score de ASA y procedimientos realizados de forma programada. La excepción fue que hubo un número de pacientes hipertensos significativamente mayor en el grupo control que en el grupo indometacina (60 vs. 43 pacientes, p = 0,017) (Tabla 1).
Tabla 1. Variables demográficas.
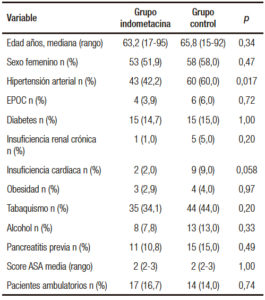
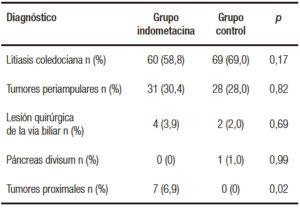
Con respecto a los diagnósticos que motivaron la realización del procedimiento, la causa más frecuente fue la litiasis coledociana, seguida por los tumores de la región periampular. La distribución entre los grupos también fue homogénea, a excepción de que había más casos de tumores de la vía biliar proximal en el grupo indometacina (7 vs. 0 pacientes, p = 0,02) (Tabla 2).
Tabla 2. Diagnósticos etiológicos.
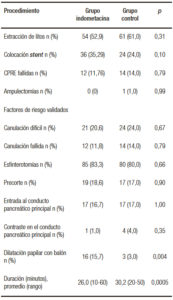
La distribución de los procedimientos realizados en cada grupo también fue similar. Tampoco se encontraron diferencias entre ambos grupos en los factores de riesgo de pancreatitis post CPRE, a excepción de que en el grupo indometacina se realizó más frecuentemente la dilatación con balón (16 vs. 3 pacientes, p = 0,004) y fue menor la duración del procedimiento (26,0 ± 9,5 vs. 30,2 ± 7,3 minutos, p = 0,0005) (Tabla 3).
Tabla 3. Procedimiento realizado.
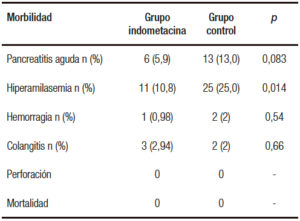
La morbilidad asociada al procedimiento estuvo representada principalmente por episodios de pancreatitis aguda, siendo leve en todos los pacientes, con 13 casos (13,0%) en el grupo control y 6 en el grupo indometacina (5,9%) (p = 0,083). El riesgo relativo (RR) fue 0,45 (intervalo de confianza del 95% (IC 95%): 0,16-1,22), la reducción del riesgo relativo (RRR) 0,55 (IC 95%: – 0,22-0,84), la reducción del riesgo absoluto (RRA) 0,07 (IC 95%: – 0,02-0,14) y el número necesario a tratar (NNT) 14 (IC 95%: 7-infinito).
La hiperamilasemia asintomática se observó en 25 casos (25,0%) del grupo control y en 11 (10,8%) del grupo indometacina (p = 0,014). El RR fue 0,43 (IC 95%: 0,21-0,86), la RRR 0,57 (IC 95%: 0,14-0,79), la RRA 0,14 (IC 95%: 0,03-0,24) y el NNT 7 (IC 95%: 4,25- 37,19) (Tabla 4).
Se registraron 3 casos de sangrado post CPRE: 2 en el grupo control (2%) y 1 en el grupo indometacina (0,98%) (p = 0,54). Estos casos fueron diagnosticados dentro de las 24 horas del procedimiento por la presencia de melena y caída del hematocrito con buena respuesta al tratamiento médico y con la necesidad de inyección de adrenalina por vía endoscópica en un caso. Por otro lado, se registraron 5 casos de colangitis post CPRE: 2 en el grupo control (2%) y 3 en el grupo indometacina (2,94%) (p = 0,66). Todos ellos tuvieron buena respuesta al tratamiento antibiótico endovenoso. No se registraron casos de perforación ni mortalidad en el presente estudio (Tabla 4).
Tabla 4. Morbilidad y mortalidad.
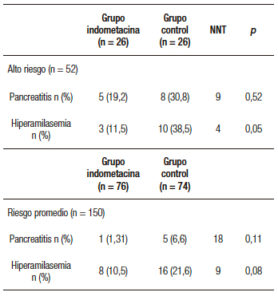
Los resultados de un subanálisis dividiendo los pacientes en los de alto riesgo y riesgo promedio se muestran en la Tabla 5. Consideramos pacientes de alto riesgo a aquellos que presentaban algunos de los factores de riesgo de pancreatitis post CPRE validados en estudios previos.6
Enumeramos a continuación los factores de riesgo que fueron considerados:
Criterios mayores (1 o más):
- Historia previa de pancreatitis post CPRE.
- Esfinterotomía pancreática.
- Precorte (realizando el mismo desde el ostium y en dirección de la vía biliar).
- Canulación difícil (más de 8 intentos de canulación).
- Dilatación neumática sin esfinterotomía.
- Ampulectomía.
Criterios menores (2 o más):
- Sexo femenino menor a 50 años.
- Pancreatitis recurrente (mayor a 2 episodios).
- Entrada al conducto pancreático principal en más de 3 oportunidades.
- Tres o más inyecciones de contraste al conducto pancreático con al menos uno que opacifique la cola del páncreas.
- Inyección excesiva de contraste con opacificación del acino pancreático.
- Biopsia por cepillado del conducto pancreático.
Tabla 5. Subanálisis: pacientes de alto riesgo y riesgo promedio.
Discusión
Teniendo en cuenta el impacto de la pancreatitis post CPRE en la morbimortalidad y la dificultad para contar con stents pancreáticos en nuestro medio, determinar la efectividad de la prevención farmacológica es importante para nuestra práctica diaria. Existen varios ensayos clínicos y metanálisis que abordaron este tema.
En 2003, Murray y col. demostraron un beneficio estadísticamente significativo con el uso de diclofenac por vía rectal en 220 pacientes que iban a someterse a una CPRE (6,4% de prevalencia de pancreatitis en el grupo diclofenac vs. 15,5% en el grupo placebo [p = 0,049]).7 Tres estudios publicados en 2007 también mostraron beneficios. Sotoudehmanesh y col. encontraron que la administración de indometacina rectal profiláctica en pacientes de bajo riesgo no tiene beneficios. El análisis del subgrupo de pacientes a los que se inyectaba contraste en el ducto pancreático reveló un efecto protector, pero la muestra era inadecuada para sacar conclusiones concretas (prevalencia de pancreatitis del 2,3% con indometacina vs. 18,6% con placebo [p = 0,014]).8 Khoshbaten y col. demostraron un beneficio estadísticamente significativo con la administración rectal de diclofenac en 100 pacientes de alto riesgo que fueron sometidos a pancreatografía (prevalencia de pancreatitis del 4% con diclofenac vs. 26% con placebo [p < 0,01]).9 Montaño Loza y col. también demostraron beneficios en 150 pacientes sin diferenciar categorías de riesgo de pancreatitis post CPRE (prevalencia de pancreatitis del 5,3% con indometacina vs. 16% con placebo [p = 0,034]).10 Posteriormente, en el 2012, Otsuka y col. reportaron resultados significativos comparando diclofenac rectal vs. placebo (prevalencia de pancreatitis del 3,9% con indometacina vs. 18,9% con placebo [p = 0,017]).11 En el mismo año, Elmunzer y col. publicaron el ensayo clínico más importante sobre el tema. Estos autores incluyeron un total de 602 pacientes y los dividieron en dos grupos: 307 recibieron indometacina rectal post CPRE y 295 placebo. La prevalencia de pancreatitis fue de 16,9% en el grupo con placebo y 9,2% en el grupo con indometacina (p = 0,03). Sin embargo, en este trabajo se utilizó además la colocación de un stent pancreático profiláctico en más del 80% de los pacientes, lo cual puede sesgar las conclusiones.12 Finalmente, en un ensayo clínico reciente, realizado en el 2015 por Andrada-Dávila y col., se compararon 100 mg de indometacina rectal vs. placebo en 166 pacientes con riesgo alto de pancreatitis post CPRE, con una diferencia significativa a favor del uso de indometacina (prevalencia de pancreatitis del 4,82% con indometacina vs. 20,23% con placebo [p = 0,01, RRA 15%, RRR 75%, NNT 6]).13
Desde el primero publicado en el año 2008 por Elmunzer y col., los diferentes metanálisis sobre el papel de los AINEs en la protección de la pancreatitis post CPRE concluyen que tanto la indometacina como el diclofenac por vía rectal, antes o inmediatamente después del procedimiento, reducen la prevalencia de hiperamilasemia asintomática, pancreatitis y severidad de los episodios.14-27 Un trabajo publicado recientemente incluyó 4.741 pacientes tomados de 17 ensayos controlados aleatorizados, con un total de 466 pancreatitis post CPRE, confirmando que los AINEs por vía rectal son una medida barata y efectiva para la prevención de esta complicación (p = 0,005, RR 0,55 [IC 95%: 0,40-0,77] y NNT 19). Una de las principales fortalezas de este trabajo es el gran número de pacientes, si bien sus autores remarcan la heterogeneidad de los diferentes estudios como una limitación. Además, se halló que no hay diferencias significativas entre la indometacina y el diclofenac, entre la administración realizada antes o después de la CPRE (p = 0,99), o entre pacientes de alto riesgo y de riesgo promedio (p = 0,69).28
Cuando los resultados de los estudios comentados nos llevaron a implementar el uso de supositorios de indometacina en nuestros pacientes, decidimos comparar los resultados antes y después del tratamiento. Observamos resultados similares a los de la literatura, ya que pudimos reducir en un 7% el riesgo absoluto de pancreatitis post CPRE, con un buen NNT de 14. Si bien este beneficio atribuible no alcanzó significación estadística debido al reducido tamaño de nuestra población, la diferencia es notable y pensamos que un error alfa de solo el 9% merece ser tenido en cuenta. Acompañando los resultados del objetivo principal, la prevalencia de hiperamilasemia asintomática fue significativamente menor, con una reducción del riesgo absoluto del 14% y un excelente NNT de 7.
Pese a la dispersión numérica que implica la división en grupos de una muestra reducida, con la consecuente pérdida de poder estadístico, los resultados del subanálisis de los pacientes con alto y bajo riesgo nos permitieron ver que la disminución de casos de pancreatitis e hiperamilasemia es más acentuada con la administración de indometacina, tanto en la diferencia porcentual como en el NNT.
Con respecto a las complicaciones, estas tuvieron una prevalencia similar a lo comunicado en la literatura, no hubo diferencias entre ambos grupos y todas fueron leves.
Las principales limitaciones de nuestro estudio son su diseño retrospectivo en el que ambos grupos de pacientes no fueron simultáneos y el reducido tamaño de la muestra, condicionado por la población que atendemos. Sin embargo, la homogeneidad entre ambos grupos del análisis permite dar validez a su comparación, evitando posibles variables confundidoras, y las diferencias observadas son importantes para sacar conclusiones a pesar de no haberse alcanzado la significación estadística en el objetivo principal.
Podemos concluir, en concordancia con los estudios y metanálisis previos, que la aplicación de la indometacina rectal en nuestro medio es una medida efectiva, segura y de bajo costo para prevenir la pancreatitis post CPRE y la hiperamilasemia asintomática en pacientes sometidos a una CPRE.
References
- Freeman ML. Complications of endoscopic retrograde cholangiopancreatography: avoidance and management. Gastrointest Endosc Clin N Am 2012; 22: 567-586.
- Balmadrid B, Kozarek R. Prevention and management of adverse events of endoscopic retrograde cholangiopancreatography. Gastrointest Endosc Clin N Am 2013; 23: 385-403.
- Dumonceau J-M, Andriulli A, Elmunzer B, Mariani A, Meister T, Deviere J. Prophylaxis of post-ERCP pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) Guideline – updated June 2014. Endoscopy 2014; 46: 799-815.
- Tenner S, Baillie J, DeWitt J, Vege SS. American College of Gastroenterology Guideline: Management of acute pancreatitis. Am J Gastroenterol 2013; 108: 1400-1415.
- Mazaki T, Mado K, Masuda H, Shiono M. Prophylactic pancreatic stent placement and post-ERCP pancreatitis: an updated meta-analysis. J Gastroenterol 2014; 49: 343-355.
- Rustagi T, Jamidar PA. Endoscopic retrograde cholangiopancreatography-related adverse events: general overview. Gastrointest Endosc Clin N Am 2015.
- Murray B, Carter R, Imrie C, Evans S, O’Suilleabhain C. Diclofenac reduces the incidence of acute pancreatitis after endoscopic retrograde cholangiopancreatography. Gastroenterology 2003; 124: 1786-1791.
- Sotoudehmanesh R, Khatibian M, Kolahdoozan S, Ainechi S, Malboosbaf R, Nouraie M. Indomethacin may reduce the incidence and severity of acute pancreatitis after ERCP. Am J Gastroenterol 2007; 102: 978-983.
- Khoshbaten M, Khorram H, Madad L, Ehsani Ardakani MJ, Farzin H, Zali MR. Role of diclofenac in reducing post-endoscopic retrograde cholangiopancreatography pancreatitis. J Gastroenterol Hepatol 2008; 23: e11-e16.
- Montaño Loza A, Rodríguez Lomelí X, García Correa JE, Dávalos Cobián C, Cervantes Guevara G, Medrano Muñoz F. Effect of the administration of rectal indomethacin on amylase serum levels after endoscopic retrograde cholangiopancreatography, and its impact on the development of secondary pancreatitis episodes. Rev Esp Enferm Dig 2007; 99: 330-336.
- Otsuka T, Kawazoe S, Nakashita S, Kamachi S, Oeda S, Sumida C. Low-dose rectal diclofenac for prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis: a randomized controlled trial. J Gastroenterol 2012; 47: 912-917.
- Elmunzer BJ, Scheiman JM, Lehman GA, Chak A, Mosler P, Higgins PDR. A randomized trial of rectal indomethacin to prevent post-ERCP pancreatitis. N Engl J Med 2012; 366: 1414-1422.
- Andrade-Dávila VF, Chávez-Tostado M, Dávalos-Cobián C, García-Correa J, Montaño-Loza A, Fuentes-Orozco C. Rectal indomethacin versus placebo to reduce the incidence of pancreatitis after endoscopic retrograde cholangiopancreatography: results of a controlled clinical trial. BMC Gastroenterol 2015; 15: 85.
- Elmunzer BJ, Waljee AK, Elta GH, Taylor JR, Fehmi SMA, Higgins PDR. A meta-analysis of rectal NSAIDs in the prevention of post-ERCP pancreatitis. Gut 2008; 57: 1262-1267.
- Zheng M-H, Xia HH-X, Chen Y-P. Rectal administration of NSAIDs in the prevention of post-ERCP pancreatitis: a complementary meta-analysis. Gut 2008; 57: 1632-1633.
- Dai H-F, Wang X-W, Zhao K. Role of nonsteroidal anti-inflammatory drugs in the prevention of post-ERCP pancreatitis: a meta-analysis. Hepatobiliary Pancreat Dis Int 2009; 8: 11-16.
- Ding X, Chen M, Huang S, Zhang S, Zou X. Nonsteroidal anti-inflammatory drugs for prevention of post-ERCP pancreatitis: a meta-analysis. Gastrointest Endosc 2012; 76: 1152-1159.
- Akbar A, Abu Dayyeh BK, Baron TH, Wang Z, Altayar O, Murad MH. Rectal nonsteroidal anti-inflammatory drugs are superior to pancreatic duct stents in preventing pancreatitis after endoscopic retrograde cholangiopancreatography: a network meta-analysis. Clin Gastroenterol Hepatol 2013; 11: 778-783.
- Shi N, Deng L, Altaf K, Huang W, Xue P, Xia Q. Rectal indomethacin for the prevention of post-ERCP pancreatitis: a meta-analysis of randomized controlled trials. Turkish J Gastroenterol 2015; 26: 236-240.
- Sun H-L, Han B, Zhai H-P, Cheng X-H, Ma K. Rectal NSAIDs for the prevention of post-ERCP pancreatitis: a meta-analysis of randomized controlled trials. Surgeon 2014; 12: 141-147.
- Sethi S, Sethi N, Wadhwa V, Garud S, Brown A. A meta-analysis on the role of rectal diclofenac and indomethacin in the prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis. Pancreas 2014; 43: 190-197.
- Ahmad D, Lopez KT, Esmadi MA, Oroszi G, Matteson-Kome ML, Choudhary A. The effect of indomethacin in the prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis. Pancreas 2014; 43: 338-342.
- Puig I, Calvet X, Baylina M, Isava Á, Sort P, Llaó J. How and when should NSAIDs be used for preventing post-ERCP pancreatitis? A systematic review and meta-analysis. Sastre J, ed. PLoS One 2014; 9: e92922.
- Li X, Tao L-P, Wang C-H. Effectiveness of nonsteroidal anti-inflammatory drugs in prevention of post-ERCP pancreatitis: a meta-analysis. World J Gastroenterol 2014; 20: 12322.
- Kubiliun NM, Adams MA, Akshintala VS, Conte ML, Cote GA, Cotton PB. Evaluation of pharmacologic prevention of pancreatitis after endoscopic retrograde cholangiopancreatography: a systematic review. Clin Gastroenterol Hepatol 2015; 13: 1231-1239.
- McCune WS, Shorb PE, Moscovitz H. Endoscopic cannulation of the ampulla of vater: a preliminary report. Ann Surg 1968; 167: 752-756
- Rustagi T, Jamidar PA. Endoscopic retrograde cholangiopancreatography (ERCP)-related adverse events: post-ERCP pancreatitis. Gastrointest Endosc Clin N Am 2015; 25: 107-121.
- Patai Á, Solymosi N, Mohácsi L, Patai ÁV. Indomethacin and diclofenac in the prevention of post-ERCP pancreatitis: a systematic review and meta-analysis of prospective controlled trials. Gastrointest Endosc 2017; 85: 1144-1156.
Correspondencia: José Carlos Sotelo
Acuña de Figueroa 1240 (CP: AAX 1180).
Servicio de Gastroenterología y Endoscopía, Sanatorio Güemes de Buenos Aires, Ciudad Autónoma de Buenos Aires, Argentina.
Tel: +54 (011) 495981200
Correo electrónico: jose_sotelo2004@hotmail.com
Acta Gastroenterol Latinoam 2018;48(2): 131-137
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE





