Guillermo Flores,1 Atenas Villela-Peña,1 Ricardo Alemán,1 Guillermo Castellanos2
1Departamento de Medicina Interna.
2Departamento de Patología.
Unidad Médica de Alta Especialidad, Hospital de Especialidades del Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social y Facultad de Medicina de la Universidad Nacional Autónoma de México. México.
Acta Gastroenterol Latinoam 2018;48(4):314-321
Recibido: 26/10/2017 / Aprobado: 20/04/2018 / Publicado en www.actagastro.org el 17/12/2018
Resumen
La acidosis láctica tipo B es una manifestación poco frecuente de las neoplasias malignas, de las cuales las neoplasias hematológicas, en particular el linfoma no Hodgkin, son las más frecuentes. Presentamos el caso de un hombre de 71 años con acidosis láctica persistente quien presentó hemorragia del tubo digestivo alto, por lo cual se realizó una endoscopía en la que se encontraron múltiples lesiones ulceradas en la mucosa gástrica. El análisis histopatológico de las biopsias endoscópicas de la mucosa gástrica demostró linfoma no Hodgkin de células B grande difuso. Una tomografía de abdomen demostró múltiples adenopatías retroperitoneales y mesentéricas. No se conocen con precisión la frecuencia y la fisiopatología de la acidosis láctica asociada a neoplasias malignas, sin embargo, se ha relacionado con mal pronóstico.
Palabras claves. Linfoma no Hodgkin, acidosis láctica, hipoglucemia, insuficiencia hepática.
Severe Lactic Acidosis as an Initial Presentation Non-Hodgkin Lymphoma. A case report and literature review
Summary
Type B lactic acidosis is a rare condition in patients with solid tumors or hematologic malignancies. We present the case of a 71-year-old Mexican mestizo male with persistent lactic acidosis that developed upper gastrointestinal bleeding with multiple gastric ulcers. Whereby, a computed tomography (CT) was realized, that showed numerous enlarged lymph nodes which were found. Biopsy of gastric ulcers disclosed a Non-Hodgkin Lymphoma. The pathogenesis of malignancy-induced type B lactic acidosis is now well understood and factors such as increased glycolysis, increased production by malignant cells, and decreased hepatic clearance have all been implicated. Lactic acidosis induced by lymphoma carries poor prognosis. Prompt diagnosis and early treatment of the underlying malignancy remains the only method to achieve complete resolution of this metabolic condition.
Key words. Lactic Acidosis, lymphoma, non-Hodgkin, hypoglycemia, liver failure.
Abreviaturas
ECOG: Eastern Cooperative Oncology Group (escala para medir calidad de vida).
BUN: nitrógeno ureico sanguíneo.
ALB: acidosis Láctica Tipo B.
IPC: índices de proliferación celular.
BL/LLA: linfoma tipo Burkitt y linf mas/leucemias linfoblásticas agudas.
LDCGB: linfoma difuso de células grandes.
La acidosis láctica tipo B es una manifestación poco frecuente de algunas neoplasias; las neoplasias hematológicas, particularmente los linfomas, son la causa más frecuente. Presentamos el caso de un paciente con acidosis láctica como manifestación inicial de linfoma no Hodgkin.
Caso clínico
Hombre de 71 años que ingresó por lesión renal aguda y acidosis metabólica. Antecedentes de alcoholismo y tabaquismo durante 20 años, que suspendió hace 26 años. Diabetes mellitus tipo 2 de 15 años de evolución en tratamiento con pioglitazona, nefropatía diabética de 9 meses de evolución clasificada como KDIGO 3a, hipertensión arterial sistémica diagnosticada un año previo a su ingreso en tratamiento con clortalidona 12,5 mg/día y enalapril 10 mg cada 12 horas. Nueve meses antes de su ingreso presentó un infarto agudo de miocardio que ameritó intervención coronaria percutánea y colocación de un stent a la arteria coronaria derecha. Durante esa hospitalización presentó complicaciones hemodinámicas y requirió ventilación mecánica invasiva. Durante la hospitalización por el infarto agudo de miocardio se diagnosticó tuberculosis pulmonar, para la cual recibió tratamiento con antituberculosos en fase intensiva y de sostén por 2 y 4 meses respectivamente, con curación bacteriológica.
Inició cuatro días antes de su ingreso con deposiciones líquidas, náuseas, vómitos e intolerancia a líquidos. A su ingreso el paciente presentaba deshidratación severa. Tensión arterial de 90/50 mmHg, frecuencia cardíaca de 105 latidos/min, frecuencia respiratoria 28 respiraciones/ min, temperatura 36°C. Somnoliento, pero reactivo. El abdomen presentaba peristaltismo disminuido, hepatomegalia de 2 cm por debajo del reborde costal, sin irritación peritoneal. Examen de miembros inferiores con edemas hasta los tobillos.
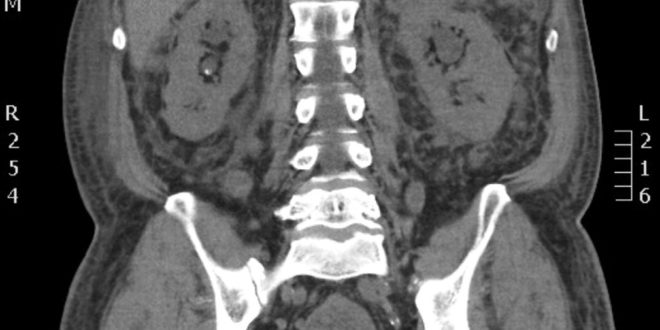
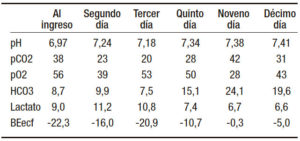
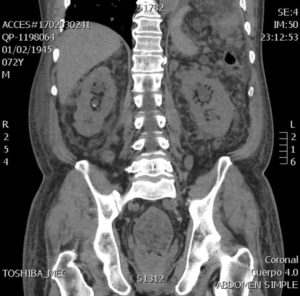
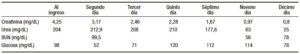
Los resultados de los exámenes de laboratorio se muestran en las Tablas 1 y 2, en donde resaltan la lesión renal aguda y una acidosis metabólica de brecha aniónica elevada e hiperlactacidemia. Inició hidratación endovenosa y antibióticos de amplio espectro, evolucionó con mejoría logrando estabilidad hemodinámica y recuperación de la función renal con persistencia de la acidosis metabólica de brecha aniónica elevada e incremento de lactato. Se descartaron otras causas posibles de acidosis láctica como hipoxemia, insuficiencia hepática, intoxicaciones y deficiencia de tiamina. Una tomografía de abdomen (Figura 1) descartó isquemia intestinal, evidenciando múltiples adenopatías mesentéricas y retroperitoneales, por lo que se programó la biopsia de ganglio. Previo a la realización del procedimiento, el paciente presentó una hemorragia de tubo digestivo alto y descenso de la hemoglobina de 2 gr/dL en 24 horas, con repercusión hemodinámica que respondió a líquidos intravenosos y transfusión de hemoderivados. Recibió también tiamina por vía endovenosa. La endoscopía (Figura 2) mostró múltiples úlceras en la mucosa gástrica, sospechosas de linfoma, sin evidencia de hemorragia activa. El análisis histopatológico de las biopsias endoscópicas de la mucosa gástrica demostró infiltrado difuso de la lámina propia, constituido por mantos amplios de células grandes con escaso citoplasma, núcleos ovoides con morfología de centroblastos y ocasionalmente inmunoblastos que sustituían el epitelio glandular gástrico parcialmente; escasas glándulas presentaban lesión linfoepitelial; no se observó patrón de crecimiento nodular. Resultado de inmunohistoquímica: CD20+, CD3-, CD10+, Bcl-6+, Bcl-2+, P53+, LMP1-, CD30-, CD5-, citoqueratinas (AE1/AE3) negativas, cromogranina A-, Ki67=70%; que corresponden a linfoma difuso de células grandes B, tipo centro germinal (Figura 3). El paciente fue enviado para su valoración al hospital de Oncología, sin embargo, falleció antes del inicio de la quimioterapia. No se realizó necropsia.
Tabla 1. Resultado de los gases sanguíneos.
Tabla 2. Exámenes de laboratorio.
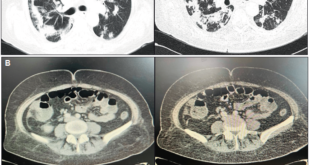
Figura 1. Tomografía simple de abdomen que muestra un proceso inflamatorio severo de la grasa mesentérica, con la presencia de múltiples adenomegalias.
Figura 2. Endoscopía del tubo digestivo alto en la que se observan múltiples úlceras difusas de bordes elevados en toda la cámara gástrica a predominio en la curvatura mayor.
Figura 3. Biopsias endoscópicas de la mucosa gástrica: (A) Infiltrado denso de células linfoides en la lámina propia (HE; 200x). (B) CD20; (C) CD3; (D) CD10; (E) Bcl-6; (F) Bcl-2; (G) MIB-1 (Ki-67) 70% (mieloperoxidasa).
Revisión de la literatura
La acidosis láctica tipo B (ALB) es un trastorno severo del metabolismo intermediario, que conlleva una elevada tasa de mortalidad.1 Puede presentarse en pacientes con neoplasias sólidas y hematológicas.2-9 Los más frecuentes son los linfomas,10-37 seguido de leucemias23, 38-45 y tumores sólidos como el cáncer gástrico y el pulmonar, entre otros.2, 5, 6, 26, 46-49 En ocasiones, la ALB puede ser la alteración inicial de este tipo de enfermedades.50
Definición
La ALB secundaria a neoplasias malignas se define como el aumento de lactato de 4 mmol/L o más en asociación a un tumor. Este tipo de acidosis láctica no está asociada a hipoperfusión, aunque el mecanismo por el cual ocurre no se conoce con exactitud. Existen diversas hipótesis como la disfunción renal12 y la hepática,50 sobreexpresión del factor similar a insulina tipo 1 y hexokinasa junto con la glucólisis anaeróbica,13, 30, 31, 51-53 factor de necrosis tumoral alfa (TNF-ά),42 deficiencia de tiamina54-56 y el uso de algunos fármacos quimioterapéuticos.
Epidemiología
Se desconoce con exactitud la incidencia de pacientes con neoplasias hematológicas y ALB, aunque si se ha determinado es que es más frecuente en adultos y está asociada a mal pronóstico.50 En la Tabla 3 se muestran los tipos histológicos de las neoplasias en pacientes con ALB secundaria, obtenidos de 4 series con el mayor número de casos informados.23, 51, 57 Este análisis nos conduce a la observación de que los linfomas en general, particularmente el linfoma difuso de células grandes B (LDCGB), en conjunto con las leucemias, son las entidades que con mayor frecuencia se asocian a ALB, como reflejo de que estas representan las neoplasias hematopoyéticas de mayor prevalencia mundial.58 Además de las entidades ya mencionadas, también se han visto asociados excepcionalmente el mieloma múltiple y algunos carcinomas. De esta forma, coincidimos con la opinión de otros autores que señalan que el tipo histológico de la neoplasia no parece ser un factor determinante en la patogénesis de la ALB, por lo que se plantea que el volumen tumoral es otra condición que podría favorecer su desarrollo, aunque este tampoco es un factor definitivo.23 De acuerdo con la Tabla 3, los tipos histológicos más prevalentes LB/LLA, linfoma tipo Burkitt y linfomas/leucemias linfoblásticas agudas) son conocidos por mostrar altos índices de proliferación celular (IPC) mediante inmunomarcación con MIB1 (ki67), que van del 40 al 90%.58 El caso que hemos presentado correspondió a un LDCGB con IPC de 70% (Figura 3), lo que nos hace teorizar una posible asociación de ALB con neoplasias que demuestren altos IPC; no conocemos publicación que analice esta asociación. Con seguridad, un mejor conocimiento de la fisiopatología de la ALB ayudará a clarificar estos fenómenos. Reportes previos de una sola institución informaron 7 casos de acidosis láctica en un período de 13 años, 5 en linfoma y 2 en leucemia linfocítica crónica.23 En la revisión bibliográfica realizada y reportada en la referencia antes mencionada que comprendió desde 1990 hasta 2006, se informaron 53 casos de ALB en pacientes con leucemia y linfoma.51 Una revisión sistemática entre el 2000 y el 2010 de las neoplasias asociadas con acidosis láctica demostró un total de 31 casos, de los cuales 87% fueron neoplasias hematológicas. Los linfomas fueron los más frecuentes (58%), y de estos, 16 casos (52%) eran de linfoma no Hodgkin, un caso (3%) de linfoma de Hodgkin y un caso más de mieloma múltiple. Ocho casos de leucemias (26%), cinco de los cuales fueron de leucemia linfoblástica (16%), dos de leucemia mieloide aguda y uno más con leucemia linfocítica crónica.57 El resto de los tumores fueron de primario no conocido.
Tabla 3. Tipos histológicos y frecuencia de las neoplasias observadas en 4 series de pacientes con acidosis láctica tipo B secundaria.
Fisiopatología
El hígado y los riñones son los principales órganos implicados en la conversión de lactato en piruvato y por consiguiente en glucosa, por lo tanto, la disfunción de cualquiera de estos dos órganos puede producir acumulación de lactato.59 A pesar de tener un aporte adecuado de oxígeno, las células tumorales tienen preferencia por el metabolismo anaeróbico, por lo que una gran cantidad de glucosa es convertida en lactato, este mecanismo es conocido como efecto Warburg.52, 53 En el efecto Warburg las células tumorales oxidan glucosa mediante glucólisis anaeróbica produciendo lactato y ATP. Asimismo, existe la hipótesis de que esta forma de metabolismo de la glucosa provee además sustratos como aminoácidos, nucleótidos y lípidos a las células tumorales para facilitar el crecimiento y la proliferación. Otro mecanismo posible es la microembolización vascular que causa hipoperfusión y metabolismo anaeróbico.57
Otro mecanismo asociado a la producción de lactato en los pacientes con cáncer es la participación de sustancias como el factor de necrosis tumoral α, que condiciona inhibición de la piruvato deshidrogenasa y por lo tanto, aumento de la formación de lactato.42, 51
La oxidación de la glucosa para producir ATP requiere la acción de la enzima piruvato deshidrogenasa. La tiamina es un cofactor de esta última, por lo tanto la deficiencia de este cofactor hace que la vía de producción de energía sea más lenta. La deficiencia de tiamina se observa en algunos de los pacientes con cáncer, por lo tanto este puede ser otro factor que condicione acidosis láctica.54-56, 60 A su vez, hay fármacos quimioterapéuticos, como el metotrexate, que inducen acidosis láctica por competir con la tiamina.56
Además de la acidosis láctica, la hipoglucemia es otro efecto que puede observarse en pacientes con neoplasias. Los mecanismos son múltiples, algunos de los cuales comprenden infiltración con insuficiencia hepática,50 sobreexpresión de hexocinasa (una enzima limitante en la glicólisis)51 producción de péptido similar a la insulina por células malignas,51 anticuerpos contra el receptor de insulina, y consumo de glucosa por las células tumorales.42, 61-63 En cuanto al último mecanismo que se menciona, el aumento del consumo de glucosa por las células neoplásicas representa la base para el PET con fluorodesoxiglucosa (PET-FDG) en el monitoreo del crecimiento del cáncer.53
La asociación de acidosis láctica e hipoglucemia es conocida como efecto exagerado de Warburg o “hiper-Warburgismo”.53 Dada esta asociación, existe la teoría de que la administración de glucosa exógena aumenta la formación de ácido láctico. A pesar de que se puede deducir que esta producción de ácido láctico empeora el estado ácido base del paciente, se cree que su formación es una alternativa para el uso de energía para preservar la función cerebral en pacientes con neuroglucopenia. Esta hipótesis se sustenta en algunos estudios en los que se administra una infusión con lactato en pacientes con hipoglucemia para proveer protección de la disfunción neurológica por glucopenia. El efecto Warburg se presenta en tumores de rápido crecimiento.64
Tratamiento
Las opciones de tratamiento de la acidosis láctica no se han establecido por completo. No existe un fundamento claro acerca de la administración de tiamina a pesar de tener niveles séricos dentro del rango normal, la cual se cree que ayuda a la síntesis de acetil coenzima A en lugar de la producción de ácido láctico. Por otra parte existe la teoría de que el exceso de tiamina podría conducir a un aumento del tamaño del tumor ya que favorece la síntesis de DNA tumoral. Por lo tanto el uso de tiamina es controvertido, por lo que se recomienda cuantificar la concentración de tiamina y descartar otras causas de ALB en los pacientes con neoplasias hematológicas.
Se ha propuesto a la hemodiálisis como una opción para disminuir la acidosis láctica previa al tratamiento definitivo del tumor.65
Evolución y pronóstico
El pronóstico en la mayoría de los pacientes que desarrollan ALB secundario a neoplasias malignas es malo, por lo que se considera un factor de mal pronóstico.3, 24, 50, 66 Los autores del presente artículo analizamos un grupo de 18 pacientes con diagnóstico reciente de linfoma e identificamos 4 con acidosis láctica, 2 de ellos con linfoma no Hodgkin difuso de células B grandes, 1 paciente con linfoma de células T/NK y otro con linfoma de Hodgkin clásico (esclerosis nodular). Se hizo una evaluación de las características generales de los pacientes, encontrando que aquellos con acidosis láctica presentaban una puntuación de ECOG entre 3 y 4, Karnosfsky de 20 y 30 puntos, lo cual refleja el mal estado de los pacientes; solo 1 falleció durante el estudio. Debido al número reducido de pacientes en el estudio no se logró identificar causalidad. (Frecuencia de acidosis láctica tipo B en pacientes con diagnóstico reciente de linfoma no Hodgkin y linfoma Hodgkin en el Hospital de Especialidades del Centro Médico Nacional Siglo XXI. (Tesis para obtener el título de la especialidad. Atenas Villela Peña http://132.248.9.195/ptd2017/agosto/515217986/Index.htm)
Conclusiones
La acidosis láctica es un signo ominoso en pacientes con linfoma o leucemia. La fisiopatología de la acidosis es multifactorial y en un mismo paciente diferentes mecanismos pueden estar involucrados de manera simultánea. El diagnóstico oportuno y el inicio del tratamiento del linfoma o la leucemia son los factores más importantes en la resolución de la de la acidosis láctica en este tipo de pacientes.
Referencias
- Kraut JA, Madias NE. Lactic acidosis. N Engl J Med 2014; 371: 2309-2319.
- De Groot R, Sprenger RA, Imholz AL, Gerding MN. Type B lactic acidosis in solid malignancies. Neth J Med 2011; 69: 120-123.
- Claudino WM, Dias A, Tse W, Sharma VR. Type B lactic acidosis: a rare but life threatening hematologic emergency. A case illustration and brief review. Am J Blood Res 2015; 5: 25-29.
- Diaz J, Antoine J, Azad N. A case of hypoglycemia, lactic acidosis, and hematologic malignancy. Endocr Pract 2010; 16: 241-243.
- Abdullah SY, Ali MK, Sabha MM. Type-B lactic acidosis associated with progressive multiple myeloma. Saudi Med J 2015; 36: 239-242.
- Sia P, Plumb TJ, Fillaus JA. Type B lactic acidosis associated with multiple myeloma. Am J Kidney Dis 2013; 62: 633-637.
- Spinazze S, Schrijvers D. Metabolic emergencies. Crit Rev Oncol Hematol. 2006; 58: 79-89.
- Jabr FI. Lactic acidosis in patients with neoplasms: an oncologic emergency. Mayo Clin Proc 2006; 81: 1505-1506.
- Ouchikhe A, Le Bivic JL, Longuet O, Maindivide J, Vincent JF. Severe lactic acidosis revealing hematologic malignancy. Ann Fr Anesth Reanim 2014; 33: 430-432.
- Vega J, Rodríguez Mde L, Pena A, Vásquez A. Type B lactic acidosis associated with marginal lymphoma of the spleen: report of one case. Rev Med Chil 2012; 140: 236-242.
- López Rodríguez M, Vázquez Muñoz E, Gómez Cerezo J, Pagan Muñoz B, Ruiz Bravo-Burguillos E, Barbado Hernández FJ. Lactic acidosis, severe hypoglycemia and hepatosplenomegaly. Rev Clin Esp 2007; 207: 521-522.
- Yun S, Walker CN, Vincelette ND, Anwer F. Acute renal failure and type B lactic acidosis as first manifestation of extranodal T-cell lymphoblastic lymphoma. BMJ Case Rep 2014; 2014. pii: bcr2014205044.
- Glasheen JJ, Sorensen MD. Burkitt’s lymphoma presenting with lactic acidosis and hypoglycemia – a case presentation. Leuk Lymphoma 2005; 46: 281-283.
- Bergin C, Pilkington R, McCreary C, Mulcahy F, Crowley V. Lactic acidosis, non-Hodgkins lymphoma and the acquired immunodeficiency syndrome. Genitourin Med 1994; 70: 148-149.
- Chan FH, Carl D, Lyckholm LJ. Severe lactic acidosis in a patient with B-cell lymphoma: a case report and review of the literature. Case Rep Med 2009; 2009: 534561.
- Di Comite G, Dagna L, Piatti PM, Monti LD, Tantardini F, Praderio L. Hypoglycaemia and lactic acidosis in a MALT non Hodgkin’s lymphoma. Leuk Lymphoma 2002; 43: 1341-1342.
- Garg M, Lee BE, McGarry K, Mangray S, Castillo JJ. CD20- negative diffuse large B-cell lymphoma presenting with lactic acidosis. Am J Hematol 2015; 90: E49-E50.
- Kuo CY, Yeh ST, Huang CT, Lin SF. Diffuse large B-cell lymphoma presenting with type B lactic acidosis and hemophagocytic syndrome. Kaohsiung J Med Sci 2014; 30: 428-429.
- Tanios G, Aranguren IM, Goldstein JS, Patel CB. Diffuse large B-cell lymphoma: A metabolic disorder? Am J Case Rep 2013; 14: 518-525.
- Keller BC, Nussensveig D, Dowell JE. Diffuse large B-cell lymphoma in a hepatitis C virus-infected patient presenting with lactic acidosis and hypoglycemia. Am J Med Sci 2010; 339: 202-204.
- Prokesch BC, Shiloh MU. EBV-driven HIV-associated diffuse large B-cell lymphoma causing profound lactic acidosis. Blood 2014; 124: 842.
- He YF, Wei W, Sun ZM, Ji CS, Wang G, Chen MP, et al. Fatal lactic acidosis and hypoglycemia in a patient with relapsed natural killer/T-cell lymphoma. Adv Ther 2007; 24: 505-509.
- Friedenberg AS, Brandoff DE, Schiffman FJ. Type B lactic acidosis as a severe metabolic complication in lymphoma and leukemia: a case series from a single institution and literature review. Medicine (Baltimore) 2007; 86: 225-232.
- Dogan E, Erkoc R, Sayarlioglu H, Alici S, Dilek I, Alici O. Fatal lactic acidosis due to leukemic transformation in a patient with non- Hodgkin’s lymphoma: case report. Adv Ther. 2005; 22: 443-446.
- Jung B, Zoric L, Chanques G, Konate A, Nocca D, Jaber S. Acute abdomen and severe lactic acidosis can lead to a surprising diagnosis. Intensive Care Med 2010; 36: 169-170.
- Yatabe T, Taniguchi Y, Nishiyama M, Inoue K, Ikezoe T, Fujimoto S, Yokojama M. Lactic acidosis and asymptomatic hypoglycaemia due to plasmablastic lymphoma. Anaesth Intensive Care 2015; 43: 416-417.
- VanderMolen LA, Swain S, Longo DL. Lactic acidosis in lymphoma: prompt resolution of acidosis with therapy directed at the lymphoma. J Natl Cancer Inst 1988; 80: 1077-1078.
- McKay JW, Delbeke D, Sandler MP. Lymphoma and Lactic Acidosis. Clin Nucl Med 2017; 42: 371-372.
- Kumar A, Raina V. Non-Hodgkins lymphoma with lactic acidosis at presentation: A case report of a rare oncologic emergency. Indian J Med Paediatr Oncol 2014; 35: 83-85.
- Rastogi MV, Desai N, Quintos JB. Non-islet-cell tumor hypoglycemia and lactic acidosis in a child with congenital HIV and Burkitt’s lymphoma. J Pediatr Endocrinol Metab 2008; 21: 805- 810.
- Abrahamian H, Pecherstorfer M, Vesely M, Baumgartner G, Irsigler K. Recurrent hypoglycemia and lactate acidosis in non- Hodgkin’s lymphoma. Dtsch Med Wochenschr 1991; 116: 1428-1432.
- Scheerer PP, Pierre RV, Schwartz DL, Linman JW. Reed-sternberg-cell leukemia and lactic acidosis; unusual manifestations of Hodgkin’s disease. N Engl J Med 1964; 270: 274-278.
- Revesz T, Obeid K, Mpofu C. Severe lactic acidosis and renal involvement in a patient with relapsed Burkitt’s lymphoma. Pediatr Hematol Oncol 1995; 12: 283-288.
- Kulkarni K, Kaur S, Sibal A, Jerath N, Arya LS. Severe lactic acidosis, hypertriglyceridemia, and extensive axial skeleton involvement in a case of disseminated Burkitt’s lymphoma. Int J Hematol 2010; 91: 546-548.
- Huo L, Luo Y, Zhang T, Zhu Z, Li F, Zhao Y. Unexpected primary osseous lymphoma as the cause of lactic acidosis in a patient suffering from pancreatitis. Clin Nucl Med 2010; 35: 790-793.
- Mosunjac MB, Sundstrom JB, Mosunjac MI. Unusual presentation of anaplastic large cell lymphoma with clinical course mimicking fever of unknown origin and sepsis: autopsy study of five cases. Croat Med J 2008; 49: 660-668.
- Hou Z, Ji J, Kuang P, He C. Severe lactic acidosis in a patient with acute leukemia: a case report and literature review. Zhonghua Xue Ye Xue Za Zhi 2014; 35: 53-55.
- Lee HS, Kim HJ, Choi S, Kim CK, Lee NS, Lee KT, Won JH, Park HS, Hong DS. A case of type B lactic acidosis in acute leukemia. Yonsei Med J 2010; 51: 460-462.
- Chang H, Shuai X, Ma HB, Liu T. A case report of acute lymphoblastic leukemia complicated by lactic acidosis. Int J Hematol 2010; 92: 538-541.
- Terpe F, Siekmeyer M, Bierbach U, Siekmeyer W, Kratzsch J, Till H et al. Fulminant and fatal course of acute lymphoblastic leukemia due to lactic acidosis and suspected abdominal compartment syndrome. J Pediatr Hematol Oncol 2012; 34: e80-e83.
- Makino H, Noda K, Inagaki Y, Horie H, Osegawa M, Kanatsuka A, Yoshida S. Lactic acidosis and hypoglycemia associated with acute leukemia. Jpn J Med 1985; 24: 257-262.
- Durig J, Fiedler W, de Wit M, Steffen M, Hossfeld DK. Lactic acidosis and hypoglycemia in a patient with high-grade non- Hodgkin’s lymphoma and elevated circulating TNF-alpha. Ann Hematol 1996; 72: 97-99.
- Gardner AJ, Griffiths J. A case of type B lactic acidosis as a com plication of chronic myelomonocytic leukaemia: a case report and review of the literature. J Med Case Rep 2015; 9: 16.
- Ali AA, Flombaum CD, Brochstein JA, Gillio AP, Bussel JB, Boulad F. Lactic acidosis and renal enlargement at diagnosis and relapse of acute lymphoblastic leukemia. J Pediatr 1994; 125: 584- 586.
- Udayakumar N, Rajendiran C, Muthuselvan R. A typical presentation of acute myeloid leukemia. J Cancer Res Ther 2006; 2: 82-84.
- Nair R, Shah U. Lactic Acidosis: A rare oncological emergency in solid tumors at presentation. Am J Med Sci 2017; 353: 402-406.
- Ustun C, Fall P, Szerlip HM, Jillella A, Hendricks L, Burgess R et al. Multiple myeloma associated with lactic acidosis. Leuk Lymphoma 2002; 43: 2395-2397.
- Cheng JC, Esparza SD, Knez VM, Sakamoto KM, Moore TB. Severe lactic acidosis in a 14-year-old female with metastatic undifferentiated carcinoma of unknown primary. J Pediatr Hematol Oncol 2004; 26: 780-782.
- Muñoz J, Stoltenberg M. Severe lactic acidosis in a patient with metastatic prostate cancer. J Cancer Res Ther 2011; 7: 201-202.
- Padilla GF, Garibay MA, Hummel HN, Ávila R, Méndez A, Ramírez R. Fulminant non-Hodgkin lymphoma presenting as lactic acidosis and acute liver failure: case report and literature review. Acta Gastroenterol Latinoam 2009; 39: 129-134.
- Sillos EM, Shenep JL, Burghen GA, Pui CH, Behm FG, Sandlund JT. Lactic acidosis: a metabolic complication of hematologic malignancies: case report and review of the literature. Cancer 2001; 92: 2237-2246.
- Buppajarntham S, Junpaparp P, Kue APP. Warburg effect associated with transformed lymphoplasmacytic lymphoma to diffuse large B-cell lymphoma. Am J Emerg Med 2013; 31: 999 e5-e6.
- Elhomsy GC, Eranki V, Albert SG, Fesler MJ, Parker SM, Michael AG, Griffing GT. “Hyper-warburgism,” a cause of asymptomatic hypoglycemia with lactic acidosis in a patient with non-Hodgkin’s lymphoma. J Clin Endocrinol Metab 2012; 97: 4311-4316.
- Masood U, Sharma A, Nijjar S, Sitaraman K. B-cell lymphoma, thiamine deficiency, and lactic acidosis. Proc (Bayl Univ Med Cent) 2017; 30: 69-70.
- Rouzet P, Rubie H, Robert A, Dutour A, Olives JP, Scipioni C et al. Severe hyperlactacidemia in 2 children treated for malignant tumors. Role of vitamin B1. Arch Fr Pediatr 1991; 48: 423-426.
- Svahn J, Schiaffino MC, Caruso U, Calvillo M, Minniti G, Dufour C. Severe lactic acidosis due to thiamine deficiency in a patient with B-cell leukemia/lymphoma on total parenteral nutrition during high-dose methotrexate therapy. J Pediatr Hematol Oncol 2003; 25: 965-968.
- Ruiz JP, Singh AK, Hart P. Type B lactic acidosis secondary to malignancy: case report, review of published cases, insights into pathogenesis, and prospects for therapy. ScientificWorldJournal 2011; 11: 1316-1324.
- Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136: E359-E386.
- Luft FC. Lactic acidosis update for critical care clinicians. J Am Soc Nephrol 2001; 12: S15-S19.
- Dean RK, Subedi R, Gill D, Nat A. Consideration of alternative causes of lactic acidosis: Thiamine deficiency in malignancy. Am J Emerg Med 2017; 35: 1214: e5- e6.
- Apostolopoulos A, Ling WS. Hypoglycemia associated with a large histiocytic lymphoma: case presentation and literature review. Mt Sinai J Med 1982; 49: 318-322.
- Kulkarni A, Zlabek J, Farnen J, Capla R. Recurrent hypoglycemia and hypothermia in a patient with Hodgkin’s disease. Haematologica 2006; 91: ECR50.
- Anagnostis P, Vakalopoulou S, Slavakis A, Simoulidou E, Rakitzi P, Garipidou V, Harsoulis F. Hypoglycemia in a patient with advanced Sezary syndrome. Leuk Lymphom 2009; 50: 284-286.
- El Imad T, El Khoury L, Geara AS. Warburg’s effect on solid tumors. Saudi J Kidney Dis Transpl 2014; 25: 1270-1277.
- Prikis M, Bhasin V, Young MP, Gennari FJ, Rimmer JM. Sustained low-efficiency dialysis as a treatment modality in a patient with lymphoma-associated lactic acidosis. Nephrol Dial Transplant. 2007; 22: 2383-2385.
- Doolittle GC, Wurster MW, Rosenfeld CS, Bodensteiner DC. Malignancy-induced lactic acidosis. South Med J 1988; 81: 533- 536.
Correspondencia: Guillermo Flores
Avenida Cuauhtémoc # 330. Colonia Doctores. México D. F. 06720.
Departamento de Medicina Interna, Unidad Médica de Alta Especialidad, Hospital de Especialidades del Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social. Delegación Cuauhtémoc, Ciudad de México. México
Tel.: (52) 55 2699 4868
Correo electrónico: gmf368@yahoo.com
Acta Gastroenterol Latinoam 2018;48(4): 314-321
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE